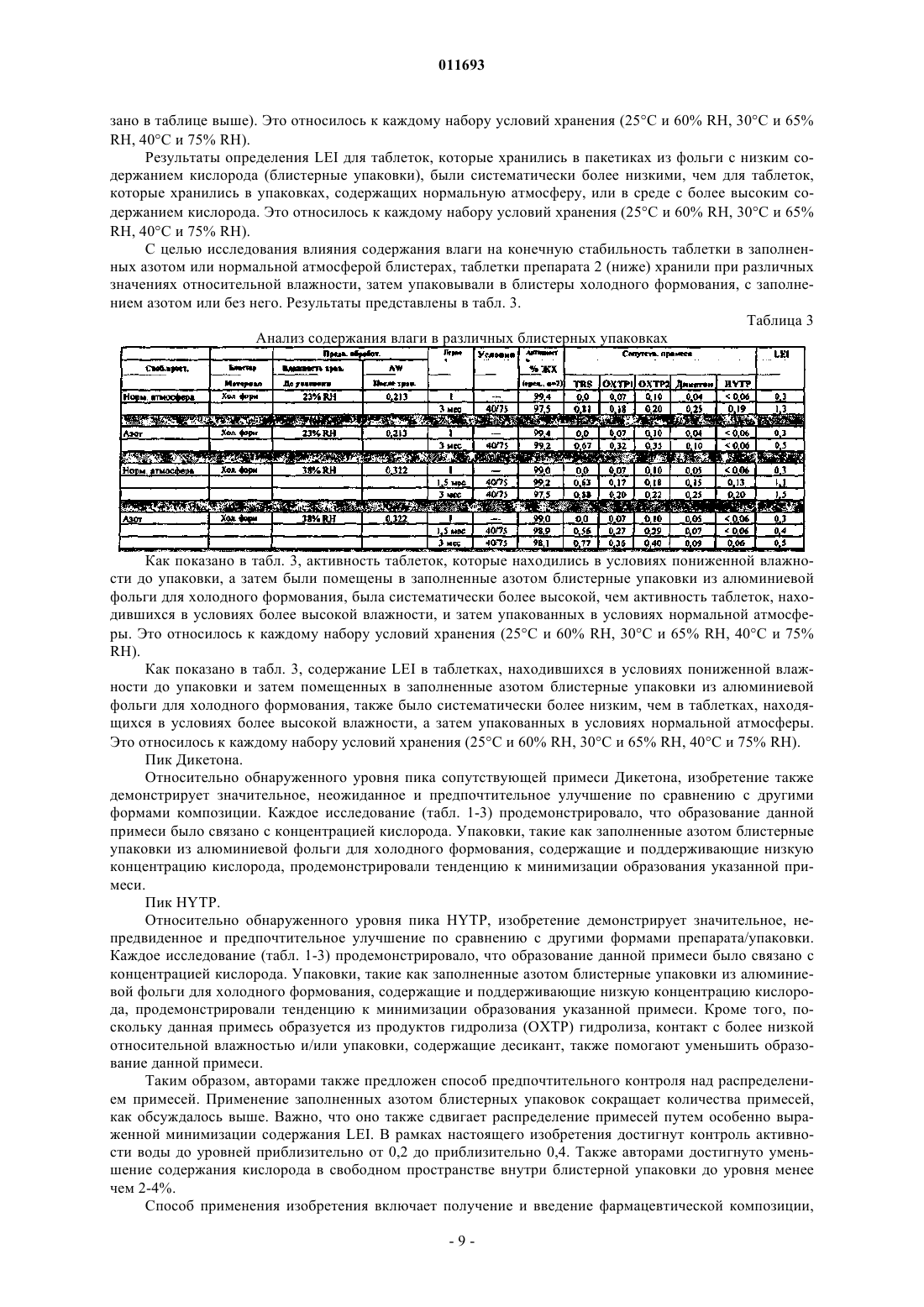
Препарат тиенопиридинового ингибитора агрегации тромбоцитов
Номер патента: 11693
Опубликовано: 28.04.2009
Авторы: Эдельман Тамара Бет, Терник Роберт Луис, Орен Питер Ллойд, Дзинник Дэвид Брайан
Формула / Реферат
1. Композиция, содержащая терапевтически эффективное количество соединения формулы I
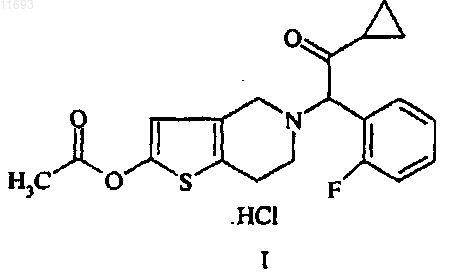
упакованная в воздухо- и влагонепроницаемую блистерную упаковку, заполненную инертным газом.
2. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно от 5 до приблизительно 60 мг в пересчете на основание.
3. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно 5 мг в пересчете на основание.
4. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно 10 мг в пересчете на основание.
5. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно 15 мг в пересчете на основание.
6. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно 60 мг в пересчете на основание.
7. Композиция по п.1, отличающаяся тем, что блистерная упаковка представляет собой блистерную упаковку из алюминиевой фольги.
8. Композиция по п.1, отличающаяся тем, что соединение формулы I представлено в форме таблетки, каплеты или капсулы, содержащих соединение формулы I.
9. Способ производства композиции, содержащей соединение формулы I, включающий стадии:
a) получение таблеток, каплет или капсул, содержащих соединение формулы I, и
b) упаковку указанных таблеток, каплет, капсул или другой твердой дозированной формы, содержащих соединение формулы I, в заполненные инертным газом блистерные упаковки.
10. Способ по п.9, отличающийся тем, что содержание кислорода в свободном пространстве внутри блистерной упаковки снижается до уровня менее 2,0-4,0%, и активность воды в таблетках, каплетах или капсулах, содержащих соединение формулы I, контролируется на уровне менее чем приблизительно 0,2-0,4.
11. Производственное изделие, включающее соединение формулы I, упакованное в заполненную инертным газом воздухо- и влагонепроницаемую блистерную упаковку.
12. Способ производства лекарственного средства, содержащего соединение формулы I, включающий стадию упаковки указанного лекарственного средства в упаковку из непроницаемого материала, содержащую положительное давление инертного газа, для применения в лечении сердечно-сосудистых заболеваний.
Текст
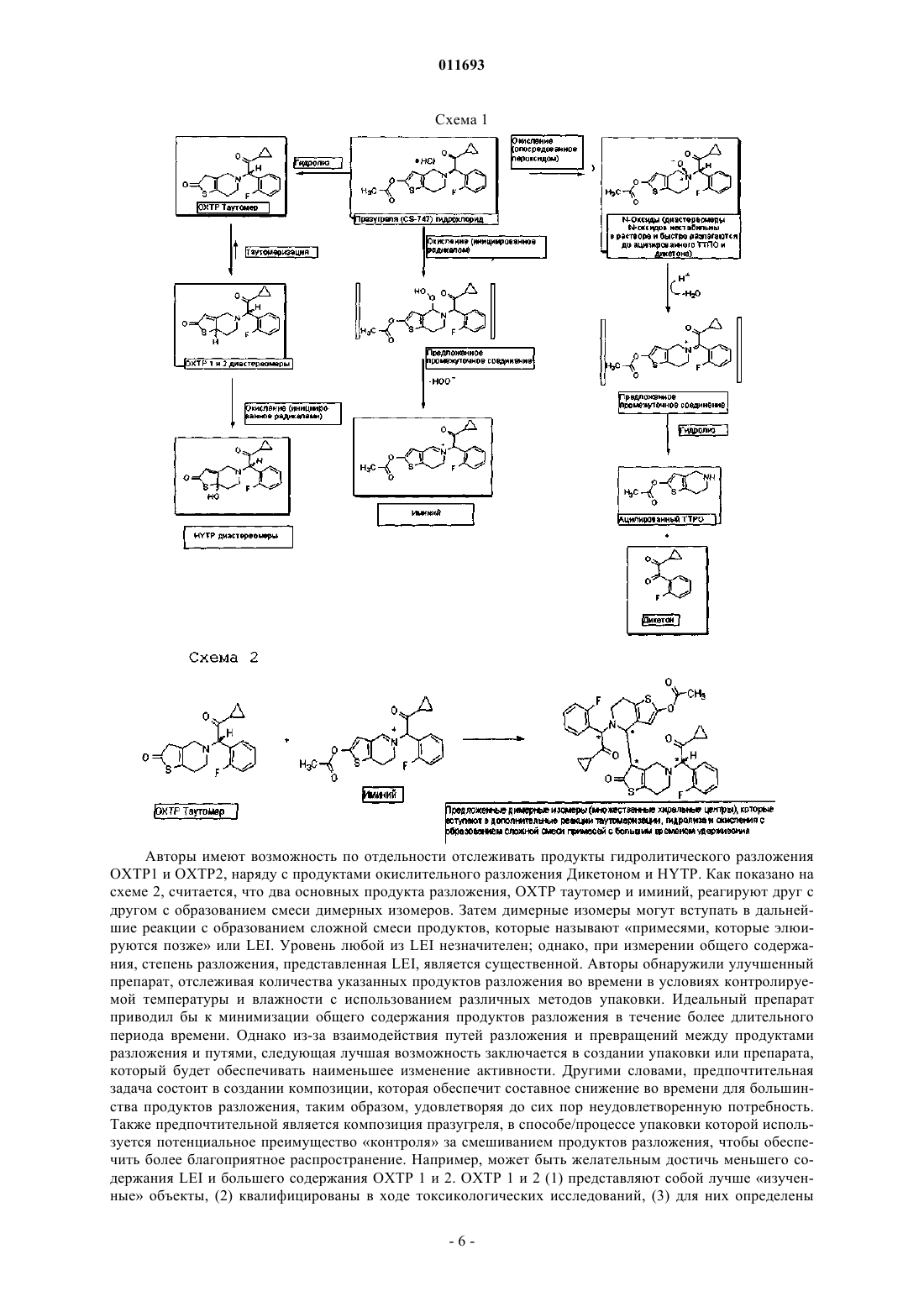
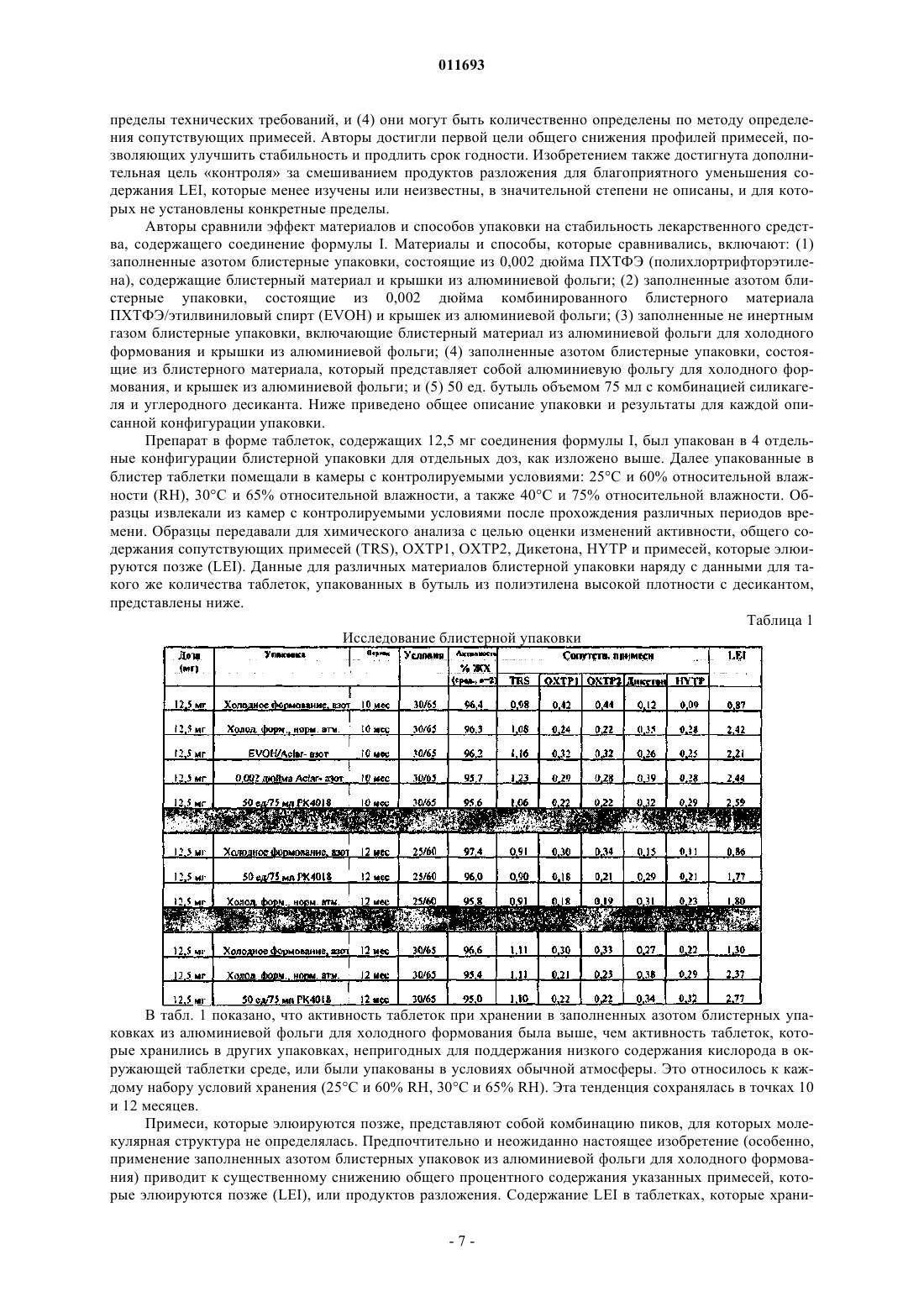
011693 Изобретение относится к новой композиции празугреля. Тиенопиридины, такие как тиклопидин и клопидогрель (продаваемый под торговым названиемPlavix, зарегистрированный товарный знак Sanofi-Aventis S.A.), применяются для лечения тромбоза и связанных с ним заболеваний. В частности, клопидогрель нашел более широкое применение по сравнению с ранее созданным тиклопидином. Празугрель представляет собой тиенопиридин следующего поколения, который в настоящее время изучается в клинических условиях для лечения тромбоза и/или связанных с ним заболеваний, в том числе в качестве вспомогательного средства при вмешательствах на коронарные сосуды. Патент США 5288726 раскрывает и заявляет производные тетрагидропиридина, в том числе 2 ацетокси-5-(-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин. Патент США 6693115 В 2 раскрывает и заявляет соли 2-ацетокси-5-(-циклопропилкарбонил-2 фторбензил)-4,5,6,7-тетрагидротиено[3,2-c]пиридина с хлористо-водородной кислотой и малеиновой кислотой. Соли гидрохлорид и малеат обеспечивают неожиданное и неочевидное улучшение профилей эффективности и стабильности по сравнению с другими солями, а также по сравнению с молекулой свободного основания. Соль 2-ацетокси-5-(-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-c]пиридина гидрохлорид также известна как празугрель. Длительный контакт соли (празугреля гидрохлорида) с воздухом и влажностью приводит к частичному разложению. Таким образом, существует потребность в дальнейшем улучшении стабильности, срока годности и,таким образом, долгосрочной эффективности отдельных доз празугреля. Настоящее изобретение предлагает композицию, содержащую терапевтически эффективное количество соединения формулы I упакованную в воздухо- и влагонепроницаемую блистерную упаковку, заполненную инертным газом. Настоящее изобретение дополнительно предлагает композицию, содержащую соединение формулыI в форме таблетки, каплеты, капсулы или другой твердой лекарственной формы, упакованную в воздухо- и влагонепроницаемую блистерную упаковку, заполненную инертным газом. Настоящее изобретение предлагает улучшенную композицию соединения формулы I, содержащую терапевтически эффективное количество соединения формулы I в форме таблетки, каплеты, капсулы или другой твердой лекарственной формы, упакованной в воздухо- и влагонепроницаемую блистерную упаковку, заполненную инертным газом. Настоящее изобретение относится к способу улучшения стабильности и срока годности соединения формулы I, включающему упаковку таблетки(ок), каплеты(каплет) или капсулы(капсул) или другой твердой лекарственной формы соединения формулы I в блистерную упаковку(ки) из алюминиевой фольги, наполненную инертным газом. Настоящее изобретение относится к применению композиции, содержащей соединение формулы I,для лечения и/или профилактики тромбоза, острого коронарного синдрома, OKC-MM, удара, аневризм мозговых сосудов и сосудистых заболеваний с высоким риском, путем введения композиции, содержащей соединение формулы I, содержащей терапевтически эффективное количество соединения формулы I в виде таблетки, каплеты, капсулы или другой твердой лекарственной формы, упакованной в воздухо- и влагонепроницаемую блистерную упаковку, заполненную инертным газом. Настоящее изобретение относится к применению фармацевтической композиции, содержащей соединения формулы I, которая упакована в заполненную азотом блистерную упаковку из алюминиевой фольги, в комбинации с другими кардиозащитными средствами для лечения сердечно-сосудистых заболеваний. Настоящее изобретение относится к способу улучшения стабильности и срока годности фармацевтической композиции, содержащей соединение формулы I, где отдельная таблетка(ки), каплета(ты) или капсула(лы), содержащие соединения формулы I, упакованы в блистерные упаковки из алюминиевой фольги, заполненные азотом. Настоящее изобретение предлагает композицию соединения формулы I, содержащую терапевтически эффективное количество соединения формулы 1 приблизительно от 5 до 60 мг в пересчете на основание, упакованную в блистерную упаковку из алюминиевой фольги, заполненную инертным газом. Настоящее изобретение предлагает способ производства соединения формулы I, который включает стадии:a) получения таблеток, каплет или капсул, содержащих соединения формулы I, иb) упаковку указанных таблеток, каплет или капсул, содержащих соединения формулы I, в блистерную упаковку из алюминиевой фольги, заполненную инертным газом. Настоящее изобретение предлагает производственное изделие, которое включает соединение формулы I, упакованное в воздухо- и влагонепроницаемую блистерную упаковку, заполненную инертным газом. Настоящее изобретение относится к способам лечения сердечно-сосудистых заболеваний, включающим введение пациенту, нуждающемуся в этом, композиции, соединения формулы I, содержащей терапевтически эффективное количество соединения формулы I в форме таблетки, каплеты, капсулы или другой твердой лекарственной формы, упакованных в воздухо- и влагонепроницаемую блистерную упаковку, заполненную инертным газом. Настоящее изобретение относится к способу производства лекарственного средства, включающему упаковку соединения формулы I в воздухо- и влагонепроницаемую блистерную упаковку, содержащую преимущественно инертный газ, для применения отдельно или в комбинации с другими кардиозащитными средствами для лечения, профилактики и/или облегчения сердечно-сосудистых заболеваний. В данном описании термин празугрель означает соединение формулы I, приведенной выше. Хотя данное соединение также называется CS-747HCl и празугрель HCl здесь и далее, указанные термины означают один и тот же объект, соединение формулы I, приведенной выше. Термин сердечно-сосудистые заболевания означает заболевания, которые поддаются лечению,профилактике или течение которых может быть облегчено с помощью лечения соединением формулы I и/или при внешнем вмешательстве на сердце, включая коронарные сосуды (PCI) или за их пределами. Примеры сердечно-сосудистых заболеваний по изобретению включают окклюзию коронарных артерий,рестеноз, острый коронарный синдром (OKC), включая OKC при наличии медикаментозного лечения(OKC-МЛ), сосудистые заболевания с высоким риском (СЗВР), аневризму мозгового сосуда (CVA), застойную сердечную недостаточность, сердечную альтернацию, аневризму желудочка, аневризму стенки,инфаркт миокарда, остановку сердца, нарушения сердечного ритма, включая фибрилляцию предсердий,отек сердца, сердечную недостаточность, одышку сердечного генеза, тахикардию, удар, преходящий ишемический приступ, сердечное кровохарканье, сердечную недостаточность, шумы сердца, синкопе сердечного генеза, тампонаду сердца, заболевания мозговых сосудов и/или заболевание периферических артерий. Введение в данном описании означает пероральное введение соединения формулы I, включая буккальное, сублингвальное и другие формы перорального введения, которые дают возможность соединению формулы I выполнять его предусмотренную функцию лечения и/или профилактику возникновения или рецидива сердечно-сосудистых заболеваний, отдельно или в качестве составляющей комбинированной терапии (лечения) с процедурой внешнего вмешательства, например процедурой PCI, или в качестве составляющей комбинированного лечения с применением других кардиозащитных средств. Такое введение благодаря комбинированному лечению включает проведение процедуры PCI, например имплантацию стента или проведение баллонной ангиопластики. Термин лечение в данном описании означает облегчение, ингибирование, профилактику возникновения или рецидива, уменьшение выраженности или влияния сердечно-сосудистых заболеваний,включая, но не ограничиваясь ими, рестеноз, острые коронарные синдромы (OKC), в том числе OKC при наличии медикаментозного лечения, инфаркта миокарда, аневризмы мозговых артерий и сосудистых заболеваний с высоким риском, путем применения соединения формулы I, отдельно или в комбинации с другими кардиозащитными средствами или в качестве вспомогательного средства при внешнем вмешательстве, таком как PCI или других процедур внешнего вмешательства. Термин терапевтически эффективное количество в данном описании означает количество соединения формулы I, необходимое или достаточное в виде одной или множественных единиц, для лечения конкретного сердечно-сосудистого заболевания в схеме лечения, включающей соединение формулы I в соответствии с предписаниями квалифицированного лечащего врача, или как зарегистрировано соответствующими регулирующими органами. Терапевтически эффективное количество может изменяться в зависимости от факторов, известных специалисту в данной области (компетентный специалист, назначающий лекарственные средства),включая, например, необязательное сочетание соединения I с аспирином или другим кардиозащитным средством или внешними вмешательствами, такими как PCI, применение покрытых лекарственными средствами стентов, способ и схема введения, размеры субъекта, генетическая или поведенческая предрасположенность к сердечно-сосудистым заболеваниям или тяжесть и рецидивы. Специалист в данной области может учесть перечисленные и связанные с ними факторы, чтобы надлежащим образом определить терапевтически эффективное количество для конкретного пациента. Фраза другие кардиозащитные средства в данном описании означает терапевтические средства,которые были исследованы и доказали способность обеспечивать полезный эффект (лечение и/или профилактику возникновения или рецидива) для пациента, страдающего или подверженного сердечнососудистым заболеваниям. Примеры кардиозащитных агентов включают, но, не ограничиваясь ими, аспирин, эффективные ингибиторы GPIIb/IIIa, эффективные статины, такие как ингибиторы HMG-CoA-2 011693 редуктазы, суперстатины, ингибиторы ацил-СоА-холестерин O-ацилтрансферазы (ACAT), эффективные антикоагулянты и другие эффективные средства, влияющие на липидный обмен. Фраза фармацевтически приемлемый носитель означает какую-либо субстанцию или среду, введенную в препарат вместе с соединением формулы I, которая дает возможность соединению выполнять его предусмотренную функцию. Примеры таких носителей включают растворы, растворители, дисперсионные среды, агенты для задержки высвобождения, эмульсии, микрочастицы и т.п. для комбинированного лечения. Фразы комбинированная терапия, комбинированное лечение, в сочетании с, комбинация соединения формулы I и стента и в сочетании с процедурой PCI, если они используются в данном описании как синонимы и показывают, что пациенту, который является кандидатом для процедуры PCI или другого внешнего вмешательства, вводят терапевтически эффективную(ые) дозу(ы) соединения формулы I или его фармацевтически приемлемой соли, пролекарства, активного метаболита, рацемата или энантиомера, необязательно в сочетании с аспирином, в течение разумного периода времени до и/или после PCI или другого внешнего вмешательства. Разумный период времени для введения соединения формулы I, необязательно с аспирином, до PCI или другого внешнего вмешательства, может составлять приблизительно до шестидесяти дней до процедуры и может не включать предварительного введения. Цель предварительного введения состоит в обеспечении длительного благоприятного эффекта плюс быстрое наступление действия на функции тромбоцитов до внешнего вмешательства, а также быстрого начала действия, характерного для соединения формулы I, без предварительного лечения (нагрузочная доза), максимально увеличивая, таким образом, потенциальную пользу для пациента. Введение соединения формулы I до внешнего вмешательства, такого как установка стента или баллонная ангиопластика,может не быть практикуемым или необходимым в неотложных ситуациях. Для целей данного изобретения разумный период после PCI или другого внешнего вмешательства, в случае комбинированной терапии соединением формулы I, может представлять собой период приблизительно от 5 до 700 дней, предпочтительно приблизительно от 30 дней до приблизительно 365 дней. В конечном итоге, точный период лечения в соответствии с данным изобретением определяется лечащим или наблюдающим врачом и корректируется для конкретного пациента. Фраза воздухо- и влагонепроницаемый в данном описании означает материалы подходящей толщины, известные специалисту в данной области или определенные с минимальным экспериментированием, которые при запаивании в пределах технических требований, вероятно, будут в существенной степени препятствовать доступу и выходу воздуха и влажности. Специалисту в данной области понятно, что может быть трудно достичь абсолютной непроницаемости и что авторы считают, что фраза воздухо- и влагонепроницаемый материал или блистерная упаковка используется сравнительным образом на основании знаний специалиста в данной области о том, что некоторые материалы являются в меньшей степени непроницаемыми для воздуха и влажности, чем другие, и что абсолютной непроницаемости достичь трудно. Предпочтительным является материал, который является как воздухо-, так и влагонепроницаемым. Примеры воздухо- и влагонепроницаемых материалов включают алюминий, ПХТФЭ (Aclar) иAclar-EVOH. Наиболее предпочтительными являются блистерные упаковки из алюминиевой фольги. Фраза заполненный инертным газом в данном описании означает, что газ, который инертен по отношению к таблетке, капсуле, каплете или другой твердой лекарственной форме, окружает доступную впадину или пространство, кроме занятого таблеткой, каплетой или капсулой в блистерной упаковке. Газ может быть инертным газом или другим газом, который не оказывает неблагоприятного воздействия (не реагирует с) на таблетку, каплету или капсулу. Примеры газов, полезных в качестве инертных газов,включают СО 2, аргон, азот, неон, криптон и СО (в фармацевтически приемлемых количествах, которые не приводят к летальному исходу). Более предпочтительным в качестве газа, полезного для практики изобретения, является азот или аргон. Наиболее предпочтительным является азот. Фразы в основном и преобладание инертного газа в данном описании являются синонимами и означают, что объем пространства, окружающего таблетку, каплету или капсулу в упаковочной впадине блистера, в значительной мере или приблизительно, или до практически возможной степени целиком заполнен азотом или другим инертным газом. Результатом указанного преобладания инертного газа является снижение содержания кислорода до менее чем 2-4%. Термин в пересчете на основание в данном описании имеет обычное значение, т.е. количество соединения формулы I (соль HCl), эквивалентное форме основания. Специалист в данной области может осуществить пересчет, и примеры эквивалентных количеств показаны в примерах. Термин другая твердая лекарственная форма в данном описании включает быстрораспадающуюся, быстрорастворяющуюся, с быстрым высвобождением или другую принятую или такую, которая может быть принята, твердую форму лекарственного средства, известную специалисту в данной области. Термин композиция в данном описании имеет обычное значение, а также включает полученное фармацевтическим способом соединение формулы I и упаковку указанного соединения формулы I в соответствии с настоящим изобретением. Поэтому соединение формулы I в виде в таблетки, каплеты, капсулы, формы с замедленным высвобождением или быстрораспадающейся (растворяющейся) формы или-3 011693 другой твердой формы, упакованной в блистерную упаковку из алюминиевой фольги, заполненную инертным газом, представляет собой композицию для целей настоящего изобретения. Также соединение формулы I в виде таблетки, каплеты, капсулы, формы с замедленным высвобождением или быстрораспадающейся (растворяющейся) формы или другой твердой формы, упакованной в блистерную упаковку из алюминиевой фольги, заполненную инертным газом, представляет собой производственное изделие для целей настоящего изобретения. Один из вариантов осуществления настоящего изобретения представляет собой фармацевтическую композицию, содержащую соединение формулы I, в виде отдельных таблеток, каплет или капсул, которые упакованы в воздухо- и влагонепроницаемый материал, содержащий инертный газ, с целью улучшения стабильности и/или продления срока годности. В предпочтительном варианте осуществления настоящее изобретение предлагает композицию соединения формулы I в виде таблетки, каплеты или капсулы, содержащие соединение формулы I, которые упакованы в блистерные упаковки из алюминиевой фольги в атмосфере, состоящей в основном из инертного газа. В другом предпочтительном варианте осуществления таблетки, каплеты или капсулы, содержащие соединения формулы I, упакованы в блистерную(ые) упаковку(ки) , содержащие газ, выбранный из группы, состоящей из азота, гелия, неона, аргона, углекислого газа и монооксида углерода. В наиболее предпочтительном варианте осуществления таблетки, каплеты или капсулы, содержащие соединения формулы I упакованы в блистерную(ые) упаковку(и), заполненные инертным газом, выбранным из группы, состоящей из азота, гелия и аргона. В наиболее предпочтительном варианте осуществления таблетки, каплеты или капсулы, содержащие соединения формулы I упакованы в блистерную(ые) упаковку(и), заполненную азотом. Поэтому наиболее предпочтительная композиция включает таблетки, каплеты или капсулы, содержащие соединения формулы I, упакованные в блистерную(ые) упаковку(и) из алюминиевой фольги, заполненную азотом. В другом предпочтительном варианте осуществления соединение формулы I упаковано в воздухои влагонепроницаемую блистерную упаковку из алюминия, заполненную азотом, приспособленную для применения при лечении OKC, OKC при наличии медикаментозного лечения (ОКС-МЛ), удар и СЗВР,отдельно или в комбинации с другими кардиозащитными средствами, или в качестве вспомогательного средства при внешнем вмешательстве, таком как PCI или другое внешнее вмешательство. Соединение формулы I, его аналоги, соли, сольваты и энантиомеры могут быть получены различными способами, в том числе способами, описанными частично или полностью в патентах США 5288726 и 6693115 В 2, которые включены в данное описание путем ссылки во всей их полноте. В частности, в патенте США 6693115 В 2 раскрыта и заявлена гидрохлоридная соль 2-ацетокси-5-(циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-c]пиридина, соединение формулы I,также известное как празугрель. Твердая дозированная форма для перорального применения может быть получена с использованием разнообразных фармацевтически приемлемых эксципиентов, хорошо известных специалисту в данной области. Обычно, один или более эксципиентов выбирают из каждой из следующих категорий:(a) разбавители, такие как, но не ограничиваясь ими, маннит, моногидрат лактозы, предварительно желатинизированный крахмал или микрокристаллическая целлюлоза;(b) дезинтегранты, такие как, но не ограничиваясь ими, натрийкроскармеллоза, гидроксипропилцеллюлоза с низкой степенью замещения или натрия крахмал гликолят;(c) связующие вещества, включая, но не ограничиваясь ими, гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу. В случае таблеток также рекомендуется применение лубрикантов, таких как,но не ограничиваясь ими, стеарат магния, стеариновая кислота и глицерилбегенат. При получении таблетки часто желательна пленочная оболочка, покрывающая полученную таблетку, для обеспечения фармацевтически приемлемого внешнего вида и облегчения проглатывания указанной таблетки. Коммерческие поставщики, такие как Colorcon Inc. (США), производят разнообразные системы пленочного покрытия, содержащие полимеры, пластификаторы и пигменты, которые могут быть смешаны с водой и распылены на таблетки в чане для покрытия с боковой вентиляцией. Особенно предпочтительная система продается под названием Opadry II, и данная система пленочного покрытия(содержащая аддитивный моногидрат лактозы) особенно пригодна для нанесения пленочного покрытия для таблеток с выгравированными надписями. Предположительно празугрель может быть смешан с одним или несколькими эксципиентами, описанными выше, и помещен в капсулы или спрессован в таблетки. Для улучшения свойств текучести может быть желательным обработать такие смеси роллерным уплотнением с помощью роллера или другого оборудования для получения материала с большей текучестью. Из-за особенностей стабильности празугреля (чувствительность к гидролизу и окислению) не могут быть рекомендованы некоторые эксципиенты, более конкретно, повидон и кросповидон (обычно содержащие следы перекисей) и производственные процессы (например, влажная грануляция). Блистерная упаковка из алюминиевой фольги, заполненная инертным газом, представляет собой предпочтительное и-4 011693 привлекательное решение проблемы. Для дополнительного увеличения стабильности произведенного продукта, блистерная упаковка отдельных доз, в частности, блистерная упаковка из алюминиевой фольги, заполненная инертным газом, представляет собой предпочтительное решение проблемы. Блистерная упаковка отдельных доз представляет собой традиционную упаковку для пациентов и поставщиков здравоохранения, и такие впадины и упаковки могут быть изготовлены из целого ряда пленкообразующих материалов. Чаще блистеры изготавливают из пленок, состоящих из ПВХ, ПХТФЭ и других добавок, разработанных таким образом, чтобы способствовать образованию впадины при нагревании и обработке, для образования впадины для удерживания готовой твердой дозированной формы для перорального применения (капсула, желатиновая капсула или таблетка). После того как дозированная форма помещена в образовавшиеся впадины, состав задней фольги наносится на верхнюю часть впадины, и заднюю сторону припаивают к пленке блистера приложением подходящего количества тепла. Специалист в данной области может производить указанную выше операцию, включая определение подходящего количества тепла путем минимального экспериментирования. Другой вид блистерной упаковки для отдельных доз состоит из алюминиевых блистеров холодного формования. В таких случаях более тяжелый калибр фольги с подходящими добавками образуется без приложения тепла во впадину для удерживания твердой дозированной формы для перорального применения. После того как дозированная форма помещена в образовавшиеся впадины, состав задней фольги наносится на верхнюю часть впадин, и задняя сторона припаивается к пленке блистера приложением подходящего количества тепла. Одним из значительных преимуществ данного вида блистера является то, что алюминиевая фольга фактически непроницаема для влаги и кислорода, и, таким образом, может быть особенно пригодной для упаковки лекарственных форм празугреля (соединение формулы I), которое нуждается в большей защите от влажности и воздуха. Воздухо- и влагонепроницаемая блистерная упаковка, заполненная инертным газом, имеющая алюминиевую впадину и крышку из алюминиевой фольги, является наиболее предпочтительной. Введение инертной атмосферы во впадину блистера может быть обеспечено с помощью различных средств. В одном случае может быть использован вакуум, чтобы удалить воздух из образовавшихся впадин, и далее таблетки размещают во впадинах в камере, сконструированной над машиной для упаковки в блистеры, таким образом, что атмосфера может контролироваться введением инертного газа, с эффективной минимизацией содержания кислорода. Альтернативно, установка для продувания газом может быть размещена на машине для упаковки в блистеры, чтобы вводить инертные газы под давлением во впадины, содержащие таблетки, непосредственно перед установкой запаивания. Путем контроля давления установки для продувания газом содержащая кислород атмосфера может быть вытеснена из впадины, что эффективно снижает содержание кислорода во впадине, содержащей лекарственную форму, наполняя впадину в основном инертным газом. Альтернативно, заполнение инертным газом может быть обеспечено путем инъекции контролируемого количества сжиженного инертного газа во впадину блистера непосредственно перед установкой для запаивания. Как только газ нагревается и расширяется, содержание кислорода может быть эффективно снижено вытеснением. Демонстрация изобретения На стабильность таблеток, капсул или каплет, содержащих соединения формулы I, влияют факторы, включающие старение (длительность хранения), а также условия хранения, такие как температура и относительная влажность. Надлежащие условия хранения гарантируют увеличение срока хранения, в течение которого активность таблеток, каплет или капсул с большей вероятностью будет находиться в пределах рекомендованных и/или одобренных пределов технических требований, таким образом, гарантируя химическую и фармакодинамическую целостность таблеток, каплет или капсул, которые вводят пациентам. Исследования показали, что, несмотря на улучшение, связанное с гидрохлоридной солью CS747 в отношении стабильности и т.д. (см. патент США 6693115 В 2), еще существуют возможности для улучшения. Конкретно, на сегодняшний день известно, что при хранении таблетки, содержащие соединение формулы I, подвергаются разложению как гидролитическим, так и окислительным путем. Также считается, что существуют перекрестки между этими путями разложения, где промежуточные звенья или продукты определенных стадий в одном пути могут подвергаться внутреннему превращению или кинетическому ускорению или могут быть созданы помехи концентрацией продукта (или промежуточного соединения), воздуха или влажности из окружающей среды или другого пути. Предложенные схематические пути разложения, которые признаны в настоящий момент, приведены ниже на схемах 1 и 2 без доказательств. Авторы имеют возможность по отдельности отслеживать продукты гидролитического разложенияOXTP1 и OXTP2, наряду с продуктами окислительного разложения Дикетоном и HYTP. Как показано на схеме 2, считается, что два основных продукта разложения, OXTP таутомер и иминий, реагируют друг с другом с образованием смеси димерных изомеров. Затем димерные изомеры могут вступать в дальнейшие реакции с образованием сложной смеси продуктов, которые называют примесями, которые элюируются позже или LEI. Уровень любой из LEI незначителен; однако, при измерении общего содержания, степень разложения, представленная LEI, является существенной. Авторы обнаружили улучшенный препарат, отслеживая количества указанных продуктов разложения во времени в условиях контролируемой температуры и влажности с использованием различных методов упаковки. Идеальный препарат приводил бы к минимизации общего содержания продуктов разложения в течение более длительного периода времени. Однако из-за взаимодействия путей разложения и превращений между продуктами разложения и путями, следующая лучшая возможность заключается в создании упаковки или препарата,который будет обеспечивать наименьшее изменение активности. Другими словами, предпочтительная задача состоит в создании композиции, которая обеспечит составное снижение во времени для большинства продуктов разложения, таким образом, удовлетворяя до сих пор неудовлетворенную потребность. Также предпочтительной является композиция празугреля, в способе/процессе упаковки которой используется потенциальное преимущество контроля за смешиванием продуктов разложения, чтобы обеспечить более благоприятное распространение. Например, может быть желательным достичь меньшего содержания LEI и большего содержания OXTP 1 и 2. OXTP 1 и 2 (1) представляют собой лучше изученные объекты, (2) квалифицированы в ходе токсикологических исследований, (3) для них определены-6 011693 пределы технических требований, и (4) они могут быть количественно определены по методу определения сопутствующих примесей. Авторы достигли первой цели общего снижения профилей примесей, позволяющих улучшить стабильность и продлить срок годности. Изобретением также достигнута дополнительная цель контроля за смешиванием продуктов разложения для благоприятного уменьшения содержания LEI, которые менее изучены или неизвестны, в значительной степени не описаны, и для которых не установлены конкретные пределы. Авторы сравнили эффект материалов и способов упаковки на стабильность лекарственного средства, содержащего соединение формулы I. Материалы и способы, которые сравнивались, включают: (1) заполненные азотом блистерные упаковки, состоящие из 0,002 дюйма ПХТФЭ (полихлортрифторэтилена), содержащие блистерный материал и крышки из алюминиевой фольги; (2) заполненные азотом блистерные упаковки, состоящие из 0,002 дюйма комбинированного блистерного материала ПХТФЭ/этилвиниловый спирт (EVOH) и крышек из алюминиевой фольги; (3) заполненные не инертным газом блистерные упаковки, включающие блистерный материал из алюминиевой фольги для холодного формования и крышки из алюминиевой фольги; (4) заполненные азотом блистерные упаковки, состоящие из блистерного материала, который представляет собой алюминиевую фольгу для холодного формования, и крышек из алюминиевой фольги; и (5) 50 ед. бутыль объемом 75 мл с комбинацией силикагеля и углеродного десиканта. Ниже приведено общее описание упаковки и результаты для каждой описанной конфигурации упаковки. Препарат в форме таблеток, содержащих 12,5 мг соединения формулы I, был упакован в 4 отдельные конфигурации блистерной упаковки для отдельных доз, как изложено выше. Далее упакованные в блистер таблетки помещали в камеры с контролируемыми условиями: 25 С и 60% относительной влажности (RH), 30C и 65% относительной влажности, а также 40C и 75% относительной влажности. Образцы извлекали из камер с контролируемыми условиями после прохождения различных периодов времени. Образцы передавали для химического анализа с целью оценки изменений активности, общего содержания сопутствующих примесей (TRS), OXTP1, ОХТР 2, Дикетона, HYTP и примесей, которые элюируются позже (LEI). Данные для различных материалов блистерной упаковки наряду с данными для такого же количества таблеток, упакованных в бутыль из полиэтилена высокой плотности с десикантом,представлены ниже. Таблица 1 Исследование блистерной упаковки В табл. 1 показано, что активность таблеток при хранении в заполненных азотом блистерных упаковках из алюминиевой фольги для холодного формования была выше, чем активность таблеток, которые хранились в других упаковках, непригодных для поддержания низкого содержания кислорода в окружающей таблетки среде, или были упакованы в условиях обычной атмосферы. Это относилось к каждому набору условий хранения (25C и 60% RH, 30C и 65% RH). Эта тенденция сохранялась в точках 10 и 12 месяцев. Примеси, которые элюируются позже, представляют собой комбинацию пиков, для которых молекулярная структура не определялась. Предпочтительно и неожиданно настоящее изобретение (особенно,применение заполненных азотом блистерных упаковок из алюминиевой фольги для холодного формования) приводит к существенному снижению общего процентного содержания указанных примесей, которые элюируются позже (LEI), или продуктов разложения. Содержание LEI в таблетках, которые храни-7 011693 лись в заполненных азотом блистерных упаковках из алюминиевой фольги для холодного формования,было существенно ниже, чем в таблетках, которые хранились в других упаковках, непригодных для поддержания низкого содержания кислорода в окружающей таблетки среде, или которые были упакованы в условиях нормальной атмосферы. Это относилось к каждому набору условий хранения (25C и 60% RH,30C и 65% RH, 40C и 75% RH [не показаны]). В ходе проведения данного исследования были произведены пустые блистеры, наполненные азотом, с использованием трех видов блистерного материала: 0,002 дюйма ПХТФЭ, EVOH/ПХТФЭ и алюминиевых блистеров для холодного формования. Через показательные промежутки времени измеряли содержание кислорода в пустых блистерах, чтобы определить влияние длительности и условий хранения на данный параметр. Ниже представлены характерные результаты. Анализ содержания кислорода в блистерной упаковке Вследствие неспособности двух прозрачных блистерных пленок (0,002 дюйма ПХТФЭ иEVOH/ПХТФЭ) поддерживать низкое содержание кислорода, такие блистеры (0,002 дюйма ПХТФЭ иEVOH/ПХТФЭ) не изучались в более поздних временных точках в ходе данного исследования. Проведенное исследование показало, что заполненные азотом блистерные упаковки из алюминиевой фольги для холодного формования при давлении 25 фунт/дюйм 2, 30C и 65% RH содержали наименьшее количество кислорода в различных точках времени. В другом исследовании стабильности препарата дозированную форму в виде таблетки, содержащей 12,5 мг соединения формулы I, упаковывали в пакетики из фольги, наполненные газом, содержащим известные концентрации кислорода в азоте, с целью дальнейшего прояснения влияния концентрации кислорода на образование примесей в композиции. Результаты этого исследования, которое представлено в данном описании как исследование Multi-Vac, приведены в табл. 2 ниже. Таблица 2 Исследование Multi-Vac Как показано в табл. 2, активность таблеток при хранении в среде с низким содержанием кислорода, которое обеспечивается с помощью заполненных азотом блистерных упаковок из алюминиевой фольги для холодного формования, была систематически более высокой, чем активность таблеток, упакованных в условиях нормальной атмосферы или в среде с более высоким содержанием кислорода (как пока-8 011693 зано в таблице выше). Это относилось к каждому набору условий хранения (25C и 60% RH, 30C и 65%RH, 40C и 75% RH). Результаты определения LEI для таблеток, которые хранились в пакетиках из фольги с низким содержанием кислорода (блистерные упаковки), были систематически более низкими, чем для таблеток,которые хранились в упаковках, содержащих нормальную атмосферу, или в среде с более высоким содержанием кислорода. Это относилось к каждому набору условий хранения (25C и 60% RH, 30C и 65%RH, 40C и 75% RH). С целью исследования влияния содержания влаги на конечную стабильность таблетки в заполненных азотом или нормальной атмосферой блистерах, таблетки препарата 2 (ниже) хранили при различных значениях относительной влажности, затем упаковывали в блистеры холодного формования, с заполнением азотом или без него. Результаты представлены в табл. 3. Таблица 3 Анализ содержания влаги в различных блистерных упаковках Как показано в табл. 3, активность таблеток, которые находились в условиях пониженной влажности до упаковки, а затем были помещены в заполненные азотом блистерные упаковки из алюминиевой фольги для холодного формования, была систематически более высокой, чем активность таблеток, находившихся в условиях более высокой влажности, и затем упакованных в условиях нормальной атмосферы. Это относилось к каждому набору условий хранения (25C и 60% RH, 30C и 65% RH, 40C и 75%RH). Как показано в табл. 3, содержание LEI в таблетках, находившихся в условиях пониженной влажности до упаковки и затем помещенных в заполненные азотом блистерные упаковки из алюминиевой фольги для холодного формования, также было систематически более низким, чем в таблетках, находящихся в условиях более высокой влажности, а затем упакованных в условиях нормальной атмосферы. Это относилось к каждому набору условий хранения (25C и 60% RH, 30C и 65% RH, 40C и 75% RH). Пик Дикетона. Относительно обнаруженного уровня пика сопутствующей примеси Дикетона, изобретение также демонстрирует значительное, неожиданное и предпочтительное улучшение по сравнению с другими формами композиции. Каждое исследование (табл. 1-3) продемонстрировало, что образование данной примеси было связано с концентрацией кислорода. Упаковки, такие как заполненные азотом блистерные упаковки из алюминиевой фольги для холодного формования, содержащие и поддерживающие низкую концентрацию кислорода, продемонстрировали тенденцию к минимизации образования указанной примеси. Пик HYTP. Относительно обнаруженного уровня пика HYTP, изобретение демонстрирует значительное, непредвиденное и предпочтительное улучшение по сравнению с другими формами препарата/упаковки. Каждое исследование (табл. 1-3) продемонстрировало, что образование данной примеси было связано с концентрацией кислорода. Упаковки, такие как заполненные азотом блистерные упаковки из алюминиевой фольги для холодного формования, содержащие и поддерживающие низкую концентрацию кислорода, продемонстрировали тенденцию к минимизации образования указанной примеси. Кроме того, поскольку данная примесь образуется из продуктов гидролиза (OXTP) гидролиза, контакт с более низкой относительной влажностью и/или упаковки, содержащие десикант, также помогают уменьшить образование данной примеси. Таким образом, авторами также предложен способ предпочтительного контроля над распределением примесей. Применение заполненных азотом блистерных упаковок сокращает количества примесей,как обсуждалось выше. Важно, что оно также сдвигает распределение примесей путем особенно выраженной минимизации содержания LEI. В рамках настоящего изобретения достигнут контроль активности воды до уровней приблизительно от 0,2 до приблизительно 0,4. Также авторами достигнуто уменьшение содержания кислорода в свободном пространстве внутри блистерной упаковки до уровня менее чем 2-4%. Способ применения изобретения включает получение и введение фармацевтической композиции,-9 011693 содержащей соединение формулы I, в форме таблетки, каплеты или капсулы, упакованной в заполненные азотом алюминиевые блистерные упаковки. Блистерные упаковки могут представлять собой отдельные единицы или блоки из многочисленных блистерных упаковок, соединенных в подходящих точках перфорации для раздачи или упаковки с целью продажи, в соответствии с обстоятельствами или регуляторными требованиями. Способ по изобретению включает введение активного ингредиента в таблетку,каплету или капсулу, включая капсулу замедленного высвобождения или быстрораспадающуюся таблетку, упакованную в заполненную азотом блистерную упаковку, предпочтительно блистерную упаковку из алюминиевой фольги. Улучшение композиции в данном описании заключается в упаковке таблетки, каплеты или капсулы в заполненную азотом блистерную упаковку, предпочтительно блистерную упаковку из алюминиевой фольги. Обычно таблетка, каплета или капсула может содержать эквивалент приблизительно от 1 до 60 мг соединения формулы I. Предпочтительно таблетка, каплета или капсула может содержать эквивалент приблизительно от 5 до 60 мг основания соединения формулы I. Наиболее предпочтительно таблетка, каплета или капсула содержит эквивалент приблизительно 5, 10, 15, 30 или 60 мг основания соединения формулы I. Следующие способы получения таблетки, каплеты или капсулы, пригодных для данного изобретения, носят исключительно иллюстративный характер и не предназначены для ограничения данного изобретения каким-либо способом. Следует понимать, что полученные таким образом таблетки, каплеты или капсулы затем упаковывают в заполненные азотом блистерные упаковки из алюминиевой фольги,получение которых описано в примерах и/или в любом разделе данного описания. "Активный ингредиент" означает соединение формулы (I) или его фармацевтически приемлемую соль, сольват, активный метаболит, энантиомер, рацемат или пролекарство, содержащее или не содержащее другое(ие) кардиозащитное(ые) средство(ва), для введения пациенту, нуждающемуся в этом, необязательно в сочетании с аспирином, или в качестве вспомогательного средства для введения стента, или процедуры PCI. Примеры Следующие примеры композиций в форме таблетки, каплеты или капсулы, а также сравнительные примеры предназначены для дальнейшей иллюстрации настоящего изобретения и не предназначены для ограничения данного изобретения. Препарат 1.CS-747 HCl (13,72 мг, эквивалент 12,5 мг основания), маннит, гидроксипропилметилцеллюлозу, натрийкроскармеллозу, микрокристаллическую целлюлозу и стеарат магния смешивают, затем подвергают роллерному уплотнению для получения гранулята. К полученному грануляту добавляют еще порцию натрийкроскармеллозы, микрокристаллической целлюлозы и стеарат магния, материал перемешивают и прессуют с получением таблеток массой 250 мг. Смесь пленочного покрытия Opadry II добавляют в воду, затем смесь распыляют на таблетки в чане для нанесения покрытия с боковой вентиляцией. Затем таблетку упаковывают в блистерную упаковку из алюминиевой фольги, заполненную инертным газом, таким как азот, затем запаивают с использованием методик, известных специалисту в данной области. Препарат 2.CS-747 HCl (10,98 мг, эквивалент 10,00 мг основания), маннит, гидроксипропилметилцеллюлозу,натрийкроскармеллозу, микрокристаллическую целлюлозу и стеарат магния смешивают, затем подвергают роллерному уплотнению для получения гранулята. К полученному грануляту добавляют еще порцию натрийкроскармеллозы, микрокристаллической целлюлозы и стеарат магния, материал перемешивают и прессуют с получением таблеток массой 250 мг. Смесь пленочного покрытия Opadry II добавляют в воду, затем смесь распыляют на таблетки в чане для нанесения покрытия с боковой вентиляцией. Твердые композиции, содержащие соединение формулы I, могут быть получены с использованием перечисленных ниже ингредиентов для таблетки, капсулы или каплеты. Препарат 3.CS-747 HCl (5,49 мг, эквивалент 5,0 мг основания), маннит, гидроксипропилметилцеллюлозу, натрийкроскармеллозу, микрокристаллическую целлюлозу и стеарат магния смешивают, затем подвергают роллерному уплотнению для получения гранулята. К полученному грануляту добавляют еще порцию натрийкроскармеллозы, микрокристаллической целлюлозы и стеарат магния, материал перемешивают и прессуют с получением таблеток массой 125-250 мг. Смесь пленочного покрытия Opadry II добавляют в воду, затем смесь распыляют на таблетки в чане для нанесения покрытия с боковой вентиляцией. Затем полученную таблетку(ки), каплету(ты) или капсулу(лы) упаковывают в блистерную(ые) упаковку(и), заполненные азотом, с использованием методик, раскрытых в данном описании, и/или известных специалисту в данной области, или определенных путем минимального экспериментирования специалистом в данной области. Далее таблетку(ки), каплету(ты) или капсулу(лы) помещают в коробки для хранения и/или отгрузки. Препарат 4.- 10011693 роллерному уплотнению для получения гранулята. К полученному грануляту добавляют еще порцию натрийкроскармеллозы, микрокристаллической целлюлозы и стеарат магния, материал перемешивают и прессуют с получением таблеток массой 125-250 мг. Смесь пленочного покрытия Opadry II добавляют в воду, затем смесь распыляют на таблетки в чане для нанесения покрытия с боковой вентиляцией. Затем полученную таблетку(ки), каплету(ты) или капсулу(лы) упаковывают в блистерную(ые) упаковку(и), заполненные азотом, с использованием методик, раскрытых в данном описании, и/или известных специалисту в данной области, или определенных путем минимального экспериментирования специалистом в данной области. Далее таблетку(ки), каплету(ты) или капсулу(лы) помещают в коробки для хранения и/или отгрузки. Препарат 5.CS-747 HCl (16,47 мг, эквивалент 15,00 мг основания), маннит, гидроксипропилметилцеллюлозу,натрийкроскармеллозу, микрокристаллическую целлюлозу и стеарат магния смешивают, затем подвергают роллерному уплотнению для получения гранулята. К полученному грануляту добавляют еще порцию натрийкроскармеллозы, микрокристаллической целлюлозы и стеарат магния, материал перемешивают и прессуют с получением таблеток массой 125-250 мг. Смесь пленочного покрытия Opadry II добавляют в воду, затем смесь распыляют на таблетки в чане для нанесения покрытия с боковой вентиляцией. Затем полученную таблетку(ки), каплету(ты) или капсулу(лы) упаковывают в блистерную(ые) упаковку(и), заполненные азотом, с использованием методик, раскрытых в данном описании и/или известных специалисту в данной области или определенных путем минимального экспериментирования специалистом в данной области. Далее таблетку(ки), каплету(ты) или капсулу(лы) помещают в коробки для хранения и/или отгрузки. Препарат 6.CS-747 HCl (32,94 мг, эквивалент 30 мг основания), маннит, гидроксипропилметилцеллюлозу, натрийкроскармеллозу, микрокристаллическую целлюлозу и стеарат магния смешивают, затем подвергают роллерному уплотнению для получения гранулята. К полученному грануляту добавляют еще порцию натрийкроскармеллозы, микрокристаллической целлюлозы и стеарат магния, материал перемешивают и прессуют с получением таблеток массой 125-250 мг. Смесь пленочного покрытия Opadry II добавляют в воду, затем смесь распыляют на таблетки в чане для нанесения покрытия с боковой вентиляцией. Затем полученную таблетку(ки), каплету(ты) или капсулу(лы) упаковывают в блистерную(ые) упаковку(и), заполненные азотом, с использованием методик, раскрытых в данном описании, и/или известных специалисту в данной области, или определенных путем минимального экспериментирования специалистом в данной области. Далее таблетку(ки), каплету(ты) или капсулу(лы) помещают в коробки для хранения и/или отгрузки. Специалисту в данной области будет понятно, что другие дозы соединения формулы I, например доза 60 мг, могут быть получены в соответствии с методиками, описанными выше для приведенных доз,при необходимости с соответствующими модификациями. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция, содержащая терапевтически эффективное количество соединения формулы I упакованная в воздухо- и влагонепроницаемую блистерную упаковку, заполненную инертным газом. 2. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно от 5 до приблизительно 60 мг в пересчете на основание. 3. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно 5 мг в пересчете на основание. 4. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно 10 мг в пересчете на основание. 5. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно 15 мг в пересчете на основание. 6. Композиция по п.1, отличающаяся тем, что терапевтически эффективное количество соединения формулы I составляет приблизительно 60 мг в пересчете на основание. 7. Композиция по п.1, отличающаяся тем, что блистерная упаковка представляет собой блистерную упаковку из алюминиевой фольги.- 11011693 8. Композиция по п.1, отличающаяся тем, что соединение формулы I представлено в форме таблетки, каплеты или капсулы, содержащих соединение формулы I. 9. Способ производства композиции, содержащей соединение формулы I, включающий стадии:a) получение таблеток, каплет или капсул, содержащих соединение формулы I, иb) упаковку указанных таблеток, каплет, капсул или другой твердой дозированной формы, содержащих соединение формулы I, в заполненные инертным газом блистерные упаковки. 10. Способ по п.9, отличающийся тем, что содержание кислорода в свободном пространстве внутри блистерной упаковки снижается до уровня менее 2,0-4,0%, и активность воды в таблетках, каплетах или капсулах, содержащих соединение формулы I, контролируется на уровне менее чем приблизительно 0,20,4. 11. Производственное изделие, включающее соединение формулы I, упакованное в заполненную инертным газом воздухо- и влагонепроницаемую блистерную упаковку. 12. Способ производства лекарственного средства, содержащего соединение формулы I, включающий стадию упаковки указанного лекарственного средства в упаковку из непроницаемого материала,содержащую положительное давление инертного газа, для применения в лечении сердечно-сосудистых заболеваний.
МПК / Метки
МПК: A61K 31/4365
Метки: ингибитора, препарат, тиенопиридинового, агрегации, тромбоцитов
Код ссылки
<a href="https://eas.patents.su/13-11693-preparat-tienopiridinovogo-ingibitora-agregacii-trombocitov.html" rel="bookmark" title="База патентов Евразийского Союза">Препарат тиенопиридинового ингибитора агрегации тромбоцитов</a>
Предыдущий патент: Способ ингибирования выработки микотоксина
Следующий патент: Тест-система для диагностики рака предстательной железы и способ диагностики рака предстательной железы
Случайный патент: Модуль строительных лесов, строительные леса и способ их использования