Продукты для ухода за ранами, содержащие кератин
Номер патента: 11388
Опубликовано: 27.02.2009
Авторы: Келли Роберт Джеймс, Роддик-Ланзилотта Алиса Даун, Али Мохаммад Азам
Формула / Реферат
1. Способ получения материала для лечения ран, включающий в себя:
(a) получение 10% раствора белка кератина;
(b) смешивание белка кератина с водорастворимым полимером с образованием однородной смеси;
(c) отливку водной смеси, полученной таким образом; и
(d) следующие друг за другом процессы замораживания и оттаивания с получением гидрогеля.
2. Способ по п.1, в котором физико-механические свойства биоматериалов улучшают введением агентов сшивания для образования дисульфидных связей и удаления сульфонатных функциональных групп.
3. Способ по п.2, в котором агент сшивания, используемый как восстановитель, представляет собой тиол или тиогликолят.
4. Способ по п.2 или 3, в котором физико-механические свойства представляют собой прочность в мокром и сухом состояниях.
5. Способ по п.3, в котором тиогликолят является раствором тиогликолята аммония.
6. Способ по любому из пп.1-5, в котором белок кератин является S-сульфированным.
7. Способ по любому из пп.1-6, в котором белок кератин является белковой фракцией.
8. Способ по п.7, в котором белковая фракция является интактной.
9. Способ по п.7 или 8, в котором белок кератин относится к семейству белков промежуточных филаментов.
10. Способ по любому из пп.1-9, в котором водорастворимый полимер выбирают из группы, состоящей из поливинилового спирта, поливинилпирролидона, полиэтиленгликоля.
11. Гидрогель для лечения ран, содержащий S-сульфированный кератин в смеси с водорастворимым полимером, обеспечивающим образование водородных связей, и который поперечно сшит с количеством агента для поперечной сшивки белка, достаточным для придания пространственной стабильности.
12. Гидрогель для лечения ран по п.11, в котором S-сульфированный кератин представляет собой белок промежуточных филаментов S-сульфированного кератина, водорастворимый полимер, обеспечивающий образование водородных связей, выбран из группы, состоящей из поливинилового спирта и поливинилпирролидона и их смесей, и агент для поперечной сшивки белка выбран из группы, состоящей из глутаральдегида, формальдегида, карбодиимида, 2,5-гександиона, диимидата, бисакриламида и их смесей.
13. Гидрогель для лечения ран по п.12, в котором агент для поперечной сшивки белка включает глутаральдегид.
14. Гидрогель для лечения ран, содержащий S-сульфированный кератин в смеси с водорастворимым полимером, обеспечивающим образование водородных связей.
15. Гидрогель для лечения ран по п.14, в котором S-сульфированный кератин представляет собой белок промежуточных филаментов S-сульфированного кератина, а водорастворимый полимер, обеспечивающий образование водородных связей, выбран из группы, состоящей из поливинилового спирта и поливинилпирролидона и их смесей.
Текст
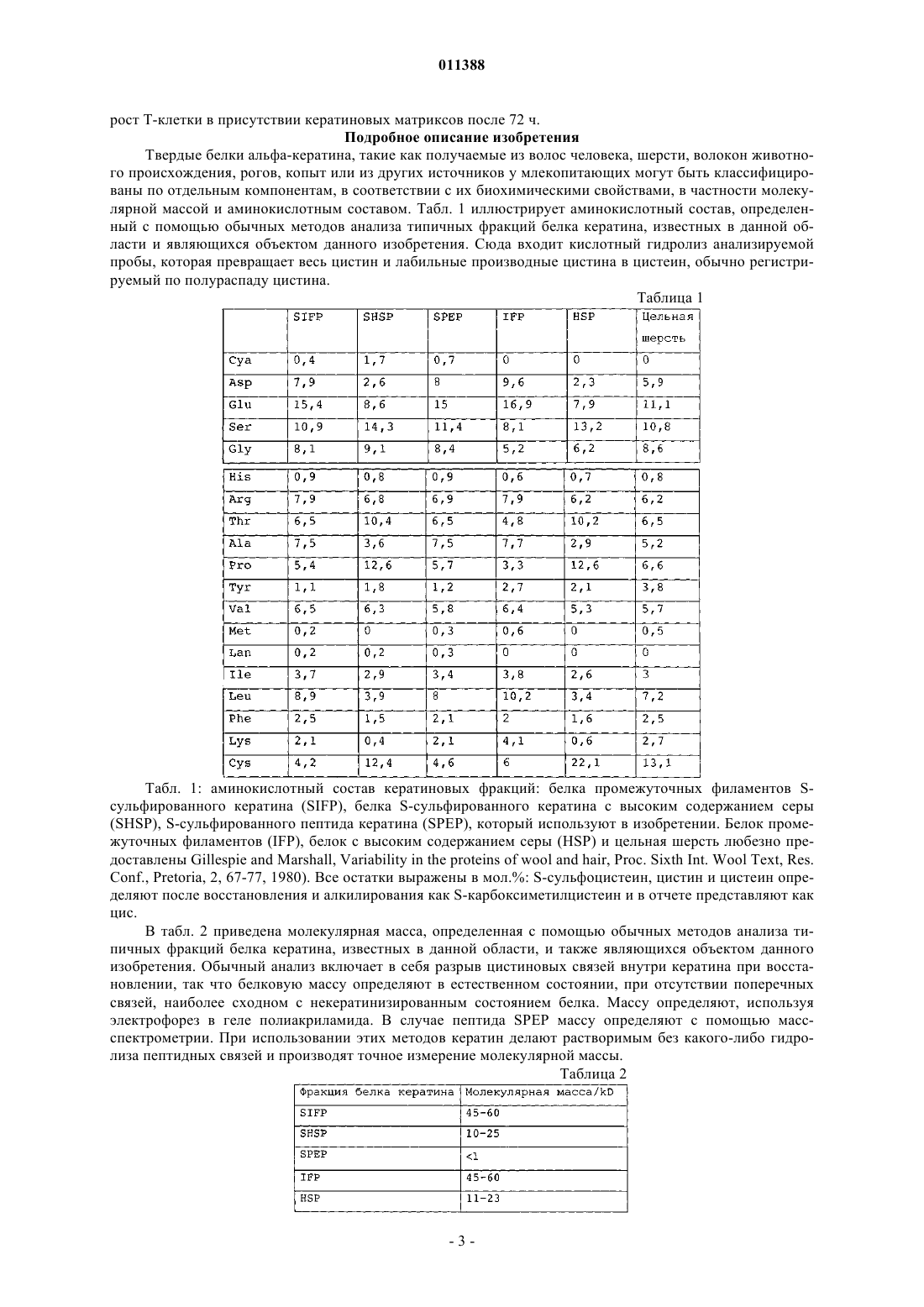
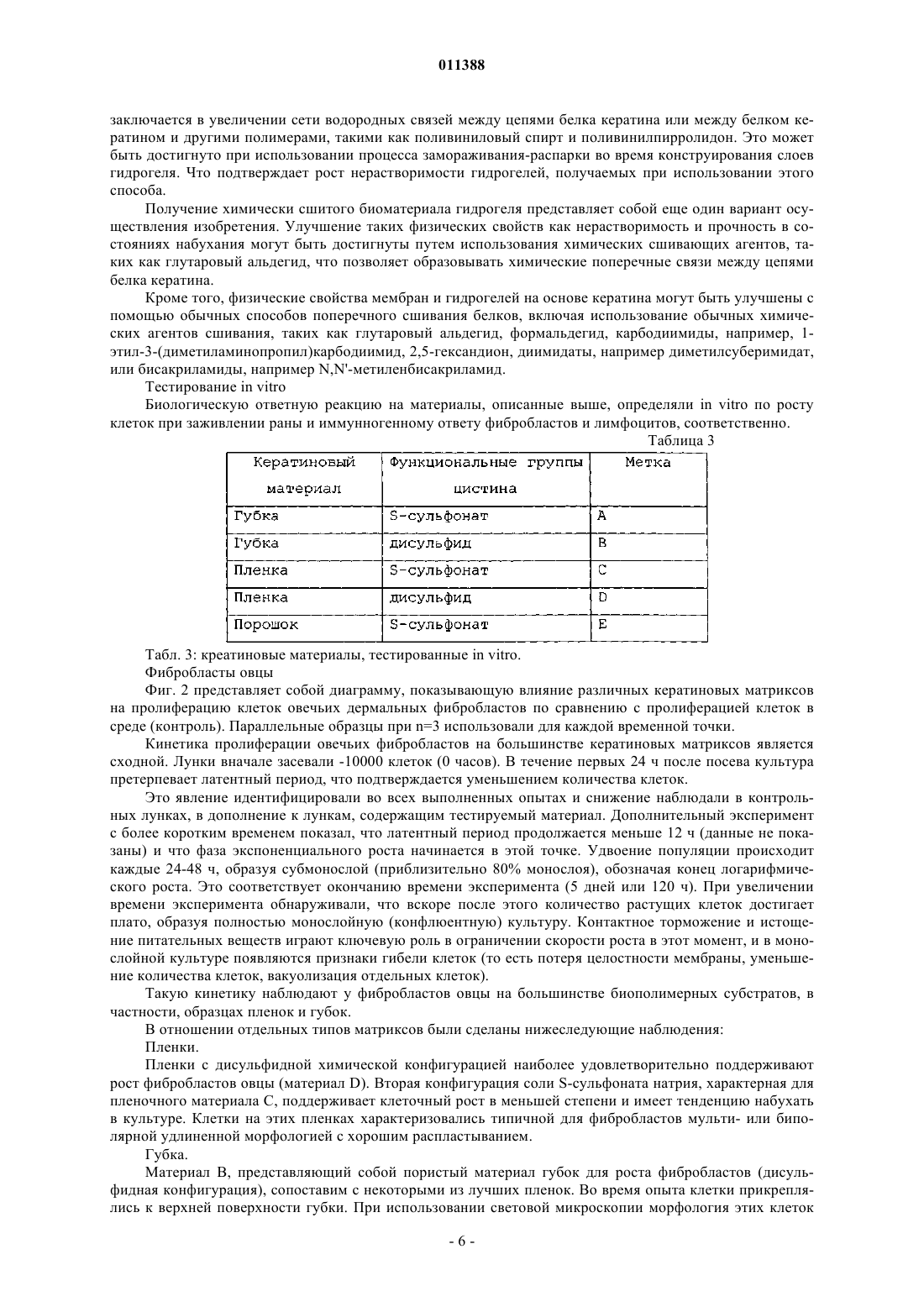
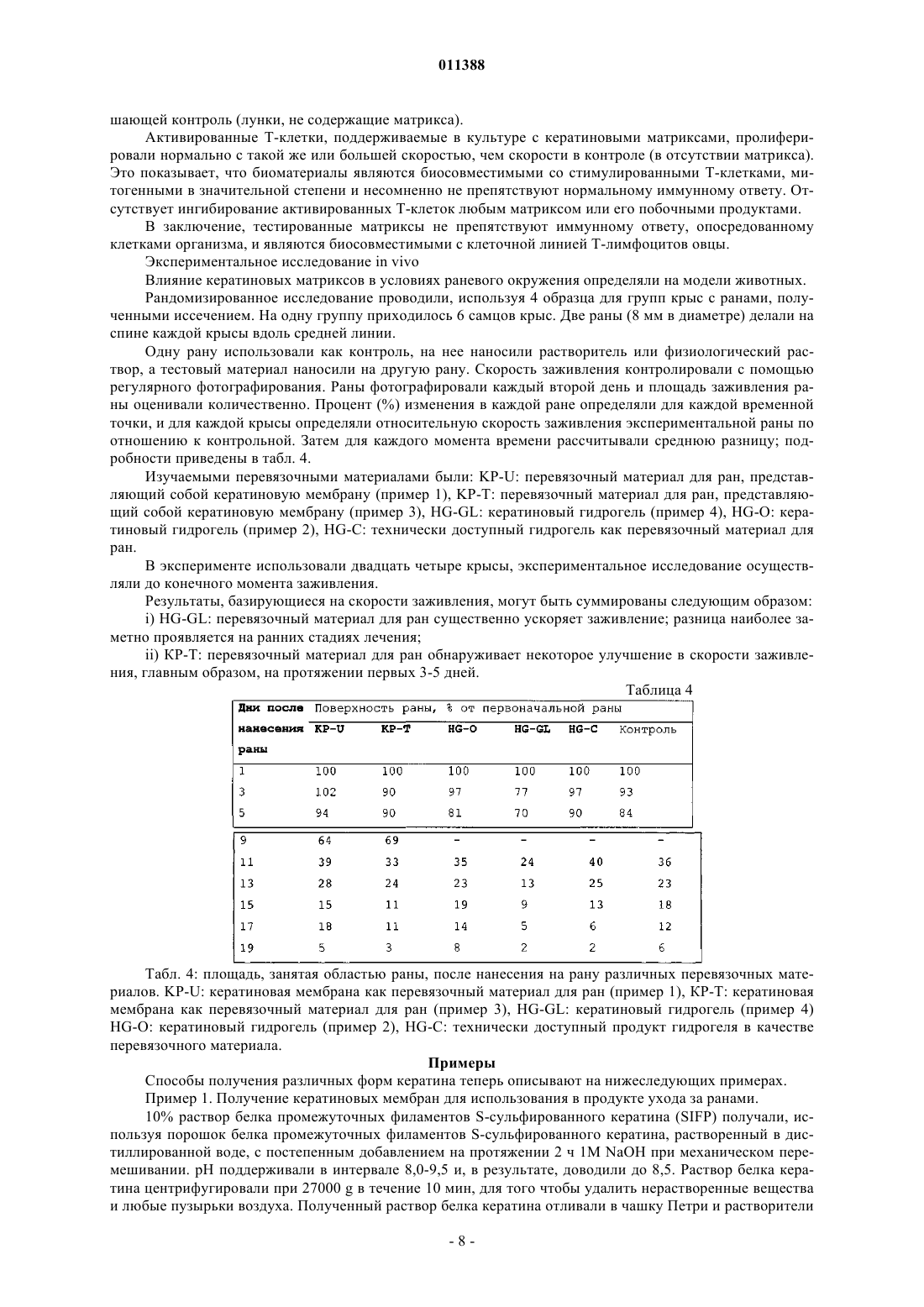
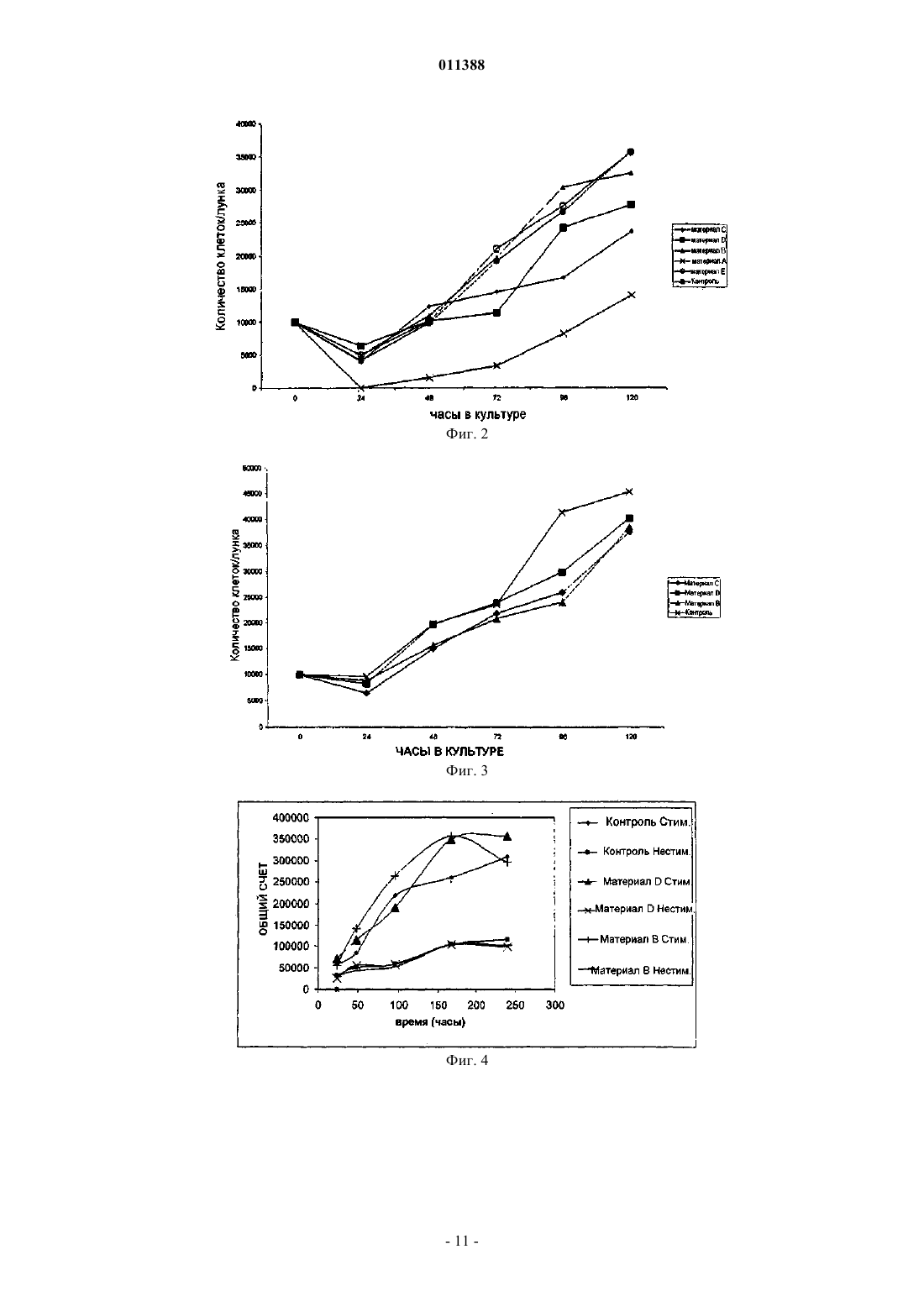
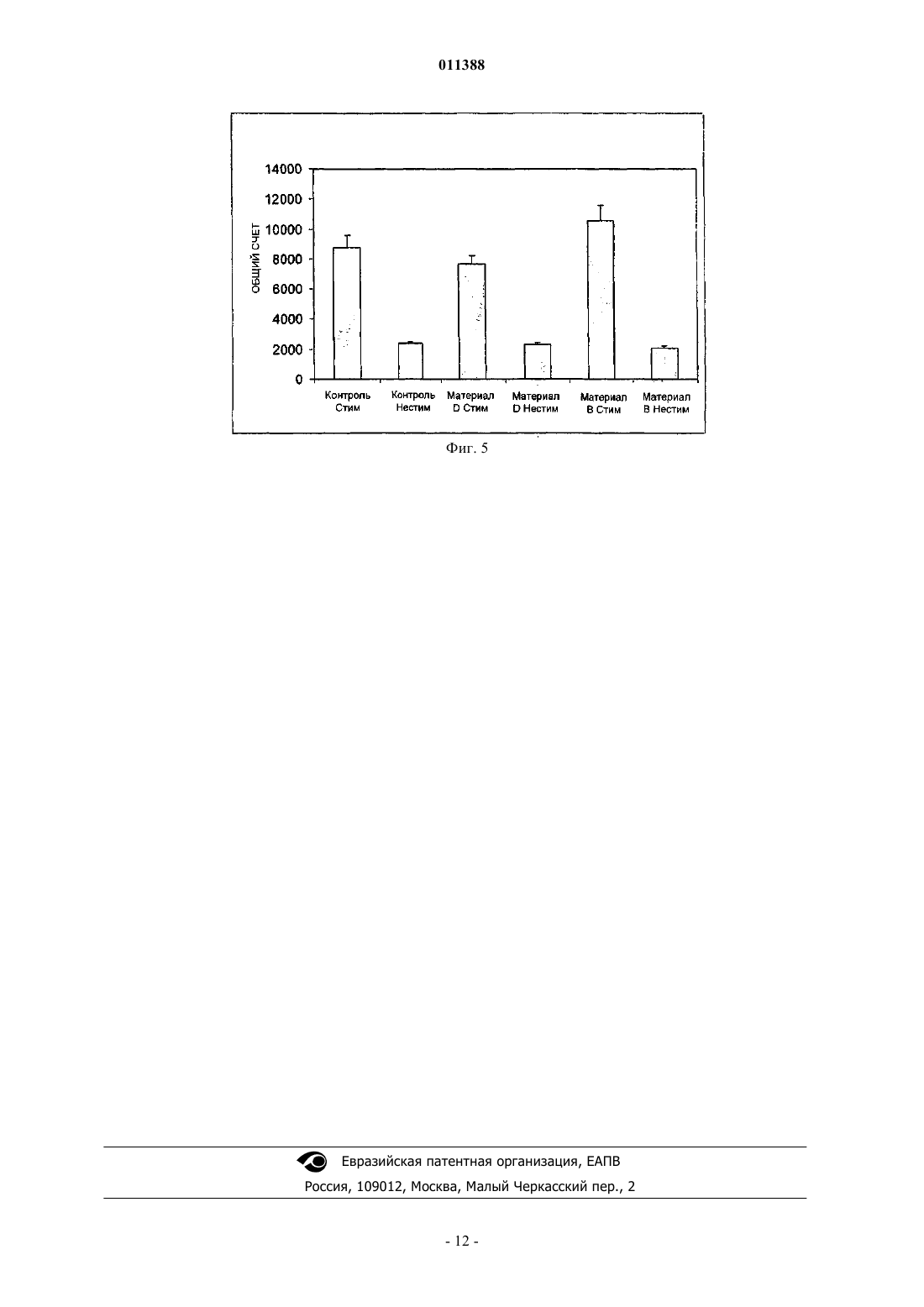
011388 Область применения Изобретение относится к продуктам, содержащим кератин, которые используют при уходе за ранами. Предпосылки создания изобретения Раны и повреждения могут быть вызваны множеством ситуаций, включая оперативное вмешательство, травматическое повреждение, ожоги, ссадины и пересадку кожи. Лечение ран может оказаться трудным и может привести к таким проблемам как язвы и сепсис. Особую проблему представляют долго не заживающие раны, такие как пролежни и диабетические язвы. Лечение таких состояний имеет возрастающее значение при старении населения. Обычный каскад биохимических процессов, который имеет место при лечении раны, включая гемостаз и воспаление, образование грануляционной ткани и реэпителизацию, и ремоделирование, разрушен в случае долго не заживающей раны, частично вследствие пролонгированной воспалительной реакции, которая имеет место, и высвобождения деструктивных ферментов воспалительными клетками. В течение некоторого времени замечали, что поддержание влажных окружающих условий может улучшить скорость заживления раны. Было разработано много продуктов, которые обеспечивают такие окружающие условия, для того чтобы увеличить скорость заживления долго не заживающей раны. Вещества, используемые в этих перевязочных средствах, являются до некоторой степени биосовместимыми и включают в себя полимер молочной кислоты, хитин, производные альгината и коллаген. Ответная реакция этих веществ на раневые экссудаты и биохимические окружающие условия, которые эти вещества обеспечивают, являются основой их действия на рану. Коммерчески доступные перевязочные вещества включают в себя разнообразные синтетические материалы, такие как силиконовые соединения, найлоновые ткани или марли с вазелином и тому подобное [A. J. Platt, A. Phipps and K. Judkins, A comparative study of silicone net dressing and paraffin gauze dressing in skin-grafted sites, Burns, 22(7), 1996, p. 543-545; Claudia Valenta and Barbara G. Auner, The use ofpolymers for dermal and transdermal delivery, European Journal of Pharmaceutics and Biopharmaceutics, 58(2),2004, p. 279-289]. В то время как эти традиционные перевязочные материалы для ран являются недорогими и легкодоступными, они, как правило, имеют слабое сродство к раневой поверхности, недостаточную паропроницаемость и в, конечном счете, неудовлетворительны при долго не заживающих ранах,требующих длительных сроков лечения. [Marcel F. Jonkman, Izaak Molenaar, Paul Nieuwenhuis, Peter Bruinand Albert J. Pennings, New method to assess the water vapour permeance of wound coverings, Biomaterials,9(3), 1988, p. 263-267]. Высокоэффективные перевязочные материалы для ран часто получают из природных веществ, обладающих свойствами, аналогичными свойствам кожи пациентов. Перевязочные материалы для ран могут быть разработаны с использованием природных веществ или комбинаций синтетических или природных веществ (JP 47470/1988; Jen Ming Yang and Hao Tzu Lin,Properties of chitosan containing PP-g-AA-g-NIPAAm bigraft nonwoven fabric for wound dressing. Journal ofMembrane Science, 243(1-2), 2004, p. 1-7). Использование перевязочных материалов для ран является чрезвычайно важной частью обработки ран и существенно для получения успешных результатов леченияwounds: pathogenesis-guided management, The American Journal of Surgery, 188(1), 2004, p. 31-35]. Оптимальный перевязочный материал для ран защищает травмированную ткань, поддерживает влажное окружение раны, водопроницаем, контролирует микрофлору раны, подает лечебные агенты в область раны,легок для нанесения, не требует частых перемен, не токсичен и не является антигенным. В настоящее время коммерчески доступными являются несколько видов перевязочных материалов для ран, включая перевязочные материалы, герметически закрывающие рану, не прилипающие перевязочные материалы, впитывающие перевязочные материалы и перевязочные материалы в виде слоев, пен,порошков и гелей. Были сделаны попытки получить улучшенные перевязочные материалы, которые способствуют процессу заживления раны, в частности для лечения долго не заживающих ран, посредством использования биологических материалов, таких как клеточные и ростовые факторы. До настоящего времени эти биологические вещества оказываются очень дорогостоящими в силу таких факторов, как способы получения и свойства хранения и стабильности и, к тому же, они обнаруживают минимальную клиническую пригодность при ускорении процесса заживления долго не заживающей раны. Прежде всего, эффективная обработка ран требует понимания процесса заживления ткани и знания свойств перевязочных материалов для ран. Только в случае, когда оба этих фактора рассматривают совместно, может быть осуществлен рациональный и осмысленный способ выбора перевязочного материала. Белки кератина присутствуют в широком диапазоне биологических тканей, играя роль в формировании структуры кожи, волос и других материалов. Было показано, что кератины, экстрагируемые из волос, являются ценным компонентом перевязочных материалов для ран. В US 5932552 описан биосовместимый кератиновый материал, получаемый или посредством восстановления, или посредством окисления, для использования в качестве компонента продуктов ухода за ранами. Эти способы, относящиеся к области окисления кератинов с целью получения полярной группы, являются грубыми и приводят к деградации кератина, вызывая разрушение белка и потерю существенных физических характеристик, являющихся следствием состава белковых аминокислот и третичной структуры. Кроме того, про-1 011388 цессы окисления, использованные при получении этих материалов, являются необратимыми; и образованные группы цистеиновой кислоты не могут быть превращены обратно в цистин для осуществления полезной структурной функции. Те способы, которые относятся к восстановительному методу получения растворимых протеинов, проводят в строго щелочных условиях, которые также вызывают разрушение белка и потерю существенных физических характеристик белков кератина. Центральные компоненты кератиновых волокон, в частности белки промежуточных филаментов и белки матриксов, присутствующие в шерсти и волосах, играют исключительную роль внутри волокна,которая отражена в их третичной структуре и аминокислотном составе. Те же самые свойства могут быть использованы для того, чтобы разработать материалы с полезными физическими свойствами и высокими абсорбирующими способностями, если использовать очищенные формы этих белков. Для этого, способы, используемые для изоляции кератинов, должны быть мягкими, чтобы препятствовать разрушению белка, создать обратимые модификации цистина, для того чтобы иметь возможность реконструировать прочные материалы через создание цистиновых связей и облегчить изоляцию специфических фракций белка кератина из источника кератина. Настоящее изобретение относится к новым материалам для использования в качестве продуктов ухода за ранами, которые получают в соответствии с этими принципами. Цель изобретения Целью настоящего изобретения является получение продуктов ухода за ранами, в которых используют фракцию белка кератина. Дополнительной целью изобретения является получение фракции белка кератина, которая является интактной и S-сульфированной, для использования при уходе за ранами или,по крайней мере, предложить обществу подходящий выбор. Сущность изобретения Изобретение относится к материалу для лечения ран, содержащему фракцию белка кератина, в котором белковая фракция является интактной. Изобретение также относится к материалу для лечения ран, содержащему фракцию белка кератина,в котором фракция белка относится к семейству белков промежуточных филаментов. Изобретение также относится к материалу для лечения ран, содержащему фракцию белка кератина, в которой фракция белка относится к семейству белков с высоким содержанием серы. Изобретение также относится к материалу для лечения ран, содержащему фракцию белка кератина,в которой фракция белка является S-сульфированной. Белковая фракция может быть гидролизована. Белок предпочтительно является S-сульфированным. Белок может относиться к семейству белков с высоким содержанием серы. Белок может представлять собой белок промежуточных филаментов. Материал предпочтительно представляет собой волокно, пленку, пену или гидрогель. Изобретение также относится к способу получения материала для лечения ран, включающему в себяb) смешивание белка кератина с водорастворимым полимером до образования однородной смеси;d) замораживание и распарку, следующие друг за другом, для получения гидрогеля. Физико-механические свойства биоматериалов могут быть улучшены введением агентов сшивания для образования дисульфидных связей и, таким образом, удаления сульфонатных функциональных групп). Агент сшивания, используемый как восстановитель, может быть тиолом или тиогликолятом. К физико-механическим свойствам может относиться прочность во влажном и сухом состояниях. Тиогликолят может представлять собой раствор тиогликолята аммония. Водорастворимым полимером может быть поливиниловый спирт, поливинилпирролидон, полиэтиленгликоль или тому подобное. Изобретение также относится к способу улучшения свойства прочности во влажном состоянии продуктов ухода за ранами, получаемых способом по изобретению, путем введения в них агента сшивания. Агентом сшивания предпочтительно является альдегид. Агент сшивания может быть выбран из группы, состоящей из формальдегида, глиоксаля, глутарового альдегида и тому подобного. Краткое описание чертежей Изобретение описано на примерах с опорой на нижеследующие конкретные варианты осуществления. На фиг. 1: показана ответная реакция ран, обработанных кератином и другими веществами; на фиг. 2 - пролиферация фибробластов овцы на кератиновых материалах; на фиг. 3 - пролиферация человеческих фибробластов на кератиновых материалах; на фиг. 4 - влияние стимуляции Con(А) (конканавалином А) на рост Т-клетки в присутствии кератиновых матриксов; и на фиг. 5 - влияние Con(А) стимуляции на-2 011388 рост Т-клетки в присутствии кератиновых матриксов после 72 ч. Подробное описание изобретения Твердые белки альфа-кератина, такие как получаемые из волос человека, шерсти, волокон животного происхождения, рогов, копыт или из других источников у млекопитающих могут быть классифицированы по отдельным компонентам, в соответствии с их биохимическими свойствами, в частности молекулярной массой и аминокислотным составом. Табл. 1 иллюстрирует аминокислотный состав, определенный с помощью обычных методов анализа типичных фракций белка кератина, известных в данной области и являющихся объектом данного изобретения. Сюда входит кислотный гидролиз анализируемой пробы, которая превращает весь цистин и лабильные производные цистина в цистеин, обычно регистрируемый по полураспаду цистина. Таблица 1 Табл. 1: аминокислотный состав кератиновых фракций: белка промежуточных филаментов Sсульфированного кератина (SIFP), белка S-сульфированного кератина с высоким содержанием серы(SHSP), S-сульфированного пептида кератина (SPEP), который используют в изобретении. Белок промежуточных филаментов (IFP), белок с высоким содержанием серы (HSP) и цельная шерсть любезно предоставлены Gillespie and Marshall, Variability in the proteins of wool and hair, Proc. Sixth Int. Wool Text, Res.Conf., Pretoria, 2, 67-77, 1980). Все остатки выражены в мол.%: S-сульфоцистеин, цистин и цистеин определяют после восстановления и алкилирования как S-карбоксиметилцистеин и в отчете представляют как цис. В табл. 2 приведена молекулярная масса, определенная с помощью обычных методов анализа типичных фракций белка кератина, известных в данной области, и также являющихся объектом данного изобретения. Обычный анализ включает в себя разрыв цистиновых связей внутри кератина при восстановлении, так что белковую массу определяют в естественном состоянии, при отсутствии поперечных связей, наиболее сходном с некератинизированным состоянием белка. Массу определяют, используя электрофорез в геле полиакриламида. В случае пептида SPEP массу определяют с помощью массспектрометрии. При использовании этих методов кератин делают растворимым без какого-либо гидролиза пептидных связей и производят точное измерение молекулярной массы. Таблица 2-3 011388 Табл. 2: молекулярная масса кератиновых фракций: белка промежуточных филаментов Sсульфированного кератина (SIFP), белка S-сульфированного кератина с высоким содержанием серы(SHSP), пептида S-сульфированного кератина (SPEP), который используют в изобретении. Белок промежуточных филаментов (IFP) и белок с высоким содержанием серы (HSP) любезно предоставлены Gillespie and Marshall, Variability in the proteins of wool and hair, Proc. Sixth Int. Wool Text, Res. Conf., Pretoria, 2,67-77, 1980.) Как аминокислотный состав, так и молекулярная масса варьируют незначительно между типами кератина, между разновидностями, а также внутри пород одного вида, например между шерстью овец различных пород. Цифры, приводимые в табл. 1 и 2, являются показательными для заданного источника кератина. Однако отдельные типы белков кератина или фракции белка кератина имеют отличительные характеристики, в частности молекулярную массу и аминокислотный состав. Объектом изобретения являются материалы, содержащие интактные фракции белка Sсульфированного кератина. Термин "интактные" относится к белкам, которые, по существу, не являются гидролизованными, если понятие гидролиз определять как разрыв связей посредством добавления воды. Gillespie (Biochemistry and physiology of the skin, vol 1, Ed. Goldsmith Oxford University Press, London,1983, pp475-510) полагает, что термин "интактные" относится к белкам в кератинизированном полимерном состоянии и, кроме того, относится к полипептидным субъединицам, которые собирают в одно целое, чтобы образовать интактные кератины шерсти и волос. Для целей изобретения термин "интактные" относят к полипептидным субъединицам, описанным Gillespie. Они эквивалентны белкам кератина в их естественном виде без поперечных дисульфидных связей, которые образуются в процессе кератинизации. Фракции белка кератина представляют собой отдельные группы, относящиеся к семейству белков кератина, таких как белки промежуточных филаментов, белки с высоким содержанием серы или белки с высоким содержанием глицин-тирозина, хорошо известные в данной области. Белки промежуточных филаментов описаны подробно Orwin et al Structure and Biochemistry of Mammalian Hard Keratin, Electron Microscopy Reviews, 4, 47,1991) и также отнесены к белкам с низким содержанием серы Gilliespie(Biochemistry and physiology of the skin, vol 1, Ed. Goldsmith Oxford University Press, London, 1983, pp475510). Ключевыми характеристиками этого семейства белков являются молекулярная масса, которая находится в интервале 40-60 kD, и содержание цистеина (измеряемое по полураспаду цистина), составляющее приблизительно 4%. Семейство белков, с высоким содержанием серы, также полностью в тех же публикациях описано Orwin и Gillespie. Это семейство белков имеет большую степень гетерогенности,но может быть охарактеризовано тем, что имеет молекулярную массу в интервале 10-30 kD, а содержание цистеина составляет более чем 10%. Субпопуляцию этого семейства представляют белки со сверхвысоким содержанием серы, которые могут содержать цистеин до 34%. Семейство белков с высоким содержанием глицин-триозина также подробно описано Orwin и Gillespie в тех же самых публикациях. Это семейство также определяют как белки с высоким содержанием тирозина, и его отличают такие характеристики, как молекулярная масса, меньшая чем 10 kD, содержание тирозина, обычно превышающее 10%, и содержание глицина, обычно превышающее 20%. Для целей изобретения "фракцию белка кератина" очищают от кератина, который преимущественно, хотя и не полностью содержит одну определенную белковую группу, которая была описана выше. В соответствии с изобретением, S-сульфированные кератины содержат цистеин/цистин, которые преимущественно присутствуют в виде S-сульфоцистеина, обычно известного как соль Бунте. Эта высокополярная группа сообщает белкам значительную растворимость. Будучи устойчивой в растворе, Sсульфогруппа является лабильным производным цистеина, чрезвычайно реактивным по отношению к тиолам, таким как цистеин, и другим восстановителям. Взаимодействие с восстановителями приводит к превращению S-сульфоцистеиновой группы обратно в цистеин. S-сульфоцистеин химически отличается от цистеиновой кислоты, хотя обе группы содержат SO3 группу. Цистеиновую кислоту необратимо получают окислением цистеина или цистина, и, однажды образованная, она не способна снова образовывать дисульфидные поперечные связи с цистеином. S-сульфоцистеин является реакционноспособным по отношению к цистеину и легко образует дисульфидные поперечные связи.SIFP может быть получен способами, аналогичными тем, которые были описаны в WO03011894. Перспективы и другие детали изобретения будут описаны более подробно. Было показано, что высоко S-сульфированные кератины могут образовывать разнообразные матриксы, включая пористые губки, пленки и волокна, при использовании способов, которые отмечены вNZ/PCT/00169 (который введен в настоящее описание). Очищенные белки промежуточных филаментов кератина шерсти являются, в частности, весьма пригодными для преобразования в матриксы, частично благодаря их высокой молекулярной массе и третичной структуре. В способах, отмеченных в NZ/PCT/00169, осуществляют обширное использование этих материалов для образования пригодных матриксов.S-сульфокератины могут быть получены множеством способов, включая способы, которые отмечены в PCT/NZ02/00125 (который введен в настоящее описание). Матриксы из пористой губки используют, главным образом, в раневом окружении, так как они мо-4 011388 гут играть существенную роль в поглощении раневого экссудата, поддерживая здоровое окружение при заживлении раны. В дополнение, они могут функционировать как среда подачи других лечебных средств, таких как факторы роста, антибактериальные агенты или культуральные клетки, которые стимулируют процесс лечения. Эти свойства усиливают при использовании фракций S-сульфированного белка кератина для конструирования матриксов. Высокополярная природа S-сульфогруппы придает матриксам, получаемым из этого материала, высокие абсорбирующие способности. В добавление, Sсульфированные кератины являются биосовместимыми и не вызывают неблагоприятную ответную реакцию in vitro. Пленки являются важным компонентом перевязочных материалов для лечения ран, обеспечивая защищающий рану барьер и поддерживая соответствующее раневое окружение, для того чтобы способствовать заживлению. Пленки S-сульфированных кератинов являются биосовместимыми и не вызывают неблагоприятную ответную реакцию in vitro. Как таковые, они являются пригодными компонентами перевязочных материалов для ран. Волокна, воспроизводимые из белков промежуточных филаментов S-сульфированного кератина,могут быть использованы в качестве компонента перевязочных материалов для ран. Волокна являются чрезвычайно гибкими, так, они могут быть оформлены в переплетенные или непереплетенные структуры, и конструкция волокон может служить в качестве надежного контроля химии материала для влияния на взаимодействие перевязочных материалов с раной. Много работы было вложено в использование регенерированных волокон для ухода за ранами, в частности волокон альгината. Регенерированные кератиновые волокна, полученные из S-сульфированных белков промежуточных филаментов, являются новым материалом для использования при таких применениях. Гидрогели часто используют в перевязочных материалах для ран; они играют существенную роль при регулировании условий раневого окружения и обеспечивают подходящую среду для подачи активных веществ, способствующих заживлению или стимулирующих заживление. S-сульфированные кератины, в частности белок промежуточных филаментов S-сульфированного интактного кератина, являются отличным субстратом для образования гидрогелей вследствие высокой степени упорядоченности и межмолекулярного взаимодействия, достигаемых как следствие интактной природы белков. Кератиновые материалы, получаемые из белковых фракций SIFP и SHSP, содержат различные количества высокополярной S-сульфогруппы и, следовательно, различны по своим физико-химическим характеристикам, в частности по своей способности поглощать влагу. Перевязочные материалы для ран,получаемые из комбинации этих веществ, поглощают влагу в большей или меньшей степени; и, таким образом, может быть отрегулирована степень, с которой они будут поглощать раневые экссудаты. Белки S-сульфированного кератина, получаемого в виде спрея или порошков, высушенных вымораживанием, являются материалами с высокими абсорбирующими способностями и являются ценным компонентом перевязочных материалов для ран, в частности для использования в перевязочных материалах типа гидрогелей, в которых производные альгинатов или коллагена являются продуктами, часто используемыми, и в настоящее время доступными. Комбинация белков SIFP и SHSP ведет к существенному контролю абсорбирующей способности порошка, а природа образованного геля, вследствие варьирования количества S-сульфогрупп, присутствующих в каждой белковой фракции, - к контролю спектральной поглощательной способности. Вследствие интактной природы белков и растворимости материала в воде из-за присутствия полярной S-сульфонатной группы, фракции белка S-сульфированного кератина, в частности фракция белка промежуточных филаментов кератина, могут легко образовывать разнообразные матриксы, а физические свойства этих матриксов являются такими, что они могут обеспечивать физически полезное влияние на раневое окружение. Более того, после преобразования в пленки, волокна или губки материалы могут быть химически обработаны для удаления S-сульфонатных функциональных групп и образования в материале дисульфидных поперечных связей, аналогичных тем, которые присутствуют в природном кератине. Способы такой обработки описаны в NZ/PCT/00169. Обработанные таким образом кератиновые матриксы обладают меньшими абсорбирующими свойствами и сохраняют свою структуру в раневом окружении. Они хорошо подходят для подачи биоактивных веществ, таких как антибактериальные агенты, факторы роста, лечение антибиотиками, культивируемые клетки и другие лекарственные средства, к участку раны. Физические и механические свойства перевязочных материалов для ран или лечебных мембран могут быть легко усовершенствованы множеством способов. Один способ включает в себя обработку в течение 1 ч восстанавливающими реагентами, такими как раствор тиогликолята аммония с рН=7,0, для того чтобы удалить сульфонатные функциональные группы из S-сульфонаткератина и ввести в качестве сшивающих агентов цистиндисульфиды. Это вызывает значительное улучшение механических свойств мембранных материалов, в частности прочности в мокром состоянии. Химическое превращение подтверждают, используя инфракрасную спектроскопию с Фурье-преобразованием, так как S-сульфонатная группа дает сильное и резкое поглощение у 1022 см-1, которое исчезает при воздействии на Sсульфированный образец описанных реагентов. Способ улучшения физической и механической прочности биоматериалов кератинового гидрогеля-5 011388 заключается в увеличении сети водородных связей между цепями белка кератина или между белком кератином и другими полимерами, такими как поливиниловый спирт и поливинилпирролидон. Это может быть достигнуто при использовании процесса замораживания-распарки во время конструирования слоев гидрогеля. Что подтверждает рост нерастворимости гидрогелей, получаемых при использовании этого способа. Получение химически сшитого биоматериала гидрогеля представляет собой еще один вариант осуществления изобретения. Улучшение таких физических свойств как нерастворимость и прочность в состояниях набухания могут быть достигнуты путем использования химических сшивающих агентов, таких как глутаровый альдегид, что позволяет образовывать химические поперечные связи между цепями белка кератина. Кроме того, физические свойства мембран и гидрогелей на основе кератина могут быть улучшены с помощью обычных способов поперечного сшивания белков, включая использование обычных химических агентов сшивания, таких как глутаровый альдегид, формальдегид, карбодиимиды, например, 1 этил-3-(диметиламинопропил)карбодиимид, 2,5-гександион, диимидаты, например диметилсуберимидат,или бисакриламиды, например N,N'-метиленбисакриламид. Тестирование in vitro Биологическую ответную реакцию на материалы, описанные выше, определяли in vitro по росту клеток при заживлении раны и иммунногенному ответу фибробластов и лимфоцитов, соответственно. Таблица 3 Табл. 3: креатиновые материалы, тестированные in vitro. Фибробласты овцы Фиг. 2 представляет собой диаграмму, показывающую влияние различных кератиновых матриксов на пролиферацию клеток овечьих дермальных фибробластов по сравнению с пролиферацией клеток в среде (контроль). Параллельные образцы при n=3 использовали для каждой временной точки. Кинетика пролиферации овечьих фибробластов на большинстве кератиновых матриксов является сходной. Лунки вначале засевали -10000 клеток (0 часов). В течение первых 24 ч после посева культура претерпевает латентный период, что подтверждается уменьшением количества клеток. Это явление идентифицировали во всех выполненных опытах и снижение наблюдали в контрольных лунках, в дополнение к лункам, содержащим тестируемый материал. Дополнительный эксперимент с более коротким временем показал, что латентный период продолжается меньше 12 ч (данные не показаны) и что фаза экспоненциального роста начинается в этой точке. Удвоение популяции происходит каждые 24-48 ч, образуя субмонослой (приблизительно 80% монослоя), обозначая конец логарифмического роста. Это соответствует окончанию времени эксперимента (5 дней или 120 ч). При увеличении времени эксперимента обнаруживали, что вскоре после этого количество растущих клеток достигает плато, образуя полностью монослойную (конфлюентную) культуру. Контактное торможение и истощение питательных веществ играют ключевую роль в ограничении скорости роста в этот момент, и в монослойной культуре появляются признаки гибели клеток (то есть потеря целостности мембраны, уменьшение количества клеток, вакуолизация отдельных клеток). Такую кинетику наблюдают у фибробластов овцы на большинстве биополимерных субстратов, в частности, образцах пленок и губок. В отношении отдельных типов матриксов были сделаны нижеследующие наблюдения: Пленки. Пленки с дисульфидной химической конфигурацией наиболее удовлетворительно поддерживают рост фибробластов овцы (материал D). Вторая конфигурация соли S-сульфоната натрия, характерная для пленочного материала С, поддерживает клеточный рост в меньшей степени и имеет тенденцию набухать в культуре. Клетки на этих пленках характеризовались типичной для фибробластов мульти- или биполярной удлиненной морфологией с хорошим распластыванием. Губка. Материал В, представляющий собой пористый материал губок для роста фибробластов (дисульфидная конфигурация), сопоставим с некоторыми из лучших пленок. Во время опыта клетки прикреплялись к верхней поверхности губки. При использовании световой микроскопии морфология этих клеток-6 011388 была сходной на всех субстратах, сравниваемых с внематриксным контролем. Под микроскопом наблюдали как клетки просачивались в вещество губки. Порошок. Подборка разведений порошка кератина представлена на диаграмме как материал Е. Этот результат представляет кривую наблюдаемого роста для концентрации 2 мг/мл-1. Растворы с более высокими концентрациями, чем указанная концентрация, приведены на той же кривой. При более низких концентрациях скорость пролиферации несколько превышала контроль. Информация, полученная из тестов, предполагает, что для фибробластов овцы порошок кератина при значительной концентрации сам может быть митогенным. Человеческие фибробласты На фиг. 3 представлена диаграмма, показывающая влияние различных кератиновых матриксов на пролиферацию клеток человеческих дермальных фибробластов по сравнению с клетками, растущими в контрольной среде. Данные по человеческим фибробластам для соответствующих субстратов кератина в той или иной степени аналогичны данным для линии клеток овцы. Снова типичная кривая роста устанавливалась на протяжении 120-часового периода, однако 100% монослой был получен в контроле к концу этого периода. Через 120 ч в культурах, выращенных в присутствии большинства тестовых материалов, 83-89% клеток достигали монослоя. Лимфоциты овцы На фиг. 4 показано влияние ConA стимуляции на Т-клетки, выращенные в присутствии/отсутствии кератиновых матриксов на протяжении 10 дней. Используя серию эталонов, счет тритированного тимидина был преобразован в количество клеток в лунке для каждой обработанной группы. Результаты анализа предполагают: 1. В течение 240 ч. эксперимента отмечают заметную разницу в количестве клеток между ConA стимулированными и неактивированными клетками Т-лимфоцитов овцы. В контроле (выращенном в отсутствии кератиновых биополимеров) отмечают 6-кратную разницу в количестве клеток, между нестимулированными и стимулированными клетками через 240 ч. Клетки, выращенные в отсутствии ConA,достигали на 10 день плотности 50000 клетки/лунка, тогда как контрольные клетки с добавлением ConA в той же временной точке превышали 300000 клетки/лунка. Такие высокие плотности были достижимы,так как клетки растили в суспензионной культуре, поэтому лимитирующими факторами были снижение питательных веществ и отсутствие ограничений, налагаемых размером поверхности субстрата. 2. Наблюдали незначительную разницу в скоростях пролиферации клеток образца (матрикс присутствует) и в контрольных лунках (матрикс отсутствует). Этот эффект наблюдали как для стимулированных клеток, так и для нестимулированных клеток. Другими словами:(a) нестимулированные клетки, выращенные в присутствии матриксов, пролиферировали в той же степени как клетки, выращенные исключительно в культуральных лунках сравнения. Это указывает на то, что, хотя кератиновые биоматериалы не являются неиммуногенными, они являются антигенно инертными. Если бы они были неиммуногенными, то можно было бы ожидать отсутствие пролиферации у лимфоцитов, подвергшихся воздействию биоматериала. Если он действительно инертен, то скорости клеточной пролиферации мимикрировали бы скорость пролиферации контрольных культур, что оказывается в данном случае;(b) стимулированные клетки, выращенные в присутствии матриксов, пролиферировали с такой же или чуть большей скоростью, чем в контрольных лунках (которые не содержали кератинового матрикса). Это предполагает, что активированные Т-клетки не ингибируются никаким образом самим матриксом или любыми побочными продуктами его деградации, которые он может образовывать на протяжении этого короткого времени. Неспособность ингибировать активные Т-клетки тестируемыми биоматериалами показывает, что продукт не препятствует нормальному опосредованному клеткой иммунному ответу. На фиг. 5 показано влияние ConA стимуляции на клетки Т-лимфоцитов, выращенные в присутствии различных матриксов, через 72 ч. Общий счет отражает уровень потребления тимидина и включения в ДНК, что затем используют для оценки уровня пролиферации (смотри предыдущую диаграмму). Культивирование в течение 72 ч рассматривают как оптимальное время для сравнения обработок, так как клетки полностью находятся в фазе экспоненциального роста. Результаты представлены в виде диаграммы, состоящей из вертикальных столбцов, где стимулирующие и нестимулирующие обработки располагают рядом друг с другом. Ошибки представлены как средние значения стандартных отклоненийSD для n=3. Счет для нестимулированных лунок (без метки) обнаруживает очень малые вариации с незначительными отклонениями оценок. Счет для стимулированных клеток несколько более вариабелен, хотя t-тест Стьюдента показывает, что только материал С значительно отличается от контроля (р=0,075). Было показано, что непримированные Т-клетки пролиферируют в одинаковой степени в присутствии или отсутствии матриксов. Это показывало, что биоматериалы не только неиммуногенны, но инертны. Ни один тестируемый матрикс не стимулировал нормальный иммунный ответ в степени, превы-7 011388 шающей контроль (лунки, не содержащие матрикса). Активированные Т-клетки, поддерживаемые в культуре с кератиновыми матриксами, пролиферировали нормально с такой же или большей скоростью, чем скорости в контроле (в отсутствии матрикса). Это показывает, что биоматериалы являются биосовместимыми со стимулированными Т-клетками, митогенными в значительной степени и несомненно не препятствуют нормальному иммунному ответу. Отсутствует ингибирование активированных Т-клеток любым матриксом или его побочными продуктами. В заключение, тестированные матриксы не препятствуют иммунному ответу, опосредованному клетками организма, и являются биосовместимыми с клеточной линией Т-лимфоцитов овцы. Экспериментальное исследование in vivo Влияние кератиновых матриксов в условиях раневого окружения определяли на модели животных. Рандомизированное исследование проводили, используя 4 образца для групп крыс с ранами, полученными иссечением. На одну группу приходилось 6 самцов крыс. Две раны (8 мм в диаметре) делали на спине каждой крысы вдоль средней линии. Одну рану использовали как контроль, на нее наносили растворитель или физиологический раствор, а тестовый материал наносили на другую рану. Скорость заживления контролировали с помощью регулярного фотографирования. Раны фотографировали каждый второй день и площадь заживления раны оценивали количественно. Процент (%) изменения в каждой ране определяли для каждой временной точки, и для каждой крысы определяли относительную скорость заживления экспериментальной раны по отношению к контрольной. Затем для каждого момента времени рассчитывали среднюю разницу; подробности приведены в табл. 4. Изучаемыми перевязочными материалами были: KP-U: перевязочный материал для ран, представляющий собой кератиновую мембрану (пример 1), KP-T: перевязочный материал для ран, представляющий собой кератиновую мембрану (пример 3), HG-GL: кератиновый гидрогель (пример 4), HG-O: кератиновый гидрогель (пример 2), HG-C: технически доступный гидрогель как перевязочный материал для ран. В эксперименте использовали двадцать четыре крысы, экспериментальное исследование осуществляли до конечного момента заживления. Результаты, базирующиеся на скорости заживления, могут быть суммированы следующим образом:i) HG-GL: перевязочный материал для ран существенно ускоряет заживление; разница наиболее заметно проявляется на ранних стадиях лечения;ii) КР-Т: перевязочный материал для ран обнаруживает некоторое улучшение в скорости заживления, главным образом, на протяжении первых 3-5 дней. Таблица 4 Табл. 4: площадь, занятая областью раны, после нанесения на рану различных перевязочных материалов. KP-U: кератиновая мембрана как перевязочный материал для ран (пример 1), КР-Т: кератиновая мембрана как перевязочный материал для ран (пример 3), HG-GL: кератиновый гидрогель (пример 4)HG-O: кератиновый гидрогель (пример 2), HG-C: технически доступный продукт гидрогеля в качестве перевязочного материала. Примеры Способы получения различных форм кератина теперь описывают на нижеследующих примерах. Пример 1. Получение кератиновых мембран для использования в продукте ухода за ранами. 10% раствор белка промежуточных филаментов S-сульфированного кератина (SIFP) получали, используя порошок белка промежуточных филаментов S-сульфированного кератина, растворенный в дистиллированной воде, с постепенным добавлением на протяжении 2 ч 1 М NaOH при механическом перемешивании. рН поддерживали в интервале 8,0-9,5 и, в результате, доводили до 8,5. Раствор белка кератина центрифугировали при 27000 g в течение 10 мин, для того чтобы удалить нерастворенные вещества и любые пузырьки воздуха. Полученный раствор белка кератина отливали в чашку Петри и растворители-8 011388 выпаривали в условиях окружающей среды до получения остающейся кератиновой мембраны. Растворитель может включать также некоторый процент смешивающегося с водой растворителя на органической основе, такого как спирт. Пример 2. Получение кератинового гидрогеля для использования в продукте ухода за ранами. 10% Раствор белка промежуточных филаментов S-сульфированного кератина (SIFP) получали таким же образом, как описано в примере 1. Раствор затем перемешивали до получения однородной смеси с водорастворимыми полимерами, такими как поливиниловый спирт (PVA), содержащий 20% твердого вещества, и поливинилпирролидон (PVP), содержащий 10% твердого вещества, чтобы получить оптимальную реологию и оптимальную композицию, то есть SIFP:PVA:PVP = 100:60:40 (мас./мас., %), для получения гидрогеля. Объединенный раствор затем отливали и отверждали посредством цикла замораживания-распарки для получения гидрогеля на основе кератина, что включало замораживание материала в течение 1 ч при -80 С и распаривание в течение 1 ч при 23 С. Для получения гидрогеля этот цикл замораживания-распарки повторяли до 7 раз. Полученный гидрогель промывали дистиллированной водой многократно для удаления любых непрореагировавших полимеров и кератина. Пример 3. Получение поперечно-сшитой кератиновой мембраны для использования в продукте ухода за ранами. Для того чтобы улучшить физическую прочность, а также механические свойства материалов, получаемых таким же образом, как описано в примере 1, мембраны обрабатывали восстановителями, для того чтобы стимулировать образование поперечных связей. Погружение мембраны на 60 мин в 0,25 М раствор тиогликолята аммония при рН 7,0 использовали для удаления сульфонатной группы из Sсульфированного белка кератина (SIFP) и получения возможности образования дисульфидных связей(-S-S-). Полученные мембраны многократно отмывали дистиллированной водой для удаления любых остаточных реагентов. Пример 4. Получение химически поперечно-сшитого кератинового гидрогеля для использования в продукте ухода за ранами. Приведенное ниже получение раствора кератина, PVA и PVP аналогично получению, описанному в примере 2. В смешанный раствор добавляли 0,05-0,1% глутарового альдегида в качестве агента сшивания. Объединенный раствор затем отливали и отверждали посредством цикла замораживанияраспарки для получения гидрогеля на основе кератина, что включало замораживание материала в течение 1 ч при -80 С и распаривание в течение 1 ч при 23 С. Для получения гидрогеля этот цикл замораживания-распарки повторяли до 7 раз. Полученный гидрогель промывали дистиллированной водой многократное число раз для удаления любых непрореагировавших полимеров и кератина, так же как остатков непрореагировавшего глутарового альдегида. Физические исследования показали значительное улучшение их (гидрогелей) способности сохранять размеры или прочность. Эти характеристики также подтверждаются нерастворимостью гидрогелей в водном растворителе, после получения однородной смеси белка кератина и полимеров из водного растворителя (то есть, воды). Пример 5. Получение поперечно-сшитой дисульфидными связями кератиновой мембраны для использования в продукте ухода за ранами. 10% Раствор белка промежуточных филаментов S-сульфированного кератина (SIFP) получали таким же образом, как описано в примере 1. Раствор затем смешивали с 1% от 0,25 М раствора тиогликолята аммония (NH4TG) до получения однородной смеси, где композиции являются такими как:SIFP:NH4TG=99:1 (мас./мас., %). Смешанный раствор затем отливали в чашку Петри, а растворители выпаривали в условиях окружающей среды для получения сшитой дисульфидными связями кератиновой мембраны. Получаемую мембрану многократно промывали дистиллированной водой для удаления любого остаточного NH4TG. Пример 6. Получение поперечно-сшитого дисульфидными связями кератинового гидрогеля для использования в продукте ухода за ранами. 10% Раствор белка промежуточных филаментов S-сульфированного кератина (SIFP) получали таким же образом, как описано в примере 1. Раствор затем смешивали с 1% от 0,25 М раствором тиогликолята аммония (NH4TG) до получения однородной смеси, где композиции соответствовали:SIFP:NH4TG=99:1 (мас./мас.,%). Смешанный раствор затем отливали и отверждали посредством цикла замораживания-распарки для получения сшитого дисульфидными связями кератинового гидрогеля,что включало замораживание материала в течение 1 ч при -80 С и распаривание в течение 1 ч при 23 С. Для получения химически сшитого поперечными связями гидрогеля этот цикл замораживанияраспарки повторяли до 7 раз. Пример 7. Получение не связанного поперечными связями кератинового гидрогеля для использования в продукте ухода за ранами. 10% Раствор белка промежуточных филаментов S-сульфированного кератина (SIFP) получали таким же образом, как описано в примере 1. Раствор отливали и отверждали посредством цикла замораживания-распарки для получения гидрогеля на основе кератина. Что включало замораживание материала в течение 1 ч при -80 С и распаривание в течение 1 ч при 23 С. Для получения гидрогеля белка кератина этот цикл замораживания-распарки повторяли до 7 раз.-9 011388 Промышленная применимость Изобретение может быть использовано в широком ряду продуктов ухода за ранами. Такие продукты будут способствовать лечению и скорости заживления ран, обеспечивая условия биохимического окружения вокруг области раны, что стимулирует заживление. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения материала для лечения ран, включающий в себя:(b) смешивание белка кератина с водорастворимым полимером с образованием однородной смеси;(d) следующие друг за другом процессы замораживания и оттаивания с получением гидрогеля. 2. Способ по п.1, в котором физико-механические свойства биоматериалов улучшают введением агентов сшивания для образования дисульфидных связей и удаления сульфонатных функциональных групп. 3. Способ по п.2, в котором агент сшивания, используемый как восстановитель, представляет собой тиол или тиогликолят. 4. Способ по п.2 или 3, в котором физико-механические свойства представляют собой прочность в мокром и сухом состояниях. 5. Способ по п.3, в котором тиогликолят является раствором тиогликолята аммония. 6. Способ по любому из пп.1-5, в котором белок кератин является S-сульфированным. 7. Способ по любому из пп.1-6, в котором белок кератин является белковой фракцией. 8. Способ по п.7, в котором белковая фракция является интактной. 9. Способ по п.7 или 8, в котором белок кератин относится к семейству белков промежуточных филаментов. 10. Способ по любому из пп.1-9, в котором водорастворимый полимер выбирают из группы, состоящей из поливинилового спирта, поливинилпирролидона, полиэтиленгликоля. 11. Гидрогель для лечения ран, содержащий S-сульфированный кератин в смеси с водорастворимым полимером, обеспечивающим образование водородных связей, и который поперечно сшит с количеством агента для поперечной сшивки белка, достаточным для придания пространственной стабильности. 12. Гидрогель для лечения ран по п.11, в котором S-сульфированный кератин представляет собой белок промежуточных филаментов S-сульфированного кератина, водорастворимый полимер, обеспечивающий образование водородных связей, выбран из группы, состоящей из поливинилового спирта и поливинилпирролидона и их смесей, и агент для поперечной сшивки белка выбран из группы, состоящей из глутаральдегида, формальдегида, карбодиимида, 2,5-гександиона, диимидата, бисакриламида и их смесей. 13. Гидрогель для лечения ран по п.12, в котором агент для поперечной сшивки белка включает глутаральдегид. 14. Гидрогель для лечения ран, содержащий S-сульфированный кератин в смеси с водорастворимым полимером, обеспечивающим образование водородных связей. 15. Гидрогель для лечения ран по п.14, в котором S-сульфированный кератин представляет собой белок промежуточных филаментов S-сульфированного кератина, а водорастворимый полимер, обеспечивающий образование водородных связей, выбран из группы, состоящей из поливинилового спирта и поливинилпирролидона и их смесей.
МПК / Метки
МПК: A61K 38/17, A61L 15/32, A61K 9/70, A61P 17/02, A61K 38/00, A61L 26/00
Метки: ухода, ранами, кератин, продукты, содержащие
Код ссылки
<a href="https://eas.patents.su/13-11388-produkty-dlya-uhoda-za-ranami-soderzhashhie-keratin.html" rel="bookmark" title="База патентов Евразийского Союза">Продукты для ухода за ранами, содержащие кератин</a>
Предыдущий патент: Применение замещённых 2 – аминотетралинов для профилактического лечения болезни паркинсона
Следующий патент: Лекарственное средство
Случайный патент: Производные 7-алкинил-1,8-нафтиридонов, их получение и их применение в терапии