Производные 4-замещённых хинолинов, способ и промежуточные продукты для их получения и содержащие их фармацевтические композиции
Номер патента: 10403
Опубликовано: 29.08.2008
Авторы: Мартэн Жан-Поль, Маллерон Жан-Люк, Эль Амад Юссеф, Биго Антони, Вивьяни Фабрис, Табар Мишель, Миньяни Серж, Ронан Батист, Пантель Ги, Шев Мишель
Формула / Реферат
1. Производное 4-замещенного хинолина, отличающееся тем, что оно отвечает общей формуле (I)
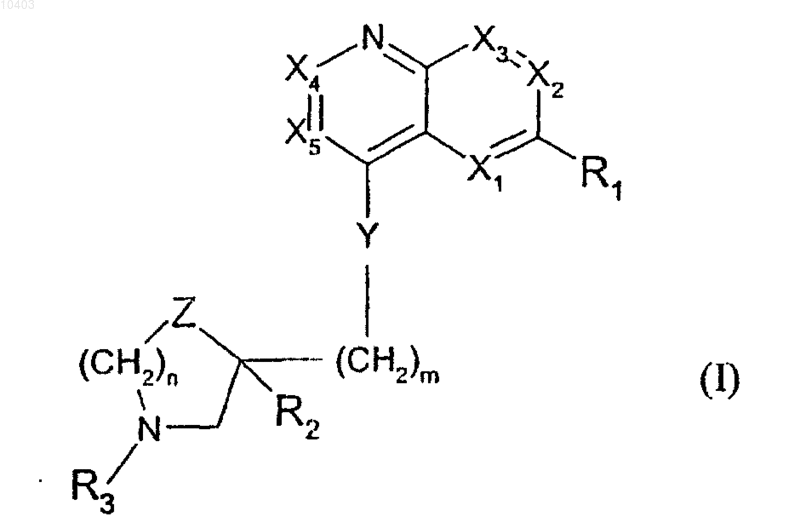
в которой X1, Х2, Х3, X4 и X5 принимают значения, соответственно, от >C-R'1 до >C-R'5;
R1 означает (C1-С10)алкилоксигруппу;
R'1, R'2, R'3 и R'4 означают атом водорода;
R'5 означает атом водорода или галогена;
m равно 2;
n равно 0, 1 или 2;
Y означает группу CHR или CROH, причем R означает атом водорода;
Z означает группу СН2, и в этом случае n равно 0 или 1, или же Z означает атом кислорода, и в этом случае n равно 2;
R2 означает радикал -CO2R, причем R означает атом водорода или (C1-С6)алкил;
R3 означает радикал alk-Rш3, в котором alk означает (C1-С10)алкиленовый радикал и Rш3 означает феноксигруппу, фенилтиогруппу, фениламиногруппу, 5- или 6-членную гетероарилтиогруппу, содержащую в качестве гетероатома S или N; или
Rш3 означает -CR'b=CR'c-R'а, где R'а означает фенил, R'b и R'с означают атомы водорода, или Rш3 означает -CуC-Rd, где Rd означает фенил, причем указанные фенильные радикалы замещены 2-3 атомами галогена;
в его энантиомерных или диастереоизомерных формах, или в виде смесей этих форм, и/или, если возможно, в син- или антиформе, или в виде их смесей, а также его соли.
2. Производное общей формулы (I) по п.1, отличающееся тем, что
X1, X2, Х3, X4 и Х5 имеют указанные в п.1 значения;
R1 означает (C1-С10)алкилоксигруппу;
R'1, R'2 и R'4 означают атом водорода;
R'5 означает атом водорода или галогена,
Y означает радикал CH2, CHOH;
n имеет указанное в п.1 значение;
Z означает группу CH2 и n равно 0 или 1 или Z означает атом кислорода, и в этом случае n равно 2;
R2 означает радикал -CO2R, причем R означает атом водорода или (C1-С6)алкил; и
R3 означает радикал alk-Rш3, в котором alk означает (C1-С10)алкиленовый радикал и Rш3 означает феноксигруппу, фенилтиогруппу, фениламиногруппу, гетероарилтиогруппу, определенную в п.1; или
Rш3 означает -CR'b=CR'c-R'а, где R'a означает фенил и где R'b и R'с означают атомы водорода; или
Rш3 означает -CуC-Rd, где Rd означает фенил,
имея в виду, что вышеуказанные фенильные радикалы возможно замещены, как рассмотрено п.1;
в его энантиомерных или диастереоизомерных формах, или в виде смесей этих форм, и/или, если возможно, в син- или антиформе, или в виде их смесей, а также его соли.
3. Производное общей формулы (I) по п.1, отличающееся тем, что
X1, X2, Х3, X4 и X5 означают, соответственно, от >C-R'1 до >C-R'5;
R1 означает (C1-С10)алкилоксигруппу;
R'1, R'2 и R'4 означают атом водорода;
R'5 означает атом водорода или галогена,
Y означает радикал CH2, CHOH;
n имеет указанное в п.1 значение;
Z означает группу CH2 и n равно 0 или 1, или Z означает атом кислорода, и в этом случае n равно 2;
R2 имеет указанное в п.2 значение; и
R3 означает радикал alk-Rш3, в котором alk означает (C1-С10)алкиленовый радикал и Rш3 означает феноксигруппу, фенилтиогруппу, гетероарилтиогруппу, определенную в п.1; или
Rш3 означает -CR'b=CR'C-R'а, где R' а означает фенил, и где R'b и R'с означают атомы водорода; или
Rш3 означает радикал -CуC-Rd, в котором Rd означает фенил;
имея в виду, что вышеуказанные фенильные радикалы возможно замещены, как рассмотрено в п.1;
в его энантиомерных или диастереоизомерных формах, или в виде смесей этих форм, и/или, если возможно, в син- или антиформе, или в виде их смесей, а также его соли.
4. Производное общей формулы (I) по п.1, выбранное из имеющих следующие названия:
1-[(Е)-3-(2,5-дифторфенил)пропенил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[(E)-3-(2,5-дифторфенил)пропенил]-3-[3-гидрокси(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[2-(2,5-дифторфенилсульфанил)этил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[2-(2,5-дифторфенокси)этил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[2-(2-тиенилтио)этил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[(Е)-3-(2,5-дифторфенил)пропенил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]азетидин-3-карбоновая кислота;
1-[(E)-3-(2,5-дифторфенил)пропенил]-3-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[(E)-3-(2,5-дифторфенил)пропенил]-3-[3-гидрокси(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[2-(2,5-дифторфенилсульфанил)этил]-3-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[2-(тиофен-2-илсульфанил)этил]-3-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота;
1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновая кислота;
3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновая кислота;
1-[3-(2,5-дифторфенил)пропил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновая кислота;
1-[2-[(2,5-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновая кислота;
в его энантиомерных или диастереоизомерных формах, или в виде смесей этих форм, и/или, в случае необходимости, в син- или антиформе, или в виде их смесей, а также его соли.
5. Способ получения производных общей формулы (I), указанной в п.1, отличающийся тем, что цепь R3, определенную в п.1, вводят в реакцию конденсации с производным 4-замещенного хинолина общей формулы (II)
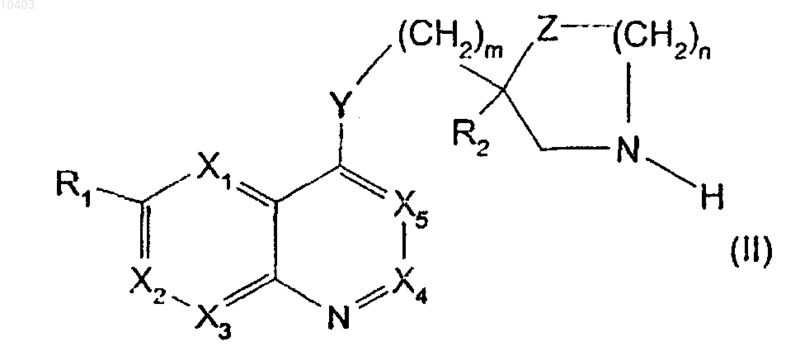
в которой X1, Х2, Х3, Х4, X5, R1, R2, Y, Z, m и n имеют указанные в п.1 значения, причем R2 защищен метилом, бензилом, трет-бутилом, фенилпропилом или пропенилом, когда он содержит карбоксигруппу,
затем, в случае необходимости, удаляют защитную группу от карбоксигруппы, в случае необходимости, разделяют энантиомерные или диастереоизомерные формы и/или, в случае необходимости, син- или антиформы и, в случае необходимости, превращают полученный продукт в соль.
6. Способ по п.5, отличающийся тем, что реакцию конденсации цепи R3 с гетероциклическим атомом азота осуществляют, действуя производным общей формулы (IIa)
R3-X (IIa)
в которой R3 имеет указанное в п.1 значение и X означает атом галогена, метилсульфонил, трифторметилсульфонил или п-толуолсульфонил.
7. Способ по любому из пп.5 и 6, отличающийся тем, что, когда R3 означает радикал -alk-Rш3, в котором alk означрхт (C1-10)алкил и Rш3 означает радикал -CуC-Rd, в котором Rd имеет указанное в п.1 значение, реакцию осуществляют конденсацией алкинилгалогенида формулы HCуC-alk-X, в котором alk имеет вышеуказанное значение и X означает атом галогена, затем замещением цепи соответствующим радикалом Rd.
8. Способ по любому из пп.5 и 6, отличающийся тем, что, когда R3 означает радикал -alk-Rш3, в котором alk означает (C1-10)алкил и Rш3 означает феноксигруппу, фенилтиогруппу, фениламиногруппу или гетероарилтиогруппу, осуществляют реакцию конструированием цепи, конденсируя сначала цепь HO-alk-X, в которой X означает атом галогена, затем либо превращая полученную гидроксиалкильную цепь в галогеналкильную, метансульфонилалкильную или п-толуолсульфонилалкильную цепь, и, наконец, действуя в щелочной среде ароматическим производным структуры Rш3H или Rш3H2, либо прямо действуя ароматическим производным в условиях дегидратации.
9. Способ по п.5, отличающийся тем, что производные общей формулы (II), в которых Y означает группу CHR, получают реакцией конденсации гетероароматического производного общей формулы (III)
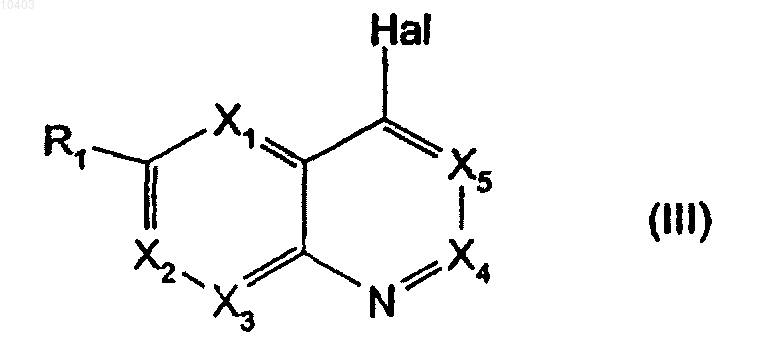
в которой R1, X1, Х2, Х3, X4 и X5 имеют указанные в п.1 значения и Hal означает атом галогена, с производным общей формулы (IV)
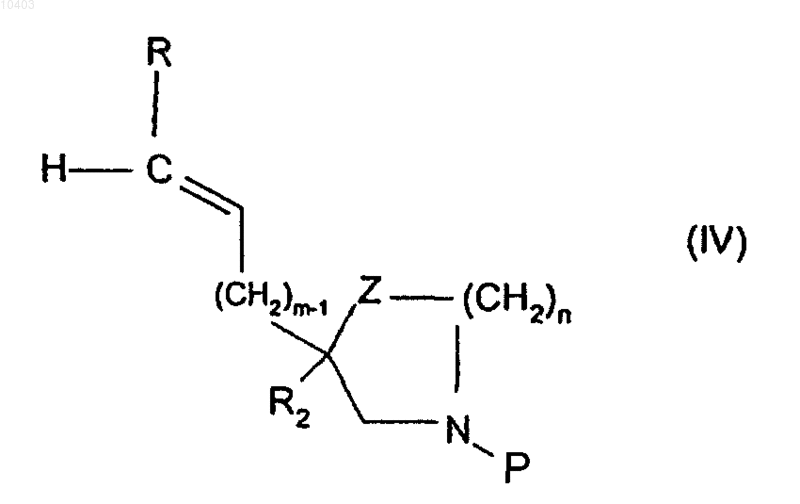
в которой P означает защитную группу, выбираемую из трет-бутоксикарбонила или бензилоксикарбонила, и R, Z, m, n и R2 имеют указанные в п.1 значения, с последующим удалением защитных групп и/или с последующим превращением, путем последующей операции, таким образом полученных заместителей ароматического бицикла общей формулы (II) для получения производного, содержащего ожидаемый радикал R1, R'1, R'2, R'3, R'4, R'5, и, в случае необходимости, с последующим удалением защитного радикала или защитных радикалов, еще имеющихся в молекуле.
10. Способ по п.9, отличающийся тем, что производные общей формулы (IV), в которой R, Z, P, R2 и n имеют указанные в п.9 значенияи m равно 2, получают реакцией конденсации с производным общей формулы (V)
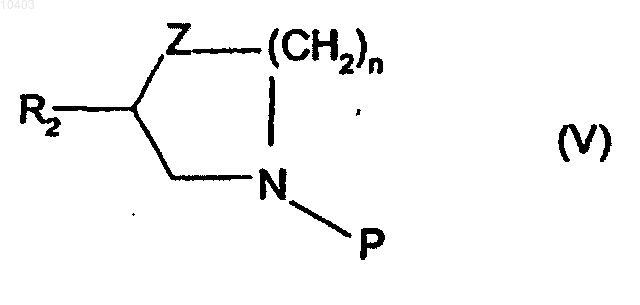
в которой n, Z и R2 имеют указанные в п.1 значения и P имеет указанное в п.10 значение, продукта общей формулы (VI)
Hal-(CH2)m-1-CH=CHR (VI)
в которой Hal означает атом галогена и m и R имеют указанные в п.1 значения.
11. Производные общей формулы (II)
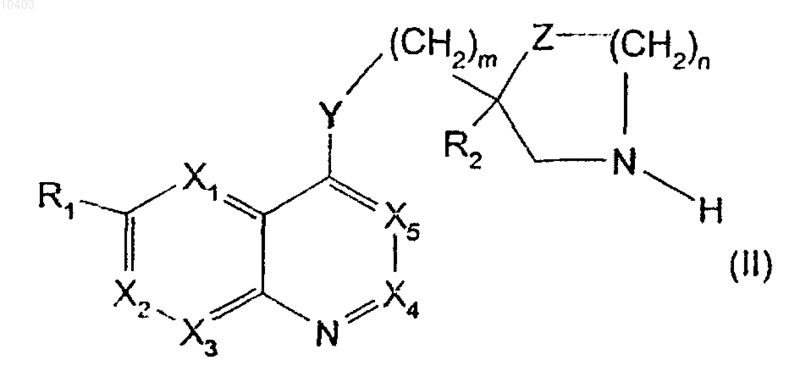
в которой X1, X2, X3, X4, X5, R1, R2, Y, Z, m и n имеют указанные в п.1 значения, причем R2 защищен метилом, бензилом, трет-бутилом, фенилпропилом или пропенилом когда он содержит карбоксигруппу.
12. Производные общей формулы (IV)
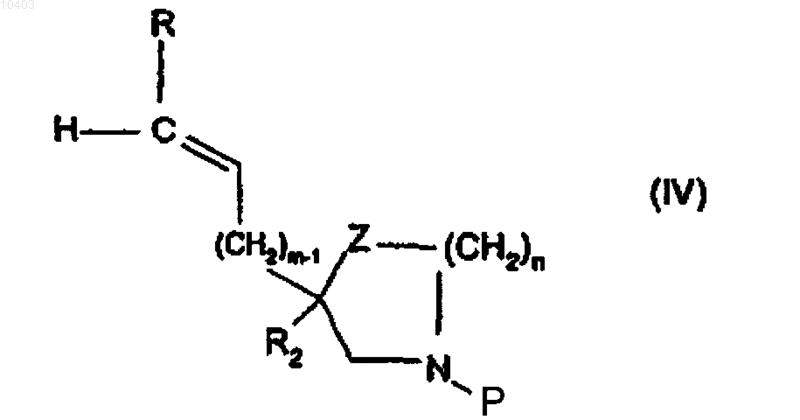
в которой P означает защитную группу, выбираемую из трет-бутоксикарбонила или бензилоксикарбонила;
m равно 2;
n равно 0, 1 или 2;
R означает атом водорода или (C1-С6)алкил;
Z означает группу CH2, и в этом случае n равно 0 или 1, или же Z означает атом кислорода, и в этом случае n равно 2; и
R2 имеет указанные в п.1 значения.
13. Применение производных по любому из пп.1-4 общей формулы (I), такой как указанная в п.1, в качестве лекарственных средств для лечения бактериальных инфекций.
14. Фармацевтическая композиция для лечения бактериальных инфекций, отличающаяся тем, что она содержит по меньшей мере одно производное по п.1, в чистом состоянии или в виде ассоциации с одним или несколькими совместимыми и фармацевтически приемлемыми разбавителями и/или добавками.
Текст
010403 Настоящее изобретение относится к производным 4-замещенных хинолинов общей формулы (I) которые активны в качестве антимикробных средств. Изобретение относится также к способу и промежуточным продуктам для их получения и содержащим их фармацевтическим композициям. В международных заявках на патенты WO 99/37635 и WO 00/43383 описываются антимикробные производные хинолилпропилпиперидина общей формулыR3 находится в положении 2 или 3 и означает (C1-С 6)алкил, который может быть необязательно замещен 1-3 заместителями, выбираемыми из тиола, галогена, алкилтиогруппы, трифторметила, карбоксигруппы, алкилоксикарбонила, алкилкарбонила, алкенилоксикарбонила, алкенилкарбонила, гидроксигруппы, необязательно замещенных алкилом;Z1-Z5 означают N или CR1a. В других заявках, в частности WO 00/21952, WO 00/21948, WO 01/07432, WO 01/07433, WO 03/010138,а также WO 02/40474 или WO 02/072572, описываются другие производные 4-хинолилпропилпиперидинов, замещенные, в частности по положению 3 или дизамещенные по положению 4, активные в той же самой области. В европейской заявке на патент 30044 описываются, кроме того, родственные производные, активные в сердечно-сосудистой области. На сегодняшний день не описано ни одного производного такого рода, пиперидиновый цикл которого модифицирован так, как в производных формулы (I), указанных выше. В настоящее время найдено, и это составляет объект настоящего изобретения, что соединения общей формулы (I), в которойR'3 означает фенил или 5- или 6-членный гетероцикл, который, необязательно, может содержать другой гетероатом, выбираемый из О, S или N;R'5 означает атом водорода или галогена;Z означает группу СН 2, и в этом случае n равно 0 или 1, или же Z означает атом кислорода, и в этом случае n равно 2;R2 означает радикал -CO2R, причем R означает атом водорода или (C1-С 6)алкил;-1 010403 означают атомы водорода; или R3 означает -CC-Rd, где Rd означает фенил, причем указанные фенильные радикалы замещены 2-3 атомами галогена; в их энантиомерных или диастереоизомерных формах или в виде смесей этих форм и/или, если возможно, в син- или антиформе или в виде их смеси, а также их соли являются очень сильнодействующими антибактериальными средствами. Из соединений общей формулы (I) объектом изобретения является, в частности, любое из соединений, имеющих следующие названия: 1-[(E)-3-(2,5-дифторфенил)аллил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота; 1-[(E)-3-(2,5-дифторфенил)аллил]-3-[3-гидрокси(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин 3-карбоновая кислота; 1-[2-(2,5-дифторфенилсульфанил)этил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3 карбоновая кислота; 1-[2-(2,5-дифторфенилокси)этил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота; 1-[2-(тиофен-2-илсульфанил)этил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота; 1-[(Е)-3-(2,5-дифторфенил)аллил]-3-[3-(3-фтор-6-метоксихинолин-4-ил)пропил]азетидин-3-карбоновая кислота; 1-[(E)-3-(2,5-дифторфенил)аллил]-3-[3-гидрокси(3-фтор-6-метоксихинолин-4-ил)пропил]азетидин 3-карбоновая кислота; 1-[(Е)-3-(2,5-дифторфенил)аллил]-3-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота; 1-[(Е)-3-(2,5-дифторфенил)аллил]-3-[3-гидрокси(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин 3-карбоновая кислота; 1-[2-(2,5-дифторфенилсульфанил)этил]-3-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин-3 карбоновая кислота; 1-[2-(2,5-дифторфенилокси)этил]-3-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота; 1-[2-(тиофен-2-илсульфанил)этил]-3-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]пирролидин-3-карбоновая кислота; 1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]3-пирролидинкарбоновая кислота; 3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]3-пирролидинкарбоновая кислота; 1-[3-(2,5-дифторфенил)пропил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновая кислота; 1-[2-[(2,5-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновая кислота; в его энантиомерных или диастереоизомерных формах или в виде смесей этих форм и/или, если возможно, в син- или антиформе или в виде их смеси, а также его соли. Согласно изобретению продукты общей формулы (I) могут быть получены реакцией конденсации цепи R3 с производным 4-замещенного хинолина общей формулы (II) в которой X1, X2, X3, X4, X5, R1, R2, Y, Z, m и n имеют вышеуказанные значения, причем R2 защищен, когда он включает карбоксигруппу,затем, в случае необходимости, удалением защитной группы от карбоксигруппы, в случае необходимости, разделением энантиомерных или диастереоизомерных форм и/или, в случае необходимости,син- или антиформ и, в случае необходимости, превращением полученного продукта в соль. Реакцию конденсации цепи R3 с гетероциклическим атомом азота осуществляют, преимущественно, действуя производным общей формулы (IIa)R3-X (IIa) в которой R3 имеет вышеуказанное значение и X означает атом галогена, метилсульфонил, трифторметилсульфонил или п-толуолсульфонил, в безводной, предпочтительно инертной, среде, в органическом растворителе, таком как амид (например, диметилформамид), кетон (например, ацетон) или нитрил (например, ацетонитрил), в присутствии основания, такого как азотсодержащее органическое основание(например, триэтиламин) или неорганическое основание (например, карбонат щелочного металла, как карбонат калия), при температуре от 20 С до температуры кипения растворителя с обратным холодильником. Атом азота пирролидинового цикла производного общей формулы (II), необязательно, защищен согласно обычным способом, совместимым с остальной частью молекулы или реакцией; защиту осуществляют, например, с помощью защитного радикала, выбираемого из трет-бутоксикарбонила и бензилоксикарбонила, и этот атом азота высвобождают до реакции конденсации с производным формулы (IIa), в частности, кислотным гидролизом. Предпочтительно действуют производным общей формулы (IIa), гдеX означает атом хлора, брома или иода. Условия, в которых може быть осуществлена реакция конденсации между производными общих формул (II) и (IIa), также описываются в международной заявке WO 02/40474. Когда R3 означает радикал -alk-R3, в котором R3 представляет собой группу -CC-Rd, в которой Rd имеет вышеуказанное значение, промежуточно конденсируют алкинилгалогенид формулы HCC-alk-X,затем конденсируют соответствующий радикал Rd с таким образом полученным алкином. Когда R3 означает радикал alk-R3, в котором alk означает алкил и R3 означает феноксигруппу, фенилтиогруппу, фениламиногруппу, гетероарилоксигруппу, гетероарилтиогруппу или гетероариламиногруппу, цепь также можно конструировать, конденсируя сначала цепь HO-alk-X, в которой X означает атом галогена, предпочтительно иода, в условиях, описанных выше для реакции продукта общей формулы (IIa), затем, в случае необходимости, превращая гидроксиалкильную цепь в галогеналкильную, метансульфонилалкильную или п-толуолсульфонилалкильную цепь и, наконец, действуя в щелочной среде ароматическим производным структуры R3H или R3H2. Превращение гидроксилированной цепи в галогеналкильную или п-толуолсульфонильную цепь осуществляют обычными способами галогенирования или сульфонилирования, в частности действием галогенирующего агента, такого как тионилхлорид, галогенсодержащих производных фосфора (например, трихлорид или трибромид фосфора) или сульфонилирующего агента, как, например, метансульфонилхлорида, п-толуолсульфонилхлорида или ангидрида трифторметансульфокислоты. Реакцию проводят в органическом растворителе, таком как хлорсодержащий растворитель (например, дихлорметан или хлороформ), при температуре 0-60 С. В некоторых случаях может оказаться предпочтительным работать в присутствии основания, такого как пиридин или триэтиламин. Взаимодействие ароматического производного R3H или R3H2 преимущественно осуществляют, как описано выше для воздействия производного общей формулы (IIa), в органическом растворителе, таком как амид (например, диметилформамид), кетон (например, ацетон), нитрил (например, ацетонитрил), в присутствии основания, такого как органическое азотсодержащее основание (например, триэтиламин) или неорганическое основание (например, карбонат щелочного металла, как карбонат калия), при температуре от 20 С до температуры кипения реакционной среды с обратным холодильником. Может оказаться предпочтительным работать в присутствии йодида калия. Можно еще работать в простом эфире (как, например, тетрагидрофуран) в условиях дегидратации в присутствии, например, диизопропилкарбодиимида и трифенилфосфина. Разумеется, что если радикалы R3 включают карбоксигруппу или аминогруппу в качестве заместителей, то последние предварительно защищают, затем высвобождают после реакции. Работают в соответствии с хорошо известными специалисту способами, в частности согласно способам, описанным T.W. Greene и P.G.M. Wuts "Protective Groups in Organic Synthesis" (2-е издание), A. Wiley - Interscience Publication(1991), или Mc Omie "Protective Groups in Organic Chemistry", Plenum Press (1973). Защищенный карбоксильный радикал, который включен в R2, может быть выбран из легко гидролизующихся сложных эфиров. В качестве примера можно назвать метиловые, бензиловые, трет-бутиловые сложные эфиры или же фенилпропиловый или аллиловый сложные эфиры. В случае необходимости,защиту карбоксильного радикала осуществляют одновременно с реакцией. В случае необходимости, защиту аминогруппы осуществляют с помощью обычных защитных радикалов, указанных в вышеприведенных ссылках. Введение и удаление этих защитных радикалов осуществляют в соответствии с известными специалисту способами. Согласно изобретению производные общей формулы (I), в которых R2 означает гидроксиметил или гидроксиэтил, могут быть получены действием соответствующего восстановителя на производное, в котором R2 означает карбоксигруппу или карбоксиметил или защищенную карбоксигруппу или защищенный карбоксиметил. Возможно имеющаяся кетогруппа тогда должна быть промежуточно защищена. Также согласно изобретению продукты общей формулы (I), в которой R2 означает карбоксиметил или карбоксиэтил, могут быть также получены из производных, в которых R2 означает гидроксиметил или гидроксиэтил, действием на него галогенирующего или тозилирующего агента, затем цианирующего агента и, наконец, гидролизом нитрила. Восстановление защищенной карбоксигруппы можно осуществлять обычными способами, которые не затрагивают остальной части молекулы, в особенности действием гидрида (например, литийалюминийгидрида или диизобутилалюминийгидрида) в растворителе, таком как простой эфир (например, тет-3 010403 рагидрофуран), при температуре 20-60 С. Возможно присутствующую кетогруппу промежуточно защищают, затем удаляют защиту согласно известным специалисту классическим способам, в частности через циклический или нециклический ацеталь. Восстановление свободной карбоксигруппы может быть осуществлено также хорошо известными специалисту способами, например гидрированием в присутствии катализатора на основе родия или рутения, действием натрийборгидрида в присутствии кислоты Льюиса или литийалюминийгидрида в простом эфире. Предпочтительно в этом случае кетогруппу также промежуточно защищают. Превращение гидроксиметильного или гидроксиэтильного радикала в карбоксиметильный или карбоксиэтильный радикал осуществляют обычными способами, которые не затрагивают остальной части молекулы, в частности действием галогенирующего агента, такого как, например, тионилхлорид, или трихлорид, или трибромид фосфора, или тозилирующего агента, затем цианида щелочного металла, например цианида калия или цианида натрия, для получения соответствующего цианометильного производного с последующим гидролизом нитрила. Галогенирование может быть осуществлено в хлорсодержащем растворителе (как, например, дихлорметан или хлороформ), при температуре от 0 С до температуры кипения растворителя с обратным холодильником. Согласно изобретению продукты общей формулы (II), в которых Y означает группу CHR, получают реакцией конденсации гетероароматического производного общей формулы (III) в которой R1, X1, Х 2, X3, X4 и X5 имеют вышеуказанные значения и Hal означает атом галогена, с производным общей формулы (IV) в которой P означает защитную группу и R, Z, m, n и R2 имеют вышеуказанные значения или R2 означает защищенный радикал, если R2 означает или включает карбоксильную группу, с последующим удалением защитных групп и/или с последующим превращением, путем последующей операции, заместителей таким образом полученного ароматического бицикла общей формулы (II) для получения производного,содержащего ожидаемый радикал R1, R'1, R'2, R'3, R'4, R'5, и, в случае необходимости, с последующим удалением защитного радикала или защитных радикалов, еще имеющихся в молекуле.P может представлять собой любую защитную группу для атома азота, совместимую с реакцией(например, трет-бутилоксикарбонил, бензилоксикарбонил). Защитные группы для карбоксильных групп выбирают среди обычных групп, введение и удаление которых не затрагивают остальной части молекулы, в частности указанных в вышеприведенных ссылках. Реакцию также можно осуществлять, последовательно действуя на производное общей формулы(II) органобораном (как, например, 9-борабицикло[3,3,1]нонан) в растворителе, таком как простой эфир(например, тетрагидрофуран, диоксан), при температуре от -20 до 20 С, затем бициклическим производным общей формулы (III), в котором Hal означает атом хлора или предпочтительно атом брома или иода,по аналогии со способами, описанными Suzuki et al., Pure and Appl. Chem., 57, 1749 (1985). Реакцию осуществляют обычно в присутствии соли палладия (например, дифенилфосфиноферроценпалладий) и основания, такого как фосфат калия, при температуре от 20 С до температуры кипения растворителя с обратным холодильником. Согласно изобретению продукты общей формулы (II), в которых Y означает группу CROH, могут быть получены окислением в щелочной среде соответствующего производного, в котором Y означает группу CHR. Окисление осуществляют действием с кислородом, предпочтительно в инертном растворителе, таком как диметилсульфоксид, в присутствии трет-бутанола и основания, такого как трет-бутилат калия или натрия, при температуре 0-100 С. Производные общей формулы (II), в которых Y означает группу CRF или CF2, могут быть получены фторированием, соответственно, исходя из производного, в котором Y означает группу CROH, и производного, в котором Y означает карбонил. Реакцию осуществляют в присутствии фторида серы (напри-4 010403 мер, в присутствии аминотрифторида серы (как, например, диэтиламинотрифторид серы (Tetrahedron, 44,2875 (1988, бис(2-метоксиэтил)аминотрифторид серы (Deoxofluor), морфолинотрифторид серы) или,альтернативно, в присутствии тетрафторида серы (J. Org. Chem., 40, 3808 (1975. Реакцию фторирования можно еще осуществлять с помощью фторирующего агента, как гексафторпропилдиэтиламин (патент Японии 2039546) или N-(хлор-2-трифтор-1,1,2-этил)диэтиламин. Работают в органическом растворителе, таком как хлорсодержащий растворитель (например, дихлорметан, дихлорэтан, хлороформ), или в простом эфире (например, тетрагидрофуран, диоксан) при температуре от -78 до 40 С (предпочтительно от 0 до 30 С). Предпочтительно работают в инертной среде (в частности, в атмосфере аргона или азота). Производные общей формулы (II), в которых Y означает карбонильную группу, могут быть получены окислением соответствующего производного общей формулы (II), в котором Y означает группуCHOH. Это окисление осуществляют, например, с помощью перманганата калия, в случае необходимости, в растворе гидроксида натрия (например, 3 н. раствор гидроксида натрия) при температуре от -20 до 20 С, или же действуя оксалилхлоридом в присутствии диметилсульфоксида с последующим добавлением амина, такого как триэтиламин, в инертном растворителе, таком как дихлорметан, диметилсульфоксид, при температуре от -60 до 20 С, по аналогии со способом, описанным D. Swern et al., J. Org. Chem.,44, 4148 (1979). Эти производные также могут быть получены реакцией конденсации литийсодержащего производного по положению 4 гетероароматического производного общей формулы (III') в которой R1, X1, Х 2, Х 3, X4 и X5 имеют вышеуказанные значения, с производным общей формулы (IV) в которой P, R2, m и n имеют указанное в случае формулы (IV) значение и alc означает алкил с 1-4 атомами углерода, предпочтительно метил, с последующим удалением защитных групп и/или с последующим превращением, путем последующей операции, заместителей таким образом полученного ароматического бицикла общей формулы (II) для получения производного, содержащего ожидаемый радикал R1,R'1, R'2, R'3, R'4, R'5, и, в случае необходимости, с последующим удалением защитного радикала/защитных радикалов, еще имеющихся в молекуле. Литийсодержащее производное по положению 4 производного формулы (III') получают с помощью сильного литийсодержащего основания, такого как бутиллитий, втор-бутиллитий или предпочтительно диизопропиламид лития, в растворителе, таком как простой эфир, например тетрагидрофуран, при температуре от -78 до -40 С. Реакцию конденсации этого литийсодержащего производного со сложным эфиром формулы (IV) осуществляют в том же растворителе при температуре от -78 до 0 С. Производное формулы (III') может быть получено способом, описанным в международной заявке на патент WO 02/40474. Производное общей формулы (II), в котором Y означает группу CRNH2, может быть получено из соответствующего СНОН-производного, которое превращают в его тозилированное производное, на которое действуют аммиаком. Работают в инертном растворителе, таком как N,N-диметилформамид или диметилсульфоксид, и предпочтительно под давлением (2-20 атм), при температуре от 20 до 100 С. Тозилоксипроизводное получают из продукта общей формулы (II), в котором Y означает CROH,действуя тозилхлоридом в пиридине, при температуре от -10 до 20 С. В международной заявке на патент WO 02/40474 описываются способы получения соединений с различными значениями R1, X1, Х 2, Х 3, Х 4 и Х 5 в производных общих формул (II) и (III) и Hal в производных общей формулы (III). Производные общей формулы (IV) могут быть получены реакцией конденсации производного общей формулы (V)-5 010403 в которой n и P имеют вышеуказанное значение и R2 имеет указанное в случае общей формулы (IV) или(IV') значение, с продуктом общей формулы (VI) в которой Hal означает атом галогена, предпочтительно брома, и m и R имеют вышеуказанное значение. Работают предпочтительно в присутствии сильного основания, в частности амида щелочного металла,например бис(триметилсилил)амида лития, или литийорганического соединения, например бутиллития,в органическом растворителе, которым может быть, в частности, простой эфир, такой как тетрагидрофуран или диоксан. В том случае, если m=1, в реакцию конденсации предпочтительно вводят производное общей формулы (V), такой как приведенная выше, с продуктом типа дибромэтана общей формулы (VI') в которой R имеет вышеуказанное значение, затем из полученного продукта удаляют бромоводород известным специалисту способом. Можно, например, сослаться на способ, описанный R.А. Bunce et al.,Organic Preparations Procedure Internationale, 31 (1), 99-106 (1999). Другие способы, позволяющие получать производные общей формулы (IV), описываются в международной заявке WO 02/40474. Работают, исходя из соответствующего азотсодержащего гетероциклического производного. Примеры приводятся ниже в экспериментальной части. Промежуточные производные общих формул (II) и (IV), получаемые во время осуществления способа согласно изобретению, являются новыми и на этом основании составляют часть изобретения. Производные формулы (V) вообще известны (можно указать, например, в качестве ссылки европейский патент 405506 или международную заявку WO 00/37458), и некоторые имеются в продаже. Получение их представлено ниже в экспериментальной части. Подразумевается, что производные общей формулы (I) и (II) могут существовать в энантиомерных или диастереоизомерных формах или в син- или антиформе, которые, очевидно, входят в рамки настоящего изобретения. Эти формы могут быть разделены обычными способами, известными специалисту, в частности путем хиральной хроматографии или высокоэффективной жидкостной хроматографии (ВЭЖХ). Производные общей формулы (I) могут быть очищены, в случае необходимости, физическими методами, такими как кристаллизация или хроматография. Производные общей формулы (I), в случае необходимости, могут быть превращены в аддитивные соли кислот или оснований с помощью известных способов. Имеют в виду, что эти аддитивные соли кислот или оснований также входят в рамки настоящего изобретения. В качестве примеров аддитивных солей фармацевтически приемлемых кислот можно назвать соли,образуемые с неорганическими кислотами (например, гидрохлориды, гидробромиды, сульфаты, нитраты или фосфаты), или с органическими кислотами (например, сукцинаты, фумараты, тартраты, ацетаты,пропионаты, малеаты, цитраты, метансульфонаты, этансульфонаты, фенилсульфонаты, п-толуолсульфонаты, изетионаты, нафтилсульфонаты или камфорсульфонаты), или с замещенными производными этих кислот. Производные общей формулы (I), содержащие карбоксигруппу, могут быть превращены в соли металлов или аддитивные соли азотсодержащих оснований согласно известным способам. Соли могут быть получены действием металла (например, щелочного или щелочно-земельного металла), амиака или амина в качестве основания на продукт согласно изобретению в соответствующем растворителе, таком как спирт, простой эфир или вода, или реакцией обмена с солью органической кислоты. Образовавшаяся соль осаждается после необязательного концентрирования раствора, ее отделяют фильтрованием, декантацией или лиофилизацией. В качестве примеров фармацевтически приемлемых солей можно назвать, в частности, соли с щелочными металлами (натрий, калий, литий) или с щелочно-земельными металлами(магний, кальций), аммонийную соль, соли азотсодержащих оснований (этаноламин, диэтаноламин, триметиламин, триэтиламин, метиламин, пропиламин, диизопропиламин, N,N-диметилэтаноламин, бензиламин, дициклогексиламин, N-бензилфенетиламин, N,N'-дибензилэтилендиамин, дифенилендиамин,бензгидриламин, хинин, холин, аргинин, лизин, лейцин, дибензиламин). Производные общей формулы (I) согласно изобретению являются особенно активными антибактериальными средствами. Ниже приводится исследование их активности. а) Активность in vitro. Для определения минимальных ингибирующих концентраций (C.M.I.), выражаемых в мкг/мл, использовали метод разведений в агаровой среде в соответствии с рекомендациями NCCLS. Активности соединений согласно примерам 1-4 представлены в нижеприводимой таблице.In vitro соединения согласно изобретению, следовательно, являются в высшей степени активными в отношении одновременно как грамположительных бактерий, как и грамотрицательных бактерий.b) Активность in vivo. Некоторые производные оказались активными в отношении экспериментальных инфекцийStaphylococcus aureus IP 8203 у мышей в дозах, составляющих от 5 до 50 мг/кг при введении подкожно или перорально.c) Продукты согласно изобретению особенно представляют интерес вследствие их слабой токсичности. Ни один из продуктов не проявил токсичности в дозе 50 мг/кг при введении мышам подкожно или перорально (2 введения в сутки). Эти свойства делают пригодными вышеуказанные продукты, а также их соли фармацевтически приемлемых кислот и оснований для использования в качестве лекарственных средств при лечении чувствительных к лечению микробных заболеваний, провоцируемых грамположительными бактериями, и в частности при лечении стафилококковых инфекций, таких как стафилококковые сепсисы, злокачественные стафилококковые инфекции лица или кожи, пиодермиты, септические или гнойные раны, карбункулы, флегмоны, рожи, острые обычные или постгриппозные стафилококковые заболевания, бронхопневмонии, легочные нагноения, а также при лечении стрептококковых или энтерококковых поражений. Эти продукты также могут быть использованы в качестве лекарственных средств при лечении респираторных инфекций верхних и нижних дыхательных путей, провоцируемых грамотрицательными бактериями, такими как Haemophilus influenzae и Moraxella catarrhalis. Следовательно, объектом настоящего изобретения в качестве лекарственных средств и особенно лекарственных средств, предназначенных для лечения бактериальных инфекций у человека или животного, являются соединения общей формулы (I), такие как указанные выше, а также их фармацевтически приемлемые соли, и в частности предпочтительные соединения, указанные выше. Настоящее изобретение относится также к фармацевтическим композициям, включающим по меньшей мере одно производное 4-замещенного хинолина согласно изобретению, в случае необходимости, в виде соли, в чистом виде или в виде ассоциации с одним или несколькими совместимыми и фармацевтически приемлемыми разбавителями или добавками. Композиции согласно изобретению могут быть использованы перорально, парентерально, локально, ректально или в виде аэрозолей. В качестве твердых композиций для перорального введения могут быть использованы таблетки,пилюли, желатиновые капсулы, порошки и грануляты. В этих композициях активный продукт согласно изобретению смешан с одним или несколькими инертными разбавителями или добавками, такими как сахароза, лактоза или крахмал. Эти композиции могут включать вещества, другие, чем разбавители, например смазку, такую как стеарат магния, или защитную оболочку, предназначенную для контролируемого высвобождения. В качестве жидких композиций для перорального введения можно использовать фармацевтически приемлемые растворы, суспензии, эмульсии, сиропы и эликсиры, содержащие инертные разбавители,такие как вода или парафиновое масло. Эти композиции также могут включать вещества, другие, чем разбавители, например смачиватели, подсластители или ароматизаторы. Композиции для парентерального введения могут представлять собой стерильные растворы или эмульсии. В качестве растворителя или эксципиента можно использовать воду, пропиленгликоль, полиэтиленгликоль, растительные масла, в частности оливковое масло, сложные органические эфиры для инъекций, например этилолеат. Эти композиции также могут содержать добавки, в частности смачиватели, изотонизирующие средства, эмульгаторы, диспергаторы и стабилизаторы. Стерилизацию можно осуществлять несколькими способами, например с помощью бактериологического фильтра, путем облучения или путем нагревания. Они также могут быть получены в форме твердых стерильных композиций, которые могут быть растворены в момент употребления в стерильной воде-7 010403 или любой другой стерильной среде для инъекций. Композициями для локального введения могут быть, например, кремы, мази, лосьоны или аэрозоли. Композиции для ректального введения представляют собой суппозитории или ректальные капсулы,которые содержат, кроме действующего начала, эксципиенты, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли. Композиции также могут быть аэрозолями. Для использования в форме жидких аэрозолей композиции могут представлять собой стабильные стерильные растворы или твердые композиции, растворяемые в момент употребления в стерильной апирогенной воде, в сыворотке или любом другом фармацевтически приемлемом эксципиенте. Для использования в форме сухих аэрозолей, предназначенных непосредственно для ингаляции, действующее начало тонко измельчают и объединяют с водорастворимым разбавителем или твердым эксципиентом с гранулометрическим составом 30-80 мкм, как, например, декстран, маннит или лактоза. В терапии человека новые производные 4-замещенного хинолина согласно изобретению особенно пригодны для лечения инфекций бактериального происхождения. Дозы зависят от требуемого эффекта и длительности лечения. Врач определяет дозировку, которую он считает наиболее соответствующей применительно к лечению, в зависимости от возраста, массы, тяжести инфекции и других факторов, характеризующих подвергаемого лечению субъекта. Обычно дозы составляют от 750 мг до 3 г активного продукта в 2 или 3 приема в сутки перорально или от 400 мг до 1,2 г внутривенно для взрослого. Следующие примеры иллюстрируют композиции согласно изобретению. а) Обычным способом получают жидкую композицию, предназначенную для использования парентерально, в которую входят(достаточное количество) до рН 4-4,5 Вода чистая для инъекцийb) Обычным способом получают жидкую композицию, предназначенную для использования парентерально, в которую входят 2-[3-(3-Фтор-6-метоксихинолин-4-ил)пропил]-4-[2-(2,5-дифторфенилсульфанил)этил]морфолин-2-карбоновая кислота 500 мг Глюкоза(достаточное количество) до рН 4-4,5 Вода чистая для инъекций(достаточное количество) до 50 мл Следующие примеры поясняют изобретение. Пример 1. (.+-.)-1-[(2 Е)-3-(2,5-Дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]3-пирролидинкарбоновая кислота. К 1,25 г (2,336 ммоль) метил-(.+-.)-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в виде раствора в 25 см 3 диоксана при температуре около 20 С добавляют 14,2 см 3 5 н. водного раствора гидроксида натрия. После перемешивания в течение 16 ч при кипении с обратным холодильником реакционную среду концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 40 см 3 ацетонитрила. После перемешивания в течение 0,5 ч при температуре около 0 С суспендированное твердое вещество оранжевого цвета отфильтровывают, промывают 2 раза по 7 см 3 ацетонитрила, затем растворяют в 55 см 3 воды. Водную фазу затем подкисляют 1 н. соляной кислотой до значения рН, близкого к 6-7, затем экстрагируют 2 раза по 20 см 3 дихлорметана. Органические фазы объединяют, промывают 2 раза по 10 см 3 воды,сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении(2,7 кПа), получая 0,55 г (.+-.)-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты в виде твердого вещества желтого цвета, плавящегося при температуре 77 С. 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6,в м.д.), 1,59 (м, 4H); 1,81 (м, 2H); 2,25 (м, 1H); 2,38 (уш.д,J=9 Гц, 1H); 2,57 (м, 1H); 2,96 (уш.д, J=9 Гц, 1H); 3,07 (уш.т, J=7,5 Гц, 2H); 3,21 (уш.д, J=6 Гц, 2H); 3,94(с, 3H); 6,47 (д, J=16 и 6 Гц, 1H); 6,61 (уш.д, J=16 Гц, 1H); 7,12 (м, 1H); 7,24 (развязанный т, J=9,5 и 4,5 Гц,1H); 7,35 (д, J=3 Гц, 1H); 7,39 (дд, J=9 и 3 Гц, 1H); 7,50 (м, 1H); 7,96 (д, J=9 Гц, 1H); 8,68 (уш.с, 1H). Масс-спектр (IC) (химическая ионизация): m/z=485 (MH+). Пример 2. Метил-(.+-.)-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилат. К 2,171 г (5,67 ммоль) дигидрохлорида метил-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоксилата в виде раствора в 150 см 3 ацетонитрила при температуре около 20 С и в атмосфере аргона добавляют 3,92 г карбоната калия, 1,03 г иодида калия, затем свежеприготовленный раствор 2-[(1E)-3-хлор-1-пропенил]-1,4-дифторбензола (7,34 ммоль) в дихлорметане. После перемешивания-8 010403 в течение 20 ч при кипении с обратным холодильником реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 200 см 3 дихлорметана, промывают 3 раза по 100 см 3 воды, затем с помощью 75 см 3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 2,6 г масла оранжевого цвета, которое очищают флэш-хроматографией [элюент: циклогексан/этилацетат (1:1 по объемам)]. После концентрирования фракций при пониженном давлении получают 1,45 г метил-(.+-.)-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор 6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в виде масла желтого цвета. 1(с, 3H); 3,95 (с, 3H); 6,45 (д, J=16,5 и 6 Гц, 1H); 6,60 (уш.д, J=16,5 Гц, 1H); 7,12 (м, 1H); 7,23 (развязанный т, J=9,5 и 4,5 Гц, 1H); 7,34 (д, J=3 Гц, 1H); 7,39 (дд, J=9 и 3 Гц, 1H); 7,49 (ддд, J=9,5-6 и 3 Гц, 1H); 7,96 (д,J=9 Гц, 1H); 8,68 (уш.с, 1H). Масс-спектр (IE) (электронный удар): m/z=498 (M+); 439 (M-CO2CH3+); 153 (C9H7F2+). Раствор 2-[(1E)-3-хлор-1-пропенил]-1,4-дифторбензола (7,34 ммоль) в дихлорметане может быть получен следующим образом. К 1,25 г (7,34 ммоль) 2,5-дифторкоричного спирта в виде раствора в 130 см 3 дихлорметана при температуре около 20 С и в атмосфере аргона добавляют раствор 0,66 см 3 (9,07 ммоль) тионилхлорида и 1,08 г (9,07 ммоль) бензтриазола в 70 см дихлорметана. После перемешивания в течение 10 мин реакционную смесь фильтруют через фильтр из пористого стекла 3 и твердый остаток промывают 2 раза по 20 см 3 дихлорметана. Фильтрат промывают 3 раза по 75 см 3 воды. Органическую фазу сушат над безводным сульфатом магния и фильтруют, получая раствор 2-[(1E)-3-хлор-1-пропенил]-1,4-дифторбензола(7,34 ммоль), который сразу используют на следующей стадии. Дигидрохлорид метил-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата может быть получен следующим образом. К 2,9 г (6,495 ммоль) 1-(1,1-диметилэтил)- и (3-метил)-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил) пропил]-1,3-пирролидиндикарбоксилата в виде раствора в 20 см 3 метанола при температуре около 20 С добавляют 8,117 см 3 4 н. раствора хлороводорода в диоксане. После перемешивания в течение 4 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа),получая 2,38 г дигидрохлорида метил-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в виде твердого вещества желтого цвета. Масс-спектр (IE): m/z=346 (M+); 315 (M-OCH3+); 304 (M-C2H4N+); 204 (C12H11ONF+). 1-(1,1-Диметилэтил)- и (3-метил)-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1,3-пирролидиндикарбоксилат может быть получен следующим образом. К 24,84 см 3 (12,42 ммоль) раствора 9-BBN (9-борабицикл[3,3,1]нонан), 0,5M тетрагидрофуран при температуре около 0 С в атмосфере аргона добавляют раствор 2,23 г (8,279 ммоль) 1-(1,1-диметилэтил)- и(3-метил)-(.+-.)-3-(2-пропенил)-1,3-пирролидиндикарбоксилата в 30 см 3 тетрагидрофурана. После нагревания реакционной смеси до температуры около 20 С, затем перемешивания в течение 3 ч при температуре около 20 С последовательно добавляют 2,509 г (8,279 ммоль) 3-фтор-4-иод-6-метоксихинолина в виде суспензии в 70 см 3 тетрагидрофурана, затем 5,27 г (24,84 ммоль) фосфата калия и 0,182 г (0,248 ммоль)PdCl2dppf (1,1'-бис(дифенилфосфино)ферроценилпалладийдихлорид). После перемешивания в течение 16 ч при температуре кипения с обратным холодильником реакционную смесь охлаждают, затем фильтруют через целит. Целит промывают 3 раза по 25 см 3 тетрагидрофурана. Фильтрат затем концентрируют досуха при пониженном давлении (2,7 кПа). Остаток обрабатывают с помощью 100 см 3 дихлорметана,промывают 3 раза по 40 см 3 воды, потом с помощью 50 см 3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 5,7 г масла оранжевого цвета, которое очищают флэш-хроматографией [элюент: циклогексан/этилацетат (7:3 по объемам)]. После концентрирования фракций при пониженном давлении получают 2,9 г 1-(1,1-диметилэтил)- и (3-метил)-(.+-.)-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-1,3-пирролидиндикарбоксилата в виде масла желтого цвета. Масс-спектр (IE): m/z=446 (M+); 390 (M-C4H8+), 345 (390-CO2H+); 204 (C12H11ONF+). 3-Фтор-4-иод-6-метоксихинолин может быть получен способом, описанным в международной заявке на патент WO 02/40474. 1-(1,1-Диметилэтил)- и (3-метил)-(.+-.)-3-(2-пропенил)-1,3-пирролидиндикарбоксилат может быть получен следующим образом. К 2,55 г (11,12 ммоль) 1-(1,1-диметилэтил)- и (3-метил)-1,3-пирролидиндикарбоксилата в виде раствора в 30 см 3 тетрагидрофурана при температуре около -78 С и в атмосфере аргона по каплям добавляют 12,23 см 3 (12,23 ммоль) бис(триметилсилил)амида лития в виде 1M раствора в тетрагидрофуране. После перемешивания в течение 0,25 ч при температуре около -78 С добавляют 1,486 см 3 (16,68 ммоль) аллилбромида, затем выдерживают в течение 1,5 ч для повышения температуры от -78 С до температуры около 20 С. Реакционную среду тогда гидролизуют с помощью 10 см 3 1 н. соляной кислоты, затем концентрируют на три четверти при пониженном давлении (2,7 кПа). Концентрат обрабатывают 50 см 3 этил-9 010403 ацетата. Органическую фазу декантируют, промывают последовательно 15 см 3 1 н. соляной кислоты, 20 см 3 воды и 2 раза по 20 см 3 водного насыщенного раствора гидрокарбоната натрия, сушат над безводным сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 2,5 г масла желтого цвета, которое очищают флэш-хроматографией [элюент: циклогексан/этилацетат(7:3 по объемам)]. После концентрирования фракций при пониженном давлении получают 2,23 г 1-(1,1 диметилэтил)- и (3-метил)-(.+-.)-3-(2-пропенил)-1,3-пирролидиндикарбоксилата в виде бесцветного масла. Масс-спектр (IC): m/z=287 (MNH4+), 270 (MH+), 231 (MNH4+-C4H8). 1-(1,1-Диметилэтил)- и (3-метил)-1,3-пирролидиндикарбоксилат может быть получен следующим образом. К 2,5 г (19,36 ммоль) метил-3-пирролидинкарбоксилата в виде раствора в 50 см 3 дихлорметана при температуре около 20 С и в атмосфере аргона последовательно добавляют 3 см 3 триэтиламина, затем 4,649 г ди-трет-бутилдикарбоната в виде раствора в 30 см 3 дихлорметана. После перемешивания в течение 20 ч при температуре около 20 С реакционную смесь промывают последовательно 3 раза по 50 см 3 воды и 50 см 3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 3,08 г бесцветного масла, которое очищают флэш-хроматографией [элюент: циклогексан/этилацетат(6:4 по объемам)]. После концентрирования фракций при пониженном давлении получают 2,55 г 1-(1,1 диметилэтил)- и (3-метил)-1,3-пирролидиндикарбоксилата в виде бесцветного масла. Масс-спектр (IC): m/z=247 (MNH4+), 230 (MH+), 191 (MNH4+-C4H8), 174 (MH+-C4H8). Метил-(.+-.)-3-пирролидинкарбоксилат может быть получен следующим образом. К 5 г (22,8 ммоль) метил-(.+-.)-1-(фенилметил)-3-пирролидинкарбоксилата в виде раствора в 100 см 3 метанола при температуре около 20 С и в атмосфере аргона последовательно добавляют 0,704 г 10%ного палладия-на-угле (Pd/С), затем 11,5 г формиата аммония. После перемешивания в течение 3 ч при температуре кипения с обратным холодильником реакционную смесь фильтруют через целит. Целит промывают 3 раза по 20 см 3 метанола. Фильтрат затем концентрируют досуха при пониженном давлении(2,7 кПа), получая 2,5 г метил-(.+-.)-3-пирролидинкарбоксилата в виде бесцветного масла. Масс-спектр (IC): m/z=130 (MH+). Метил-(.+-.)-1-(фенилметил)3-пирролидинкарбоксилат может быть получен следующим образом. К 9,496 г (110,3 ммоль) метилакрилата и 32,37 г (115,8 ммоль) N-бутоксиметил-N-триметилсилилметилбензиламина (диполь Ashiwa) в виде раствора в 350 см 3 дихлорметана при температуре около 20 С и в атмосфере аргона по каплям добавляют 0,213 см 3 (2,758 ммоль) трифторуксусной кислоты. Реакция очень экзотермическая; после перемешивания в течение 4 ч при температуре около 20 С добавляют 15 г карбоната калия. После перемешивания в течение 15 мин при температуре около 20 С реакционную смесь последовательно промывают 3 раза по 150 см 3 воды и 150 см 3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 26 г масла желтого цвета, которое очищают флэш-хроматографией [элюент:циклогексан/этилацетат (градиент от 7:3 до 6:4 по объемам)]. После концентрирования фракций при пониженном давлении получают 24,5 г метил-(.+-.)-1-(фенилметил)3-пирролидинкарбоксилата в виде масла желтого цвета. Масс-спектр (IE): m/z=219 (M+), 188 (M-CH3O+), 142 (M-C6H5+), 128 (M-C7H7+).N-Бутоксиметил-N-триметилсилилметилбензиламин (диполь Ashiwa) может быть получен способом, описанным Terao Y., Kotaki H., Imai N., Achiwa K., Chem. Pharm. Bull., 33, 896 (1985). Пример 3. Энантиомер А 1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты. К 0,0693 г (0,139 ммоль) энантиомера А (левовращающий) метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в виде раствора в 3 см 3 диоксана при температуре около 20 С добавляют 1,17 см 3 5 н. водного раствора гидроксида натрия. После перемешивания в течение 48 ч при кипении с обратным холодильником реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 5 см 3 воды и 5 см 3 дихлорметана. Водную фазу подкисляют 5 н. соляной кислотой, затем 1 н. соляной кислотой до значения рН около 7. Органическую фазу декантируют, затем водную фазу концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,067 г остатка, который очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (60:20:20 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,059 г твердого вещества бежевого цвета, которое обрабатывают с помощью 5 см 3 воды и 5 см 3 дихлорметана. Значение рН водной фазы доводят до 7 с помощью 0,01 н. водного раствора гидроксида натрия. Водную фазу экстрагируют 2 раза по 5 см 3 дихлорметана. Органические фазы объединяют, промывают 5 см 3 воды, сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,04 г энантиомера А 1-[(2 Е)-3-(2,5 дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества бежевого цвета, плавящегося при температуре 76-80 С.(д, J=16 и 6 Гц, 1H); 6,61 (уш.д, J=16 Гц, 1H); 7,14 (м, 1H); 7,25 (развязанный т, J=9,5 и 5 Гц, 1H); 7,307,45 (м, 2H); 7,51 (ддд, J=9,5-6 и 3 Гц, 1H); 7,96 (д, J=9 Гц, 1H); 8,69 (с, 1H). Масс-спектр (IE): m/z=484 (M+); 439 (M-CO2H+); 153 (C9H7F2+). Энантиомер А (левовращающий) метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата может быть получен, как описывается дальше в примерах 5 и 6. Пример 4. Энантиомер В 1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). К 0,0675 г (0,135 ммоль) энантиомера В (правовращающий) метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в виде раствора в 3 см 3 диоксана при температуре около 20 С добавляют 1,137 см 3 5 н. водного раствора гидроксида натрия. После перемешивания в течение 48 ч при кипении с обратным холодильником реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 2 см 3 воды и 5 см 3 дихлорметана. Водную фазу подкисляют 1 н. соляной кислотой, затем 0,1 н. соляной кислотой до значения рН около 7. Водную фазу экстрагируют 2 раза по 5 см 3 дихлорметана. Органические фазы объединяют, промывают 5 см 3 воды, сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,035 г энантиомера В 1-[(2E)-3-(2,5-дифторфенил)2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества бежевого цвета, плавящегося при температуре 80-84C.(с, 3H); 6,47 (д, J=16 и 6 Гц, 1H); 6,61 (уш.д, J=16 Гц, 1H); 7,12 (м, 1H); 7,24 (развязанный т, J=9,5 и 4,5 Гц,1H); 7,35 (м, 1H); 7,38 (дд, J=9 и 3 Гц, 1H); 7,50 (ддд, J=9,5-6 и 3 Гц, 1H); 7,96 (д, J=9 Гц, 1H); 8,69 (уш.с, 1H). Масс-спектр (IE): m/z=484 (M+); 439 (M-CO2H+); 153 (C9H7F2+). Энантиомер В (правовращающий) метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата может быть получен, как описывается ниже. Примеры 5 и 6. Энантиомеры А (левовращающий) и В (правовращающий) метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата (абсолютная конфигурация не определена). Метил-(.+-.)-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]3-пирролидинкарбоксилат (0,155 г) вводят в колонку диаметром 80 см и длиной 35 см, содержащую 1200 г неподвижной хиральной фазы Chiralpak AD TM с гранулометрической фракцией 20 мкм. Элюирование осуществляют с помощью подвижной фазы [гептан/2-пропанол/метанол (92:5:3 по объемам)] с расходом 120 мл/мин; детектирование осуществляют с помощью УФ-детектора при длине волны 254 нм. Энантиомер А (левовращающий), абсолютная конфигурация которого не определена, элюируемый в первую очередь, выделят, затем концентрируют в вакууме, получая 0,069 г бесцветного масла. Масс-спектр (IE): m/z=498 (M+); 439 (M-CO2CH3+); 153 (C9H7F2+).[]D20=-11,6+0,4 [метанол (с=0,5), 589 нм]. Энантиомер В (правовращающий), абсолютная конфигурация которого не определена, элюируемый во вторую очередь, выделяют, затем концентрируют в вакууме, получая 0,067 г бесцветного масла. Масс-спектр (IE): m/z=498 (M+); 439 (M-CO2CH3+); 153 (C9H7F2+).[]D20=+11,50,4 [метанол (с=0,5), 589 нм]. Метил-(.+-.)-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]3-пирролидинкарбоксилат может быть получен, как описывается в примере 2. Пример 7. Энантиомер А 4-[2-[(2,5-дифторфенил)тио]этил]-2-[3-(3-фтор-6-метокси-4-хинолинил) пропил]-2-морфолинкарбоновой кислоты (абсолютная конфигурация не определена). Раствор 0,21 г энантиомера А метил-4-[2-[(2,5-дифторфенил)тио]этил]-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоксилата в смеси из 10 см 3 1,4-диоксана, 10 см 3 метанола и 1,18 см 3 5 н. раствора гидроксида натрия выдерживают при температуре около 80 С при перемешивании и в инертной атмосфере в течение 12 ч. После охлаждения до температуры около 20 С реакционную среду выпаривают при пониженном давлении (2 кПа; 45 С), получая беловатую пленку. Остаток обрабатывают 25 см 3 дихлорметана и 10 см 3 дистиллированной воды, затем нейтрализуют 1,2 см 3 5 н. соляной кислоты. Органическую фазу сушат над сульфатом магния, фильтруют, затем выпаривают досуха при пониженном давлении (2 кПа) при температуре около 30 С. Полученный остаток очищают хроматографией на колонке с силикагелем (гранулометрический состав 70-200 мкм; диаметр 2 см), элюируя смесью хлороформметанол-28%-ный раствор гидроксида аммония (12:3:0,5 по объемам) и собирая фракции по 10 см 3. Фракции, содержащие целевой продукт, объединяют, затем выпаривают согласно вышеописанным усло- 11010403 виям. Получают 0,18 г энантиомера А 4-[2-[(2,5-дифторфенил)тио]этил]-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоновой кислоты в виде твердого вещества белого цвета. 1H-ЯМР-спектр (300 МГц, (CD3)2SO-d6 с добавкой нескольких капель CD3COOD-d4,в м.д.): 1,451,90 (м, 4H); 2,04 (д, J=11 Гц, 1H); 2,12 (уш.т, J=11 Гц, 1H); 2,40-2,60 (м, 2H); 2,63 (уш.д, J=11 Гц, 1H); 2,95-3,05 (м, 2H); 3,04 (т, J=7,5 Гц, 2H); 3,12 (д, J=11 Гц, 1H), 3,52 (очень уш.д, J=11 Гц, 1H); 3,77 (уш.т,J=11 Гц, 1H); 3,85 (с, 3H); 7,20 (м, 1H); 7,30-7,50 (м, 2H); 7,50-7,60 (м, 2H); 8,08 (д, J=9 Гц, 1H); 8,73[]D20=-12,7+0,6 [метанол, с=0,5%]. Пример 8. Энантиомер В 4-[2-[(2,5-дифторфенил)тио]этил]-2-[3-(3-фтор-6-метокси-4-хинолинил) пропил]-2-морфолинкарбоновой кислоты (абсолютная конфигурация не определена). Раствор 0,22 г энантиомера В метил-4-[2-[(2,5-дифторфенил)тио]этил]-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоксилата в смеси из 10 см 3 1,4-диоксана, 10 см 3 метанола и 1,23 см 3 5 н. раствора гидроксида натрия выдерживают при температуре около 80 С при перемешивании и в инертной атмосфере в течение 12 ч. После охлаждения до температуры около 20 С реакционную среду выпаривают при пониженном давлении (2 кПа; 45C), получая беловатую пленку. Остаток обрабатывают 25 см 3 дихлорметана и 10 см 3 дистиллированной воды, затем нейтрализуют 1,2 см 3 5 н. соляной кислоты и экстрагируют 25 см 3 диэтилового эфира. Органическую фазу сушат над сульфатом магния, фильтруют, затем выпаривают досуха при пониженном давлении (2 кПа) при температуре около 30 С. Полученный остаток очищают хроматографией на колонке с силикагелем (гранулометрия 70-200 мкм; диаметр 2 см), элюируя смесью хлороформ-метанол-28%-ный раствор гидроксида аммония (12:3:0,5 по объемам) и собирая фракции по 10 см 3. Фракции, содержащие целевой продукт, объединяют, затем выпаривают согласно вышеописанным условиям. Получают 0,2 г энантиомера В 4-[2-[(2,5-дифторфенил)тио]этил]-2-[3-(3-фтор 6-метокси-4-хинолинил)пропил]-2-морфолинкарбоновой кислоты в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6,в м.д.): 1,50-1,85 (м, 4H); 1,96 (д, J=11 Гц, 1H); 2,08 (уш.т,J=11 Гц, 1H); 2,45-2,55 (м, 2H); 2,60 (уш.д, J=11 Гц, 1H); 3,07 (м, 2H); 3,10 (т, J=7,5 Гц, 2H); 3,10-3,20 (м,2H); 3,54 (очень уш.д, J=11 Гц, 1H); 3,91 (уш.т, J=11 Гц, 1H); 3,98 (с, 3H); 7,07 (м, 1H); 7,20-7,35 (м, 2H); 7,35-7,45 (м, 2H); 7,96 (д, J=9 Гц, 1H); 8,68 (с, 1H).[]D20=+16,00,5 [метанол, с=0,5%]. Энантиомеры А и В метил-4-[2-[(2,5-дифторфенил)тио]этил]-2-[3-(3-фтор-6-метокси-4-хинолинил) пропил]-2-морфолинкарбоксилата. Смесь 0,7 г метил-(.+-.)-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоксилата (рацемическая смесь энантиомеров А и В), 0,59 г 2-[(2-бромэтил)тио]-1,4-дифторбензола, 0,32 г иодида калия и 1,33 г карбоната калия в 45 см 3 ацетонитрила нагревают при перемешивании и в инертной атмосфере в течение 20 ч при температуре около 75C. После охлаждения до температуры около 20 С реакционную смесь фильтруют и нерастворимую часть промывают 2 раза по 10 см 3 ацетонитрила. Фильтрат выпаривают при пониженном давлении (2 кПа) при температуре около 40 С. Остаток после выпаривания обрабатывают 50 см 3 дистиллированной воды и 100 см 3 этилацетата. Органическую фазу промывают 3 раза по 30 см 3 дистиллированной воды и 2 раза по 50 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и выпаривают согласно вышеописанным условиям. Полученное масло очищают хроматографией на колонке с силикагелем (гранулометрический состав 70-200 мкм; диаметр 2,5 см),элюируя смесью дихлорметан-этилацетат (90:10 по объемам) и собирая фракции по 10 см 3. Содержащие целевой продукт фракции объединяют, затем выпаривают при пониженном давлении (2 кПа) при температуре около 40 С. Получают 0,52 г метил-(.+-.)-4-[2-[(2,5-дифторфенил)тио]этил]-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоксилата в виде густого бесцветного масла (рацемическая смесь энантиомеров А и В). 1(т, J=7 Гц, 2H); 3,17 (уш.д, J=11 Гц, 1H); 3,59 (с, 3H); 3,64 (очень уш.д, J=7 Гц, 1H); 3,81 (развязанный т,J=11 и 3 Гц, 1H); 3,97 (с, 3H); 7,65 (м, 1H); 7,20-7,35 (м, 2H); 7,36 (д, J=3 Гц, 1H); 7,40 (дд, J=9 и 3 Гц, 1H); 7,96 (д, J=9 Гц, 1H); 8,68 (уш.с, 1H). 1-[(2-Бромэтил)тио]-2,5-дифторбензол получают согласно способу, описанному в международной заявке на патент WO 02/40474. Исходя из рацемической смеси полученных выше энантиомеров А и В, осуществляют выделение каждого энантиомера путем ВЭЖХ. Разделение 2 энантиомеров А и В осуществляют, исходя из 0,52 г вышеописанной смеси А и В, при использовании неподвижной фазы Chiracel OD TM C18 (гранулометрическая фракция 20 мкм; колонка диаметром 80 мм и длиной 350 мм; масса неподвижной фазы составляет 1200 г); подвижная фаза образована смесью гептан-этанол-триэтиламин (95:05:0,05 по объемам) с расходом 110 см 3 в минуту и длина волны УФ-детектора фиксирована при 265 нм. Фракции, содержащие первый энантиомер (энантиомер А), элюируемый в первую очередь, левовращающий, объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40 С,- 12010403 получая 0,224 г бесцветного масла. Фракции, содержащие второй энантиомер (энантиомер В), элюируемый во вторую очередь, правовращающий, объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40 С,получая 0,236 г бесцветного масла. Энантиомер А. 1[]D20=+24,10,9 [диметилсульфоксид, с=0,5%]. Метил-(.+-.)-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоксилат. К раствору 3,2 г 4-(1,1-диметилэтил)- и (2-метил)-(.+-.)-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2,4-морфолиндикарбоксилата в 70 см 3 диоксана добавляют 17,3 см 3 4 н. раствора хлороводорода в диоксане, затем выдерживают при перемешивании в течение 16 ч при температуре 20 С. Реакционную среду после этого выпаривают при пониженном давлении (45 С; 5 кПа). Остаток обрабатывают 30 см 3 этилацетата и 20 см 3 дистиллированной воды, затем нейтрализуют насыщенным раствором гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния, фильтруют, после чего выпаривают досуха при пониженном давлении (2 кПа) при температуре около 40 С. Полученный остаток очищают хроматографией на колонке с силикагелем (гранулометрия 70-200 мкм; диаметр 2,5 см), элюируя смесью дихлорметан-метанол (95:5 по объемам) и собирая фракции по 10 см 3. Фракции, содержащие целевой продукт, объединяют, затем выпаривают согласно вышеописанным условиям. Получают 1,8 г метил-(.+-.)-2[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоксилата в виде густого масла коричневого цвета. 1(с, 3H); 7,36 (д, J=3 Гц, 1H); 7,40 (дд, J=9 и 3 Гц, 1H); 7,96 (д, J=9 Гц, 1H); 8,68 (уш.с, 1H). 4-(1,1-Диметилэтил)- и (2-метил)-(.+-.)-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2,4-морфолиндикарбоксилат. К раствору 3,9 г 4-(1,1-диметилэтил)- и (2-метил)-(.+-.)-2-(2-пропенил)-2,4-морфолиндикарбоксилата в 40 см 3 тетрагидрофурана при перемешивании в инертной атмосфере и после охлаждения до температуры -10 С по каплям добавляют 32 см 3 0,5 М раствора 9-борабицикло[3,3,1]нонана в тетрагидрофуране. Смесь затем доводят до температуры около 20 С, тогда как перемешивание продолжают еще в течение 4 ч. В течение 45 мин добавляют 4,35 г 4-иод-3-хлор-6-метоксихинолина в виде раствора в 30 см 3 тетрагидрофурана, затем 260 мг дифенилфосфиноферроценпалладийхлорида и, наконец, 7,54 г фосфата калия. Реакционную смесь в течение 15 ч кипятят с обратным холодильником, затем фильтруют в горячем состоянии через фильтр из пористого стекла. Фильтрат обрабатывают 4 раза по 20 см 3 этилацетата и концентрируют досуха при пониженном давлении (40 С; 5 кПа). Остаток обрабатывают 250 см 3 этилацетата и 200 см 3 воды. Органическую фазу декантируют, промывают 3 раза по 50 см 3 дистиллированной воды и 2 раза по 100 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния,фильтруют, затем концентрируют при пониженном давлении (45C; 5 кПа). Остаток очищают хроматографией на колонке с силикагелем (гранулометрия 70-200 мкм; диаметр 2,8 см), элюируя дихлорметаном, затем смесью дихлорметан-этилацетат (90:10 по объемам) и собирая фракции по 200 см 3. Фракции,содержащие продукт, объединяют, затем концентрируют при пониженном давлении (40 С; 5 кПа). Получают 3,22 г 4-(1,1-диметилэтил)- и (2-метил)-(.+-.)-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2,4 морфолиндикарбоксилата в виде вязкого масла желтого цвета. 1H-ЯМР-спектр (300 МГц, (CD3)2SO-d6,в м.д.): 1,35-1,85 (м, 4H); 1,38 (с, 9H); 2,85-3,05 (м, 1H),3,07 (м, 2H); 3,61 (с, 3H); 3,67 (м, 4H); 3,97 (с, 3H); 4,17 (д, J=13,5 Гц, 1H); 7,35-7,45 (м, 2H); 7,97 (д, J=9 Гц,1H); 8,69 (уш.с, 1H). 4-(1,1-Диметилэтил)- и (2-метил)-(.+-.)-2-(2-пропенил)-2,4-морфолиндикарбоксилат. К раствору 3,7 см 3 диизопропиламина в 50 см 3 тетрагидрофурана при перемешивании в инертной атмосфере и после охлаждения до температуры -70 С по каплям добавляют 15 см 3 1,6 М раствора бутиллития в гексане. Смесь перемешивают при той же температуре в течение 70 мин. В течение 40 мин по каплям добавляют раствор 5 г 4-(1,1-диметилэтил)- и (2-метил)-2,4-морфолиндикарбоксилата в 40 см 3- 13010403 тетрагидрофурана. Смесь перемешивают при той же температуре в течение 40 мин. В течение 25 мин по каплям добавляют раствор 3,2 г аллилбромида в 10 см 3 тетрагидрофурана. Смесь перемешивают при той же температуре в течение 70 мин. Смесь затем доводят до температуры около 20 С, тогда как перемешивание продолжают еще в течение 2 ч. Добавляют по каплям 15 см 3 насыщенного раствора хлорида аммония. Температуру повышают до 25 С. Органическую фазу декантируют, промывают 1 раз 50 см 3 дистиллированной воды и 2 раза по 100 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют, затем концентрируют при пониженном давлении (45 С; 5 кПа). Остаток очищают хроматографией на колонке с силикагелем (гранулометрия 70-200 мкм; диаметр 2,8 см), элюируя дихлорметаном и собирая фракции по 50 см 3. Фракции, содержащие продукт, объединяют, затем концентрируют при пониженном давлении (45 С; 5 кПа). Получают 3,5 г 4-(1,1-диметилэтил)- и (2-метил)-(.+-.)2-(2-пропенил)-2,4-морфолиндикарбоксилата в виде бесцветного масла. 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6,в м.д.): 1,40 (с, 9H); 2,38 (д, J=7,5 Гц, 2H); 2,80-3,05 (м,2H); 3,55-3,80 (м, 3H); 3,66 (с, 3H); 4,20 (д, J=13 Гц, 1H); 5,00-5,20 (м, 2H); 5,70 (м, 1H). 4-(1,1-Диметилэтил)- и (2-метил)-(.+-.)-2,4-морфолиндикарбоксилат. К раствору 10 г 4-(1,1-диметилэтил)-2,4-морфолиндикарбоксилата в 200 см 3 ацетонитрила при перемешивании в инертной атмосфере и при температуре около 20 С добавляют 13,5 см 3 иодметана, затем 7 г карбоната цезия. Смесь перемешивают при той же температуре в течение 24 ч. Смесь затем фильтруют через целит и фильтрат концентрируют досуха при пониженном давлении (45C; 5 кПа). Остаток обрабатывают 250 см 3 дихлорметана и 200 см 3 воды. Органическую фазу декантируют, промывают 3 раза по 50 см 3 дистиллированной воды и 2 раза по 100 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют, затем концентрируют при пониженном давлении (35C; 5 кПа). Получают 5 г 4-(1,1-диметилэтил)- и (2-метил)-(.+-.)-2,4-морфолиндикарбоксилата в виде вязкого масла желтого цвета, которое медленно кристаллизуется. Температура плавления составляет 68 С. 1H-ЯМР-спектр (300 МГц, (CD3)2SO-d6 при температуре 37C,в м.д.): 1,45 (с, 9H); 3,18 (дд развязанный, J=13,5-9 и 3 Гц, 1H); 3,28 (дд, J=13,5 и 8 Гц, 1H); 3,53 (м, 2H); 3,71 (с, 3H); 3,80 (дд, J=13,5 и 3 Гц,1H); 3,89 (д, J=11 и 4 Гц, 1H); 4,17 (дд, J=8 и 3 Гц, 1H). Пример 9. Энантиомер А 4-[3-(2,5-дифторфенил)-2-пропенил]-2-[3-(3-фтор-6-метокси-4-хинолинил) пропил]-2-морфолинкарбоновой кислоты (абсолютная конфигурация не определена). Раствор 0,21 г энантиомера А метил-4-[3-(2,5-дифторфенил)-2-пропенил]-2-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-2-морфолинкарбоксилата в смеси из 10 см 3 1,4-диоксана, 10 см 3 метанола и 1,22 см 3 5 н. раствора гидроксида натрия выдерживают при температуре около 80 С при перемешивании и в инертной атмосфере в течение 12 ч. После охлаждения до температуры около 20 С реакционную среду выпаривают при пониженном давлении (2 кПа; 45C), получая беловатую пленку. Остаток обрабатывают с помощью 25 см 3 дихлорметана и 10 см 3 дистиллированной воды, затем нейтрализуют 1,23 см 3 5 н. соляной кислоты. Органическую фазу сушат над сульфатом магния, фильтруют, затем выпаривают досуха при пониженном давлении (2 кПа) при температуре около 30 С. Полученный остаток очищают хроматографией на колонке с силикагелем (гранулометрический состав 70-200 мкм; диаметр 2 см), элюируя смесью хлороформ-метанол-28%-ный раствор гидроксида аммония (12:3:0,5 по объемам) и собирая фракции по 10 см 3. Фракции, содержащие целевой продукт, объединяют, затем выпаривают согласно вышеописанным условиям. Получают 0,13 г энантиомера А 4-[3-(2,5-дифторфенил)-2-пропенил]-2-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-2-морфолинкарбоновой кислоты в виде желтого лака. 1[]D20=-12,60,7 [метанол, с=0,5%]. Пример 10. Энантиомер В 4-[3-(2,5-дифторфенил)-2-пропенил]-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоновой кислоты (абсолютная конфигурация не определена). Раствор 0,21 г энантиомера В метил-4-[3-(2,5-дифторфенил)-2-пропенил]-2-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-2-морфолинкарбоксилата в смеси из 10 см 3 1,4-диоксана, 10 см 3 метанола и 1,22 см 3 5 н. раствора гидроксида натрия выдерживают при температуре около 80 С при перемешивании и в инертной атмосфере в течение 12 ч. После охлаждения до температуры около 20 С реакционную среду выпаривают при пониженном давлении (2 кПа; 45C), получая беловатую пленку. Остаток обрабатывают 25 см 3 дихлорметана и 10 см 3 дистиллированной воды, затем нейтрализуют 1,2 см 3 5 н. соляной кислоты. Органическую фазу сушат над сульфатом магния, фильтруют, затем выпаривают досуха при пониженном давлении (2 кПа) при температуре около 30 С. Полученный остаток очищают хроматографией на колонке с силикагелем (гранулометрический состав 70-200 мкм; диаметр 2 см), элюируя смесью хлороформ-метанол-28%-ный раствор гидроксида аммония (12:3:0,5 по объемам) и собирая фракции по 10 см 3. Фракции, содержащие целевой продукт, объединяют, затем выпаривают согласно вышеописанным условиям. Получают 0,14 г энантиомера В 4-[3-(2,5-дифторфенил)-2-пропенил]-2-[3-(3-фтор-6-метокси-4-хи- 14010403 нолинил)пропил]-2-морфолинкарбоновой кислоты в виде густого масла оранжевого цвета. 1[]D20=+12,40,6 [метанол, с=0,5%]. Получение энантиомеров А и В метил-4-[3-(2,5-дифторфенил)-2-пропенил]-2-[3-(3-фтор-6-метокси 4-хинолинил)пропил]-2-морфолинкарбоксилата. К 0,7 г 2,5-дифторкоричного спирта, растворенного в 90 см 3 хлороформа, при перемешивании в инертной атмосфере и при температуре около 23 С по каплям добавляют раствор 0,62 г бензонитрила и 0,62 г тионилхлорида в 30 см 3 хлороформа. Смесь затем перемешивают при этой же самой температуре в течение 2 ч. Реакционную смесь обрабатывают 75 см 3 насыщенного раствора гидрокарбоната натрия,затем 75 см 3 дистиллированной воды и, наконец, сушат над сульфатом магния, получая раствор S желтого цвета. Этот раствор S добавляют к смеси 1,1 г метил-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2 морфолинкарбоксилата, 0,5 г иодида калия и 2,1 г карбоната калия в 150 см 3 ацетонитрила, после чего всю массу нагревают при перемешивании и в инертной атмосфере в течение 20 ч при температуре около 75 С. После охлаждения до температуры около 20 С реакционную среду фильтруют и нерастворимую часть промывают 2 раза по 10 см 3 ацетонитрила. Фильтрат выпаривают при пониженном давлении (2 кПа) при температуре около 40 С. Остаток после выпаривания обрабатывают 50 см 3 дистиллированной воды и 100 см 3 этилацетата. Органическую фазу промывают 3 раза по 30 см 3 дистиллированной воды и 2 раза по 50 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и выпаривают в вышеописанных условиях. Полученное масло очищают хроматографией на колонке с силикагелем(гранулометрия 70-200 мкм; диаметр 2,5 см), элюируя смесью дихлорметан-этилацетат (80:20 по объемам) и собирая фракции по 10 см 3. Фракции, содержащие целевой продукт, объединяют, затем выпаривают при пониженном давлении (2 кПа) при температуре около 40 С. Получают 0,48 г метил-4-[3-(2,5 дифторфенил)-2-пропенил]-2-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-2-морфолинкарбоксилата в виде смолоподобного вещества коричневого цвета (рацемическая смесь энантиомеров А и В). 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6,в м.д.): 1,40-1,60 (м, 1H); 1,73 (м, 3H); 1,99 (д, J=11 Гц,1H); 2,12 (развязанный т, J=11 и 3,5 Гц, 1H); 2,64 (уш.д, J=11 Гц, 1H); 3,05 (м, 2H); 3,05-3,15 (м, 2H); 3,18(уш.д, J=11 Гц, 1H); 3,61 (с, 3H); 3,67 (очень уш.д, J=11 Гц, 1H); 3,83 (развязанный т, J=11 и 2,5 Гц, 1H); 3,96 (с, 3H); 6,39 (д, J=16,5 и 7 Гц, 1H); 6,61 (уш.д, J=16,5 Гц, 1H); 7,13 (м, 1H); 7,24 (развязанный т, J=10 и 5 Гц, 1H); 7,36 (д, J=3 Гц, 1H); 7,40 (дд, J=9 и 3 Гц, 1H); 7,49 (м, 1H); 7,96 (д, J=9 Гц, 1H); 8,68 (уш.с, 1H). Исходя из рацемической смеси полученных выше энантиомеров А и В, осуществляют выделение каждого энантиомера путем ВЭЖХ. Разделение 2 энантиомеров А и В осуществляют, исходя из 0,52 г вышеописанной смеси А и В, при использовании неподвижной фазы Chiracel OD TM C18 (гранулометрическая фракция 20 мкм; колонка диаметром 80 мм и длиной 350 мм; масса неподвижной фазы составляет 1200 г); подвижная фаза образована смесью гептан/метанол/пропанол (95:01:04 по объемам) с расходом 100 см 3 в минуту, и длина волны УФ-детектора фиксирована при 254 нм. Фракции, содержащие первый энантиомер, элюируемый в первую очередь (называемый энантиомером А), левовращающий, объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40 С, получая 0,217 г бесцветного масла. Фракции, содержащие второй энантиомер, элюируемый во вторую очередь (называемый энантиомером В), правовращающий, объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40 С, получая 0,212 г бесцветного масла. Энантиомер А. 1(уш.д, J=11 Гц, 1H); 3,61 (с, 3H); 3,67 (очень уш.д, J=11 Гц, 1H); 3,83 (развязанный т, J=11 и 2,5 Гц, 1H); 3,96 (с, 3H); 6,39 (д, J=16 и 7 Гц, 1H); 6,61 (уш.д, J=16 Гц, 1H); 7,13 (м, 1H); 7,24 (развязанный т, J=10 и 5 Гц,1H); 7,36 (д, J=3 Гц, 1H); 7,40 (дд, J=9 и 3 Гц, 1H); 7,49 (м, 1H); 7,96 (д, J=9 Гц, 1H); 8,68 (с, 1H). Пример 11. 1-[(2E)-3-(2,5-Дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]3-азетидинкарбоновая кислота. К 614 мг (1,267 ммоль) метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4- 15010403 хинолинил)пропил]-3-азетидинкарбоксилата в виде раствора в 20 см 3 диоксана при температуре около 20 С добавляют 5 см 3 5 н. водного раствора гидроксида натрия. После перемешивания в течение 1,5 ч при кипении с обратным холодильником добавляют еще 6 см 3 5 н. водного раствора гидроксида натрия и кипятят с обратным холодильником еще в течение 3 ч; реакционную среду охлаждают и добавляют 4,5 см 3 37%-ной соляной кислоты, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который подвергают флэш-хроматографии на колонке с 200 см 3 тонкоизмельченного диоксида кремния [элюент: градиент растворителей дихлорметан-метанол-28%-ный раствор гидроксида аммония(2,7 кПа). Остаток (530 мг) обрабатывают с помощью 10 см 3 дихлорметана, разбавленного с помощью 25 см 3 диэтилового эфира, получая 445 мг 1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-3-азетидинкарбоновой кислоты в виде твердого вещества розоватого цвета, плавящегося при температуре 211 С. 1(уш.д, J=16,5 Гц, 1H); 7,13 (м, 1H); 7,25 (развязанный т, J=9,5 и 5 Гц, 1H); 7,35-7,45 (м, 2H); 7,49 (ддд,J=9,5-6 и 3 Гц, 1H); 7,96 (д, J=9 Гц, 1H); 8,70 (уш.с, 1H). Масс-спектр (IC): m/z=471 (M+H)+ (пик молекулярного иона). Метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-азетидинкарбоксилат может быть получен, как описывается в примере 12. Пример 12. Метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил) пропил]-3-азетидинкарбоксилат. К 1,18 г (2,91 ммоль) дигидрохлорида метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-азетидинкарбоксилата при температуре около 20 С и в атмосфере аргона добавляют 2 г карбоната калия, 0,531 г иодида калия, затем свежеприготовленный раствор 2-[(1E)-3-хлор-1-пропенил]-1,4-дифторбензола (3,8 ммоль) в 70 см 3 ацетонитрила. После перемешивания в течение 3 ч при температуре кипения с обратным холодильником реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 100 см 3 воды, экстрагируют 6 раз по 100 см 3 дихлорметана, концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,546 г масла коричневого цвета, которое очищают флэш-хроматографией при использовании 240 мл тонкоизмельченного диоксида кремния [элюент: градиент циклогексан/этилацетат (от 50:50 до 40:60 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,799 г метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-3-азетидинкарбоксилата в виде масла желтого цвета. 1(ддд, J=9,5-6 и 3 Гц, 1H); 7,96 (д, J=9 Гц, 1H); 8,70 (д, J=1 Гц, 1H). Масс-спектр (IE): m/z=484 (M+); m/z=191 (пик молекулярного иона). Раствор 2-[(1E)-3-хлор-1-пропенил]-1,4-дифторбензола (3,8 ммоль) в ацетонитриле может быть получен следующим образом. К 0,646 г (3,8 ммоль) 2,5-дифторкоричного спирта в виде раствора в 40 см 3 дихлорметана при температуре около 20 С и в атмосфере аргона добавляют раствор 0,34 см 3 (4,66 ммоль) тионилхлорида и 0,555 г (4,66 ммоль) бензотриазола в 40 см 3 дихлорметана. После перемешивания в течение 10 мин реакционную смесь фильтруют через фильтр из пористого стекла 3 и твердый остаток промывают 3 раза по 10 см 3 дихлорметана. Фильтрат промывают 3 раза по 30 см 3 воды. Органическую фазу сушат над сульфатом магния и фильтруют, получая раствор 2-[(1E)-3-хлор-1-пропенил]-1,4-дифторбензола (3,8 ммоль),который затем концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 20 С,перед растворением в ацетонитриле. Дигидрохлорид метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-азетидинкарбоксилата может быть получен следующим образом. К 1,325 г (3,06 ммоль) 1-(1,1-диметилэтил)- и (3-метил)-3-[3-(фтор-6-метокси-4-хинолинил)пропил]1,3-азетидиндикарбоксилата в виде раствора в 10 см 3 метанола при температуре около 20 С добавляют 10 см 3 4 н. раствора хлороводорода в диоксане. После перемешивания в течение 4 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,19 г дигидрохлорида метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-азетидинкарбоксилата в виде меренги бледно-желтого цвета. Масс-спектр (IE): m/z=332 (M+); m/z=304, 204 (пик молекулярного иона) и 191. 1-(1,1-Диметилэтил)- и (3-метил)-3-[3-(фтор-6-метокси-4-хинолинил)пропил]-1,3-азетидиндикарбоксилат может быть получен следующим образом. К 12 см 3 (6 ммоль) раствора 9-BBN (9-борабицикло[3,3,1]нонан), 0,5 М тетрагидрофуран при температуре около 3C и в атмосфере аргона добавляют раствор 1,021 г (4 ммоль) 1-(1,1-диметилэтил)- и (3 метил)-3-(2-пропенил)-1,3-азетидиндикарбоксилата в 15 см 3 тетрагидрофурана. После нагревания реак- 16010403 ционной смеси до температуры около 20 С, затем перемешивания в течение 3 ч при температуре около 20 С последовательно добавляют 2,34 г (4,4 ммоль) 3-фтор-4-иод-6-метоксихинолина в виде суспензии в 35 см 3 тетрагидрофурана, затем 2,55 г (12 ммоль) фосфата калия и 0,09 г (0,123 ммоль) PdCl2dppf (1,1'бис(дифенилфосфино)ферроценилпалладийдихлорид). После перемешивания в течение 19 ч при температуре кипения с обратным холодильником реакционную смесь охлаждают, затем фильтруют через фильтр из пористого стекла, который обильно промывают тетрагидрофураном и этилацетатом. Фильтрат затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 3,09 г масла черного цвета,которое очищают флэш-хроматографией при использовании 300 см 3 тонкоизмельченного диоксида кремния [элюент: градиент циклогексан/этилацетат (от 75:25 до 60-40 по объемам)]. После концентрирования фракций при пониженном давлении получают 1,334 г 1-(1,1-диметилэтил)- и (3-метил)-3-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-1,3-азетидиндикарбоксилата в виде масла желтого цвета. Масс-спектр (IC): m/z=433 (M+H)+ (пик молекулярного иона). 1-(1,1-Диметилэтил)- и (3-метил)-3-(2-пропенил)-1,3-азетидиндикарбоксилат может быть получен следующим образом. К 3,601 г (16,73 ммоль) 1-(1,1-диметилэтил)- и (3-метил)-1,3-азетидиндикарбоксилата в виде раствора в 40 см 3 тетрагидрофурана при температуре около -78 С и в атмосфере аргона по каплям добавляют 20 см 3 (20 ммоль) бис(триметилсилил)амида лития в виде 1M раствора в тетрагидрофуране. После перемешивания в течение 10 мин при температуре около -78 С добавляют 2,2 см 3 (25,4 ммоль) аллилбромида, затем выдерживают для повышения температуры от -78 до около 20 С, при которой перемешивают еще в течение 17 ч. Реакционную среду концентрируют досуха при пониженном давлении (2,7 кПа). Остаток обрабатывают 50 см 3 воды, затем экстрагируют 3 раза по 50 см 3 этилацетата, сушат над безводным сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 3,525 г масла желтого цвета, которое очищают флэш-хроматографией [элюент: градиент циклогексан-этилацетат (от 90:10 до 80:20 по объемам)]. После концентрирования фракций при пониженном давлении получают 2,75 г 1-(1,1-диметилэтил)- и (3-метил)-3-(2-пропенил)-1,3-азетидиндикарбоксилата в виде бесцветного масла. Масс-спектр (IC): m/z=256 (M+H)+; m/z=273 (M+NH4+) (пик молекулярного иона). 1-(1,1-Диметилэтил)- и (3-метил)-1,3-азетидиндикарбоксилат может быть получен следующим образом. К раствору 3,513 г (17,46 ммоль) 1-(1,1-диметилэтил)ового эфира 1,3-азетидиндикарбоновой кислоты в виде раствора в 30 см 3 метанола добавляют 0,9 см 3 (0,9 ммоль) 1M раствора тетрабутиламмонийфторида; охлаждают дотемпературы около 5 С и в течение 5 мин приливают 10 см 3 (20 ммоль) 2 М раствора триметилсилилдиазометана в гексане, затем, спустя 30 мин, еще 15 см 3 (30 ммоль) 2 М раствора триметилсилилдиазометана в гексане. После обесцвечивания растворители выпаривают при пониженном давлении (2,7 кПа), получая 4,205 г жидкости коричневого цвета, которую очищают флэш-хроматографией при использовании 320 мл тонкоизмельченного диоксида кремния [элюент: циклогексан/этилацетат(80:20 по объемам)]. После концентрирования фракций при пониженном давлении получают 3,456 г 1(1,1-диметилэтил)- и (3-метил)-1,3-азетидиндикарбоксилата в виде бесцветного масла. Масс-спектр (IC): m/z=216 (M+H)+, m/z=233 (M+NH4)+ (пик молекулярного иона). Пример 13. Натриевая соль 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]3-азетидинкарбоновой кислоты. Следуют методике примера 11, но исходя из 512,4 мг (1,08 ммоль) метил-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-азетидинкарбоксилата, 20 см 3 диоксана и 10 см 3 5 н. водного раствора гидроксида натрия, и кипятят с обратным холодильником в течение 1,5 ч. Охлаждают, затем добавляют 5 см 3 соляной кислоты, потом водный раствор гидроксида аммония для достижения значения рН 8. После этого растворители выпаривают при пониженном давлении (2,7 кПа) не досуха. Обрабатывают 20 см 3 воды и оставляют стоять, после чего отфильтровывают, промывают водой и диэтиловым эфиром. Таким образом получают 473 мг натриевой соли 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-азетидинкарбоновой кислоты в виде порошка белого цвета, плавящегося при температуре 67 С. 1H-ЯМР-спектр (300 МГц, (CD3)2SO-d6,в м.д.): 1,57 (м, 2H); 1,96 (м, 2H); 2,57 (уш.т, J=7 Гц, 2H); 2,74 (уш.т, J=7 Гц, 2H); 2,95-3,10 (м, 2H); 3,05 (уш.д, J=7 Гц, 2H); 3,32 (уш.д, J=7 Гц, 2H); 3,97 (с, 3H); 7,04 (дд, J=5,5 и 3,5 Гц, 1H); 7,17 (уш.д, J=3,5 Гц, 1H), 7,38 (м, 1H); 7,40 (дд, J=9 и 3 Гц, 1H); 7,60 (уш.д,J=5,5 Гц, 1H); 7,97 (д, J=9 Гц, 1H); 8,70 (уш.с, 1H). Масс-спектр (IE): m/z=460 (M+), m/z=331 (пик молекулярного иона). Пример 14. Метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-азетидинкарбоксилат может быть получен следующим образом. К раствору 508 мг (1,35 ммоль) метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-(2-гидроксиэтил]-3-азетидинкарбоксилата, 314 мг (2,7 ммоль) 2-тиофентиола и 708 мг (2,7 ммоль) трифенилфосфина в 5 см 3 тетрагидрофурана при температуре около 20 С добавляют 0,53 см 3 (2,7 ммоль) диизопропилкарбодиимида в 5 см 3 тетрагидрофурана и выдерживают при перемешивании в течение 22 ч при температуре около 20 С.- 17010403 После этого к реакционной среде добавляют 30 см 3 диэтилового эфира и экстрагируют 2 раза по 30 см 3 воды, к которой добавлено 0,5 см 3 концентрированной метансульфоновой кислоты, затем 1 раза по 30 см 3 воды. Эти объединенные водные кислые фазы промывают 30 см 3 диэтилового эфира, затем подщелачивают до значения рН 11; экстрагируют 5 раз по 50 см 3 дихлорметана, после чего выпаривают досуха при пониженном давлении (2,7 кПа). Остаток (693 мг) очищают флэш-хроматографией при использовании 150 см 3 тонкоизмельченного диоксида кремния [элюент: циклогексан/этилацетат (1:1 по объемам)]. После концентрирования фракций при пониженном давлении получают 340 мг метил-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-азетидинкарбоксилата в виде почти бесцветного масла. 1(дд, J=5,5 и 3,5 Гц, 1H), 7,17 (дд, J=3,5 и 1 Гц, 1H), 7,37 (уш.д, J=3 Гц, 1H); 7,41 (уш.дд, J=9 и 3 Гц, 1H); 7,60 (дд, J=5,5 и 1 Гц, 1H), 7,97 (д, J=9 Гц, 1H); 8,70 (д, J=1 Гц, 1H). Масс-спектр (IE): m/z=474 (M+), m/z=345 (пик молекулярного иона). Метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-(2-гидроксиэтил)-3-азетидинкарбоксилат может быть получен следующим образом. К раствору 2,57 г (6,347 ммоль) дигидрохлорида метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]3-азетидинкарбоксилата и 0,75 см 3 (9,6 ммоль) 2-иодэтанола в 100 см 3 ацетонитрила добавляют 3,51 г(24,4 ммоль) карбоната калия и перемешивают в течение 20 ч при температуре около 20 С, после чего кипятят с обратным холодильником в течение 1,25 ч и растворители выпаривают при пониженном давлении. Остаток обрабатывают 100 см 3 воды и экстрагируют 3 раза по 100 см 3 дихлорметана, который затем выпаривают при пониженном давлении (2,7 кПа). Получают 2,88 г масла розового цвета, которое очищают флэш-хроматографией при использовании 300 мл тонкоизмельченного диоксида кремния [элюент: градиент дихлорметан-метанол-28%-ный раствор гидроксида аммония (от 100:0:0 до 86:12:2 по объемам)]. После концентрирования фракций при пониженном давлении получают 1,748 г метил-3-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-1-(2-гидроксиэтил)-3-азетидинкарбоксилата в виде масла розового цвета. Масс-спектр (IE): m/z=376 (M+); m/z=345 (пик молекулярного иона). Пример 15. Натриевая соль (.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты. Следуя методике, описанной в примере 1, но исходя из 4-бром-3-хлор-6-метоксихинолина (который может быть получен способом, описанным в международной заявке на патент WO 2002/40474-А 2), получают натриевую соль (.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты в виде твердого вещества, плавящегося при температуре 77 С. Масс-спектр (IE): m/z=500 M+; m/z=153 C9H7F2+ (пик молекулярного иона). ИК-спектр (KBr): 2936, 1621, 1504, 1491, 1230, 1117, 831, 743 и 728 см-1. Пример 16. Натриевая соль (.+-.)-1-[(2 Е)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты. Следуя методике, описанной в примере 1, но исходя из 4-бром-6-метоксихинолина, получают натриевую соль (.+-.)-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоновой кислоты в виде твердого вещества, плавящегося при температуре 109-112C. Масс-спектр (IC): m/z=467 MH+ (пик молекулярного иона). ИК-спектр (KBr): 2941, 1621, 1591, 1509, 1490, 1242, 1228, 1031 845 и 728 см-1. Пример 17. Энантиомер А (левовращающий) 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2 тиенилтио)этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоксилата, получают энантиомер А (левовращающий) 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре 160 С.[]D20=-36,30,8 [дихлорметан (с=0,5), 589 нм]. ИК-спектр (KBr): 2937, 1620, 1508, 1228, 1031, 847, 832, 809, 785, 708 и 452 см-1. Масс-спектр (IE): m/z=474 (M+); 345 (M=C5H5S2)+ пик молекулярного иона. Метил-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоксилат может быть получен, как описывается в примере 2, но исходя из 2-[(2-бромэтил)тио]тиофена. Получают масло желтого цвета. Масс-спектр (IE): m/z=488 (M+). 2-[(2-Бромэтил)тио]тиофен может быть получен способом, описанным в международной заявке на патент WO 2002/40474-А 2. Пример 18. Энантиомер В (правовращающий) 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2 тиенилтио)этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоксилата, получают энантиомер В (правовра- 18010403 щающий) 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре 172 С.[]D20=+36,30,8 [дихлорметан (с=0,5), 589 нм]. ИК-спектр (KBr): 2937, 1620, 1508, 1228, 1031, 847, 832, 809, 785, 708 и 452 см-1. Масс-спектр (IE): m/z=474 (M+); 345 (M=C5H5S2)+ пик молекулярного иона. Пример 19. Энантиомер А (правовращающий) натриевой соли 1-[2-[(2,5-дифторфенил)тио]этил]-3[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-1-[2-[(2,5-дифторфенил)тио]этил]-3[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер А (правовращающий) натриевой соли 1-[2-[(2,5-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил) пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета.[]D20=+15,30,8 [дихлорметан (с=0,5), 589 нм]. ИК-спектр (KBr): 2934, 1620, 1509, 1483, 1361, 1230, 1187, 1030, 909, 831 и 757 см-1. Масс-спектр (IC): m/z=505 (MH)+ пик молекулярного иона. Метил-(.+-.)-1-[2-[(2,5-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилат может быть получен следуя методике примера 2, но исходя из 2-[(2-бромэтил)тио]1,4-дифторбензола. Получают масло бледно-желтого цвета. Масс-спектр (IE): m/z=518 (M+). 2-[(2-Бромэтил)тио]-1,4-дифторбензол может быть получен согласно способу, описанному в международной заявке на патент WO 2002/40474-А 2. Пример 20. Энантиомер В (левовращающий) натриевой соли 1-[2-[(2,5-дифторфенил)тио]этил]-3[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-[(2,5-дифторфенил)тио] этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер В(левовращающий) натриевой соли 1-[2-[(2,5-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета.[]D20=-17,50,7 [дихлорметан (с=0,5), 589 нм]. ИК-спектр (KBr): 2934, 1620, 1509, 1483, 1361, 1230, 1187, 1030, 909, 831 и 757 см-1. Масс-спектр (IC): m/z=505 (MH)+ пик молекулярного иона. Пример 21. Энантиомер А (левовращающий) 1-[2-(2,6-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-(2,6-дифторфенокси)этил]3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер А (левовращающий) 1-[2-(2,6-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде белого лака.[]D20=-18,90,7 [метанол (с=0,5), 589 нм]. ИК-спектр (CCl4): 2929, 1621, 1507, 1499, 1477, 1292, 1231, 1031, 1008, 908 и 832 см-1. Масс-спектр (IC): m/z=489 (MH)+ пик молекулярного иона. Метил-(.+-.)-1-[2-(2,6-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилат может быть получен, следуя методике примера 2, но исходя из 2-(2-бромэтокси)-1,3 дифторбензола. Получают масло желтого цвета. Масс-спектр (IE): m/z=502 (M+). 2-(2-Бромэтокси)-1,3-дифторбензол может быть получен согласно способу, описанному в международной заявке на патент WO 2002/40474. Пример 22. Энантиомер В (правовращающий) 1-[2-(2,6-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-(2,6-дифторфенокси)этил]3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер В (правовращающий) 1-[2-(2,6-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде белого лака.[]D20=+18,30,7 [метанол (с=0,5), 589 нм]. ИК-спектр (CCl4): 2929, 1621, 1507, 1499, 1477, 1292, 1231, 1031, 1008, 908 и 832 см-1. Масс-спектр (IC): m/z=489 (MH)+ пик молекулярного иона. Пример 23. Энантиомер А 1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). К 0,49 г (0,987 ммоль) энантиомера А метил-1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6- 19010403 метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в виде раствора в 30 см 3 диоксана при температуре около 20 С добавляют 8,3 см 3 5 н. водного раствора гидроксида натрия. После перемешивания в течение 16 ч при кипении с обратным холодильником реакционную среду концентрируют при пониженном давлении (2,7 кПа), затем обрабатывают 75 см 3 дистиллированной воды. Прозрачный раствор желтого цвета после этого подкисляют до значения рН 5 20 см 3 2 н. соляной кислоты, затем экстрагируют 75 см 3 дихлорметана, потом 2 раза по 50 см 3 дихлорметана. Органические фазы декантируют, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,29 г остатка, который растирают с 5 см 3 диизопропилового эфира, после чего высушивают. Эту операцию повторяют 2 раза. Получают 0,28 г энантиомера А 1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества кремового цвета. Масс-спектр (IE): m/z=482 (M+); m/z=151 (C9H5F2+) пик молекулярного иона. ИК-спектр (KBr): 2943, 1621, 1509, 1496, 1231, 1170, 1031, 830, 767 и 595 см-1.[]D20=-37,51 [дихлорметан (с=0,3), 589 нм]. Энантиомер А метил-1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил) пропил]-3-пирролидинкарбоксилата может быть получен следующим образом. Раствор 1,68 г метил-(.+-.)-1-(2-пропинил)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата (рацемат), 75 мг дииодида меди, 0,67 г 2,5-дифторбромбензола и 0,24 г тетракистрифенилфосфина в 17 см 3 триэтиламина нагревают при температуре 80 С в течение 1 ч, затем перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разбавляют с помощью 100 см 3 этилацетата, затем фильтруют, органическую фазу промывают 3 раза по 50 см 3 дистиллированной воды, затем экстрагируют с помощью 100 см 3 2 н. соляной кислоты. Водную фазу доводят до значения рН 8-9 добавлением карбоната калия, затем экстрагируют 3 раза по 100 см 3 этилацетата. Органические фазы объединяют, промывают 50 см 3 дистиллированной воды, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,83 г густого масла коричневого цвета, которое очищают флэш-хроматографией [элюент: циклогексан-этилацетат (1:1 по объемам)]. После концентрирования фракций при пониженном давлении получают 1,46 г густого масла бледно-желтого цвета. Разделение хиральной ВЭЖХ двух энантиомеров А и В метил-1-[3-(2,5-дифторфенил)-2-пропинил]3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата осуществляют согласно методике, описанной в примере 5 и 6. Для энантиомера A: []D20=-21,40,5 [метанол (с=0,5), 589 нм]; масс-спектр (IE): m/z=496 (M+). Для энантиомера В: []D20=+19,20,7 [метанол (с=0,5), 589 нм]; масс-спектр (IE): m/z=496 (M+). Метил-(.+-.)-1-(2-пропинил)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоксилат (рацемат) может быть получен следующим образом. К раствору 6,23 г дигидрохлорида метил-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в 62 см 3 диметилформамида при комнатной температуре по каплям добавляют 6,7 см 3 триэтиламина, затем по каплям добавляют 2,4 см 3 пропаргилбромида. Раствор перемешивают при комнатной температуре в течение 1 ч, затем реакционную смесь выливают на 180 г измельченного льда и 300 см 3 дистиллированной воды. Водную фазу экстрагируют 3 раза по 350 см 3 диэтилового эфира, органические фазы объединяют, промывают 350 см 3 дистиллированной воды, сушат над сульфатом магния,затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 3,2 г масла оранжевого цвета. Масс-спектр (IE): m/z=384 (M+). Пример 24. Энантиомер В 1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из энантиомера В метил-1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата получают энантиомер В 1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=482 (M+); m/z=151 (C9H5F2+) пик молекулярного иона. ИК-спектр (KBr): 2943, 1621, 1509, 1496, 1231, 1170, 1031, 830, 767 и 595 см-1.[]D20=+24,7+0,7 [метанол (с=0,3), 589 нм]. Пример 25. Энантиомер А 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоксилата, получают энантиомер А 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты в виде твердого вещества. Масс-спектр (IE): m/z=500 (M+); m/z=153 (C9H7F2+) пик молекулярного иона. ИК-спектр (KBr): 2965, 2936, 1621, 1591, 1504, 1491, 1423, 1230, 1117, 831, 743 и 728 см-1.[]D20=-7,40,6 [дихлорметан (с=0,5), 589 нм]. Метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]- 20010403 3-пирролидинкарбоксилат получают согласно способу, описанному в примере 1, но исходя из 4-бром-3 хлор-6-метоксихинолина. Масс-спектр (IE): m/z=515 (M+). Пример 26. Энантиомер В 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоксилата, получают энантиомер В 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты в виде твердого вещества. Масс-спектр (IE): m/z=500 (M+); m/z=153 (C9H7F2+) пик молекулярного иона. ИК-спектр (KBr): 2965, 2936, 1621, 1591, 1504, 1491, 1423, 1230, 1117, 831, 743 и 728 см-1.[]D20=+5,50,5 [дихлорметан (с=0,5), 589 нм]. Пример 27. Энантиомер А 1-[3-(2,6-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 2,6-дифторбромбензола, получают энантиомер А 1-[3-(2,6-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=482 (M+); m/z=151 (C9H5F2+) пик молекулярного иона. ИК-спектр (KBr): 2941, 1707, 1622, 1509, 1469, 1231, 1145, 1030, 1004, 830, 785 и 719 см-1.[]D20=-310,7 [метанол (с=0,5), 589 нм]. Пример 28. Энантиомер В 1-[3-(2,6-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 2,6-дифторбромбензола, получают энантиомер В 1-[3-(2,6-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=482 (M+); m/z=151 (C9H5F2+) пик молекулярного иона. ИК-спектр (KBr): 2941, 1707, 1622, 1509, 1469, 1231, 1145, 1030, 1004, 830, 785 и 719 см-1.[]D20=+31,70,9 [метанол (с=0,5), 589 нм]. Пример 29. Энантиомер А (левовращающий) 1-[2-(2,5-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-(2,5-дифторфенокси)этил]3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер А (левовращающий) 1-[2-(2,5-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде меренги белого цвета.[]D20=-17,50,7 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2930, 1709, 1622, 1514, 1231, 1205, 1159, 1029, 832 и 793 см-1. Масс-спектр (IC): m/z=489 (MH+); пик молекулярного иона. Метил-(.+-.)-1-[2-(2,5-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилат может быть получен согласно методике, описанной в примере 2, но исходя из 2-(2 бромэтокси)-1,4-дифторбензола. Получают масло желтого цвета. Масс-спектр (IE): m/z=502 (M+). 2-(2-Бромэтокси)-1,4-дифторбензол может быть получен согласно способу, описанному в международной заявке на патент WO 2002/40474-А 2. Пример 30. Энантиомер В (правовращающий) 1-[2-(2,5-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-(2,5-дифторфенокси)этил]3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер В (правовращающий) 1-[2-(2,5-дифторфенокси)этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета,плавящегося при температуре 157 С.[]D20=+22,60,7 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2930, 1709, 1622, 1514, 1231, 1205, 1159, 1029, 832 и 793 см-1. Масс-спектр (IE): m/z=488 (M+); 345 (M-C7H5OF2)+ (пик молекулярного иона). Пример 31. Энантиомер А (правовращающий) натриевой соли 3-[3-(3-хлор-6-метокси-4-хинолинил) пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоксилата, получают энантиомер А (правовращающий) натриевой соли 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре в интервале от 265 до 270 С.[]D20=+7,10,6 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2952, 2815, 1621, 1558, 1506, 1412, 1229, 1125, 1028, 828, 744 и 705 см-1. Масс-спектр (ES) (ионизация электронным распылением): m/z=491 (MH)+ пик молекулярного иона. Метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3 пирролидинкарбоксилат может быть получен согласно методике, описанной в примере 2, но исходя из 3 хлор-4-бром-6-метоксихинолина и 2-[(2-бромэтил)тио]тиофена. Получают бесцветное масло. Масс-спектр (IE): m/z=504 (M+). 3-Хлор-4-бром-6-метоксихинолин может быть получен согласно описанному в международной заявке на патент WO 2002/40474-А 2. Пример 32. Энантиомер В (левовращающий) натриевой соли 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоксилата, получают энантиомер В (левовращающий) натриевой соли 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-(2-тиенилтио)этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре в интервале от 269 до 271C.[]D20=-3,30,5 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2952, 2815, 1621, 1558, 1506, 1412, 1229, 1125, 1028, 828, 744 и 705 см-1. Масс-спектр (ES): m/z=491 (MH)+ пик молекулярного иона. Пример 33. Энантиомер А (правовращающий) 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-[(2,5 дифторфенил)тио]этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-[(2,5-дифторфенил)тио]этил]-3-пирролидинкарбоксилата, получают энантиомер А(правовращающий) 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-[(2,5-дифторфенил)тио]этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре 146 С.[]D20=+25,80,8 [метанол (с=0,5), 589 нм]. ИК-спектр (CH2Cl2): 2940, 1732, 1622, 1504, 1484, 1230, 1188, 1119 и 834 см-1. Масс-спектр (IC): m/z=521 (MH)+ пик молекулярного иона. Метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-[(2,5-дифторфенил)тио]этил]-3-пирролидинкарбоксилат может быть получен согласно методике, описанной в примере 2, но исходя из 3 хлор-4-бром-6-метоксихинолина и 2-[(2-бромэтил)тио]-1,4-дифторбензола. Получают масло цвета охры. Масс-спектр (IE): m/z=534 (M+). Пример 34. Энантиомер В (левовращающий) 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-[(2,5 дифторфенил)тио]этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-[(2,5-дифторфенил)тио]этил]-3-пирролидинкарбоксилата, получают энантиомер В (левовращающий) 3-[3-(3-хлор-6-метокси-4-хинолинил)пропил]-1-[2-[(2,5-дифторфенил)тио]этил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре 146C.[]D20=-20,40,8 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2953, 1707, 1620, 1504, 1483, 1231, 1188, 1118, 829 и 744 см-1. Масс-спектр (IC): m/z=521 (MH)+ пик молекулярного иона. Пример 35. Энантиомер А 1-[(2E)-3-(2,5-дихлорфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-1,4-дихлорбензола, получают энантиомер А 1-[(2E)-3-(2,5-дихлорфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=516 M+; m/z=481 (M-Cl)+ пик молекулярного иона. ИК-спектр (KBr): 2938, 1709, 1621, 1508, 1464, 1360, 1230, 1097, 1030, 969, 830, 811 и 785 см-1.[]D20=-21,20,6 [метанол (с=0,5), 589 нм]. Пример 36. Энантиомер В 1-[(2E)-3-(2,5-дихлорфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-1,4-дихлорбензола, получают энантиомер В 1-[(2 Е)-3-(2,5-дихлорфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества, плавящегося при температуре 102C. Масс-спектр (IE): m/z=516 M+; m/z=481 (M-Cl)+ пик молекулярного иона. ИК-спектр (KBr): 2938, 1709, 1621, 1508, 1464, 1360, 1230, 1097, 1030, 969, 830, 811 и 785 см-1.[]D20=+22 [метанол (с=0,5), 589 нм]. Пример 37. Энантиомер А натриевой соли 1-[(2E)-3-(3,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-3,5-дифторбензола, получают энантиомер А натриевой соли 1-[(2E)-3-(3,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6 метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=484 M+; m/z=153 (C9H7F2)+ пик молекулярного иона. ИК-спектр (KBr): 2928, 1706, 1621, 1591, 1509, 1469, 1322, 1231, 1119, 1030, 984 и 831 см-1.[]D20=-25,60,8 [метанол (с=0,5), 589 нм]. Пример 38. Энантиомер В 1-[(2E)-3-(3,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-3,5-дифторбензола, получают энантиомер В 1-[(2E)-3-(3,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=484 M+; m/z=153 (C9H7F2)+ пик молекулярного иона. ИК-спектр (KBr): 2928, 1706, 1621, 1591, 1509, 1469, 1322, 1231, 1119, 1030, 984 и 831 см-1.[]D20=+28,20,8 [метанол (с=0,5), 589 нм]. Пример 39. Энантиомер А 1-[3-(5-хлор-2-фторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 2-фтор-5-хлорбромбензола, получают энантиомер А 1-[3-(5-хлор-2-фторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IC): m/z=499 MH+ пик молекулярного иона. ИК-спектр (CCl4): 2936, 1704, 1622, 1508, 1487, 1469, 1259, 1232, 1218 и 832 см-1.[]D20=-27,30,9 [метанол (с=0,5), 589 нм]. Пример 40. Энантиомер В 1-[3-(5-хлор-2-фторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 2-фтор-5-хлорбромбензола, получают энантиомер В 1-[3-(5-хлор-2-фторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IC): m/z=499 MH+ пик молекулярного иона. ИК-спектр (KBr): 2942, 1707, 1621, 1509, 1486, 1469, 1260, 1231, 1145, 1085, 1030 и 830 см-1.[]D20=+29,61 [метанол (с=0,5), 589 нм]. Пример 41. Энантиомер А гидрохлорида 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,6 дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-2,6-дифторбензола, получают энантиомер А гидрохлорида 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,6 дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества, плавящегося при температуре 96 С. Масс-спектр (IE): m/z=484 M+; m/z=153 (C9H7F2)+ пик молекулярного иона. ИК-спектр (KBr): 2942, 2459, 1715, 1621, 1509, 1468, 1361, 1266, 1232, 990, 830 и 782 см-1.[]D20=-22,30,8 [метанол (с=0,5), 589 нм]. Пример 42. Энантиомер В 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(2,6-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-2,6-дифторбензола, получают энантиомер В 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[(2 Е)-3-(2,6-дифторфенил)2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества, плавящегося при температуре 88 С. Масс-спектр (IC): m/z=485 MH+ пик молекулярного иона. ИК-спектр (KBr): 2941, 1710, 1621, 1508, 1467, 1360, 1266, 1231, 1144, 989, 830 и 782 см-1.[]D20=+23,70,7 [метанол (с=0,5), 589 нм]. Пример 43. Энантиомер А 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[3-(3,4,5-трифторфенил)2-пропинил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 3,4,5-трифторбромбензола, получают энантиомер А 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[3-(3,4,5-трифторфенил)-2-пропинил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=500 M+; m/z=169 (C9H4F3)+ пик молекулярного иона. ИК-спектр (KBr): 2944, 1709, 1621, 1612, 1528, 1429, 1232, 1048, 858 и 830 см-1.- 23010403 Пример 44. Энантиомер В 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[3-(3,4,5-трифторфенил)2-пропинил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 3,4,5-трифторбромбензола, получают энантиомер В 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[3-(3,4,5-трифторфенил)-2-пропинил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=500 M+; m/z=169 (C9H4F3)+ пик молекулярного иона. ИК-спектр (KBr): 2944, 1709, 1621, 1612, 1528, 1429, 1232, 1048, 858 и 830 см-1.[]D20=+16,80,6 [метанол (с=0,5), 589 нм]. Пример 45. Энантиомер А 1-[(2E)-3-(5-хлор-2-фторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-2-фтор-5-хлорбензола, получают энантиомер А 1-[(2E)-3-(5-хлор-2-фторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IC): m/z=501 MH+ пик молекулярного иона. ИК-спектр (CCl4): 2936, 1707, 1621, 1508, 1482, 1231, 1033, 972, 832 и 649 см-1.[]D20=-17,40,6 [метанол (с=0,5), 589 нм]. Пример 46. Энантиомер В 1-[(2E)-3-(5-хлор-2-фторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-2-фтор-5-хлорбензола, получают энантиомер В 1-[(2E)-3-(5-хлор-2-фторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=500 M+, m/z=169 (C9H7ClF)+ пик молекулярного иона. ИК-спектр (CCl4): 2936, 1707, 1621, 1508, 1482, 1231, 1033, 972, 832 и 649 см-1.[]D20=+18,30,6 [метанол (с=0,5), 589 нм]. Пример 47. Энантиомер А 1-[(2E)-3-(2,3-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-2,3-дифторбензола, получают энантиомер А 1-[(2E)-3-(2,3-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IC): m/z=485 MH+ пик молекулярного иона. ИК-спектр (CCl4): 2936, 1706, 1622, 1508, 1484, 1264, 1231, 1032, 973, 832 и 713 см-1.[]D20=-21,10,6 [метанол (с=0,5), 589 нм]. Пример 48. Энантиомер В 1-[(2E)-3-(2,3-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-2,3-дифторбензола, получают энантиомер В 1-[(2E)-3-(2,3-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=484 M+ пик молекулярного иона; m/z=153 (C9H7F2)+. ИК-спектр (CCl4): 2936, 1706, 1622, 1508, 1484, 1264, 1231, 1032, 973, 832 и 713 см-1.[]D20=+21,50,7 [метанол (с=0,5), 589 нм]. Пример 49. Энантиомер А 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[(2 Е)-3-(3,4,5-трифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-3,4,5-трифторбензола, получают энантиомер А 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(3,4,5-трифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества, плавящегося при температуре 110 С. Масс-спектр (IE): m/z=502 M+; m/z=171 (C9H6F3)+ пик молекулярного иона. ИК-спектр (KBr): 2940, 1620, 1529, 1509, 1442, 1359, 1232, 1042, 970, 831 и 790 см-1.[]D20=+28,10,8 [метанол (с=0,5), 589 нм]. Пример 50. Энантиомер В 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(3,4,5-трифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из 2-2E)-3-хлор-2-пропенил)-3,4,5-трифторбензола, получают энантиомер В 3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1-[(2E)-3-(3,4,5-трифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества, плавящегося при температуре 148 С. Масс-спектр (IE): m/z=502 M+; m/z=171 (C9H6F3)+ пик молекулярного иона. ИК-спектр (KBr): 2940, 1620, 1529, 1509, 1442, 1359, 1232, 1042, 970, 831 и 790 см-1.[]D20=-19,40,6 [метанол (с=0,5), 589 нм]. Пример 51. Энантиомер А 1-[3-(2,3-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 2,3-дифторбромбензола, получают энантиомер А 1-[3-(2,3-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IC): m/z=483 MH+ пик молекулярного иона. ИК-спектр (KBr): 2941, 1706, 1621, 1584, 1509, 1489, 1473, 1231, 1146, 1030, 831, 784 и 716 см-1.[]D20=-25,10,8 [метанол (с=0,5), 589 нм]. Пример 52. Энантиомер В 1-[3-(2,3-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 2,3-дифторбромбензола, получают энантиомер В 1-[3-(2,3-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=482 M+; m/z=151 (C9H5F2)+ пик молекулярного иона. ИК-спектр (KBr): 2941, 1706, 1621, 1584, 1509, 1489, 1473, 1231, 1146, 1030, 831, 784 и 716 см-1.[]D20=+27,20,9 [метанол (с=0,5), 589 нм]. Пример 53. Энантиомер А 1-[3-(3,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 3,5-дифторбромбензола, получают энантиомер А 1-[3-(3,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=482 M+; m/z=151 (C9H5F2)+ пик молекулярного иона. ИК-спектр (KBr): 2937, 1708, 1619, 1586, 1509, 1470, 1430, 1231, 1122, 1030, 990, 857, 831 и 672 см-1.[]D20=-19,40,7 [метанол (с=0,5), 589 нм]. Пример 54. Энантиомер В 1-[3-(3,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 3,5-дифторбромбензола, получают энантиомер В 1-[3-(3,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IE): m/z=482 M+; m/z=151 (C9H5F2)+ пик молекулярного иона. ИК-спектр (KBr): 2937, 1708, 1619, 1586, 1509, 1470, 1430, 1231, 1122, 1030, 990, 857, 831 и 672 см-1.[]D20=+27,71 [метанол (с=0,5), 589 нм]. Пример 55. Энантиомер А 1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 2,5-дихлорбромбензола, получают энантиомер А 1-[3-(2,5-дифторфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IC): m/z=515 MH+ пик молекулярного иона. ИК-спектр (KBr): 2928, 1709, 1621, 1509, 1468, 1231, 1096, 1031, 830, 786 и 600 см-1.[]D20=-22,50, 9 [метанол (с=0,5), 589 нм]. Пример 56. Энантиомер В 1-[3-(2,5-дихлорфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 23, но исходя из 2,5-дихлорбромбензола, получают энантиомер В 1-[3-(2,5-дихлорфенил)-2-пропинил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества. Масс-спектр (IC): m/z=515 MH+; m/z=287 (C17H20N2OF)+ пик молекулярного иона. ИК-спектр (KBr): 2928, 1709, 1621, 1509, 1468, 1231, 1096, 1031, 830, 786 и 600 см-1.[]D20=+27,50,9 [метанол (с=0,5), 589 нм]. Пример 57. Энантиомер А (правовращающий) 1-[2-[(2,6-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-[(2,6-дифторфенил)тио] этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер А(правовращающий) 1-[2-[(2,6-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре 106C.[]D20=+29,10,7 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2940, 1704, 1621, 1606, 1509, 1463, 1233, 1144, 990, 830 и 785 см-1. Масс-спектр (IE): m/z=504 (M+); 345 (M-C7H5F2S)+ пик молекулярного иона. Метил-(.+-.)-1-[2-[(2,6-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилат может быть получен согласно методике, описанной в примере 2, но исходя из 2-[(2- 25010403 бромэтил)тио]-1,3-дифторбензола. Получают масло бледно-желтого цвета. Масс-спектр (IE): m/z=518 (M+). 2-[(2-Бромэтил)тио]-1,3-дифторбензол может быть получен по способу, описанному в международной заявке на патент WO 2002/40474-А 2. Пример 58. Энантиомер В (левовращающий) 1-[2-[(2,6-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-[(2,6-дифторфенил)тио] этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер В(левовращающий) 1-[2-[(2,6-дифторфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре 86 С.[]D20=-29,30,8 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2940, 1704, 1621, 1606, 1509, 1463, 1233, 1144, 990, 830 и 785 см-1. Масс-спектр (IC): m/z=505 (MH+) пик молекулярного иона. Пример 59. Энантиомер А (правовращающий) 1-[2-[(2,5-дихлорфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-[(2,5-дихлорфенил)тио] этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер А(правовращающий) 1-[2-[(2,5-дихлорфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре 79 С.[]D20=+22,30,7 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2939, 1706, 1621, 1569, 1509, 1450, 1362, 1230, 1141, 1095, 1034, 830, 806 и 575 см-1. Масс-спектр (ES): m/z=537 (MH+) пик молекулярного иона. Метил-(.+-.)-1-[2-[(2,5-дихлорфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилат может быть получен согласно методике, описанной в примере 2, но исходя из 2-[(2 бромэтил)тио]-1,4-дихлорбензола. Получают масло бледно-желтого цвета. Масс-спектр (IE): m/z=550 (M+). 2-[(2-Бромэтил)тио]-1,4-дихлорбензол может быть получен по способу, описанному в международной заявке на патент WO 2002/40474-А 2. Пример 60. Энантиомер В (левовращающий) 1-[2-[(2,5-дихлорфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-[(2,5-дихлорфенил)тио] этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер В(левовращающий) 1-[2-[(2,5-дихлорфенил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре 67 С.[]D20=-22,60,7 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2939, 1706, 1621, 1569, 1509, 1450, 1362, 1230, 1141, 1095, 1034, 830, 806 и 575 см-1. Масс-спектр (IC): m/z=537 (MH+) пик молекулярного иона. Примеры 61 и 62. Диастереоизомеры А (правовращающий) и С (левовращающий) натриевой соли 1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3 пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). 1-[(2E)-3-(2,5-Дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]3-пирролидинкарбоновую кислоту (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в количестве 0,370 г вводят в колонку диаметром 6 см и длиной 30 см, содержащую 600 г неподвижной хиральной фазы CHIROBIOTIC TM гранулометрической фракции 10 мкм. Элюирование осуществляют с помощью подвижной фазы [Н 2 О-тетрагидрофуран-триэтиламин-уксусная кислота(80:15:0,15:0,05 по объемам)] с расходом 100 мл/мин, детектирование осуществляют с помощью УФ-детектора при длине волны 254 нм. Диастереоизомер А (правовращающий), абсолютная конфигурация которого не определена, элюируемый в первую очередь, выделяют, затем концентрируют в вакууме, получая 0,150 г порошка белого цвета. Этот порошок затем очищают при использовании той же самой колонки, элюируя с помощью подвижной фазы [метанол-триэтиламин-уксусная кислота (100:0,05:0,05)] с расходом 100 мл/мин. Диастереоизомер А (правовращающий), абсолютная конфигурация которого не определена, элюируемый в первую очередь, выделяют, затем концентрируют в вакууме, получая 0,060 г меренги белого цвета.[]D20=+54,51,2 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 3428, 2959, 1622, 1591, 1509, 1491, 1429, 1355, 1231, 1148, 1029, 975, 830 и 728 см-1. Масс-спектр (ES): m/z=501 (MH)+. Диастереоизомер С (левовращающий), абсолютная конфигурация которого не определена, элюируемый во вторую очередь, выделяют, затем концентрируют в вакууме, получая 0,080 г меренги белого цвета.[]D20=-24,60,8 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 3415, 2955, 1622, 1591, 1509, 1491, 1429, 1355, 1231, 1199, 1030, 975, 830 и 728 см-1. Масс-спектр (ES): m/z=501 (MH)+. 1-[(2E)-3-(2,5-Дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]3-пирролидинкарбоновая кислота (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) может быть получена согласно методике, описываемой в примерах 64 и 65, но исходя из энантиомера А 1-(1,1-диметилэтил)- и (3-метил)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1,3-пирролидиндикарбоксилата (абсолютная конфигурация не определена); получают масло желтого цвета. Масс-спектр (IE): m/z=500 (M+). Примеры 63 и 64. Диастереоизомеры В (левовращающий) и D (правовращающий) натриевой соли 1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3 пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примерах 61 и 62, но исходя из натриевой соли 1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновой кислоты (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации), получают следующее. Диастереоизомер В (левовращающий), абсолютная конфигурация которого не определена, элюируемый в первую очередь, выделяют, затем концентрируют в вакууме, получая 0,130 г меренги белого цвета.[]D20=-53,11,0 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 3414, 2938, 1622, 1591, 1509, 1491, 1429, 1354, 1230, 1198, 1029, 974, 830 и 728 см-1. Масс-спектр (ES): m/z=501 (MH)+. Диастереоизомер D (правовращающий), абсолютная конфигурация которого не определена, элюируемый во вторую очередь, выделяют, затем концентрируют в вакууме, получая 0,100 г меренги белого цвета.[]D20=+24,80,7 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 3397, 2958, 1622, 1591, 1509, 1491, 1429, 1355, 1230, 1199, 1029, 975, 831 и 728 см-1. Масс-спектр (ES): m/z=501 (MH)+. Натриевая соль 1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3 гидроксипропил]-3-пирролидинкарбоновой кислоты (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) может быть получена следующим образом. К 0,56 г (1,088 ммоль) метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4 хинолинил)-3-гидроксипропил]-3-пирролидинкарбоксилата (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в виде раствора в 120 см 3 диоксана при температуре около 20 С добавляют 9,14 см 3 5 н. водного раствора гидроксида натрия. После перемешивания в течение 16 ч при кипении с обратным холодильником реакционную смесь охлаждают, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 50 см 3 воды. Значение рН доводят до величины около 7 добавлением 1 н. соляной кислоты. Водную фазу концентрируют досуха при пониженном давлении (2,7 кПа), получая 7 г остатка, который обрабатывают 50 см 3 метанола. Суспендированный NaCl отфильтровывают. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа),получая 1,2 г твердого вещества бледно-желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан-метанол (80:20 по объемам)+0,5% NH4OH]. После концентрирования фракций при пониженном давлении получают 0,464 г натриевой соли 1-[(2 Е)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3 фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновой кислоты (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в виде меренги бледно-желтого цвета. Масс-спектр (IE): m/z=522 (M+). Метил-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-[3-(3-фтор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоксилат (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) может быть получен, как описывается в примерах 71 и 72, но исходя из энантиомера В 1(1,1-диметилэтил)- и метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1,3-пирролидиндикарбоксилата (абсолютная конфигурация не определена); получают масло желтого цвета, которое затвердевает. Масс-спектр (IE): m/z=500 (M+). Энантиомеры А и В 1-(1,1-диметилэтил)- и метил-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1,3 пирролидиндикарбоксилата (абсолютная конфигурация не определена) могут быть получены следующим образом. 2,55 г 1-(1,1-диметилэтил)- и метил-(.+-.)-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-1,3-пирролидиндикарбоксилата вводят в колонку диаметром 8 см и длиной 30 см, содержащую 1200 г неподвижной хиральной фазы WHELK OI, SS TM гранулометрической фракции 10 мкм. Элюирование осуществляют с помощью подвижной фазы [гептан/метил-трет-бутиловый эфир/этанол/триэтиламин (76:20:2:2:0,1 по объемам] с расходом 140 мл/мин; детектирование осуществляют с помощью УФ-детектора при длине волны 254 нм. Энантиомер А (правовращающий), абсолютная конфигурация которого не определена, элюируемый в первую очередь, выделяют, затем концентрируют в вакууме, получая 1,15 г бесцветного масла.[]D20=+23,60,9 [метанол (с=0,5), 589 нм]. Масс-спектр (IE): m/z=460 (M+); 359 (M-C5H9O2)+; 57 (C4H9+). Энантиомер В (левовращающий), абсолютная конфигурация которого не определена, элюируемый во вторую очередь, выделяют, затем концентрируют в вакууме, получая 1,25 г бесцветного масла.[]D20=-21,40,8 [метанол (с=0,5), 589 нм]. Масс-спектр (IE): m/z=460 (M+); 359 (M-C5H9O2)+; 57 (C4H9+). Пример 65. Энантиомер А (левовращающий) натриевой соли 1-[3-[(2,5-дифторфенил)тио]пропил]3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[3-[(2,5-дифторфенил)тио] пропил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер А (левовращающий) натриевой соли 1-[3-[(2,5-дифторфенил)тио]пропил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре в интервале от 110 до 113 С.[]D20=-17,80,6 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2955, 1620, 1509, 1483, 1230, 1188, 1032, 908, 825, 810, 785 и 757 см-1. Масс-спектр (IC): m/z=519 (MH+) пик молекулярного иона. Метил-(.+-.)-1-[3-[(2,5-дифторфенил)тио]пропил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоксилат может быть получен согласно методике, описанной в примере 2, но исходя из 2[(3-бромпропил)тио]-1,4-дифторбензола. Получают масло оранжевого цвета. Масс-спектр (IE): m/z=532 (M+). 2-[(3-Бромпропил)тио]-1,4-дифторбензол может быть получен способом, описанным в международной заявке на патент WO 2002/40474-А 2. Пример 66. Энантиомер В (правовращающий) натриевой соли 1-[3-[(2,5-дифторфенил)тио]пропил]3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[3-[(2,5-дифторфенил)тио] пропил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер В (правовращающий) натриевой соли 1-[3-[(2,5-дифторфенил)тио]пропил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета, плавящегося при температуре в интервале от 121 до 123 С.[]D20=+18,80,8 [метанол (с=0,5), 589 нм]. ИК-спектр (KBr): 2955, 1620, 1509, 1483, 1230, 1188, 1032, 908, 825, 810, 785 и 757 см-1. Масс-спектр (ES): m/z=519 (MH+) пик молекулярного иона. Пример 67. 1-[2-[(2-Пиридинил)тио]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновая кислота (абсолютная конфигурация не определена). Следуя методикам, описанным в примерах 1 и 2, но исходя из 2-[(2-бромэтил)тио]пиридина, получают масло оранжевого цвета. Масс-спектр (ES): m/z=470 (MH+) пик молекулярного иона. 2-[(2-Бромэтил)тио]пиридин может быть получен по способу, описанному в международной заявке на патент WO 2002/40474-А 2. Пример 68. Энантиомер А (правовращающий) 1-[2-[(2,5-дифторфенил)амино]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-[(2,5-дифторфенил)амино] этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер А(правовращающий) 1-[2-[(2,5-дифторфенил)амино]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета.[]D20=+28,50,7 [дихлорметан (с=0,5), 589 нм]. ИК-спектр (KBr): 2929, 1635, 1621, 1531, 1510, 1231, 1187, 1030, 830 и 786 см-1. Масс-спектр (ES): m/z=488 (MH+) пик молекулярного иона. Метил-(.+-.)-1-[2-[(2,5-дифторфенил)амино]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоксилат может быть получен следующим образом. К 1,9 г (2,77 ммоль) метил-1-[2-[(2,5-дифторфенил)-[(2-нитрофенил)сульфонил]амино]этил]-3-[3-(3 фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в виде раствора в 60 см 3 диметилформамида при температуре около 20 С и в атмосфере аргона добавляют 1,65 см 3 1,8-диазабицикло[5,4,0]ундец-7-ена (DBU) и 1,16 см 3 меркаптоэтанола. После перемешивания в течение 5 ч при температуре около 20 С реакционную смесь выливают в 600 см 3 воды, затем экстрагируют 4 раза по 200 см 3 дихлорметана. Органические фазы объединяют, промывают 200 см 3 воды, сушат над безводным сульфатом магния,фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,67 г масла желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан-метанол (95:5 по объемам)]. После- 28010403 концентрирования фракций при пониженном давлении получают 1,58 г масла желтого цвета, которое снова очищают флэш-хроматографией [элюент: дихлорметан-этилацетат (9:1 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,76 г метил-(.+-.)-1-[2-[(2,5-дифторфенил) амино]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата в виде масла бледно-желтого цвета. Масс-спектр (IE): m/z=501 (M+). Метил-1-[2-[(2,5-дифторфенил)-[(2-нитрофенил)сульфонил]амино]этил]-3-[3-(3-фтор-6-метокси-4 хинолинил)пропил]-3-пирролидинкарбоксилат может быть получен по методике, описанной в примере 2,но исходя из N-(2-бромэтил)-N-(2,5-дифторфенил)-2-нитробензолсульфонамида. Получают масло бледно-желтого цвета. Масс-спектр (IC): m/z=687 (MH+).N-(2-Бромэтил)-N-(2,5-дифторфенил)-2-нитробензолсульфонамид может быть получен способом,описанным в международной заявке на патент WO 2002/40474-А 2. Пример 69. Энантиомер В (правовращающий) 1-[2-[(2,5-дифторфенил)амино]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). Следуя методике, описанной в примере 3, но исходя из метил-(.+-.)-1-[2-[(2,5-дифторфенил)амино] этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3-пирролидинкарбоксилата, получают энантиомер В(правовращающий) 1-[2-[(2,5-дифторфенил)амино]этил]-3-[3-(3-фтор-6-метокси-4-хинолинил)пропил]-3 пирролидинкарбоновой кислоты (абсолютная конфигурация не определена) в виде твердого вещества белого цвета.[]D20=-40,50,9 [дихлорметан (с=0,5), 589 нм]. ИК-спектр (KBr): 2929, 1635, 1621, 1531, 1510, 1231, 1187, 1030, 830 и 786 см-1. Масс-спектр (ES): m/z=488 (MH+) пик молекулярного иона. Примеры 70 и 71. Диастереоизомеры А (правовращающий) и С (левовращающий) 3-[3-(3-хлор-6 метокси-4-хинолинил)-3-гидроксипропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (абсолютная конфигурация не определена). 3-[3-(3-Хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1-[(2E)-3-(2,5-дифторфенил)-2-пропенил]3-пирролидинкарбоковую кислоту (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в количестве 0,367 г вводят в колонку диаметром 6 см и длиной 30 см, содержащую 600 г неподвижной хиральной фазы CHIROBIOTIC TM гранулометрической фракции 10 мкм. Элюирование осуществляют с помощью подвижной фазы [H2O-тетрагидрофуран-триэтиламин-уксусная кислота(80:15:0,1:0,1 по объемам)] с расходом 90 мл/мин; детектирование осуществляют с помощью УФ-детектора при длине волны 254 нм. Диастереоизомер А (правовращающий), абсолютная конфигурация которого не определена, элюируемый в первую очередь, выделяют, затем концентрируют в вакууме, получая 0,161 г бесцветного масла.[]D20=+63,71,7 [метанол (с=0,5), 589 нм]. ИК-спектр (CH2Cl2): 3593, 1718, 1621, 1503, 1491, 1421, 1355, 1231, 1185, 1117, 1068, 1036, 975 и 835 см-1. Масс-спектр (ES): m/z=517 (MH)+. Диастереоизомер С (левовращающий), абсолютная конфигурация которого не определена, элюируемый во вторую очередь, выделяют, затем концентрируют в вакууме, получая 0,0137 г бесцветного масла.[]D20=отрицательный знак в метаноле [метанол (с=0,5), 589 нм]. ИК-спектр (CH2Cl2): 3587, 1723, 1621, 1503, 1491, 1421, 1355, 1231, 1117, 975, 897 и 836 см-1. Масс-спектр (ES): m/z=517 (MH)+. 3-[3-(3-Хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1-[3-(2,5-дифторфенил)-2-пропенил]-3 пирролидинкарбоновая кислота (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) может быть получена следующим образом. К 0,51 г (1,165 ммоль) дигидрохлорида 3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-3 пирролидинкарбоновой кислоты (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в виде раствора в 25 см 3 дихлорметана при температуре около 20 С и в атмосфере аргона добавляют 0,354 г триэтиламина, 0,74 г триацетоксиборгидрида натрия и раствор 0,294 г (E)-3-(2,5-дифторфенил)пропеналя. После перемешивания в течение 2 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,82 г остатка, который очищают флэш-хроматографией [элюент: хлороформ-метанол-28%-ный водный раствор NH4OH (12:2,25:0,38 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,42 г 3-[3-(3-хлор-6 метокси-4-хинолинил)-3-гидроксипропил]-1-[3-(2,5-дифторфенил)-2-пропенил]-3-пирролидинкарбоновой кислоты (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в виде масла желтого цвета. Масс-спектр (IE): m/z=516 (M+). Дигидрохлорид 3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновой кислоты (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) может быть получен следующим образом.- 29010403 К 0,604 г (1,3 ммоль) 1,1-диметилэтил-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-3 пирролидиндикарбоксилата (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в виде раствора в 20 см 3 диоксана при температуре около 20 С добавляют 16 см 3 4 н. раствора хлороводорода в диоксане. После перемешивания в течение 48 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,64 г твердого вещества желтого цвета, которое растирают 10 см 3 диэтилового эфира. После отфильтровывания твердое вещество промывают 10 см 3 диэтилового эфира, затем высушивают при пониженном давлении (2,7 кПа), получая 0,6 г дигидрохлорида 3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-3-пирролидинкарбоновой кислоты (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в виде твердого вещества желтого цвета. Масс-спектр (IE): m/z=437 (M+). 1-(1,1-Диметилэтил)-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1,3-пирролидиндикарбоксилат (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) может быть получен следующим образом. В раствор 2,3 г (5,12 ммоль) энантиомера А 1-(1,1-диметилэтил)-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1,3-пирролидиндикарбоксилата (абсолютная конфигурация не определена) в 185 см 3 диметилсульфоксида при температуре около 20 С барботируют кислород в течение 20 мин вплоть до насыщения. Затем добавляют 1,32 г (11,78 ммоль) трет-бутилата калия в виде раствора в 84 мл трет-бутанола. Снова барботируют кислород в течение 5 ч. Реакционную смесь охлаждают до температуры около 0 С. Добавляют по каплям 540 см 3 воды, поддерживая температуру около 20 С, значение рН доводят до 5-6 путем добавления 1,5 см 3 уксусной кислоты, после чего добавляют 250 см 3 воды. Реакционную смесь экстрагируют 4 раза по 250 см 3 дихлорметана. Органические фазы объединяют, промывают 250 см 3 воды, сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 3,14 г масла желтого цвета, которое обрабатывают 40 см 3 диэтилового эфира. Эфирную фазу промывают 2 раза по 20 см 3 воды, сушат над безводным сульфатом магния,фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,27 г 1-(1,1-диметилэтил)-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1,3-пирролидиндикарбоксилата (смесь 2 диастереоизомеров А и С неустановленной абсолютной конфигурации) в виде меренги бледно-желтого цвета. Масс-спектр (IE): m/z=464 (M+). Энантиомер А 1-(1,1-диметилэтил)-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1,3 пирролидиндикарбоксилата (абсолютная конфигурация не определена) может быть получен следующим образом. К 2,78 г (6 ммоль) энантиомера А 1-(1,1-диметилэтил)- и (3-метил)-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1,3-пирролидиндикарбоксилата (абсолютная конфигурация не определена) в виде раствора в 230 см 3 диоксана при температуре около 20 С добавляют 50 см 3 5 н. водного раствора гидроксида натрия. После перемешивания в течение 18 ч при кипении с обратным холодильником реакционную смесь охлаждают, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 700 см 3 воды. Значение рН доводят до примерно 4 добавлением лимонной кислоты. После выдерживания в течение 4 ч при температуре около 20 С суспензию фильтруют,твердое вещество промывают 3 раза по 50 см 3 диизопропилового эфира, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 43 С, получая 2,3 г энантиомера А 1-(1,1-диметилэтил)-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1,3-пирролидиндикарбоксилата (абсолютная конфигурация не определена) в виде твердого вещества белого цвета. Масс-спектр (IE): m/z=448 (M+). Энантиомеры А и В 1-(1,1-диметилэтил)- и (3-метил)-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1,3-пирролидиндикарбоксилата (абсолютная конфигурация не определена) могут быть получены следующим образом. 1-(1,1-Диметилэтил)- и (3-метил)-(.+-.)-3-[3-(3-хлор-6-метокси-4-хинолинил)-3-гидроксипропил]-1,3 пирролидиндикарбоксилат в количестве 2,55 г вводят в колонку диаметром 6 см и длиной 30 см, содержащую 800 г неподвижной хиральной фазы WHELK OI, SS TM гранулометрической фракции 10 мкм. Элюирование осуществляют с помощью подвижной фазы [гептан/метил-трет-бутиловый эфир/метанол/ изопропанол/триэтиламин (74:20:1:4:0,1 по объемам)] с расходом 120 мл/мин; детектирование осуществляют с помощью УФ-детектора при длине волны 254 нм. Энантиомер А (правовращающий), абсолютная конфигурация которого не определена, элюируемый в первую очередь, выделяют, затем концентрируют в вакууме, получая 0,46 г бесцветного масла. Масс-спектр (IE): m/z=462 (M+); 361 (M-C5H9O2)+, 57 (C4H9+).[]D20=+18,80,6 [метанол (с=0,5), 589 нм]. Энантиомер В (левовращающий), абсолютная конфигурация которого не определена, элюируемый во вторую очередь, выделяют, затем концентрируют в вакууме, получая 0,217 г бесцветного масла.
МПК / Метки
МПК: C07D 409/14, C07D 401/06, C07D 413/06
Метки: 4-замещённых, хинолинов, способ, содержащие, продукты, фармацевтические, композиции, производные, промежуточные, получения
Код ссылки
<a href="https://eas.patents.su/30-10403-proizvodnye-4-zameshhyonnyh-hinolinov-sposob-i-promezhutochnye-produkty-dlya-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-замещённых хинолинов, способ и промежуточные продукты для их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Усовершенствованные электрические кабели ствола скважины
Следующий патент: Сверхзагрузка липосом для доставки лекарственных веществ
Случайный патент: Соединения тетрагидроциклопента[b]индола в качестве модуляторов рецептора андрогенов












