Способ получения производных 2-оксо-1-пирролидина внутримолекулярным аллилированием
Формула / Реферат
1. Способ получения соединений общей формулы (I)
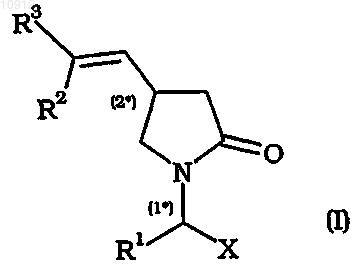
где R2 и R3 являются одинаковыми или различными и каждый независимо означает водород, С1-С4алкил, циано, арил, -COOR7, галоген, R8COO-, R9SO3O- или R10SO2O-,
R1 означает Ra, Rb или С2-С20алкенил, необязательно замещенный арилом,
X означает -CONR11R12, -COOR13 или -CN,
R7, R8, R9 и R10, каждый независимо, выбирают из группы, включающей водород, Ra' или Rb',
R11, R12 и R13 являются одинаковыми или различными и каждый независимо означает водород, С1-С4алкил, арил, арилалкил, гетероарил или гетероциклоалкил,
Ra и Ra', каждый независимо, означает С1-С20алкил или С1-С20алкил, замещенный одним или более атомами галогена, группами гидрокси, тиол, амино, нитро, циано, тиоцианато, карбокси, сульфоновая кислота, Rb, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкокси, арилокси, сульфонамид, ацил, сложный эфир, амидо, азидо, ацилокси, сложный оксиэфир и/или амидоокси,
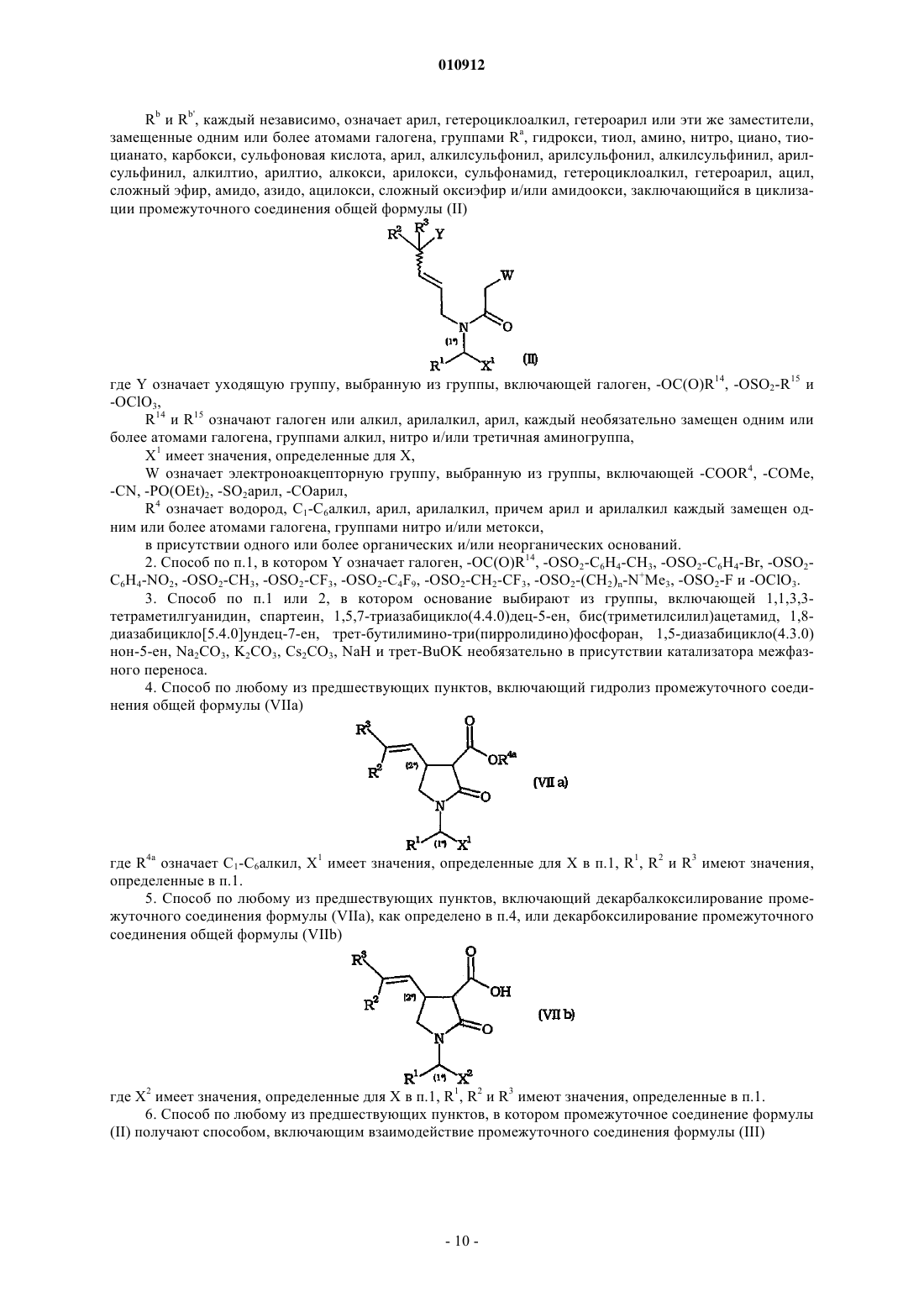
Rb и Rb', каждый независимо, означает арил, гетероциклоалкил, гетероарил или эти же заместители, замещенные одним или более атомами галогена, группами Ra, гидрокси, тиол, амино, нитро, циано, тиоцианато, карбокси, сульфоновая кислота, арил, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкокси, арилокси, сульфонамид, гетероциклоалкил, гетероарил, ацил, сложный эфир, амидо, азидо, ацилокси, сложный оксиэфир и/или амидоокси, заключающийся в циклизации промежуточного соединения общей формулы (II)
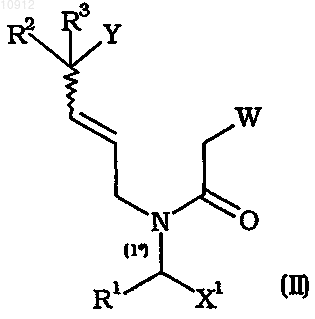
где Y означает уходящую группу, выбранную из группы, включающей галоген, -OC(O)R14, -OSO2-R15 и
-OClO3,
R14 и R15 означают галоген или алкил, арилалкил, арил, каждый необязательно замещен одним или более атомами галогена, группами алкил, нитро и/или третичная аминогруппа,
X1 имеет значения, определенные для X,
W означает электроноакцепторную группу, выбранную из группы, включающей -COOR4, -COMe,
-CN, -PO(OEt)2, -SO2арил, -СОарил,
R4 означает водород, C1-С6алкил, арил, арилалкил, причем арил и арилалкил каждый замещен одним или более атомами галогена, группами нитро и/или метокси,
в присутствии одного или более органических и/или неорганических оснований.
2. Способ по п.1, в котором Y означает галоген, -OC(O)R14, -OSO2-C6H4-СН3, -OSO2-C6H4-Br, -OSO2-C6H4-NO2, -OSO2-CH3, -OSO2-CF3, -OSO2-C4F9, -OSO2-CH2-CF3, -OSO2-(CH2)n-N+Me3, -OSO2-F и -OClO3.
3. Способ по п.1 или 2, в котором основание выбирают из группы, включающей 1,1,3,3-тетраметилгуанидин, спартеин, 1,5,7-триазабицикло(4.4.0)дец-5-ен, бис(триметилсилил)ацетамид, 1,8-диазабицикло[5.4.0]ундец-7-ен, трет-бутилимино-три(пирролидино)фосфоран, 1,5-диазабицикло(4.3.0) нон-5-ен, Na2CO3, K2CO3, Cs2CO3, NaH и трет-BuOK необязательно в присутствии катализатора межфазного переноса.
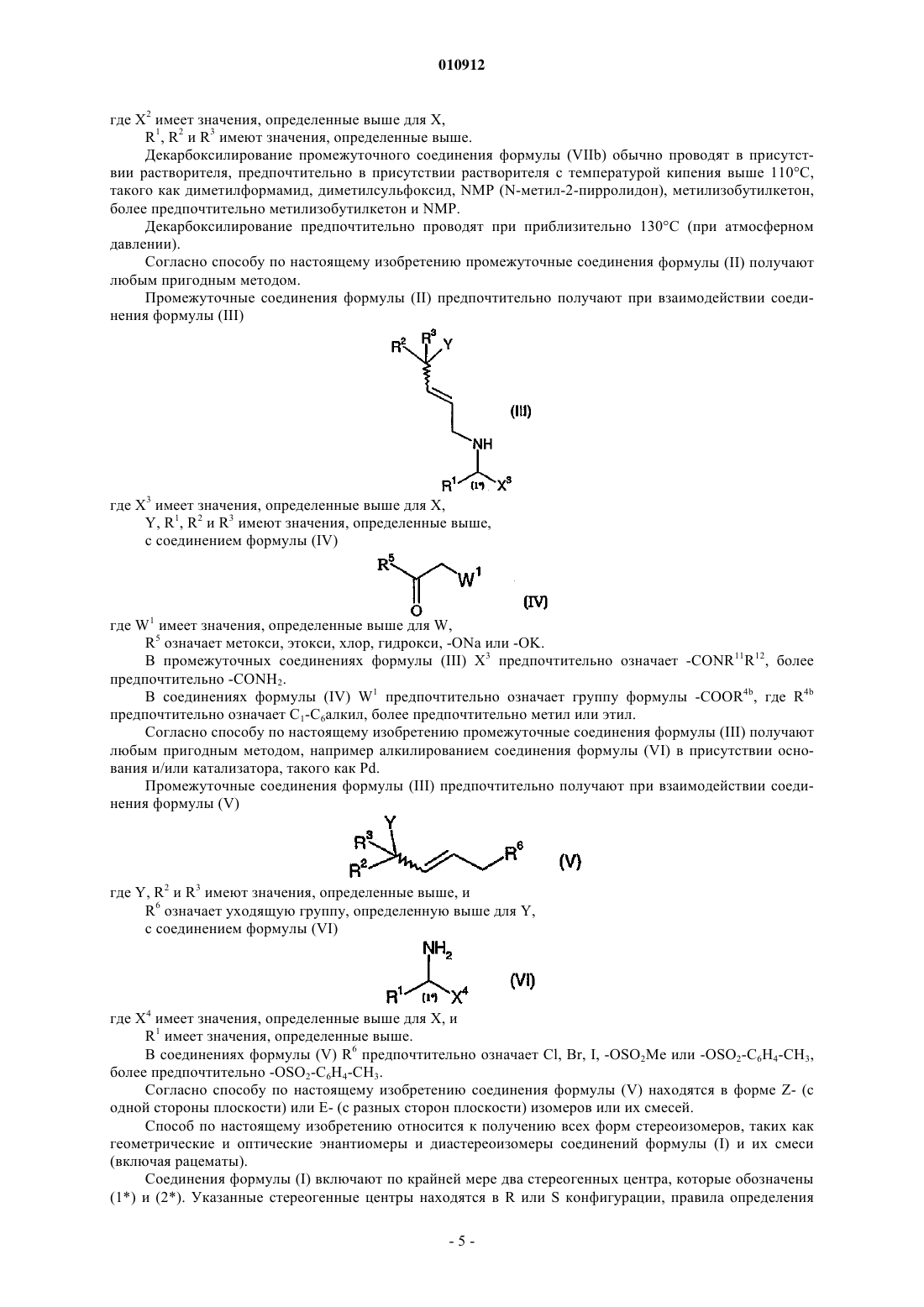
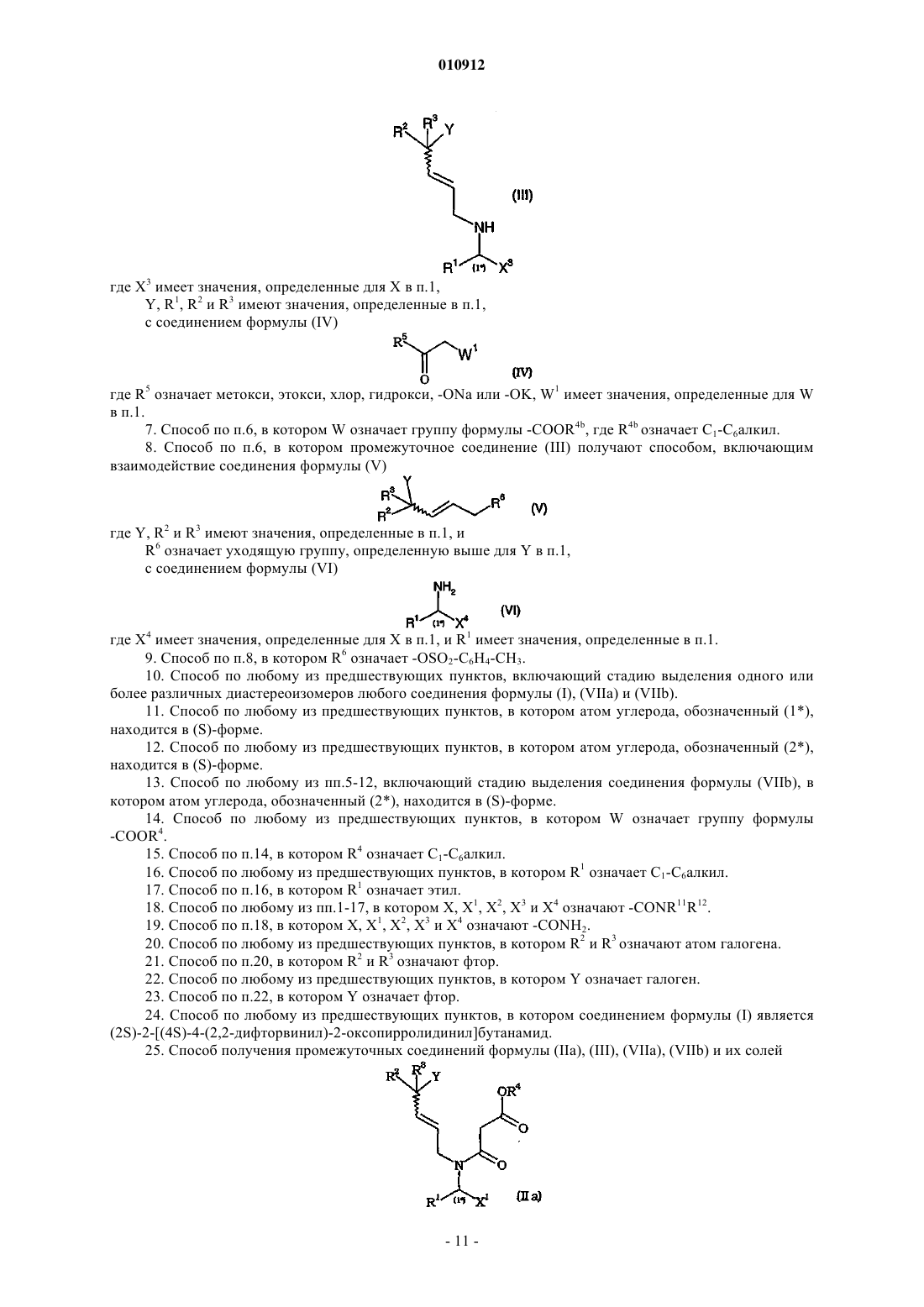
4. Способ по любому из предшествующих пунктов, включающий гидролиз промежуточного соединения общей формулы (VIIа)
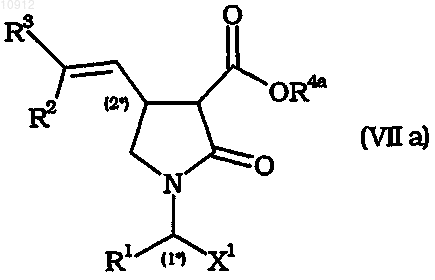
где R4a означает С1-С6алкил, X1 имеет значения, определенные для X в п.1, R1, R2 и R3 имеют значения, определенные в п.1.
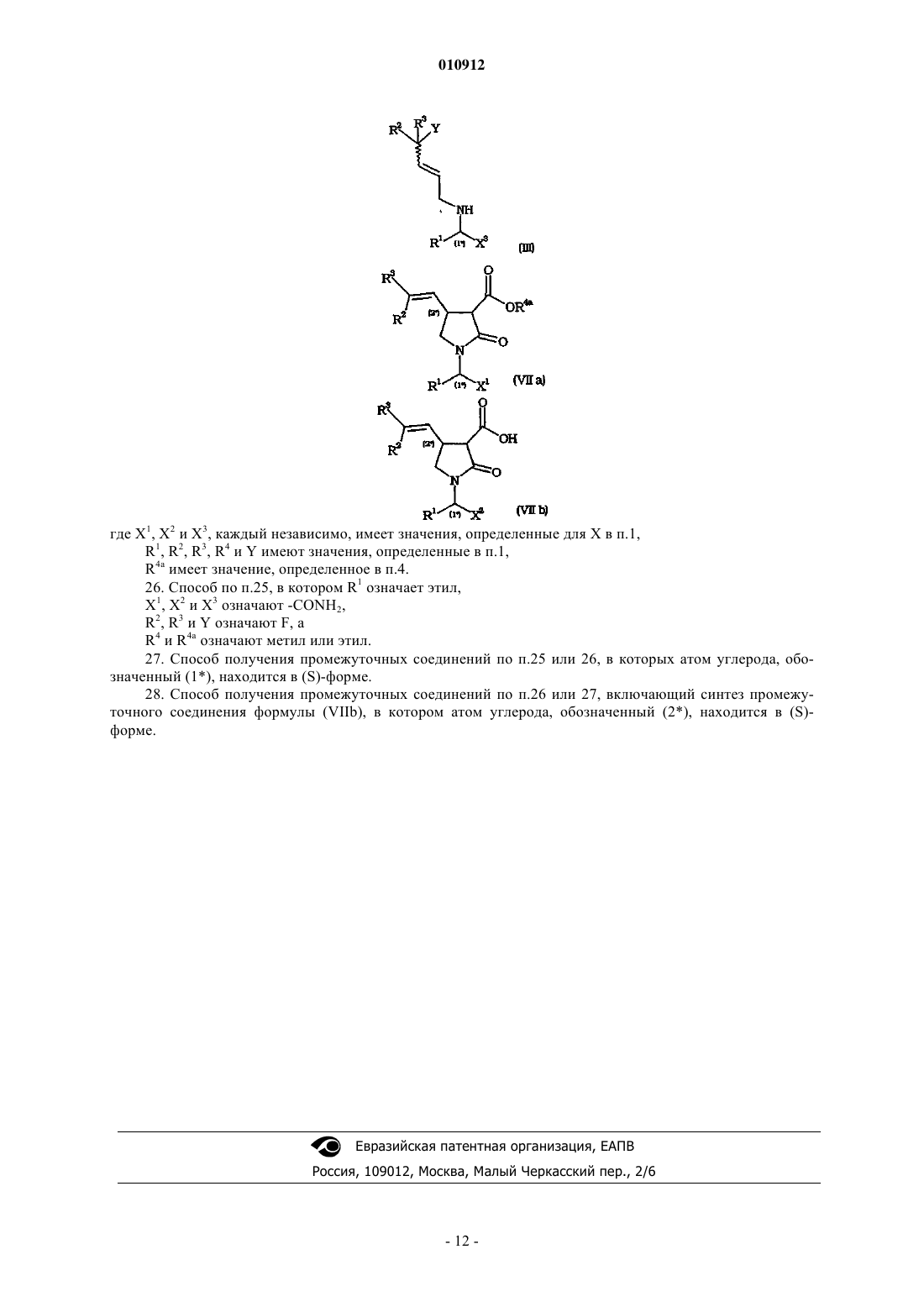
5. Способ по любому из предшествующих пунктов, включающий декарбалкоксилирование промежуточного соединения формулы (VIIа), как определено в п.4, или декарбоксилирование промежуточного соединения общей формулы (VIIb)

где X2 имеет значения, определенные для X в п.1, R1, R2 и R3 имеют значения, определенные в п.1.
6. Способ по любому из предшествующих пунктов, в котором промежуточное соединение формулы (II) получают способом, включающим взаимодействие промежуточного соединения формулы (III)
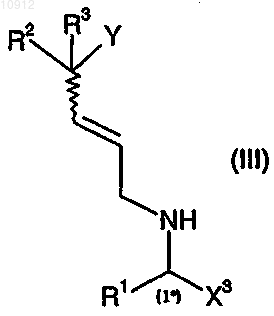
где X3 имеет значения, определенные для X в п.1,
Y, R1, R2 и R3 имеют значения, определенные в п.1,
с соединением формулы (IV)
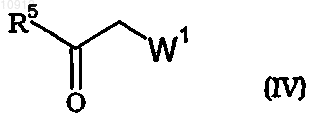
где R5 означает метокси, этокси, хлор, гидрокси, -ONa или -OK, W1 имеет значения, определенные для W в п.1.
7. Способ по п.6, в котором W означает группу формулы -COOR4b, где R4b означает С1-С6алкил.
8. Способ по п.6, в котором промежуточное соединение (III) получают способом, включающим взаимодействие соединения формулы (V)
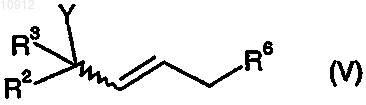
где Y, R2 и R3 имеют значения, определенные в п.1, и
R6 означает уходящую группу, определенную выше для Y в п.1,
с соединением формулы (VI)
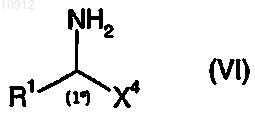
где X4 имеет значения, определенные для X в п.1, и R1 имеет значения, определенные в п.1.
9. Способ по п.8, в котором R6 означает -OSO2-C6H4-CH3.
10. Способ по любому из предшествующих пунктов, включающий стадию выделения одного или более различных диастереоизомеров любого соединения формулы (I), (VIIа) и (VIIb).
11. Способ по любому из предшествующих пунктов, в котором атом углерода, обозначенный (1*), находится в (S)-форме.
12. Способ по любому из предшествующих пунктов, в котором атом углерода, обозначенный (2*), находится в (S)-форме.
13. Способ по любому из пп.5-12, включающий стадию выделения соединения формулы (VIIb), в котором атом углерода, обозначенный (2*), находится в (S)-форме.
14. Способ по любому из предшествующих пунктов, в котором W означает группу формулы
-COOR4.
15. Способ по п.14, в котором R4 означает C1-С6алкил.
16. Способ по любому из предшествующих пунктов, в котором R1 означает C1-С6алкил.
17. Способ по п.16, в котором R1 означает этил.
18. Способ по любому из пп.1-17, в котором X, X1, X2, Х3 и X4 означают -CONR11R12.
19. Способ по п.18, в котором X, X1, X2, Х3 и X4 означают -CONH2.
20. Способ по любому из предшествующих пунктов, в котором R2 и R3 означают атом галогена.
21. Способ по п.20, в котором R2 и R3 означают фтор.
22. Способ по любому из предшествующих пунктов, в котором Y означает галоген.
23. Способ по п.22, в котором Y означает фтор.
24. Способ по любому из предшествующих пунктов, в котором соединением формулы (I) является (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид.
25. Способ получения промежуточных соединений формулы (IIа), (III), (VIIр), (VIIb) и их солей
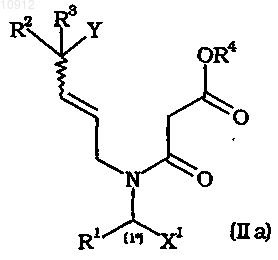
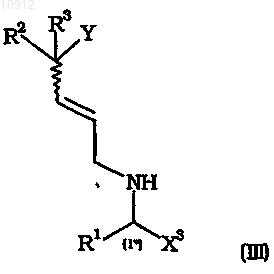
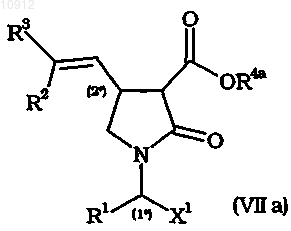
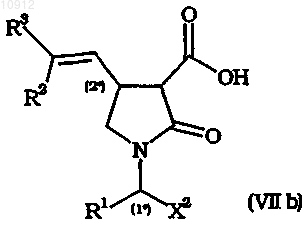
где X1, X2 и X3, каждый независимо, имеет значения, определенные для X в п.1,
R1, R2, R3, R4 и Y имеют значения, определенные в п.1,
R4a имеет значение, определенное в п.4.
26. Способ по п.25, в котором R1 означает этил,
X1, X2 и X3 означают -CONH2,
R2, R3 и Y означают F, а
R4 и R4a означают метил или этил.
27. Способ получения промежуточных соединений по п.25 или 26, в которых атом углерода, обозначенный (1*), находится в (S)-форме.
28. Способ получения промежуточных соединений по п.26 или 27, включающий синтез промежуточного соединения формулы (VIIb), в котором атом углерода, обозначенный (2*), находится в (S)-форме.
Текст
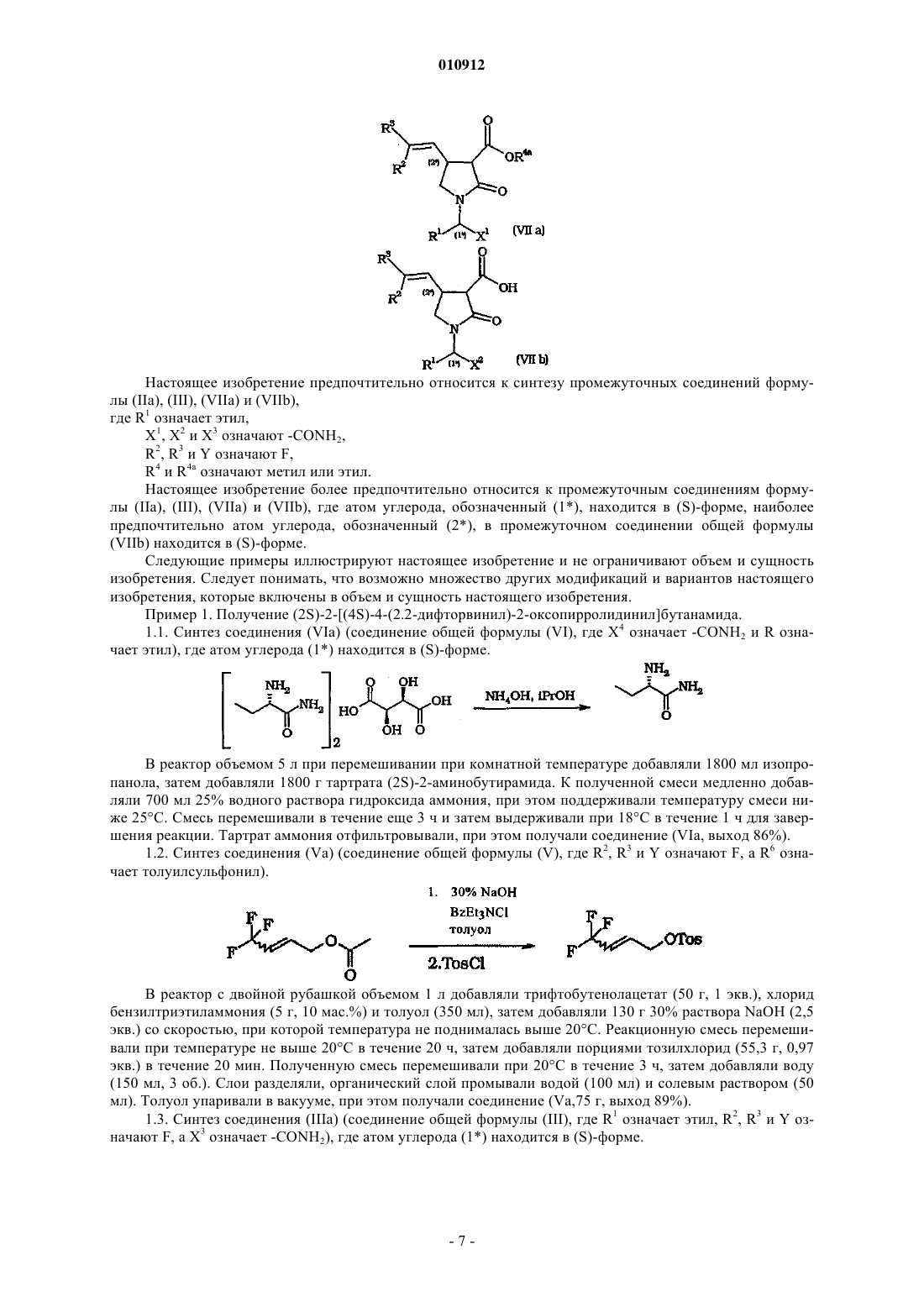
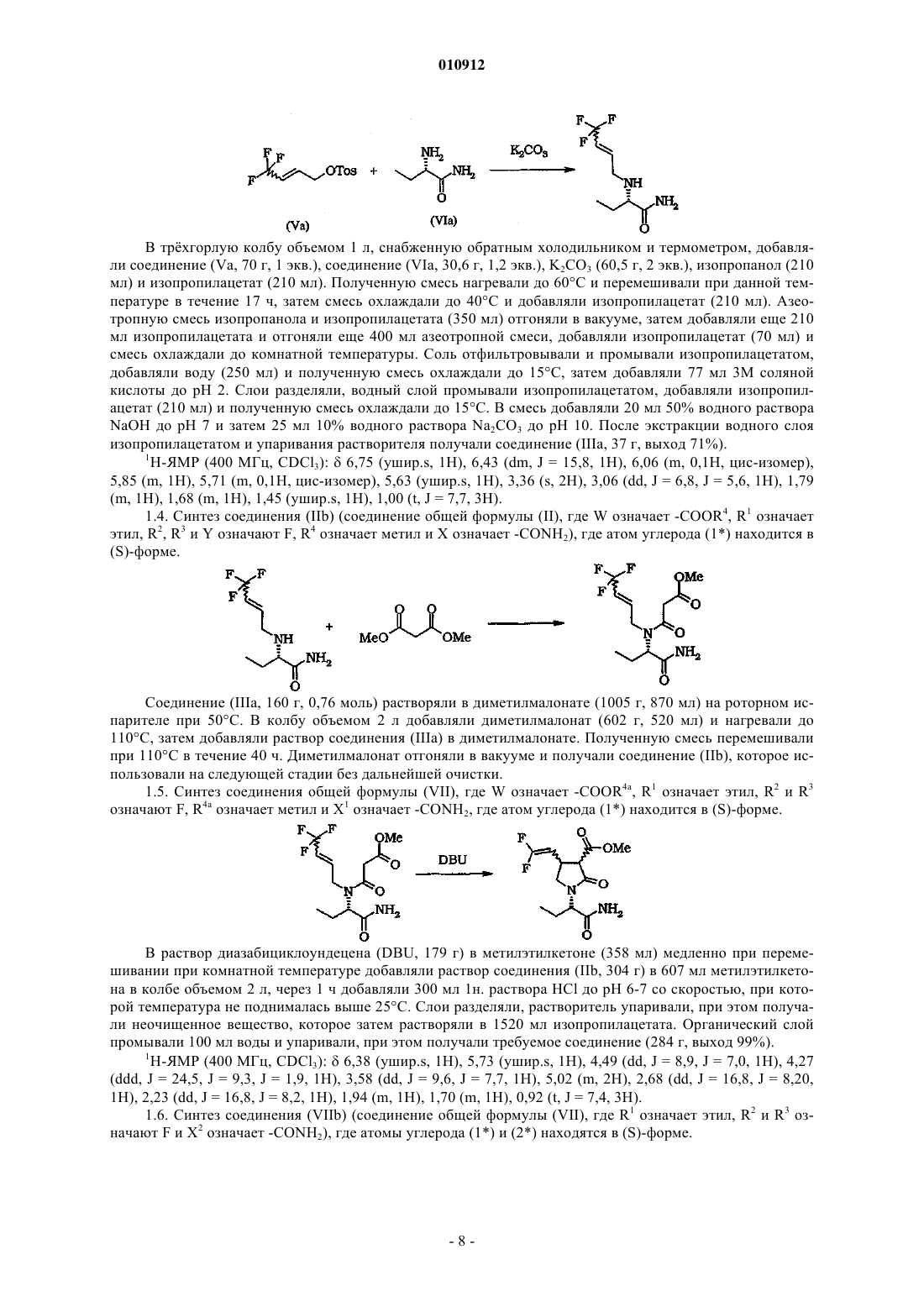
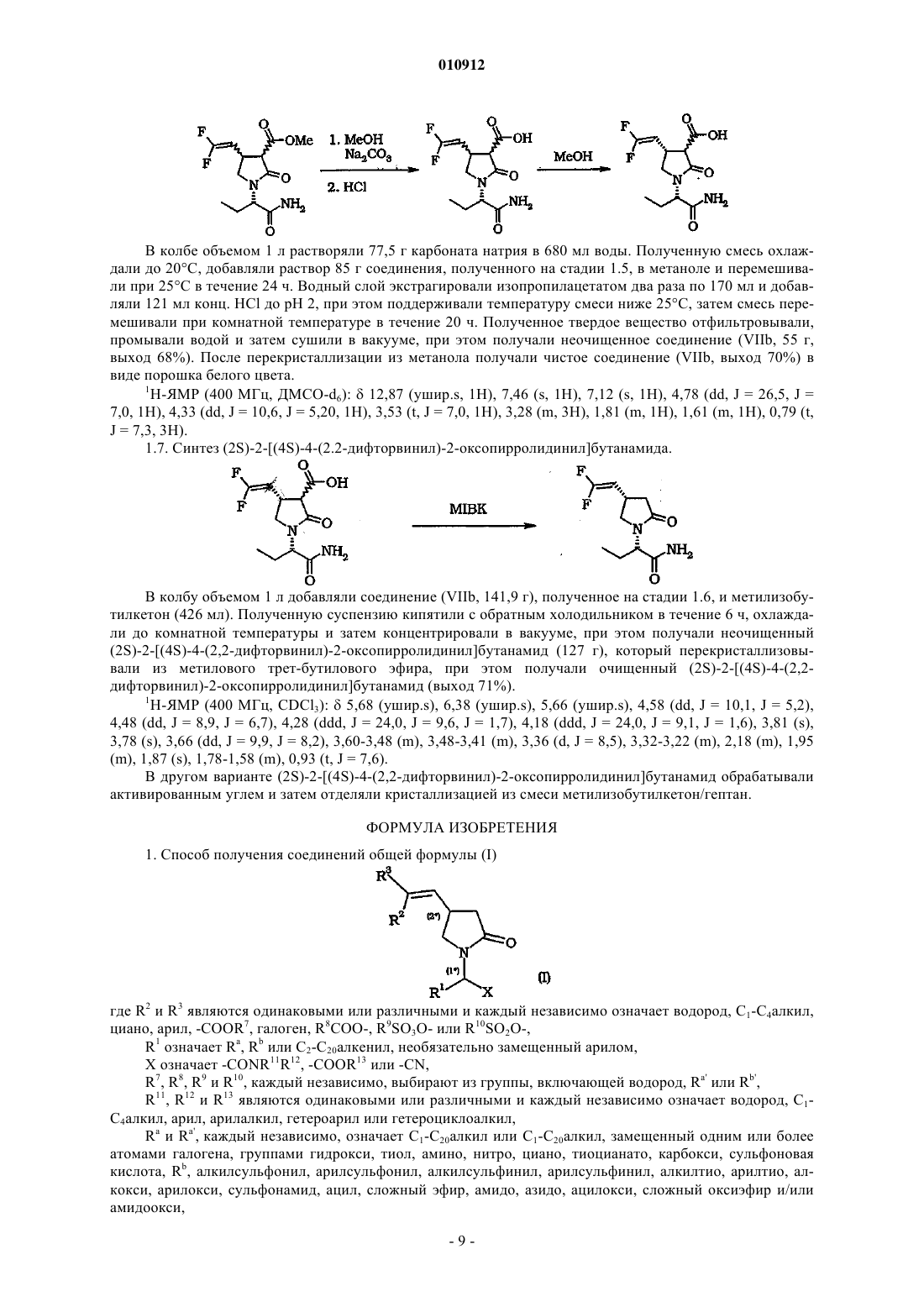
010912 Настоящее изобретение относится к способу получения производных 2-оксо-1-пирролидина. В патенте ЕР 0162036 В 1 описано соединение (S)этил-2-оксо-1-пирролидинацетамид, которое известно под международным непатентованным названием леветирацетам. В патенте ЕР 0162036 В 1 описан леветирацетам в качестве лекарственного средства, предназначенного для лечения и профилактики гипоксических и ишемических расстройств центральной нервной системы. Указанное соединение является также эффективным средством для лечения эпилепсии. В патентах ЕР 0162036 и ВР 2225322 описан способ получения леветирацетама. В заявке WO 01/62726 описаны другие производные 2-оксо-1-пирролидина и способы их получения. В указанной заявке, в частности, описан способ синтеза двух диастереоизомеров 2,2(диметил)этилового эфира (2S)-2-(2-оксо-4-(2,2-дифторвинил)-1-пирролидинил)бутановой кислоты. На первой стадии 2-аминобутират взаимодействует с метилитаконатом. Затем полученный сложный эфир превращают в трет-бутиловый эфир (2S)-2-[4-гидроксиметил-2-оксо-1-пирролидинил]бутановой кислоты, который окисляют до альдегида, который затем взаимодействует с CF2Br2 (реакция Виттига). Настоящее изобретение относится к другому способу получения производных 2-оксо-1 пирролидина. Настоящее изобретение относится к способу получения соединений общей формулы (I) где R2 и R3 являются одинаковыми или различными и каждый независимо означает водород, С 1-С 4 алкил,циано, арил, -COOR7, галоген, R8COO-, R9SO3O- или R10SO2O-,R1 означает Ra, Rb или С 2-С 20 алкенил, необязательно замещенный арилом,X означает -CONR11R12, -COOR13 или -CN,R7, R8, R9 и R10, каждый независимо, означает водород, Ra' или Rb',R11, R12 и R13 являются одинаковыми или различными и каждый независимо означает водород, С 1 С 4 алкил, арил, арилалкил, гетероарил или гетероциклоалкил,Ra и Ra', каждый независимо, означает C1-С 20 алкил или С 1-С 20 алкил, замещенный одним или более атомами галогена, группами гидрокси, тиол, амино, нитро, циано, тиоцианато, карбокси, сульфоновая кислота, Rb, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкокси, арилокси, сульфонамид, ацил, сложный эфир, амидо, азидо, ацилокси, сложный оксиэфир и/или амидоокси,Rb и Rb', каждый независимо, означает арил, гетероциклоалкил, гетероарил или эти же заместители(арил, гетероциклоалкил или гетероарил), замещенные одним или более атомами галогена, группами Ra,гидрокси, тиол, амино, нитро, циано, тиоцианато, карбокси, сульфоновая кислота, арил, алкилсульфонил,арилсульфонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкокси, арилокси, сульфонамид,гетероциклоалкил, гетероарил, ацил, сложный эфир, амидо, азидо, ацилокси, сложный оксиэфир и/или амидоокси,причем указанный способ включает циклизацию промежуточного соединения общей формулы (II)-OClO3,R14 и R15 означают галоген или алкил, арилалкил, арил, каждый необязательно замещен одним или более атомами галогена, группами алкил, нитро и/или третичная аминогруппа,X1 имеет значения, определенные для X,W означает электроноакцепторную группу, выбранную из группы, включающей -COOR4, -COMe,-CN, -PO(OEt)2, -SO2 арил, -СОарил,R4 означает водород, C1-С 6 алкил, арил, арилалкил, причем арил и арилалкил, каждый, замещен одним или более атомами галогена, группами нитро и/или метокси,в присутствии одного или более органических и/или неорганических оснований. Термин алкил, используемый в настоящем описании, означает насыщенные одновалентные углеводородные радикалы, содержащие остатки с прямой, разветвленной или циклической цепью или их комбинации. Термин арил, используемый в настоящем описании, означает органический радикал, полученный из ароматического углеводорода удалением одного атома водорода, такой как фенил или нафтил. Термин арилалкил, используемый в настоящем описании, означает алкил, замещенный одной или более арильными группами. Термин алкиларил, используемый в настоящем описании, означает арил, замещенный одной или более алкильными группами. Термин алкенил, используемый в настоящем описании, означает углеводородные радикалы с разветвленной, прямой и циклической цепью, содержащие по крайней мере одну двойную связь, или их комбинации. Термин гетероциклоалкил, используемый в настоящем описании, означает циклический алкил(циклоалкил), содержащий по крайней мере один атом О, S и/или N, который прерывает структуру карбоцикла. Предпочтительные гетероциклоалкилы включают тетрагидрофуранил, тетрагидропиранил, пиперидинил, пиперазинил, морфолино и пирролидинил. Термин гетероарил, используемый в настоящем описании, означает арил, определенный выше,содержащий по крайней мере один атом О, S и/или N, который прерывает структуру карбоцикла, такой как пиридил, фурил, пирролил, тиенил, изотиазолил, имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, изобензофурил, бензотиенил, пиразолил, индолил, изоиндолил,пуринил, карбазолил, изоксазолил, тиазолил, оксазолил, бензтиазолил или бензоксазолил. Термин галоген, используемый в настоящем описании, означает атом Cl, Br, F, I. Термин гидрокси, используемый в настоящем описании, означает группу формулы -ОН. Термин тиол, используемый в настоящем описании, означает группу формулы -SH. Термин циано, используемый в настоящем описании, означает группу формулы -CN. Термин тиоцианато, используемый в настоящем описании, означает группу формулы -SCN. Термин карбокси, используемый в настоящем описании, означает группу формулы -СООН. Термин нитро, используемый в настоящем описании, означает группу формулы -NO2. Термин азидо, используемый в настоящем описании, означает группу формулы -N3. Термин сульфоновая кислота, используемый в настоящем описании, означает группу формулы-SO3H. Термин сульфонамид, используемый в настоящем описании, означает группу формулы -SO2NH2,где один или оба атома водорода необязательно заменены на радикал алкил, арил, гетероарил и/или гетероциклоалкил или указанные радикалы замещены заместителями, определенными выше. Термин ацил, используемый в настоящем описании, означает группу формулы RcCO-, где Rc означает алкил, арил, гетероциклоалкил или гетероарил или указанные радикалы замещены заместителями,определенными выше. Термин сложный эфир, используемый в настоящем описании, означает группу формулы -COORd,где Rd означает алкил, арил, гетероциклоалкил или гетероарил или указанные радикалы замещены заместителями, определенными выше. Термин алкокси, используемый в настоящем описании, означает группы формулы -ORe, где Re означает алкил или гетероциклоалкил или указанные радикалы замещены заместителями, определенными выше. Термин арилокси, используемый в настоящем описании, означает группы формулы -ORf, где Rf означает арил или гетероарил или указанные радикалы замещены заместителями, определенными выше. Термин алкилтио, используемый в настоящем описании, означает группы формулы -SRg, где Rg означает алкил или гетероциклоалкил или указанные радикалы замещены заместителями, определенными выше. Термин арилтио, используемый в настоящем описании, означает группы формулы -SRh, где Rh означает арил или гетероарил или указанные радикалы замещены заместителями, определенными выше. Термин ацилокси, используемый в настоящем описании, означает группу формулы RiCOO-, гдеR означает алкил, арил, гетероарил или гетероциклоалкил или указанные радикалы замещены заместителями, определенными выше.-SO2Rj, где Rj означает алкил или гетероциклоалкил или указанные радикалы замещены заместителями,определенными выше. Термин арилсульфонил, используемый в настоящем описании, означает группу формулы -SO2Rk,где Rk означает арил или гетероарил или указанные радикалы замещены заместителями, определенными выше. Термин алкилсульфинил, используемый в настоящем описании, означает группу формулы -SORl, где Rl означает алкил или гетероциклоалкил или указанные радикалы замещены заместителями, определенными выше. Термин арилсульфинил, используемый в настоящем описании, означает группу формулы -SO-Rm,где Rm означает арил или гетероарил или указанные радикалы замещены заместителями, определенными выше. Термин сложный оксиэфир, используемый в настоящем описании, означает группу формулы-OCOORn, где Rn означает алкил, арил, гетероарил или гетероциклоалкил или указанные радикалы замещены заместителями, определенными выше. Термин амино, используемый в настоящем описании, означает группу формулы -NH2, где один или оба атома водорода необязательно заменены на алкильную группу. Термин амидо, используемый в настоящем описании, означает группу формулы -CONH2, где один или оба атома водорода необязательно заменены на алкил, арил, гетероарил и/или гетероциклоалкил или указанные радикалы замещены заместителями, определенными выше. Термин амидоокси, используемый в настоящем описании, означает группу формулы -OCONH2,где один или оба атома водорода необязательно заменены на алкил, арил, гетероарил и/или гетероциклоалкил или указанные радикалы замещены заместителями, определенными выше. В случае, если в одном соединении присутствуют более одного заместителя Ra, Ra', Rb или Rb', то указанные заместители являются одинаковыми или различными. Термин уходящая группа, используемый в настоящем описании, имеет значение, известное специалистам в данной области техники (см. книгу Advanced Organic Chemistry: reactions, mechanisms andstructure, Jerry March, John Wiley and Sons Ed., 3 издание, с. 179 (1985 и означает группу, которая является частью молекулы субстрата или присоединена к молекуле субстрата. В условиях реакции замещения уходящую группу отщепляют при взаимодействии молекулы субстрата, например, с нуклеофилом.Y означает предпочтительные уходящие группы по настоящему изобретению, которые включают галоген, -OC(O)R14, -OSO2-C6H4-CH3, -OSO2-C6H4-Br, -OSO2-C6H4-NO2, -OSO2-CH3, -OSO2-CF3, -OSO2C4F9, -OSO2-CH2-CF3, -OSO2-(CH2)n-N+Me3, -OSO2-F и -OClO3. Согласно способу по настоящему изобретению Y более предпочтительно означает галоген, наиболее предпочтительно F. Согласно способу по настоящему изобретениюR' предпочтительно означает C1-С 6 алкил, более предпочтительно метил, этил, н-пропил, изопропил,н-бутил или изобутил, наиболее предпочтительно метил, этил или н-пропил, прежде всего этил,R2 и R3 предпочтительно означают галоген, более предпочтительно F,X предпочтительно означает -CONR11R12, более предпочтительно -CONH2,W предпочтительно означает электроноакцепторную группу, выбранную из группы, включающей-COOR4, -CN, -PO(OEt)2, более предпочтительно группу формулы -COOR4,R4 предпочтительно означает C1-С 6 алкил, арил, арилалкил, арил или арилалкил, замещенный одним или более атомами галогена, группами нитро, метокси, более предпочтительно R4 означает С 1-С 6 алкил,наиболее предпочтительно метил или этил. Стадию циклизации обычно проводят в присутствии одного или более органических и/или неорганических оснований. Предпочтительные органические основания по настоящему изобретению включают TMG (1,1,3,3 тетраметилгуанидин), спартеин, TBD (1,5,7-триазабицикло(4.4.0)дец-5-ен), BSA (бис(триметилсилил) ацетамид), DBU (1,8-диазабицикло[5.4.0]ундец-7-ен), ВТРР (трет-бутилимино-три(пирролидино)фосфоран), DBN (1,5-диазабицикло(4.3.0)нон-5-ен), более предпочтительно DBU. Предпочтительные неорганические основания по настоящему изобретению включают Na2CO3,K2CO3, Cs2CO3, NaH, трет-BuOK, более предпочтительно K2CO3 и CsCO3, наиболее предпочтительноCs2CO3. Неорганические основания используют в отсутствии или необязательно в присутствии катализатора межфазного переноса, предпочтительно неорганические основания используют в присутствии катализатора межфазного переноса. Примеры используемых катализаторов межфазного переноса включают, без ограничения перечисленных, соли четвертичного аммония, такие как BzEt3NCl, Bu4NHSO4, Bu4NSO3BzMe и Bu4NBr. Стадию циклизации обычно проводят в присутствии растворителя, предпочтительно в апротонном растворителе. Предпочтительные растворители включают толуол, тетрагидрофуран, диэтоксиметан, диметилсульфоксид, этилацетат, изопропилацетат, метиловый трет-бутиловый эфир, дихлорметан, нитри-3 010912 лы, такие как ацетонитрил, амиды, такие как диметилацетамид, N-метилпирролидон, диметилформамид,кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, или их смеси. Более предпочтительные растворители включают полярные растворители, такие как кетоны, амиды и нитрилы, наиболее предпочтительно метилэтилкетон, ацетонитрил и N-метилпирролидон. Реакцию обычно проводят при температуре от -40 до +80 С, предпочтительно от -30 до +40 С, более предпочтительно от -20 до +25 С. Способ по настоящему изобретению используют также для получения фармацевтически приемлемых солей соединения (I). Термин фармацевтически приемлемые соли по настоящему изобретению включает терапевтически активные нетоксичные основно-аддитивные и кислотно-аддитивные соли, которые образуются из соединений формулы (I). При циклизации промежуточного соединения общей формулы (II) обычно образуется промежуточное соединение формулы (VII) В данном случае способ также включает удаление электроноакцепторной группы W в соединении(VII). Если W означает группу формулы -COOR4a, прежде всего, где R4a означает C1-С 6 алкил, то способ по настоящему изобретению включает декарбалкоксилирование промежуточного соединения формулы где X1 имеет значения, определенные выше для X,R1, R2 и R3 имеют значения, определенные выше. В промежуточном соединении формулы (VIIa) R4a предпочтительно означает метил или этил. Декарбалкоксилирование промежуточного соединения (VIIа) проводят любым пригодным методом. Декарбалкоксилирование промежуточного соединения (VIIа) проводят напрямую, например, методом декарбалкоксилирования Крапчо (Krapcho), описанным в статье А.Р. Krapcho и др., Tetrahedron Letters, с. 215 (1967), или сначала соединение (VIIa) гидролизуют до соответствующей кислоты, которую затем декарбоксилируют. Таким образом, если W означает группу формулы -COOR4a, где R4a означает C1-С 6 алкил, способ по настоящему изобретению включает гидролиз промежуточного соединения (VIIа). Гидролиз соединения общей формулы (VIIа) обычно проводят в присутствии растворителя, такого как метанол, этанол, изопропанол, вода или их смеси, предпочтительно в смеси воды и метанола. Гидролиз обычно проводят в присутствии основания, такого как K2CO3, Na2CO3, NaOH или LiOH,предпочтительно K2CO3 и Na2CO3. В случае, если электроноакцепторная группа W означает -СООН или ее можно превратить в группу-СООН, прежде всего, гидролизом соединения (VIIа), описанным выше, способ по настоящему изобретению включает декарбоксилирование промежуточного соединения общей формулы (VIIb)-4 010912 где X2 имеет значения, определенные выше для X,R1, R2 и R3 имеют значения, определенные выше. Декарбоксилирование промежуточного соединения формулы (VIIb) обычно проводят в присутствии растворителя, предпочтительно в присутствии растворителя с температурой кипения выше 110 С,такого как диметилформамид, диметилсульфоксид, NMP (N-метил-2-пирролидон), метилизобутилкетон,более предпочтительно метилизобутилкетон и NMP. Декарбоксилирование предпочтительно проводят при приблизительно 130 С (при атмосферном давлении). Согласно способу по настоящему изобретению промежуточные соединения формулы (II) получают любым пригодным методом. Промежуточные соединения формулы (II) предпочтительно получают при взаимодействии соединения формулы (III) где X3 имеет значения, определенные выше для X,Y, R1, R2 и R3 имеют значения, определенные выше,с соединением формулы (IV) где W1 имеет значения, определенные выше для W,R5 означает метокси, этокси, хлор, гидрокси, -ONa или -OK. В промежуточных соединениях формулы (III) X3 предпочтительно означает -CONR11R12, более предпочтительно -CONH2. В соединениях формулы (IV) W1 предпочтительно означает группу формулы -COOR4b, где R4b предпочтительно означает C1-С 6 алкил, более предпочтительно метил или этил. Согласно способу по настоящему изобретению промежуточные соединения формулы (III) получают любым пригодным методом, например алкилированием соединения формулы (VI) в присутствии основания и/или катализатора, такого как Pd. Промежуточные соединения формулы (III) предпочтительно получают при взаимодействии соединения формулы (V)R6 означает уходящую группу, определенную выше для Y,с соединением формулы (VI) где X4 имеет значения, определенные выше для X, иR1 имеет значения, определенные выше. В соединениях формулы (V) R6 предпочтительно означает Cl, Br, I, -OSO2Me или -OSO2-C6H4-CH3,более предпочтительно -OSO2-C6H4-CH3. Согласно способу по настоящему изобретению соединения формулы (V) находятся в форме Z- (с одной стороны плоскости) или Е- (с разных сторон плоскости) изомеров или их смесей. Способ по настоящему изобретению относится к получению всех форм стереоизомеров, таких как геометрические и оптические энантиомеры и диастереоизомеры соединений формулы (I) и их смеси(включая рацематы). Соединения формулы (I) включают по крайней мере два стереогенных центра, которые обозначены(1) и (2). Указанные стереогенные центры находятся в R или S конфигурации, правила определения-5 010912 указанных R и S конфигураций описаны в статье Pure. Appl. Chem., 45, cc. 11-30 (1976). Способ по настоящему изобретению предпочтительно относится к получению соединений формулы (I), где стереогенный центр, обозначенный (1), находится в (S)- или (R)-форме, более предпочтительно в (S)-форме. Способ по настоящему изобретению предпочтительно относится к получению соединений формулы (I), где стереогенный центр, обозначенный (2), находится в (S)- или (R)-форме, более предпочтительно в (S)-форме. Термин (S)-форма, используемый в настоящем описании, означает, что более 50%, предпочтительно более 90% соединений включают атом углерода, который является стереогенным центром, обозначенным звездочкой, в S конфигурации. Термин (R)-форма, используемый в настоящем описании, означает, что более 50%, предпочтительно более 90% соединений включают атом углерода, который является стереогенным центром, обозначенным звездочкой, в R конфигурации. Способ по настоящему изобретению предпочтительно относится к циклизации промежуточных соединений общей формулы (II), где атом углерода, обозначенный (1), находится в (S)-форме. Неожиданно было установлено, что на стадии циклизации промежуточного соединения формулы(II), при декарбалкоксилировании промежуточного соединения формулы (VIIа) или декарбоксилировании промежуточного соединения (VIIb) и в ходе реакции соединения формулы (III) с соединением формулы (IV) рацемизация не происходит. Согласно способу по настоящему изобретению в соединениях общей формулы (VI) атом углерода,обозначенный (1), более предпочтительно находится в (S)-форме. Способ по настоящему изобретению необязательно включает стадию разделения различных диастереоизомеров, прежде всего, стадию выделения одного или более различных диастереоизомеров любого соединения формулы (I), (VIIа) и (VIIb). Способ по настоящему изобретению предпочтительно включает выделение диастереоизомеров промежуточного соединения (VIIb) любым пригодным методом,предпочтительно перекристаллизацией, более предпочтительно в растворителях, таких как ацетонитрил,ацетон, изопропанол, метанол, вода, N-метил-2-пирролидон или их смеси. Способ по настоящему изобретению наиболее предпочтительно включает стадию выделения соединения формулы (VIIb), в котором атом углерода, обозначенный (2), находится в (S)-форме. Способ по настоящему изобретению также используют для получения соединений общей формулы(I) in situ, при этом в качестве исходного материала используют соединения общей формулы (V) и (VI). Термин in situ означает проведение двух или более последовательных реакций без выделения промежуточных соединений, которые при этом образуются. Настоящее изобретение прежде всего относится к получению (2S)-2-[(4S)-4-(2,2-дифторвинил)-2 оксопирролидинил]бутанамида. Способ по настоящему изобретению позволяет получать соединения формулы (I) с высокой степенью очистки. Кроме того, стадию циклизации проводят в отсутствие токсичного или дорогостоящего катализатора, прежде всего, металлических катализаторов. Настоящее изобретение также относится к синтезу промежуточных соединений формулы (IIа), (III),(VIIа), (VIIb) и их солей. Настоящее изобретение предпочтительно относится к синтезу промежуточных соединений формулы (IIа), (III), (VIIа) и (VIIb),где R1 означает этил,X1, X2 и X3 означают -CONH2,R2, R3 и Y означают F,R4 и R4a означают метил или этил. Настоящее изобретение более предпочтительно относится к промежуточным соединениям формулы (IIа), (III), (VIIа) и (VIIb), где атом углерода, обозначенный (1), находится в (S)-форме, наиболее предпочтительно атом углерода, обозначенный (2), в промежуточном соединении общей формулы(VIIb) находится в (S)-форме. Следующие примеры иллюстрируют настоящее изобретение и не ограничивают объем и сущность изобретения. Следует понимать, что возможно множество других модификаций и вариантов настоящего изобретения, которые включены в объем и сущность настоящего изобретения. Пример 1. Получение (2S)-2-[(4S)-4-(2.2-дифторвинил)-2-оксопирролидинил]бутанамида. 1.1. Синтез соединения (VIа) (соединение общей формулы (VI), где X4 означает -CONH2 и R означает этил), где атом углерода (1) находится в (S)-форме. В реактор объемом 5 л при перемешивании при комнатной температуре добавляли 1800 мл изопропанола, затем добавляли 1800 г тартрата (2S)-2-аминобутирамида. К полученной смеси медленно добавляли 700 мл 25% водного раствора гидроксида аммония, при этом поддерживали температуру смеси ниже 25 С. Смесь перемешивали в течение еще 3 ч и затем выдерживали при 18 С в течение 1 ч для завершения реакции. Тартрат аммония отфильтровывали, при этом получали соединение (VIа, выход 86%). 1.2. Синтез соединения (Va) (соединение общей формулы (V), где R2, R3 и Y означают F, a R6 означает толуилсульфонил). В реактор с двойной рубашкой объемом 1 л добавляли трифтобутенолацетат (50 г, 1 экв.), хлорид бензилтриэтиламмония (5 г, 10 мас.%) и толуол (350 мл), затем добавляли 130 г 30% раствора NaOH (2,5 экв.) со скоростью, при которой температура не поднималась выше 20 С. Реакционную смесь перемешивали при температуре не выше 20 С в течение 20 ч, затем добавляли порциями тозилхлорид (55,3 г, 0,97 экв.) в течение 20 мин. Полученную смесь перемешивали при 20 С в течение 3 ч, затем добавляли воду(150 мл, 3 об.). Слои разделяли, органический слой промывали водой (100 мл) и солевым раствором (50 мл). Толуол упаривали в вакууме, при этом получали соединение (Vа,75 г, выход 89%). 1.3. Синтез соединения (IIIа) (соединение общей формулы (III), где R1 означает этил, R2, R3 и Y означают F, а X3 означает -CONH2), где атом углерода (1) находится в (S)-форме. В трхгорлую колбу объемом 1 л, снабженную обратным холодильником и термометром, добавляли соединение (Vа, 70 г, 1 экв.), соединение (VIа, 30,6 г, 1,2 экв.), K2CO3 (60,5 г, 2 экв.), изопропанол (210 мл) и изопропилацетат (210 мл). Полученную смесь нагревали до 60 С и перемешивали при данной температуре в течение 17 ч, затем смесь охлаждали до 40 С и добавляли изопропилацетат (210 мл). Азеотропную смесь изопропанола и изопропилацетата (350 мл) отгоняли в вакууме, затем добавляли еще 210 мл изопропилацетата и отгоняли еще 400 мл азеотропной смеси, добавляли изопропилацетат (70 мл) и смесь охлаждали до комнатной температуры. Соль отфильтровывали и промывали изопропилацетатом,добавляли воду (250 мл) и полученную смесь охлаждали до 15 С, затем добавляли 77 мл 3 М соляной кислоты до pH 2. Слои разделяли, водный слой промывали изопропилацетатом, добавляли изопропилацетат (210 мл) и полученную смесь охлаждали до 15 С. В смесь добавляли 20 мл 50% водного раствораNaOH до pH 7 и затем 25 мл 10% водного раствора Na2CO3 до pH 10. После экстракции водного слоя изопропилацетатом и упаривания растворителя получали соединение (IIIа, 37 г, выход 71%). 1 Н-ЯМР (400 МГц, CDCl3):6,75 (ушир.s, 1 Н), 6,43 (dm, J = 15,8, 1H), 6,06 (m, 0,1 Н, цис-изомер),5,85 (m, 1H), 5,71 (m, 0,1H, цис-изомер), 5,63 (ушир.s, 1H), 3,36 (s, 2H), 3,06 (dd, J = 6,8, J = 5,6, 1H), 1,79(m, 1H), 1,68 (m, 1H), 1,45 (ушир.s, 1H), 1,00 (t, J = 7,7, 3H). 1.4. Синтез соединения (IIb) (соединение общей формулы (II), где W означает -COOR4, R1 означает этил, R2, R3 и Y означают F, R4 означает метил и X означает -CONH2), где атом углерода (1) находится в Соединение (IIIа, 160 г, 0,76 моль) растворяли в диметилмалонате (1005 г, 870 мл) на роторном испарителе при 50 С. В колбу объемом 2 л добавляли диметилмалонат (602 г, 520 мл) и нагревали до 110 С, затем добавляли раствор соединения (IIIа) в диметилмалонате. Полученную смесь перемешивали при 110 С в течение 40 ч. Диметилмалонат отгоняли в вакууме и получали соединение (IIb), которое использовали на следующей стадии без дальнейшей очистки. 1.5. Синтез соединения общей формулы (VII), где W означает -COOR4a, R1 означает этил, R2 и R3 означают F, R4a означает метил и X1 означает -CONH2, где атом углерода (1) находится в (S)-форме. В раствор диазабициклоундецена (DBU, 179 г) в метилэтилкетоне (358 мл) медленно при перемешивании при комнатной температуре добавляли раствор соединения (IIb, 304 г) в 607 мл метилэтилкетона в колбе объемом 2 л, через 1 ч добавляли 300 мл 1 н. раствора HCl до pH 6-7 со скоростью, при которой температура не поднималась выше 25 С. Слои разделяли, растворитель упаривали, при этом получали неочищенное вещество, которое затем растворяли в 1520 мл изопропилацетата. Органический слой промывали 100 мл воды и упаривали, при этом получали требуемое соединение (284 г, выход 99%). 1 Н-ЯМР (400 МГц, CDCl3):6,38 (ушир.s, 1H), 5,73 (ушир.s, 1H), 4,49 (dd, J = 8,9, J = 7,0, 1H), 4,27(ddd, J = 24,5, J = 9,3, J = 1,9, 1H), 3,58 (dd, J = 9,6, J = 7,7, 1H), 5,02 (m, 2H), 2,68 (dd, J = 16,8, J = 8,20,1H), 2,23 (dd, J = 16,8, J = 8,2, 1H), 1,94 (m, 1H), 1,70 (m, 1H), 0,92 (t, J = 7,4, 3H). 1.6. Синтез соединения (VIIb) (соединение общей формулы (VII), где R1 означает этил, R2 и R3 означают F и X2 означает -CONH2), где атомы углерода (1) и (2) находятся в (S)-форме. В колбе объемом 1 л растворяли 77,5 г карбоната натрия в 680 мл воды. Полученную смесь охлаждали до 20 С, добавляли раствор 85 г соединения, полученного на стадии 1.5, в метаноле и перемешивали при 25 С в течение 24 ч. Водный слой экстрагировали изопропилацетатом два раза по 170 мл и добавляли 121 мл конц. HCl до pH 2, при этом поддерживали температуру смеси ниже 25 С, затем смесь перемешивали при комнатной температуре в течение 20 ч. Полученное твердое вещество отфильтровывали,промывали водой и затем сушили в вакууме, при этом получали неочищенное соединение (VIIb, 55 г,выход 68%). После перекристаллизации из метанола получали чистое соединение (VIIb, выход 70%) в виде порошка белого цвета. 1 Н-ЯМР (400 МГц, ДМСО-d6):12,87 (ушир.s, 1H), 7,46 (s, 1H), 7,12 (s, 1 Н), 4,78 (dd, J = 26,5, J = 7,0, 1 Н), 4,33 (dd, J = 10,6, J = 5,20, 1H), 3,53 (t, J = 7,0, 1H), 3,28 (m, 3H), 1,81 (m, 1H), 1,61 (m, 1H), 0,79 (t,J = 7,3, 3 Н). 1.7. Синтез (2S)-2-[(4S)-4-(2.2-дифторвинил)-2-оксопирролидинил]бутанамида. В колбу объемом 1 л добавляли соединение (VIIb, 141,9 г), полученное на стадии 1.6, и метилизобутилкетон (426 мл). Полученную суспензию кипятили с обратным холодильником в течение 6 ч, охлаждали до комнатной температуры и затем концентрировали в вакууме, при этом получали неочищенный(2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид (127 г), который перекристаллизовывали из метилового трет-бутилового эфира, при этом получали очищенный (2S)-2-[(4S)-4-(2,2 дифторвинил)-2-оксопирролидинил]бутанамид (выход 71%). 1 Н-ЯМР (400 МГц, CDCl3):5,68 (ушир.s), 6,38 (ушир.s), 5,66 (ушир.s), 4,58 (dd, J = 10,1, J = 5,2),4,48 (dd, J = 8,9, J = 6,7), 4,28 (ddd, J = 24,0, J = 9,6, J = 1,7), 4,18 (ddd, J = 24,0, J = 9,1, J = 1,6), 3,81 (s),3,78 (s), 3,66 (dd, J = 9,9, J = 8,2), 3,60-3,48 (m), 3,48-3,41 (m), 3,36 (d, J = 8,5), 3,32-3,22 (m), 2,18 (m), 1,95(m), 1,87 (s), 1,78-1,58 (m), 0,93 (t, J = 7,6). В другом варианте (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид обрабатывали активированным углем и затем отделяли кристаллизацией из смеси метилизобутилкетон/гептан. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений общей формулы (I) где R2 и R3 являются одинаковыми или различными и каждый независимо означает водород, С 1-С 4 алкил,циано, арил, -COOR7, галоген, R8COO-, R9SO3O- или R10SO2O-,R1 означает Ra, Rb или С 2-С 20 алкенил, необязательно замещенный арилом,X означает -CONR11R12, -COOR13 или -CN,R7, R8, R9 и R10, каждый независимо, выбирают из группы, включающей водород, Ra' или Rb',R11, R12 и R13 являются одинаковыми или различными и каждый независимо означает водород, С 1 С 4 алкил, арил, арилалкил, гетероарил или гетероциклоалкил,Ra и Ra', каждый независимо, означает С 1-С 20 алкил или С 1-С 20 алкил, замещенный одним или более атомами галогена, группами гидрокси, тиол, амино, нитро, циано, тиоцианато, карбокси, сульфоновая кислота, Rb, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкокси, арилокси, сульфонамид, ацил, сложный эфир, амидо, азидо, ацилокси, сложный оксиэфир и/или амидоокси,-9 010912Rb и Rb', каждый независимо, означает арил, гетероциклоалкил, гетероарил или эти же заместители,замещенные одним или более атомами галогена, группами Ra, гидрокси, тиол, амино, нитро, циано, тиоцианато, карбокси, сульфоновая кислота, арил, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкокси, арилокси, сульфонамид, гетероциклоалкил, гетероарил, ацил,сложный эфир, амидо, азидо, ацилокси, сложный оксиэфир и/или амидоокси, заключающийся в циклизации промежуточного соединения общей формулы (II)-OClO3,R14 и R15 означают галоген или алкил, арилалкил, арил, каждый необязательно замещен одним или более атомами галогена, группами алкил, нитро и/или третичная аминогруппа,X1 имеет значения, определенные для X,W означает электроноакцепторную группу, выбранную из группы, включающей -COOR4, -COMe,-CN, -PO(OEt)2, -SO2 арил, -СОарил,R4 означает водород, C1-С 6 алкил, арил, арилалкил, причем арил и арилалкил каждый замещен одним или более атомами галогена, группами нитро и/или метокси,в присутствии одного или более органических и/или неорганических оснований. 2. Способ по п.1, в котором Y означает галоген, -OC(O)R14, -OSO2-C6H4-СН 3, -OSO2-C6H4-Br, -OSO2C6H4-NO2, -OSO2-CH3, -OSO2-CF3, -OSO2-C4F9, -OSO2-CH2-CF3, -OSO2-(CH2)n-N+Me3, -OSO2-F и -OClO3. 3. Способ по п.1 или 2, в котором основание выбирают из группы, включающей 1,1,3,3 тетраметилгуанидин, спартеин, 1,5,7-триазабицикло(4.4.0)дец-5-ен, бис(триметилсилил)ацетамид, 1,8 диазабицикло[5.4.0]ундец-7-ен, трет-бутилимино-три(пирролидино)фосфоран, 1,5-диазабицикло(4.3.0) нон-5-ен, Na2CO3, K2CO3, Cs2CO3, NaH и трет-BuOK необязательно в присутствии катализатора межфазного переноса. 4. Способ по любому из предшествующих пунктов, включающий гидролиз промежуточного соединения общей формулы (VIIа) где R4a означает С 1-С 6 алкил, X1 имеет значения, определенные для X в п.1, R1, R2 и R3 имеют значения,определенные в п.1. 5. Способ по любому из предшествующих пунктов, включающий декарбалкоксилирование промежуточного соединения формулы (VIIа), как определено в п.4, или декарбоксилирование промежуточного соединения общей формулы (VIIb) где X2 имеет значения, определенные для X в п.1, R1, R2 и R3 имеют значения, определенные в п.1. 6. Способ по любому из предшествующих пунктов, в котором промежуточное соединение формулы(II) получают способом, включающим взаимодействие промежуточного соединения формулы (III) где R5 означает метокси, этокси, хлор, гидрокси, -ONa или -OK, W1 имеет значения, определенные для W в п.1. 7. Способ по п.6, в котором W означает группу формулы -COOR4b, где R4b означает С 1-С 6 алкил. 8. Способ по п.6, в котором промежуточное соединение (III) получают способом, включающим взаимодействие соединения формулы (V)R6 означает уходящую группу, определенную выше для Y в п.1,с соединением формулы (VI) где X4 имеет значения, определенные для X в п.1, и R1 имеет значения, определенные в п.1. 9. Способ по п.8, в котором R6 означает -OSO2-C6H4-CH3. 10. Способ по любому из предшествующих пунктов, включающий стадию выделения одного или более различных диастереоизомеров любого соединения формулы (I), (VIIа) и (VIIb). 11. Способ по любому из предшествующих пунктов, в котором атом углерода, обозначенный (1),находится в (S)-форме. 12. Способ по любому из предшествующих пунктов, в котором атом углерода, обозначенный (2),находится в (S)-форме. 13. Способ по любому из пп.5-12, включающий стадию выделения соединения формулы (VIIb), в котором атом углерода, обозначенный (2), находится в (S)-форме. 14. Способ по любому из предшествующих пунктов, в котором W означает группу формулы-COOR4. 15. Способ по п.14, в котором R4 означает C1-С 6 алкил. 16. Способ по любому из предшествующих пунктов, в котором R1 означает C1-С 6 алкил. 17. Способ по п.16, в котором R1 означает этил. 18. Способ по любому из пп.1-17, в котором X, X1, X2, Х 3 и X4 означают -CONR11R12. 19. Способ по п.18, в котором X, X1, X2, Х 3 и X4 означают -CONH2. 20. Способ по любому из предшествующих пунктов, в котором R2 и R3 означают атом галогена. 21. Способ по п.20, в котором R2 и R3 означают фтор. 22. Способ по любому из предшествующих пунктов, в котором Y означает галоген. 23. Способ по п.22, в котором Y означает фтор. 24. Способ по любому из предшествующих пунктов, в котором соединением формулы (I) является(2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид. 25. Способ получения промежуточных соединений формулы (IIа), (III), (VIIа), (VIIb) и их солейR4 и R4a означают метил или этил. 27. Способ получения промежуточных соединений по п.25 или 26, в которых атом углерода, обозначенный (1), находится в (S)-форме. 28. Способ получения промежуточных соединений по п.26 или 27, включающий синтез промежуточного соединения формулы (VIIb), в котором атом углерода, обозначенный (2), находится в (S)форме.
МПК / Метки
МПК: C07C 237/22, C07D 207/26
Метки: внутримолекулярным, получения, 2-оксо-1-пирролидина, аллилированием, способ, производных
Код ссылки
<a href="https://eas.patents.su/13-10912-sposob-polucheniya-proizvodnyh-2-okso-1-pirrolidina-vnutrimolekulyarnym-allilirovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных 2-оксо-1-пирролидина внутримолекулярным аллилированием</a>
Предыдущий патент: Ингибиторы проникновения вируса вич
Следующий патент: Непептидные антагонисты брадикинина и фармацевтические композиции на их основе
Случайный патент: Способ передачи информации с помощью хаотических сигналов