Производные 8-хлор-2,3-бензодиазепина
Номер патента: 9373
Опубликовано: 28.12.2007
Авторы: Сабо Геза, Линг Иштван, Вег Миклош, Сюч Дьюла, Гиглер Габор, Шимиг Дьюла, Сенаши Габор, Харсинг Ласло Габор, Баркоци Йожеф, Кертес Саболч
Формула / Реферат
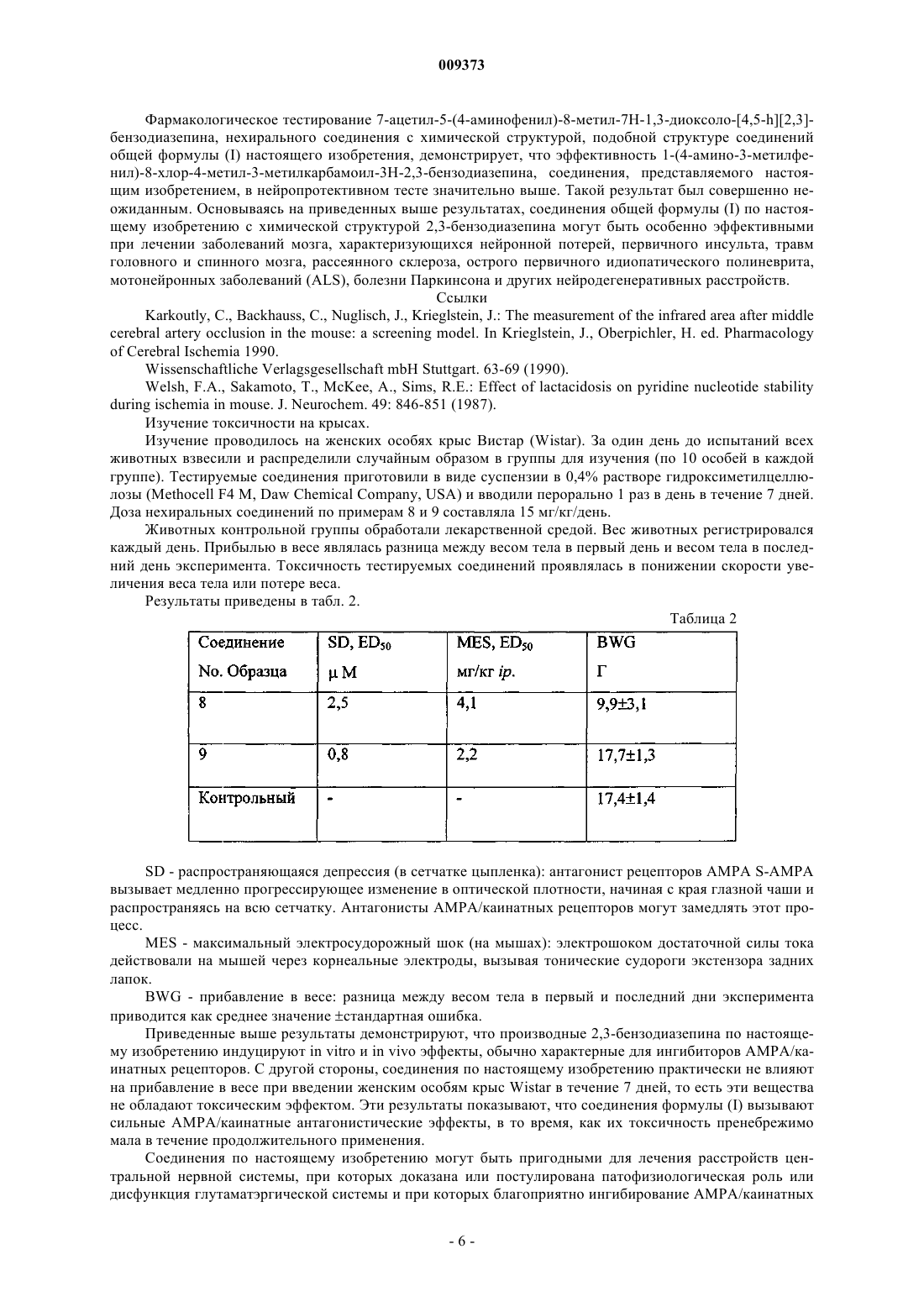
1. Производные 8-хлор-2,3-бензодиазепина общей формулы (I)
где R означает группу C1-C6 алкила или группу общей формулы -NH-R1, где R1 означает группу C1-C6алкила или С3-С7циклоалкила; а также их соли, образованные добавлением фармацевтически приемлемой кислоты.
2. Соединения общей формулы (I) по п.1, где R означает группу С1-4алкилов, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты.
3. Соединения общей формулы (I) как по п.2, где R означает метил или этил, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты.
4. Соединения общей формулы (I) по п.1, где R означает группу с формулой -NH-R1, в которой R1 означает группу С1-4алкилов или группу С3-6циклоалкилов, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты.
5. Соединения общей формулы (I) по п.4, где R1 означает метил- или циклопропилгруппу, а также соли этих соединений, образованные добавлением фармацевтически приемлемых кислот.
6. Соединения по любому из пп.1-5: 1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин 3-карбоновой кислоты метиламид; 1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин-3-карбоновой кислоты циклопропиламид; 3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин; 3-пропионил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-3Н-2,3-бензодиазепин, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты.
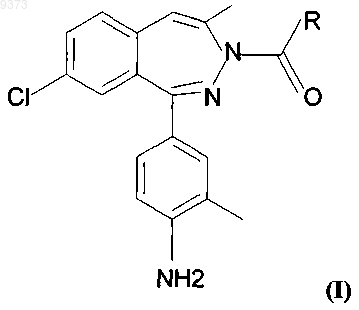
7. Способ получения соединений общей формулы (I), где R означает группу C1-6алкила или группу с формулой -NH-R1, в которой R1 означает группу алкила C1-6 или группу циклоалкила С3-7, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты, включающий
а) восстановление вещества общей формулы (II)
где R имеет значение, установленное выше, или
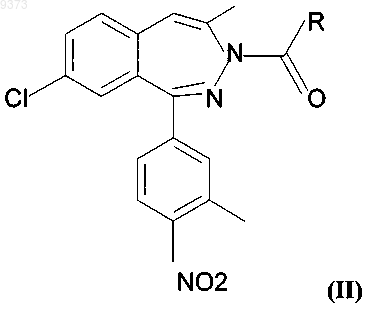
б) получение веществ общей формулы (I), содержащих на месте R группу общей формулы -NH-R1, где R1 имеет значение, установленное выше, то есть соединения общей формулы (III)
где R1 имеет значение, установленное выше, реакцией вещества общей формулы (IV)
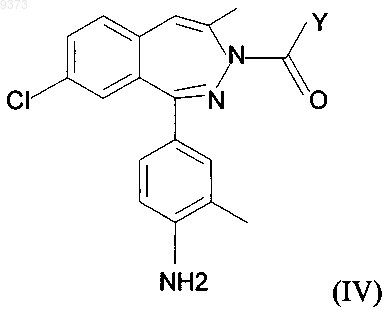
где Y обозначает С1-С6алкил, атом галогена, арилоксигруппу или алкоксигруппу С1-С6алкилов, с амином общей формулы (V)
H2N-R1 (V)
где R1 имеет значение, установленное выше, и, если требуется, преобразование соединения общей формулы (I), полученного таким способом, в его соль посредством добавления фармацевтически приемлемой кислоты.
8. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение общей формулы (I) (где R имеет значение, установленное в п.1) или соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты, в смеси с инертным твердым или жидким носителем, и /или вспомогательными веществами, и, если требуется, добавочными фармацевтическими ингредиентами.
9. Способ изготовления фармацевтической композиции по п.8, который включает смешивание соединения общей формулы (I) или соли этого соединения, образованной добавлением фармацевтически приемлемой кислоты, с твердым или жидким инертным носителем и/или вспомогательными веществами и, если требуется, с добавочными фармацевтическими ингредиентами, а также приведение смеси к форме галенова препарата.
10. Использование соединений общей формулы (I) и их солей, образованных добавлением фармацевтически приемлемой кислоты в качестве фармацевтических ингредиентов.
11. Способ лечения расстройств центральной нервной системы с помощью применения соединений, обладающих ингибирующей активностью АМРА/каинатных рецепторов, который включает введение пациенту, в случае необходимости такого лечения, фармацевтически эффективного количества соединения общей формулы (I) или его соли, образованной добавлением фармацевтически приемлемой кислоты.
12. Соединения общей формулы (II), где R имеет значение, установленное в п.1.
13. Соединения общей формулы (VIII)

где Y обозначает атом галогена, арилоксигруппу или алкоксигруппу С1-С6алкилов.
14. Способ получения соединений общей формулы (II) по п.12, где R имеет значение, определенное в п.12, включающий реакцию вещества общей формулы (VII)
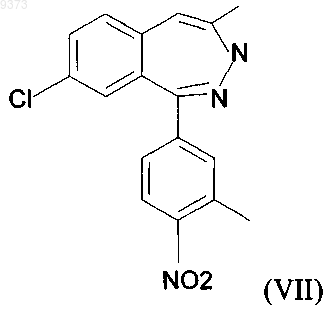
с реагентом, способным вводить Y группу, и реакцию полученного таким образом соединения общей формулы (VIII) с амином общей формулы (V).
Текст
009373 Область, к которой относится изобретение Изобретение относится к новым производным 8-хлор-2,3-бензодиазепина, обладающим активностью ингибирования АМРА/каинатных рецепторов, способу их получения, фармацевтическим композициям, содержащим указанные новые производные бензодиазепина, и к использованию этих соединений для лечения или предупреждения заболеваний. Изобретение также включает новые промежуточные соединения, полезные для синтеза новых производных 8-хлор-2,3-безнодиазепина. Предшествующий уровень техники Известно, что 2,3-бензодиазепины оказывают анксиолитическое, антидепрессивное, противосудорожное, мышечно-релаксирующее и нейропротекторное действие (см., например, венгерские патенты 155572, 179018, 191698, 191702, 195788 и 206719 и WO/01422 и т.д.). Известно также, что определенные производные 2,3-бензодиазепина проявляют свою активность,ингибируя АМРА-рецепторы неконкурентным образом [Donovan S.D. et. al.: J. Pharmacol. Exp. Ther. 271,25-29, (1994)]. Известно, что глутаматные рецепторы АМРА-типа играют важную роль при острых и хронических заболеваниях центральной нервной системы; так, ингибируя АМРА-рецепторы, можно достичь миорелаксирующего, нейропротекторного и антиконвульсивного эффекта. Подробное описание изобретения Согласно одному аспекту настоящего изобретения предложены производные 8-хлор-2,3-безнодиазепина общей формулы где R означает группу низший алкил или группу общей формулы -NH-R1, где R1 означает группу низший алкил или низший циклоалкил; а также соли этих соединений, образованные присоединением фармацевтически приемлемой кислоты. Толкования терминов, используемых в описании изобретения, следующие. Термин низший алкил следует понимать как неразветвленные или разветвленные насыщенные алкильные группы, имеющие в своем составе от 1 до 6 атомов углерода (например, метил-, этил-, нпропил-, изопропил-, н-бутилгруппы и т.д.) Термин низший циклоалкил относится к циклическим углеводородным группам, имеющим в своем составе от 3 до 7 атомов углерода (циклопропил-, циклобутил-, циклопентил- или циклогексилгруппы и т.д.). Термин соли, образованные добавлением фармацевтически приемлемой кислоты подразумевает соли, образованные фармацевтически приемлемыми кислотами, соли которых обладают биологическими свойствами соответствующего основания общей формулы (I). Для получения соли применимы как органические, так и неорганические кислоты (такие, как хлористый водород, бромистый водород, серная,фосфорная, азотная, муравьиная, уксусная, молочная, яблочная, винная, янтарная, лимонная, малеиновая,фумаровая, толуолсульфоновая, бензосульфоновая кислоты и т.п.). К подгруппе соединений по изобретению принадлежат соединения общей формулы (I), содержащие на месте R группу низший алкил, предпочтительно алкил, имеющий в своем составе от 1 до 4 атомов углерода, особенно предпочтительно метил или этил, а также фармацевтически приемлемые соли этих соединений. Другая подгруппа соединений по изобретению представлена соединениями общей формулы(I), где R обозначает группу NH-R1, в которой формула R1 означает 1-4 алкил или 3-6 циклоалкил, особенно метил или циклопропил, а также соли этих соединений, образованные присоединением фармацевтически приемлемой кислоты. Наиболее предпочтительными примерами соединений по изобретению являются следующие производные: 1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин-3-карбоновой кислоты метиламид,1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин-3-карбоновой кислоты циклопропиламид,3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин, 3-пропионил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин, а также соли этих соединений, образованные присоединением фармацевтически приемлемой кислоты. Согласно еще одному аспекту настоящего изобретения предлагается способ получения соединений общей формулы (I), гдеR обозначает группу низший алкил или группу общей формулы -NH-R1, где R1 обозначает группу низший алкил или группу низший циклоалкил, а также соли этих соединений, образованные присоединением фармацевтически приемлемых кислот; где способ включает:-1 009373 а) восстановление соединения общей формулы (II) где R имеет значение, установленное выше, или б) для получения веществ общей формулы (I), содержащих на месте R группу общей формулы -NHR1, где R1 имеет значение, установленное выше (то есть соединения общей формулы (III) где R1 имеет значение, установленное выше), - взаимодействие вещества общей формулы (IV) где Y обозначает низший алкил или уходящую группу, с амином общей формулы (V)H2N-R1 (V) где R1 имеет значение, установленное выше,и, возможно, превращение соединения общей формулы (I), полученного таким способом, в его фармацевтически приемлемую соль присоединения кислоты. Согласно варианту (а) способа по изобретению восстанавливают соединение общей формулы (II),где R имеет значение, установленное выше. Эта реакция может проводиться всеми непосредственно известными способами. При одном из воплощений способа проводят каталитическое гидрирование. В качестве катализатора можно использовать никелевый катализатор Ренея, палладий, нанесенный на носитель, или платину. Источником водорода могут служить водород, гидразин, гидразин гидрат, муравьиная кислота, формиат триалкиламмония или формиаты щелочных металлов. В качестве восстановителя можно также применять хлорид олова(II) или дитионат натрия. Согласно варианту (б) способа по изобретению осуществляют реакцию соединения общей формулы (IV) с амином общей формулы (V) с образованием соединения общей формулы (III), которое является соединением общей формулы (I), содержащим группу -NH-R1 на месте R. В общей формуле (IV) Y обозначает низший алкил или уходящую группу. Уходящей группой предпочтительно является атом галогена (например, бромид или иодид), арилоксигруппа (например, возможно замещенная феноксигруппа, предпочтительно феноксигруппа) или алкоксигруппа низших алкилов (например, метокси-, этоксигруппа и т.д.). Реакцию можно осуществлять всеми известными методами, непосредственно описанными в литературе [Houben-Weyl: Amine, vol. XI, GeorgVerlag, Stuttgart, (1957); S. Patai: The Chemisty of amine group, Interscience Publishers, (1968)]. Взаимодействие можно проводить в протонных растворителях (предпочтительно в среде низших спиртов, в частности в этаноле) или в избытке амина общей формулы (V). Реакцию проводят при температуре между -20 и 150C, предпочтительно между 20 и 60C. Если желательно, полученные таким образом соединения общей формулы (I) можно превратить в их фармацевтически приемлемые соли присоединения кислоты. Получение соли осуществляют всеми известными способами. Неорганические или органические кислоты, используемые для образования соли,добавляют к раствору соединения общей формулы (I) в инертном органическом растворителе, или до-2 009373 бавляется раствор кислоты, используемой для образования соли, в инертном органическом растворителе. Соединения общей формулы (II), используемые в качестве исходных веществ в способе по изобретению, до настоящего времени не были описаны в литературе. Согласно другому аспекту настоящего изобретения предложены новые соединения общей формулы(II), где R имеет значение, установленное выше. В соответствии еще с одним аспектом настоящего изобретения предложены соединения общей формулы (VIII) где Y обозначает уходящую группу. Согласно еще одному аспекту настоящего изобретения предлагается способ получения соединений общей формулы (II), где R имеет значение, установленное выше, включающий реакцию соединения формулы (VII) с реагентом, способным вводить Y группу,и реакцию полученного таким образом соединения общей формулы (VIII) с амином общей формулы (V). На первой стадии способа соединение общей формулы (VIII), в которой Y обозначает группу низший алкил или уходящую группу, образуется из 2,3-бензодиазепина формулы (VII) в реакции с реагентом,способным ввести группу Y. Y обозначает группу низший алкил или уходящую группу. Уходящей группой предпочтительно является атом галогена (например, бромид или иодид), арилоксигруппа (например,возможно замещенная феноксигруппа, предпочтительно феноксигруппа) или низшая алкоксигруппа (например, метокси-, этоксигруппа и т.д.). Получение осуществляют всеми известными способами, непосредственно описанными в литературе [Houben-Weyl: Methoden der Organishen Chemie, Carbonsure undCarbonsure-derivative, Band E5; S. Patai: the chemistry of amides, Interscience Publishers, (1970)]. Так, в случае соединений, содержащих в качестве уходящей группы феноксигруппу в позиции Y, предпочтительно проводить ацилирование хлорформиатом в присутствии основания (предпочтительно органическое основание, такое как триэтиламин) при температуре кипения реакционной смеси. В случае соединений, содержащих алкил в позиции Y, предпочтительно проводить реакцию с соответствующим ангидридом карбоновой кислоты (например, уксусным ангидридом или пропионовым ангидридом) при температуре между 100 и 150C. Ангидрид карбоновой кислоты может также служить реакционной средой, и,как правило, нет необходимости использовать другой растворитель. Затем осуществляют взаимодействие полученного таким способом соединения общей формулы(VIII) с амином общей формулы (V). Реакцию проводят, как описано выше для вещества общей формулы(IV) с аминами общей формулы (V). Соединения общей формулы (I), как отмечалось выше, обладают ценными фармацевтическими свойствами, и их особенно можно использовать для лечения и предотвращения расстройств центральной нервной системы, которые можно лечить введением ингибиторов АМРА/каинатных рецепторов. Особенно отмечаются следующие показания: эпилепсия, расстройства, сопровождающиеся мышечной спастичностью, инсульты, травмы, затрагивающие мозг и позвоночник, рассеянный склероз, острый первичный идиопатический полиневрит, мотонейронные заболевания (ALS), болезнь Паркинсона и другие нейродегенеративные расстройства. Согласно дополнительному аспекту настоящего изобретения предлагаются фармацевтические композиции, содержащие в качестве активного ингредиента соединение общей формулы (I),-3 009373 где R имеет значение, установленное выше, или соль этого соединения, образованную добавлением фармацевтически приемлемой кислоты, с подходящим инертным твердым или жидким носителем и/или вспомогательными веществами и, если требуется, другими фармацевтическими активными ингредиентами. Согласно аспекту настоящего изобретения предлагается способ получения фармацевтической композиции, точно определенной выше, способ включает смешивание вещества общей формулы (I) или соли этого вещества, образованной добавлением фармацевтически приемлемой кислоты, с инертным твердым или жидким фармацевтическим носителем и/или дополнительными веществами и, если требуется, с добавочными фармацевтически активными ингредиентами, а также приведение смеси к форме галенова препарата. Фармацевтические композиции согласно изобретению можно производить способами, обычно применяемыми в фармакологической промышленности. Фармацевтические композиции по настоящему изобретению могут подходить для перорального (например, таблетки, таблетки в оболочке, капсулы,пилюли, растворы, суспензии или эмульсии), парентерального (например, растворы для внутривенных,внутримышечных или интраперитонеальных инъекций), ректального (например, свечи) или местного(например, мази) применения. Твердые или жидкие фармацевтические композиции можно производить с помощью методов, обычно применяемых в фармацевтической промышленности. Твердые фармацевтические композиции для перорального введения могут содержать связующие вещества (такие, как желатин, сорбит, поливинилпирролидон и т.д.), носители (такие, как лактоза, глюкоза, крахмал, фосфат калия), вспомогательные вещества для изготовления таблеток (например, стеарат магния, тальк, полиэтиленгликоль, диоксид кремния и т.д.) и вещества, способствующие смачиванию(например, лаурилсульфат натрия). Фармацевтические композиции для перорального применения могут представлять собой растворы, суспензии или жидкие эмульсии, содержащие суспендирующие вещества(например, метил-n-гидроксибензоат и т.д.). Фармацевтические композиции для парентерального введения, как правило, представляют собой стерильные растворы активного ингредиента в воде или изотоническом растворе хлорида натрия. Фармацевтические композиции для ректального введения (например, свечи) содержат активный ингредиент,равномерно распределенный в основном материале (например, масле какао и т.д.), обычно применяемом для изготовления суппозиторий. Фармацевтические композиции по изобретению можно производить с помощью способов, обычно применяемых в фармакологической промышленности. Соединение общей формулы (I) или его соль, образованная добавлением фармацевтически приемлемой кислоты, смешивается с инертным твердым или жидким фармацевтическим носителем и вспомогательными веществами, затем смесь приводится к форме галенова препарата. Различные фармацевтические составы и соответствующие им препараты описаны,например, в Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co., Easton, USA, (1990). Фармацевтические композиции по данному изобретению, как правило, содержат 0,1-95,0 мас.% соединения общей формулы (I), или соль данного соединения, образованную добавлением фармацевтически приемлемой кислоты, или четвертичное аммониевое производное данного соединения. Дневная доза соединения общей формулы (I) зависит от нескольких факторов, например от активности активного ингредиента, способа введения, степени тяжести излечиваемого заболевания, общего состояния пациента, возраста и веса тела пациента. Доза для перорального введения для взрослого человека составляет 0,5-1000 мг,предпочтительно от 20 до 200 мг в день, доза может вводиться пациенту одной или несколькими порциями. В случае заболевания, требующего неотложной помощи, может вводиться одиночная доза 10-1000 мг. Глутамат является наиболее важным возбуждающим нейронным медиатором центральной нервной системы. Действие глутамата передается с помощью рецепторов NMDA, АМРА и каинатного типа, связанных через ионный канал. Неконкурентные ингибиторы АМРА/каинатных рецепторов со структурой 2,3-бензодиазепина обладают сильным мышечно-релаксирующим, нейропротективным и противосудорожным эффектом, и потенциально эти соединения можно применять в случаях всех заболеваний, при которых ингибирование АМРА/каинатных рецепторов дает благоприятный результат. Такими заболеваниями, например, являются эпилепсия, расстройства, сопровождающиеся мышечной спастичностью,различные нейродегенеративные заболевания, инсульт и т.д. Неожиданно было обнаружено, что сила неконкурентного АМРА антагонистического воздействия 2,3-бензодиазепинов, соответствующих общей формуле (I), является неизменной, тогда как их токсичность, проявляющаяся в течение длительного применения, пренебрежимо мала. Способы Тест распространяющаяся депрессия на сетчатке глаза цыплят. Исследование проводилось по Ширдоуну (Sheardown) (1993). Цыплят (Shaver Redbrow, возраст 4-7 дней) обезглавили под анестезией диэтиловым эфиром. Глаза удалили и рассекли по экваториальной плоскости. Ближнюю часть и стекловидное тело удалили, дальнюю часть глаза поместили в раствор Рингера (Ringer) следующего состава: NaCl 100 mM, KCl 3 mM, CaCl2 1 mМ, MgSO4 1 mM, NaHCO3 30 mМ, D-глюкоза 10 mМ, рН 7,3. После периода стабилизации длительностью 90 мин значение латентности распространяющейся депрессии (SD), вызванной действием 5 мкМ S-AMPA, измеряли при комнатной температуре.-4 009373 Первый показатель латентности был контрольной величиной. Далее сетчатка инкубировалась в течение 15 мин в растворе Рингера, содержащем тестируемое соединение, и значение латентности распространяющейся депрессии (SD) измеряли снова в присутствии тестируемого соединения. После инкубации сетчатки в течение 60 мин в растворе Рингера, не содержащем лекарства, измеряли значение латентности распространяющейся депрессии (SD) для того, чтобы оценить степень восстановления после действия лекарства. Увеличение латентности распространяющейся депрессии на 30 с или более оценивалось как 100% ингибирование. СсылкиStudy. Brain Res. 607, 189-194. Тест максимального электросудорожного шока на мышах. Эксперименты проводили по Свиниарду и соавторам (Swinyard et al.) (1952). Мужские особи NMRI мышей весом 20-25 г подвергали действию тестируемых соединений, введенных интраперитонеально,объемом 10 мкл/кг. Спустя 30 мин через корнеальные электроды подействовали электрическим током мощностью 50 Гц, 40 мА, 0,4 с, далее прослеживали возникновение или отсутствие тонических судорог экстензора задних лапок у всех особей мышей. Реакция была положительной, если у животных наблюдались тонические судороги экстензора задних лапок, и отрицательной, если отклика не возникало. Число животных, у которых обнаруживалась положительная реакция, подсчитывалось в каждой группе. Доза тестируемого вещества, вызывающая 50% (ED50) ингибирование, рассчитывалась по методу Литчфилдаand rats. J. pharmacol. 106, 319-330 (1952). Необратимая фокальная ишемия головного мозга у мышей. В экспериментах использовался модифицированный метод Каркоутли (Karkoutly) и соавторов (1990). Мужским особям NMRI мышей весом 30-35 г под анестезией 2,2,2-трибромэтанола вводили 500 мг/кг(20 мл/кг) i.p. Хирургические процедуры проводили по Велшу (Welsh) и соавторам (1987). После просверливания отверстия в черепе периферийную ветвь средней артерии большого мозга подвергли электрокоагуляции. Тестируемые соединения вводили через 30 мин после операции. 2 дня спустя животных усыпили пентобарбиталом натрия (120 мг/кг i.p.). Мозг промыли через левый желудочек сердца 4% раствором 2,3,5-трифенилтетразолинхлорида (ТТС). Час спустя животных обезглавили, мозги удалили и поместили на несколько минут в ледяной физиологический раствор. Затем мозги поместили в 8% формалиновый раствор на 24 ч. Площадь поверхности некротического мозга (не обработанного ТТС) измерялась с помощью компьютерной системы анализа изображения (DigiCell для Windows 4.0). Статистическую значимость оценивали, используя ANOVA, сразу после теста Данкана (Duncan). Результаты 1-(4-Амино-3-метилфенил)-8-хлор-4-метил-3-метилкарбамоил-3H-2,3-бензодиазепин, по статистике, значительно уменьшал площадь некротической поверхности уже при дозе 0,3 мг/кг, в то время, как эталонное вещество, 7-ацетил-5-(4-аминофенил)-8-метил-7 Н-1,3-диоксоло-[4,5-h][2,3]-бензодиазепин,давал такой же эффект только в дозе 10 мг/кг i.p. (табл. 1). Таблица 1 Нейропротективный эффект 1-(4-амино-3-метилфенил)-8-хлор-4-метил-3-метилкарбамоил-3H-2,3 бензодиазепина при моделировании постоянной фокальной ишемии на мышах-5 009373 Фармакологическое тестирование 7-ацетил-5-(4-аминофенил)-8-метил-7 Н-1,3-диоксоло-[4,5-h][2,3]бензодиазепина, нехирального соединения с химической структурой, подобной структуре соединений общей формулы (I) настоящего изобретения, демонстрирует, что эффективность 1-(4-амино-3-метилфенил)-8-хлор-4-метил-3-метилкарбамоил-3H-2,3-бензодиазепина, соединения, представляемого настоящим изобретением, в нейропротективном тесте значительно выше. Такой результат был совершенно неожиданным. Основываясь на приведенных выше результатах, соединения общей формулы (I) по настоящему изобретению с химической структурой 2,3-бензодиазепина могут быть особенно эффективными при лечении заболеваний мозга, характеризующихся нейронной потерей, первичного инсульта, травм головного и спинного мозга, рассеянного склероза, острого первичного идиопатического полиневрита,мотонейронных заболеваний (ALS), болезни Паркинсона и других нейродегенеративных расстройств. Ссылкиduring ischemia in mouse. J. Neurochem. 49: 846-851 (1987). Изучение токсичности на крысах. Изучение проводилось на женских особях крыс Вистар (Wistar). За один день до испытаний всех животных взвесили и распределили случайным образом в группы для изучения (по 10 особей в каждой группе). Тестируемые соединения приготовили в виде суспензии в 0,4% растворе гидроксиметилцеллюлозы (Methocell F4 М, Daw Chemical Company, USA) и вводили перорально 1 раз в день в течение 7 дней. Доза нехиральных соединений по примерам 8 и 9 составляла 15 мг/кг/день. Животных контрольной группы обработали лекарственной средой. Вес животных регистрировался каждый день. Прибылью в весе являлась разница между весом тела в первый день и весом тела в последний день эксперимента. Токсичность тестируемых соединений проявлялась в понижении скорости увеличения веса тела или потере веса. Результаты приведены в табл. 2. Таблица 2SD - распространяющаяся депрессия (в сетчатке цыпленка): антагонист рецепторов AMPA S-AMPA вызывает медленно прогрессирующее изменение в оптической плотности, начиная с края глазной чаши и распространяясь на всю сетчатку. Антагонисты АМРА/каинатных рецепторов могут замедлять этот процесс.MES - максимальный электросудорожный шок (на мышах): электрошоком достаточной силы тока действовали на мышей через корнеальные электроды, вызывая тонические судороги экстензора задних лапок.BWG - прибавление в весе: разница между весом тела в первый и последний дни эксперимента приводится как среднее значение стандартная ошибка. Приведенные выше результаты демонстрируют, что производные 2,3-бензодиазепина по настоящему изобретению индуцируют in vitro и in vivo эффекты, обычно характерные для ингибиторов АМРА/каинатных рецепторов. С другой стороны, соединения по настоящему изобретению практически не влияют на прибавление в весе при введении женским особям крыс Wistar в течение 7 дней, то есть эти вещества не обладают токсическим эффектом. Эти результаты показывают, что соединения формулы (I) вызывают сильные АМРА/каинатные антагонистические эффекты, в то время, как их токсичность пренебрежимо мала в течение продолжительного применения. Соединения по настоящему изобретению могут быть пригодными для лечения расстройств центральной нервной системы, при которых доказана или постулирована патофизиологическая роль или дисфункция глутаматэргической системы и при которых благоприятно ингибирование АМРА/каинатных-6 009373 рецепторов. Так, производные 2,3-бензодиазепина по настоящему изобретению могут эффективно использоваться для лечения расстройств центральной нервной системы, при которых введение ингибиторов АМРА/каинатных рецепторов оказывается благотворным для достижения или поддержания терапевтического действия. Соединения общей формулы (I), главным образом, применимы при следующих терапевтических показаниях: эпилепсия, спастическая ригидность, инсульт, мозговые и спинно-мозговые травмы, рассеянный склероз, острый первичный идиопатический полиневрит, мотонейронные заболевания (ALS), болезнь Паркинсона и другие нейродегенеративные нарушения. Согласно дополнительному аспекту настоящего изобретения предусматривается использование соединений общей формулы (I) и их солей, образованных добавлением фармацевтически приемлемых кислот, в качестве фармацевтических ингредиентов. Согласно аспекту настоящего изобретения предлагается способ лечения расстройств центральной нервной системы с помощью применения соединений, обладающих ингибирующей активностью АМРА/каинатных рецепторов, который включает введение пациенту, в случае необходимости такого лечения, фармацевтически эффективного количества соединения общей формулы (I) или его соли, образованной добавлением фармацевтически приемлемой кислоты. Дальнейшие детали настоящего изобретения представлены в прилагающихся примерах без ограничения объема охраны изобретения приведенными примерами. Пример 1. 3-Ацетил-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепин. Раствор 1,5 г (4,6 ммоль) 8-хлор-4-метил-1-(3 метил-4-нитрофенил)-5 Н-2,3-бензодиазепина в 15 мл уксусного ангидрида перемешивали при нагревании на масляной бане при 130-140C в течение 5 ч. Реакционную смесь прилили примерно к 200 г измельченного льда, затем образовавшиеся кристаллы отфильтровали. Неочищенный продукт перекристаллизовали из ацетонитрила. Таким образом получили 0,78 г (46%) требуемого соединения, плавящегося при температуре 192-194C. Элементный анализ: C19H16ClN3O3 (369,81). Вычислено: С 61,71%, Н 4,36%, N 11,36%, Cl 9,59%. Найдено: С 60,02%, Н 4,53%, N 11,08%, Cl 9,71%. ИК (KBr): 1681, 1527, 1333, 1309. 1 Н ЯМР (ДМСО-d6):8,06 (d, J=8,4 Гц, 1 Н), 7,66 (dd, J1=2,2 Гц, J2=8,4 Гц, 1 Н), 7,63 (s, 1H), 7,50C ЯМР (ДМСО-d6):169,00, 150,24, 145,85, 140,50, 137,83, 134,34, 133,95, 133,18, 131,37, 130,77,130,31, 130,07, 128,95, 124,80, 123,70, 22,05, 19,48, 19,22. Пример 2. 8-Хлор-4-метил-1-(3-метил-4-нитрофенил)-3-пропионил-3H-2,3-бензодиазепин. Раствор 1,78 г (5,4 ммоль) 8-хлор-4-метил-1-(3-метил-4-нитрофенил)-5 Н-2,3-бензодиазепина в 18 мл пропионового ангидрида перемешивали при нагревании на масляной бане при температуре 130-140C в течение 4 ч. Реакционную смесь прилили примерно к 100 г измельченного льда, экстрагировали 1 раз 50 мл,затем дважды по 20 мл дихлорметаном. Органическую фазу промыли 1 раз 30 мл насыщенного раствора карбоната натрия, затем трижды по 30 мл воды, после высушили над безводным сульфатом натрия. Смолу, полученную после упаривания, очищали колоночной хроматографией и полученный продукт перекресталлизовали из этанола. Таким образом получили 1,01 г (49%) требуемого продукта, плавящегося при температуре 134-138C. Элементный анализ: C20H18ClN3 О 3 (383,84). Вычислено: С 62,58%, Н 4,73%, N 10,95%, Cl 9,24%. Найдено: С 62,06%, Н 4,76%, N 10,85%, Cl 9,14%. ИК (KBr): 1676, 1521, 1349. 1 Н ЯМР (ДМСО-d6):8,07 (d, J=8,4 Гц, 1 Н), 7,68 (dd, J1=2,2 Гц, J2=8,4 Гц, 1H), 7,62 (d, J=1,4 Гц,1H), 7,52 (d, J=8,2 Гц, 1 Н), 7,49 (dd, J1=1,6 Гц, J2=8,3 Гц, 1H), 7,20 (d, J=2,1 Гц, 1 Н), 6,65 (s, 1H), 2,65 (m,2H), 2,55 (s, 3H), 2,17 (d, J=0,7 Гц, 3H), 1,03 (m, 3H). 13 С ЯМР (ДМСО-d6):150,25, 140,53, 137,82, 134,38, 133,90, 133,18, 131,35, 130,74, 130,30, 129,98,128,92, 124,80, 123,65, 123,04, 26,81, 19,49, 19,24, 8,61. Пример 3. 8-Хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепин 3-карбоновой кислоты фениловый эфир. 15 г (45,7 ммоль) 8-хлор-4-метил-1-(3-метил-4-нитрофенил)-5 Н-2,3-бензодиазепина кипятили в смеси 28,85 мл (228,5 ммоль) фенилхлорформиата и 6,34 мл (45,7 ммоль) триэтиламина в течение 3,5 ч. Реакционную смесь разбавили 150 мл циклогексана, растворитель декантировали, получили продукт в виде масла, остаток растворили в дихлорметане, промыли 1 раз насыщенным раствором гидрокарбоната натрия, затем водой и сушили над безводным сульфатом натрия. После упаривания неочищенный продукт перекристаллизовали из этанола. Таким образом получили 11,86 г (58%) требуемого вещества (желтого цвета), плавящегося при температуре 188-190C. Элементный анализ: C24H18ClN3O4 (447,887). Вычислено: С 64,36%, Н 4,05%, N 9,38%, Cl 7,92%. Найдено: С 64,16%, Н 4,01%, N 9,33%, Cl 7,90%.(m, 8H), 6.43 (q, J=0,9 Гц, 1H), 2,63 (s, 3H), 2,39 (d, J=1,2 Гц, 3H). 13 С ЯМР (CDCl3):166,99, 151,01, 150,89, 150,49, 144,91, 140,58, 137,55, 134,51, 134,37, 133,91,131,73, 131,28, 130,23, 130,15, 129,38, 128,78, 125,75, 124,69, 123,61, 121,57, 20,27, 19,93. Пример 4. 8-Хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепин 3-карбоновой кислоты метиламид. 11,86 г (26,4 ммоль) 8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепин-3-фенилкарбоновой кислоты эфира перемешивали с раствором 43 мл метиламина (8 М) в этаноле при комнатной температуре в течение 24 ч. Выделившиеся кристаллы отфильтровали и промыли этанолом. Таким образом получили 8,87 г (87%) требуемого продукта (желтого цвета), плавящегося при температуре 196-198C. Элементный анализ: C19H17ClN4O3 (384,821). Вычислено: С 59,30%, Н 4,45%, N 14,56%, Cl 9,21%. Найдено: С 57,73%, Н 4,35%, N 14,06%, Cl 9,01%. ИК(KBr): 3383, 1670, 1515, 1344,853. 1 Н ЯМР (CDCl3):8,00 (d, J=8,2 Гц, 1 Н), 7,41 (m, 3H), 7,20 (d, J=8,2 Гц, 1H), 6,99 (d, J=2,1 Гц, 1H),6,22 (s, 1H), 6,06 (bq, J=4,3 Гц, 1 Н), 2,97 (d, J=4,9 Гц, 3H), 2,64 (s, 3H), 2,24 (d, J=0,9 Гц, 3H). 13C ЯМР (CDCl3):166,55, 156,30, 150,18, 148,15, 140,89, 138,49, 135,02, 133,91, 133,65, 131,12,131,01, 130,02, 129,65, 128,18, 124,83, 121,57, 26,91, 20,40, 19,78. Пример 5. 8-Хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепин-3-карбоновой кислоты циклопропил амид. 2,07 г (4,6 ммоль) 8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепин-3-карбоновой кислоты фенилового эфира кипятили в 10 мл циклопропиламина в течение 10 ч. Образовавшиеся кристаллы отфильтровали, затем неочищенный продукт перекристаллизовали из этанола. Таким образом получили 1,12 г (59%) требуемого продукта, плавящегося при 221-223C. Элементный анализ: C21H19ClN4O3 (410,867). Вычислено: С 61,39%, Н 4,66%, N 13,64%, Cl 8,63%. Найдено: С 61,27%, Н 4,65%, N 13,62%, Cl 8,54%. ИК (KBr): 3404, 1675, 1516, 1344, 849. 1C ЯМР (ДМСО-d6)166,53, 156,16, 150,00, 147,66, 140,47, 138,45, 135,46, 134,16, 132,97, 130,93,130,39, 129,98, 129,37, 129,14, 124,49, 121,91, 23,20, 19,44 (2C), 6,47. Пример 6. 3-Ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,2-бензодиазепин. 0,78 г (2,1 ммоль) 3-ацетил-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепина растворили в смеси 15 мл метанола и 15 мл дихлорметана, затем добавили при интенсивном перемешивании 0,5 г влажного никелевого катализатора Ренея и 0,26 мл (5,25 ммоль) 98%-ого гидразин гидрата. Смесь перемешивали более 1 ч. Катализатор отфильтровали, промыли дихлорметаном, фильтрат упарили и остаток загустили, растирая его с 15 мл воды. Неочищенный продукт перекристаллизовали из этанола. Таким образом получили 0,56 г (79%) требуемого соединения, плавящегося при 209-211C. Элементный анализ: C19H18ClN3O (339,83). Вычислено: С 67,16%, Н 5,34%, N 12,37%, Cl 10,43%. Найдено: С 65,87%, Н 5,46%, N 12,21%, Cl 10,26%. ИК (KBr): 3388, 3344, 3236, 1646, 1388. 1 Н ЯМР (ДМСО-d6):7,60 (dd, J1=2,3 Гц, J2=8,4 Гц, 1 Н), 7,45 (d, J=8,4 Гц, 1H), 7,26 (d, J=2,2 Гц,1 Н), 7,13 (s, 1 Н), 6,95 (dd, J1=1,8 Гц, J2=8,2 Гц, 1H), 6,61 (d, J=8,3 Гц, 1 Н), 6,58 (s, 1H), 5,55 (bs, 2H), 2,16(s, 3H), 2,10 (s, 3H), 2,06 (s, 3H). 13 С ЯМР (ДМСО-d6):171,00, 168,15, 150,08, 146,10, 137,84, 135,80, 131,89, 130,42, 130,32, 129,57,129,47, 123,35, 122,82, 120,55, 113,09, 21,79, 18,94, 17,56. Пример 7. 1-(4-Амино-3-метилфенил)-8-хлор-4-метил-3-пропионил-3H-2,3-бензодиазепин. 1,01 г (2,63 ммоль) 8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3-пропионил-3H-2,3-бензодиазепина растворили в смеси 20 мл метанола и 5 мл дихлорметана, затем при интенсивном перемешивании добавили 0,5 г влажного никелевого катализатора Ренея и 0,33 мл (6,57 ммоль) 98%-ого гидразингидрата. Смесь перемешивали более 1 ч, катализатор отфильтровали, промыли дихлорметаном, фильтрат упарили, остаток загустили перетиранием с 10 мл воды. Неочищенный продукт перекристаллизовали из этанола. Таким образом получили 0,51 г (55%) требуемого продукта, плавящегося при 218-221C. Элементный анализ: C20H20ClN3O (353,85). Вычислено: С 67,89%, Н 5,70%, N 11,87%, Cl 10,02%. Найдено: С 66,72%, Н 5,82%, N 11,55%, Cl 9,88%. ИК(KBr): 3352, 1639, 1323. 1(m, 1H), 2,16 (d, J=0,7 Гц, 3H), 2,06 (s, 3H), 0,98 (t, J=7,5 Гц, 3H). 13 С ЯМР (ДМСО-d6):171,26, 171,10, 150,11, 146,21, 137,86, 135,86, 131,85, 130,43, 130,32, 129,57,129,47, 123,33, 122,85, 120,56, 113,07, 26,73, 18,97, 17,59, 8,77. Пример 8. 1-(4-Амино-3-метилфенил)-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепин 3-карбоновой кислоты метиламид. 10,89 г (28 ммоль) 8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3H-2,3-бензодиазепин 3-карбоновой кислоты метиламида растворили в смеси 190 мл метанола и 95 мл дихлорметана и затем при интенсивном перемешивании добавили 0,5 г влажного никелевого катализатора Ренея и 3,5 мл (70 ммоль) 98%ого гидразин гидрата. Смесь перемешивали более 1 ч, катализатор отфильтровали, промыли дихлорметаном, фильтрат упарили и остаток загустили, растирая его с 100 мл воды. Неочищенный продукт перекристаллизовали из этанола. Таким образом получили 7,73 г (78%) требуемого соединения, плавящегося при температуре 210-212C. Элементный анализ: C19H19ClN4O (354,838). Вычислено: С 64,31%, Н 5,40%, N 15,79%, Cl 9,99%. Найдено: С 63,99%, Н 5,33%, N 15,69%, Cl 9,97%. ИК (KBr) 3465, 3397, 3378, 1668, 1507, 1318. 1 Н ЯМР (CDCl3):7,35 (dd, J1=2,2 Гц, J2=8,3 Гц, 1 Н), 7,21 (m, 2 Н), 7,16 (d, J=8,3 Гц, 1 Н), 7,07 (dd,J1=2,1 Гц, J2=8,3 Гц, 1H), 6,64 (d, J=8,2 Гц, 1H), 6,21 (s, 1H), 6,04 (bq, J=4,9 Гц, 1H), 3,93 (bs, 2H), 2,94 (d,J=4,9 Гц, 3H), 2,24 (d, J=1,0 Гц, 3H), 2,18 (s, 3H). 13C ЯМР (CDCl3):169,67, 156,64, 147,72, 147,35, 138,52, 136,28, 131,79, 130,45, 130,30, 130,09,129,49, 129,42, 125,98, 121,72, 121,60, 114,07, 26,78, 19,42, 17,28. Пример 9. 1-(4-Амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин-3-карбоновой кислоты циклопропиламид. 1,38 г (3,35 ммоль) 8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3 Н-2,3-бензодиазепин-3-карбоновой кислоты циклопропиламида растворили в смеси 28 мл метанола и 14 мл дихлорметана, затем при интенсивном перемешивании добавили 1,0 г влажного никелевого катализатора Ренея и 0,42 мл (8,37 ммоль) 98%-ого гидразин гидрата. Смесь перемешивали более 1 ч, катализатор отфильтровали, промыли дихлорметаном, фильтрат упарили и остаток загустили, растирая его с 10 мл воды. Неочищенный продукт перекристаллизовали из этанола. Таким образом получили 1,15 г (90%) требуемого соединения, плавящегося при 233-236C. Элементный анализ: C21H21Cl4O (380,876). Вычислено: С 66,22%, Н 5,56%, N 14,71%, Cl 9,31%. Найдено: С 66,16%, Н 5,60%, N 14,78%, Cl 9,27%. ИК (KBr): 3394, 3333, 1669, 1506. 1 Н ЯМР (ДМСО-d6):7,55 (dd, J1=2,0 Гц, J2=8,3 Гц, 1 Н), 7,37 (d, J=8,4 Гц, 1 Н), 7,21 (s, 1H), 7,16 (d,J=2,0 Гц, 1 Н), 7,04 (dd, J1=1,6 Гц, J2=8,2 Гц, 1 Н), 6,75 (bq, J=2,7 Гц, 1 Н), 6,59 (d, J=8,3 Гц, 1 Н), 6,37 (s,1H), 5,47 (bs, 2H), 2,58 (m, 1 Н), 2,11 (s, 3H), 2,05 (s, 3H), 0,60 (m, 4 Н). 13 С ЯМР (ДМСО-d6):168,73, 156,44, 149,69, 147,69, 138,49, 136,92, 132,08, 129,95, 129,78, 129,56,129,14, 122,92, 121,47, 120,38, 112,96, 23,15, 19,07, 17,45, 6,42. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные 8-хлор-2,3-бензодиазепина общей формулы (I) где R означает группу C1-C6 алкила или группу общей формулы -NH-R1, где R1 означает группу C1-C6 алкила или С 3-С 7 циклоалкила; а также их соли, образованные добавлением фармацевтически приемлемой кислоты. 2. Соединения общей формулы (I) по п.1, где R означает группу С 1-4 алкилов, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты. 3. Соединения общей формулы (I) как по п.2, где R означает метил или этил, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты. 4. Соединения общей формулы (I) по п.1, где R означает группу с формулой -NH-R1, в которой R1-9 009373 означает группу С 1-4 алкилов или группу С 3-6 циклоалкилов, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты. 5. Соединения общей формулы (I) по п.4, где R1 означает метил- или циклопропилгруппу, а также соли этих соединений, образованные добавлением фармацевтически приемлемых кислот. 6. Соединения по любому из пп.1-5: 1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин 3-карбоновой кислоты метиламид; 1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3-бензодиазепин 3-карбоновой кислоты циклопропиламид; 3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-3H-2,3 бензодиазепин; 3-пропионил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-3 Н-2,3-бензодиазепин, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты. 7. Способ получения соединений общей формулы (I), где R означает группу C1-6 алкила или группу с формулой -NH-R1, в которой R1 означает группу алкила C1-6 или группу циклоалкила С 3-7, а также соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты, включающий а) восстановление вещества общей формулы (II) где R имеет значение, установленное выше, или б) получение веществ общей формулы (I), содержащих на месте R группу общей формулы -NH-R1,где R1 имеет значение, установленное выше, то есть соединения общей формулы (III) где R1 имеет значение, установленное выше, реакцией вещества общей формулы (IV) где Y обозначает С 1-С 6 алкил, атом галогена, арилоксигруппу или алкоксигруппу С 1-С 6 алкилов, с амином общей формулы (V)H2N-R1 (V) где R1 имеет значение, установленное выше, и, если требуется, преобразование соединения общей формулы (I), полученного таким способом, в его соль посредством добавления фармацевтически приемлемой кислоты. 8. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение общей формулы (I) (где R имеет значение, установленное в п.1) или соли этих соединений, образованные добавлением фармацевтически приемлемой кислоты, в смеси с инертным твердым или жидким носителем,и /или вспомогательными веществами, и, если требуется, добавочными фармацевтическими ингредиентами. 9. Способ изготовления фармацевтической композиции по п.8, который включает смешивание соединения общей формулы (I) или соли этого соединения, образованной добавлением фармацевтически приемлемой кислоты, с твердым или жидким инертным носителем и/или вспомогательными веществами и, если требуется, с добавочными фармацевтическими ингредиентами, а также приведение смеси к форме галенова препарата.- 10009373 10. Использование соединений общей формулы (I) и их солей, образованных добавлением фармацевтически приемлемой кислоты в качестве фармацевтических ингредиентов. 11. Способ лечения расстройств центральной нервной системы с помощью применения соединений,обладающих ингибирующей активностью АМРА/каинатных рецепторов, который включает введение пациенту, в случае необходимости такого лечения, фармацевтически эффективного количества соединения общей формулы (I) или его соли, образованной добавлением фармацевтически приемлемой кислоты. 12. Соединения общей формулы (II), где R имеет значение, установленное в п.1. 13. Соединения общей формулы (VIII) где Y обозначает атом галогена, арилоксигруппу или алкоксигруппу С 1-С 6 алкилов. 14. Способ получения соединений общей формулы (II) по п.12, где R имеет значение, определенное в п.12, включающий реакцию вещества общей формулы (VII) с реагентом, способным вводить Y группу, и реакцию полученного таким образом соединения общей формулы (VIII) с амином общей формулы (V).
МПК / Метки
МПК: C07D 243/02
Метки: 8-хлор-2,3-бензодиазепина, производные
Код ссылки
<a href="https://eas.patents.su/12-9373-proizvodnye-8-hlor-23-benzodiazepina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 8-хлор-2,3-бензодиазепина</a>
Предыдущий патент: N- ациламинобензольные производные в качестве селективных ингибиторов моноаминооксидазы в
Следующий патент: Активирующее ppar соединение и содержащая его фармацевтическая композиция
Случайный патент: Кронштейн для радиатора