Применение glp-1 или его аналогов в лечении инфаркта миокарда
Формула / Реферат
1. Способ снижения смертности и заболеваемости после инфаркта миокарда, включающий введение пациенту, нуждающемуся в этом, соединения, которое выбирается из группы, включающей GLP-1, GLP-1 аналоги, GLP-1 производные и их фармацевтически приемлемые соли, в дозе, обеспечивающей эффективную нормализацию содержания глюкозы в крови.
2. Способ по п.1, где упомянутое соединение вводится внутривенно.
3. Способ по п.1, где упомянутое соединение вводится подкожно.
4. Способ по любому из пп.1-3, где скорость введения упомянутого соединения составляет от 0,25 до 6 пмоль/кг/мин.
5. Способ по п.4, где скорость введения упомянутого соединения составляет от 0,5 до 2,4 пмоль/кг/мин.
6. Способ по п.5, где упомянутая скорость составляет приблизительно от 0,5 пмоль/кг/мин приблизительно до 1,2 пмоль/кг/мин.
7. Способ по п.1, где упомянутое соединение вводится внутривенно и, кроме того, иным парентеральным путем.
8. Способ по п.7, где иным парентеральным путем является подкожный путь.
9. Способ по п.1, где упомянутым вводимым соединением является GLP-1(7-36) амид либо его фармацевтически приемлемая соль.
10. Способ снижения смертности и заболеваемости после инфаркта миокарда, включающий введение соединения, которое проявляет инсулинотропную активность посредством взаимодействия с тем рецептором либо рецепторами, с которыми взаимодействует GLP-1 при проявлении своей инсулинотропной активности.
11. Способ снижения заболеваемости и смертности после инфаркта миокарда, включающий введение соединения, которое усиливает чувствительность к инсулину посредством взаимодействия с тем рецептором либо рецепторами, с которыми взаимодействует GLP-1 для усиления чувствительности к инсулину.
Текст
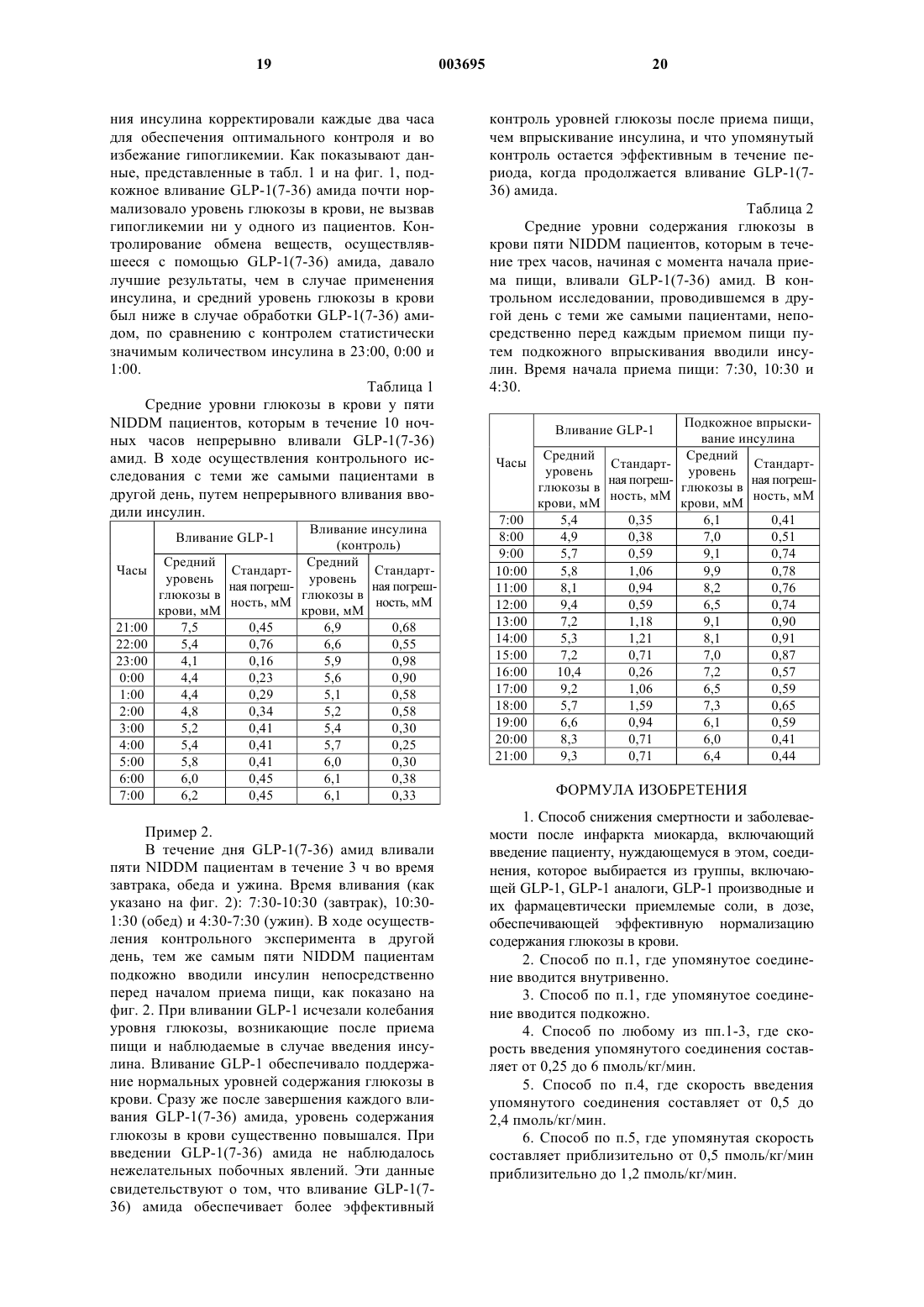
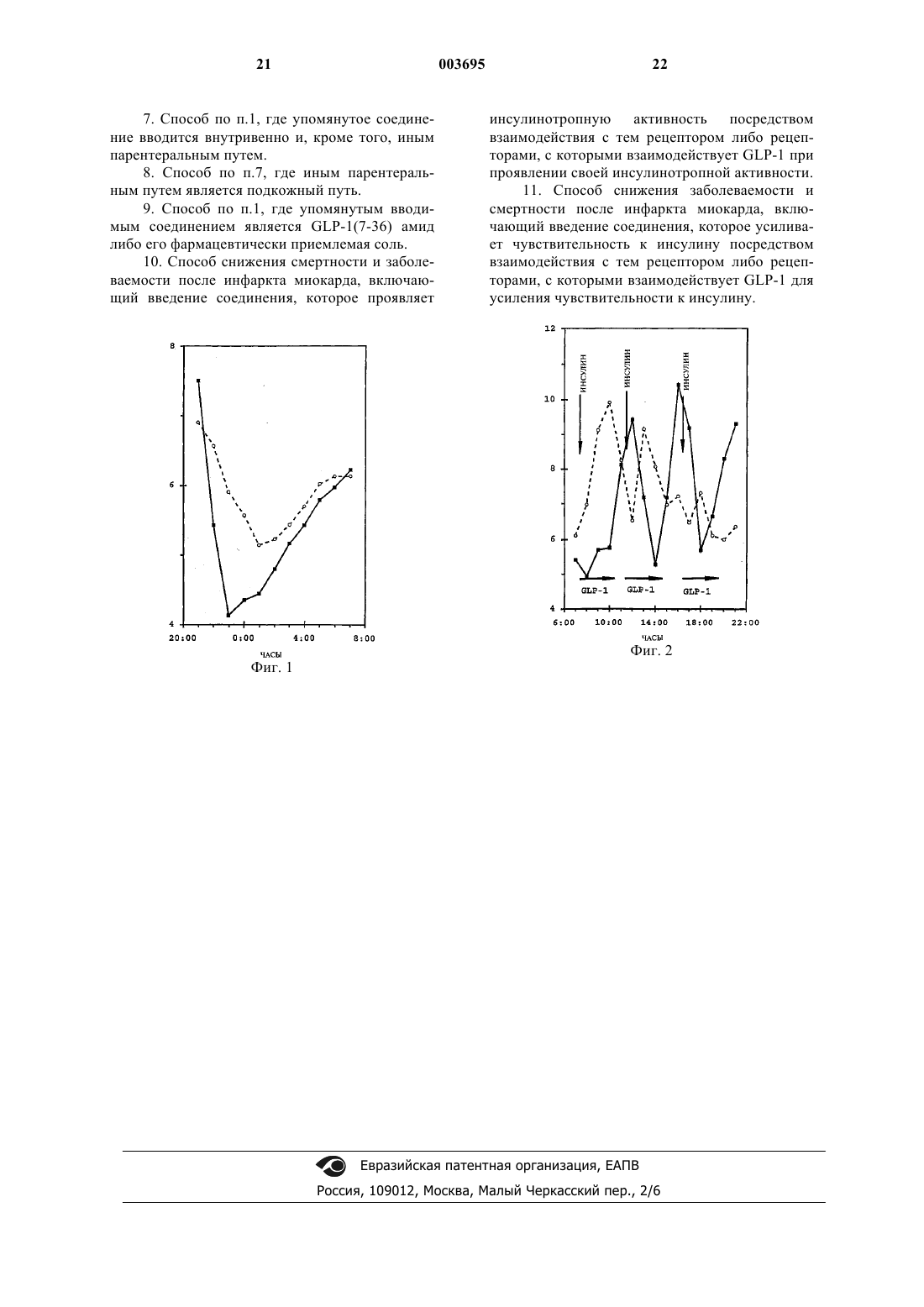
1 Предпосылки создания изобретения Область, к которой относится изобретение Настоящее изобретение относится к способу снижения смертности и заболеваемости пациентов-диабетиков после инфаркта миокарда. Вспомогательная информация Заболеваемость и смертность от сердечнососудистых болезней выше у пациентов с проявляющимся диабетом либо нарушенной толерантностью к глюкозе, по сравнению с пациентами, не имеющими подобных расстройств. Диабетики составляют до 24% от общего числа пациентов, поступающих в отделения интенсивной терапии для больных с острой коронарной недостаточностью по подозрению на инфаркт, в то время, как они составляют лишь около 5% от общего числа пациентов [Мальмберг (Malmberg) и Райден (Ryden); Фаллер Дж.Г. (Fuller J.H.), Diabet. Metab. 19:96-99(1993)]. Больничная смертность пациентовдиабетиков с инфарктом миокарда в 2 раза превышает соответствующие показатели для недиабетиков [Хемстен А. (Hamsten A.) и другие,J. Int. Med. 736:1-3 (1994), Приложение 236; Мальмберг К. и Райден Л., Eur. Heart J. 9:256264 (1988)]. Диабетики чаще заболевают и чаще умирают на этапе выздоровления после острого приступа болезни, главным образом, вследствие смертельного повторного инфаркта и застойной сердечной недостаточности [Мальмберг и Райден; Стоун П. (Stone Р.) и другие, J. Am. Coll.Am. Coll. Cardiol. 22:707-713 (1993)]. Различие в уровне смертности и заболеваемости между диабетиками и недиабетиками после инфаркта миокарда сохраняется, несмотря на снижение количества случаев заболеваемости и смертности после острого инфаркта миокарда [Грейнджер K.Б. (Granger С.В.) и другие, J. Am. Coll.(1993)]. Факторы, обусловливающие неблагоприятный прогноз среди пациентов-диабетиков с острым инфарктом миокарда, могут действовать перед, во время и после острого приступа. К ним относится рассеянный атеросклероз коронарных сосудов, с более запущенной и обширной болезнью коронарной артерии, которая,вместе с возможной диабетической кардиомиопатией, может способствовать высокому преобладанию застойной сердечной недостаточности. Значение может иметь также и автономная невропатия с нарушенным восприятием боли и повышенными колебаниями частоты сердечных сокращений в покое. Коронарный тромб является неотъемлемой частью развивающегося инфаркта и, что примечательно, у пациентовдиабетиков было обнаружено нарушение актив 003695 2 ности тромбоцитов, коагуляции и фибринолитических функций. [Деви Г. (Davi G.) и другие,New England J. Med., 322:1769-1774 (1990)]. Важную роль у диабетиков могут играть усиленные нарушения обмена веществ. Следствием инфаркта миокарда является снижение уровня инсулина в системе кровообращения,весьма существенное снижение адренергического тонуса и выделение стрессовых гормонов,например, кортизона, катехоламинов и глюкагона, которые вместе усиливают гипергликемию и стимулируют липолиз. Выделенные свободные жирные кислоты через посредство нескольких механизмов дополнительно повреждают сердечную мышцу, в то время, как избыточное окисление свободных жирных кислот, возможно, может вызывать повреждение не пораженных ишемией частей сердечной мышцы [Родригес Б. (Rodrigues В.) и другие. CardiovascularResearch, 26 (10):913-922 (1992)]. Необходимы паллиативные меры по нормализации уровня глюкозы в крови и контролированию метаболического каскада, который обостряет у диабетиков поражения, вызванные диабетом. В недавнем исследовании, улучшенная коррекция метаболических нарушений у пациентов-диабетиков при остром инфаркте миокарда, включая тщательно контролируемое вливание инсулина и глюкозы, а также жесткое регулирование уровней глюкозы в крови после острого приступа посредством подкожного многоразового введения инсулина, позволила снизить смертность в течение года после инфаркта миокарда на 30%, по сравнению с контрольной группой диабетиков, которым инсулин вводился лишь в случае необходимости по клиническим показаниям [Мальмберг К. и другие, J. Am.College Cardiology, 26:57-65 (1995)]. Вливание инсулина, однако, создает потенциальную возможность возникновения гипогликемии, которая определяется как уровень глюкозы в крови ниже 0,3 мМ. Гипогликемия повышает опасность желудочковых экстрасистолий и представляет собой опасное последствие вливания инсулина. С целью предотвращения гипогликемии был разработан алгоритм вливания инсулина для диабетиков [Хендра Т.Дж. (Hendra Т.J.) и другие, Diabetes Res. Clin.Pract., 16:213-220 (1992)]. Однако, в случае применения упомянутого алгоритма, гипогликемия развилась у 21% пациентов. В другом исследовании, посвященном контролированию уровня глюкозы после инфаркта миокарда, гипогликемия развилась у 18% пациентов в случае вливания инсулина и глюкозы [Мальмберг K.А.(Malmberg K.A.) и другие, Diabetes Care,17:1007-1014 (1994)]. При вливании инсулина также часто требуется контролирование уровней глюкозы в крови для того, чтобы можно было обнаружить появление признаков гипогликемии и снять их как можно быстрее. У пациентов, которым в 3 ходе осуществления вышеупомянутого исследования [Мальмберг, 1994] производили вливание инсулина, уровни глюкозы в крови измеряли, как минимум, через каждый час и, в соответствии с этим, корректировали скорость вливания. Таким образом, безопасность и эффективность способа лечения пациентов с инфарктом миокарда посредством вливания инсулина и глюкозы зависит от простоты и скорости доступа к данным, касающимся уровня глюкозы в крови. Подобная настоятельная потребность контролирования уровня глюкозы в крови возлагает тяжелое бремя на медицинский персонал,а также повышает неудобства и стоимость лечения. Как следствие, отделения для больных сердечно-сосудистыми заболеваниями часто не выделяют ресурсов для оптимизации уровней содержания глюкозы в крови у диабетиков с острым инфарктом миокарда, что могло бы обеспечиваться посредством внутривенного введения инсулина. Учитывая опасность и нагрузки, характерные для вливания инсулина,необходим альтернативный подход к регулированию уровня глюкозы в крови во время острого инфаркта миокарда у диабетиков. Гормон инкретин, глюкагоноподобный пептид 1, сокращенно обозначаемый, как GLP1, образуется из проглюкагона в желудочнокишечном тракте и усиливает выделение инсулина, индуцируемое питательными веществами[Крциманн Б. (Krcymann В.) и другие, Lancet 2:1300-1303 (1987)]. Известно, что различные процессированные формы GLP-1 стимулируют секретирование инсулина (инсулинотропное действие) и образование цАМФ [см., например,Мойсов С. (Mojsov S.), Int. J. Peptide Protein Research, 40:333-343 (1992)]. Была установлена взаимосвязь между результатами различных лабораторных экспериментов in vitro и инсулинотропными реакциями млекопитающих, особенно людей, на экзогенное введение GLP-1,GLP-1(7-36) амида и GLP-1(7-37) кислоты [см.,например, Наук М.А. (Nauck M.A.) и другие,Diabetologia, 36:741-744 (1993); Гутняк М. (Gutniak М.) и другие. New England J. of Medicine,326 (20):1316-1322 (1992); Наук M.A. и другие,J. Clin. Invest., 91:301-307 (1993); и Торенс Б.(1993)]. GLP-1(7-36) амид оказывает явно выраженное антидиабетогенное воздействие на инсулинозависимых диабетиков посредством стимулирования чувствительности к инсулину и повышения выделения инсулина, индуцированного глюкозой, в физиологических концентрациях [Гутняк М. и другие, New England J. Med. 326:1316-1322 (1992)]. GLP-1(7-36) амид, в случае введения инсулинонезависимым диабетикам, стимулирует выделение инсулина, снижает секретирование глюкагона, замедляет опорожнение желудка и усиливает использование глюкозы [Наук, 1993; Гутняк, 1992; Наук, 1993]. 4 Помехой для использования молекул типаGLP-1 для длительного лечения является то, что период полувыведения таких пептидов из системы кровообращения является весьма непродолжительным. Например, период полувыведения GLP-1(7-37) из системы кровообращения составляет всего лишь от 3 до 5 мин. Период полувыведения GLP-1(7-36) амида, в случае его подкожного введения, составляет приблизительно 50 мин. Таким образом, для достижения продолжительного воздействия упомянутые молекулы GLP должны вводиться посредством непрерывного вливания [Гутняк М. и другие,Diabetes Care 17:1039-1044 (1994)]. Непродолжительный период полувыведения и последующая необходимость в постоянном введенииGLP-1 не являются недостатком в данном изобретении, поскольку пациент, как правило, прикован к постели в отделении для больных сердечно-сосудистыми заболеваниями, где жидкости постоянно вводятся парентеральным путем. Краткое изложение сущности изобретения Настоящее изобретение предоставляет способ снижения смертности и заболеваемости после инфаркта миокарда, который включает введение пациенту, нуждающемуся в этом, соединения из группы, в состав которой входятGLP-1, GLP-1 аналоги, GLP-1 производные и их фармацевтически приемлемые соли, в дозе, эффективной для нормализации уровня глюкозы в крови. Настоящее изобретение обеспечивает преимущества снижения смертности и заболеваемости после инфаркта миокарда, наблюдаемые при комбинированном лечении глюкозой и инсулином у диабетиков при остром инфаркте миокарда, но без неудобной и дорогостоящей потребности в частом контролировании уровня содержания глюкозы в крови, истолкования результатов определения уровня содержания глюкозы в крови и корректирования скорости введения инсулина, а также без постоянно присутствующей опасности гипогликемии, которой сопровождается вливание инсулина. Краткое описание рисунков Фиг. 1 - кривая, демонстрирующая влияние непрерывного вливания GLP-1(7-36) амида на среднюю концентрацию глюкозы в крови(мМ) у пяти инсулинонезависимых пациентов, больных сахарным диабетом (NIDDM),в течение ночи. Упомянутая кривая также показывает влияние непрерывного вливания инсулина на среднюю концентрацию глюкозы в крови у тех же самых пяти инсулинонезависимых пациентов-диабетиков, но в течение другой ночи. Фиг. 2 - кривая, показывающая влияние вливания GLP-1(7-36) амида на среднюю концентрацию глюкозы в крови (мМ) у пяти инсулинонезависимых пациентов-диабетиков,при вливании его в течение дня в продолжение трех часов, начиная с момента начала каждого 5 приема пищи во время завтрака, обеда и ужина. Упомянутая кривая показывает также влияние подкожного введения инсулина на среднюю концентрацию глюкозы в крови у тех же самых пяти инсулинонезависимых пациентовдиабетиков, но в течение другого дня, и с впрыскиванием незадолго до начала каждого приема пищи. Подробное описание изобретения"GLP-1" означает GLP-1(7-37). По традиции, принятой в данной области, аминоконечная область GLP-1(7-37) обозначается номером 7, в то время, как карбоксиконечная - номером 37. Аминокислотная последовательность GLP-1(737) хорошо известна в данной области, однако,она приведена далее для удобства читателя:"GLP-1 аналог" определяется, как молекула, имеющая одну или несколько аминокислотных замен, делеций, инверсий либо добавок, по сравнению с GLP-1. К числу GLP-1 аналогов,известных в данной области, относятся, например, GLP-1(7-34) и GLP-1(7-35), GLP-1(7-36),Gln9-GLP-1(7-37), D-Gln9-GLP-1(7-37), Thr16Lys18-GLP-1(7-37) и Lys18-GLP-1(7-37). Предпочтительными GLP-1 аналогами являютсяGLP-1(7-36), которые представляют собой биологически процессированные формы GLP-1,обладающие инсулинотропными свойствами. Другие GLP-1 аналоги раскрываются в патенте США 5545618, который включен в настоящее описание в качестве ссылки."GLP-1 производное" определяется, как молекула, имеющая аминокислотную последовательность GLP-1 либо GLP-1 аналога, но, дополнительно, имеющая химическую модификацию одной или нескольких своих аминокислотных боковых групп, атомов -углерода, конечной аминогруппы либо конечной карбокислотной группы. Химическая модификация включает, но, однако, этим не ограничивается, добавку химических составляющих, образование новых связей и удаление химических составляющих. Модификации аминокислотных боковых групп включают, без ограничения, ацилирование лизиновых -аминогрупп, N-алкилирование аргинина, гистидина либо лизина, алкилирование глутаминовых либо аспарагиновых карбокислотных групп и деамидирование глутамина либо аспарагина. К модификациям конечных аминогрупп относятся, без ограничения, модификации дезаминогрупп, N-низших алкиловых, Nди-низших алкиловых и N-ацильных групп. К модификациям конечных карбоксильных групп 6 относятся, без ограничения, модификации амидных, низших алкиламидных, диалкиламидных групп и низшего алкилового эфира. Низшим алкилом является C1-C4 алкил. Более того,одна либо несколько боковых групп либо конечных групп, могут защищаться с помощью защитных групп, известных среднему химикуспециалисту по белкам. -углерод аминокислоты может быть моно- либо диметилированным. В состав предпочтительной группы GLP-1 аналогов и производных, предназначенных для использования в настоящем изобретении, входят молекулы приведенной далее формулы: и их фармацевтически приемлемые соли,где R1 выбирают из группы, в состав которой входит L-гистидин, D-гистидин, дезаминогистидин, 2-аминогистидин, -гидроксигистидин,гомогистидин, альфа-фторметилгистидин и альфа-метилгистидин; Х выбирают из группы, в состав которой входит Аlа, Gly, Val, Thr, Ilе и альфа-метил-Ala; Y выбирают из группы, в состав которой входит Glu, Gln, Ala, Thr, Ser иGly; Z выбирают из группы, в состав которой входит Glu, Gln, Ala, Thr, Ser и Gly; и R2 выбирают из группы, в состав которой входит NH2 иGly-OH; при условии, что упомянутое соединение имеет изоэлектрическую точку в пределах,приблизительно, от 6,0, приблизительно, до 9,0,а также, дополнительно, при условии, что когдаR1 - His, Х - Ala, Y - Glu, и Z - Glu, R2 должен быть NH2. Многочисленные GLP-1 аналоги и производные, имеющие изоэлектрическую точку в этом диапазоне, были раскрыты и включают,например и т.п. [см., например, WO 91/11457]. Следующая предпочтительная группа активных соединений для использования в настоящем изобретении раскрывается в международной заявке WO 91/11457 и включает, по существу, GLP-1(7-34), GLP-1(7-35), GLP-1(7-36) либо GLP-1(7-37), или же их амидную форму, а 7 также их фармацевтически приемлемые соли,имеющие, как минимум, одну модификацию,выбранную из группы, включающей(a) замену лизина глицином, серином, цистеином, треонином, аспарагином, глутамином,тирозином, аланином, валином, изолейцином,лейцином, метионином, фенилаланином, аргинином либо D-лизином в положении 26 и/либо в положении 34; или же замену аргинина глицином, серином, цистеином, треонином, аспарагином, глутамином, тирозином, аланином, валином, изолейцином, лейцином, метионином, фенилаланином, лизином либо D-аргинином в положении 36;(b) замену триптофана устойчивой к окислению аминокислотой в положении 31;(c) замену, как минимум, одного из: валина тирозином в положении 16; серина лизином в положении 18; глутаминовой кислоты аспарагиновой кислотой в положении 21; глицина серином в положении 22; глутамина аргинином в положении 23; аланина аргинином в положении 24; и лизина глутамином в положении 26; и(d) замену, как минимум, одного из: аланина глицином, серином либо цистеином в положении 8; глугаминовой кислоты аспарагиновой кислотой, глицином, серином, цистеином,треонином, аспарагином, глутамином, тирозином, аланином, валином, изолейцином, лейцином, метионином либо фенилаланином в положении 9; глицина серином, цистеином, треонином, аспарагином, глутамином, тирозином, аланином, валином, изолейцином, лейцином, метионином либо фенилаланином в положении 10; и аспарагиновой кислоты глугаминовой кислотой в положении 15; и(e) замену гистидина глицином, серином,цистеином, треонином, аспарагином, глутамином, тирозином, аланином, валином, изолейцином, лейцином, метионином либо фенилаланином, или D- или N-ацилированной или алкилированной формой гистидина в положении 7; где в заменах (а), (b), (d) и (е) упомянутые замещенные аминокислоты могут, факультативно, быть в D-форме, а аминокислоты, замещенные в положении 7, могут, факультативно, быть в Nацилированной либо N-алкилированной форме. Поскольку фермент дипептидил-пептидазаIV (DPP IV) может нести ответственность за наблюдаемую ускоренную инактивацию in vivo введенного GLP-1, [см., например, Ментлайн Р.(Mentlein R.) и другие, Eur. J. Biochem., 214:829835 (1993)], предпочтительным является введение GLP-1 аналогов и производных, защищенных от воздействия DPP IV, в то время как более предпочтительным является введение Gly8GLP-1(7-36)NH2, Val8-GLP-1(7-37)ОН, a-мeтилAla8-GLP-1(7-36)NH2 и Gly8-Gln21-GLP-1(737)OH либо их фармацевтически приемлемых солей. 8 Предпочтительным является использование в настоящем изобретении молекулы, заявленной в патенте США 5188666, который включен в настоящее описание в качестве ссылки. Такую молекулу выбирают из группы, в состав которой входит пептид, имеющий представленную далее аминокислотную последовательность где Х выбирают из группы, в состав которой входит Lys и Lys-Gly; и производное упомянутого пептида, где упомянутый пептид выбирают из группы, в состав которой входит: фармацевтически приемлемая соль упомянутого пептида, полученная добавлением кислоты; фармацевтически приемлемая карбоксилатная соль упомянутого пептида; фармацевтически приемлемый низший алкиловый эфир упомянутого пептида; и фармацевтически приемлемый амид упомянутого пептида, выбранный из группы, в состав которой входит амид, низший алкиламид и низший диалкиламид. В состав другой предпочтительной группы молекул, предназначенных для использования в настоящем изобретении, входят соединения,заявленные в патенте США 5512549, который включен в настоящее описание в качестве ссылки, имеющие общую формулу и их фармацевтически приемлемые соли, где R1 выбирают из группы, включающей 4 имидазопропионил, 4-имидазоацетил либо 4 имидазо-,-диметилацетил; R2 выбирают из группы, включающей C6-C10 неразветвленный ацил, либо он отсутствует; R3 выбирают из группы, включающей Gly-OH либо NH2; и Хаа Lys либо Arg. Более предпочтительными соединениями последовательности 4 для использования в настоящем изобретении являются соединения,где Хаа - Arg и R2 - С 6-С 10 неразветвленный ацил. Весьма предпочтительными соединениями последовательности 4 для использования в настоящем изобретении являются соединения,где Хаа - Arg, R2 - С 6-С 10 неразветвленный ацил и R3 - Gly-OH. Более предпочтительными соединениями последовательности 4 для использования в настоящем изобретении являются соединения, 9 где Хаа - Arg, R2 - С 6-С 10 неразветвленный ацил,R3 - Gly-OH и R1 - 4-имидазопропионил. Наиболее предпочтительным соединением последовательности 4 для использования в настоящем изобретении является соединение,где Хаа - Arg, R2 - C8 неразветвленный ацил, R3 Gly-OH и R1 - 4-имидазопропионил. Весьма предпочтительным является использование в настоящем изобретении молекулы, заявленной в патенте США 5120712, который включен в настоящее описание в качестве ссылки. Такую молекулу выбирают из группы, в состав которой входит пептид, имеющий представленную далее аминокислотную последовательность и производное упомянутого пептида, где упомянутый пептид выбирают из группы,включающей: фармацевтически приемлемую соль упомянутого пептида, полученную добавлением кислоты; фармацевтически приемлемую карбоксилатную соль упомянутого пептида; фармацевтически приемлемый низший алкиловый эфир упомянутого пептида; и фармацевтически приемлемый амид упомянутого пептида,выбранный из группы, включающей амид, низший алкиламид и низший диалкиламид. Наиболее предпочтительным является использование в настоящем изобретении GLP-1(736) амида либо его фармацевтически приемлемой соли. Аминокислотная последовательностьGLP-1(7-36) амида выглядит следующим образом: Способы получения упомянутого активного соединения, использованного в настоящем изобретении, а именно, GLP-1, GLP-1 аналога либо GLP-1 производного, использованного в настоящем изобретении, хорошо известны и описаны в патентах США 5118666,5120712 и 5523549, которые включены в настоящее описание в качестве ссылки. Аминокислотную часть упомянутого активного соединения, использованного в настоящем изобретении, либо ее предшественника, получают 1) химией твердофазного синтеза; 2) очисткой GLP молекул из природных источников; либо 3) технологией рекомбинантных ДНК. Твердофазный химический синтез полипептидов хорошо известен в настоящей области и его описание можно найти в учебниках поFreeman,СанФранциско (1969), стр. 24-66. Аминокислотная часть, например, может быть синтезирована по твердофазной методике с использованием синтезатора пептидов 430 А(компания PE-Applied Biosystems, Inc., 850 Lincoln Center Drive, Фостер Сити, Калифорния 94404) и синтетических циклов, поставляемых компанией PE-Applied Biosystems. Биохимические аминокислоты и другие реактивы коммерчески доступны от компании PE-Applied Biosystems и других компаний, занимающихся химическими поставками. К исходным р-метилбензгидриламиновым смолам с целью получения С-конечных карбоксамидов применяют биохимические методы секвенирования с использованием протоколов двойных пар. Для получения С-конечных кислот используют соответствующие полиакриламидные смолы. Asn,Gln и Arg соединяют, используя предварительно полученные гидроксибензотриазоловые эфиры. Могут быть использованы приведенные далее защитные группы боковых цепей:Thr, бензил Туr, 4-бромкарбобензокси Лишение защитных свойств биохимическими методами может осуществляться с помощью трифторуксусной кислоты в метиленхлориде. После завершения синтеза, упомянутые пептиды могут лишаться защитных свойств и отщепляться от смолы с помощью безводного фтороводорода (HF), включающего 10% метакрезола. Отщепление упомянутой защитной группы (групп) боковых цепей и упомянутого пептида от смолы осуществляется при температуре от -5 до 5 С, в предпочтительном варианте,на льду, в течение 60 мин. После удаления фтороводорода, упомянутый пептид/смолу промывают эфиром, пептид экстрагируют ледяной уксусной кислотой и лиофилизируют. Для получения активного соединения, используемого в настоящем изобретении, могут применяться способы, хорошо известные рядовому специалисту в области технологии рекомбинантных ДНК. Фактически, способам рекомбинантных ДНК может отдаваться предпочтение по причине более высокого выхода. Основными этапами получения рекомбинантной продукции являются следующие:a) выделение естественной последовательности ДНК, кодирующей молекулу GLP-1, либо конструирование синтетической или полусинте 11 тической кодирующей последовательности ДНК для молекулы GLP-1,b) введение упомянутой кодирующей последовательности в экспрессирующий вектор с помощью способа, пригодного для экспрессии белков либо самостоятельно, либо в виде слитых белков,c) трансформация соответствующей эукариотической либо прокариотической клеткихозяина с помощью упомянутого экспрессирующего вектора,d) культивирование упомянутой трансформированной клетки-хозяина в условиях,обеспечивающих возможность экспрессии молекулы GLP-1, иe) выделение и очистка рекомбинантно продуцированной молекулы GLP-1. Как указывалось ранее, упомянутые кодирующие последовательности могут быть полностью синтетическими либо результатом модификаций более крупной нативной ДНК, кодирующей глюкагон. Последовательность ДНК,кодирующей предпроглюкагон, представлена в работе Ланда (Lund) и других, Рrос. Natl AcadSci. U.S.A. 79:345-349 (1982), и она может быть использована в качестве исходного материала при полусинтетическом продуцировании соединений, соответствующих настоящему изобретению, путем изменения нативной последовательности с целью достижения необходимых результатов. Синтетические гены, следствием транскрипции и трансляции которых in vitro или inviva является продуцирование молекулы GLP-1,могут конструироваться способами, хорошо известными в данной области. Опытному специалисту понятно, что, вследствие естественного вырождения упомянутого генетического кода, может быть получено значительное, но, тем не менее, определенное количество последовательностей ДНК, все из которых будут кодировать молекулу GLP-1. Методика конструирования синтетического гена хорошо известна в данной области. См. Браун (Brown) и другие, (1979) Methods in Enzymology, издательство Academic Press, НьюЙорк, 68:109-151. Упомянутая последовательность ДНК программируется из необходимой аминокислотной последовательности с помощью генетического кода, который легко устанавливается рядовым биологом. После завершения программирования сама упомянутая последовательность может продуцироваться с помощью традиционного устройства для синтезирования ДНК, например, синтезаторов ДНК модели 380 А либо 380 В (компания PE-Applied Biosystems, Inc., 850 Lincoln Center Drive, Фостер Сити, Калифорния 94404). Для экспрессии упомянутой аминокислотной части соединения, используемого в настоящем изобретении, последовательность синтетической ДНК, полученной методами генной ин 003695 12 женерии, встраивается в один из многих подходящих экспрессирующих векторов на основе рекомбинантных ДНК с помощью соответствующих рестриктаз. См., в общем, МаниатисHarbor Laboratory Press, Нью-Йорк, том 1-3. Сайты рестриктазного расщепления встраиваются в любой конец ДНК, кодирующей молекулуGLP-1,для облегчения выделения из/включения в амплифицирующие и экспрессирующие векторы, хорошо известные в данной области. Конкретные использованные эндонуклеазы будут определяться характером рестриктазного расщепления исходного использованного экспрессирующего вектора. Рестрикционные сайты выбираются для правильного ориентирования упомянутой кодирующей последовательности относительно контрольных последовательностей для обеспечения, тем самым, соответствующего внутрирамочного считывания и экспрессии необходимого белка. Упомянутая кодирующая последовательность должна позиционироваться таким образом, чтобы оказаться в соответствующей рамке считывания с промотором и сайтом связывания рибосом упомянутого экспрессирующего вектора, которые функционируют в упомянутой клетке-хозяине, в которой должен быть экспрессирован упомянутый белок. Для обеспечения эффективной транскрипции упомянутого синтетического гена, его необходимо функционально связать с областью промотора-оператора. Таким образом, упомянутая область промотора-оператора упомянутого синтетического гена размещается с такой же самой последовательной ориентацией относительно инициирующего кодона ATG упомянутого синтетического гена. В данной области известны различные экспрессирующие векторы, пригодные для трансформации прокариотических и эукариотических клеток. См., например, The PromegaPines Road, La Jolla, Калифорния, 92037). Кроме того, в патенте США 4710473 описываются векторы трансформации плазмиды кольцевой ДНК, пригодные для экспрессии экзогенных генов Е. coli на высоких уровнях. Эти плазмиды пригодны в качестве трансформирующих векторов в методах рекомбинантных ДНК и(a) наделяют упомянутую плазмиду способностью к автономной репликации в клеткехозяине;(b) контролируют автономную репликацию плазмиды в зависимости от температуры,при которой поддерживаются культуры клеткихозяина;(c) стабилизируют обеспечение жизнедеятельности упомянутой плазмиды в популяциях клетки-хозяина;(d) направляют синтез белкового продукта,свидетельствующего о жизнедеятельности плазмиды в популяции клетки-хозяина;(e) обеспечивают последовательные сайты распознавания рестриктаз, характерные для упомянутой плазмиды; и(f) завершают транскрипцию мРНК. Упомянутые плазмиды кольцевой ДНК пригодны для использования в качестве векторов в методах рекомбинантных ДНК для обеспечения высоких уровней экспрессии экзогенных генов. Следующим этапом после завершения конструирования экспрессирующего вектора для аминокислотной части соединения, используемого в настоящем изобретении, является введение упомянутого вектора в подходящую клетку и, тем самым, конструирование рекомбинантной клетки-хозяина, пригодной для экспрессирования упомянутого полипептида. Способы трансформации клеток векторами на основе рекомбинантных ДНК хорошо известны в данной области и их описание может быть найдено в таких общих справочных пособиях, как Маниатис и другие, см. ранее. Клетки-хозяева могут конструироваться как из эукариотических, так и из прокариотических клеток. Прокариотические клетки-хозяева, в общем, продуцируют упомянутый белок с более высокой скоростью и легче культивируются. Белки, экспрессированные высокоуровневыми бактериальными экспрессирующими системами, агрегируются, что является их характерной особенностью, в виде гранул либо внутриклеточных телец, которые содержат высокие уровни сверхпродуцированного белка. Подобные белковые скопления, как правило, должны выделяться, растворяться, денатурироваться и повторно укладываться с помощью способов, хорошо известных в данной области. См. Крюгер(Kreuger) и другие (1990) в Protein Folding, под редакцией Гираш (Gierasch) и Кинг (King), стр. 136-142, American Association for the Advancement of Science Publication89-18S, Вашингтон, округ Колумбия; и патент США 4923967. Изменения аминокислотной последовательности-предшественника GLP-1 либо GLP-1 аналога для получения необходимого GLP-1 аналога либо GLP-1 производного, осуществляются с помощью хорошо известных способов: химическая модификация, ферментативная модификация либо сочетание химической и ферментативной модификации предшественниковGLP-1. Классические способы жидкофазного синтеза и полусинтетические способы также могут быть пригодными для получения молекулGLP-1, используемых в настоящем изобретении. Способы получения молекул GLP-1, соответст 003695 14 вующих настоящему изобретению, хорошо известны рядовому химику-специалисту по белкам. Добавка ацильной группы к эпсилонаминогруппе Lys34 может осуществляться с помощью любого из многочисленных способов,известных в данной области. См. BioconjugateRes. 6 (2):171-176 (1989). Например, к лизил-эпсилон-амину, с помощью 50% ацетонитрила в боратном буфере,может добавляться N-гидроксисукцинимидный эфир октановой кислоты. Упомянутый пептид может ацилироваться перед либо после добавки упомянутой имидазольной группы. Более того,если упомянутый пептид получают методами рекомбинантных ДНК, ацилирование может быть осуществлено перед ферментативным расщеплением. Кроме того, лизин в GLP-1 производном может быть ацилирован, как описано в международной заявке WO 96-29342, которая включена в настоящее описание в качестве ссылки. В данной области описано существование и получение множества защищенных, незащищенных и частично защищенных, естественных и искусственных функциональных аналогов и производных GLP-1(7-36) амида и молекулGLP-1(7-37) [см., например, патенты США 5120712 и 5118666, которые включены в настоящее описание в качестве ссылки, и Орсков К. (Orskov C.) и другие, J. Biol. Chem., 264 (22): 12826-12829 (1989), а также WO 91/11457 (Бакли Д.И. (Вuсklеу D.I.) и другие, опубликованный 8 августа 1991 г.)]. Факультативно, могут защищаться амино и карбоксильные конечные аминокислотные остатки GLP-1 производных либо, факультативно,защищается только одна из конечных областей. Описание реакций образования и удаления таких защитных групп приведено в стандартных работах, в том числе, например, в "Protective(1981); и "The Peptides", том I, Schruder и Libke,издательство Academic Press, Лондон и НьюЙорк (1965). К числу репрезентативных аминозащитных групп относятся, например, формил,ацетил, изопропил, бутоксикарбонил, флуоренилметоксикарбонил, карбобензилокси и т.п. К числу репрезентативных карбоксизащитных групп относятся, например, бензиловый эфир,метиловый эфир, этиловый эфир, t-бутиловый эфир, p-нитрофениловый эфир и т.п. Карбоксиконечные, низшие алкилоэфирные GLP-1 производные, используемые в настоящем изобретении, получают в результате реакции необходимого (C1-C4)алканола с необ 15 ходимым полипептидом в присутствии каталитической кислоты,например хлористоводородной кислоты. Подходящими условиями для упомянутого получения алкилового эфира являются следующие: температура реакции приблизительно 50 С и продолжительность реакции от приблизительно 1 ч до приблизительно 3 ч. Подобным же образом могут быть получены алкилэфирные производные Asp и/или Glu остатков. Получение карбоксамидного производного соединения, используемого в настоящем изобретении, осуществляется, например, как описано у Стюарта Дж.М. (Stewart J.M.) и других.Chemical Company Press, 1984. В настоящем исследовании может использоваться фармацевтически приемлемая солевая форма GLP-1, GLP-1 аналога либо GLP-1 производного. Кислотами, традиционно используемыми для получения солей, получаемых добавлением кислоты, являются неорганические кислоты, например хлористо-водородная кислота,бромисто-водородная кислота,иодистоводородная кислота, серная кислота, фосфорная кислота и т.п., и органические кислоты, например, p-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, pбромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и т.п. Примерами таких солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат,моногидрогенфосфат, дигидрогенфосфат, метафосфат, пирофосфат, хлорид, бромид, иодид,ацетат, пропионат, деканоат, каприлат, акрилат,формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат,себацат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат,фенилацетат, фенилпропионат, фенилбутират,цитрат, лактат, гамма-гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат,манделат и т.п. Предпочтительными солями,полученными добавлением кислоты, являются соли, полученные с помощью минеральных кислот, например хлористо-водородной кислоты и бромисто-водородной кислоты, и особенно хлористо-водородной кислоты. К числу солей, полученных добавлением оснований, относятся соли, полученные из неорганических оснований, например аммония либо гидроксидов, карбонатов, бикарбонатов щелочных либо щелочно-земельных металлов и т.п. Таким образом, к числу таких оснований,пригодных для получения солей, соответствующих настоящему изобретению, относятся гидроксид натрия, гидроксид калия, гидроксид 16 аммония, карбонат калия и т.п. Особо предпочтительными являются солевые формы.GLP-1, GLP-1 аналог либо GLP-1 производное, используемые в настоящем изобретении, перед использованием в настоящем изобретении могут вводиться в состав лекарственной формы с одним или несколькими наполнителями. Например, упомянутое активное соединение, используемое в настоящем изобретении,может образовывать комплексное соединение с двухвалентным катионом металла с помощью хорошо известных способов. К подобным катионам металлов относятся, например, Zn,Mn, Fe, Со, Cd, Ni и т.п. Факультативно, упомянутое активное соединение, используемое в настоящем изобретении, может сочетаться с фармацевтически приемлемым буфером с регулированием рН для обеспечения приемлемой устойчивости и его пригодности для парентерального введения. Факультативно, может добавляться одно или несколько фармацевтически приемлемых антимикробных средств. Предпочтительными фармацевтически приемлемыми антимикробными средствами являются метакрезол и фенол. Может добавляться одна или несколько фармацевтически приемлемых солей для регулирования ионной силы либо тоничности. Для дополнительного регулирования изотоничности упомянутой лекарственной формы может добавляться один либо несколько наполнителей. Примером наполнителя, регулирующего изотоничность, является глицерин. Введение может осуществляться любым путем, эффективность которого известна рядовому врачу. Предпочтение отдается парентеральному введению. Под парентеральным введением в медицинской литературе традиционно понимается впрыскивание дозированной лекарственной формы в организм с помощью стерильного шприца или какого-либо иного механического приспособления, например, инфузионного насоса. Парентеральными путями введения являются внутривенный, внутримышечный,подкожный, внутрибрюшинный, интраспинальный, подоболочечный, интрацеребровентрикулярный, внутриартериальный, субарахноидальный и эпидуральный. Более предпочтительными путями введения упомянутых соединений, используемых в настоящем изобретении, являются внутривенный, внутримышечный и подкожный. Еще более предпочтительными путями введения соединений, используемых в настоящем изобретении, являются внутривенный и подкожный. Для парентерального введения, активное соединение, используемое в настоящем изобретении, в предпочтительном варианте, сочетается с дистиллированной водой с соответствующим рН. Дополнительные фармацевтические способы могут использоваться для контролирования длительности действия. Препараты с кон 17 тролируемым выделением могут быть получены посредством использования полимеров для образования комплексных соединений либо абсорбирования упомянутого активного соединения, используемого в настоящем изобретении. Продленное терапевтическое воздействие может обеспечиваться посредством выбора подходящих макромолекул, например, полиэфиров, полиаминокислот, поливинилпирролидона, этиленвинилацетата, метилцеллюлозы, карбоксиметилцеллюлозы либо протаминсульфата, а также посредством подбора концентрации макромолекул и способов включения с целью пролонгирования выделения. Другим возможным способом увеличения продолжительности действия препаратов контролируемого выделения является включение активного соединения, используемого в настоящем изобретении, в частицы полимерного материала, например, полиэфиров, полиаминокислот, гидрогелей, полимера молочной кислоты либо сополимеров этилена и винилацетата. В альтернативном варианте,вместо включения соединения в упомянутые полимерные частицы, возможно заключение соединения, используемого в настоящем изобретении, в микрокапсулы, полученные, например, коацервативными способами либо межфазной полимеризацией, например, гидроксиметилцеллюлозы, либо в желатиновые микрокапсулы, соответственно, либо в коллоидные системы доставки лекарственного препарата, например, липосомы, альбуминовые микросферы,микроэмульсии, наночастицы и нанокапсулы,либо в макроэмульсии. Подобные способы раскрываются в Remington's Pharmaceutical Sciences(1980). Диагноз "инфаркт миокарда" ставится по медицинским показаниям на основании, как правило, обнаружения, как минимум, двух из представленных далее симптомов и показаний: 1) боль в грудной клетке, длящаяся, как минимум, 15 мин; 2) наличие, как минимум, двух стандартных значений содержания креатинкиназы и креатинкиназы В в сыворотке, которые имеют,как минимум, два стандартных отклонения от нормального диапазона в течение 10-16 ч после появления симптомов; 3) наличие двух или более стандартных уровней содержания лактатдегидрогеназы в сыворотке, имеющих, как минимум, два стандартных отклонения от нормального диапазона в течение 48-72 ч после появления симптомов,включая изоэнзиматическую картину, типичную для инфаркта миокарда; и 4) развитие новых зубцов Q и/или увеличение исходных зубцов ST после инверсии зубца Т в, как минимум, двух из двенадцати стандартных отведений ЭКГ. Острая фаза инфаркта миокарда приходится на первые 72 ч после появления симптомов либо показаний, описание которых было приве 003695 18 дено ранее. Способ лечения, который является предметом настоящего изобретения, применяется в течение острой фазы инфаркта миокарда,т.е. при остром инфаркте миокарда. Пациентом, нуждающимся в соединениях,используемых в настоящем изобретении, является пациент, находящийся в острой фазе инфаркта миокарда, и который также неспособен к саморегулированию уровня содержания глюкозы в крови. Пациент неспособен к саморегулированию, если у него: 1) ранее был диагностирован инсулинозависимый диабет (IDDM) либо инсулинонезависимый диабет (NIDDM), согласно определению Национальной группы по сбору данных, касающихся диабета [Diabetes,28:1039-1057 (1979)]; 2) уровень содержания глюкозы в крови превышает 11 ммоль/л, даже без предшествующего диагностирования диабета; либо 3) наблюдается аномальная толерантность к глюкозе. Доза GLP-1, GLP-1 аналога либо GLP-1 производного, эффективная в отношении нормализации уровня глюкозы в крови пациента,будет зависеть от ряда факторов, к которым относятся, без ограничения, пол, масса и возраст пациента, степень неспособности регулировать уровень глюкозы в крови, первопричины любой неспособности регулировать уровень глюкозы в крови, в случае одновременного введения глюкозы либо иного источника углевода, путь введения и биодоступность, персистирование в организме, лекарственная форма и эффективность введенного соединения. В случае непрерывного введения подходящая скорость введения составляет приблизительно от 0,25 пмоль/кг массы тела/мин до 6 пмоль/кг массы тела/мин, в предпочтительном варианте приблизительно от 0,5 пмоль/кг/мин до 1,2 пмоль/кг/мин. В случае периодического введения, при определении дозы, предназначенной для введения, необходимо учитывать промежуток времени между дозами,биодоступность GLP-1, GLP-1 аналога либоGLP-1 производного и количество, необходимое для обеспечения нормального уровня глюкозы в крови. Определение дозы и скорости введенияGLP-1, GLP-1 аналога либо GLP-1 производного для достижения необходимого клинического результата находится в пределах возможностей рядового врача. Настоящее изобретение будет более понятным со ссылкой на конкретные примеры,которые приведены для иллюстрирования, а не для ограничения настоящего изобретения. Пример 1.GLP-1(7-36) амид вводили путем подкожного вливания со скоростью 1,2 пмоль/кг/ч в течение 10 ночных часов пяти пациентам, страдающим инсулинонезависимым диабетом(NIDDM). В качестве контроля инсулин непрерывно вливали тем же самым пяти пациентам,однако, не в те дни, в которые производилось вливание GLP-1(7-36) амида. Скорость влива 19 ния инсулина корректировали каждые два часа для обеспечения оптимального контроля и во избежание гипогликемии. Как показывают данные, представленные в табл. 1 и на фиг. 1, подкожное вливание GLP-1(7-36) амида почти нормализовало уровень глюкозы в крови, не вызвав гипогликемии ни у одного из пациентов. Контролирование обмена веществ, осуществлявшееся с помощью GLP-1(7-36) амида, давало лучшие результаты, чем в случае применения инсулина, и средний уровень глюкозы в крови был ниже в случае обработки GLP-1(7-36) амидом, по сравнению с контролем статистически значимым количеством инсулина в 23:00, 0:00 и 1:00. Таблица 1 Средние уровни глюкозы в крови у пятиNIDDM пациентов, которым в течение 10 ночных часов непрерывно вливали GLP-1(7-36) амид. В ходе осуществления контрольного исследования с теми же самыми пациентами в другой день, путем непрерывного вливания вводили инсулин. Вливание инсулина(контроль) Средний Средний СтандартСтандартуровень уровень ная погрешная погрешглюкозы в глюкозы в ность, мМ ность, мМ крови, мМ крови, мМ 7,5 0,45 6,9 0,68 5,4 0,76 6,6 0,55 4,1 0,16 5,9 0,98 4,4 0,23 5,6 0,90 4,4 0,29 5,1 0,58 4,8 0,34 5,2 0,58 5,2 0,41 5,4 0,30 5,4 0,41 5,7 0,25 5,8 0,41 6,0 0,30 6,0 0,45 6,1 0,38 6,2 0,45 6,1 0,33 Вливание GLP-1 Пример 2. В течение дня GLP-1(7-36) амид вливали пяти NIDDM пациентам в течение 3 ч во время завтрака, обеда и ужина. Время вливания (как указано на фиг. 2): 7:30-10:30 (завтрак), 10:301:30 (обед) и 4:30-7:30 (ужин). В ходе осуществления контрольного эксперимента в другой день, тем же самым пяти NIDDM пациентам подкожно вводили инсулин непосредственно перед началом приема пищи, как показано на фиг. 2. При вливании GLP-1 исчезали колебания уровня глюкозы, возникающие после приема пищи и наблюдаемые в случае введения инсулина. Вливание GLP-1 обеспечивало поддержание нормальных уровней содержания глюкозы в крови. Сразу же после завершения каждого вливания GLP-1(7-36) амида, уровень содержания глюкозы в крови существенно повышался. При введении GLP-1(7-36) амида не наблюдалось нежелательных побочных явлений. Эти данные свидетельствуют о том, что вливание GLP-1(736) амида обеспечивает более эффективный 20 контроль уровней глюкозы после приема пищи,чем впрыскивание инсулина, и что упомянутый контроль остается эффективным в течение периода, когда продолжается вливание GLP-1(736) амида. Таблица 2 Средние уровни содержания глюкозы в крови пяти NIDDM пациентов, которым в течение трех часов, начиная с момента начала приема пищи, вливали GLP-1(7-36) амид. В контрольном исследовании, проводившемся в другой день с теми же самыми пациентами, непосредственно перед каждым приемом пищи путем подкожного впрыскивания вводили инсулин. Время начала приема пищи: 7:30, 10:30 и 4:30. Подкожное впрыскивание инсулина Средний Средний СтандартСтандартуровень уровень ная погрешная погрешглюкозы в глюкозы в ность, мМ ность, мМ крови, мМ крови, мМ 5,4 0,35 6,1 0,41 4,9 0,38 7,0 0,51 5,7 0,59 9,1 0,74 5,8 1,06 9,9 0,78 8,1 0,94 8,2 0,76 9,4 0,59 6,5 0,74 7,2 1,18 9,1 0,90 5,3 1,21 8,1 0,91 7,2 0,71 7,0 0,87 10,4 0,26 7,2 0,57 9,2 1,06 6,5 0,59 5,7 1,59 7,3 0,65 6,6 0,94 6,1 0,59 8,3 0,71 6,0 0,41 9,3 0,71 6,4 0,44 Вливание GLP-1 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ снижения смертности и заболеваемости после инфаркта миокарда, включающий введение пациенту, нуждающемуся в этом, соединения, которое выбирается из группы, включающей GLP-1, GLP-1 аналоги, GLP-1 производные и их фармацевтически приемлемые соли, в дозе,обеспечивающей эффективную нормализацию содержания глюкозы в крови. 2. Способ по п.1, где упомянутое соединение вводится внутривенно. 3. Способ по п.1, где упомянутое соединение вводится подкожно. 4. Способ по любому из пп.1-3, где скорость введения упомянутого соединения составляет от 0,25 до 6 пмоль/кг/мин. 5. Способ по п.4, где скорость введения упомянутого соединения составляет от 0,5 до 2,4 пмоль/кг/мин. 6. Способ по п.5, где упомянутая скорость составляет приблизительно от 0,5 пмоль/кг/мин приблизительно до 1,2 пмоль/кг/мин. 7. Способ по п.1, где упомянутое соединение вводится внутривенно и, кроме того, иным парентеральным путем. 8. Способ по п.7, где иным парентеральным путем является подкожный путь. 9. Способ по п.1, где упомянутым вводимым соединением является GLP-1(7-36) амид либо его фармацевтически приемлемая соль. 10. Способ снижения смертности и заболеваемости после инфаркта миокарда, включающий введение соединения, которое проявляет 22 инсулинотропную активность посредством взаимодействия с тем рецептором либо рецепторами, с которыми взаимодействует GLP-1 при проявлении своей инсулинотропной активности. 11. Способ снижения заболеваемости и смертности после инфаркта миокарда, включающий введение соединения, которое усиливает чувствительность к инсулину посредством взаимодействия с тем рецептором либо рецепторами, с которыми взаимодействует GLP-1 для усиления чувствительности к инсулину.
МПК / Метки
МПК: A61K 38/26
Метки: аналогов, применение, миокарда, glp-1, инфаркта, лечении
Код ссылки
<a href="https://eas.patents.su/12-3695-primenenie-glp-1-ili-ego-analogov-v-lechenii-infarkta-miokarda.html" rel="bookmark" title="База патентов Евразийского Союза">Применение glp-1 или его аналогов в лечении инфаркта миокарда</a>