Способ подавления роста опухоли и лечения заболеваний путем избирательного ингибирования участков рецепторов с тирозинкиназной активностью
Формула / Реферат
1. Способ подавления роста опухоли или лечения заболеваний, связанных с активностью тирозинкиназного рецептора, включающий введение ингибиторов, избирательно воздействующих на аминокислотную последовательность SEQ ID NO: 1 в структуре тирозинкиназного рецептора или на последовательность, отличающуюся от SEQ ID NO: 1 вставкой нескольких аминокислотных остатков, или на фрагмент последовательности SEQ ID NO: 1.
2. Способ по п.1, где последовательности, отличающиеся от SEQ ID NO: 1 вставкой нескольких аминокислотных остатков, представляют собой SEQ ID NO: 2 и 3.
3. Способ по п.1, где фрагменты последовательности SEQ ID NO: 1 представляют собой SEQ ID NO: 4-11.
Текст
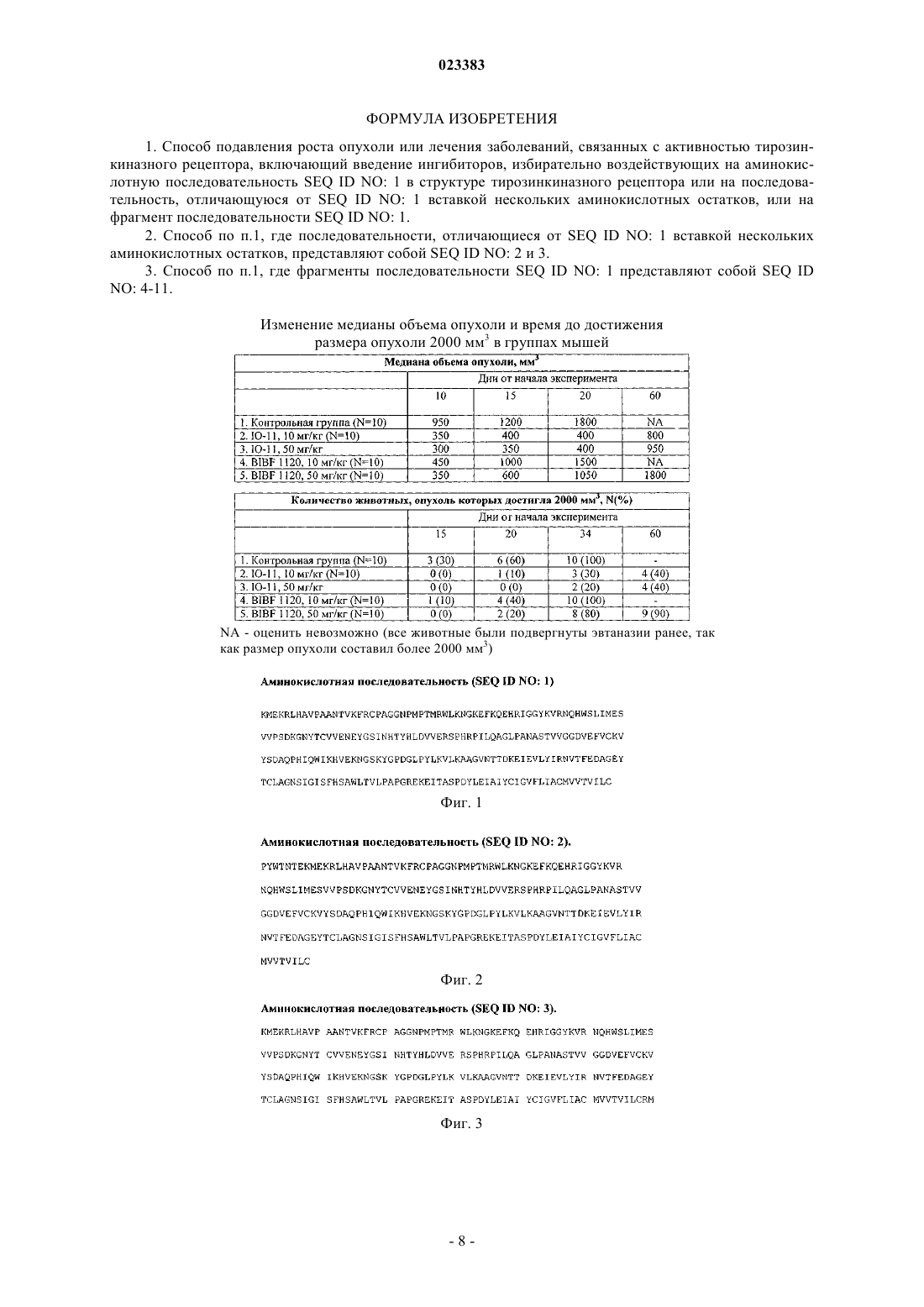
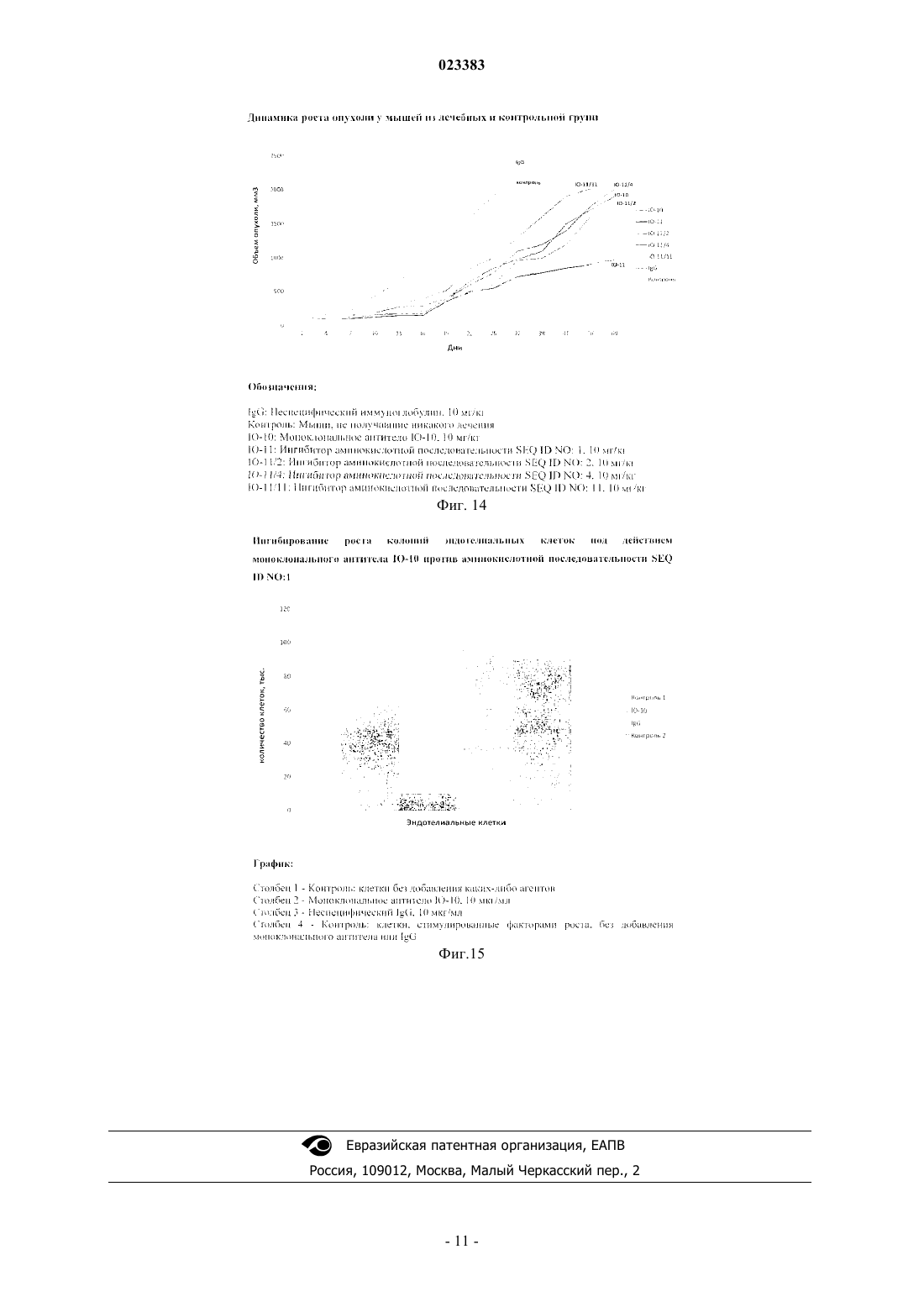
СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПУТЕМ ИЗБИРАТЕЛЬНОГО ИНГИБИРОВАНИЯ УЧАСТКОВ РЕЦЕПТОРОВ С ТИРОЗИНКИНАЗНОЙ АКТИВНОСТЬЮ Изобретение относится к медицине и включает способ подавления роста опухоли, основанный на избирательном ингибировании конкретных участков рецепторов с тирозинкиназной активностью,состоящих из аминокислот, находящихся на клетках опухоли или сосудов. Избирательное ингибирование участков рецепторов с тирозинкиназной активностью, описанных в настоящем изобретении, без ингибирования остальной части рецептора и/или других рецепторов в случае мультикиназных ингибиторов приводит к достоверному повышению противоопухолевой эффективности применяемых ингибиторов тирозинкиназ, снижению токсичности проводимого лечения, возможности использовать низкую концентрацию агента для полного блокирования,проводить длительное лечение. Преимущество изобретения заключается в разработке нового класса лекарственных препаратов для лечения злокачественных новообразований и других болезней. Тимофеев Илья Валерьевич (RU)DATABASE Gen Bank: EAW49340.1,04.02.2010, [найдено 11.01.2013]. Найдено из Интернет URL:http://www.ncbi.nlm.nih.gov/ Краткое описание изобретения Изобретение относится к медицине и включает способ подавления роста опухоли, основанный на избирательном ингибировании конкретных участков рецепторов с тирозинкиназной активностью, состоящих из аминокислот, находящихся на клетках опухоли или сосудов. Избирательное ингибирование участков рецепторов с тирозинкиназной активностью, описанных в настоящем изобретении, без ингибирования остальной части рецептора и/или других рецепторов в случае мультикиназных ингибиторов приводит к достоверному повышению противоопухолевой эффективности применяемых ингибиторов тирозинкиназ, снижению токсичности проводимого лечения, возможности использовать низкую концентрацию агента для полного блокирования, проводить длительное лечение. Преимущество изобретения заключается в разработке нового класса лекарственных препаратов для лечения злокачественных новообразований и других болезней. Полное описание изобретения Известно, что в основе развития злокачественных новообразований лежит избыточная пролиферация клеток, а также образование кровеносных сосудов в опухоли, через которые происходит ее питание (ангиогенез) (J. Folkman et. al. Nature; 339, 58 (1989). Образование новых кровеносных сосудов происходит из уже существующего эндотелия и является важным компонентом многих заболеваний и нарушений, в том числе таких как рост и метастазирование опухолей, ревматоидный артрит, псориаз, атеросклероз, диабетическая ретинопатия, ретролентальная фиброплазия, неоваскулярная глаукома, гемангиомы, иммунное отторжение трансплантированной роговицы и других тканей, а также хронические воспаления. Пролиферация клеток опухоли, равно как и эндотелиальных клеток, может быть вызвана различными факторами, которые естественным образом встречаются в природе. Данные факторы связываются с рецепторами на поверхности опухолевых, эндотелиальных и других клеток, что приводит к активации рецепторов и проведению сигнала внутрь клетки с последующим делением. По многочисленным данным рецепторы с тирозинкиназной активностью часто экспрессированы на клетках опухолей, что приводит к пролиферации клеток самой опухоли и эндотелиоцитов, способствует опухолевой прогрессии. Зачастую активирующие мутации рецепторов с тирозинкиназной активностью также изменяют течения болезни и чувствительность к проводимой терапии. К данной группе рецепторов относятся рецепторы фактора роста эндотелия сосудов (VEGFR), рецепторы эпидермального фактора роста (EGFR), рецепторы инсулиноподобного фактора роста (IGFR),рецепторы фактора роста фибробластов (FGFR). Например, роль последних доказана в развитии ряда злокачественных новообразований, в частности почечно-клеточного рака, рака легкого (указывается как одна из причин резистентности к EGFR ингибиторам), рака молочной железы, рака поджелудочной железы, рака желудка, рака мочевого пузыря, рака предстательной железы, рака яичников, рака эндометрия,колоректального рака. Рецепторы с тирозинкиназной активностью объединены общим признаком - внутриклеточная часть представлена тирозинкиназой. Фосфорилирование тирозинкиназы приводит к активации рецептора и распространению сигнала внутрь клетки. К другим частям рецепторов относятся надмембранная и внутримембранная (трансмембранная) части. Надмембранная и внутримембранная части различных типов рецепторов с тирозинкиназной активностью отличаются между собой: как по первичной аминокислотной последовательности, так и по вторичной, третичной структуре. В некоторых случаях отмечается гомология структуры рецепторов. Трансмембранная часть рецепторов с тирозинкиназной активностью содержит 1 трансмембранный домен. В настоящее время создано большое количество таргетных препаратов, блокирующих/ингибирующих активность различных типов рецепторов с тирозинкиназной активностью. К ним относятся ингибиторы тирозинкиназы, а также моноклональные антитела. Существующие препараты снижают активность внутриклеточной тирозинкиназы путем блокирования различных активных частей одного или, как правило, нескольких рецепторов. Неизбирательное блокирование сопряжено со снижением эффективности воздействия на опухолевые клетки, клетки сосудов, а также другие структуры, экспрессирующие соответствующий тип рецептора. В настоящем изобретении описывается способ избирательного ингибирования определенных участков рецепторов с тирозинкиназной активностью без влияния на остальную часть рецептора и/или другие рецепторы в случае мультикиназных ингибиторов, что приводит к достоверному повышению противоопухолевой эффективности применяемых ингибиторов тирозинкиназ, возможности использовать низкую концентрацию агента для полного блокирования, а следовательно, снижению токсичности проводимого лечения, проводить длительное лечение. Описываемое в заявке избирательное воздействие на рецепторы с тирозинкиназной активностью отличается также тем, что направлено против определенных аминокислотных последовательностей, зачастую не являющихся активными центрами связывания рецептора со специфическим лигандом (фактором роста), что приводит к разрушению рецептора и потере его активности. Описываемое избирательное воздействие также подразумевает, что лиганд может связаться с рецептором, однако активации внутриклеточной части - тирозинкиназы - все равно не произойдет. Кроме того, описываемое в изобретении селективное ингибирование может проводиться в отношении некоторых аминокислот активных центров рецепторов с тирозинкиназной активностью. В настоящем изобретении показано, что угнетение роста, например, опухолевых клеток, может быть вызвано пу-1 023383 тем ингибирования определенной аминокислотной последовательности и не зависит от наличия определенных рецепторов VEGFR, FGFR и других. То есть все рецепторы могут быть представлены на клетках,не требуется ингибитор против каждого - угнетение роста может быть достигнута путем ингибирования нескольких аминокислотных последовательностей. Основным объектом настоящего изобретения является способ избирательного ингибирования аминокислотной последовательности, которая может встречаться в структуре рецепторов с тирозинкиназной активностью, что приводит к вышеуказанным эффектам. Основная аминокислотная последовательность приводится на фиг. 1. Данная аминокислотная последовательность может отличаться на несколько аминокислот, и это не повлияет на эффективность создаваемых ингибиторов. Например, на фиг. 2 и 3 представлены возможные аминокислотные последовательности, в которых добавлены аминокислоты с одного из концов. Создаваемые ингибиторы по основному объекту изобретения могут блокировать любые фрагменты аминокислотной последовательности, указанной на фиг. 1, что не приведет к изменению эффективности. Например, предметом блокирования могут быть участки аминокислотной последовательности, как указано на фиг. 4-10. Отличительной особенностью настоящего изобретения является разрушение не только активных центров рецептора, но и других его компонентов. Так, воздействие на аминокислотную последовательность, указанную на фиг. 11, может привести к инактивации рецепторов и может быть использовано в лечении. Терапевтическое использование способа Для использования способа, описанного в настоящем изобретении, в терапевтической практике любые антагонисты указанных аминокислотных последовательностей по способу вводятся млекопитающему, предпочтительно человеку, в фармацевтически приемлемой форме, включая введение внутривенно, а также следующими путями: внутримышечным, интраперитонеальным, интрацереброспинальным, подкожным, внутрисуставным, внуртисиновиальным, внутриоболочечным, оральным, локальным или ингаляционным. Антагонисты также могут вводиться внутриопухолевым, околоопухолевым, внутриочаговым и околоочаговым путями для обеспечения локального действия наряду с системным терапевтическим действием. Подобные формы введения включают фармацевтически приемлемые носители, которые по своей природе не обладают ни токсическим, ни терапевтическим действием. Примерами таких носителей являются ионообменные вещества, квасцы, стеарат алюминия, лецитин, белки плазмы (такие, как белок плазмы человека), буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия,частичные глицеридные смеси насыщенных овощных жирных кислот, вода, соли или электролиты, такие как сульфат протамина, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидная окись кремния, трисиликат магния, поливинилпирролидон, вещества с целлюлозной основой и полиэтиленгликоль. Носители для локальной или основанной на геле форм антагонистов включают полисахариды, такие как натриевая соль карбоксиметилцеллюлозы или метилцеллюлозы, поливинилпирролидон,полиакрилаты, полимеры полиоксиэтиленполиоксипропиленового блока, полиэтиленгликоль и спирты. Для введения во всех случаях используются обычные лекарственные формы, получаемые со складов. К таким формам относятся, например, микрокапсулы, нанокапсулы, липосомы, пластыри, ингаляционные препараты, аэрозоли, подъязычные таблетки и препараты с постоянным высвобождением вещества. Антагонист в таких препаратах будет обычно содержаться в концентрации примерно от 0,001 до 100 мг/мл. Подходящие примеры препаратов с постоянным высвобождением вещества включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антагонист; подобные матрицы имеют определенную форму, например это могут быть пленки или микрокапсулы. К примерам матриц с постоянным высвобождением относятся полиэфиры, гидрогели [например, поли(2-гидроксиэтилметакрилат)],описанные Лангером и др. (J. Biomed. Mater. Res. 15, 167 (1981) и Лангером (Chem. Tech. 12 (1982), или поли(винилалкоголь), полилактиды (патент США 3773919), сополимеры L-глутаминовой кислоты и гаммаэтил-L-глутамата, описанные Сидман и др. (Biopolymers 22, 547 (1983), недеградируемый этиленвинилацетат (Лангер и др. см. выше), деградируемые сополимеры молочной и гликолевой кислот, такие как Lupron Depot (инъецируемые микросферы, состоящие из полимеров молочной и гликолевой кислот и ацетата лейпролида), и поли-D-(-)-3-гидроксибутировой кислоты. В то время, как такие полимеры, как этиленвинилацетат и сополимер молочной и гликолевой кислот, способны к постоянному высвобождению молекул в течение более 100 дней, определенные гидрогели высвобождают белки за более короткие периоды времени. Когда инкапсулированные полипептидные антагонисты остаются в организме на долгое время, они могут денатурировать или агрегироваться в результате воздействия влаги при температуре 37 С, что ведет к потере биологической активности и возможным изменениям в иммуногенности. С целью стабилизации могут быть разработаны разумные стратегии, в зависимости от действующего механизма. Например, если обнаружен механизм агрегации, выражающийся в формировании межмолекулярной S-S-связи посредством тиодисульфидного обмена, стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации с целью удаления кислых растворов, контролирования влажности, использования соответствующих добавок и разработки специфических полимерных матричных составов. Антагонистические составы с постоянным высвобождением антагониста включают также антагонистические антитела, заключенные в липосомах. Липосомы, содержащие антагонисты, могут быть получены известными в данной области методами, например, описанными Эпстейном и др. (Proc. Nat.Acad. Sci. 82, 3688 (1985); Хуанг и др. (Procc. Nat. Acad. Sci. 77, 4030 (1980); патент США 4485045 и патент США 4544545. Липосомы, как правило, имеют небольшую величину (величиной около 200-800) и принадлежат к однослойному типу, в котором содержание липидов выше, чем 30 мол.% холестерина; выбранное соотношение может изменяться для подбора оптимальных условий терапии. Липосомы с продолжительным сроком циркуляции покрываются патентом США 5013556. Еще одним путем использования данного изобретения является инкорпорирование антагониста внутрь изделий, имеющих определенную форму. Такие изделия могут быть использованы для модулирования роста клеток эндотелия и ангиогенеза. Кроме того, такие изделия могут быть использованы для модулирования инвазии опухолей и метастазов. Возможна конъюгация антагониста по способу и другого лечебного средства. При профилактике или лечении заболевания необходимая доза антагониста будет зависеть от типа заболевания, от его степени серьезности и протекания, от того, вводятся ли антитела с профилактической или терапевтической целью, от предыдущей терапии, от истории болезни пациента и его реакции на антагонист и от указаний лечащего врача. Антагонист может вводиться пациенту различными способами, единовременно или в качестве серии назначений. Антагонисты, избирательно воздействующие на аминокислотные последовательности по настоящему способу, могут быть использованы для лечения различных неопластических и ненеопластических заболеваний и нарушений. Опухоли и близкие состояния, которые поддаются такому лечению, включают рак молочной железы, немелкоклеточный и мелкоклеточный рак легкого, опухоли трахеи, рак желудка, рак пищевода, колоректальный рак, рак печени, рак яичников, рак шейки матки, рак тела матки, гиперплазию эндометрия, эндометриоз, фибросаркомы, хондросаркомы, опухоли головы и шеи, гепатобластому, саркому Капоши, меланому, рак кожи, гемангиому, кавернозную гемангиому, гемангиобластому,рак поджелудочной железы, рак надпочечников, ретинобластомы, астроцитому, глиобластому, шванному, олигодендроглиому, медуллобластому, нейробластому, рабдомиосаркому, остеогенную саркому,лейомиосаркому, почечно-клеточный рак, рак мочевого пузыря, рак полового члена, рак предстательной железы, опухоль Вилмса, аномальную пролиферацию сосудов, связанную с факоматозами. Возможно применение способа при неонкологических заболеваниях, которые поддаются лечению,включая такие как ревматоидный артрит, псориаз, атеросклероз, диабетические и другие ретинопатии,фиброплазии, неоваскулярную глаукому, тироидные гиперплазии (в том числе болезнь Граве), трансплантацию роговицы и других тканей, хронические воспаления, воспаление легких, нефротический синдром, асцит, преэклампсию, перикардиальный выпот (например, связанный с перикардитом) и плевральный выпот. В зависимости от типа заболевания и от степени его серьезности первоначальная доза для введения пациенту будет составлять от 1 мкг/кг до 30 мг/кг и может вводиться путем одного или многих отдельных назначений/введений или путем постоянного вливания. Обычная дневная доза может варьировать примерно от 1 мкг/кг до 100 мг/кг и более в зависимости от вышеупомянутых факторов. Для повторного назначения в течение нескольких дней и более в зависимости от условий лечение повторяется,пока не будет достигнуто желаемое подавление симптомов болезни. Однако могут использоваться и другие режимы дозировки. Успех лечения легко определяется обычными методами и анализами, например методами рентгено-визуализации опухолей. В соответствии с другим применением изобретения эффективность антагониста в предотвращении или лечении болезней может быть улучшена путем введения антагониста серийно или же в комбинации с другим веществом, эффективным для данной цели, таким, например, как фактор некроза опухоли, интерфероны, интерлейкины; антитела и низкомолекулярные ингибиторы, способные нейтрализовать или ингибировать активность фактора роста эндотелия сосудов и/или его рецепторов, и/или фактора роста гепатоцитов и/или его рецепторов, и/или эпидермального фактора роста и/или его рецепторов, и/или фактора роста плаценты и/или его рецепторов, и/или эпидермального фактора роста и/или его рецепторов, и/или инсулиноподобного фактора роста и/или его рецепторов, и/или фактора роста фибробластов и/или его рецепторов, и/или mTOR, и/или других внутриклеточных киназ, или одно или более обычных терапевтических веществ, таких как, например, алкилирующие соединения, антибиотики, антиметаболиты, антрациклины, винкаалкалоиды, эпиподофиллотоксины, другие цитостатики. Подобные вещества могут присутствовать во вводимом составе или могут вводиться отдельно. Кроме того, антагонист по способу может вводиться серийно или же в комбинации с радиологическим лечением. Один антагонист или более вводятся пациенту с опухолью в терапевтически эффективных дозах,определенных, например, при наблюдении некроза опухоли или ее метастатических фокусов, если они имеются. Такая терапия продолжается до тех пор, пока перестает наблюдаться дальнейшее улучшение,или клиническое обследование показывает, что опухоль или ее метастазы исчезли. При прогрессировании болезни вводится одно или несколько описанных выше веществ(о) или используются другие методы лечения. Поскольку эффективность дополнительных веществ будет варьировать, желательно сравнить их влияние на опухоль путем стандартного матричного скрининга. Производится повторное введение антагониста и дополнительного агента, пока не будет достигнут желаемый клинический эффект. В альтернативном случае антагонист(ы) по способу вводятся совместно и, при желании, вместе с дополнительными веществами. Антагонисты по способу могут быть использованы с препаратами поддерживающей и сопроводительной терапии, например, с эритропоэтинами, препаратами, стимулирующими лейкопоэз или повышающими количество тромбоцитов и/или нейтрофилов, макрофагов, с нутритивной поддержкой, нестероидными противовоспалительными средствами, компонентами крови, дексаметазоном, золедроновой кислотой, антителами против RANKL. Ниже в качестве примеров представлены некоторые доказательства способа подавления роста опухоли, заключающегося в блокировании аминокислотных последовательностей, приведенных в настоящем изобретении. Нижеследующие примеры предлагаются только в качестве иллюстрации и не должны восприниматься как в чем-либо ограничивающие настоящее изобретение. Пример 1. Результаты исследования: анализ выживания или пролиферации опухолевых клеток invitro при добавлении моноклинального антитела, блокирующего аминокислотную последовательность,указанную на фиг. 1. Следующие клеточные линии были выбраны для проведения исследования: 1) человеческого немелкоклеточного рака легкого; 2) человеческого рака предстательной железы; 3) человеческого рака молочной железы; 4) человеческого почечно-клеточного рака; 5) человеческого рака желудка; 6) человеческого рака носоглотки; 7) человеческого рака яичников. На клетках указанных клеточных линий в стандартном анализе Вестерн-блоттинг была определена гиперэкспрессия рецепторов различных факторов роста, а именно VEGFR, FGFR, EGFR, IGFR, а также фактора роста тромбоцитов (PDGFR). Общий уровень экспрессии факторов на опухолевых клетках колебался в пределах 30-100% в зависимости от типа рецептора и клеточной линии. С помощью секвенирования было доказано, что регионы рецепторов с аминокислотной последовательностью, представленной на фиг. 1-11, присутствуют на клетках всех линий кроме линии человеческого рака носоглотки. Основываясь на полученных данных, человеческие линии почечно-клеточного рака, рака молочной железы, рака предстательной железы, немелкоклеточного рака легкого, рака желудка и рака яичников были отобраны для дальнейших исследований. В качестве антагониста, блокирующего аминокислотную последовательность, указанную на фиг. 1, использовалось специфическое высокоаффинное (Kd =1,7 нМ) мышиное моноклональное антитело IO-10. Термин "моноклональное антитело" используется здесь для обозначения антитела, полученного из популяции достаточно однородных антител, т.е. индивидуальные антитела,составляющие популяцию, идентичны в своей специфичности и сродству, за исключением возможных,естественно встречающихся мутаций, которые могут присутствовать в незначительных количествах. Блокирующее мышиное антитело IO-10 было специально разработано на основании гибридомного метода (G. Khler, С. Milstein. J Nature 256, 495 (1975) для проведения настоящих исследований. Мышь иммунизировали антигеном, представляющим пептид из аминокислотной последовательности, указанной на фиг. 1. Клетки опухолевых линий были высеяны с плотностью 104 клеток/мл в 6-луночных пластинках. В каждую лунку было добавлено блокирующее моноклональное антитело IO-10 в концентрации 100 мкг/мл и в равном объеме. Также в качестве контроля к части культуры было добавлено постороннее моноклонального антитела без нейтрализующей способности (приобретенное в Abcam, концентрация 100 мкг/мл). После инкубации в каждую лунку была добавлена комбинация факторов роста (VEGF, FGF,IGF, EGF) по 1 нг/мл. В качестве дополнительного контроля часть клеток выращивалась в отсутствие как антитела, так и факторов роста. После роста культуры в течение 3 недель клетки в каждой лунке были подсчитаны с помощью компьютерной программы на анализаторе Hewlett Packard Scanjet (США). Как показано на фиг. 12, моноклональное антитело IO-11 полностью ингибировало способность добавленных факторов роста поддерживать рост и выживание клеток всех указанных опухолевых линий(более чем на 90%). Моноклональное антитело без нейтрализующей способности (Abcam) не вызвало изменений в выживаемости клеток. В опыте было выявлено, что подавление пролиферативной активности не зависит от дозы агента, блокирующего аминокислотную последовательность (эффективность нескольких доз была одинаковой). Общий вывод по данному примеру: при избирательном воздействии блокирующим агентом, в данном случае антителом, на аминокислотную последовательность, указанную в фиг. 1, достигается сильное ингибирование роста опухолевых клеток в отношении нескольких клеточных линий. Пример 2. Результаты исследования: изучение и сравнение эффективности изолированного блокирования аминокислотной последовательности, указанной на фиг. 1, и блокирования нескольких рецепторов с тирозинкиназной активностью стандартными ингибиторами тирозинкиназ. В исследовании в качестве экспериментальной клеточной линии была выбрана линия человеческого почечно-клеточного рака типа Caki, клетки которой экспрессируют различные рецепторы с тирозинкиназной активностью, в частности в 80-100% - VEGFR, FGFR и PDGFR, что было выявлено в предыдущем исследовании. В связи с этим данная клеточная линия использовалась в экспериментах как модель. Клетки были высеяны в 96-луночных пластинках объемом 90 мкл/лунка. После 24 ч инкубации в увлажненном инкубаторе при температуре 37 С, 5% СО 2 и 95% воздуха к клеткам были добавлены тестируемые растворенные агенты в количестве 100 мкг/мл. В качестве тестируемых агентов использовались низкомолекулярные ингибиторы: 1) ингибитор IO -11, полученный путем химического синтеза для данного исследования, целенаправленно блокирующий аминокислотную последовательность, приведенную на фиг. 1, и 2) коммерчески приобретенный BIBF 1120, который является ингибитором VEGFR, PDGFR,FGFR, демонстрируя IC50 в пределах (20-100 нмоль/л). Ингибиторы были добавлены к клеткам, часть клеток осталась без добавления какого-либо агента(контрольная группа). Через сутки после инкубации с ингибиторами к клеткам была добавлена смесь факторов роста VEGF, PDGF, FGF в количестве 10 нмоль/л. В случае, если ингибиторы блокировали активность рецепторов с тирозинкиназной активностью, добавленные факторы роста не должны были оказать свое действие. Клетки контрольной группы были разделены на две подгруппы, к одной были добавлены факторы роста, другая осталась без стимуляции. Инкубация с факторами роста продолжалась на протяжении 2 суток, после чего все клетки были посчитаны с помощью компьютерной программы на анализаторе Hewlett Packard Scanjet (США). Уровень ингибирования в процентах был оценен как отношение количества клеток в группе с ингибиторами к клеткам, которые не получали лечение и были стимулированы факторами роста. Уровень ингибирования для IO-11 составил 95%, уровень ингибирования для BIBF 1120 был 54%. Статистические отличия по количеству клеток для IO-11 и BIBF 1120 были достоверны (Р=0,003), что означает преимущества в ингибировании для IO-11. Количество клеток в контрольной группе без стимуляции было достоверно ниже, чем в контрольной группе со стимуляцией факторами роста (Р=0,001). Ингибитор IO11 значимо подавлял эффекты добавленных факторов роста, количество клеток по сравнению со стимулированным контролем было достоверно ниже (Р 0,001). Результаты графически показаны на фиг. 13. Общий вывод: избирательное ингибирование аминокислотной последовательности, указанной на фиг. 1, приводит к лучшим результатам эффективности, чем "неселективное" ингибирование рецепторовVEGFR, FGFR, PDGFR. Факторы роста оказывают стимулирующее воздействие на пролиферацию опухолевых клеток; их эффекты достоверно подавляются при ингибировании аминокислотной последовательности, указанной на фиг. 1. Пример 3. Результаты исследования: ингибирование роста опухоли in vivo при блокировании аминокислотной последовательности, указанной на фиг. 1, 2, 4 и 11. Самкам мышей (Beige/nude) возрастом 8 недель (приобретенным в Harlan Sprague Dawley, Inc. (Индианаполис, США) были подкожно введены 2106 опухолевых клеток линии человеческого почечноклеточного рака (Caki) в 100 мкл физиологического раствора с фосфатным буфером (ФРФБ). После того как установился рост опухоли (1 мм 3), мыши были разделены на 7 групп. Первой (лечебной) группе мышей (N=10) вводили инграперитонеально 2 раза в неделю моноклональное антитело IO-10, описанное в предыдущих примерах, в дозе 10 мг/кг. Второй (лечебной) группе мышей (N=10) вводили интраперитонеально 2 раза в неделю ингибиторIO-11/2, полученный путем химического синтеза и блокирующий аминокислотную последовательность,указанную на фиг. 2, в дозе 10 мг/кг. Четвертой (лечебной) группе мышей (N=10) вводили интраперитонеально 2 раза в неделю ингибитор IO-11/4, полученный путем химического синтеза и блокирующий аминокислотную последовательность, указанную на фиг. 4, в дозе 10 мг/кг. Пятой (лечебной) группе мышей (N=10) вводили интраперитонеально 2 раза в неделю ингибиторIO-11/11, полученный путем химического синтеза и блокирующий аминокислотную последовательность,указанную на фиг. 1, в дозе 10 мг/кг. Шестая (контрольная) группа мышей (N=10) лечения не получала. Седьмая (контрольная) группа мышей (N=10) получала лечение неспецифическим иммуноглобулином (IgG), интраперитонеально, в дозе 10 мг/кг. Размер опухоли и вес животных измеряли каждые 3 дня. Мыши подвергались эвтаназии при достижении опухоли размера 2000 мм 3 или на 60 день эксперимента. График роста опухоли в группах представлен на фиг. 14. На рисунке видно, что у тех мышей, которым были введены антагонисты (моноклональное антитело или низкомолекулярные ингибиторы) аминокислотной последовательности, указанной на фигурах 1,2,4,11 рост опухоли был достоверно замедлен,чем у мышей из контрольных групп. Медиана объема опухоли мышей контрольных групп была достоверно больше по сравнению с мышами лечебных групп (Р 0,001). У более 60% мышей, получавших антагонисты, объем опухоли не достиг критического значения в 2000 мм 3 на протяжении контрольного срока исследования - 60 дней, в отличии от мышей контрольных групп, где на 32 день эвтаназии была подвергнута последняя мышь, тк объем опухоли достиг 2000 мм 3. Общий вывод: селективные антагонисты (как моноклональные антитела, так и ингибиторы, полученные химическим путем), аминокислотных последовательностей (фиг. 1, 2, 4, 11) оказывают достоверное торможение опухолевого роста, тем самым влияя на продолжительность жизни. Пример 4. Результаты исследования: сравнение эффективности избирательного ингибирования аминокислотной последовательности, представленной на фиг. 1, и общего блокирования рецепторов с тирозинкиназной активностью в отношении опухолевого роста in vivo. Самкам мышей (Beige/nude) возрастом 6-8 недель (приобретенным в Harlan Sprague Dawley, Inc.(Индианаполис, США) были подкожно введены 2106 опухолевых клеток линии человеческого почечноклеточного рака (Caki) в 100 мкл физиологического раствора с фосфатным буфером (ФРФБ). После того как установился рост опухоли (1 мм 3), мыши были разделены на 6 групп. Первая (контрольная) группа мышей (N=10) лечения не получала. Второй (лечебной) группе мышей (N=10) вводили интраперитонеально 2 раза в неделю ингибиторBIBF 1120, блокирующий VEGFR, PDGFR, FGFR, в дозе 50 мг/кг. Размер опухоли и вес животных измеряли каждые 3 дня. Мыши подвергались эвтаназии при достижении опухоли размера 2000 мм 3 или на 60 день эксперимента. Изменение медианы объема опухоли и время до достижения размера опухоли 2000 мм 3 приведено в таблице. Как видно из таблицы, через 15 дней лечения достигнуты достоверные отличия в медиане объема опухоли между группами 2 и 4. Повышение дозы ингибитора IO-11 влияния на эффективность не оказывало, а, следовательно, даже небольшая доза сопровождается выраженным эффектом. На 20-й день получены достоверные отличия в размере опухоли в пользу IO-11 для всех лечебных групп. Было отмечено замедление опухолевого роста в группах мышей, получавших IO-11. Общий вывод: ингибирование аминокислотной последовательности, представленной на фиг. 1, является более эффективным в отношении подавления роста опухоли, чем ингибирование рецепторовVEGFR, PDGFR, FGFR. Использование ингибиторов, избирательно блокирующих данную аминокислотную последовательность, позволяет снижать дозу препарата без потери эффективности, что будет сопровождаться меньшей токсичностью. Пример 5. Результаты исследования: анализ выживания или пролиферации эидотелиалъпых клетокin vitro при добавлении моноклонального антитела IO-10. Для анализа выживания эндотелиальных клеток в среде факторов роста эндотелия сосудов (VEGFA) и фактора роста фибробластов (bFGF) и при блокировании аминокислотной последовательности,представленной на фиг. 1, был проведен подобный эксперимент, что и при блокировании фактора роста эндотелия сосудов, описанный в патенте США 20090022716 (Rockwell; Patricia et al. US Patent 20090022716). В качестве модели эндотелиоцитов использовались бычьи клетки капиллярного эндотелия коры надпочечников (КЭКН) (N. Ferrara et al. Proc. Nat. Acad. Sci. 84: 5773 (1987). В начале мы выявили высокую экспрессию VEGFR и FGFR на КЭКН в стандартном анализе Вестерн-блоттинг. Затем КЭКН были высеяны с плотностью 5104 клеток/мл в 12-луночных пластинках. В каждую лунку были добавлены VEGF-A 10 нг/мл и bFGF 10 нг/мл в присутствии или в отсутствие моноклонального антитела IO-10 (10 мкг/мл), а также постороннего моноклонального антитела без нейтрализующей активности (Abcam (10 мкг/мл. После роста культуры в течение 5 дней клетки в каждой лунке были подсчитаны с помощью компьютерной программы на анализаторе Hewlett Packard Scanjet (США). В качестве дополнительного контроля КЭКН выращивались в отсутствие факторов роста. Как показано на фиг. 15, моноклинальное антитело IO-10 подавляло способность добавленных факторов роста поддерживать рост и выживание бычьих КЭКН. Моноклональное антитело без нейтрализующей активности (Abcam) не оказывало никакого действия на клетки. Таким образом, пример демонстрирует, что при блокировании пути указанной на фиг. 1 аминокислотной последовательности, эндотелиальные клетки перестают размножаться и теряют митогенную активность, что может приводить к нарушению ангиогенеза в опухоли. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ подавления роста опухоли или лечения заболеваний, связанных с активностью тирозинкиназного рецептора, включающий введение ингибиторов, избирательно воздействующих на аминокислотную последовательность SEQ ID NO: 1 в структуре тирозинкиназного рецептора или на последовательность, отличающуюся от SEQ ID NO: 1 вставкой нескольких аминокислотных остатков, или на фрагмент последовательности SEQ ID NO: 1. 2. Способ по п.1, где последовательности, отличающиеся от SEQ ID NO: 1 вставкой нескольких аминокислотных остатков, представляют собой SEQ ID NO: 2 и 3. 3. Способ по п.1, где фрагменты последовательности SEQ ID NO: 1 представляют собой SEQ IDNO: 4-11. Изменение медианы объема опухоли и время до достижения размера опухоли 2000 мм 3 в группах мышейNA - оценить невозможно (все животные были подвергнуты эвтаназии ранее, так как размер опухоли составил более 2000 мм 3)
МПК / Метки
МПК: A61K 39/00, A61K 39/395, A61P 35/00
Метки: активностью, участков, подавления, лечения, рецепторов, способ, опухоли, ингибирования, избирательного, путем, роста, заболеваний, тирозинкиназной
Код ссылки
<a href="https://eas.patents.su/12-23383-sposob-podavleniya-rosta-opuholi-i-lecheniya-zabolevanijj-putem-izbiratelnogo-ingibirovaniya-uchastkov-receptorov-s-tirozinkinaznojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Способ подавления роста опухоли и лечения заболеваний путем избирательного ингибирования участков рецепторов с тирозинкиназной активностью</a>
Предыдущий патент: Способ получения высококонцентрированного препарата иммуноглобулина для подкожного применения
Следующий патент: Способ формирования защитного покрытия на полимерном основании
Случайный патент: Форма волны от излучателя в логарифмическом спектре для электромагнитного исследования с управляемым источником