Производные 8-пиперидинил-2-пиридинилпиримидо[1,2-a]пиримидин-4-она
Номер патента: 16251
Опубликовано: 30.03.2012
Авторы: Иэш Филипп, Локхед Алистер, Саади Мурад, Словински Франк
Формула / Реферат
1. Производное пиримидона, представленное формулой (I), или его соль
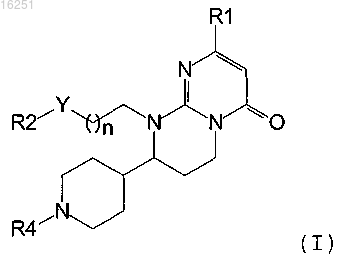
где Y представляет собой связь или карбонильную группу;
R1 представляет собой 2-, 3- или 4-пиридинил;
R2 представляет собой бензольное кольцо, необязательно замещенное 1 или 2 заместителями, выбранными из атома галогена и C1-6 алкоксигруппы;
R4 представляет собой атом водорода, C1-6 алкоксикарбонильную группу или C1-6 алкильную группу;
n принимает значения от 0 до 3.
2. Производное пиримидона или его соль по п.1, где R1 представляет собой 4-пиридинил.
3. Производное пиримидона или его соль по п.1 или 2,
где R1 представляет собой 4-пиридинил;
R2 представляет собой бензольное кольцо, необязательно замещенное 1 или 2 заместителями, выбранными из атома галогена или C1-2 алкоксигруппы;
R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу или C1-3 алкильную группу;
Y представляет собой карбонильную группу.
4. Производное пиримидона, которое выбирают из группы, состоящей из следующих соединений:
(+/-)1,1-диметилэтил 4-[6-оксо-1-(2-оксо-2-фенилэтил)-8-(4-пиридинил)-1,3,4,6-тетрагидро-2Н-пиримидо [1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат;
(+/-)этил 4-[6-оксо-1-(2-оксо-2-фенилэтил)-8-(4-пиридинил)-1,3,4,6-тетрагидро-2Н-пиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат;
(+/-)9-(2-оксо-2-фенилэтил)-8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-он;
(+/-)8-(1-метил-4-пиперидинил)-9-(2-оксо-2-фенилэтил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-он;
(+)9-(2-оксо-2-фенилэтил)-8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-он;
(-)9-(2-оксо-2-фенилэтил)-8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-он;
(+/-)9-[2-(4-фтор-2-метоксифенил)этил]-8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-он или
(-)9-[2-оксо-2-(3-бромфенил)этил]-8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-он,
или его соль, или его сольват, или его гидрат.
5. Соединение формулы (III)
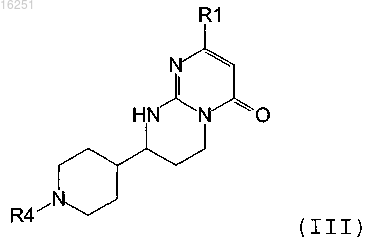
где R1 и R4 такие, как определено для соединения формулы (I) по п.1.
6. Лекарственное средство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного пиримидона, представленного формулой (I), или его соли по п.1.
7. Ингибитор GSK3β, выбранный из группы производных пиримидона, представленных формулой (I), или их солей по п.1.
8. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3β.
9. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративного заболевания.
10. Применение по п.9, где нейродегенеративное заболевание выбирают из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, сосудистой деменции; острого инсульта, травматических повреждений; цереброваскулярных расстройств, травмы головного мозга, травмы спинного мозга; периферических невропатий; ретинопатии или глаукомы.
11. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения инсулиннезависимого сахарного диабета, ожирения; маниакально-депрессивного расстройства; шизофрении; облысения или рака.
12. Применение по п.11, где рак представляет собой рак молочной железы, немелкоклеточный рак легкого, рак щитовидной железы, лейкемию Т- или В-клеток или вызываемые вирусом опухоли.
13. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения малярии.
14. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения костных заболеваний.
15. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения Pemphigus vulgaris.
16. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения нейтропении, вызванной химиотерапией рака.
Текст
где Y представляет собой связь или карбонильную группу; R1 представляет собой 2, 3 или 4 пиридинил; R2 представляет собой необязательно замещенное бензольное кольцо; R4 представляет собой атом водорода, C1-6 алкоксикарбонильную группу или C1-6 алкильную группу; n принимает значения от 0 до 3. Изобретение относится также к лекарственному средству, содержащему указанное производное или его соль в качестве активного ингредиента, которое используют для профилактического и/или терапевтического лечения такого нейродегенеративного заболевания, как болезнь Альцгеймера, вызываемого аномальной активностью GSK3.(71)(73) Заявитель и патентовладелец: САНОФИ-АВЕНТИС (FR); МИЦУБИСИ ТАНАБЕ ФАРМА КОРПОРЕЙШН (JP) 016251 Область техники Настоящее изобретение относится к соединениям, которые являются применимыми в качестве активного ингредиента лекарственного средства, предназначенного для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, вызываемых аномальной активностью GSK3. Уровень техникиGSK3 (гликогенсинтаза киназа 3) представляет собой ориентированную на пролин серинтреонинкиназу, которая играет важную роль в регуляции метаболизма, дифференцировки и выживаемости. Первоначально ее идентифицировали как фермент, способный фосфорилировать и, следовательно,ингибировать гликогенсинтазу. Позднее обнаружили, что GSK3 идентична киназе 1 таубелка (ТРК 1),ферменту, который фосфорилирует таубелок в эпитопах, которые, как было обнаружено, также оказываются гиперфосфорилированными при болезни Альцгеймера и некоторых таупатиях. Интересно, что фосфорилирование GSK3 протеинкиназой В (АКТ) приводит к потере ее киназной активности. Была выдвинута гипотеза, что ингибирование может опосредовать некоторые из воздействий нейротрофических факторов. Более того, фосфорилирование GSK3 -катенина, белка, вовлеченного в выживание клетки, приводит к его деградации по убиквитин-зависимому протеосомному пути. Таким образом, оказывается, что ингибирование GSK3 активности может привести к нейротрофической активности. Действительно, имеется доказательство, что литий, являющийся неконкурентным ингибитором GSK3, усиливает в некоторых моделях нейритогенез и также увеличивает выживаемость нейрональных клеток посредством индукции факторов выживания, таких как Bcl-2, и ингибирования экспрессии проапоптотических факторов, таких как Р 53 и Bax. Последние исследования продемонстрировали, что -амилоид увеличивает GSK3 активность и фосфорилирование таубелка. Более того, это гиперфосфорилирование, так же как нейротоксические эффекты -амилоида блокируются хлоридом лития и антисмысловой мРНК GSK3. Эти наблюдения позволяют убедительно предположить, что GSK3 может связывать основные патологические процессы при болезни Альцгеймера: аномальный процессинг АРР (белка предшественника амилоида) (и гиперфосфорилирование таубелка. Хотя тау-гиперфосфорилирование приводит к дестабилизации нейронального цитоскелета, патологические последствия аномальной активности GSK3, скорее всего, не являются следствием только патологического фосфорилирования таубелка, потому что, как упоминалось выше, чрезмерная активность этой киназы может влиять на выживаемость посредством модуляции экспрессии апоптических и антиапоптических факторов. Более того, было показано, что индуцированный -амилоидом рост активностиGSK3 приводит к фосфорилированию и, следовательно, ингибированию пируватдегидрогеназы, основного фермента продуцирования энергии и синтеза ацетилхолина. В целом, эти экспериментальные наблюдения указывают на то, что GSK3 может найти применение при лечении нейропатологических последствий и дефицита внимания и нарушения познавательной способности, связанных с болезнью Альцгеймера, а также других острых и хронических нейродегенеративных заболеваний и других патологий, при которых нарушена регуляция GSK3 (Nature reviews Vol.3,June 2004, p.479-487; Trends in Pharmacological Sciences Vol. 25 No. 9, Sept. 2004, p. 471-480; Journal ofneurochemistry 2004, 89, 1313-1317; Medicinal Research Reviews, Vol. 22, No. 4, 373-384, 2002). Нейродегенеративные заболевания включают в себя, кроме прочих, болезнь Паркинсона, тауопатии(Biochem. J. 372, p.129-136, 2003) и другие деменции, включающие сосудистую деменцию; острый инсульт и другие травматические повреждения; цереброваскулярные расстройства (например, возрастную дегенерацию желтого пятна); травму спинного и головного мозга, боковой амиотрофический склероз(European Journal of Neuroscience, Vol. 22, pp. 301-309, 2005), периферийные невропатии; ретинопатии и глаукому. Последние исследования показали, что ингибирование GSK3 приводит к нейрональной дифференцировке эмбриональных стволовых клеток (ESC) и способствует восстановлению человеческих и мышиных стволовых клеток (ESC-s) и поддержанию их плюрипотентности. Это предполагает, что ингибиторы GSK3 могли бы найти применение в восстановительной медицине (Nature Medicine 10, p. 55-63,2004). Ингибиторы GSK3 могут также найти применение при лечении других нарушений нервной системы, таких как биполярные расстройства (маникально-депрессивное расстройство). Например, литий использовали как стабилизатор настроения и основное лечение при биполярном расстройстве в течение более чем 50 лет. Терапевтическую активность лития наблюдают при дозах (1-2 мМ), при которых он является непосредственным ингибитором GSK3. Хотя механизм действия лития не ясен, ингибиторыGSK3 могли бы быть использованы для того, чтобы имитировать стабилизирующее действие лития на настроение. Изменения сигнального пути Akt-GSK3 также были вовлечены в патогенез шизофрении. В дополнение, ингибирование GSK3 могло бы оказаться полезным при лечении разных видов ра-1 016251 ка, таких как колоректальный рак, рак предстательной железы, рак молочной железы, немелкоклеточный рак легкого, рак щитовидной железы, лейкемия Т- или В-клеток и некоторых опухолей, вызываемых вирусом. Например, было показано, что активная форма GSK3 повышена в опухолях пациентов, страдающих колоректальным раком. И ингибирование GSK3 в клетках колоректального рака активизирует р 53-зависимый апоптоз и противодействует росту опухоли. Ингибирование GSK3 также усиливаетTRAIL-индуцируемый апоптоз в линии клеток рака предстательной железы. GSK3 также играет роль в динамике митотического веретена, и ингибиторы GSK3 препятствуют движению хромосомы и приводят к стабилизации микротрубочек и прометафазоподобной остановке, что аналогично наблюдаемому при малых дозах Таксола (Taxol). Другие возможные применения ингибиторов GSK3 включают в себя терапию инсулиннезависимого сахарного диабета (такого как сахарный диабет типа II), ожирения и облысения. Ингибиторы GSK3 человека также могут ингибировать ортолог этого фермента, pfGSK3, найденный в Plasmodium falciparum. В результате, они могли бы быть использованы при лечении малярии (Biochimica et Biophysica Acta 1697, 181-196, 2004). В последнее время, и генетика человека, и исследования животных указывали на роль путиWnt/LPR5 как основного регулятора роста костной массы. Ингибирование GSK3 ведет к последовательной активации классического Wnt сигнального пути. Так как дефицитный Wnt сигнальный путь был вовлечен в нарушения, связанные со сниженной костной массой, GSK3 ингибиторы также можно использовать для лечения расстройств, связанных со сниженной костной массой, костных патологий, остеопороза. В соответствии с последними данными, ингибиторы GSK3 могли бы использоваться при лечении или предотвращении Pemphigus vulgaris (обыкновенной пузырчатки). Последние исследования показывают, что лечение с помощью ингибитора GSK3 улучшает регенерацию нейтрофилов и мегакариоцитов. Поэтому, ингибиторы GSK3 будут применимы при лечении нейтропении, вызываемой химиотерапией рака. Описание изобретения Целью настоящего изобретения является получение соединений, применимых в качестве активного ингредиента лекарственного средства, предназначенного для профилактики и/или терапевтического лечения заболевания, вызываемого аномальной активностью GSK3, более конкретно, нейродегенеративных заболеваний. Точнее говоря, целью является получение новых соединений, применимых в качестве активного ингредиента лекарственного средства, которое дает возможность предотвращения и/или лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Таким образом, авторы настоящего изобретения идентифицировали соединения, обладающие ингибирующей активностью по отношению к GSK3. В результате, они обнаружили, что соединения, представленные нижеследующей формулой (I), обладают требуемой активностью и оказались пригодными в качестве активного ингредиента лекарственного средства, предназначенного для профилактики и/или терапевтического лечения вышеуказанных заболеваний. В настоящем изобретении, таким образом, предлагают в качестве объекта изобретения производные пиримидона, представленные формулой (I), или их соли где Y представляет собой связь или карбонильную группу;R2 представляет собой бензольное кольцо, необязательно замещенное 1 или 2 заместителями, выбранными из атома галогена и C1-6 алкоксигруппы;R4 представляет собой атом водорода, С 1-6 алкоксикарбонильную группу или C1-6 алкильную группу;n принимает значения от 0 до 3. Согласно еще одному аспекту настоящего изобретения, предлагают лекарственное средство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производных пиримидона, представленных формулой (I), и их физиологически преемлемых солей. Согласно следующему аспекту изобретения предлагается ингибитор GSK3, выбранный из группы производных пиримидона, представленных формулой (I), или их солей. Согласно еще одному аспекту настоящего изобретения, предлагают применение указанных выше соединений для получения лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3.-2 016251 В одном из вариантов осуществления изобретения лекарственное средство предназначено для профилактического и/или терапевтического лечения нейродегенеративного заболевания. Нейродегенеративное заболевание предпочтитиельно выбирают из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, сосудистой деменции; острого инсульта, травматических повреждений; цереброваскулярных расстройств, травмы головного мозга, травмы спинного мозга; периферических невропатий; ретинопатии или глаукомы. В следующем варианте осуществления изобретения лекарственное средство предназначено для профилактического и/или терапевтического лечения инсулиннезависимого сахарного диабета, ожирения; маникально-депрессивного расстройства; шизофрении; облысения или рака. Предпочтитиельно, рак представляет собой рак молочной железы, немелкоклеточный рак легкого, рак щитовидной железы, лейкемию Т- или В-клеток или вызываемые вирусом опухоли. В еще одном варианте осуществления изобретения лекарственное средство предназначено для профилактического и/или терапевтического лечения малярии, костных заболеваний, Pemphigus vulgaris или нейтропении, вызванной химиотерапией рака. Используемая здесь C1-6 алкильная группа представляет собой прямую или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, например, метильную группу, этильную группу, нпропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, вторбутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, 1,1-диметилпропильную группу, н-гексильную группу, изогексильную группу и тому подобное;C1-6 алкоксигруппа представляет собой алкилоксигруппу, имеющую от 1 до 4 атомов углерода, например метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу и тому подобное; Атом галогена представляет собой атом фтора, атом хлора, атом брома или атом иода; Уходящая группа L представляет собой группу, которая могла бы быть легко отщеплена и замещена. Такая группа может быть, например, тозилом, мезилом, бромидом и тому подобное. Соединения, представленные указанной выше формулой (I), могут образовывать соль. При наличии кислотной группы примеры соли включают в себя соли щелочных металлов и щелочно-земельных металлов, таких как соли лития, натрия, калия, магния и кальция; соли аммиака и таких аминов, как метиламин, диметиламин, триметиламин, дициклогексиламин, трис(гидроксиметил)аминометан, N,Nбис(гидроксиэтил)пиперазин, 2-амино-2-метил-1-пропанол, этаноламин, N-метилглюкамин и Lглюкамин; или соли с основными аминокислотами, такими как лизин, 5-оксилизин, и аргинин. Основноаддитивные соли кислотных соединений получают путем стандартных методик, хорошо известных в данной области техники. Когда имеется основная группа, то примеры включают соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота; соли с органическими кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфокислота, уксусная кислота, пропионовая кислота, винная кислота, фумаровая кислота, малеиновая кислота, яблочная кислота, щавелевая кислота, янтарная кислота, лимонная кислота, бензойная кислота, миндальная кислота, коричная кислота, молочная кислота, гликолевая кислота, глюкуроновая кислота, аскорбиновая кислота, никотиновая кислота и салициловая кислота; или соли с кислотными аминокислотами, такими как как аспаргиновая кислота и глутаминовая кислота. Кислотно-аддитивные соли основных соединений получают по стандартным методикам, хорошо известным в данной области техники, которые включают, кроме прочих, растворение свободного основания в водном спиртовом растворе, содержащем соответствующую кислоту, и отделение соли путем упаривания раствора, или посредством взаимодействия свободного основания и кислоты в органическом растворителе; в этом случае соль отделяют непосредственно, или осаждают вторым органическим растворителем, или она может быть получена путем концентрирования раствора. Кислоты, которые могут быть использованы для получения кислотно-аддитивных солей, предпочтительно включают в себя такие кислоты, которые при соединении со свободным основанием образуют фармацевтически приемлемые соли, то есть соли, анионы которых в фармацевтических дозах соли являются относительно безопасными для организма животного. Так что, полезные свойства, присущие свободному основанию, не дескридитированы побочными эффектами, получаемыми за счет анионов. Хотя терапевтически приемлемые соли основных соединений являются предпочтительными, все кислотно-аддитивные соли включены в объем настоящего изобретения. Производные пиримидона, представленные указанной выше формулой (I), могут иметь один или несколько асимметричных атомов углерода. Что касается стереохимии таких асимметричных атомов углерода, они независимо могут находиться и в (R), и в (S) конфигурации; и производное может существовать в виде стереоизомеров, таких как оптические изомеры или диастереомеры. Любые стереоизомеры в чистом виде, любые смеси стереоизомеров, рацематы и тому подобное включены в объем настоящего изобретения. Примеры соединений по настоящему изобретению приведены в табл. 1, находящейся ниже. Однако-3 016251 объем настоящего изобретения не ограничен этими соединениями. Объект настоящего изобретения включает также соединения, представленные формулой (I), где R1 представляет собой 4-пиридинил. Еще один объект настоящего изобретения включает соединения, представленные формулой (I), гдеR2 представляет собой бензольное кольцо, необязательно замещенное 1 или 2 заместителями, выбранными из атома галогена или C1-2 алкоксигруппы;R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу или C1-3 алкильную группу;Y представляет собой карбонильную группу. Следующий объект настоящего изобретения включает группу соединений формулы, определенных ниже: 1) (+/-)1,1-диметилэтил 4-[6-оксо-1-(2-оксо-2-фенилэтил)-8-(4-пиридинил)-1,3,4,6-тетрагидро-2 Нпиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат; 2) (+/-)этил 4-[6-оксо-1-(2-оксо-2-фенилэтил)-8-(4-пиридинил)-1,3,4,6-тетрагидро-2 Н-пиримидо[1,2 а]пиримидин-2-ил]-1-пиперидинкарбоксилат; 3) (+/-)9-(2-оксо-2-фенилэтил)-8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4 Н-пиримидо(-)9-[2-оксо-2-(3-бромфенил)этил]-8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4 Нпиримидо[1,2-а]пиримидин-4-он. Еще одним объектом изобретения являются соединения формулы (III) где R1 и R4 такие, как определено для соединения формулы (I) выше. Соединения по изобретению могут быть получены, например, по методикам, описанным ниже. Методика получения Соединения пиримидона, представленные указанной выше формулой (I), могут быть получены по методике, показанной на схеме 1. Схема 1(На приведенной выше схеме обозначения R1, R2, R4, Y, n аналогичны уже приведенным обозначениям для соединения формулы (I. Следуя этой методике, чтобы получить соединение указанной выше формулы (I), производное пиримидона, представленное приведенной выше формулой (III), где R1, R4 являются такими же, как были определены для соединения формулы (I), вводят во взаимодействие в обычных атмосферных условиях с основанием, таким как гидрид натрия, карбонат натрия или карбонат калия, в таком растворителе, какN,N-диметилформамид, N-метилпирролидон, N,N-диметилацетамид или хлороформ, при соответствующей температуре в интервале от 0 до 130 С; и затем - с соединением формулы (II), где R2, Y и n являются такими же, как были определены для соединения формулы (I), a L представляет собой уходящую группу, предпочтительно бромид или мезил. Альтернативно, соединения формулы (I), в которых Y представляет собой карбонильную группу,могут быть получены окислением соединения формулы (I), в котором Y представляет собой метилено-4 016251 вую группу, замещенную гидроксильной группой, по методикам, хорошо известным специалисту в данной области техники. Соединение формулы (II) коммерчески доступно или может быть синтезировано по методикам, хорошо известным специалисту в данной области техники. Соединение формулы (III) может быть получено по методике, приведенной на схеме 2. Схема 2(На приведенной выше схеме определения для R1, R4 аналогичны уже описанным.) Согласно этой методике, 3-кетоэфир формулы (IV), где R1 является таким же, как определено для соединения формулы (I), и R представляет собой алкильную группу, такую как, например, метильную или этильную, вводят во взаимодействие с соединением формулы (V), в котором R4 является таким же,как определено для соединения формулы (I). Реакцию можно проводить в присутствии такого основания как карбонат калия, в спиртовом растворителе, таком как метанол, этанол и тому подобное, или без него,при соответствующей температуре, находящейся в интервале от 25 до 140 С, в обычных атмосферных условиях. Альтернативно, соединение формулы (III), в котором R4 представляет собой атом водорода вводят во взаимодействие с таким основанием как карбонат натрия или триэтиламин в смеси растворителей,таких как тетрагидрофуран и вода, и затем - с соединением R4L формулы (VI), в котором R4 определен аналогично тому, как он определен в соединении формулы (I), рядом с атомом водорода, a L представляет собой уходящую группу, предпочтительно, хлорид, мезил или бромид, чтобы получить еще одно соединение формулы (III), где R4 не является атомом водорода. Соединение формулы (IV) коммерчески доступно или может быть синтезировано по методикам,хорошо известным специалисту в данной области техники. Например, соединения формулы (IV), в которых R1 представляет собой пиридиновое кольцо могут быть, соответственно, получены посредством взаимодействия изоникотиновой кислоты с соответствующим моноэфиром малоновой кислоты. Реакция может быть осуществлена при использовании методов,хорошо известных специалисту в данной области техники, таких как, например, в присутствии связующего агента, такого как 1,1'-карбонилбис-1 Н-имидазола в растворителе, таком как тетрагидрофуран, при температуре в интервале 20-70 С. Соединение формулы (V) может быть синтезировано по методикам, хорошо известным специалисту в данной области техники. Например, соединение формулы (V), в котором R4 аналогичен тому, которые определяли для соединения формулы (I), может быть получено по методике, показанной на схеме 3, исходя из соединения формулы (VIII). Условия, которые могут быть использованы, приведены в разделе "Химические примеры". Схема 3 Соединение формулы (VII) может быть синтезировано по аналогии с методом, описанным в J. Org.Chem. 1977, 42, 221-225. Соединение формулы (VIII) может быть синтезировано по аналогии с методом, описанным в J.Med. Chem. 1978, 21, 623-628. В приведенных выше реакциях иногда может оказаться необходимой защита функциональной группы или удаление защиты функциональной группы. В зависимости от типа функциональной группы может быть выбрана соответствующая защитная группа Pg и может быть применен способ, описанный в литературе. Примеры защитных групп, способов защиты и способов удаления защитных групп приведены, например, в Protective groups in Organic Synthesis Greene et al., 2nd Ed. (John WileySons, Inc., NewYork) 1985. Соединения по настоящему изобретению обладают ингибирующей активностью по отношению кGSK3. Соответственно, соединения по настоящему изобретению являются применимыми в качестве активного ингредиента для получения лекарственного средства, которое дает возможность пррофилактического и/или терапевтического лечения заболевания, вызываемого аномальной активностью GSK3 и, более подробно, таких нейродегенеративных заболеваний как болезнь Альцгеймера. И, в дополнение,соединения по настоящему изобретению являются также применимыми как активный ингредиент при получении лекарственного средства для пофилактического и/или терапевтического лечения таких нейродегенеративных заболеваний как болезнь Паркинсона, тауопатии (например, лобно-височно-теменная деменция, кортикобазальная дегенерация, заболевание Пика, прогрессирующий супрануклеарный паралич) и других деменций, включающих сосудистую деменцию; острого инсульта и других травматических повреждений; цереброваскулярных расстройств (например, возрастная дегенерация желтого пятна); травмы спинного и головного мозга; периферийных невропатий; ретинопатии и глаукомы; и других заболеваний, таких как инсулиннезависимый сахарный диабет (такой как сахарный диабет типа II) и ожирение; маникально-депрессивное расстройство; шизофрения; облысение; таких видов рака, как рак молочной железы, немелкоклеточный рак легкого, рак щитовидной железы, лейкемию Т- или В-клеток и некоторых опухолей, вызываемых вирусом. Настоящее изобретение дополнительно относится к способу лечения нейродегенеративных заболеваний, вызываемых аномальной активностью GSK3, и упомянутых выше заболеваний, который включает введение в организм млекопитающего, нуждающегося в лечении, эффективного количества соединения формулы (I). В качестве активного ингредиента лекарственного средства по настоящему изобретению может быть использовано вещество, которое выбирают из группы, состоящей из соединения, представленного указанной выше формулой (I) и его фармакологически приемлемых солей и его сольватов, и его гидратов. Вещество, само по себе, может быть введено в качестве лекарственного средства по настоящему изобретению, однако, желательно вводить лекарственное средство в виде фармацевтической композиции, которая содержит в качестве активного ингредиента упомянутое выше вещество и одну или несколько фармацевтических добавок. В качестве активного ингредиента лекарственного средства по настоящему изобретению может быть использована комбинация двух или более из указанных выше веществ. Указанная выше фармацевтическая композиция может быть дополнена активным ингредиентом из другого лекарственного средства для лечения указанных выше заболеваний. Тип фармацевтической композиции особенно не ограничивают, и композиция может быть предложена в виде любого состава для перорального или парентерального введения. Например, фармацевтическая композиция может быть представлена в форме для фармацевтических композиций, предназначенных для перорального введения,таких как гранулы, мелкие гранулы, порошки, твердые капсулы, мягкие капсулы, сиропы, эмульсии, суспензии, растворы и тому подобное. Или она может быть в форме фармацевтических композиций, предназначенных для парентеральных введений, таких как инъекции для внутривенного, внутримышечного или подкожного введения, капельные инфузии трансдермальные препараты, трансмукозальные препараты, назальные капли, лекарственные формы для ингаляции, суппозитории и тому подобное. Препараты для инъекций или препараты для капельных инфузий, могут быть получены в виде порошкообразных препаратов, таких как лиофилизованные препараты; их можно использовать прямо перед употреблением,растворяя в соответствующей водной среде, такой как физиологический солевой раствор. Препараты с замедленным высвобождением, такие как препараты, покрытые полимерной оболочкой, можно вводить прямо интрацеребрально. Типы фармацевтических добавок, используемые в производстве фармацевтической композиции,коэффициенты соотношения фармацевтических добавок и активного ингредиента и способы получения фармацевтической композиции могут быть соответственно выбраны специалистом в данной области техники. В качестве фармацевтических добавок могут быть использованы неорганические или органические вещества, или твердые или жидкие вещества. Как правило, фармацевтические добавки могут быть введены в соотношении, находящемся в интервале 1-90 мас.% от массы активного ингредиента. Примеры наполнителей, используемых для получения твердых фармацевтических композиций,включают в себя, например, лактозу, сахарозу, крахмал, тальк, целлюлозу, декстрин, каолин, карбонат кальция и тому подобное. Для получения жидких композиций для орального введения можно использовать обычный инертный разбавитель, такой как вода, растительное масло. Жидкая композиция может содержать, в дополнение к инертному разбавителю, такие вспомогательные вещества, как увлажняющие агенты, суспендирующие вспомогательные средства, подсластители, ароматизаторы, красители и консерванты. Жидкая композиция может быть помещена в капсулы, выполненные из абсорбируемого материала, такого как желатин. Примеры растворителей или суспензионных сред, используемых при получении композициий для парентерального введения, например инъекций, суппозиториев, включают воду,пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат, лецитин и тому подобное. Примеры веществ основы, используемых для суппозиториев включают в себя, например, масло какао, эмульгиро-6 016251 ванное масло какао, липид лауриновой кислоты, витепсол. Дозу и частоту введения лекарственного средства по настоящему изобретению в особенности не ограничивают. И они могут быть выбраны надлежащим образом, в зависимости от таких условий, как цель профилактического и/или терапевтического лечения, тип заболевания, масса тела или возраст пациента, тяжесть заболевания и тому подобное. Как правило, ежедневная доза при оральном введении взрослому пациенту может составлять от 0,01 до 1,000 мг (масса активного ингредиента). Доза может быть введена один раз в день или несколько раз в день разделенными порциями, или один раз в несколько дней. Когда используют лекарственное средство в виде инъекции, введения взрослому пациенту,предпочтительно, могут осуществлять непрерывно или с перерывами, с дневной дозой от 0,001 до 100 мг(масса активного ингредиента). Химические примеры Пример 1 (соединение 1 табл. 1). (+/-)1,1-Диметилэтил 4-[6-оксо-1-(2-оксо-2-фенилэтил)-8-(4 пиридинил)-1,3,4,6-тетрагидро-2H-пиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат. 1.1. (+/-)6-Пиперидин-4-ил-1,4,5,6-тетрагидропиримидин-2-иламин (3:1) гидрохлорид. К раствору 5 г (29,04 ммоль) 2-амино-4-(4-пиридинил)пиримидина (Journal of Medicinal Chemistry(1978), 21(7), 623-8) в 30 мл 6 н. раствора хлористо-водородной кислоты в изопропаноле добавляли 5 мл воды и 0,2 г палладиевого катализатора на угольном носителе (10 мас.%/мас.). Суспензию в течение 8 ч гидрировали при температуре 50 С под давлением 40 (psi) фунт/кв.дюйм. Катализатор удаляли фильтрованием, и растворитель выпаривали при пониженном давлении. Добавляли изопропанол, и полученный раствор повторно фильтровали, и растворитель удаляли выпариванием при пониженном давлении, чтобы получить 4,0 г (55%) соединения в виде белого порошка, который, по существу, и использовали. 1.2. (+/-)8-(4-Пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4 он. Смесь 2,8 г (14,50 ммоль)этил 3-(пиридин-4-ил)-3-оксопропионата, 3,7 г (14,50 ммоль) (+/-)6 пиперидин-4-ил-1,4,5,6-тетрагидропиримидин-2-иламина (3:1) гидрохлорида и 6,01 г (43,50 ммоль) карбоната калия в 50 мл этанола кипятили 12 ч с обратным холодильником. Охлажденный раствор упаривали, чтобы удалить растворитель. Смесь растворяли в дихлорметане,сушили над сульфатом натрия, упаривали, и остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол/раствор водного аммиака (29%) в соотношении от 100/0/0 до 80/20/2, что приводило к получению 1,69 г (37%) продукта в виде белого твердого вещества. Т.пл. (Mp): 245-247 С. 1.3. (+/-)1,1-Диметилэтил 4-[6-оксо-8-(4-пиридинил)-1,3,4,б-тетрагидро-2 Н-пиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат. К раствору 1,7 г (5,46 ммоль) (+/-)8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4 Нпиримидо[1,2-а]пиримидин-4-она в 20 мл тетрагидрофурана добавляли 11 мл воды, 0,761 мл (5,46 ммоль) триэтиламина и 1,19 г (5,46 ммоль) дитрет-бутилдикарбоната в 15 мл тетрагидрофурана. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь упаривали, чтобы удалить растворитель. Остаток растворяли в дихлорметане и промывали насыщенным водным раствором хлорида аммония, насыщенным водным хлоридом натрия, сушили над сульфатом натрия, и растворитель выпаривали. Неочищенный продукт перекристаллизовывали из этилацетата и фильтровали, чтобы получить 2,19 г(97%) чистого продукта в виде белого твердого вещества. Т.пл. (Мр): 148-150 С. 1.4. (+/-)1,1-Диметилэтил 4-[6-оксо-1-(2-оксо-2-фенилэтил)-8-(4-пиридинил)-1,3,4,6-тетрагидро-2 Нпиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат. К раствору 0,31 г (0,76 ммоль) (+/-)1,1-диметилэтил 4-[6-оксо-8-(4-пиридинил)-1,3,4,6-тетрагидро 2 Н-лиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилата в 6 мл безводного диметилформамида добавляли 0,039 г (0,98 ммоль) гидрида натрия (60% суспензия в минеральном масле). Смесь оставляли перемешиваться при 50 С в течение 1 ч и охлаждали при 0 С. Затем, добавляли 0,18 г (0,91 ммоль) 2 бромацетофенона. Смесь оставляли перемешиваться в течение 12 ч при 0 С и при комнатной температуре. Добавляли воду, и смесь оставляли перемешиваться 1 ч при 0 С. Осадок отфильтровывали, подвергали хроматографии на силикагеле, элюируя смесью хлороформ/метанол в соотношениях от 100/0 до 97/3, чтобы получить 0,140 г чистого продукта в виде белого твердого вещества. Т.пл. (Мр): 179-181 С. Пример 2 (соединение 3 табл. 1).[1,2-а]пиримидин-4-он. К раствору 0,0847 г (0,16 ммоль) (+/-)4-[6-оксо-1-(2-оксо-2-фенилэтил)-8-(4-пиридинил)-1,3,4,6 тетрагидро-2 Н-пиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилата в 2 мл тетрагидрофурана добавляли 5 мл водного раствора хлористо-водородной кислоты (2 н.); и полученный раствор перемешивали 2 ч при комнатной температуре.-7 016251 Полученную смесь упаривали, и остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/водный раствор аммиака (29%) в соотношениях 80/20/2, чтобы получить 0,030 г чистого продукта в виде белого твердого вещества. Т.пл. (Мр): 227-229 С. Пример 3 (соединение 2 табл. 1). (+/-)Этил 4-[6-оксо-1-(2-оксо-2-фенилэтил)-8-(4-пиридинил)1,3,4,6-тетрагидро-2 Н-пиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат. 3.1 (+/-)Этил 4-[6-оксо-8-(4-пиридинил)-1,3,4,6-тетрагидро-2 Н-пиримидо[1,2-а]пиримидин-2-ил]-1 пиперидинкарбоксилат. К раствору 0,2 г (0,64 ммоль) (+/-)8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4 Нпиримидо[1,2-а]пиримидин-4-она в 10 мл диметилформамида добавляют 98 мкл (0,71 ммоль) триэтиламина и 106 мкл (1,03 ммоль) этилхлороформиата. Полученную смесь перемешивали 16 ч при комнатной температуре. Затем охлажденную смесь добавляли к дихлорметану и промывали насыщенным водным раствором хлорида аммония, затем насыщенным водным раствором хлорида натрия. Органический раствор сушили над сульфатом натрия и упаривали, чтобы получить 0,2 г чистого продукта в виде желтого твердого вещества. Т.пл. (Мр): 185-187 С. 3.2. (+/-)Этил 4-[6-оксо-1-(2-охо-2-фенилэтил)-8-(4-пиридинил)-1,3,4,6-тетрагидро-2 Н-пиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат. Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.4), используя (+/-) этил 4-[6-оксо-8-(4-пиридинил)-1,3,4,6-тетрагидро-2 Н-пиримидо[1,2-а]пиримидин-2-ил]-1-пиперидинкарбоксилат. Т.пл. (Мр): 159-161 С. Пример 4 (соединение 4 табл. 1). (+/-)8-(1-Метил-4-пиперидинил)-9-(2-оксо-2-фенилэтил)-2-(4 пиридинил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Гидрохлорид (2:1). 4.1. (+/-)8-(1-Метил-4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. К раствору 0,45 г (1,45 ммоль) (+/-)8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4 Нпиримидо[1,2-а]пиримидин-4-она, 0,452 г (14,45 ммоль) параформальдегида в 10 мл уксусной кислоты добавляли 0,364 г (6,99 ммоль) цианоборогидрида натрия. Полученную смесь перемешивали 12 ч при комнатной температуре; смесь охлаждали при 0 С, затем осторожно вливали в 60 мл водного раствора гидроксида натрия (30%), экстрагировали дихлорметаном, сушили над сульфатом натрия и упаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/водный раствор аммиака (29%) в соотношениях от 98/2/0,2 до 95/5/05, чтобы получить 0,316 г чистого продукта в виде масла. 4.2.(+/-)8-(1-Метил-4-пиперидинил)-9-(2-оксо-2-фенилэтил)-2-(4-пиридинил)-6,7,8,9-тетрагидро 4 Н-пиримидо[1,2-а]пиримидин-4-он. Гидрохлорид (2:1). Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.4), используя (+/-)8(1-метил-4-пиперидинил)-2-(4-пиридинил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Т.пл. (Мр): 272-274 С. Пример 5 (соединение 5 табл. 1) (+)9-(2-Оксо-2-фенилэтил)-8-(4-пиперидинил)-2-(4-пиридинил)6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Гидрохлорид (2:1). 117 мг (0,27 ммоль) (+/-)9-(2-Оксо-2-фенилэтил)-8-(4-пиперидинил)-2-(4-пиридинил)-6,7,8,9 тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она (соединение 3) отделяли хиральной препаративной ВЭЖХ (HPLC) (CHIRALCEL OD 25050), элюируя изопропанолом, чтобы получить 0,046 г чистого продукта, получаемого в форме свободного основания, которое преобразовывали в гидрохлорид, tR (время удерживания): 56 мин. Т.пл. (Мр) : 269 С. []D20 = +10,3 (с=0,724, этанол). Пример 6 (соединение 6 табл. 1). (-)9-(2-Оксо-2-фенилэтил)-8-(4-пиперинидил)-2-(4-пиридинил)6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Гидрохлорид (2:1). 117 мг (0,27 ммоль) (+/-)9-(2-оксо-2-фенилэтил)-8-(4-пиперинидил)-2-(4-пиридинил)-2-(4 пиридинил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она (соединение 3) отделяли хиральной препаративной ВЭЖХ (HPLC) (CHIRALCEL OD 25050), элюируя изопропанолом, чтобы получить 0,055 г чистого продукта, получаемого в форме свободного основания, которое преобразовывали в гидрохлорид, tR (время удерживания): 19 мин. Мр: 269 С. []D20 = -15,7 (с=0,848, этанол). Перечень химических структур и физических данных для соединений указанной выше формулы (I),иллюстрирующий настоящее изобретение, приведен в табл. 1. Соединения получали, в соответствии со способами, описанными в примерах. В табл. р, о и m имеют значение 2; q яавляется 0; Et обозначает этильную группу; Bu обозначает бутильную группу; Ph обозначает фенильную группу; (Rot.) указывает на левовращающие или правовращающие свойства энантиомерного соединения. Пример тестирования ингибирующей активности по отношению к GSK3 лекарственного средства по настоящему изобретению: Могут быть использованы два различных протокола. По первому протоколу: 7,5 мкМ предварительно фосфорилированного GS1 пептида и 10 мкМ АТР(АТФ) (содержащего 33 Р-АТР, 300,000 cpm (импульсов в минуту 1 ч инкубировали при комнатной температуре в 25 мМ Tris-HCl, pH 7,5, 0,6 мМ DTT, 6 мМ MgCl2, 0,6 мМ EGTA (этиленгликолевая тетраацетиловая кислота), 0,05 мг/мл BSA буфера (буфера бычьего сывороточного альбумина) в присутствииGSK3 (общий объем реакции: 100 мкл). По второму протоколу: 4,1 мкМ предварительно фосфорилированного GS1 пептида и 42 мкМ АТР(содержащего 33 Р-АТР, 260,000 cpm) 2 ч инкубировали в 80 мМ Mes-NaOH, pH 6,5, 1 мМ ацетата Mg, 0,5 мМ EGTA, 5 мМ 2-меркаптоэтанола, 0,02% Tween 20, 10% глицероловом буфере при комнатной температуре в присутствии GSK3. Ингибиторы растворяли в ДМСО (DMSO) (с конечной концентрацией растворителя в реакционной среде, составляющей 1%). Реакцию останавливали 100 микролитрами раствора, составленного из 25 г полифосфорной кислоты (85% Р 2 О 5), 126 мл 85% Н 3 РО 4, Н 2 О до 500 мл и затем, перед использованием разбавляли до соотношения 1:100. Затем аликвоту реакционной смеси перемещали на катионовые фильтры (Whatman P81) и промывали описанным выше раствором. Включенную 33 Р радиоактивность определяли с помощью жидкостной сцинтилляционной спектрометрии. Фосфорилированный GS-1 пептид имеет нижеследующую последовательность: NH2YRRAAVPPSPSLSRHSSPHQS(Р)EDEE-СООН.(Woodgett, J. R. (1989) Analytical Biochemistry 180, 237241.-9 016251 Ингибирующую активность соединений по настоящему изобретению по отношению к GSK3 выражают в IC50, и в качестве иллюстрации интервал изменений IC50 соединений, показанный в табл. 1,представляет концентрации между 10 нмол и 1 мкмол. Например, для соединения 3 табл. 1 приведена(1) Таблетки. Ингредиенты, приведенные ниже, смешивали общепринятым способом и подвергали сжатию, используя стандартную аппаратуру.(2) Мягкие капсулы. Ингредиенты, приведенные ниже, смешивали общепринятым способом и заполняли ими мягкие капсулы.(1) Парентеральные препараты Ингредиенты, приведенные ниже, смешивали общепринятым способом, чтобы получить препараты для инъекций заключенные в 1 мл ампулу. Промышленная применимость Соединения по настоящему изобретению обладают ингибирующей активностью по отношению кGSK3 и применимы в качестве активного ингредиента лекарственного средства, предназначенного для профилактического и/или терапевтического лечения заболеваний, вызываемых аномальной активностью где Y представляет собой связь или карбонильную группу;R2 представляет собой бензольное кольцо, необязательно замещенное 1 или 2 заместителями, выбранными из атома галогена и C1-6 алкоксигруппы;R4 представляет собой атом водорода, C1-6 алкоксикарбонильную группу или C1-6 алкильную группу;n принимает значения от 0 до 3. 2. Производное пиримидона или его соль по п.1, где R1 представляет собой 4-пиридинил. 3. Производное пиримидона или его соль по п.1 или 2,где R1 представляет собой 4-пиридинил;R2 представляет собой бензольное кольцо, необязательно замещенное 1 или 2 заместителями, выбранными из атома галогена или C1-2 алкоксигруппы;R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу или C1-3 алкильную группу;Y представляет собой карбонильную группу. 4. Производное пиримидона, которое выбирают из группы, состоящей из следующих соединений: где R1 и R4 такие, как определено для соединения формулы (I) по п.1. 6. Лекарственное средство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного пиримидона, представленного формулой (I), или его соли по п.1. 7. Ингибитор GSK3, выбранный из группы производных пиримидона, представленных формулой(I), или их солей по п.1. 8. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3. 9. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративного заболевания. 10. Применение по п.9, где нейродегенеративное заболевание выбирают из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, сосудистой деменции; острого инсульта, травматических повреждений; цереброваскулярных расстройств, травмы головного мозга, травмы спинного мозга; периферических невропатий; ретинопатии или глаукомы. 11. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения инсулиннезависимого сахарного диабета, ожирения; маниакальнодепрессивного расстройства; шизофрении; облысения или рака. 12. Применение по п.11, где рак представляет собой рак молочной железы, немелкоклеточный рак легкого, рак щитовидной железы, лейкемию Т- или В-клеток или вызываемые вирусом опухоли. 13. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения малярии. 14. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения костных заболеваний. 15. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения Pemphigus vulgaris. 16. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения нейтропении, вызванной химиотерапией рака.
МПК / Метки
МПК: A61P 37/00, C07D 487/04, A61P 33/06, A61K 31/519, A61P 35/00, A61P 25/28
Метки: 8-пиперидинил-2-пиридинилпиримидо[1,2-a]пиримидин-4-она, производные
Код ссылки
<a href="https://eas.patents.su/12-16251-proizvodnye-8-piperidinil-2-piridinilpirimido12-apirimidin-4-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 8-пиперидинил-2-пиридинилпиримидо[1,2-a]пиримидин-4-она</a>
Предыдущий патент: Применение плазминогена для лечения инфекционных заболеваний
Следующий патент: Несущий опорный элемент для системы фиксации костей
Случайный патент: Способ смены передаточного отношения и устройство для его осуществления












