Применение соединения из класса пептидов для лечения аллодинии и других типов хронической или фантомной боли
Формула / Реферат
1. Применение соединения формулы (I)
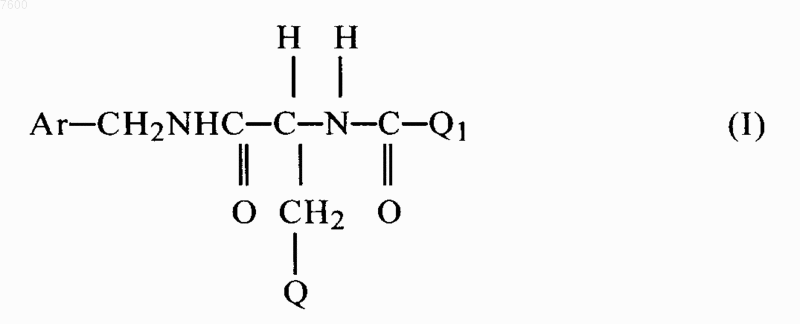
где Аr обозначает фенил, который может быть незамещен или замещен по меньшей мере одной галогруппой;
Q обозначает (низш.)алкоксигруппу, содержащую 1-3 атома углерода, и
Q1 обозначает метил,
или его фармацевтически приемлемой соли для приготовления фармацевтической композиции, предназначенной для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания, или хронической или фантомной боли, или ощущения шума в ушах.
2. Применение по п.1, где соединение или его фармацевтически приемлемая соль находятся в R-конфигурации.
3. Применение по любому из пп.1-2, где соединение представляет собой практически чистый энантиомер.
4. Применение по любому из пп.1-3, где Аr обозначает незамещенный фенил.
5. Применение по любому из пп.1-4, где галоген обозначает фтор.
6. Применение по любому из пп.1-5, где Q обозначает (низш.)алкоксигруппу, содержащую 1-3 атома углерода, и Аr обозначает незамещенный фенил.
7. Применение по п.1, где соединение формулы (I) представляет собой (R)-2-ацетамидо-N-бензил-3-метоксипропионамид или его фармацевтически приемлемую соль.
8. Применение по п.7, где соединение представляет собой практически чистый энантиомер.
9. Применение соединения по любому из пп.1-8 для приготовления лекарственного средства, предназначенного для лечения ощущения шума в ушах.
10. Применение фармацевтической композиции, содержащей эффективное количество соединения по любому из пп.1-8 и фармацевтически приемлемый носитель для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания, или хронической или фантомной боли, или ощущения шума в ушах.
Текст
007600 Предпосылки создания изобретения Настоящее изобретение относится к новому применению группы специфических аминокислотных производных формулы I для приготовления фармацевтических композиций, предназначенных для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания, но связанной часто также с невропатической болью, или других различных типов хронической или фантомной боли. В частности, настоящее изобретение относится к новому применению харкосерида и его производных для приготовления фармацевтических композиций, предназначенных для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания, но связанной часто с невропатической болью, или других различных типов хронической или фантомной боли. Химическое название соединения SPM 927, которое обозначено также в настоящем описании как харкосерид, (R)-2-анетамидо-N-бензил-3-метоксипропионамид. Соединения по изобретению представляют собой известные агенты, которые применяют для лечения припадков, связанных с нарушениями центральной нервной системы, таких как эпилепсия, удар и церебральная ишемия. Настоящее изобретение относится к новому применению соединения формулы I, приведенной ниже, для приготовления фармацевтических композиций, предназначенных для лечения боли, в частности,для лечения болезней, связанных с хронической болью, и, прежде всего, для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания,но связанной часто также с состояниями невропатической боли, или других различных типов хронической или фантомной боли и ощущения шума в ушах. Соединения по изобретению представляют собой соединения формулы I(I) или их фармацевтически приемлемые соли,где Аr обозначает фенил, который может быть незамещен или замещен по меньшей мере одной галогруппой;Q1 обозначает метил. Под объем изобретения подпадают также диастереомеры и энантиомеры соединений формулы I. Предпочтительными соединениями по изобретению являются соединения формулы I в виде (R)-,(S)- или (R,S)-изомеров. Наиболее предпочтительным соединением является(R)-2-ацетамидо-N-бензил-3 метоксипропионамид или его фармацевтически приемлемая соль. Боль представляет собой субъективное чувство, и ее ощущение связано с конкретными частями центральной нервной системы (ЦНС). Как правило, отрицательные (периферические) стимулы передаются в центральную нервную систему заблаговременно, но боль не всегда связана с ноцицепцией. Существует широкое разнообразие типов клинической боли, в основе которой лежат различные патофизиологические механизмы и для лечения которых требуются различные подходы. Ощущение боли характеризуется тремя основными типами клинической боли:- острая боль,- хроническая боль,- невропатическая боль,Острая клиническая боль, как правило, является следствием воспаления или повреждения мягких тканей. Этот тип боли является адаптивным и имеет важную биологическую функцию предупреждения и способствует нахождению в покое поврежденной части организма с целью ее заживления и репарации. Защитная функция достигается посредством того, что поврежденная/воспаленная область и окружающая ее ткань становятся гиперчувствительными ко всем стимулам, что позволяет избегать контакта с любым внешним стимулом. Нейронные механизмы, лежащие в основе этого типа клинической боли, сравнительно хорошо изучены и фармакологический контроль острой клинической боли можно эффективно осуществлять с помощью, например, нестероидных противовоспалительных средств (НСПВС), и вплоть до использования опиоидов, в зависимости от типа и интенсивности ощущения. Хроническая клиническая боль проявляется в виде постоянных сенсорных аномалий, являющихся результатом возникновения периферической патологии, такой как рак или хроническое воспаление (например, артрит), или может не зависеть от инициирующих боль механизмов. Последний случай является-1 007600 неадаптивным, не имеет преимущества для выживания и очень часто не поддается эффективному лечению. Невропатическая боль вызывается повреждением или инфекцией периферических сенсорных нервов. Она включает (но не ограничиваясь этим) боль, вызванную травмой периферических нервов, инфекцией, связанной с вирусом герпеса, сахарным диабетом, каузалгией, авульсией сплетения, невромой, ампутацией конечности и васкулитом. Невропатическая боль может также вызваться повреждением нерва,являющегося результатом хронического алкоголизма, заражения вирусом иммунодефицита человека,гипотиреозом, уремией или недостатком витаминов. Невропатическая боль включает (но не ограничиваясь этим) боль, вызванную поражением нерва, например, боль, вызванную диабетом. Для невропатической боли характерны два различных патофизиологических механизма: Во-первых, повышенная активность афферентных ноцицептивных нейронов, следствием чего является повышение чувствительности (спящих) нейронов (примером этого является боль, связанная с воспалением, раком, головная боль, боль нижней спинной области, висцеральная боль, мигрень), при этом первичный афферентный ноцицептивный нейрон остается интактным, хотя при этом, как правило, рецепторная активность изменяется и снижаются пороги чувствительности, увеличивается скорость разрядов и инициируется или повышается спонтанная активность. Во-вторых, эктопическая активность афферентных ноцицептивных нейронов, в результате повреждений их аксонов (примером является невропатическая боль периферической и центральной нервной системы), при этом происходит повреждение афферентного нейрона. Это приводит к необратимым биохимическим, морфологическим и функциональным изменениям периферической и центральной нервной системы. Таким образом, (периферическая) невропатия в широком смысле относится к болезни (периферической) нервной системы. Известно несколько причин невропатии человека, отличающихся широким разнообразием симптомов и неврологических расстройств. Под болевыми невропатиями понимают неврологические нарушения, характеризующиеся персистентной болью и гиперчувствительностью той области организма, в которой повреждена сенсорная иннервация, однако поражение сенсорных нервов не всегда вызывает невропатическую боль, как правило, при этом наблюдается пониженная чувствительность, а не гиперчувствительность или боль. Специфические соматосенсорные нарушения обозначают как аллодиния (безвредная соматосенсорная стимуляция вызывает аномально интенсивное чувство боли взрывного, распространяющегося характера, часто сохраняющуюся после прекращения действия стимула, типа спускового механизма), гипералгезия (безвредная стимуляция вызывает более интенсивное и пролонгированное чувство боли), парестезия (спонтанно возникающие, но не болевые ощущения, обозначаемые как пощипывание или покалывание иголками), дизестезия (индуцированная, а также спонтанная аномальная чувствительность). В развитии общих патофизиологических случаев аномальной боли, прежде всего, начинающейся после поражения периферического нерва, рассматривается несколько имеющих решающее значение процессов. Так, за имеющим высокую частоту разрядом от эктопической области следует увеличение чувствительности дорзальных роговидных отростков нейрона и распространение восприимчивой области, часто называемое центральной сенсибилизацией. Обычные аналгетики типа опиоидов и нестероидных противовоспалительных средств (НСПВС) лишь в некоторой степени улучшают синдромы хронической аномальной боли. В процессе разработки альтернативных режимов лечения, обеспечивающих достаточно высокий уровень и постоянное облегчение боли, были исследованы кортикостероиды, блокаторы проводимости, глицерин, антидепрессанты,местные аналгетики, ганглиозиды и электростимуляция, при этом установлено, что эффективностью в отношении облегчения состояний различных типов невропатических болей обладают, прежде всего, антиконвульсанты, но они, по-видимому, наиболее эффективны в случае пароксизмальной, режущей боли,например, невралгии тройничного нерва. Если общую сверхактивность и не имеющий решающего значения низкий порог активации сенсорных нейронов, представляющих собой один из основных синдромов восприятия невропатии и невропатической боли с выраженной механической аллодинией, рассматривать в качестве наиболее важного клинического симптома, приводящего к потере трудоспособности, то избирательное ингибированиеэтого патофизиологического процесса вместо полного ингибирования имеющих высокий порог безвредных стимулов (например, с помощью местных анестетиков) нормальной сенсорной ноцицепции, должно давать очевидные преимущества. Перечисленные выше условия, как известно, плохо поддаются лечению с помощью современных поступающих в продажу аналгетиков, таких, как опиоиды или нестероидные противовоспалительные средства (НСПВС), вследствие их недостаточной эффективности или ограничивающих возможность их применения побочных действий. Таким образом, объектом изобретения является новое применение соединений вышеуказанной формулы I и их производных для приготовления фармацевтических композиций, предназначенных для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания, но часто связанной с невропатической болью, или других различных типов хро-2 007600 нической или фантомной боли. В частности, объектом изобретения является новое применение харкосерида для приготовления фармацевтических композиций, предназначенных для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания, но часто связанной с невропатической болью, или других различных типов хронической или фантомной боли. Харкосерид, имеющий химическое название (R)-2-ацетамидо-N-бензил-3-метоксипропионамид,представляет собой одно из производных, выбранных из группы специфических производных аминокислот. Эта группа соединений описана в патентах US 5378729, 5654301 и 5773475. Они обладают активностью при лечении эпилепсии и удара. Однако в вышеперечисленных ссылках отсутствуют данные,которые делали бы очевидным настоящее изобретение. Соединения по настоящему изобретению могут образовывать фармацевтически приемлемые соли как с органическими, так и с неорганическими кислотами или основаниями. Например, кислотно-аддитивные соли основных соединений получают либо путем растворения свободного основания в водном или водно-спиртовом растворе, либо в других приемлемых растворителях, содержащих соответствующую кислоту, и выделения соли из раствора путем его упаривания. Примерами фармацевтически приемлемых солей являются гидрохлориды, гидробромиды, гидросульфаты и т.д., а также соли натрия, калия и магния и т.д. Соединения по настоящему изобретению могут содержать один или несколько асимметричных атомов углерода. Под объем изобретения подпадают индивидуальные диастереомеры или энантиомеры и их смеси. Индивидуальные диастереомеры или энантиомеры можно получать или выделять методами,хорошо известными в данной области. Предпочтительно соединения по изобретению находятся в (R)-конфигурации. Наиболее предпочтительным соединением является (R)-2-ацетамидо-N-бензил-3-метоксипропионамид. Соединения по изобретению можно синтезировать методами, описанными в патентах US 5378729,5654301 и 5773475. Полученные с помощью методов синтеза соединения можно использовать в фармацевтических композициях в качестве агентов для лечения боли, когда применяют эффективное количество соединения формулы I в сочетании с фармацевтически приемлемым носителем. Фармацевтические средства можно применять для лечения указанных выше нарушений у страдающих ими млекопитающих, включая человека, путем введения млекопитающим эффективного количества описанных выше соединений в виде стандартной дозы лекарственного средства. На основе фармацевтического соединения, полученного согласно изобретению, можно приготавливать и вводить пероральным или парентеральным путем широкое разнообразие форм лекарственных средств. Например, эти фармацевтические композиции можно приготавливать в инертных, фармацевтически приемлемых либо твердых, либо жидких носителях. Препараты в виде твердых форм включают порошки, таблетки, диспергируемые гранулы, капсулы, крахмальные капсулы и суппозитории. Другие твердые и жидкие препараты можно приготавливать с помощью известных в данной области методов и вводить пероральным путем в виде соответствующей композиции или парентеральным путем, например,с помощью внутривенной, внутримышечной или подкожной инъекции, в виде жидкой композиции. Количество действующего вещества в стандартной дозе лекарственного средства можно варьировать или регулировать от примерно 1 до примерно 2 х 300 мг в день на пациента. Предпочтительной является суточная доза, составляющая от примерно 1 до примерно 300 мг. Однако дозы можно изменять в зависимости от потребностипациента, серьезности состояния, подлежащего лечению, и применяемого соединения. Определение соответствующей дозы для конкретной ситуации известно в данной области. В приведенных ниже экспериментальных примерах с использованием определенных полученных на животных моделях продемонстрирована в целом активность харкосерида и его производных в отношении связанной с невропатией боли и, в частности, эффективность харкосерида и его производных в отношении аллодинии. 1. Пример 1. Тест с использованием формалина, крысы Высокую и зависящую от дозы эффективность харкосерида можно продемонстрировать на последней фазе формалинового теста с использованием крыс. Формалиновый тест представляет собой модель индуцированной химическим стимулом тонической боли, при котором оценивают двухфазные изменения ноцицептивного поведения, и спинальную/супраспинальную пластичность ноцицепции рассматривают в качестве молекулярной основы невропатической боли, в частности во время второй (латентной) фазы опыта, когда большинство применяемых в клинических условиях лекарственных средств против невропатической боли обладают эффективностью. Эти особенности позволили использовать формалиновый тест в качестве пригодной модели персистентной клинической боли. Антиноцицептивные свойства соединения анализировали с помощью метода оценки поведения с использованием взвешенных баллов: у свободно движущихся животных оценивали положение левой задней-3 007600 лапы с помощью шкалы баллов от 0 до 3 до и через 10, 20, 30 и 40 мин после инъекции 0,05 мл стерильного 2,5% формалина под кожу на дорзальной поверхности лапы. Харкосерид, введенный внутрибрюшинно (i.p.) непосредственно перед инъекции формалина, вызывал зависящее от дозы снижение вызванного формалином тонического связанного с воспалением ноцицептивного поведения, что продемонстрировано в табл. 1 (взвешенные баллы болиСКО, n=11-12 животных/группу). Таблица 1: Взвешенный балл боли, формалиновый тест, крысы достоверное различие относительно варианта с использованием носителя (метод ANOVA, скорректированный для множественных сравнений, р 0,05). Термин ANOVA обозначает метод дисперсионного анализа. Эти результаты поддерживают и подтверждают гипотезу об активности соединения в отношении невропатической боли. Приведенные в настоящем описании данные подтверждают и создают необходимую научную основу для объяснения наблюдаемой активности, ранее обнаруженной с помощью теста по оценке корчей животных и формалиновому тесту, проведенному с использованием мышей. Последние данные были ограничены тем, что тест по оценке корчей рассматривается как очень неспецифический тест с некоторыми индуцируемыми химическими агентами тоническими ноцицептивными действиями, который обычно дает позитивные результаты при использовании всех психоактивных лекарственных средств из класса мышечных релаксантов и т.д., поэтому он не является достаточно специфическим для подтверждения специфической активности. Кроме того, результаты, ранее полученные с помощью формалинового теста с использованием мышей, не давали четкого доказательства зависимости от дозы и, как следствие, специфичности обнаруженных воздействий харкосерида. Кроме того, было обнаружено, что только при наиболее высокой из изученных доз была получена заметная эффективность, хотя уже в первом исследовании было обнаружено, что эта доза обладает выраженными побочными воздействиями на поведение. Таким образом, эти лекарственные средства вызывают изменение в поведении, такие связанные с воздействием лекарственного средства изменения не могут в дальнейшем рассматриваться как доказательства антиноцицептивного действия. Таким образом, только приведенные в настоящем описании новые данные могут рассматриваться как доказательство in vivo антиноцицептивного действия харкосерида, при этом, зависимость от дозы служит критерием специфичности и улучшенного антиноцицептивного поведения, которое не зависит от токсических эффектов. 2. Пример 2. Повреждение, вызванное постоянным сжатием (CCI, модель Беннета) Эффективность харкосерида в отношении снижения спонтанной хронической боли, механической аллодинии и тепловой гипералгезии оценивали с использованием в качестве модели периферической невропатии, которую создавали путем повреждения, вызванного постоянным сжатием (CCI), что представляет собой одну из лучших по своим характеристикам моделей с использованием животных для изучения in vivo хронической боли, вызванной повреждением периферического нерва. При создании этой модели вокруг седалищного нерва накладывают лигатуры, что вызывает набухание аксона и частичную деафферентацию (прерывание афферентной иннервации), проявляющуюся в виде значительной, но не полной потери аксонов в дистальной части периферического нерва. Одним из выраженных поведенческих симптомов после наложения лигатуры на седалищный нерв, является защита животным его задней лапы, что свидетельствует о возникновении спонтанной хронической боли. Эта гипотеза подтверждается данными о повышенной невральной активности спинного мозга и повышенном уровне спонтанных невральных разрядов в нейронах спиноталамического пути и в вентробазальном таламусе в отсутствии явной периферической стимуляции. Помимо проявления поведенческих реакций, характерных для спонтанной боли, при применении CCI возникают некоторые аномалии в проявлении вызванной стимулом боли, включая тепловую гипералгезию и механическую аллодинию. Известно, что развитие этих аномальных вызванных стимулом болей происходит в областях, расположенных вне зоны действия поврежденного нерва, в областях, которые иннервируются неповрежденными нервами. Для исследования различных компонентов невропатической боли осуществляли поведенческие опыты по оценке тепловой гипералгезии и механической аллодинии. Перед каждым опытом получали исходные значения для каждого параметра; кроме того, всех животных тестировали в отношении развития поведенческих симптомов, характерных для хронической боли, через 13-25 дня после хирургическо-4 007600 го вмешательства, осуществляемого для создания CCI, за 1 день до дня введения носителя (0,04 мл стерильной воды/10 г веса тела) или введения лекарственного средства и после введения носителя/лекарственного средства. Опыты по оценке связанного с болью поведения проводили в следующей последовательности: (1) спонтанное связанное с болью поведение, (2) механическая аллодиния, (3) тепловая гипералгезия, для того, чтобы минимизировать влияние одного опыта на результаты следующего. Для каждого из параметров хронической боли процедуры тестирования и результаты представлены отдельно. За 15 мин до первого поведенческого опыта вводили i.p. либо 0 (носитель, 0,04 мл/10 г веса тела),либо 5, 10, 20 или 40 мг/кг SPM 927 (n=7-23 животных/группу). Спонтанную боль (возникновение боли без воздействия определенного внешнего стимула) в лапе с наложенной лигатурой оценивали в течение 5 мин после 10-минутного периода адаптации, используя систему баллов (взвешенные поведенческие баллы по шкале 0-5). Харкосерид не изменял уровень спонтанной боли, вызванной односторонним повреждением, связанным с постоянным сжатием, что видно из табл. 2 (взвешенный баллСКО). Таблица 2. Спонтанная ноцицепция, CCI-модель, крысы Тепловую гипералгезию оценивали по промежутку времени до отдергивания лапы (латентному периоду) в ответ на воздействие лучистого облучения, направленного на поверхность подошвы задней лапы крысы с наложенной лигатурой. По сравнению с исходным латентным периодом (с), после осуществления операции по наложению лигатуры обнаружено заметное снижение промежутка времени до отдергивания лапы в ответ на тепловой стимул, что может свидетельствовать о присутствии тепловой гипералгезии, которая обусловлена повреждением, вызванным постоянным сжатием. Харкосерид в зависимости от дозы снижал связанную с повреждением, вызванным постоянным сжатием, тепловую гипералгезию, что видно из данных, представленных в табл. 2 (латентные периоды(с)СКО). Выраженные воздействия обнаружены только при использовании наиболее высоких из изученных доз (20 и 40 мг/кг i.p.), причем максимальное действие проявлялось уже при использовании дозы 20 мг/кг i.p. Таблица 3. Тепловая гипералгезия. CCI-модель, крысы достоверное различие относительно варианта с использованием носителя (дисперсионный анализ, скорректированный для множественных сравнений, р 0,05). Чувствительность к механическому стимулу и аллодинию задней лапы крысы с наложенной лигатурой оценивали количественно по резкому отдергиванию лапы в ответ на обычно не вызывающие реакции механические стимулы, как описано выше. Реакцию на механические стимулы оценивали с помощью калиброванного электронного алгометра Von Frey, предназначенного для измерения вызывающего боль давления, который соединен с работающей в режиме on line автоматизированной системой сбора данных. Значительное снижение давления (г/мм 2), необходимого для быстрого отдергивания лапы в ответ на механический стимул после операции по наложению лигатуры рассматривается как наличие механической аллодинии. Харкосерид в зависимости от дозы снижал интенсивность механической аллодинии, связанной с наложением одностронней лигатуры на нерв, что видно из табл. 4 (давление (г/мм 2)СКО). Регрессионнный анализ показал наличие положительной линейной корреляции между дозой харкосерида и увеличением усилия, необходимого для того, чтобы вызвать отдергивание лапы. достоверное различие относительно варианта с использованием носителя (дисперсионный анализ,скорректированный для множества сравнений, р 0,05). Эти результаты поддерживают и подтверждают гипотезу об эффективности харкосерида в отношении аллодинии. Кроме того, это воздействие дополнительно свидетельствует о связи с невропатической болью и вследствие этого подтверждает потенциальную возможность клинического применения соединения для моделирования клинических симптомов, связанных с лечением. Дополнительное доказательство специфичности активности харкосерида в отношении аллодинии было получено с помощью отрицательных результатов теста, основанного на оценке движения хвоста,что исключает способность соединения вызывать аналгезию опиоидного типа. Предыдущие данные, полученные с использованием мышей, были повторены и подтверждены при использовании другого вида,крысы, при этом дополнительно осуществляли более точный подбор доз для опыта. Пример 3. Тест, основанный на оценке движения хвоста крысы Потенциальную активность харкосерида в отношении спинальной тепловой ноцицепции дополнительно оценивали с помощью теста, основанного на движении хвоста. При использовании этой модели хвост животного на расстоянии примерно 2 см от кончика подвергали тепловому облучению, создавая модель острой тепловой спинальной/рефлекторной гипералгезии, время, необходимое для отдергивания хвоста (латентный период), оценивали автоматически с помощью алгометра, определяя максимальное время воздействия стимула, при котором не происходит повреждение ткани. Этот тест широко применяется для анализа антиноцицептивного действия фармакологических агентов и позволяет с высокой точностью предсказать острое аналитическое действие в отношении человека. Как правило, наиболее высокой эффективностью обладают истинные аналгетики опиоидного типа; ни адъюванты типа амитриптилина, ни противоэпилептические средства, ни НСПВС (нестероидные противовоспалительные средства) не проявляют активности при использовании этого теста. Результаты, полученные при применении 20 и 40 мг/кг харкосерид при внутрибрюшинном введении(i.p), представлены в табл. 5 [процент антиноцицептивного действия, рассчитанный как [(латентный период после обработки лекарством) - (латентный период до обработки лекарством)/(макс. латентный период) - (латентный период до обработки лекарством)х 100]СКО, n=12 животных/группу]. Исходный латентный период или латентный период до движения хвоста до обработки лекарством определяли с помощью осреднения 5 последовательных измерений, сделанных с интервалом 2 мин. Затем вводили носитель (стерильную воду 0,04 мл/10 г веса тела) или харкосерид и с 10-минутными интервалами в течение 60 следующих мин оценивали латентные периоды до движения хвоста. Даже в дозах, дающих максимальный эффект при использовании формалинового теста на крысах (см. выше) харкосерид оказывал незначительное действие или совсем не оказывал никакого воздействия на латентный период до рефлекторного движения хвоста. Таблица 5. Острая тепловая гипералгезия, движение хвоста, крысы Таким образом, в тесте по оценке движения хвоста не обнаружено никакого антиноцицептивного действия харкосерида, это поддерживает гипотезу о профиле харкосерида, который характеризуется специфичными свойствами в отношении аллодинии и не проявляет активности в условиях острой боли. Пример 4. Антиноцицептивная активность харкосерида в сравнении с габапентином В приведенном ниже эксперименте использовали харкосерид, обозначенный аббревиатурой SPM 927, и габапентин, обозначенный аббревиатурой GBP.-6 007600 Задача: Основной целью этого эксперимента была оценка антиноцицептивной активности SPM 927 и габапентина (GBP) с помощью смоделированной на крысах воспалительной боли, и сравнение воздействий invivo каждого из изученных лекарственных средств. Методы: Вызванную каррагенином механическую гипералгезию у крыс индуцировали путем инъекции в подошву 0,1 мл 2% суспензии каррагинана и через 3 ч осуществляли оценку, оказывая давление на лапу(тест Рандалл-Селито (Randall-Sellito. Субхроническую воспалительную ноцицепцию у мышей индуцировали путем инъекции в подошву формалина (0,02 мл 5%-ного раствора). Выявляли ноцицептивное поведение (лизание лапы) и количественно оценивали в интервале между 0 и 5 мин (острая боль) и между 20 и 30 мин (субхроническая воспалительная боль) после введения формалина. Лекарственные средства и схема эксперимента: SPM 927 и GBP суспендировали в 1% метилцеллюлозе и вводили i.p. в дозах 10, 20 и 40 мг/кг. Осуществляли предварительную обработку за 30 мин до оценки боли. Одна группа животных служила в качестве контроля, и этим животным вводили путем инъекции только растворитель (10 мл/кг), а другой группе животных вводили соединение, служащее эталоном (каррагениновый тест: 10 мг/кг индометацина; формалиновый тест: 10 мг/кг морфилина). Каждое соединение тестировали в отдельном эксперименте и каждый эксперимент включал контрольную группу и обработанную эталоном группу. В каррагениновом тесте использовали 10 крыс/группу, а в формалиновом тесте - 6 мышей/группу. Результаты: Вызванная каррагинаном механическая гипералгезия у крыс: Результаты обобщены в табл. 6. Таблица 6 Носитель,Носитель,SPMSPM Индометацин невоспаленная воспаленная 927 927 927 обозначает существенное различие при сравнении с невоспаленной лапой (р 0,05; t-критерий Стьюдента),б обозначает существенное различие при сравнении с группой, обработанной носителем (р 0,05; критерий Дуннетта). Во всех трех экспериментах развилась выраженная механическая гипералгезия, что видно по существенным различиям в пороговых значениях ноцицепции в воспаленной лапе по сравнению с невоспаленной лапой. Все изученные дозы SPM 927 привели к полной реверсии вызванной каррагинаном механической гипералгезии. Антиноцицептивное действие SPM 927 сопоставимо с активностью эталона индометацина. В изученных дозах GBP не оказывал заметного воздействия на вызванную каррагинаном механическую гипералгезию. Субхроническая воспалительная ноцицепция у мышей (формалиновый тест): Результаты обобщены в приведенной ниже табл. 7.-7 007600 Обработка формалином привела к выраженному ноцицептивному ответу. SPM-927 подавлял ноцицептивный ответ в зависимости от дозы. Эффективность SPM 927 была близка к эффективности морфина, т.е. это соединение приводило к практически полной реверсии вызванной формалином ноцицепции.GBP ингибировал, но не в значительной степени, вызванный формалином ноцицептивный ответ. Пример 5. Ниже в табл. 8 и 9 представлены данные о воздействии харкосерида (далее обозначен как SPM 927),карбамазепина, леветиарацетама, габапентина и морфина на невропатическую боль в CHUNG-тесте на крысах. В каждой группе использовали по 8 крыс. Таблица 7 Фаза обозначает существенное различие при сравнении с группой, обработанной носителем (р 0,05; критерий Дуннетта). В табл. 8 приведены данные по оценке воздействий при тактильной стимуляции поврежденной лапы. В табл. 9 приведены данные о тепловой стимуляции поврежденной лапы. В целом, все соединения проявили более выраженное действие при тактильной ноцицептивной стимуляции по сравнению с тепловой ноцицептивной стимуляцией, и активность SPM 927 была как минимум сопоставимой, но, как правило, более высокой, чем активность эталонных соединений. Таблица 8. Воздействие SPM 927, карбамазепина, леветирацетама, габапентина и морфина в CHUNG-тесте по оценке невропатической боли на крысах (8 крыс на группу) Тактильная стимуляция(а) сравнение с необработанным контролем,(б) сравнение с контрольной группой (поврежденные лапы). Таблица 9. Воздействие SPM 927, карбамазепина, леветиарацетама, габапентина и морфина в CHUNG-тесте по оценке невропатической боли на крысах (8 крыс на группу) Тепловая стимуляция-9 007600 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (I) где Аr обозначает фенил, который может быть незамещен или замещен по меньшей мере одной галогруппой;Q1 обозначает метил,или его фармацевтически приемлемой соли для приготовления фармацевтической композиции,предназначенной для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания, или хронической или фантомной боли, или ощущения шума в ушах. 2. Применение по п.1, где соединение или его фармацевтически приемлемая соль находятся в Rконфигурации. 3. Применение по любому из пп.1-2, где соединение представляет собой практически чистый энантиомер. 4. Применение по любому из пп.1-3, где Аr обозначает незамещенный фенил. 5. Применение по любому из пп.1-4, где галоген обозначает фтор. 6. Применение по любому из пп.1-5, где Q обозначает (низш.)алкоксигруппу, содержащую 1-3 атома углерода, и Аr обозначает незамещенный фенил. 7. Применение по п.1, где соединение формулы (I) представляет собой (R)-2-ацетамидо-N-бензил-3 метоксипропионамид или его фармацевтически приемлемую соль. 8. Применение по п.7, где соединение представляет собой практически чистый энантиомер. 9. Применение соединения по любому из пп.1-8 для приготовления лекарственного средства, предназначенного для лечения ощущения шума в ушах. 10. Применение фармацевтической композиции, содержащей эффективное количество соединения по любому из пп.1-8 и фармацевтически приемлемый носитель для лечения аллодинии как основного и уникального симптома боли, вне зависимости от природы лежащего в ее основе заболевания, или хронической или фантомной боли, или ощущения шума в ушах.
МПК / Метки
МПК: A61P 23/00, A61K 31/165
Метки: типов, соединения, фантомной, боли, применение, хронической, пептидов, других, класса, аллодинии, лечения
Код ссылки
<a href="https://eas.patents.su/11-7600-primenenie-soedineniya-iz-klassa-peptidov-dlya-lecheniya-allodinii-i-drugih-tipov-hronicheskojj-ili-fantomnojj-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Применение соединения из класса пептидов для лечения аллодинии и других типов хронической или фантомной боли</a>
Предыдущий патент: Фармацевтические композиции, содержащие один или несколько стероидов, один или несколько тетрагидрофолатных компонентов и витамин в12
Следующий патент: Содержащая обладающий андрогенным действием 11β- галогенстероид и гестаген композиция и мужской контрацептив на основе этой композиции