Способы потенциации внутривенного эстрамустинфосфата
Номер патента: 4647
Опубликовано: 24.06.2004
Авторы: Копрески Майкл С., Фредхольм Бо, Гуннарссон Пер-Олв, Асп Берил
Формула / Реферат
1. Способ введения эстрамустинфосфата в виде внутривенной дозы, причем эта доза отдельной инфузии превышает 950 мг/м2.
2. Способ по п.1, в котором эстрамустинфосфат вводят в виде отдельной инфузии по схеме 1 раз в неделю.
3. Способ по п.1, в котором эстрамустинфосфат вводят в виде отдельной инфузии по схеме 1 раз каждые 2 недели.
4. Способ по п.1, в котором эстрамустинфосфат вводят в виде отдельной инфузии по схеме 1 раз каждые 3 недели.
5. Способ по п.1, в котором эстрамустинфосфат вводят в виде отдельной инфузии по схеме 1 раз каждые 4 недели.
6. Способ по п.1, в котором инфузию проводят на протяжении от 30 мин до 3 ч.
7. Способ по п.1, в котором достигается ослабление индуцированной раком непроходимости мочевых путей.
8. Способ по п.1, в котором достигается быстрое ослабление вызываемой раком боли.
9. Способ по п.1, в котором эстрамустинфосфат вводят в сочетании с другими противораковыми терапиями.
10. Способ по п.6, в котором эстрамустинфосфат вводят внутривенно в сочетании с другими химиотерапевтическими агентами.
11. Способ потенциации терапевтической пользы химиотерапевтической программы со многими лекарственными средствами, в котором одно из лекарственных средств в этой программе содержит эстрамустин, путем введения эстрамустинфосфата в виде внутривенной композиции.
12. Способ по п.11, в котором вышеупомянутая внутривенная композиция содержит эстрамустинфосфат, предоставляемый в высокой дозе.
13. Способ по п.11, в котором другое лекарственное средство в этой программе содержит антимитотический агент или антимикротрубочковый агент.
14. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой иринотекан СРТ-11.
15. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой доксорубицин.
16. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой этопозид.
17. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой навелбин.
18. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой винбластин.
19. Способ по п.12, в котором доза отдельной инфузии эстрамустинфосфата превышает 950 мг/м2.
20. Способ по п.13, в котором антимикротрубочковый агент является таксаном.
21. Способ по п.13, в котором антимикротрубочковый агент является инкапсулированным в липосомах таксаном.
22. Способ получения повышенных уровней эстрамустина, метаболита эстромустина в плазме, для промотирования синергического взаимодействия между эстромустином и вторым химиотерапевтическим агентом и потенциации терапевтической пользы, в котором эстрамустин вводят в виде внутривенной композиции и эстрамустин вводят в день или в пределах 3 дней введения вышеупомянутого второго химиотерапевтического агента.
23. Способ по п.22, в котором вышеупомянутый второй терапевтический агент содержит антимитотический агент или антитрубочковый агент.
24. Способ по п.22, в котором внутривенная композиция содержит эстрамустинфосфат.
25. Способ по п.23, в котором вышеупомянутый антимикротрубочковый агент представляет собой таксан.
26. Способ по п.24, в котором доза отдельной инфузии эстрамустинфосфата превышает 950 мг/м2.
27. Способ получения пролонгированных повышенных уровней эстрамустина в плазме для промотирования синергического взаимодействия между эстрамустином и вторым химиотерапевтическим агентом и для потенциации терапевтической пользы, в котором эстрамустин вводят в виде внутривенной композиции и эстрамустин вводят в день или в пределах 3 дней введения вышеупомянутого второго химиотерапевтического агента.
28. Способ по п.27, в котором вышеупомянутый второй химиотерапевтический агент содержит антимитотический агент или антимикротрубочковый агент.
29. Способ по п.27, в котором внутривенная композиция содержит эстрамустинфосфат.
30. Способ по п.28, в котором вышеупомянутый антимикротрубочковый агент представляет собой таксан.
31. Способ по п.29, в котором доза отдельной инфузии эстрамустинфосфата превышает 950 мг/м2.
32. Способ поддержания уровней эстрамустина и эстромустина в плазме и терапевтической пользы, в котором эстрамустинфосфат вводят внутривенно в виде отдельной инфузии в дозе, превышающей 950 мг/м2; с необязательным повторением этой инфузии последовательным образом.
33. Способ увеличения насыщения связывания эстрамустина с эстрамустинсвязывающим белком или подобным ему белком, в котором эстрамустин вводят в форме внутривенной композиции в виде эстрамустинфосфата в отдельной дозе, превышающей 950 мг/м2.
34. Способ пролонгирования продолжительности связывания эстрамустина или его метаболитов с эстрамустинсвязывающим белком или подобным ему белком, в котором эстрамустин вводят в форме внутривенной композиции в виде эстрамустинфосфата в отдельной дозе, превышающей 950 мг/м2.
35. Способ лечения рака предстательной железы, имеющего эстрамустинсвязывающий белок или белок, подобный эстрамустинсвязывающему белку, включающий введение внутривенной композиции в виде эстрамустинфосфата в отдельной дозе, превышающей 950 мг/м2.
36. Способ по п.27, в котором эстрамустинфосфат вводят в сочетании с одним или несколькими химиотерапевтическими агентами.
37. Способ по п.31, в котором инкапсулированный в липосомах таксан является инкапсулированным в липосомах паклитакселом.
38. Способ потенциации терапевтической пользы химиотерапевтической программы со многими лекарственными средствами, в котором одно из лекарственных средств в этой программе содержит таксан, и в котором другое лекарственное средство в этой программе содержит эстрамустинфосфат, и в котором эстрамустинфосфат вводят внутривенно в дозе, превышающей 950 мг/м2.
39. Способ введения эстрамустинфосфата, в котором эстрамустинфосфат сначала инкапсулируют в липосомах и затем вводят внутривенно.
40. Композиция эстрамустинфосфата, в которой эстрамустин инкапсулирован в липосомах.
41. Способ лечения рака предстательной железы, в котором вводят инкапсулированный в липосомах эстрамустинфосфат.
42. Химиотерапевтический агент, состоящий из эстрамустинфосфата, инкапсулированного в липосоме.
43. Композиция по п.41, предназначенная для внутривенного введения.
44. Продукт, содержащий эстрамустинфосфат, пригодный для внутривенного введения, и один или несколько химиотерапевтических агентов, в качестве объединенного препарата для одновременного, отдельного или последовательного использования в противораковой терапии.
45. Продукт по п.44, в котором вышеупомянутые один или несколько химиотерапевтических агентов выбраны из группы, состоящей из иринотекана СРТ-11, доксорубицина, этопозида, навелбина и производного таксана.
46. Продукт по п.44, в котором вышеупомянутый эстрамустинфосфат, пригодный для внутривенного введения, используют в виде инфузии отдельной дозы, превышающей 950 мг/м2.
47. Продукт по любому из пп.44-46 для лечения рака предстательной железы.
48. Способ для лечения рака предстательной железы, предусматривающий введение продукта по любому из пп.44-47.
49. Композиция для внутривенного введения, содержащая эстрамустинфосфат в смеси с альбумином.
50. Композиция по п.49, где доза отдельной инфузии активного ингредиента превышает 950 мг/м2.
51. Композиция по п.49 или 50, где альбумин является человеческим альбумином.
52. Продукт, содержащий (i) композицию по п.49 и (ii) один или несколько химиотерапевтических агентов, в качестве объединенного препарата для одновременного, отдельного или последовательного использования в противораковой терапии.
53. Продукт по п.52, в котором химиотерапевтический агент выбран из группы, состоящей из таксана и его производных, иринотекана СРТ-11, камптотецина и его производных, доксорубицина, эпирубицина, этопозида, навелбиэр, винбластина, карбоплатины или цисплатины.
54. Продукт, содержащий эстрамустинфосфат в лиофилизованной форме и физиологический раствор для парентерального применения, содержащий альбумин.
Текст
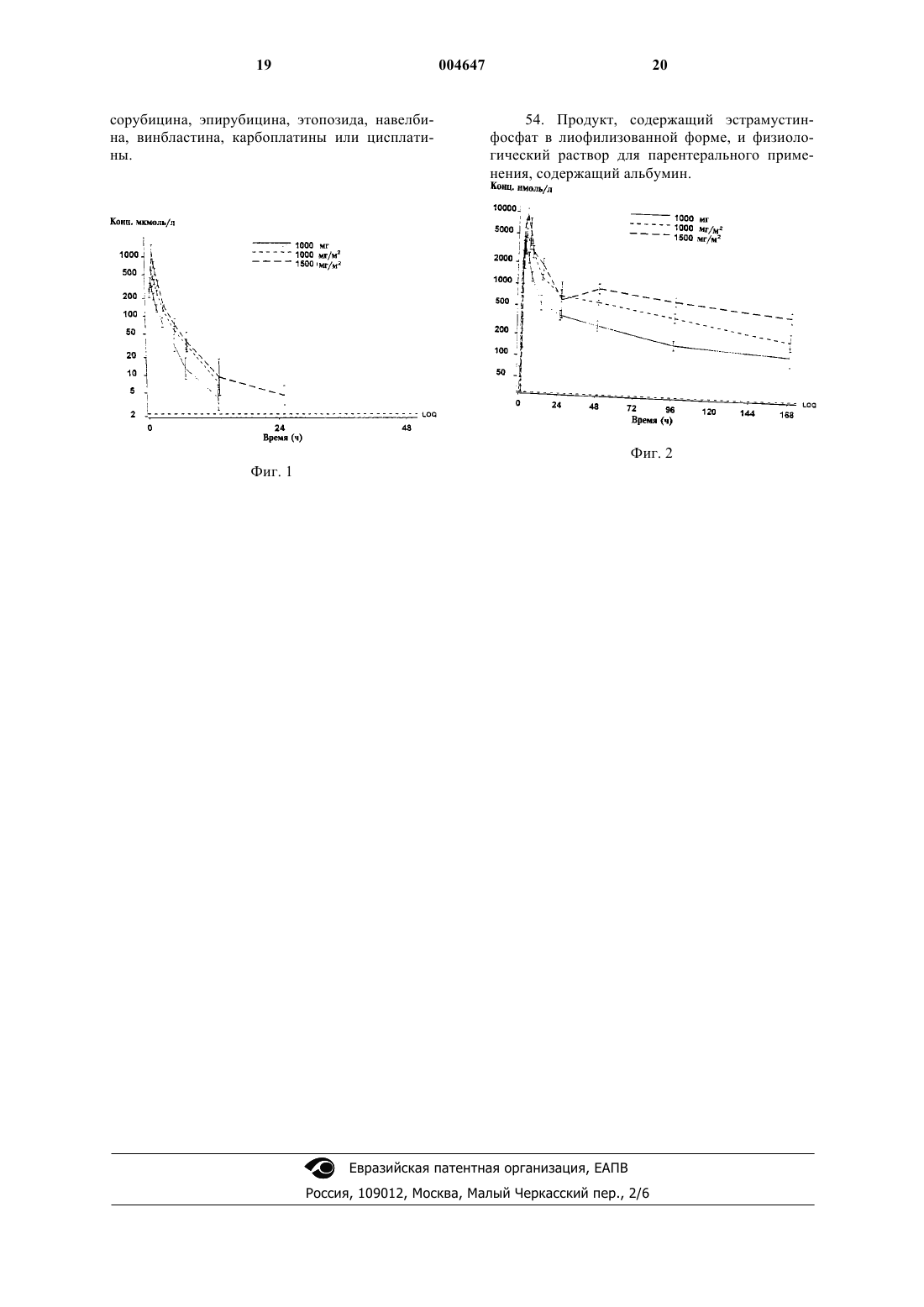
1 Данная заявка заявляет приоритет предварительной заявки США с регистрационным номером 60/079 542, которая была подана 27 марта 1998 года. Предпосылки изобретения Область изобретения Данное изобретение относится к применению эстрамустинфосфата, не содержащего азота иприткарбаматного производного эстрадиол 17b-фосфата, в виде инфузии высокой дозы. Данное изобретение относится также к способам потенциации внутривенно введенного эстрамустинфосфата и к способам лечения рака предстательной железы путем внутривенного введения эстрамустинфосфата. Предпосылки изобретения Было показано, что интактная молекула эстрамустина вызывает цитотоксические эффекты (Hartley-Asp, 1982). Исследования в культуре ткани показали, что эстрамустин (ЭМ) является антимитотическим агентом, вызывающим зависимое от дозы блокирование деления опухолевых клеток в метафазе (Hartley-Asp,1984). Известно, что остановка метафазы вызывается взаимодействием лекарственных средств с микротрубочковой структурой, которая образует митотическое веретено. При помощи иммуногистохимии было показано, что зависимые от дозы нарушения микротрубочек интерфазы имеют место в культивируемых простатических клетках человека (Mareel, 1988, Dahllof, 1993). Лечение с помощью ЭМ in vitro ингибировало сборку микротрубочек, состоящих только из тубулина, что демонстрировало прямое взаимодействие с тубулином (Dahllof, 1993). Кроме того, было продемонстрировано взаимодействие со связанными с микротрубочками белками(MAP) (Stearns, 1988). MAP являются высокомолекулярными белками, которые, как считается, являются важными в стабилизации микротрубочек. То, что ЭМ проявляет механизм действия антимитотического агента, было подтверждено in vivo (Eklov, 1992). Таким образом, эстрамустинфосфат представляет собой антимитотический агент, используемый в настоящее время в лечении прогрессированной аденокарциномы предстательной железы. В качестве единственного агента,он имеет активность в случае гормонрезистентного рака предстательной железы, которая сравнима с активностью нескольких других цитотоксических агентов, которые были исследованы в ряде проведенных во многих учреждениях рандомизированных исследований в соответствии с Национальным Проектом по Раку Предстательной железы (Murphy, 1983). Хотя это лекарственное средство вводят обычно перорально в дозе 10-15 мг/кг/день, оно одобрено для внутривенного введения в нескольких странах. Однако эстрамустинфосфат, при его введении внутривенно, использовали в дозах и согласно схеме введения, параллельных перораль 004647 2 ному введению для этого лекарственного средства, т.е. при рекомендуемых дозах 300-600 мг в день, вводимых внутривенно и обычно с повторением на протяжении нескольких дней подряд. После этой схемы введения лекарственное средство вводили перорально. В опубликованном материале могут быть найдены детали, полученные на 500 пациентах,которым сначала вводили внутривенную композицию, после чего следовало пероральное лечение. Схемы введения с применением 300-600 мг внутривенно каждый день в течение 7-21 дней с последующими ежедневными пероральными дозами были типичными в этих исследованиях. Лекарственное средство вводили в виде медленной внутривенной инъекции или в виде болюса при 300 мг/день, и тромбофлебит и местное раздражение в местах внутривенной инъекции рассматривали как главные недостатки введения лекарственного средства, требующие установления центральной линии введения для многих пациентах или прерывания лечения. В случае 450 мг/день, Nagel and Kolln (1977) утверждали, что это приводило к таким тяжелым"желудочно-кишечным проблемам, что 300 мг/день считали максимальной внутривенной суточной дозой". В компиляции данных, собранных Anderson et al., из 245 пациентов, получающих 300-600 мг/день в течение 21 дня с последующей той же самой дозой один или два раза в неделю в течение 2 месяцев, у 20% пациентов был выявлен тромбофлебит, 17% обнаружили желудочно-кишечные проблемы и у 9% расстройства печени. Токсичности, возникающие при таких схемах повторяющегося введения лекарственного средства, часто требуют прекращения введения лекарственного средства(Lundgren, 1995). Maier (1990) вводил ежедневно внутривенные дозы 900 мг/день в течение 710 дней с последующей пероральной терапией,без сообщения о флебите, но тяжелые проблемы печени действительно имели место у 11 из 18 пациентов (61%) с одним смертельным исходом, вызванным токсической недостаточностью печени. Таким образом, состояние в этой области было таково, что обычно использовали внутривенные композиции эстрамустинфосфата в качестве способа единственного агента для инициации долгосрочной пероральной терапии эстрамустином. Кроме того, внутривенное введение эстрамустинфосфата при более высоких дозах обычно считается запрещенным вследствие токсичности. В данной области неизвестно и не является очевидным, что возможно однодозовое, высокодозовое внутривенное введение эстрамустинфосфата. При пероральном введении до 1200 мг/м 2 (Keren-Rosenberg, 1997) различия в метаболизме лекарственного средства и биодоступности не позволяют производить экстраполяцию относительно внутривенной композиции с высокой дозой, так как было обнаруже 3 но, что относительная биодоступность эстромустина после перорального введения была равна только 44% (Gunnarsson, 1984) и фосфатная составляющая молекулы дефосфорилировалась в пероральной композиции в противоположность внутривенной композиции. Кроме того, в данной области неизвестно, что внутривенный эстрамустинфосфат может использоваться в комплексных химиотерапевтических программах,включающих в себя использование высокой дозы внутривенного эстрамустинфосфата. Кроме того, в данной области неизвестно, что внутривенный эстрамустинфосфат имеет клиническое применение для лечения рака предстательной железы. В более ранней работе доктор BerylHartley-Asp, соавтор этого изобретения, был первым, кто обнаружил синергический потенциал эстрамустинфосфата с другими цитотоксическими агентами (Mareel, 1988). В нескольких экспериментах было продемонстрировано,что пролонгированное экспонирование эстрамустину было необходимо для достижения потенциации. Следовательно, предполагалось, что ежедневное введение лекарственного средства обязательно приводит к использованию перорального препарата, так как более ранние данные, полученные с внутривенным (IV) препаратом, предполагали, что получение константных высоких уровней не может быть достигнуто с использованием IV-введения. Аддитивные и, возможно, синергические антимикротрубочковые эффекты в клетках invitro были показаны для эстрамустина и многих других цитотоксических агентов (Mareel, 1988,Speicher, 1992, Pienta, 1993, Batra, 1996). Таким образом, сочетание эстрамустинфосфата с другими лекарственными средствами у человека проводили с использованием перорального введения эстрамустинфосфата. Исследования ФазыII (Seidman, 1992, Hudes, 1992, Pienta, 1994, Hudes, 1996) с эстрамустинфосфатом в сочетании с винбластином проводили на гормонрезистентном раке предстательной железы. В этих исследованиях было показано 50-75% уменьшение специфического антигена предстательной железы у 88 пациентов. Наиболее частой токсичностью была тошнота, от небольшой до умеренной. Особо, можно отметить 10,5%(4/37) частоту возникновения значительной сердечно-сосудистой токсичности, в том числе один тромбоз глубоких вен (DVT), один инфаркт миокарда, один случай застойной сердечной недостаточности и одно обратимое неврологическое событие, которые требовали остановки терапии у этих пациентов и которые могли быть приписаны эстрамустинфосфату. В другом исследовании Фазы II, проведенном Pienta et al. (1994), эстрамустинфосфат (вводимый перорально) объединяли с Этопозидом. Оценивали 52 пациентa: в том числе 20 пациентов с заболеваниеми на мягких тканях, у которых 4 наблюдали 3 полные ответные реакции (CR)(15%) и 6 частичных ответных реакций (PR)(30%). Из 32 пациентов с костными метастазами у 8 пациентов наблюдалось улучшение (25%) и 12 пациентов были стабильными (38%). Всего 13 человек (25%) имели 75%-ное уменьшение количества специфического антигена предстательной железы и 28 человек (54%) имели 50%ное уменьшение. Исследование Фазы 1-II с Таксолом (Hudes, 1992) и эстрамустинфосфатом проводили на 17 пациентах с гормонрезистентным раком предстательной железы. 6 пациентов имели умеренное заболевание, и 3 из них получали PR 2+, 6 и 8 месяцев. Специфический антиген предстательной железы (PSA) уменьшался на 50% у 58,8% исследуемых. Средняя продолжительность ответной реакции была 7 месяцев. Гранулоцитопению и воспаление слизистой оболочки 3-4 степени наблюдали у 2 пациентов, степень тошноты 1-2 (70,5%) и степень 3-у одного пациента. Отек наблюдали у 8 пациентов (47%) и временное увеличение ферментов печени степени 1-3-у 6 пациентов(35,2%). В недавнем исследовании Petrylak et al.,(1997) применение увеличивающихся доз доцетаксела с эстрамустинфосфатом, принимаемых перорально, показало общий коэффициент ответной реакции в виде специфического антигена у 62% исследуемых. У пациентов с определяемым по двум параметрам заболеванием, 3 пациента (43%) давали частичную ответную реакцию в лимфатических узлах и 1 пациент давал небольшую ответную реакцию в седалищной массе. Это показывает, что комплексное лечение с перорально вводимым эстрамустинфосфатом является эффективным. Однако комбинации внутривенного эстрамустинфосфата с этими цитотоксическими агентами являются неизвестными в данной области. Различия в метаболизме, в частности, касающиеся фосфатной части молекулы, в пероральных композициях в сравнении с внутривенными композициями эстрамустинфосфата делают комплексные терапии с внутривенной композицией неочевидными. В противоположность другим антимитотическим агентам, действие эстрамустинфосфата является, по-видимому, зависимым от присутствия эстрамустин связывающего белка(ЕМВР) (Eklov, 1996). Оно обнаруживается при нормальных условиях только в предстательной железе (Forsgren, 1979, Flucher, 1989). Однако,подобный белок был также идентифицирован во многих раковых тканях, так же как и в опухолях предстательной железы, таких как раковые ткани легкого, глиомы молочной железы, ободочной кишки, поджелудочной железы (Bjork,1991, Bergh, 1988, Eklov, 1996, Edgren, 1996,Von Schoultz, 1994, Bergenheim, 1993). Этот белок связывает эстра- и эстромустин (ЭаМ и ЭоМ) с очень высокой аффинностью, и считается, что он является ответственным за селектив 5 ное удерживание ЭоМ в опухоли предстательной железы, где было обнаружено соотношение от 1:6 до 1:11 плазма/опухоль у пациентов с раком предстательной железы, подвергнутых лечению эстрамустинфосфатом перорально и внутривенно, соответственно (Norlen, 1988,Walz, 1988). И только недавно, была продемонстрирована корреляция между уровнями ЕМВР и уровнями ЭаМ и ЭоМ в опухолях предстательной железы человека после одной внутривенной дозы эстрамустинфосфата пациентам перед радикальной простатэктомией, что указывает на то, что ЕМВР мог бы быть причиной удерживания лекарственного средства (Walz,1996). Краткое описание чертежей Более полное понимание этого изобретения и его многих сопутствующих преимуществ будет легко получено и изобретение будет легко понятным со ссылкой на нижеследующее подробное описание, при рассмотрении в совокупности с сопровождающими чертежами, где фиг. 1 иллюстрирует концентрацию эстрамустинфосфата после отдельной внутривенной дозы Эстрацита (среднееSEM (стандартная ошибка среднего), N=4+4+3), предоставляемой в виде дозы 1000 мг (диапазон 980-1070 мг),1000 мг/м 2 и 1500 мг/м 2; и фиг. 2 иллюстрирует концентрацию эстромустина после отдельной внутривенной дозы Эстрацита (среднееSEM (стандартная ошибка среднего), N=4+4+3), предоставляемой в виде дозы 1000 мг (диапазон 980-1070 мг), 1000 мг/м 2 и 1500 мг/м 2. Сущность изобретения Данное изобретение описывает способы потенциации терапевтического применения и эффективности внутривенно вводимого эстрамустинфосфата. Оно обеспечивает внутривенное введение эстрамустинфосфата в дозах, превышающих 1300 мг, или в дозах, превышающих 950 мг/м 2 (миллиграммов на квадратный метр площади поверхности тела). Оно, кроме того,обеспечивает введение высоких доз внутривенного эстрамустинфосфата в виде отдельной дозы, которая может дополнительно вводиться по еженедельной или по более продолжительной схеме. Данное изобретение позволяет оптимизировать фармакокинетику для максимизации терапевтического преимущества и, кроме того,позволяет применять внутривенный эстрамустинфосфат в сочетании с другими способами терапии, в том числе с другими способами химиотерапии, давая дополнительно повышенную терапевтическую пользу. Данное изобретение позволяет применять внутривенный эстрамустинфосфат в качестве терапии для раковых опухолей предстательной железы. Таким образом, одним из применений данного изобретения является обеспечение терапии с внутривенным введением высокой дозы эстрамустинфосфата, где эта доза превышает 950 6 мг/м 2. Другим применением является обеспечение схемы внутривенного введения, посредством которого эта схема позволяет оптимизировать фармакокинетику эстрамустинфосфата и его метаболитов при минимальной токсичности и посредством которого дополнительно эта оптимизация делает возможными удобные и эффективные комплексные программы терапии. Таким образом, применение данного изобретения позволяет использовать внутривенно вводимый эстрамустинфосфат в комбинации с другими программами терапии, в том числе с цитотоксической химиотерапией. Другим применением данного изобретения является обеспечение способа, который увеличивает насыщение связывания и пролонгирует продолжительность связывания эстрамустинфосфата или его метаболитов с эстрамустинсвязывающим белком или белком, подобным эстрамустинсвязывающему белку (ЕМВР). Тем самым данное изобретение обеспечивает применение для лечения раков, имеющих ЕМВР, в частности, раков предстательной железы, путем внутривенного введения. Другим применением данного изобретения является обеспечение способа быстрого облегчения симптомов, вторичных относительно рака, включающих в себя, но не ограничивающихся ими, индуцированную боль и закупорку мочевых путей. Далее, данное изобретение делает эти применения для использования внутривенного эстрамустинфосфата независимыми от композиции. Так, данное изобретение обеспечивает инфузию эстрамустинфосфата в виде свободного лекарственного средства, в виде связанного с белком лекарственного средства или в виде лекарственного средства, находящегося в липосомах. В связи с этим данное изобретение описывает композицию эстрамустинфосфата, в которой эстрамустинфосфат вводят внутривенно в соединении с липосомами. Таким образом, способ данного изобретения, в котором дозы выше 900 мг/м 2 (обычно более 1300 мг на дозу) могут вводиться безопасно и в эффективной схеме введения, является совершенно неожиданным. Данное изобретение описывает преимущество внутривенного эстрамустина в комбинации с другими химиотерапевтическими агентами. Далее, данное изобретение описывает преимущество внутривенного введения эстрамустина в высокой дозе в комбинации с другими химиотерапевтическими агентами. Установлено, что внутривенный эстрамустинфосфат может быть использован для лечения опухолей, имеющих повышенное количество ЕМВР-подобного белка (далее называемого просто EMBP). Новые и неочевидные применения данного изобретения могут быть поняты из сравнения фармакокинетических данных после перораль 7 ного введения эстрамустинфосфата с фармакокинетическими данными после внутривенного введения высокой дозы эстрамустинфосфата. Фармакокинетические данные и данные по токсичности, касающиеся внутривенного введения высокой дозы эстрамустинфосфата, неизвестны в данной области. Дефосфорилирование эстрамустинфосфата до эстрамустина (ЭМ) с последующим окислением в положении 17 до эстромустина (ЭоМ), эстронного аналога ЭМ, являются основными метаболическими стадиями после перорального введения эстрамустинфосфата в человеке. ЭоМ является преобладающим метаболитом, обнаруженном в плазме при введении эстрамустинфосфата по схеме ежедневного перорального введения. Относительная биодоступность, основанная на эстромустине,равна приблизительно 44% (Gunnarsson, 1984). После внутривенного введения эстрамустинфосфат сначала обнаруживают в плазме, но он быстро гидролизуется до тех же самых метаболитов, которые обнаруживают после перорального введения, причем основным метаболитом является эстромустин. Как эстрамустин, так и эстромустин метаболизируются далее путем расщепления эфира карбаминовой кислоты с образованием приблизительно 15% эстрадиола и эстрона, соответственно (Gunnarsson, 1981,1984). В настоящее время обнаружена неожиданная пролонгированная доступность основного метаболита эстромустина после внутривенного введения высоких доз, которая может приводить к неожиданным клиническим преимуществам. Прежние данные для пациентов, которые получали отдельную внутривенную дозу 300 мг,показывали, что удаление эстромустина имело периоды полувыведения из организма 10-20 ч. Основной путь удаления был метаболизмом эстромустинфосфата до эстрамустина, эстромустина, эстрадиола и эстрона. Результатом особой важности для эффективности эстрамустинфосфата были периоды полувыведения эстрамустинфосфата (фиг. 1) и основного цитотоксического метаболита эстромустина (фиг. 2). Путем применения способов этого изобретения продемонстрировано новое открытие, что после отдельной высокой внутривенной дозы эстрамустинфосфата 1000 мг/мм 2 было обнаружено,что период полувыведения эстромустина был приблизительно 100 ч (фиг. 2). Это открытие дополнительно делает возможными терапевтические применения внутривенного введения высоких доз эстрамустинфосфата. Подробное описание предпочтительных вариантов Данное изобретение описывает возможность введения эстрамустинфосфата в дозах выше 950 мг/м 2 (т.е. более 1300 мг). Способ данного изобретения выполняют следующим образом. В предпочтительном способе эстрамустинфосфат вводят в виде одной инфузионной дозы, превышающей 950 мг/м 2. 8 Внутривенное введение выполняют как через центральные, так и через периферические вены. Во время приготовления предполагаемого лекарственного средства содержимое упакованного эстрамустинфосфата, предназначенного для внутривенного использования, растворяют,причем упакованное содержимое может состоять из (но не ограничивается ими) лиофилизованного порошка солей меглюмина во флаконах эстрамустинфосфата или подобного лиофилизованного эстрамустинфосфата, который сначала растворяют в стерильной воде, например, в 5 мл стерильной воды на 300 мг эстрамустинфосфата или в 5% декстрозе в воде для внутривенного введения. В предпочтительном способе в качестве разбавителя используют 5% декстрозу в воде. В предпочтительном способе во время приготовления растворенного лекарственного средства препарат не должен встряхиваться, а должен медленно переворачиваться для смешивания. Затем раствор вводится в виде внутривенной инфузии с предпочтительной продолжительностью времени инфузии от 30 мин до 3 ч, в результате чего инфузия на протяжении 1-2 ч является безопасным и удобным способом. Солевой раствор может приводить к осаждению лекарственного средства и поэтому его применение не является предпочтительным в этом вливании. При введении эстрамустинфосфата периферическим внутривенным путем предпочтительно использовать более продолжительное время инфузии и больший общий инфузионный объем для минимизации раздражения сосудов. Альтернативно, раствор эстрамустинфосфата может быть смешан с различными количествами, но предпочтительно, с 3-5% человеческого альбумина или других белков плазмы, в том числе синтетических белков плазмы, для достижения связывания белками эстрамустинфосфата и, следовательно, минимизации любого потенциального повреждения сосудов. Данное изобретение может быть дополнительно реализовано с использованием других препаратов или композиций эстрамустинфосфата. Один особенно предпочтительный препарат эстрамустинфосфата в качестве химиотерапевтического агента, который делает возможной инфузию эстрамустинфосфата через периферическую или центральную вену, как при высоких дозах, так и при дозах менее 1300 мг, включает в себя инфузию эстрамустинфосфата в соединении с липосомами (далее называемого инкапсулированным в липосомах эстрамустинфосфатом или липосомным эстрамустином). В одном предпочтительном способе приготовления липосомного эстрамустина сначала готовят раствор эстрамустинфосфата по способу, описанному выше, и затем инъецируют во флакон, содержащий пустые липосомы, доступные в виде лиофилизованного порошка. После адекватной гидратации липосом флаконы встряхивают вор 9 тексом и обрабатывают ультразвуком с последующей инфузией в пациента. При введении эстрамустинфосфата через центральные вены это введение может быть выполнено при помощи либо временного, либо постоянного устройства доступа в вену, в том числе, но не только, при помощи катетера с тройным просветом, катетера Хикмана, подключичной линии, яремной линии или mediport. Это введение может выполняться, но не обязательно, одновременно с антикоагулянтной терапией или с добавлением варьирующихся количеств, но предпочтительно 3-5% человеческого альбумина или других белков плазмы или липосомного эстрамустина для минимизации любого потенциального повреждения сосудов у данного пациента. Хотя доза эстрамустинфосфата в данном изобретении больше 1300 мг, предпочтительно,чтобы пациенту вводили дозу, превышающую 950 мг/м 2. В связи с этим, один предпочтительный способ заключается во введении одной внутривенной дозы 1000 мг/м 2. Другой предпочтительный способ заключается во введении одной внутривенной дозы 1500 мг/м 2. Кроме того, может вводиться доза 2000 мг/м 2. Однако это изобретение включает в себя и другие дозы выше 950 мг/м 2, и эти предпочтительные дозы не являются ограничительными. Наиболее предпочтительная схема введения эстрамустинфосфата в этом изобретении предусматривает одну инфузию, проводимую 1 раз в неделю до максимальной дозы 4000 мг или 3500 мг/м 2. Другой предпочтительной схемой является введение одной инфузии лекарственного средства 1 раз каждые 2 недели. Другой предпочтительной схемой является введение одной инфузии лекарственного средства 1 раз каждые 4 недели. Одна схема может быть предпочтительной относительно другой при рассмотрении схем с учетом другой сопутствующей терапии. Эти схемы могут повторяться последовательным или повторяющимся образом. Описанное здесь изобретение обеспечивает способы пролонгирования повышенных уровней в крови и/или ткани метаболитов эстрамустинфосфата, в том числе эстромустина,эстрамустина, эстрона и эстрадиола. Таким образом, становятся возможными усиленные синергические взаимодействия с другими способами терапии, причем такие другие способы терапии включают в себя, но не ограничиваются ими, химиотерапию, радиотерапию, моноклональные антитела и биологические терапии. Данное изобретение обеспечивает максимизацию терапевтической пользы путем пролонгирования повышенных уровней в крови и ткани эстрамустинфосфата и его метаболитов. Таким образом, достигается максимизация терапевтической пользы, при которой эстрамустинфосфат вводят внутривенно в дозах, превышающих 950 мг/м 2, которые вводят в сочетании 10 с другими раковыми терапиями, в том числе, но не только, радиотерапией, химиотерапией, моноклональными антителами и биологическими терапиями. В предпочтительном способе терапевтическая польза потенциируется введением внутривенно эстрамустинфосфата в отдельных дозах,превышающих 950 мг/м 2, с другими цитотоксическими химиотерапиями. В предпочтительном способе это сочетание достигается введением внутривенного эстрамустинфосфата в пределах 3 дней введения других химиотерапевтических агентов, предпочтительно в день введения или в день перед введением этих других химиотерапевтических агентов. Особенно предпочтительный эффект достигается, когда другие химиотерапевтические агенты состоят из антимитотических агентов или антимикротрубочковых агентов, в том числе, но не только, таксанов,включающих в себя таксол и таксотере, и других агентов, включающих в себя винбластин,винкристин, этопозид, навелбин, доксорубицин,иринотекан (СРТ-11), и инкапсулированных в липосомы химиотерапевтических агентов, таких как инкапсулированный в липосомы паклитаксел. Далее, может быть выгодным сочетание с моноклональной терапией, при которой моноклональный агент включает в себя радионуклеотид или агент, действующий против фактора роста. Уровни эстрамустина в плазме или сыворотке дополнительно поддерживаются при внутривенном введении эстрамустинфосфата в виде отдельной инфузии в дозе, превышающей 950 мг/м 2. Эта инфузия может необязательно повторяться последовательным или повторяемым образом для поддержания повышенных уровней в крови метаболитов эстрамустинфосфата. Таким образом, поддерживаемые уровни эстрамустинфосфата и его метаболитов позволяют получать поддерживаемую терапевтическую пользу. Таким образом, данное изобретение обеспечивает способ увеличения насыщения связывания эстрамустина или его метаболитов с эстрамустинсвязывающим белком или подобным ему белком путем введения эстрамустинфосфата внутривенно в отдельной инфузионной дозе,превышающей 950 мг/м 2. Подобным образом,продолжительность связывания эстрамустинфосфата или его метаболитов с эстрамустинсвязывающим белком или белком, подобным эстрамустинсвязывающему белку, (ЕВМР), увеличивается в данном изобретении путем введения этого лекарственного средства во внутривенных дозах, превышающих 950 мг/м 2. Вследствие этого, все раковые опухоли, имеющие либо эстрамустинсвязывающий белок, либо белок, подобный эстрамустинсвязывающему белку, могут лечиться внутривенным эстрамустинфосфатом. Особенно предпочтительно лечение, таким образом, рака предстательной железы. Особен 11 но предпочтительно внутривенное введение эстрамустинфосфата, в котором отдельная доза превышает 950 мг/м 2, при лечении раковых опухолей, имеющих либо эстрамустинсвязывающий белок, либо белок, подобный эстрамустинсвязывающему белку, например рака предстательной железы. Такие раковые опухоли могут так же лечиться липосомным эстрамустином, либо в качестве единственного агента, либо в сочетании с другими химиотерапиями. Такие введения предпочтительно повторяют последовательным или повторяемым образом в программах данного изобретения в сочетании с другими терапиями или без такого сочетания. Так, подобные программы могут включать в себя комплексное лечение внутривенным эстрамустинфосфатом с другими химиотерапевтическими способами терапии, предоставляемое согласно программе 1 раз в неделю, 1 раз каждые 2 недели, один раз каждые 3 недели или 1 раз каждые 4 недели, и вариации в такой программе. Особенно предпочтительно назначать внутривенно вводимый эстрамустинфосфат в сочетании с другими химиотерапевтическими цитотоксическими агентами при использовании в лечении рака предстательной железы. Кроме того, особенно предпочтительно назначение внутривенно вводимого эстрамустинфосфата в сочетании с облучением при использовании в лечении рака предстательной железы. Далее, предпочтительно в лечении раковых опухолей, имеющих эстрамустинсвязывающий белок или белок, подобный эстрамустинсвязывающему белку, например,рака предстательной железы, вводить эстрамустинфосфат во внутривенных дозах, превышающих 950 мг/м 2, при использовании в сочетании с другими противораковыми терапиями. Данное изобретение позволяет получить как объективную, так и субъективную терапевтическую пользу. Достигнутая польза может относиться к размеру опухоли, улучшенному качеству жизни, уменьшению опухолевой обструкции, такой как непроходимость мочевых путей, уменьшению выдаваемой раком боли,улучшенному выживанию, уменьшению времени рецидивов рака или к другому свидетельству улучшения. В частности, быстрая объективная или субъективная терапевтическая польза достигается внутривенным введением эстрамустинфосфата в дозе, превышающей 950 мг/м 2,либо в виде единственного агента, либо предпочтительно в сочетании с другими раковыми терапиями. В связи с этим, это изобретение делает возможным быстрое ослабление индуцированной раком непроходимости мочевых путей и быстрое ослабление вызываемой раком боли. Другие признаки этого изобретения станут понятными в ходе последующих описаний примеров вариантов, осуществления изобретения,которые даны для иллюстрации данного изобретения и не подразумевают его ограничения. 12 Примеры Следующие клинические случаи приводятся в качестве примеров, но не в качестве ограничения. Пример 1. Двух пациентов с прогрессированным метастатическим раком предстательной железы лечили эстрамустинфосфатом, вводимым внутривенно через центральную вену. Пациенты получали дозу эстрамустинфосфата 2500 мг/м 2. Эстрамустинфосфат вводили в виде единственной инфузии по схеме 1 раз в неделю повторяющимся образом. Каждую инфузионнную дозу вводили на протяжении 90-минутной инфузии. Эти инфузии хорошо переносились без серьезной токсичности, и оба пациента демонстрировали ответную реакцию (уменьшение) в их специфическом антигене предстательной железы (PSA). Пример 2. Трех пациентов с прогрессированным метастатическим раком предстательной железы лечили эстрамустинфосфатом, вводимым внутривенно через центральную вену, в дозе 1000 мг/м 2. Эстрамустинфосфат вводили в виде единственной инфузии по схеме 1 раз в неделю повторяющимся образом. Каждую инфузионную дозу вводили на протяжении 30-минутной инфузии. Эти инфузии хорошо переносились, и несколько пациентов продемонстрировали РSАответ. Пример 3. Трех пациентов с прогрессированным метастатическим раком предстательной железы лечили эстрамустинфосфатом, вводимым внутривенно через центральную вену, в дозе 1500 мг/м 2. Эстрамустинфосфат вводили в виде единственной инфузии по схеме 1 раз в неделю повторяющимся образом. Инфузионнную дозу вводили либо на протяжении 30 мин, либо на протяжении 1 ч. Эти инфузии хорошо переносились, и один пациент обнаружил ответную реакцию в крупной опухолевой аденопатии(увеличении лимфатических узлов). Пример 4. Трех пациентов с прогрессированным метастатическим раком предстательной железы лечили эстрамустинфосфатом, вводимым внутривенно через центральную вену. Пациенты получали дозу эстрамустинфосфата 2000 мг/м 2. Эстрамустинфосфат вводили в виде единственной инфузии по схеме 1 раз в неделю повторяющимся образом. Каждую инфузионную дозу вводили на протяжении 60-минутной инфузии. Дополнительно вводили антитромботический агент для профилактики тромбоза вены. Эти инфузии эстрамустинфосфата хорошо переносились без серьезной токсичности и с доказательством PSA-ответа. СсылкиLakaresallskapets Rikstamma, 1995 Эта заявка основывается на предварительной заявке США с регистрационным номером 60/079542, которая была подана 27 марта 1998 года, которая включена здесь в качестве ссылки во всей ее полноте. Очевидно, что в свете вышеописанного возможны многочисленные модификации и вариации. Следовательно, должно быть понятно,что в объеме прилагаемой формулы изобретения это изобретение может практиковаться иным образом, чем конкретно описано здесь. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ введения эстрамустинфосфата в виде внутривенной дозы, причем эта доза отдельной инфузии превышает 950 мг/м 2. 2. Способ по п.1, в котором эстрамустинфосфат вводят в виде отдельной инфузии по схеме 1 раз в неделю. 3. Способ по п.1, в котором эстрамустинфосфат вводят в виде отдельной инфузии по схеме 1 раз каждые 2 недели. 4. Способ по п.1, в котором эстрамустинфосфат вводят в виде отдельной инфузии по схеме 1 раз каждые 3 недели. 5. Способ по п.1, в котором эстрамустинфосфат вводят в виде отдельной инфузии по схеме 1 раз каждые 4 недели. 6. Способ по п.1, в котором инфузию проводят на протяжении от 30 мин до 3 ч. 7. Способ по п.1, в котором достигается ослабление индуцированной раком непроходимости мочевых путей. 8. Способ по п.1, в котором достигается быстрое ослабление вызываемой раком боли. 16 9. Способ по п.1, в котором эстрамустинфосфат вводят в сочетании с другими противораковыми терапиями. 10. Способ по п.6, в котором эстрамустинфосфат вводят внутривенно в сочетании с другими химиотерапевтическими агентами. 11. Способ потенциации терапевтической пользы химиотерапевтической программы со многими лекарственными средствами, в котором одно из лекарственных средств в этой программе содержит эстрамустин, путем введения эстрамустинфосфата в виде внутривенной композиции. 12. Способ по п.11, в котором вышеупомянутая внутривенная композиция содержит эстрамустинфосфат, предоставляемый в высокой дозе. 13. Способ по п.11, в котором другое лекарственное средство в этой программе содержит антимитотический агент или антимикротрубочковый агент. 14. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой иринотекан СРТ-11. 15. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой доксорубицин. 16. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой этопозид. 17. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой навелбин. 18. Способ по п.11, в котором другое лекарственное средство в вышеупомянутой схеме представляет собой винбластин. 19. Способ по п.12, в котором доза отдельной инфузии эстрамустинфосфата превышает 950 мг/м 2. 20. Способ по п.13, в котором антимикротрубочковый агент является таксаном. 21. Способ по п.13, в котором антимикротрубочковый агент является инкапсулированным в липосомах таксаном. 22. Способ получения повышенных уровней эстрамустина, метаболита эстромустина в плазме, для промотирования синергического взаимодействия между эстромустином и вторым химиотерапевтическим агентом и потенциации терапевтической пользы, в котором эстрамустин вводят в виде внутривенной композиции и эстрамустин вводят в день или в пределах 3 дней введения вышеупомянутого второго химиотерапевтического агента. 23. Способ по п.22, в котором вышеупомянутый второй терапевтический агент содержит антимитотический агент или антитрубочковый агент. 24. Способ по п.22, в котором внутривенная композиция содержит эстрамустинфосфат. 17 25. Способ по п.23, в котором вышеупомянутый антимикротрубочковый агент представляет собой таксан. 26. Способ по п.24, в котором доза отдельной инфузии эстрамустинфосфата превышает 950 мг/м 2. 27. Способ получения пролонгированных повышенных уровней эстрамустина в плазме для промотирования синергического взаимодействия между эстрамустином и вторым химиотерапевтическим агентом и для потенциации терапевтической пользы, в котором эстрамустин вводят в виде внутривенной композиции и эстрамустин вводят в день или в пределах 3 дней введения вышеупомянутого второго химиотерапевтического агента. 28. Способ по п.27, в котором вышеупомянутый второй химиотерапевтический агент содержит антимитотический агент или антимикротрубочковый агент. 29. Способ по п.27, в котором внутривенная композиция содержит эстрамустинфосфат. 30. Способ по п.28, в котором вышеупомянутый антимикротрубочковый агент представляет собой таксан. 31. Способ по п.29, в котором доза отдельной инфузии эстрамустинфосфата превышает 950 мг/м 2. 32. Способ поддержания уровней эстрамустина и эстромустина в плазме и терапевтической пользы, в котором эстрамустинфосфат вводят внутривенно в виде отдельной инфузии в дозе, превышающей 950 мг/м 2; с необязательным повторением этой инфузии последовательным образом. 33. Способ увеличения насыщения связывания эстрамустина с эстрамустинсвязывающим белком или подобным ему белком, в котором эстрамустин вводят в форме внутривенной композиции в виде эстрамустинфосфата в отдельной дозе, превышающей 950 мг/м 2. 34. Способ пролонгирования продолжительности связывания эстрамустина или его метаболитов с эстрамустинсвязывающим белком или подобным ему белком, в котором эстрамустин вводят в форме внутривенной композиции в виде эстрамустинфосфата в отдельной дозе, превышающей 950 мг/м 2. 35. Способ лечения рака предстательной железы, имеющего эстрамустинсвязывающий белок или белок, подобный эстрамустинсвязывающему белку, включающий введение внутривенной композиции в виде эстрамустинфосфата в отдельной дозе, превышающей 950 мг/м 2. 36. Способ по п.27, в котором эстрамустинфосфат вводят в сочетании с одним или несколькими химиотерапевтическими агентами. 37. Способ по п.31, в котором инкапсулированный в липосомах таксан является инкапсулированным в липосомах паклитакселом. 38. Способ потенциации терапевтической пользы химиотерапевтической программы со 18 многими лекарственными средствами, в котором одно из лекарственных средств в этой программе содержит таксан, и в котором другое лекарственное средство в этой программе содержит эстрамустинфосфат, и в котором эстрамустинфосфат вводят внутривенно в дозе, превышающей 950 мг/м 2. 39. Способ введения эстрамустинфосфата,в котором эстрамустинфосфат сначала инкапсулируют в липосомах и затем вводят внутривенно. 40. Композиция эстрамустинфосфата, в которой эстрамустин инкапсулирован в липосомах. 41. Способ лечения рака предстательной железы, в котором вводят инкапсулированный в липосомах эстрамустинфосфат. 42. Химиотерапевтический агент, состоящий из эстрамустинфосфата, инкапсулированного в липосоме. 43. Композиция по п.41, предназначенная для внутривенного введения. 44. Продукт, содержащий эстрамустинфосфат, пригодный для внутривенного введения, и один или несколько химиотерапевтических агентов, в качестве объединенного препарата для одновременного, отдельного или последовательного использования в противораковой терапии. 45. Продукт по п.44, в котором вышеупомянутые один или несколько химиотерапевтических агентов выбраны из группы, состоящей из иринотекана СРТ-11, доксорубицина, этопозида, навелбина и производного таксана. 46. Продукт по п.44, в котором вышеупомянутый эстрамустинфосфат, пригодный для внутривенного введения, используют в виде инфузии отдельной дозы, превышающей 950 мг/м 2. 47. Продукт по любому из пп.44-46 для лечения рака предстательной железы. 48. Способ для лечения рака предстательной железы, предусматривающий введение продукта по любому из пп.44-47. 49. Композиция для внутривенного введения, содержащая эстрамустинфосфат в смеси с альбумином. 50. Композиция по п.49, где доза отдельной инфузии активного ингредиента превышает 950 мг/м 2. 51. Композиция по п.49 или 50, где альбумин является человеческим альбумином. 52. Продукт, содержащий (i) композицию по п.49 и (ii) один или несколько химиотерапевтических агентов, в качестве объединенного препарата для одновременного, отдельного или последовательного использования в противораковой терапии. 53. Продукт по п.52, в котором химиотерапевтический агент выбран из группы, состоящей из таксана и его производных, иринотекана СРТ-11, камптотецина и его производных, док 19 20 54. Продукт, содержащий эстрамустинфосфат в лиофилизованной форме, и физиологический раствор для парентерального применения, содержащий альбумин.
МПК / Метки
МПК: A61P 35/00, A61K 31/56
Метки: способы, потенциации, внутривенного, эстрамустинфосфата
Код ссылки
<a href="https://eas.patents.su/11-4647-sposoby-potenciacii-vnutrivennogo-estramustinfosfata.html" rel="bookmark" title="База патентов Евразийского Союза">Способы потенциации внутривенного эстрамустинфосфата</a>