Кристаллическая форма соединения (3s,3s’) 4,4′-дисульфандиилбис(3-аминобутан-1-сульфокислоты) с l-лизином
Номер патента: 24460
Опубликовано: 30.09.2016
Авторы: Кувра Никола, Кокрель Жерар, Балавуан Фабрис, Шнайдер Жан-Мари
Формула / Реферат
1. Кристаллическая форма соединения (3S,3S') 4,4'-дисульфандиилбис(3-аминобутан 1-сульфокислоты) (ABSD) с L-лизином, где стехиометрия кристаллической формы равна <ABSD.(L-лизин)2>.
2. Кристаллическая форма по п.1, где дифракционная рентгенограмма кристаллической формы включает следующие пики:
и где дифракционная рентгенограмма получена с помощью Cu Kα анода.
3. Кристаллическая форма по любому из пп.1, 2, в которой дифракционная рентгенограмма кристаллической формы такая, как показано на фиг. 2а.
4. Способ получения кристаллической формы ABSD и L-лизина, включающий следующие стадии:
(а) взаимодействие ABSD или его соли с L-лизином;
(с) выделение кристаллической формы, полученной на стадии (а).
5. Способ по п.4, который дополнительно включает стадию (b) инициации формирования кристаллической фазы и/или улучшения кристалличности кристаллической фазы между стадиями (а) и (с).
6. Способ по п.4 или 5, где стехиометрия ABSD:L-лизин на стадии (а) находится в диапазоне примерно от 1:1,5 до 1:2,5.
7. Способ по п.4 или 5, где стадию (а) выполняют в растворе.
8. Способ по п.7, в котором ABSD и L-лизин суспендируют в воде.
9. Способ по п.4 или 5, где стадию (а) выполняют в твердой фазе предпочтительно с помощью высокоэнергетического размола.
10. Способ по п.7, где стадию (b) выполняют путем добавления антирастворителя, предпочтительно этанола.
11. Способ по любому из пп.4-10, где усовершенствование кристалличности на стадии (b) выполняют путем циклического изменения температуры.
12. Способ по п.11, где циклическое изменение температуры повторяют несколько раз.
13. Способ по п.12, где циклическое изменение температуры повторяют от 5 до 15 раз, предпочтительно 10 раз.
14. Фармацевтическая композиция для лечения гипертензии и/или связанных с ней заболеваний, содержащая кристаллическую форму по любому из пп.1-3 или кристаллическую форму, полученную способом по любому из пп.4-13, в комбинации с фармацевтически приемлемым носителем или разбавителем.
15. Применение фармацевтической композиции по п.14 в лечении гипертензии и/или связанных с ней заболеваний.
16. Применение по п.15, где заболевание представляет собой сердечную недостаточность.
Текст
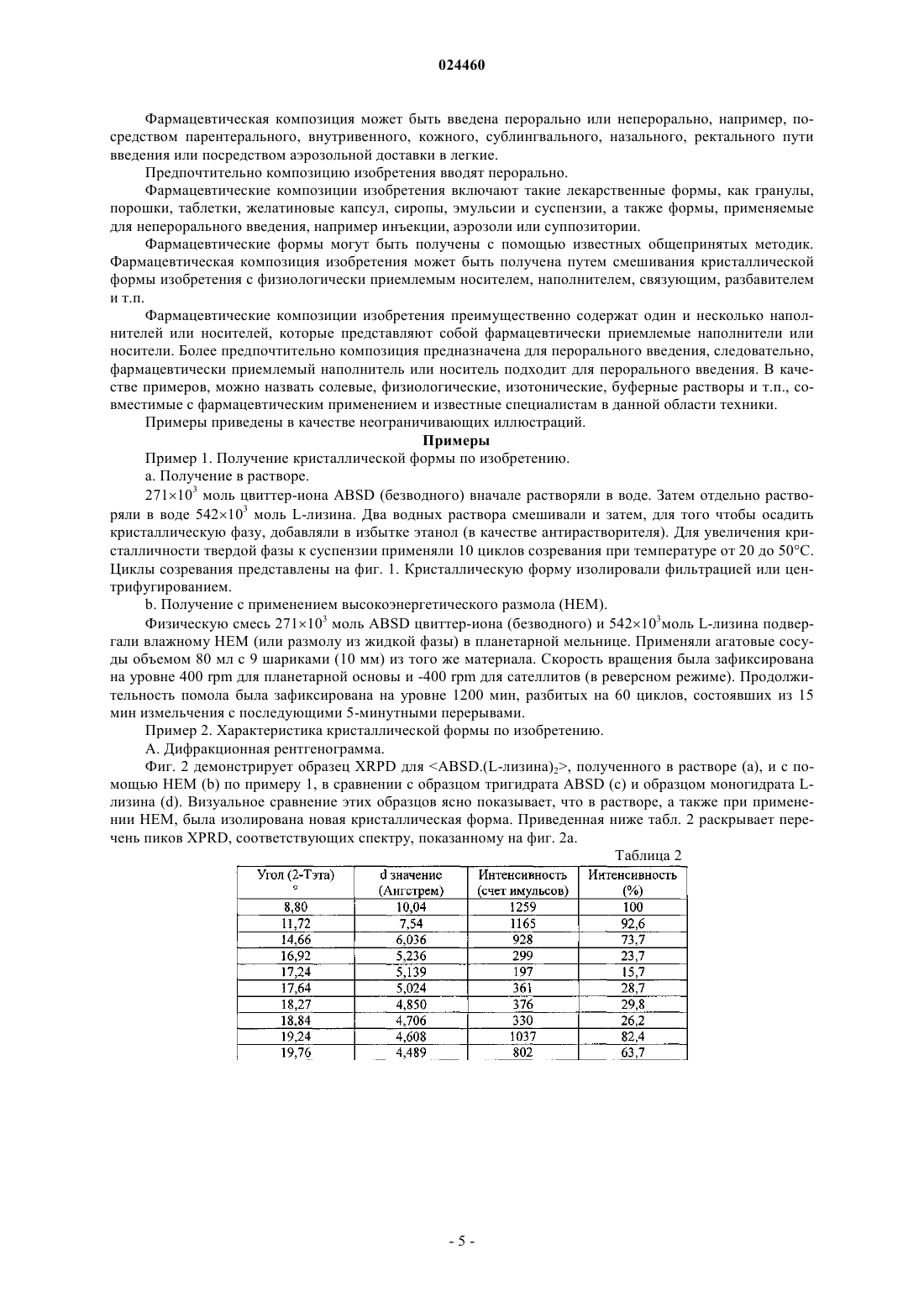
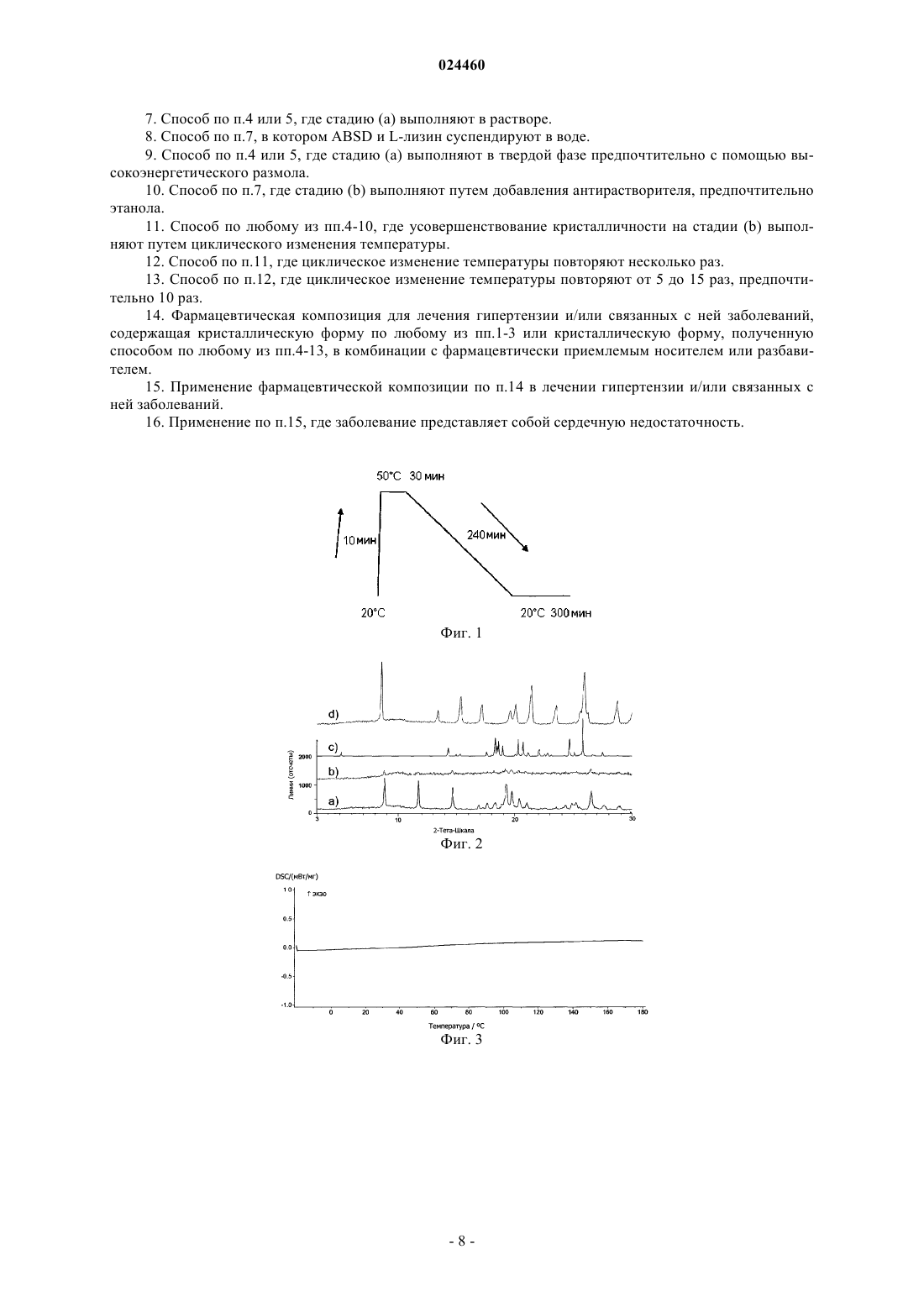
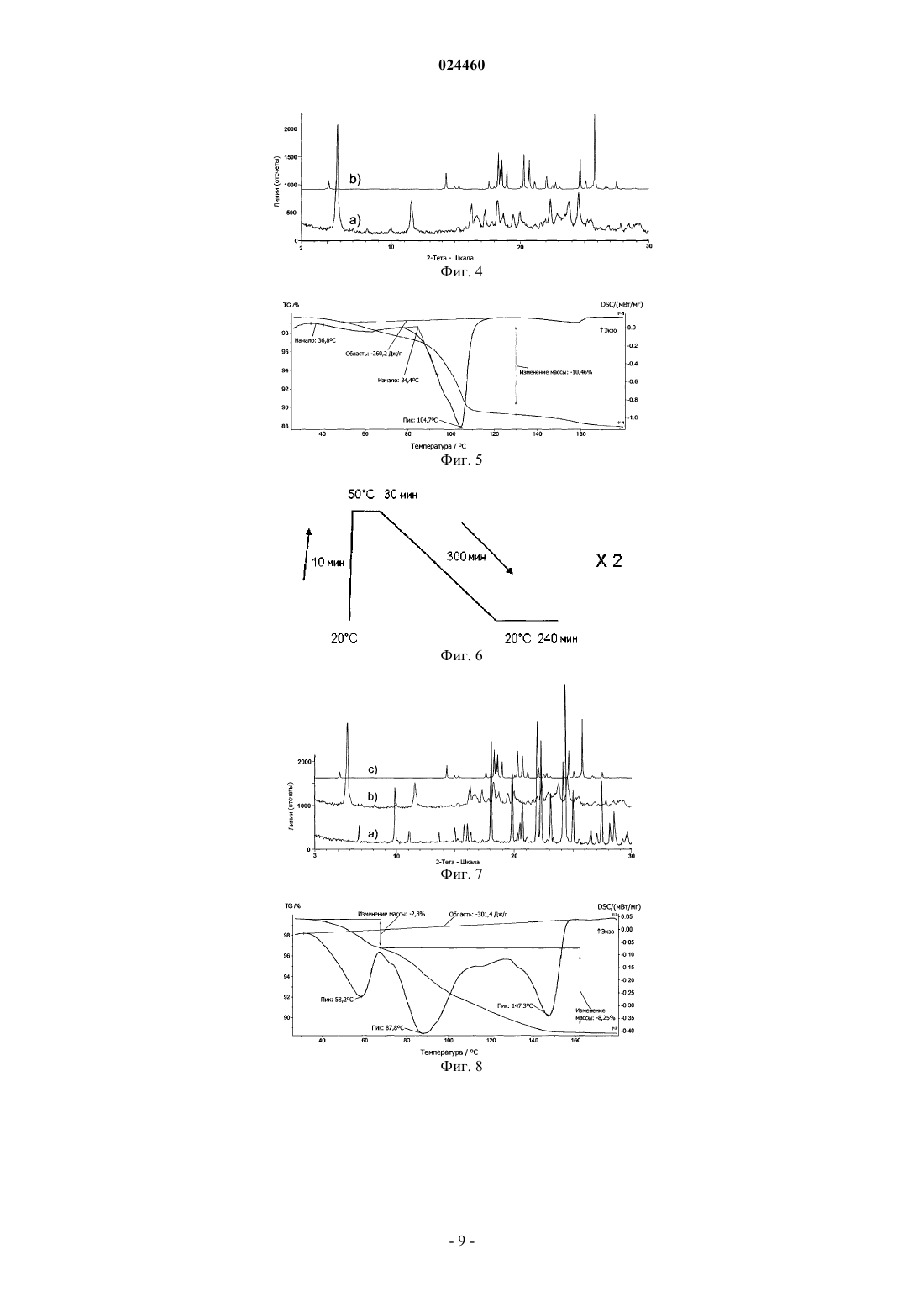
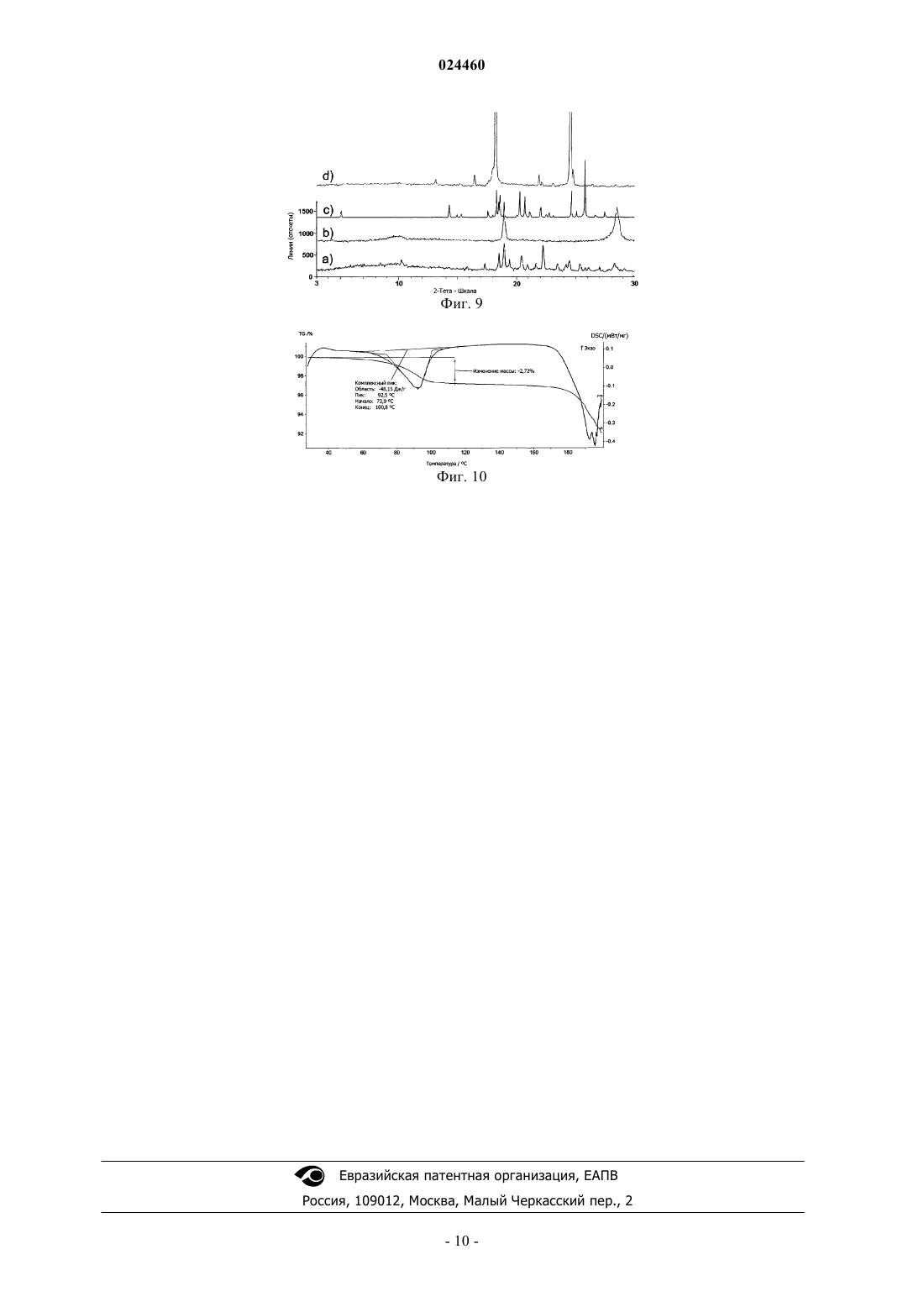
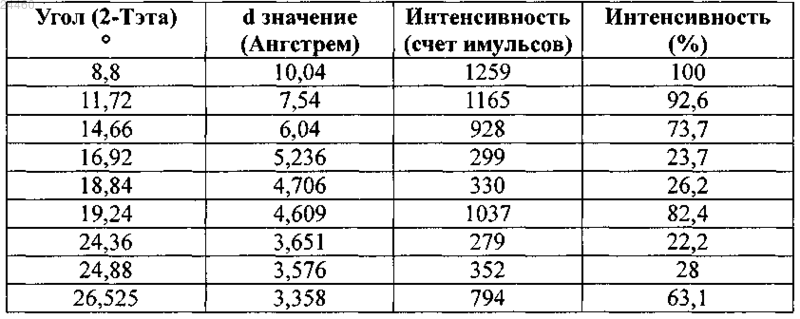
КРИСТАЛЛИЧЕСКАЯ ФОРМА СОЕДИНЕНИЯ (3S,3S') 4,4'-ДИСУЛЬФАНДИИЛБИС(3 АМИНОБУТАН-1-СУЛЬФОКИСЛОТЫ) С L-ЛИЗИНОМ Изобретение относится к новой кристаллической форме соединения (3S,3S') 4,4'дисульфандиилбис(3-аминобутан 1-сульфокислоты) (ABSD) с L-лизином, ее применению в особенности в фармацевтической промышленности и к способам ее получения. Изобретение также направлено на фармацевтические композиции, содержащие по меньшей мере одну кристаллическую форму (3S,3S') 4,4'-дисульфандиилбис(3-аминобутан 1-сульфокислоты) (ABSD) с L-лизином и на терапевтическое или профилактическое применение такой кристаллической формы и композиций, включающих эту форму. Область техники, к которой относится изобретение Настоящее изобретение относится к новой кристаллической форме (3S,3S') 4,4'дисульфандиилбис(3-аминобутан-1-сульфокислоты) (ABSD) с L-лизином и ее применению, в особенности в фармацевтической промышленности, и к способам ее получения. Изобретение также направлено на фармацевтические композиции, содержащие по меньшей мере одну кристаллическую форму (3S,3S') 4,4'дисульфандиилбис(3-аминобутан-1-сульфокислоты) (ABSD) с L-лизином, и на терапевтическое или профилактическое применение такой кристаллической формы и композиций, включающих то же самое. Новая кристаллическая форма ABSD с L-лизином безводная и демонстрирует высокую термическую стабильность и более высокую растворимость в воде по сравнению с тригидратом ABSD. Предшествующий уровень техникиABSD представляет собой димер селективного ингибитора аминопептидазы А (АРА) 3-амино-4 меркаптобутансульфокислоты. Было показано, что ABSD представляет собой эффективное антигипертензивное средство, как описано в работе Bodineau et al. in Hypertension, 2008, 51, 1318-1325. ABSD и его применение в качестве антигипертензивного средства раскрыты в патентной заявке WO 2004/007441. Впервые ABSD была изолирована в форме бис-гидрохлорида ее натриевой соли, как описано в WO 2004/007441. Но не было описано, что указанное соединение было кристаллическим, и было четко описано, что оно было сильно гигроскопичным. Как описано в международной патентной заявке WO 2012/045849, ABSD также изолировали в ее несолевой форме в виде цвиттер-иона. Было обнаружено, что данный цвиттер-ион образует несколько гидратов. Он, как правило, существует в виде смеси моно-, ди- и тригидратных форм. Было показано, что отношение каждой гидратной формы в цвиттер-ионе ABSD зависит от условий хранения (температура,атмосферное давление и относительная влажность (RH. Действительно, смесь гидратированных форм может сместиться в направлении формы тригидрата менее чем в течение двух дней, при хранении при приблизительно 20 С и RH50%. По-видимому, форма тригидрата представляет собой наиболее стабильную кристаллическую форму в условиях окружающей среды. Тем не менее, его дегидратация, в особенности в направлении формы дигидрата, начинает проявляться при температуре ниже 30 С. Данная частичная дегидратация часто связана с эффектом набухания, который может поставить под угрозу возможность изготовления таблеток с данным активным основным ингредиентом (также называемый в настоящем документе API). Таким образом, отсутствие термической стабильности, присутствие воды и чувствительность к относительной влажности в цвиттер-ионной форме ABSD может представлять собой препятствие для получения его фармацевтических препаратов. Кроме того, трудности с обработкой и хранением, скорее всего, поставят под угрозу дальнейшую разработку цвиттер-ионной формы ABSD в качестве конкурентоспособного API фармацевтических композиций. Хотя терапевтическая эффективность представляет собой основную проблему для терапевтического агента, солевые и твердотельные формы (т.е. кристаллические формы и/или аморфные состояния) лекарственного средства-кандидата могут иметь решающее значение для его фармакологических свойств и для его разработки в качестве конкурентоспособного API. Для получения фармацевтических композиций, содержащих ABSD, для введения животным существует необходимость в получении данного соединения в форме, имеющей физические свойства, поддающиеся надежной разработке. Соответственно существует необходимость в данной области техники обеспечить усовершенствованные формы ABSD,имеющие улучшенные свойства, такие как улучшенная растворимость или биодоступность и устойчивость к нагреванию, влаге и/или свету. Поиск наиболее адекватной формы API для дальнейшей разработки лекарственного средства может сократить время и снизить стоимость разработки. В этом контексте в настоящее время заявитель обнаружил, что конкретная кристаллическая форма с чрезвычайно интересными свойствами может быть неожиданно получена при контакте ABSD с Lлизином, в особенности в стехиометрии 1:2 (ABSD:L-лизин). Сущность изобретения Была выделена новая кристаллическая форма ABSD с L-лизином. Указанная кристаллическая форма была безводная и неожиданно продемонстрировала высокую термическую стабильность (вплоть до 180 С). Данная новая кристаллическая форма имела белый цвет и хорошую фильтруемость и продемонстрировала высокую растворимость в воде при комнатной температуре и пониженную, по сравнению с цвиттер-ионной формой ABSD, гигроскопичность. Указанная кристаллическая форма представляет собой очень интересную альтернативу цвиттер-ионной форме ABSD для фармацевтических применений. Такие оптимальные свойства не могут быть получены ни с другими солями ABSD, такими как моно- и динатриевые соли, ни от комбинации ABSD с другими аминокислотами, отличными от L-лизина. В одном из аспектов настоящее изобретение обеспечивает кристаллическую форму ABSD с Lлизином. В другом аспекте изобретение относится к способу получения кристаллической формы ABSD и Lлизина, включающему следующие стадии:a) взаимодействие ABSD, или его соли, или его смесей с L-лизином в стехиометрии, предпочтительно включающей от примерно 1:1,5 до 1:2,5,b) необязательно, инициация формирования кристаллической фазы, и/или необязательно, улучшение кристалличности кристаллической фазы,c) выделение кристаллической фазы, полученной на стадии (а), необязательно на стадии (b). В другом воплощении изобретение обеспечивает фармацевтическую композицию, включающую кристаллическую форму изобретения, в комбинации с фармацевтически приемлемым носителем или разбавителем. Еще в одном воплощении изобретение обеспечивает кристаллическую форму изобретения для применения в лечении гипертензии и связанных с ней заболеваний. Краткое описание чертежей Фиг. 1 - температура от времени для циклов созревания, примененных к суспензии по примеру 1 а. Фиг. 2 - образец XRPD для ABSD.(L-лизина)2, полученного в растворе (а) и с помощью НЕМ (b) в сравнении с образцом тригидрата ABSD, рассчитанным из кристаллической структуры (с), и образцом моногидрата L-лизина (d). Фиг. 3 - образец DSC для ABSD.(L-лизина)2. Указанный эксперимент выполняли при температуре от -20 вплоть до 180 С, скорость нагревания = 5 К/мин. Фиг. 4 - образец XRPD динатриевой соли ABSD (а) в сравнении с образцом тригидрата ABSD, рассчитанным из кристаллической структуры (B). Фиг. 5 - TGA-DSC выполняли на динатриевой соли ABSD при температуре от 30 С вплоть до 180 С(скорость нагревания = 5 К/мин). Фиг. 6 - температура от времени для циклов созревания, примененных к кислой натриевой солиABSD. Фиг. 7 - образец XRPD для кислой натриевой соли ABSD (а) в сравнении с образцом динатриевой соли ABSD и (b) с образцом тригидрата ABSD, рассчитанным из кристаллической структуры (с). Фиг. 8 - TGA-DSC выполняли на кислой натриевой соли ABSD при температуре от 30 вплоть до 180 С (скорость нагревания = 5 К/мин). Фиг. 9 - образец XRPD L-цистеината ABSD, изолированного с помощью медленного испарения (а),в сравнении с L-цистеинатом ABSD, изолированным с помощью фильтрация (b), образец тригидратаABSD, рассчитанный из кристаллической структуры (с) и L-цистеина (d). Фиг. 10 - TGA-DSC выполняли на L-цистеинате ABSD при температуре от 30 вплоть до 220 С (скорость нагревания = 5 К/мин). Осуществление изобретения Настоящее изобретение обеспечивает кристаллическую форму ABSD с L-лизином в качестве нового вещества, в особенности в фармацевтически приемлемой форме. Термин "фармацевтически приемлемый", примененный в настоящем документе, относится к тем соединениям, веществам, композициям и/или лекарственным формам, которые, в рамках погрешности медицинской оценки, подходят для контакта с тканями человека и животных без чрезмерной токсичности, раздражений, аллергической реакции или других создающих проблемы осложнений, соизмеримых с разумным соотношением выгоды/риска. В некоторых предпочтительных воплощениях кристаллическая форма находится в практически чистой форме. Термин "практически чистая", примененный в настоящем документе, означает соединение,имеющее чистоту больше чем примерно 90%, включая, например, примерно 91, примерно 92, примерно 93, примерно 94, примерно 95, примерно 96, примерно 97, примерно 98, примерно 99 и примерно 100 мас.%. Термин "примерно", примененный в настоящем документе, означает 1% от численного значения. Кристаллическая форма. Химическая структура кристаллической формы представляет собой более конкретно ABSD.(Lлизин)2. Кристаллическая форма продемонстрировала интересные физико-химические свойства в связи с фармацевтическими приложениями, возможными для ABSD. В особенности указанная форма была безводная (кристаллическая решетка не включает молекул воды) и демонстрировала высокую термическую стабильность, в особенности вплоть до 180 С. Данная новая кристаллическая форма имела белый цвет и хорошую фильтруемость, и продемонстрировала высокую растворимость в воде при комнатной температуре и пониженную гигроскопичность по сравнению с цвиттер-ионной формой ABSD. Указанная кристаллическая форма представляет собой чрезвычайно интересную и инновационную альтернативу цвиттер-ионной форме ABSD. Это позволяет одновременно разрешить проблемы с термической стабильностью цвиттер-иона ABSD и увеличить растворимость в воде активного ингредиента. Характеристика. Кристаллическая форма, описанная в настоящем документе, может быть идентифицирована и/или охарактеризована с помощью различных аналитических методик, известных среднему специалисту в данной области техники. Такие методики включают, без ограничений, рентгеновскую порошковую дифрактометрию (XRPD), дифференциальную сканирующую калориметрию (DSC), термогравиметрический анализ (TGA), определение изотерм сорбции влаги и/или ИК-спектра. Кристаллическая форма изобретения может быть охарактеризована, в частности, с помощью ее дифракционной рентгенограммы, включающей пики, перечисленные в приведенной ниже табл. 1, или точнее с помощью ее дифракционной рентгенограммы, как показано на фиг. 2 а, полученной с помощью CuK анода. Таблица 1 Таблица данных рентгенодифракционных пиков ABSD.(L-лизина)2 Среднему специалисту в данной области техники будет понятно, что дифракционная рентгенограмма может быть получена с погрешностью измерений, которая зависит от примененных условий измерения. В особенности общеизвестно, что интенсивности в дифракционной рентгенограмме могут колебаться в зависимости от примененных условий измерения и формы или морфологии частицы наряду с распределением кристаллов по размерам. Следует также понимать, что относительные интенсивности также могут варьировать в зависимости от условий эксперимента и, следовательно, точный порядок интенсивности не следует принимать во внимание. Кроме того, погрешность измерений угла дифракции для обычной дифракционной рентгенограммы, как правило, равно приблизительно 0,02 (в 2 тета) или менее, предпочтительно приблизительно 0,01. Следовательно, следует понимать, что кристаллическая форма настоящего изобретения не ограничена кристаллической формой, которая обеспечивает дифракционную рентгенограмму, полностью идентичную дифракционной рентгенограмме, изображенной на фиг. 2 а или описанной в табл. 1 или 2. Любая кристаллическая форма, которая обеспечивает дифракционную рентгенограмму, по существу идентичную дифракционной рентгенограмме, раскрытой на фиг. 2 а или описанной в табл. 1 или 2, входит в объем настоящего изобретения. Способность устанавливать существенные идентичности дифракционных рентгенограмм находится в пределах компетенции среднего специалиста в данной области техники. Получение. Кристаллическая форма изобретения может быть получена с помощью различных способов, включая, например, кристаллизацию или перекристаллизацию из подходящего растворителя, сублимацию,рост из расплава, твердофазный переход из другой кристаллической формы, кристаллизацию из сверхкритической жидкости и сушку распылением. Методики кристаллизации или перекристаллизации кристаллической формы из смеси растворителей включают, например, выпаривание растворителя, снижение температуры смеси растворителей, затравливание кристаллом перенасыщенной смеси растворителей молекулы и/или соли, лиофильную сушку смеси растворителей и добавление антирастворителей (противорастворителей) к смеси растворителей. Кристаллы лекарственных средств, включая полиморфы, способы получения и характеристику кристаллов лекарственных средств, рассмотрены в Solid-State Chemistry of Drugs, S.R. Byrn, R.R. Pfeiffer, andJ.G. Stowell, 2nd Edition, SSCI, West Lafayette, Ind. (1999). Для методики кристаллизации, в которой применяют растворитель, выбор растворителя (растворителей), как правило, зависит от одного или нескольких факторов, таких как растворимость соединения,методика кристаллизации, давление насыщенных паров растворителя, вязкость растворителя и токсичность. Могут быть применены комбинации растворителей, например соединение может быть растворено в первом растворителе с получением раствора, а затем добавляют антирастворитель для снижения растворимости соединения в растворе и для инициации формирования кристаллов. Антирастворитель представляет собой растворитель, в котором соединение имеет низкую растворимость. В конкретном воплощении настоящее изобретение обеспечивает способ получения кристаллической формы ABSD и L-лизина, включающий следующие стадии:(a) взаимодействие ABSD, или его соли, или его смесей, с L-лизином в стехиометрии, предпочтительно включающей от примерно 1:1,5 до 1:2,5, в особенности в стехиометрии, равной примерно 1:2,-3 024460(b) необязательно инициация формирования кристаллической фазы, и/или необязательно, улучшение кристалличности твердой фазы с помощью одного или нескольких температурных циклов, например, таких как цикл, изображенный на фиг. 1,(c) выделение кристаллической фазы, полученной на стадии (а) (или (b. Стадия (а) может быть выполнена, например, в растворе, в особенности ABSD и L-лизин могут быть суспендированы в воде или в твердой фазе предпочтительно с помощью высокоэнергетического размола (НЕМ), в особенности с помощью влажного (этанол) НЕМ. Стадия (b) может быть выполнена, например, путем добавления антирастворителя, такого как этанол, если стадию (а) выполняют в растворе. Стадия (b) также может быть выполнена путем затравливания раствора кристаллом желаемой кристаллической формы и/или путем применения одного или нескольких температурных циклов. В воплощении, стадию (b) выполняют путем добавления антирастворителя, такого как этанол, если стадию (а) выполняют в растворе, или путем затравливания раствора кристаллом желаемой кристаллической формы и затем применением одного или нескольких температурных циклов. Последнюю стадию разработали для улучшения кристалличности и тем самым фильтруемости и химической чистоты конечного продукта. Стадия (с) может быть выполнена, например, путем выпаривания реакционного растворителя, с помощью фильтрации или центрифугирования. Каждая стадия, каждая часть стадии (например, первая или вторая часть стадии (b, и/или каждая комбинация стадий (например, комбинация стадии (b) и стадии (с способа изобретения могут быть выполнены однократно, или могут быть повторены несколько раз в способе изобретения, независимо от других стадий или частей стадии. Например, на стадии (b) циклическое изменение температуры может быть выполнено однократно,альтернативно, оно может быть повторено несколько раз, предпочтительно от 5 до 15 раз, в особенности 10 раз. Повторение последовательности стадий (b) позволяет в особенности увеличить кристалличность фазы. Кристаллическая форма, полученная способом изобретения, представляет собой дополнительную цель изобретения. Фармацевтическое применение. Кристаллическая форма ABSD и L-лизина, в особенности ABSD.(L-лизин)2 изобретения, или кристаллическая форма, полученная способом изобретения, могут быть применены в способе предупреждения или лечения гипертензии и/или связанных с ней заболеваний, включающем введение терапевтически эффективного количества указанной кристаллической формы. В другом аспекте настоящее изобретение обеспечивает фармацевтическую композицию, содержащую кристаллическую форму изобретения или кристаллическую форму, полученную способом изобретения, предпочтительно в комбинации с фармацевтически приемлемым носителем или разбавителем. В другом аспекте настоящее изобретение обеспечивает кристаллическую форму изобретения, или кристаллическую форму, полученную способом изобретения, или фармацевтическую композицию изобретения, для применения в терапии, в особенности при лечении людей. В другом аспекте настоящее изобретение обеспечивает кристаллическую форму изобретения, или кристаллическую форму, полученную способом изобретения, или фармацевтическую композицию изобретения, для применения в лечении гипертензии и/или связанных с ней заболеваний. В другом аспекте изобретение обеспечивает применение кристаллической формы настоящего изобретения, или кристаллической формы, полученной способом изобретения, или фармацевтической композиции изобретения для получения лекарственного препарата для лечения гипертензии и/или связанных с ней заболеваний. В другом аспекте изобретение обеспечивает способ лечения субъекта с повышенным артериальным давлением и/или связанных с этим заболеваний, включающий введение терапевтически эффективного количества кристаллической формы настоящего изобретения, или кристаллической формы, полученной способом изобретения, или фармацевтической композиции изобретения. Настоящее изобретение обеспечивает способы предупреждения или лечения гипертензии и заболеваний, прямо или опосредованно связанных с гипертензией. В соответствии с изобретением субъект может представлять собой человека или животное. В предпочтительных воплощениях заболевания, опосредованно или прямо связанные с гипертензией, выбирают из группы, состоящей из сердечно-сосудистых заболеваний, заболеваний периферической и церебральной сосудистой системы, мозга, глаз и почек. В особенности заболевания включают первичную и вторичную артериальную гипертензию, инсульт, ишемию миокарда, сердечную недостаточность,почечную недостаточность, инфаркт миокарда, заболевания периферических сосудов, диабетическую протеинурию, синдром X и глаукому. Они также могут включать, в частности, нефропатию, ретинопатию и нейропатию у больных сахарным диабетом с гипертензией. В особенности заболевания включают первичную и вторичную артериальную гипертензию, инсульт, ишемию миокарда, сердечную недостаточность и почечную недостаточность, инфаркт миокарда,заболевание периферических сосудов, протеинурию, диабет, метаболический синдром и глаукому. Фармацевтическая композиция может быть введена перорально или неперорально, например, посредством парентерального, внутривенного, кожного, сублингвального, назального, ректального пути введения или посредством аэрозольной доставки в легкие. Предпочтительно композицию изобретения вводят перорально. Фармацевтические композиции изобретения включают такие лекарственные формы, как гранулы,порошки, таблетки, желатиновые капсул, сиропы, эмульсии и суспензии, а также формы, применяемые для неперорального введения, например инъекции, аэрозоли или суппозитории. Фармацевтические формы могут быть получены с помощью известных общепринятых методик. Фармацевтическая композиция изобретения может быть получена путем смешивания кристаллической формы изобретения с физиологически приемлемым носителем, наполнителем, связующим, разбавителем и т.п. Фармацевтические композиции изобретения преимущественно содержат один и несколько наполнителей или носителей, которые представляют собой фармацевтически приемлемые наполнители или носители. Более предпочтительно композиция предназначена для перорального введения, следовательно,фармацевтически приемлемый наполнитель или носитель подходит для перорального введения. В качестве примеров, можно назвать солевые, физиологические, изотонические, буферные растворы и т.п., совместимые с фармацевтическим применением и известные специалистам в данной области техники. Примеры приведены в качестве неограничивающих иллюстраций. Примеры Пример 1. Получение кристаллической формы по изобретению.a. Получение в растворе. 271103 моль цвиттер-иона ABSD (безводного) вначале растворяли в воде. Затем отдельно растворяли в воде 542103 моль L-лизина. Два водных раствора смешивали и затем, для того чтобы осадить кристаллическую фазу, добавляли в избытке этанол (в качестве антирастворителя). Для увеличения кристалличности твердой фазы к суспензии применяли 10 циклов созревания при температуре от 20 до 50 С. Циклы созревания представлены на фиг. 1. Кристаллическую форму изолировали фильтрацией или центрифугированием.b. Получение с применением высокоэнергетического размола (НЕМ). Физическую смесь 271103 моль ABSD цвиттер-иона (безводного) и 542103 моль L-лизина подвергали влажному НЕМ (или размолу из жидкой фазы) в планетарной мельнице. Применяли агатовые сосуды объемом 80 мл с 9 шариками (10 мм) из того же материала. Скорость вращения была зафиксирована на уровне 400 rpm для планетарной основы и -400 rpm для сателлитов (в реверсном режиме). Продолжительность помола была зафиксирована на уровне 1200 мин, разбитых на 60 циклов, состоявших из 15 мин измельчения с последующими 5-минутными перерывами. Пример 2. Характеристика кристаллической формы по изобретению. А. Дифракционная рентгенограмма. Фиг. 2 демонстрирует образец XRPD для ABSD.(L-лизина)2, полученного в растворе (а), и с помощью НЕМ (b) по примеру 1, в сравнении с образцом тригидрата ABSD (с) и образцом моногидрата Lлизина (d). Визуальное сравнение этих образцов ясно показывает, что в растворе, а также при применении НЕМ, была изолирована новая кристаллическая форма. Приведенная ниже табл. 2 раскрывает перечень пиков XPRD, соответствующих спектру, показанному на фиг. 2 а. Таблица 2b. Дифференциальная сканирующая калориметрия. Изолированную кристаллическую форму, так называемый "ABSD L-лизинат", проанализировали с помощью DSC (фиг. 3). Данный анализ не выявил какого-либо термического феномена вплоть до 180 С. Указанный результат демонстрирует хорошую термическую стабильность кристаллической формыABSD.(L-лизина)2 изобретения. Указанные результаты еще раз подтвердили, что кристаллическая форма безводна. с. Титрование по методу Карла Фишера. Титрование по методу Карла Фишера представляет собой классический способ титрования для определения следовых количеств воды в образце. Титрование по методу Карла Фишера подтвердило данные DSC-анализа, путем определения содержания воды внутри образца, равным 0,06% (т.е. очень небольшое количество адсорбированной воды). Таким образом, ABSD L-лизинат представляет собой безводное твердое вещество, которое демонстрирует значительно более высокую термическую стабильность по сравнению с ABSD в цвиттерионной форме.d. Элементный анализ. Элементный анализ следующих элементов: серы, кислорода, углерода и водорода, подтвердил, что данная кристаллическая форма имеет стехиометрию: ABSD.(L-лизин)2. Пример 3. Сравнительные примеры.a. Динатриевая соль/ABSD. Кристаллизацию динатриевой соли ABSD выполняли следующим образом. 271103 моль ABSD цвиттер-иона (безводного) добавляли к 542103 моль NaOH и смесь растворяли в 2 мл воды. Затем, кристаллизацию инициировали добавлением антирастворителя (этанола) в большом избытке (30 мл). После фильтрации, твердое вещество проанализировали с помощью XRPD. Полученный спектр представлен на фиг. 4. Данный образец XRPD доказывает, что была закристаллизована новая кристаллическая форма. Она должна представлять собой динатриевую соль ABSD. TGA-DSC анализ (в сочетании с масс-спектрометрией) выполняли на этой соли для того, чтобы зарегистрировать ее термическое поведение и определить содержание воды. Соответствующий спектр представлен на фиг. 5. Согласно этому анализу эта кристаллическая форма теряет воду между 30 и 40 С. Данная кристаллическая форма не представляет собой интересную альтернативу цвиттер-ионной форме, потому что она демонстрирует тот же тип проблемы термической стабильности.b. Натриевая кислая соль ABSD. Кристаллизацию натриевой кислой соли ABSD выполняли следующим образом. 271103 моль ABSD цвиттер-иона (безводного) добавляли к 271103 моль NaOH (только одна сульфоновая функциональная группа ABSD была при этом нейтрализована) и смесь растворяли в небольшом количестве воды (3 мл). Затем кристаллизацию инициировали добавлением по каплям антирастворителя(этанола) в большом избытке (30 мл). Для увеличения кристалличности твердого вещества применяли циклы созревания (фиг. 6). После фильтрации, твердое вещество анализировали с помощью XRPD (фиг. 7). Как видно из данного образца XRPD, была кристаллизована новая кристаллическая форма, которая должна представлять собой натриевую кислую соль ABSD.TGA-DSC-анализ (в сочетании с масс-спектроскопией) выполняли на данной кристаллической форме (фиг. 8). Данный анализ выявил потерю воды при приблизительно 35 С. Подобно динатриевой соли, данная кристаллическая форма не представляет собой интересную альтернативу цвиттер-ионной форме. с. L-Цистеинат. Кристаллизацию L-цистеината выполняли следующим образом. 271103 моль ABSD цвиттер-иона (безводного) добавляли к 542103 моль L-цистеина. Данную физическую смесь помещали в виде суспензии в 10 мл воды. После 24 ч перемешивания суспензию фильтровали и твердое вещество анализировали с помощью XRPD (фиг. 9). Маточный раствор медленно выпаривали и твердую фазу, полученную в результате данного выпаривания, также анализировали с помо-6 024460 щью XRPD (фиг. 9). Как видно из данного образца XRPD, была кристаллизована новая кристаллическая форма между ABSD и L-цистеином. Кристалличность твердого вещества, полученного с помощью фильтрации, оказалась плохой по сравнению с кристалличностью, полученной после медленного выпаривания. Оказалось, что данная кристаллическая форма нерастворима во многих растворителях, таких как вода, кетоны, спирты, диметилсульфоксид (DMSO) или хлороформ.TGA-DSC анализ в сочетании с масс-спектроскопией (MS) выполняли на данной кристаллической форме (фиг. 10). Данный анализ выявил потерю воды при приблизительно 74 С, а затем плавлениедеградацию при приблизительно 175 С. В связи с ее плохой растворимостью во многих растворителях (значительно ниже, чем у цвиттериона ABSD) данная новая кристаллическая форма не представляет собой интересную альтернативу цвиттер-ионной форме.d. Другие аминокислоты. Кристаллизация в растворе. Во время этих экспериментов молекулы аминокислот, выбранные из L-триптофана, L-серина, Dсерина, L-цистина, D-лизина, DL-лизина и L-аргинина, добавляли непосредственно к ABSD, в соответствии со стехиометрией (ABSD: аминокислота), равной 1:1 или 1:2. Затем физические смеси перемешивали при температуре окружающей среды или перекристаллизовывали из водного раствора. Никаких новых кристаллических форм не было получено с помощью L-триптофана, L-серина, D-серина, L-цистина илиD-лизина. С DL-лизином (рацемическим лизином) новое соединение могло существовать, но оно обладало высокой гигроскопичностью вплоть до расплывания, что препятствовало дальнейшему применению. С L-аргинином получали гель, независимо от способа кристаллизации. L-аргинин явно взаимодействовал с ABSD, поскольку растворимость смеси в воде была выше, чем растворимость одного ABSD,что свидетельствовало о формировании нового химического соединения. Тем не менее, L-аргининат может быть получен только в форме геля (вызывая такие критические проблемы, как способность к фильтрации и к высушиванию). НЕМ. Сухой или влажный (вода или этанол) помол применяли к физическим смесям молекул ABSD и аминокислот, выбранных из L-триптофана, L-серина и D-серина, L-цистина, L-валина, L-аргинина и Lглицина (со стехиометрией 1:1 или 1:2). Никакая оригинальная кристаллическая форма не была изолирована в ходе данных экспериментов. В заключении, L-валин, L-глицин, L-триптофан, серин (L или D), D-лизин и L-цистин не позволяют сформироваться кристаллической форме с ABSD. Кристаллическая форма DL-лизината не была изолирована. Кристаллическая форма L-аргинината не была изолирована. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма соединения (3S,3S') 4,4'-дисульфандиилбис(3-аминобутан 1 сульфокислоты) (ABSD) с L-лизином, где стехиометрия кристаллической формы равна ABSD.(Lлизин)2. 2. Кристаллическая форма по п.1, где дифракционная рентгенограмма кристаллической формы включает следующие пики: и где дифракционная рентгенограмма получена с помощью Cu K анода. 3. Кристаллическая форма по любому из пп.1, 2, в которой дифракционная рентгенограмма кристаллической формы такая, как показано на фиг. 2 а. 4. Способ получения кристаллической формы ABSD и L-лизина, включающий следующие стадии:(а) взаимодействие ABSD или его соли с L-лизином;(с) выделение кристаллической формы, полученной на стадии (а). 5. Способ по п.4, который дополнительно включает стадию (b) инициации формирования кристаллической фазы и/или улучшения кристалличности кристаллической фазы между стадиями (а) и (с). 6. Способ по п.4 или 5, где стехиометрия ABSD:L-лизин на стадии (а) находится в диапазоне примерно от 1:1,5 до 1:2,5. 7. Способ по п.4 или 5, где стадию (а) выполняют в растворе. 8. Способ по п.7, в котором ABSD и L-лизин суспендируют в воде. 9. Способ по п.4 или 5, где стадию (а) выполняют в твердой фазе предпочтительно с помощью высокоэнергетического размола. 10. Способ по п.7, где стадию (b) выполняют путем добавления антирастворителя, предпочтительно этанола. 11. Способ по любому из пп.4-10, где усовершенствование кристалличности на стадии (b) выполняют путем циклического изменения температуры. 12. Способ по п.11, где циклическое изменение температуры повторяют несколько раз. 13. Способ по п.12, где циклическое изменение температуры повторяют от 5 до 15 раз, предпочтительно 10 раз. 14. Фармацевтическая композиция для лечения гипертензии и/или связанных с ней заболеваний,содержащая кристаллическую форму по любому из пп.1-3 или кристаллическую форму, полученную способом по любому из пп.4-13, в комбинации с фармацевтически приемлемым носителем или разбавителем. 15. Применение фармацевтической композиции по п.14 в лечении гипертензии и/или связанных с ней заболеваний. 16. Применение по п.15, где заболевание представляет собой сердечную недостаточность.
МПК / Метки
МПК: A61K 31/145, C07C 229/26, C07C 323/66, A61P 9/12
Метки: l-лизином, 3s,3s, кристаллическая, форма, соединения, 4,4'-дисульфандиилбис(3-аминобутан-1-сульфокислоты
Код ссылки
<a href="https://eas.patents.su/11-24460-kristallicheskaya-forma-soedineniya-3s3s-44-disulfandiilbis3-aminobutan-1-sulfokisloty-s-l-lizinom.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическая форма соединения (3s,3s’) 4,4′-дисульфандиилбис(3-аминобутан-1-сульфокислоты) с l-лизином</a>
Предыдущий патент: Способ получения фармацевтической композиции на основе модафинила, полученная фармацевтическая композиция и ее применение
Следующий патент: Способ приготовления оксидно-полиметаллических катализаторов на основе жаропрочных сплавов для парциального окисления углеводородов в синтез-газ
Случайный патент: Способ и устройство для определения расхода текучей среды