Средство для предотвращения прогрессирования апоптотических изменений в клетках различных органов и их перехода в некротическое поражение
Номер патента: 14753
Опубликовано: 28.02.2011
Формула / Реферат
1. Лекарственное средство для предотвращения прогрессирования апоптотических и купирования некротических изменений в тканях организма, характеризующееся тем, что оно содержит 3-окси-6-метил-2-этилпиридин сукцинат, инозин и никотинамидадениндинуклеотид.
2. Лекарственное средство по п.1, характеризующееся тем, что оно содержит указанные компоненты при следующем соотношении, мг: 3-окси-6-метил-2-этилпиридин сукцинат от приблизительно 25 до приблизительно 1500, никотинамидадениндинуклеотид от приблизительно 0,5 до приблизительно 100, инозин от приблизительно 100 до приблизительно 1200.
3. Лекарственное средство по п.2, характеризующееся тем, что оно дополнительно содержит L-карнитин или его производное в количестве от приблизительно 10 до приблизительно 100 мг.
4. Лекарственное средство по п.3, характеризующееся тем, что в качестве производного L-карнитина оно содержит L-ацетилкарнитин.
5. Лекарственное средство по любому из пп.1-4, характеризующееся тем, что оно дополнительно содержит фармацевтически приемлемый носитель.
6. Лекарственное средство по п.5, характеризующееся тем, что оно выполнено в виде инъекционной лекарственной формы.
7. Лекарственное средство по п.6, характеризующееся тем, что оно находится в форме лиофилизата.
8. Лекарственное средство по п.6, характеризующееся тем, что оно выполнено в виде твердой лекарственной формы.
9. Лекарственное средство по п.8, характеризующееся тем, что оно выполнено в виде таблетки или таблетки с покрытием.
10. Лекарственное средство по п.8, характеризующееся тем, что оно выполнено в виде твердой капсулы.
11. Лекарственное средство по п.5, характеризующееся тем, что оно выполнено в виде суппозитория.
Текст
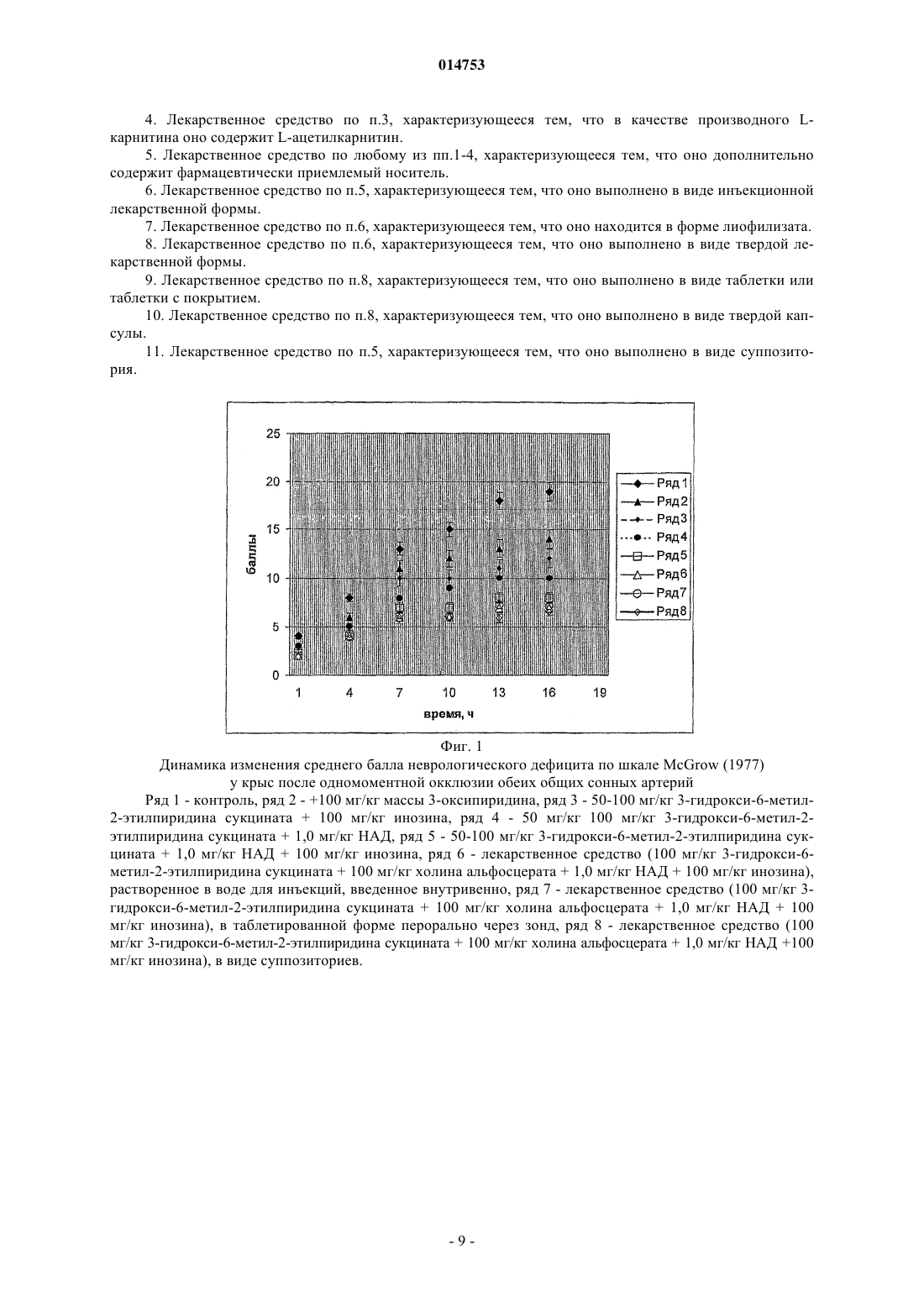
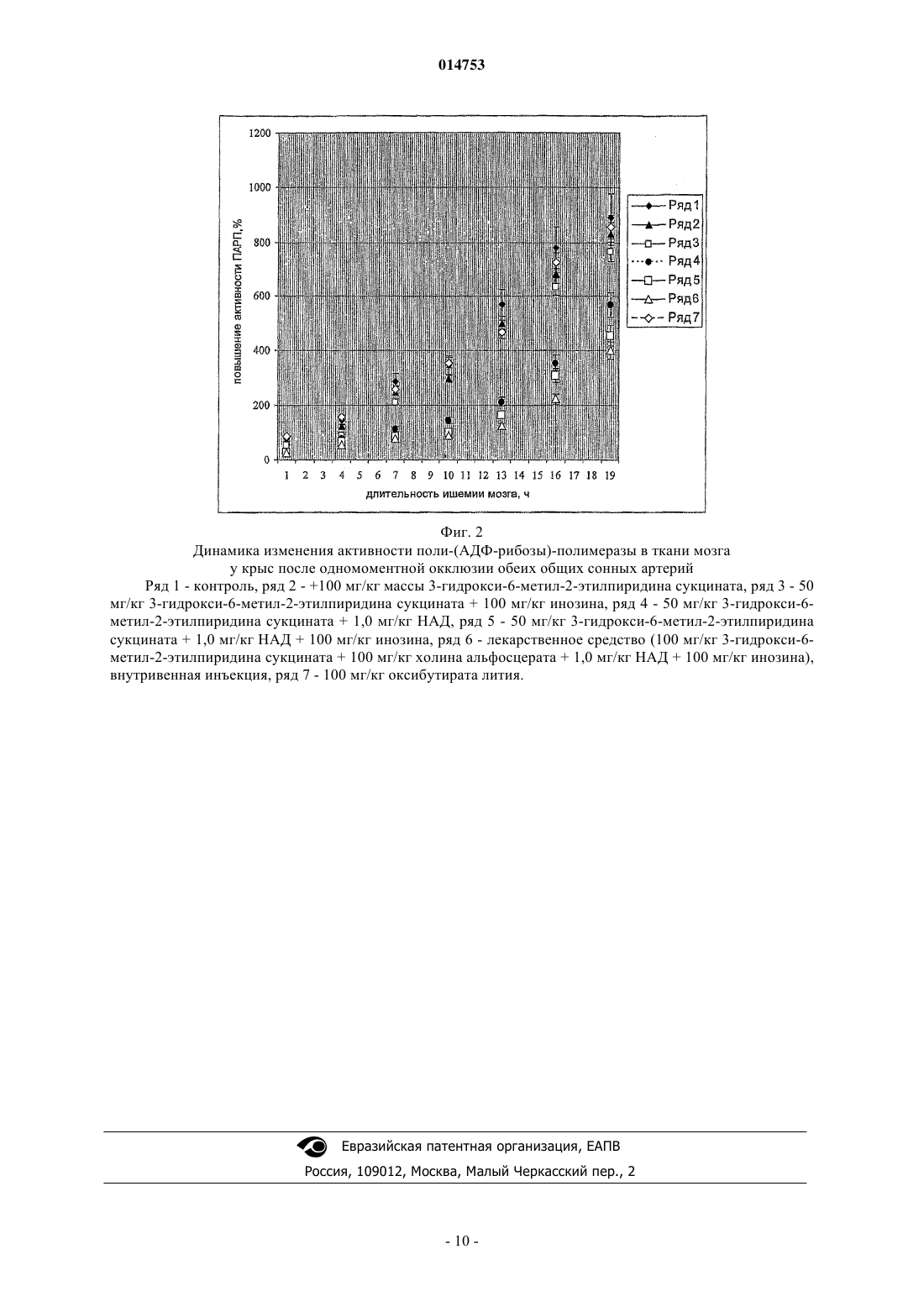
СРЕДСТВО ДЛЯ ПРЕДОТВРАЩЕНИЯ ПРОГРЕССИРОВАНИЯ АПОПТОТИЧЕСКИХ ИЗМЕНЕНИЙ В КЛЕТКАХ РАЗЛИЧНЫХ ОРГАНОВ И ИХ ПЕРЕХОДА В НЕКРОТИЧЕСКОЕ ПОРАЖЕНИЕ Лекарственное средство для предотвращения прогрессирования апоптотических и купирования некротических изменений в тканях организма. Изобретение относится к медицине, в частности к лекарственному средству для предотвращения прогрессирования (снижения скорости) апоптотических изменений в клетках различных органов и их перехода в некротическое поражение тканей. Средство содержит 3-окси-6-метил-2-этилпиридин сукцинат, инозин и никотинамидадениндинуклеотид. Лекарственное средство может дополнительно содержать L-карнитин или холина альфосцерат. Лекарственное средство может быть выполнено в инъекционной форме, в форме таблетки, капсулы или суппозитория. Лекарственное средство обладает широким спектром терапевтического действия, низкой токсичностью, позволяет устранять или минимизировать причины активации апоптотических изменений, уменьшать степень некротического поражения тканей при патологических процессах различной этиологии, замедлять процесс старения организма. Сукоян Галина Викторовна, Харебава Тенгиз Гивиевич (RU) 014753 Изобретение относится к медицине, конкретно к средствам, направленным на предотвращение прогрессирования апоптотических изменений в клетках различных органов и их перехода в некротическое поражение тканей при самых различных этиологически и патогенетически нетождественных патологических состояниях организма. Апоптоз, или программируемая клеточная гибель, впервые был описан J. Kerr и его сотрудниками в 1972 г. [1]. Этот процесс представляет собой эволюционно развитый физиологический в отличие от некроза механизм клеточной гибели, который регулирует клеточную массу и архитектуру многих тканей. Апоптотические процессы первоначально были определены как изменения, связанные с запрограммированной гибелью клеток и прежде всего характеризовали процесс старения организма в результате снижения синтеза энергии в организме. В последние годы считается, что ускорение апоптотических процессов характеризует такие различные патологические процессы, как тканевая деструкция и выраженная локальная или общая гипоксия, хроническое отравление, ишемические и реперфузионные повреждения,атеросклероз, артериальная гипертензия, острая и хроническая сердечная недостаточность независимо от этиологии [2, 3], МИЕЛАС синдром и другие типы митохондриальной недостаточности, деформирующий остеоартроз и ревматоидный артрит, гестоз у беременных, лучевая болезнь и другие заболевания,связанные с нарушениями экологии и токсическими поражениями. Активация апоптотических изменений, которые в случае сопряжения с прогрессированием гипоксически ишемических повреждений неминуемо переходят в некротические, ведет к гибели клеток, деструкции ишемизированных тканей, нарушению функций ЦНС, дыхательной недостаточности, снижению диуреза, рефрактерности к проводимой терапии, смерти. Так, например, было установлено, что гибель кардиомиоцитов при сердечной недостаточности увеличивается в 109 раз. Программируемая клеточная гибель участвует в постнатальном морфогенезе проводящей системы сердца: синусного и атриовентрикулярного узла, пучка Гиса; в развитии пароксизмальных аритмий и нарушений проводимости [4]. Апоптоз пейсмейкерных клеток может играть роль в генезе внезапной коронарной смерти. В настоящее время можно с определенной уверенностью утверждать, что основной вклад в суммарную клеточную гибель при атеросклерозе вносит апоптоз [5, 6]. Все клеточные элементы, обнаруживаемые в атеросклеротических бляшках, подвергаются программированной гибели [7]. Оказалось, что апоптотический индекс медиа нормальных коронарных сосудов равен 3+1%, в интиме - 8+1%. В атероме апоптотический индекс медиа статистически значимо не менялся(5+1%), в то время как в интиме он возрастал почти в 4 раза (34+5%) [8]. Следовательно, ингибирование апоптоза миоцитов и других клеток может быть ключевым механизмом превенции и купирования заболевания и представляет собой новую терапевтическую мишень в мультикомпонентной терапии перечисленных заболеваний, позволяющее значительно повысить выживаемость и качество жизни клетки, ткани,организма. Наиболее изученными являются апоптотические процессы при формировании коронарного атеросклероза, а в качестве препаратов, кандидатов на роль антигипоксических средств претендуют ингибиторы различных точек в каскадах апоптотических реакций (табл. 1). Таблица 1 Перечень основных ингибиторов апоптоза В настоящее время интенсивно изучается роль каспаз в процессах программированной клеточной гибели в условиях развития сердечной недостаточности. H. Yaoita и соавт. продемонстрировали, что ZVAD-fmk, общий ингибитор каспаз, способен ингибировать процессы апоптоза кардиомиоцитов и площадь инфаркта миокарда у крыс, подвергшихся реперфузии in vivo [8]. Ряд исследований свидетельствует об участии каспаз в процессе высвобождения цитохрома С при гипоксии и индукции апоптоза кардиомиоцитов [9, 10]. В недавно проведенных работах было показано повышение уровня каспаз и TNFa в кардиомиоцитах больных с сердечной недостаточностью, в том числе и при кардиомиопатиях. В настоящее время имеются фармакологические агенты, способные эффективно ингибировать апоптоз кардиомиоцитов, индуцированный различными стимулами: ишемией/реперфузией, H2O2, TNFa и др. Однако эти вещества (ZVAD-fmk, SB 203580, PD 98059, инсулиноподобный ростовой фактор, N-1 014753 ацетилцистеин) применяются в основном в экспериментальных условиях. В этой связи определенные перспективы связаны с дальнейшим клиническим исследованием карведилола (1-[9 Н-карбазол-4 илокси]-3-[(метоксифенокси)этил-2-пропанол). Препарат представляет собой (-блокатор нового поколения с выраженной антиоксидантной и умеренной сосудорасширяющей активностью. В проведенных клинических исследованиях карведилол продемонстрировал значительное снижение уровня смертности у больных с сердечной недостаточностью. Механизмом антиапоптотического действия препарата является подавление экспрессии Fas-рецептора на кардиомиоцитах [12]. Определенные перспективы в дальнейшей коррекции несостоятельности апоптоза при кардиопатологиях могут быть связаны с применением низкомолекулярных ингибиторов каспаз. В заключение надо сказать, что специфические антиапоптотические средства должны "работать" практически на всех уровнях процесса, поскольку существует некий единый механизм, контролирующий апоптоз всех клеток внутри органа или организма в целом, наличие единого универсального механизма,контролирующего апоптоз у клеток различной гистологической принадлежности. И этот механизм дает сбой при различных патологических процессах. Однако ни одно из перечисленных средств не предусматривает одновременного сбалансированного воздействия на различные звенья такого сложного универсального механизма, каким является апоптоз, и в результате не позволяет не только замедлить явление апоптоза, но и, что особенно важно, купировать его переход к некротизации ткани. Задачей изобретения является создание высокоэффективного средства, направленного на предотвращение прогрессирования апоптотических изменений и купирования некротических изменений в тканях организма при патологических процессах различной этиологии, обладающего низкой токсичностью и большой широтой терапевтического действия, позволяющего устранять (или минимизировать) причины активации апоптотических изменений, уменьшать глубину некротического поражения тканей при патологических процессах различной этиологии. Сущность изобретения состоит в создании лекарственного средства, содержащего 3-окси-6-метил 2-этилпиридин сукцинат, инозин и никотинамидадениндинуклеотид. Лекарственное средство характеризуется тем, что оно содержит указанные компоненты при следующем соотношении, мг: 3-окси-6-метил-2-этилпиридин сукцинат от приблизительно 25 до приблизительно 1500, никотинамидадениндинуклеотид от приблизительно 0,5 до приблизительно 100, инозин от приблизительно 100 до приблизительно 1200. Лекарственное средство характеризуется тем, что оно дополнительно содержит L-карнитин или его производное в количестве от приблизительно 10 до приблизительно 100 мг. Лекарственное средство характеризуется тем, что в качестве производного L-карнитина оно содержит L-ацетилкарнитин. Лекарственное средство характеризуется тем, что оно дополнительно содержит холина альфосцерат в количестве от приблизительно 50 до приблизительно 1000 мг. Лекарственное средство характеризуется тем, что оно дополнительно содержит фармацевтически приемлемый носитель. Лекарственное средство характеризуется тем, что оно выполнено в виде инъекционной лекарственной формы. Лекарственное средство характеризуется тем, что оно находится в форме лиофилизата. Лекарственное средство характеризуется тем, что оно выполнено в виде твердой лекарственной формы. Лекарственное средство характеризуется тем, что оно выполнено в виде таблетки или таблетки с покрытием. Лекарственное средство характеризуется тем, что оно выполнено в виде твердой капсулы. Лекарственное средство характеризуется тем, что оно выполнено в виде суппозитория. Использование изобретения позволяет получить следующий технический результат: разработанное средство является высокоэффективным, низкотоксичным средством, применение которого позволит купировать переход апоптотических процессов в некротические и/или ингибировать ускорение апоптоза,существенно повысить толерантность организма к физической нагрузке, время жизни на высоте и на больших глубинах, сокращать зону инфаркта(ишемии) миокарда, мозга, последствия постреперфузионных повреждений, эндо- и экзогенной интоксикации, сократить сроки и выживаемость больных при сердечной недостаточности, существенно снизить риск кардиохирургических, хирургических операций,создавать условия для хранения органов при трансплантации и подготовки к пересадке стволовых клеток. Технический эффект разработанной оригинальной комбинации достигается за счет устранения и/или уменьшения выраженности апоптоза и его перехода в некротическое поражение клетки, ткани,органа в результате синергизма действия ингредиентов, наличие которого описано в представленных примерах (см. пример 1-3). Впервые удалось получить эффект замедления апоптоза и купирования перехода апоптотических изменений в некротические комбинацией ингредиентов, для каждого из которых, кроме производных 3-2 014753 оксипиридина, ранее было показано наличие антиапоптотического действия, однако в медицинской практике ни один из них с этой целью не применялся. Производные 3-оксипиридина, в частности 3-окси-6-метил-2-этилпиридина сукцинат, обладают антигипоксическим действием и, по-видимому, являются "ловушкой" свободных радикалов, активных форм кислорода, играющих важную роль и в прогрессировании апоптотических процессов. Производные 3-оксипиридина влияют на регуляцию функционально-метаболической активности клеток прежде всего благодаря ингибированию свободно-радикального окисления мембран, влиянию на содержание биогенных аминов и энергетический обмен клеток. 3-Окси-6-метил-2-этилпиридина сукцинат стабилизирует биологические мембраны, повышает содержание полярных фракций глицерофосфолипидов, снижает соотношение холестерин/фосфолипиды и тем самым уменьшает вязкость липидного слоя. Важное значение имеет способность производных 3-оксипиридина ингибировать фосфодиэстеразную активность и повышать содержание циклических нуклеотидов, а также способность ингибировать в определенной степени синтез простагландинов и лейкотриенов. Поддержание уровня никотинамидадениндинуклеотида (НАД), входящего в состав разработанного средства, и редокс-потенциала НАД/НАДН является прямым ключевым механизмом ингибирования ускорения апоптотических процессов и их перехода в некротические изменения. Оказалось, что деструктивные изменения в ядре, запускаемые апоптозом, в результате активации поли-АДФ-рибозы полимеразы истощают уровень НАД, что и является тригерром некротической гибели клетки [11, 12]. Инозин, как и его предшественник гипоксантин и продукт его деградации аденозин, также способен дозозависимо ингибировать активацию поли-АДФ-рибозы полимеразы в макрофагах [13]. Кроме того, и НАД, и инозин, и 3-окси-6-метил-2-этилпиридина сукцинат восстанавливают различные звенья в системе энергетического обеспечения клетки, тем самым повышают использование кислорода на синтез АТФ в клетке с одной стороны и с другой, ингибируют образование свободных радикалов, которые сами по себе являются мощными индукторами апоптоза и некроза. Включение в комбинацию L-карнитина усиливает ингибирование ускорения апоптоза через поддержание стабильности митохондриальной мембраны, воздействие на метаболизм керамидов, ингибирование образования свободных радикалов и положительный эффект на повышение резервных возможностей иммунной системы. Антиапоптотический эффект L-карнитина и его производных показан как на моделях in vitro, так и in vivo [14, 15, 16, 17]. На основании этих свойств им усилена комбинация при ишемически реперфузионных, гипоксических и инфекционных поражениях сердца. Основной компонент холина альфосцеарата, холин, является важнейшим естественным ингредиентом живой клетки, играет особую роль в мозговой ткани человека. Холин является предшественником одного из важнейших нейротрансмиттеров ацетилхолина, одновременно выполняя роль донатора метальных групп, и структурным компонентом фосфолипидов. Дефицит холина также вызывает апоптоз как in vitro, так in toto [18, 19, 20], хотя механизм холина-дефицитного апоптоза остается неизвестным[21]. Учитывая важность восстановления холинергической регуляции при деструктивных процессах в мозге, холина альфосцерат включен в комбинацию при ишемических, гипоксических и других дегенеративных поражениях мозга. Таким образом, разработанное средство обладает направленным действием на различные звенья в сложной цепи апоптотических и некротических реакций, и в результате при низкой токсичности ингибирует ускорение апоптоза, купирует переход апоптотических процессов в некротические, существенно повышает толерантность организма к физической нагрузке, время жизни на высоте и на больших глубинах, сокращает зону инфаркта (ишемии) миокарда, мозга, последствия постреперфузионных повреждений, эндо- и экзогенной интоксикации, сокращает сроки и выживаемость больных при сердечной недостаточности, существенно снижает риск кардиохирургических, хирургических операций, создает условия для хранения органов при трансплантации и подготовки к пересадке стволовых клеток. Использованные в формуле количественные соотношения компонентов, включенных в препарат,отражают результат экспериментальных наблюдений, которые продемонстрировали, что выход за пределы представленных концентраций снижают синергическое действие ингредиентов и, как следствие, терапевтическую эффективность препарата. Новое средство предлагается к выпуску в стеклянных или пластиковых флаконах или ампулах, содержащих прозрачную жидкость или лиофилизированный порошок белого цвета (в последнем случае возможна комплектация растворителем), или в виде кишечнорастворимых и подъязычных таблеток белого цвета, а также суппозиториев, при следующем составе компонентов на 1 флакон-ампулу или таблетку или суппозиторий. Пример 1. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, мг: 3-окси-6-метил-2-этилпиридина сукцинат - 25,никотинамидадениндинуклеотид - 0,5,инозин - 100,затем тщательно перемешивают. Пример 2. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношени-3 014753 ях, мг: 3-окси-6-метил-2-этилпиридина сукцинат - 1500,никотинамидадениндинуклеотид - 10,инозин - 1200,затем тщательно перемешивают. Пример 3. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, мг: 3-окси-6-метил-2-этилпиридина сукцинат - 25,никотинамидадениндинуклеотид - 0,5. инозин - 100,L-карнитин - 10,затем тщательно перемешивают. Пример 4. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, мг: 3-окси-6-метил-2-этилпиридина сукцинат - 1500,никотинамидадениндинуклеотид - 10,инозин - 1200,L-карнитин - 100,затем тщательно перемешивают. Пример 5. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, мг: 3-окси-6-метил-2-этилпиридина сукцинат - 25,никотинамидадениндинуклеотид - 0,5. инозин - 100,холина альфосцеарат - 50,затем тщательно перемешивают. Пример 6. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, мг: 3-окси-6-метил-2-этилпиридина сукцинат - 1500,никотинамидадениндинуклеотид - 10,инозин - 1200,холина альфосцеарат - 1000,затем тщательно перемешивают. Средство для предотвращения прогрессирования апоптотических и купирования некротических изменений в тканях организма готовят в зависимости от вида лекарственной формы следующим образом. Для приготовления инъекционной формы смешивают в необходимых соотношениях ингредиенты,смесь разводят в предварительно очищенной воде, используемой в фармацевтической промышленности,добавляют вспомогательные вещества, пропускают через миллипоровые фильтры диаметром 22 мкм и далее разливают в ампулы или флаконы и проверяют на герметичность и стерильность. Возможен вариант лиофилизированной инъекционной формы (более стабильной), в этом случае препарат, разлитый в ампулы или флаконы, высушивают в специальных лиофильных сушках при низких температурах. Для приготовления лекарственного средства в виде твердой дозированной лекарственной формы, в частности кишечнорастворимых таблеток, приготовленную смесь прессуют в таблетки и покрывают желудочно-резистентной оболочкой (кишечнорастворимые таблетки), или прессованием гранул и частиц,предварительно покрытых желудочно-резистентной оболочкой или прессованием лекарственных веществ в смеси с желудочно-резистентным наполнителем (дурулы). При изготовлении таблеток для использования в полости рта делают непокрытые таблетки, полученные по специальной технологии с целью высвобождения лекарственного вещества или веществ в полости рта и обеспечения местного или общерезорбтивного действия (таблетки защечные, сублингвальные и др.). Возможно изготовление таблетированных форм с модифицированным высвобождением покрытые или непокрытые таблетки, содержащие специальные вспомогательные вещества или полученные по особой технологии, что позволяет программировать скорость или место высвобождения лекарственного вещества. В технологии изготовления используют вспомогательные вещества, разрешенные Фармакопеей СССР XI издания, предпочтительнее использовать технологии предварительного гранулирования ингредиентов (влажного гранулирования) при изготовлении лекарственной формы. При приготовлении лекарственного средства в форме суппозиториев (твердая дозированная лекарственная форма, состоящая из основы и лекарственных веществ, расплавляющаяся (растворяющаяся,распадающаяся) при температуре тела) используются основы, предусмотренные Фармакопеей СССР XI издания. Технологический процесс осуществляют в асептических условиях с выполнением контрольных исследований качества готовой лекарственной формы. Предлагаемое средство независимо от формы выпуска обладает высокой стабильностью.-4 014753 Лекарственное средство применяется больным с различными нозологиями, патогенетические механизмы развития которых включает гипоксический компонент и/или прогрессирование апоптоза и/или некротические изменения в зависимости от тяжести заболевания. Возможно применение в качестве адаптогенной терапии для профилактики развития органических изменений в различных органах у спортсменов, летчиков, подводников, у персонала, обслуживающего источники СВЧ, радио- и телекоммуникационные системы, часто болеющих детей и подростков. Однократная доза лекарственного средства содержит действующее начало, весовые соотношения ингредиентов в котором не выходят за следующие пределы: 3-окси-6-метил-2-этилпиридина сукцинат - 25-1500,никотинамидадениндинуклеотид - 0,5-100,инозин - 100-1200. Доза в зависимости от тяжести заболевания варьирует от однократного приема до 4 раз в сутки(каждые 6 ч). При ишемически реперфузионных, гипоксических и инфекционных поражениях сердца, осложненных и неосложненных сердечной недостаточностью, лекарственное средство применяется в лекарственной форме инъекций, таблеток или суппозиториев, действующее начало которых содержит L-карнитин или его производные при следующем соотношении компонентов, мг:L-карнитин или его производные - 10-100,2-этил-3-метилоксипиридина сукцинат - 25-1500,никотинамидадениндинуклеотид - 0,5-100,инозин - 100-1200. Доза в зависимости от тяжести заболевания варьирует от однократного приема до 4 раз в сутки(каждые 6 ч). При ишемических, гипоксических и других дегенеративных поражениях мозга лекарственное средство применяют в инъекционной, таблетированной форме или в виде суппозиториев, действующее начало которых содержит, мг: холина альфосцерат - 50-1000,3-окси-6-метил-2-этилпиридина сукцинат - 25-1500,никотинамидадениндинуклеотид - 0,5-100,инозин - 100-1200. Доза в зависимости от тяжести заболевания варьирует от однократного приема до 4 раз в сутки(каждые 6 ч). Об активности апоптоза судили по степени активности поли-(АДФ-рибозы)-полимеразы (ключевого фермента активации апоптотической гибели клеток), которую определяли с использованием тестнаборов Amersham Pharmacia Biotech. Глубину некротических повреждений кардиомиоцитов оценивали по количеству выхода миоглобина в кровь, содержание миоглобина измеряли спектрофотометрически. Пример 7. Острую гипобарическую гипоксию (как одно из наиболее адекватных методик для изучения состояний гипоксии) в сочетании с гиперкапнией моделировали путем "подъема" низкоустойчивых к гипоксии животных на критическую высоту 11500 м со скоростью около 1200 м/мин. Если время жизни на "высоте" превышало 10 мин, то моделирование гипоксии прекращали и животных относили к условно высокоустойчивым, а животных время жизни которых на "высоте" было меньше 10 мин, - к условно низкоустойчивым. В исследования брали только низкоустойчивых (НУ) к гипоксии животных. В ходе повторного эксперимента по подъему НУ животных на "высоту" - моделировании острой гипобарической гипоксии в сочетании с гиперкапнией регистрировали время потери позы (ВПП), время жизни время от окончания подъема на высоту до остановки дыхания либо появления первого атонального вдоха, время реституции (ВР) - от остановки дыхания до момента восстановления активной позы после спуска животного. Рассчитаны коэффициент устойчивости к гипоксии как отношение времени жизни к времени реституции, увеличение которого говорит о возрастании резистентности организма к действию экстремальной кислородной недостаточности. Исследуемые соединения вводили внутривенно (способ введения выбран как отражающий максимальный эффект препарата) за 15 мин до опыта. Разработанное средство также вводили внутривенно в форме инфузии, либо в таблетированной форме перорально, либо в виде суппозиториев. В норме в миокарде активность поли-(АДФ-рибозы)-полимеразы в миокарде равна 0,0350,006 пкмоль/мг белка, а в мозге 0,0300,004 пкмоль/мг белка. Как показало исследование, эффект разработанного средства не является простой суммой входящих в него ингредиентов - имеет место выраженный положительный синергизм ингредиентов по антиапоптотическому действию (сумма эффектов отдельных ингредиентов в тех же дозах дает эффект почти в два раза менее выраженный, чем в созданном лекарственном средстве). По степени выраженности эффекта при оптимальном соотношении ингредиентов в созданном лекарственном средстве независимо от его формы сила эффекта существенно не изменяется.-5 014753 Таблица 2 Активация апоптоза и состояние защитных систем организма при острой гипобарической гипоксии в сочетании с гиперкапнией Примечание: сравнение различий средних: - с нормой, - с контролем Пример 8. Купирование апоптоза при ишемии миокарда, развившейся на фоне артериальной гипертонии. Артериальную гипертензию нормотензивных крыс воспроизводили путем наложения лигатуры в виде титанового спиралевидного кольца на участок аорты с отходящими от нее артериями почек. Достигали сужения просвета аорты на 2/3 диаметра. Животных оперировали под наркозом и вскрывали брюшную полость. Артериальное давление измеряли путем использования датчика с резиновой манжеткой на хвосте животного. Сигнал от датчика регистрировали на мингографе ЕМТ 118. На 30 сутки после операции все животные были разделены на две группы: в первой группе животным была лигирована левая нисходящая межжелудочковая артерия в верхней ее трети - воспроизведена жесткая ишемия миокарда, а во второй - необратимая двусторонняя окклюзия общих сонных артерий шелковой нитью (см. пример 9). Операцию проводили стандартно, она занимала не более 7-10 мин, затем крысы быстро восстанавливались после наркоза. Животных подвергали эвтаназии на 10 сутки после операции в обеих группах. Все исследуемые соединения вводили внутривенно (способ введения выбран как отражающий максимальный эффект препарата) через 15 мин после перевязки коронарной артерии. Разработанное средство также вводили внутривенно в форме инфузии на 5% глюкозе, либо в таблетированной форме перорально, либо в виде суппозиториев. Таблица 3 Активация апоптоза и состояние защитных систем организма при остром инфаркте миокарда,развившегося на фоне артериальной гипертензии (через 6 ч после перевязки коронарной артерии)-7 014753 Защитное действие разработанного средства, независимо от способа введения, в экстремальных условиях, острой глубокой ишемии миокарда, показало ее значительное превосходство, выявило синергизм в действии входящих в него ингредиентов и в результате позволило перейти от трансмурального инфаркта миокарда до не угрожающего для жизни ишемического поражения мышцы сердца. Описанный положительный эффект не удается достичь ни препаратом 3-окси-6-метил-2-этилпиридина сукцинат, ни при его комбинации с каким-либо из ингредиентов в отдельности. Обращает на себя внимание тот факт,что резко сокращается отношение некротизируемой зоны к общей массе пораженного миокарда (зоны ишемии), что коррелирует с регистрируемым при этом резким снижением активности поли-(АДФрибозы)-полимеразы - маркера апоптоза (r 0,76, р 0,001). Это означает, что ингибирование апоптотического процесса и его перехода в некротические изменения под влиянием патентуемого средства купирует некротические изменения в миокарде и тем самым резко ограничивает зону некроза миокарда, значительно уменьшает степень выраженности аритмий. Пример 9. Купирование апоптоза при ишемии мозга, развившейся на фоне артериальной гипертонии. Воспроизведение патологии описано в примере 2. Неврологический дефицит оценивали "слепо" (без информации о распределении крыс по группам) через каждые 30 мин в течение 1 суток по шкалам балльной оценки C.P. McGrow (1977). По шкале C.P.McGrow (1977) Stroke Index возрастал с появлением отдельных признаков неврологического дефицита(неврологический балл изменялся от 0-1 (норма) до 20 (смерть. Основные признаки неврологического дефицита включали ограничение подвижности животного, птоз (одно- или двусторонний), кружение,гиперактивное поведение, вращательное, тонические и клонические судороги, кому со слабым болевым ответом или его отсутствием. Для статического анализа полученных данных по динамике неврологического дефицита использовали дисперсионный факторный анализ ANOVA. Для оценки летальности и отдельных неврологических проявлений применяли тест Фишера. В контрольной группе в первые 3 ч после окклюзии общих сонных артерий вращательные и клонические судороги зарегистрировали у 80% животных, а в подгруппе, получавшей 100 мг/кг массы животного, 3-окси-6-метил-2-этилпиридина сукцината + 100 мг/кг холина альфосцерата + 1,0 мг/кг НАД + 100 мг/кг инозина всего в 24% случаев. При оценке досуточной летальности необходимо отметить, что в контроле 50% летальность отмечалась в интервале до 8 ч, тогда как в подгруппах, леченных комбинированным средством 100 мг/кг 3-окси-6-метил-2-этилпиридина сукцината + 100 мг/кг холина альфосцерата + 1,0 мг/кг НАД + 100 мг/кг инозина и 100 мг/кг 3-окси-6-метил-2-этилпиридина сукцината + 1,0 мг/кг НАД + 100 мг/кг инозина в интервале до 8 ч ни одного летального исхода не зарегистрировано. Оценка летальности к концу первых суток после глобальной ишемии мозга показала 100% гибель в первой подгруппе, 85% во второй подгруппе, 70 и 68% в 3-1 и 4 подгруппах соответственно и 50 и 45% - в 5 и 6 подгруппах соответственно. Средняя продолжительность жизни в 1 подгруппе составила 8,71,7 ч, во 2 12,21,5 ч (р 0,05), в 3 - 14,52,1 ч (р 0,03), в 4 - 14,21,9 (р 0,01), в 5 - 18,31,4 (р 0,002), в 6 - 23,92,3 ч (р 0,001). Следует отметить, что к концу первых суток средний балл по шкале McGrow (1977) у контрольных животных на 11 пунктов выше, чем под воздействием разработанного средства 100 мг/кг 3 окси-6-метил-2-этилпиридина сукцината + 100 мг/кг холина альфосцерата + 1,0 мг/кг НАД + 100 мг/кг инозина. Полученные результаты позволяют заключить, что разработанная комбинация обладает выраженной способностью повышать выживаемость животных при глобальной ишемии мозга и значительно уменьшать выраженность неврологического дефицита при сравнении с контрольной группой (фиг. 1). В основе положительного эффекта созданного лекарственного средства независимо от способа введения лежит его способность в существенно большей степени ингибировать активность поли-(АДФрибозы)-полимеразы и тем самым развитие апоптотической и некротической гибели клеток мозга (фиг. 2). Особо обращает внимание, что на фоне введения разработанной комбинации уменьшение неврологического дефицита сопровождается купированием повышения активности фермента в течение первых суток, тогда как все препараты сравнения оказывают благоприятный эффект только в первые 6 ч после лигирования общих сонных артерий. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лекарственное средство для предотвращения прогрессирования апоптотических и купирования некротических изменений в тканях организма, характеризующееся тем, что оно содержит 3-окси-6 метил-2-этилпиридин сукцинат, инозин и никотинамидадениндинуклеотид. 2. Лекарственное средство по п.1, характеризующееся тем, что оно содержит указанные компоненты при следующем соотношении, мг: 3-окси-6-метил-2-этилпиридин сукцинат от приблизительно 25 до приблизительно 1500, никотинамидадениндинуклеотид от приблизительно 0,5 до приблизительно 100,инозин от приблизительно 100 до приблизительно 1200. 3. Лекарственное средство по п.2, характеризующееся тем, что оно дополнительно содержит Lкарнитин или его производное в количестве от приблизительно 10 до приблизительно 100 мг.-8 014753 4. Лекарственное средство по п.3, характеризующееся тем, что в качестве производного Lкарнитина оно содержит L-ацетилкарнитин. 5. Лекарственное средство по любому из пп.1-4, характеризующееся тем, что оно дополнительно содержит фармацевтически приемлемый носитель. 6. Лекарственное средство по п.5, характеризующееся тем, что оно выполнено в виде инъекционной лекарственной формы. 7. Лекарственное средство по п.6, характеризующееся тем, что оно находится в форме лиофилизата. 8. Лекарственное средство по п.6, характеризующееся тем, что оно выполнено в виде твердой лекарственной формы. 9. Лекарственное средство по п.8, характеризующееся тем, что оно выполнено в виде таблетки или таблетки с покрытием. 10. Лекарственное средство по п.8, характеризующееся тем, что оно выполнено в виде твердой капсулы. 11. Лекарственное средство по п.5, характеризующееся тем, что оно выполнено в виде суппозитория. Фиг. 1 Динамика изменения среднего балла неврологического дефицита по шкале McGrow (1977) у крыс после одномоментной окклюзии обеих общих сонных артерий Ряд 1 - контроль, ряд 2 - +100 мг/кг массы 3-оксипиридина, ряд 3 - 50-100 мг/кг 3-гидрокси-6-метил 2-этилпиридина сукцината + 100 мг/кг инозина, ряд 4 - 50 мг/кг 100 мг/кг 3-гидрокси-6-метил-2 этилпиридина сукцината + 1,0 мг/кг НАД, ряд 5 - 50-100 мг/кг 3-гидрокси-6-метил-2-этилпиридина сукцината + 1,0 мг/кг НАД + 100 мг/кг инозина, ряд 6 - лекарственное средство (100 мг/кг 3-гидрокси-6 метил-2-этилпиридина сукцината + 100 мг/кг холина альфосцерата + 1,0 мг/кг НАД + 100 мг/кг инозина),растворенное в воде для инъекций, введенное внутривенно, ряд 7 - лекарственное средство (100 мг/кг 3 гидрокси-6-метил-2-этилпиридина сукцината + 100 мг/кг холина альфосцерата + 1,0 мг/кг НАД + 100 мг/кг инозина), в таблетированной форме перорально через зонд, ряд 8 - лекарственное средство (100 мг/кг 3-гидрокси-6-метил-2-этилпиридина сукцината + 100 мг/кг холина альфосцерата + 1,0 мг/кг НАД +100 мг/кг инозина), в виде суппозиториев. Фиг. 2 Динамика изменения активности поли-(АДФ-рибозы)-полимеразы в ткани мозга у крыс после одномоментной окклюзии обеих общих сонных артерий Ряд 1 - контроль, ряд 2 - +100 мг/кг массы 3-гидрокси-6-метил-2-этилпиридина сукцината, ряд 3 - 50 мг/кг 3-гидрокси-6-метил-2-этилпиридина сукцината + 100 мг/кг инозина, ряд 4 - 50 мг/кг 3-гидрокси-6 метил-2-этилпиридина сукцината + 1,0 мг/кг НАД, ряд 5 - 50 мг/кг 3-гидрокси-6-метил-2-этилпиридина сукцината + 1,0 мг/кг НАД + 100 мг/кг инозина, ряд 6 - лекарственное средство (100 мг/кг 3-гидрокси-6 метил-2-этилпиридина сукцината + 100 мг/кг холина альфосцерата + 1,0 мг/кг НАД + 100 мг/кг инозина),внутривенная инъекция, ряд 7 - 100 мг/кг оксибутирата лития.
МПК / Метки
МПК: A61K 31/708, A61P 43/00, A61K 9/00, A61P 9/10, A61K 31/4425, A61P 9/04, A61P 9/12, A61K 31/7084
Метки: изменений, органов, средство, различных, прогрессирования, поражение, апоптотических, перехода, предотвращения, некротическое, клетках
Код ссылки
<a href="https://eas.patents.su/11-14753-sredstvo-dlya-predotvrashheniya-progressirovaniya-apoptoticheskih-izmenenijj-v-kletkah-razlichnyh-organov-i-ih-perehoda-v-nekroticheskoe-porazhenie.html" rel="bookmark" title="База патентов Евразийского Союза">Средство для предотвращения прогрессирования апоптотических изменений в клетках различных органов и их перехода в некротическое поражение</a>
Предыдущий патент: Способ и композиция для лечения ринита
Следующий патент: Новые соединения-аналоги камптотецина, способ их получения и фармацевтические композиции, которые их содержат
Случайный патент: Устройство для подачи эластичной нити