Способ и композиция для лечения ринита
Формула / Реферат
1. Гомогенная фармацевтическая композиция для лечения ринита путем интраназального или внутриглазного введения, включающая цвиттерионный цетиризин, полярную липидную липосому и фармацевтически приемлемый водный носитель, характеризующаяся тем, что цетиризин распределен по всей композиции в практически одинаковой концентрации в водной среде, независимо от того, располагается среда внутри или снаружи липосомальных структур.
2. Композиция по п.1, дополнительно включающая фармацевтически приемлемый буфер, способный обеспечить рН от приблизительно 4 до приблизительно 8.
3. Композиция по п.2, в которой интервал рН составляет от приблизительно 5 до приблизительно 7.
4. Композиция по п.2 или 3, в которой буфер является фосфатным, цитратным или ацетатным буфером.
5. Композиция по п.4, в которой буфером является двузамещенный натрийфосфат, двузамещенный калийфосфат, однозамещенный натрийфосфат, однозамещенный калийфосфат, фосфоновая кислота со щелочью, цитрат натрия, лимонная кислота со щелочью, ацетат натрия или уксусная кислота со щелочью.
6. Композиция по любому из пп.2-5, в которой количество буфера находится в пределах от приблизительно 1 до приблизительно 30 мг/мл.
7. Композиция по любому из пп.1-6, в которой цетиризин находится в форме соли.
8. Композиция по п.7, в которой соль является хлоридом, гидрохлоридом или солью азотной кислоты.
9. Композиция по п.8, в которой соль является цетиризин динитратом.
10. Композиция по п.8, в которой соль является гидрохлоридом.
11. Композиция по любому из пп.1-10, в которой количество цетиризина или соли, примененной при приготовлении композиции, составляет от приблизительно 1 до приблизительно 30 мг/мл в расчете на цвиттерионную форму.
12. Композиция по п.11, в которой количество составляет от приблизительно 5,5 до приблизительно 22 мг/мл.
13. Композиция по любому из пп.1-12, в которой полярный липид имеет природное происхождение, синтетическое/полусинтетическое происхождение или содержит смесь из них двух.
14. Композиция по любому из пп.1-13, в которой полярный липид включает или содержит фосфолипид или смесь фосфолипидов.
15. Композиция по п.14, в которой фосфолипид включает фосфолипид на основе фосфатидилхолина, фосфатидилглицерина, фосфатидилинозита, фосфатидной кислоты, фосфатидилсерина или их смесей.
16. Композиция по п.14 или 15, в которой фосфолипид включает фосфолипид, отвечающий общей формуле I
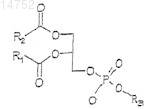
где R1и R2 независимо обозначают насыщенную или ненасыщенную, разветвленную или неразветвленную алкильную цепь с 7-23 атомами углерода и
R3 обозначает амидную или сложноэфирную связывающую группу.
17. Композиция по п.16, в которой амидная или сложноэфирная связывающая группа является -СН2-СН(ОН)-СН2ОН-группой, -CH2-CH2-N(CH3)3-группой, -CH2-CH2-NH2-группой, атомом водорода или -CH2-CH(NH2)-COOH-группой.
18. Композиция по любому из пп.12-17, в которой фосфолипид включает мембранный липид, полученный из соевых бобов.
19. Композиция по п.18, в которой фосфолипид включает Lipoid S75, Lipoid S100 и/или Lipoid S75-3N.
20. Композиция по любому из пп.14-19, в которой фосфолипид включает дилаурилфосфатидилхолин, димиристолфосфатидилхолин, дипальмитоилфосфатидилхолин, дилаурилфосфатидилглицерин, димиристолфосфатидилглицерин, диолеоилфосфатидилхолин или диолеоилфосфатидилглицерин.
21. Композиция по любому из пп.1-13, в которой полярный липид включает или состоит из гликолипида или смеси гликолипидов.
22. Композиция по п.21, в которой гликолипид включает гликоглицеролипид.
23. Композиция по п.22, в которой гликоглицеролипид включает галактоглицеролипид.
24. Композиция по п.22, в которой гликоглицеролипид включает дигалактозилдиацилглицерин общей формулы II
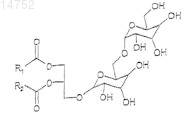
где R1и R2 такие, как определено в п.16.
25. Композиция по любому из пп.21-24, в которой гликолипид включает дигалактозилдиацилглицерин.
26. Композиция по п.21, в которой гликолипид включает гликосфинголипид.
27. Композиция по п.26, в которой гликосфинголипид включает моногликозилсфингоид, олигогликозилсфингоид, олигогликозилцерамид, моногликозилцерамид, сиалогликосфинголипид, уроногликосфинголипид, сульфогликосфинголипид, фосфогликосфинголипид, фосфоногликосфинголипид, церамид, моногексозилцерамид, дигексозилцерамид, сфингомиелин, лизосфингомиелин, сфингозин или их смесь.
28. Композиция по п.27, в которой гликосфинголипид включает сфингомиелин или продукт, полученный из него.
29. Композиция по п.21, в которой гликолипид включает гликофосфатидилинозит.
30. Композиция по любому из предшествующих пунктов, в которой количество применяемой полярной липидной субстанции находится в пределах от приблизительно 10 до приблизительно 120 мг/мл.
31. Композиция по любому из пп.1-20 или 30, в которой количество фосфолипида составляет от приблизительно 17 до приблизительно 70 мг/мл.
32. Композиция по п.31, в которой количество фосфолипида составляет от приблизительно 20 до приблизительно 40 мг/мл.
33. Композиция по любому из пп.1-32, которая дополнительно включает антиоксидант.
34. Композиция по п.33, в которой антиоксидантом является a-токоферол, аскорбиновая кислота, бутилированный гидроксианизол, бутилированный гидрокситолуол, лимонная кислота, фумаровая кислота, яблочная кислота, монотиоглицерин, пропионовая кислота, пропилгаллат, аскорбат натрия, бисульфит натрия, метабисульфит натрия, метабисульфит калия, сульфит натрия, винная кислота и/или витамин Е.
35. Композиция по любому из предшествующих пунктов, которая дополнительно включает хелатообразователь.
36. Композиция по п.35, в которой хелатообразователь является этилендиаминтетрауксусной кислотой, этилендиаминтриуксусной кислотой и/или диэтилентриаминпентауксусной кислотой.
37. Композиция по любому из пп.1-36, дополнительно включающая консервант.
38. Композиция по п.37, в которой консервантом является бензалконийхлорид, бензойная кислота, бутилированный гидроксианизол, бутилпарабен, хлорбутанол, этилпарабен, метилпарабен, пропилпарабен, феноксиэтанол и/или фенилэтиловый спирт.
39. Композиция по любому из пп.1-38, дополнительно включающая увеличивающий вязкость агент.
40. Композиция по п.39, в которой увеличивающий вязкость агент является полиэтиленгликолем, поперечно-сшитым поливинилпирролидоном и/или гидроксипропилметилцеллюлозой.
41. Композиция по любому из пп.1-40, в которой диаметр липосом составляет менее 200 нм.
42. Композиция по п.41, в которой диаметр составляет от приблизительно 40 до приблизительно 100 нм.
43. Способ получения композиции по любому из пп.1-42, включающий:
(а) прибавление полярного липида или смеси полярных липидов, который(е) при перемешивании способен(ны) набухать в водной среде до водного раствора цетиризина, и
(б) гомогенизацию состава.
44. Способ по п.43, в котором перед стадией гомогенизации рН доводят до нужной величины прибавлением кислоты или основания.
45. Способ по п.43 или 44, в котором перед стадией гомогенизации к составу прибавляют воду, солевой раствор или буферный раствор с получением нужного окончательного объема серии.
46. Способ по п.45 (как зависимый от п.44), в котором прибавление воды, солевого раствора или буфера имеет место после стадии доведения рН.
47. Способ по любому из пп.43-46, в котором по меньшей мере один из растворов/жидкостей продувают азотом и/или аргоном.
48. Способ по любому из пп.43-47, в котором водный раствор цетиризина образуют или прибавлением буфера к водному раствору цетиризина или его соли, или прибавлением цетиризина или его соли к водному буферному раствору перед прибавлением липида.
49. Способ по любому из пп.43-48, в котором при применении смеси полярных липидов ее предварительно обрабатывают органическим растворителем.
50. Способ по любому из пп.43-49, в котором стадия гомогенизации (б) включает энергичное механическое перемешивание, высокоскоростную гомогенизацию, встряхивание, вихреобразное движение и/или вращение.
51. Способ по любому из пп.43-50, включающий дополнительную стадию уменьшения размера липосом.
52. Способ по п.51, в котором стадия уменьшения размера включает экструзию через мембранный фильтр.
53. Способ по любому из пп.43-49, 51 или 52, в которой стадия гомогенизации и/или стадия уменьшения размера включает гомогенизацию при высоком давлении.
54. Композиция по любому из пп.1-42 для применения в медицине.
55. Способ лечения ринита, включающий введение композиции по любому из пп.1-42 человеку, страдающему от данного заболевания или восприимчивого к нему.
56. Способ по п.55, в котором введение выполняют интраназально.
57. Способ по п.55, в котором осуществляют внутриглазное введение.
58. Применение композиции по любому из пп.1-42 для производства медикамента для лечения ринита, причем лечение включает введение такой композиции человеку, страдающему от данного заболевания или восприимчивого к нему.
59. Применение по п.58, в котором введение является интраназальным.
60. Применение по п.58, в котором осуществляют внутриглазное введение.
Текст
СПОСОБ И КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РИНИТА Предлагаются фармацевтические композиции для лечения ринита, например, с помощью назального или глазного введения, включающие цвиттерионный цетиризин, полярную липидную липосому и фармацевтический приемлемый водный носитель. Композиции по своей природе предпочтительно являются гомогенными. 014752 Область изобретения Данное изобретение относится к способу лечения ринита и к соответствующей фармацевтической композиции. Уровень техники Аллергический и неаллергический риниты являются общими расстройствами, поражающими около 30% населения. Ринит оказывает значительное влияние на качество жизни. Фактически, считается, что ринит оказывает большее влияние на качество жизни, чем, например, астма. Поллиноз и сохраняющийся круглый год аллергический ринит характеризуются чиханием, ринореей, назальным застоем, зудом, конъюнктивитом и фарингитом. При круглогодичном рините часто заметна хроническая назальная закупорка и может распространяться на закупорку евстахиевой (слуховой) трубы. Пероральные или локальные антигистаминные препараты представляют первое направление в лечении, назальные стероиды - второе направление в лечении ринита. Для большинства больных местные кортикостероиды и антигистаминные препараты длительного действия обеспечивают значительное ослабление симптомов. Антигистаминные препараты могут также воздействовать на неиммунологически(non-IgE, не-IgE) опосредованные аллергические реакции, такие как неаллергический ринит, астма, вызванная физической нагрузкой, холодовая крапивница и неспецифическая бронхиальная повышенная реактивность. Цетиризин дигидрохлорид - [2-4-[(4-хлорфенил)фенилметил]-1-пиперазинилэтокси]уксусная кислота - является перорально и локально активным, сильно и длительно действующим антагонистом периферических H1 гистаминовых рецепторов. Цетиризин является одним из наиболее широкоприменяемых антигистаминных препаратов второго поколения для лечения риноконъюнктивита и крапивницы. Он эффективен, хорошо переносим и безопасен при пероральном применении в дозе 10 мг ежедневно. Однако при лечении больных перорально в качестве побочных действий наблюдаются седативный эффект и ксеростомия. Цетиризин также одобрен для лечения ринита у детей. Главные клинические воздействия антигистаминных препаратов заключаются в уменьшенном чихании и ринорее. Однако к уменьшению назальной блокировки они по-видимому менее чувствительны. Локальное введение антигистаминных препаратов (таких как азеластин и левокабастин) имеет преимущества, включая быстрое наступление эффекта и меньшие побочные действия. Однако в настоящее время цетиризин дигидрохлорид не является одобренным лекарственным препаратом для локального применения, хотя он вводился таким способом в клинических исследованиях. В одном из исследований (Francillon С, Pecoud A. Effect of nasal spray of cetirizine in a nasal provocation test with allergen. J. Allergy Clin. Immunol. 1993:91, Suppl. 2:258 (abstract было найдено, что назальный аэрозоль цетиризина уменьшает симптомы и увеличивает максимальную скорость истечения из носа после введения аллергена. Кроме того, при астме, вызванной физической нагрузкой, хороший защитный эффект наблюдался, когда аэрозоль цетиризина вводили в легкое с помощью распылителя (Ghosh S.K.,De Vos С., Mcllroy I., Patel K.R. Effect of cetirizine on exercise induced asthma, Thorax 1991 Apr; 46 (4) 242-4). Наблюдалось некоторое влияние на симптомы, когда цетиризин (предположительно в виде дигидрохлорида) давали в виде назального аэрозоля больным с сохраняющимся круглый год аллергическим ринитом. Концентрации в 0,625, 1,25 и 2,5 мг/мл цетиризина впрыскивали три раза в день в течение двух недель (Clement P., Roovers M.H., Francillon С., Dodion P. Dose-ranging, placebo-controlled study of cetirizine nasal spray in adults with perennial allergic rhinitis, Allergy 1994 Sep; 49 (8), 668-72). Наиболее общие побочные эффекты относились к назальным случаям, хотя не наблюдалось различия в сфере действия между группами, которых лечили плацебо или цетиризином. Однако авторы в этой публикации сделали предположение, что местное раздражение имело отрицательное действие на эффективность лечения. Действительно, было найдено, что вследствие раздражения слизистой оболочки носа цетиризином,необходимо уменьшить немедленное действие его при введении в нос. В европейском патенте ЕР 605203 В 1 сообщалось, что это может достигаться при использовании цетиризина в форме композиции,содержащей циклодекстрин. Липосомы (также известные как липидные везикулы) являются коллоидными частицами, которые получаются из полярных липидных молекул, полученных или из природных источников, или химическим синтезом. Такие сферические закрытые структуры, составленные из изогнутых липидных бислоев,обычно применяются для включения (вовлечения) лекарственных препаратов, которые часто цитотоксичны, для того, чтобы уменьшить токсичность и/или увеличить эффективность. Лекарственные препараты, включенные в липосомы, часто готовятся в сухой (например, лиофилизированной) форме, которая впоследствии переводится в другую с водным раствором непосредственно перед введением. Это делается для того, чтобы свести к минимуму возможность утечки, например, цитотоксичного препарата в водный раствор и, тем самым, уменьшить эффект включения в липосомы. Липосомы также применялись для инкапсулирования различных лекарственных соединений для назальной доставки, чтобы улучшить биодоступность, или в качестве адъювантов. Лекарственные препараты, на которые можно ссылаться, включают противостолбнячную токсоидную вакцину, инсулин,десмопрессин и дифенгидрамин гидрохлорид (см. Turker et al., Review Article: Nasal Route and Drug De-1 014752livery Systems, Pharm. World Sci., 2004: 26, 137-142 и упомянутые в данной публикации ссылки), а также ципрофлоксацин, СМЗ и сальбутамол (см. Desai et al., A Facile Method of Delivery of Liposomes by Nebulization, J. Control. Release, 2002; 84, 69-78). Цетиризин, включенный в липосомы, также вводили локально, чтобы оценить периферическую антигистаминную активность и системную абсорбцию в модели на кроликах (Elzainy et al., Cetirizine fromTopical Phosphatidylcholine-Hydrogenated Liposomes, The AAPS Journal, 2004; 6, 1-7. См. также Drug Development and Industrial Pharmacy, 2005; 31, 281-291). Было также изучено липофильное поведение катионных (где анион является хлорид-ионом) цвиттерионных и анионных форм цетиризина в буферных водных фосфатидилхолиновых липосомных системах, содержащих от приблизительно 1 до 33,5 мг/мл фосфолипида (Plemper van Balen G. et al., Lipophilicity behaviour of the zwitterionic antihistamine cetirizine in phosphatidylcholine liposomes/water systems,Pharm. Res. 2001; 18, 694-701). Цель исследования, в котором отдельные разбавленные PBS (phosphatebuffered saline, забуференный фосфатом физиологический раствор) растворы липосом, в состав которых входил яичный фосфатидилхолин, вливались в отдельные разделы ячеек для диализа, состояла в проникновении в сущность механизма взаимодействия различных электрозаряженных частиц цетиризина и других лекарственных препаратов с липосомальными мембранами. Цвиттерионная форма цетиризина, которая доминирует в интервале рН от приблизительно рН 4 до приблизительно рН 7 и даже от приблизительно рН 3 до приблизительно рН 8, рассматривалась авторами этой публикации в качестве препятствия для вхождения в липосомальную мембрану, делая более трудным образование липофильных сложенных конформеров цетиризина. В этом отношении цетиризин не включался в липосомальные мембраны для доставки лекарственного препарата больным. Насколько осведомлен заявитель, в предшествующем уровне техники отсутствует раскрытие или предложение гомогенной фармацевтической композиции, содержащей цвиттерионный цетиризин, полярную липидную липосому и фармацевтически приемлемый водный носитель. Неожиданно, нами было обнаружено, что раздражение, обычно сопровождаемое введением (например, назальным) цетиризина, можно уменьшить путем применения именно такой композиции. В изобретении предлагаются фармацевтические композиции, пригодные для лечения ринита, например, назальным или глазным введением, содержащие цвиттерионный цетиризин, полярную липидную липосому и фармацевтически приемлемый водный носитель; композиции в дальнейшем называются"композиции, описанные в изобретении". Специалистам будет понятно, что цвиттерионный цетиризин применяется в композициях, описанных в изобретении, в фармакологически эффективном количестве (см. ниже). Термин "фармакологически эффективное количество" относится к количеству цетиризина, которое способно оказывать нужный терапевтический эффект на больного, которого лечат, независимо от того, вводился ли он один или вместе с другим активным ингредиентом. Такой эффект может быть объективным (т.е. измеряемым с помощью некоторого теста или маркера) или субъективным (т.е. субъект указывает на эффект или ощущения). Под "фармацевтическими композициями" мы понимаем композиции, которые пригодны для применения при непосредственном введении млекопитающим и особенно людям. В этом отношении термин предполагает включение составов, которые содержат только компоненты, которые рассматриваются в данной области в качестве пригодных для введения млекопитающим и особенно людям. В контексте данного изобретения термин может также означать, что композиции, описанные в изобретении, находятся в жидкой форме, которая готова к применению непосредственно с полки, а не состав, в котором лекарственный препарат инкапсулирован внутри липосомы и требует перевода его в другую форму незадолго перед введением для того, чтобы избежать утечки лекарственного препарата из липосом в водный носитель. Композиции, описанные в изобретении, предпочтительно являются гомогенными. Под "гомогенными" мы понимаем, что не только композиции, описанные в изобретении, содержат липосомы, диспергированные равномерно по всему водному носителю, но к тому же, что активный ингредиент распределяется по всей композиций практически в подобной концентрации в соответствующей водной среде независимо от того, располагается среда внутри или снаружи липосомальных структур. Под "практически подобной" мы понимаем, что концентрация может изменяться на приблизительно 10% (при сравнении концентраций внутри и снаружи липосомальных структур) при комнатной температуре и атмосферном давлении. Профили концентраций лекарственного препарата можно измерить стандартными методами,известными специалисту, как, например, 31 Р-ЯМР. Например, может применяться стандартный способ зондирования in situ или способ, который включает отделение липосомальной фракции от свободного водного носителя и измерение количества/концентрации лекарственного препарата, связанного с каждой фракцией. Отделение может достигаться центрифугированием, диализом, ультрафильтрацией или гельфильтрацией. Предпочтительно, если композиции, описанные в изобретении, дополнительно включают фармацевтически приемлемый буфер, способный обеспечить рН от приблизительно рН 4 (например, 4,0) до приблизительно рН 8 (например, 8,0), предпочтительно от приблизительно рН 5 (например, 5,0) до при-2 014752 близительно рН 7 (например, 7,0). Соответствующие буферы включают такие, которые не мешают образованию липосом, такие как фосфатный (например, динатрийфосфат, дикалийфосфат, мононатрийфосфат, монокалия фосфат или фосфорная кислота плюс основание), цитратный (например, цитрат натрия или лимонная кислота плюс основание) или ацетатный буфер (например, ацетат натрия или уксусная кислота плюс основание), которые способны поддержать рН в выше обозначенных интервалах. Буферы могут применяться в количестве, которое пригодно для обеспечения вышеупомянутых эффектов и, таким образом, будет понятно специалисту без обращения за помощью к изобретательской идее. Соответствующие количества находятся, например, в пределах от приблизительно 1 мг/мл до приблизительно 30 мг/мл. Любая фармацевтически приемлемая соль цетиризина, а также цетиризин в форме свободного основания может применяться в производстве композиций, описанных в изобретении. Предпочтительные соли включают хлориды, гидрохлориды (например, дигидрохлориды) и в особенности азотнокислые соли цетиризина, наиболее предпочтительно цетиризин динитрат. Количество цетиризина или его соли, которое может применяться при получении композиций, описанных в изобретении, может определяться врачом или специалистом в отношении того, что будет наиболее пригодно для индивидуального больного. Это вероятно изменяется в зависимости от тяжести состояния, которое лечат, а также от вида, возраста, веса, пола, почечной функции, печеночной функции и реакции отдельного больного, которого лечат. Однако предпочтительно, чтобы композиции, описанные в изобретении, содержали цетиризин или его соль в количестве от приблизительно 1 до приблизительно 30 мг/мл (например, около 25, как, например, около 23 мг/мл) в пересчете на цвиттерионную форму предпочтительно в количестве от приблизительно 5,5 до приблизительно 22 мг/мл. Другой предпочтительный интервал составляет от приблизительно 6 до приблизительно 15 мг/мл, как, например, от приблизительно 8 до приблизительно 12 мг/мл. В таком случае общее количество активного ингредиента, которое может присутствовать, может быть достаточным для обеспечения дневной дозы лекарственного препарата, единичная доза которого находится в интервале от приблизительно 4 до приблизительно 20 мг, как, например, от приблизительно 5 до приблизительно 15 мг, более предпочтительно от приблизительно 7 до приблизительно 12 мг и наиболее предпочтительно от приблизительно 8 до приблизительно 10 мг. Специалисту понятно, что композиции, описанные в изобретении, могут назначаться один или несколько раз в день при одном или нескольких введениях для того, чтобы обеспечить вышеупомянутую дневную дозу. Вышеупомянутые дозы являются типичными для среднего случая; конечно, могут быть индивидуальные примеры, где применимы более высокие или более низкие интервалы доз, и они также находятся в пределах объема изобретения. Термин "липосома" будет понятен специалисту и включает структуру, состоящую из одной или нескольких концентрических сфер полярных липидных бислоев, разделенных водой или водными буферными пространствами. Липосомы можно приготовить различными способами с применением растворителей, пониженного давления, двухфазных систем, лиофилизации, ультразвука и т.д., описанных, например, в Liposome DragDelivery Systems, Betageri G.V. et al., Technomic Publishing AG, Basel, Switzerland, 1993, тем самым соответствующие описания в этот документ включены в виде ссылки. Термин "полярный липид" будет понятен специалисту и включает любой липид с группой полярных головок и двумя остатками жирных кислот, который способен образовать липосомы. Полярные липиды, такие как описаны в данном изобретении, могут быть природного и/или синтетического/полусинтетического происхождения. В композициях, описанных в изобретении, могут также применяться смеси природных и синтетических/полусинтетических полярных липидов. Полярные липиды, которые могут также применяться в композициях, описанных в изобретении, таким образом могут быть основаны, например, на фосфолипидах, и в особенности, фосфатидилхолине(phosphatidylcholine, PC), фосфатидилглицерине (phosphatidylglycerol, PG), фосфатидилинозите (phosphatidylinositol, PI), фосфатидной кислоте (phosphatidic acid, PA), фосфатидилсерине (phosphatidylserine,PS) или их смесях. Фосфолипиды, которые могут применяться в композициях, описанных в изобретении, содержат полярные и неполярные группы, связанные с остовом, включающим гидроксильные группы, как, например,глицерином. Фосфолипиды можно также представить общей формулой I где R1 и R2 независимо обозначают насыщенную или ненасыщенную (например, алкенильную группу) алкильную группу с прямой или разветвленной цепью с 7-23 атомами углерода, предпочтительно с 11-19 атомами углерода;R3 обозначает амидную или сложноэфирную связывающую группу, как, например, -СН 2-СН(ОН)СН 2 ОН (фосфатидилглицерин), -СН 2-СН 2-N(СН 3)3 (фосфатидилхолин), -CH2-CH2-NH2 (фосфатидилэтаноламин), -Н (фосфатидная кислота) или -CH2-CH(NH2)-COOH (фосфатидилсерин). Фосфолипид может быть природного происхождения. Природные фосфолипиды предпочтительно являются мембранными липидами, полученными из различных источников как растительного (например, рапс, подсолнечник и т.д. или предпочтительно соевые бобы) и животного происхождения (например, яичный желток, коровье молоко и т.д.). Фосфолипиды из соевых бобов, основного источника растительных фосфолипидов, обычно получают из побочных продуктов (т.е. лецитинов) при рафинировании неочищенного соевого масла с помощью способа рафинирования гидратацией. Лецитины далее подвергаются технологической обработке и очищаются с применением других физических операций, таких как фракционирование и/или хроматография. Можно получить другие фосфолипиды, например, путем отжима различных пригодных семян и зерен с последующей экстракцией растворителем и затем дополнительной обработкой, как описано выше. Фосфолипиды природного происхождения, которые могут упоминаться, включают, например, фосфолипиды, которые доступны под товарными знаками Lipoid S75,Lipoid S100 и Lipoid S75-3N (Lipoid GmbH, Germany), которые все являются смесями нескольких различных фосфолипидов, которые имеются в соевых бобах. Или же фосфолипид может быть синтетического или полусинтетического происхождения (т.е. полученный химическим синтезом). Например, может применяться многостадийный химический синтетический метод для того, чтобы получить основные фосфолипидные полупродукты - 1,2-диацилглицерин из (S)2-изопропилиденглицерина, последний обеспечивающий глицериновый остов, который характерен фосфолипидам. Далее можно получить 1,2-диацетилированные фосфолипиды, если соответствующая группа полярной головки присоединяется путем химического синтеза к 1,2-диацилглицериновому полупродукту. Однако обычно происхождение глицерина и жирных кислот, применяемых в различных стадиях, может быть как природное, так и синтетическое. Синтетические и/или полусинтетические фосфолипиды, которые могут упоминаться, включают дилаурилфосфатидилхолин (dilaurylphosphatidylcholine,DLPC), димиристолфосфатидилхолин (dimyristolphosphatidylcholine, DMPC), дипалмитоилфосфатидилхолин (dipalmitoylphosphatidylcholine, DPPC), дилаурилфосфатидилглицерин (dilaurylphosphatidylglycerol,DLPG), димиристолфосфатидилглицерин (dimyristolphosphatidylglycerol, DMPG), диолеоилфосфатидилхолин (dioleoylphosphatidylcholine, DOPC) и диолеоилфосфатидилглицерин (dioleoylphosphatidylglycerol,DOPG). Или же полярный липид может включать или более предпочтительно состоять из гликолипида. В контексте данного изобретения термин "гликолипид" обозначает соединение, содержащее один или несколько моносахаридных остатков, связанных гликозидной связью с гидрофобным остатком, таким как ацилглицерин, сфингоид или церамид (N-ацилсфингоид). Гликолипид может быть гликоглицеролипидом. В контексте данного изобретения термин "гликоглицеролипид" обозначает гликолипид, содержащий один или несколько остатков глицерина. Согласно предпочтительному аспекту изобретения гликоглицеролипид включает или состоит из галактоглицеролипида, более предпочтительно дигалактозилдиацилглицерина общей формулы II-4 014752 Или же гликолипид может быть гликосфинголипидом. В контексте данного изобретения термин"гликосфинголипид" обозначает липид, содержащий по меньшей мере один остаток моносахарида и/или сфингоид или церамид. Таким образом, термин может включать нейтральные гликосфинголипиды, такие как моно- и олигогликозилсфингоиды, а также олиго- и более предпочтительно моногликозилцерамиды. Термин дополнительно включает кислые гликосфинголипиды, такие как сиалогликосфинголипиды, уроногликосфинголипиды, сульфогликосфинголипиды, фосфогликосфинголипиды и фосфоногликосфинголипиды. Гликосфинголипид может быть церамидом, моногексозилцерамидом, дигексозилцерамидом,сфингомиелином, лизосфингомиелином, сфингозином или их смесью. Предпочтительно, когда гликосфинголипид является сфингомиелином или продуктами, полученными из них. Содержание сфингомиелина предпочтительно определяется с помощью хроматографических методов. Сфингомиелин можно экстрагировать из молока, предпочтительно коровьего молока, мозга, яичного желтка или эритроцитов из крови животного, предпочтительно овцы. Во избежании сомнения изобретение включает синтетические и полусинтетические сфинголипиды. Или же гликолипид может быть гликофосфатидилинозитом. В контексте данного изобретения термин "гликофосфатидилинозит" обозначает гликолипид, содержащий сахариды, связанные гликозильной связью с остатком инозита фосфатидилинозитов. Предпочтительные гликолипиды включают дигалактозилдиацилглицерин(digalactosyldiacylglycerol, DGDG). Предпочтительные полярные липиды (как, например, фосфолипиды) являются такими, которые набухают до определенной степени в воде, и/или те, которые способны к спонтанному образованию липосом. Если полярный (например, фосфо-) липид не набухает спонтанно в воде, специалисту будет ясно,что тем не менее можно получить липосомы путем прибавления более полярного, способного к набуханию (например, фосфо-) липида, как, например, анионный (например, фосфо-) липид (например, фосфатидилглицерин). Образование липосом может осуществляться при температуре выше приблизительно 0 С (например, при комнатной температуре), если температура фазового переноса ацильных цепей (таяние цепи; кристаллы от гелеобразного до жидкого состояния) ниже точки замерзания воды. Применяется какое угодно полярное липидное вещество (или его комбинация); соответствующие общие количества/концентрации липида(ов), которые могут применяться при приготовлении композиции, описанной в изобретении, находятся в интервале от приблизительно 10 до приблизительно 120 мг/мл. Композиции, описанные в изобретении, которые могут упоминаться, включают композиции, в которых, если полярный липид содержит фосфолипид (или в комбинации с другим липидом, или в других отношениях), количество фосфолипида(ов) в композиции составляет от приблизительно 10 (например, около 17, как, например, приблизительно 20) до приблизительно 120 мг/мл, более предпочтительно от приблизительно 25 (например, около 35) до приблизительно 100 (например, приблизительно 70, такое,как около 50, например, приблизительно 40) мг/мл. Композиции, описанные в изобретении, могут также включать антиоксидант, как, например, токоферол, аскорбиновую кислоту, бутилированный гидроксианизол, бутилированный гидрокситолуол,лимонную кислоту, фумаровую кислоту, яблочную кислоту, монотиоглицерин, пропионовую кислоту,пропилгаллат, аскорбат натрия, бисульфит натрия, метабисульфит натрия, метабисульфит калия, сульфит натрия, винную кислоту или витамин Е. Согласно изобретению может применяться хелатообразователь для уменьшения окисления фосфолипида и/или цетиризина, катализируемое ионом металла. Примерами пригодных хелатообразователей являются этилендиаминтетрауксусная кислота (ethylenediaminetetraacetic acid, EDTA), этилендиаминтриуксусная кислота (ethylenediaminetriacetic acid) и диэтилентриаминопентауксусная кислота (diethylenetriaminepentaacetic acid, DTPA). Также возможно применять другие агенты, которые предохраняют композицию, описанную в изобретении, и, особенно, любые остатки ненасыщенных жирных кислот, которые в ней могут присутствовать, от окисления. Композиция, описанная в изобретении, может включать один или несколько консервантов. Примерами обычных консервантов для жидких фармацевтических композиций являются бензалконийхлорид,бензойная кислота, бутилированный гидроксианизол, бутилпарабен, хлорбутанол, этилпарабен, метилпарабен, пропилпарабен, феноксиэтанол или фенилэтиловый спирт. Для того чтобы сохранить композицию, описанную в изобретении, в месте ее применения, она также может содержать увеличивающий вязкость агент, такой как, например, гидрофильные полимеры, подобные полиэтиленгликолю или поперечно-сшитому поливинилпирролидону, и/или производные целлюлозы, как, например, гидроксипропилметилцеллюлоза. Увеличивающие вязкость агенты также могут выполнять функцию в качестве защитных коллоидов для физической стабилизации композиции, описанной в изобретении, до ее введения. Композиции, описанные в изобретении, также могут включать ароматизаторы (например, лимон,ментол или мятный порошок) и/или подсластители (например, неогесперидин). Композиции, описанные в изобретении, также могут включать средства, модифицирующие тонич-5 014752 ность, такие как хлорид натрия, хлорид калия, глицерин, глюкоза, декстроза, сахароза, маннит и т.д. Возможные добавки, включая буферные средства, консерванты, увеличивающие вязкость агенты,антиоксиданты, средства, модифицирующие тоничность, и хелатообразователи, должны выбираться на основе их подлинности и применяемых количеств, имея при этом в виду, что их вредное воздействие на стабильность липосомы должно поддерживаться на минимуме. Для данного средства это может устанавливаться простыми экспериментами, которые понятны специалисту. Однако пригодные количества таких ингредиентов находятся в пределах от приблизительно 0,01 до приблизительно 10 мг/мл. Предлагается также способ получения композиций, описанных в изобретении. Неожиданно было найдено, что липосомы можно приготовить непосредственным набуханием полярных липидов в водной среде без прибавления каких-либо других наполнителей, как, например, заряженных липидов и/или поверхностно-активных веществ и т.д., которые обычно требуются в таких случаях. Согласно другому аспекту изобретения предлагается способ приготовления композиции, описанной в изобретении, который включает:(а) наличие полярного липида или смеси полярных липидов, которые способны набухать в водной среде;(б) наличие водного раствора цетиризина;(в) прибавление полярного липида или смеси к водному раствору при перемешивании, тем самым,образуя липосомный препарат цетиризина;(г) возможно доведение рН препарата до требуемой величины в интервале от приблизительно рН 4(например, 4,0) до приблизительно рН 8 (например, 8,0), предпочтительно от приблизительно рН 5 (например, 5,0) до приблизительно рН 7 (например, 7,0) прибавлением кислоты или основания (например,соляной кислоты и/или гидроокиси натрия при соответствующей концентрации (например, 1 М;(д) возможно прибавление буферного раствора или предпочтительнее воды или физиологического раствора к препарату с получением нужного объема конечной серии и(е) гомогенизацию препарата с получением фармацевтической композиции. Растворы/жидкости могут продуваться азотом или аргоном на соответствующей стадии вышеприведенного процесса, если и когда это уместно. В контексте данного изобретения липид должен быть набухаемым в водной среде, если при помещении в контакт с такой средой он набухает до заметной степени. Буферы предпочтительно могут прибавляться к водному раствору лекарственного препарата (и/или лекарственный препарат может прибавляться к водному буферному раствору) перед прибавлением липида. Несмотря на это, специалист будет отдавать себе полный отчет в присущем буферном эффекте цвиттерионного цетиризина. Образование липосом, описанных в изобретении, можно облегчить с помощью спонтанного набухания полярного липида в воде с образованием многослойной (слоистой) жидкой кристаллической фазы с максимальным содержанием воды приблизительно 35 вес.% или более высоким содержанием в зависимости от природы полярного липида. В зависимости от примененного липида или смеси липидов и других условий спонтанное образование липосом можно достичь при прибавлении избытка воды к этой многослойной фазе. Если спонтанное образование не достигается, образование липосом может достигаться стадией механического диспергирования (т.е. стадией гомогенизации (е) вышеприведенного процесса) многослойной (слоистой) жидко-кристаллической фазы в избытке воды. Способы гомогенизации/диспергирования включают энергичное механическое перемешивание, например, с помощью Ultra Turrax (JankelKuhnke, Germany). В качестве стадии гомогенизации вышеприведенного процесса также может выполняться встряхивание, вихревое движение и вращение. Распределение по размеру гомогенизированных липосом, описанных в изобретении, может быть подходящим и может получаться при экструзии через мембранный фильтр, как, например, изготовленный из поликарбоната с размером пор приблизительно 100 нм. Мембранные фильтры могут поставляться из Avestin Ins., Canada. Уменьшенный средний размер липосом и суженное распределение липосом по размеру предпочтительно можно получить, если липосомальная дисперсная система подвергается действию высокого давления при гомогенизации в соответствующем гомогенизаторе (Rannie APV, type 7.30 VH, Rannie AS,Denmark) при, например, от приблизительно 300 до приблизительно 1000 бар, таком как от приблизительно 400 до приблизительно 900 бар, например от приблизительно 500 до приблизительно 800 бар в течение от приблизительно 4 до приблизительно 8 (как, например, 7 или 6) циклов. Неожиданно, нами было найдено, что присутствие цетиризина приводит к уменьшению размера липосом. Меньшие липосомы обычно имеют преимущества, поскольку они более стабильны физически и вследствие большего отношения их площади поверхности к объему они более легко повторно сорбируются слизистой оболочкой. Предпочтительно, чтобы диаметр липосом в композициях, описанных в изобретении, составлял бы менее 200 нм (например, от приблизительно 40 до приблизительно 100 нм), при измерении, например,дифракцией лазерного облучения или динамическим рассеянием света, например, как описано в изобретении.-6 014752 Кроме того, вышеописанный способ приготовления композиций, описанных в изобретении, обычно не требует обработки органическими растворителями, такими как хлороформ или дихлорметан. Однако,если применяются два или более мембранных липидов, они могут быть соответствующим и/или неизбежным образом обработаны органическим растворителем перед прибавлением водного раствора. Например, липиды могут растворяться в летучем растворителе или смеси растворителей, таких как хлороформ или хлороформ/метанол. Раствор затем может покрыть поверхность круглодонной колбы поскольку растворитель удаляется с помощью упаривания на роторном испарителе при пониженном давлении. Избыточный объем водного буфера, содержащего лекарственный препарат, затем можно добавить к сухой тонкой пленке липидов, которым можно далее дать возможность набухнуть с образованием липосом. Композиции, описанные в изобретении, пригодны при лечении любых показаний, для которых известно назначение цетиризин, включая ринит. Понятно, что термин "ринит" включает любое раздражение и/или воспаление носа аллергического или неаллергического происхождения, включая сезонный ринит (например, вызванный внешними агентами, как, например, пыльцой; сенной лихорадкой) и/или сохраняющийся круглый год ринит (например, вызванный клещами домашней пыли, домашним плесневым грибком и т.д.), а также его симптомы. Согласно другому аспекту изобретения предлагается способ лечения ринита, включающий (например, назальное) введение фармакологически эффективного количества композиции, описанной в изобретении, человеку, страдающему от этой болезни или восприимчивого к ней. Во избежании сомнения под "лечением" мы понимаем терапевтическое лечение, а также симптоматическое лечение, профилактику или диагностику состояния. Композиции, описанные в изобретении, могут вводиться в качестве назального аэрозоля, назальных капель и/или глазных капель. Также возможно вводить композиции, описанные в изобретении, в виде мелкого аэрозоля в легкие с помощью распыления. Для назального введения можно применять любое известное из установленного уровня техники устройство, пригодное для получения аэрозолей водных липосомальных дисперсных систем. Слово "приблизительно" применяется в данном изобретении в контексте измерений (например, величин рН, размеров, температур, давлений и т.д.) и количеств (например, количеств, веса и/или концентраций индивидуальных составных частей в композиции или компонента композиции, пропорций лекарственного препарата внутри/снаружи липосомальных структур, абсолютных доз активного ингредиента,и т.д.), понятно, что такие переменные являются приблизительными и сами по себе могут изменяться на 10%, например 5% и предпочтительно 2% (например, 1%) от обозначенных в данном изобретении величин (чисел). Композиции, описанные в изобретении, и вышеупомянутый способ, который может применяться для их получения, имеют преимущества, которые упомянуты в данном изобретении. В особенности,композиции, описанные в изобретении, могут уменьшить сферу действия вредных побочных эффектов(и в частности раздражения), которое обычно наблюдается, например, при введенных назально составов цетиризина. Композиции, описанные в изобретении, легки в производстве и дают возможность производить составы на основе липосом, которые находятся в готовой для применения форме, без необходимости перевода их в другую форму перед применением. Композиции, описанные в изобретении, могут также иметь преимущество в том, что их можно получить с применением признанных фармацевтических способов обработки и использовать материалы,которые одобрены для применения в пищевой или фармацевтической промышленности или в подобных нормативных актах. Композиции, описанные в изобретении, могут также иметь преимущество в том, что они могут быть более эффективными, будучи менее токсичными, более продолжительными по действию, более сильнодействующими, продуцирующими меньшие побочные действия, более легко абсорбируемыми и/или с лучшим фармакокинетическим профилем и/или имеющими другие полезные фармакологические,физические или химические свойства по сравнению с фармацевтическими композициями, известными из предыдущего уровня техники, независимо от того применяются ли они для лечения ринита или в других случаях. Изобретение иллюстрируется с помощью следующих примеров.) Белое твердое вещество, перекристаллизованное из тетрагидрофурана/ацетонитрила/воды 2:1:0,28. Получено из коммерчески доступного цетиризина дигидрохлорида путем нейтрализации свободного основания азотной кислотой;) Lipoid S75, Lipoid GmbH, Германия. Общая методика. Веса и объемы исходных веществ приведены выше в табл. 1. Буферный раствор получали растворением буферных агентов - двузамещенного натрийфосфата дигидрата (Na2HPO42 Н 2 О) и однозамещенного калийфосфата (KH2PO4) в 1600 мл воды (80% от общего объема, указанного в составе серии) в 2000 мл мерной колбе. К буферному раствору прибавляли взвешенное количество активного агента и растворяли при перемешивании на магнитной мешалке с последующим прибавлением 100 мл водного 1 М гидроксида натрия. Отдельно взвешивали фосфолипид и прибавляли к раствору цетиризина. Перемешивание продолжали до образования хорошо диспергированной суспензии, рН которой доводили до рН 7,00,1 с помощью 1,0 М NaOH или 1,0 М HCl. Затем объем состава доводили до конечного объема серии в 2000 мл. Состав переносили в 5 л стеклянный сосуд, снабженный гомогенизатором Ultra TurraxT25 (JankelKuhnke, Germany). Гомогенизацию проводили при 22000 об./мин 3 раза по 2 мин, прерванную 10-минутными периодами отстаивания. 10 мл аликвоты таким образом полученной композиции удаляли из перемешиваемой дисперсной системы и переносили в стеклянные флаконы, на которые после наполнения или обжимались или прикреплялись с помощью соединительного болта распылительные головки (VP7 или VP7D; Valois S.A., France). Перемешанную композицию, а также отобранные аликвоты композиции во флаконах защищали от света. Найдено, что обработка ультразвуком дополнительно уменьшала средний размер частицы. В данном методе флаконы с гомогенизированными композициями помещали в ультразвуковую баню и обрабатывали ультразвуком 2 раза по 10 мин, после чего образцы становились почти прозрачными по сравнению с непрозрачной композицией, полученной при гомогенизации в Ultra-Turrax. Вышеупомянутые способы уменьшения размера частиц сравниваются в табл. 2. Распределение по размеру частиц определяли с помощью лазерной дифракции (Mastersizer 2000, Malvern Instrument, UK). Для расчета размера частиц образца, гомогенизированного при высокой скорости, применяли способ,основанный на теории Фраунхофера (Fraunhofer), тогда как для расчета размера частиц образца, дополнительно подвергнутого ультразвуку, применяли способ, основанный на теории MIE (2,50/0,001). Таблица 2 Уменьшение размера частиц Общая методика. Веса и объемы исходных веществ приведены в табл. 3. Буферный раствор получали растворением безводной лимонной кислоты и твердой гидроокиси натрия в 160 мл воды (80% от общего объема, указанного в составе композиции) в 200 мл мерной колбе. Прибавляли взвешенное количество активного агента и растворяли при перемешивании на магнитной мешалке. Отдельно взвешивали фосфолипид и прибавляли к раствору цетиризина. Перемешивание продолжали до образования хорошо диспергированной суспензии, рН которой доводили до рН 5,00,1 с помощью 1,0 М NaOH и/или 1,0 М HCl. Затем объем состава доводили до конечного объема серии в 200 мл. Состав переносили в гомогенизатор высокого давления (Rannie APV, type 7.30 VH, Rannie AS, Denmark) и гомогенизировали при 500-800 бар в течение 5 циклов. Аликвоты таким образом полученной композиции удаляли из сборника и переносили в стеклянные флаконы. Пример 3. В табл. 4 сравнивается метод уменьшения размера частиц при гомогенизации при высоком давлении, как описано в примере 2, с высокоскоростной гомогенизацией (Ultra Turrax T25 homogeniser;JankelKuhnke, Germany), как описано в примере 1. Применяемая композиция соответствовала примеру 1. Распределение по размеру частиц определяли с помощью динамического рассеяния света (Zetasizer 4,Malvern Instruments, UK) под углом 90 при комнатной температуре с применением калибровонной ячейки ZET5104 и метода анализа auto:CONTIN. Таблица 4 Уменьшение размера частиц Способы, применяемые для приготовления этих типичных серийных композиций, применяли для получения следующих дополнительных примеров. Пример 4.DGDG, Larodan Fine Chemicals, Sweden Пример 10. Тест назального раздражения в испытании на собаках. Цетиризин динитрат (5,6; 11,1 и 22,2 мг/мл, соответственно, в композициях примеров 1, 4 и 5, композиции, гомогенизированные встряхиванием, а не при высокоскоростной гомогенизации или гомогенизации при высоком давлении) вводился дважды в день в течение 14 дней четырем гончим кобелям в одной группе (5-6-месячного возраста, весом 10,1-14,2 кг). На протяжении исследования контролировали- 10014752 клинические симптомы и вес тела. Выполняли вскрытие трупа и носовые полости отбирали и обрабатывали (проводили фиксацию, удаляли соли кальция и окрашивали гематоксилином и эозином). Четыре среза с носовой полости оценивали микроскопически, по покрытию плоским эпителием, реснитчатым респираторным эпителием и обонятельным эпителием. Во время периода введения не наблюдались несвязанные с лечением клинические симптомы. Увеличение среднего веса тела на протяжении периода введения являлось незначительным. Макроскопическое и микроскопическое исследование носовой полости и препараты слизистой оболочки носа не обнаруживали никаких клинических симптомов раздражения слизистой оболочки или другого изменения. Пример 11. Тест глазного раздражения в испытании на кроликах. Потенциальные раздражающие свойства композиций, описанных в изобретении, также оценивали в тестах раздражения глаз у трех белых (альбинос) кроликов Новозеландских женских особей весом от 2,8 до 3,4 кг в одном лечении. Исследованные концентрации составляли 5,6; 11,1 и 22,2 мг/мл в композиции примера 1. 0,1 мл композиции помещали в левый глаз каждого кролика. Правый глаз без лечения служил в качестве контроля. Глаза проверяли до лечения и через 1, 24, 48 и 72 ч после лечения. Глазную реакцию на лечение сортировали по субъективной системе цифрового показателя. Клинические симптомы конъюнктивального раздражения (покраснение) наблюдали у двух кроликов в группе, получающей композицию, содержащую 22,2 мг/мл цетиризина динитрата. Через 1 ч после лечения у первого кролика отмечали показатель 2 (диффузный, темно-красный цвет, индивидуальные сосуды трудно различимы) на шкале, градуированной от 0 до 3. У второго кролика показатель 1 (несколько кровеносных сосудов с гиперемией) на шкале, градуированной до 4, отмечали при 24 ч. В обоих случаях покраснение не имело места при последующих наблюдениях и, таким образом, считалось обратимым. Других клинических симптомов раздражения глаз не наблюдали ни в одном из животных. Пример 12. Тест назального раздражения. Единичную дозу (110 мкл в каждую ноздрю) цетиризина динитрата (11,1 мг/мл) вводили пяти здоровым волонтерам в четырех курсах лечения с одним из четырех составов (I-IV, для подробностей см. табл. 5) в каждом курсе. Составы I, II и III представляют собой составы примеров, описанных выше, тогда как состав сравнения IV не являлся составом, описанным в изобретении. Тест выполняли, чтобы исследовать уменьшение раздражения с помощью липосомного состава по сравнению с простым буферным раствором. Также изучалось влияние размера частиц и отношение фосфолипида к цетиризину. Таблица 5 Составы цетиризина динитрата, применяемые в тестировании назального раздражения Относятся к табл. 2 Показатель назальных симптомов оценивали через 1, 10, 30 мин после введения. Показатель назальных симптомов включал следующие переменные величины: назальный застой, ринорею,зуд/чихание, жжение/болезненное ощущение и ощущение вкуса. Данные симптомы квалифицировали с помощью субъектов согласно шкале (0-3) - отсутствие симптома-слабый симптом-умеренный симптомсерьезный симптом. Результаты представляли в виде общего показателя, прибавляя показатели всех пяти субъектов (максимальный показатель 15). Фосфолипидные составы лучше переносились, чем простой буферный раствор. По-видимому,меньшие липосомы имеют некоторое преимущество. Слабый дискомфорт, о котором рассказывали все субъекты при 1 мин, практически исчезал при 10 мин для двух составов (II и III), которые имели размер частиц, уменьшенный с помощью ультразвуковой обработки. Наоборот, первоначальный слабый дискомфорт, о котором сообщали для состава I, сохранялся при 10 мин. Увеличение соотношения фосфолипида к цетиризину дополнительно не улучшало характеристику состава.- 11014752 Таблица 6 Тест назального раздражения у здоровых волонтеров Пример 13. Тест назального раздражения. Единичную дозу (110 мкл в каждую ноздрю) цетиризина динитрата (11,1 мг/мл) вводили четырем здоровым волонтерам в четырех курсах лечения с одним из четырех составов (I-IV, для подробностей см. табл. 7) в каждом курсе. Тест выполняли для исследования раздражающих свойств составов с различными мембранными липидами природного и синтетического происхождения. Таблица 7 Составы цетиризина динитрата, применяемые в тестировании назального раздражения Показатель назальных симптомов оценивали через 1, 10, 30 мин после введения. Показатель назальных симптомов включал следующие переменные величины: назальный застой, ринорею,зуд/чихание, жжение/болезненное ощущение и ощущение вкуса. Данные симптомы квалифицировали с помощью субъектов согласно шкале (0-3): отсутствие симптома-слабый симптом-умеренный симптомсерьезный симптом. Результаты представляли в виде общего показателя, прибавляя показатели всех четырех субъектов (максимальный показатель 12). Составы, содержащие DOPC и DOPG, очень хорошо переносились практически с отсутствием сообщений любого вида при 1 мин. При 10 мин еще имелась тенденция к лучшей переносимости этих двух составов по сравнению с мембранными липидами природного происхождения.- 12014752 Таблица 8 Тест назального раздражения у здоровых волонтеров Следующие примеры также выполнены в соответствии с методиками, аналогичными тем, которые описаны в данном изобретении. Пример 14. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гомогенная фармацевтическая композиция для лечения ринита путем интраназального или внутриглазного введения, включающая цвиттерионный цетиризин, полярную липидную липосому и фармацевтически приемлемый водный носитель, характеризующаяся тем, что цетиризин распределен по всей композиции в практически одинаковой концентрации в водной среде, независимо от того, располагается среда внутри или снаружи липосомальных структур. 2. Композиция по п.1, дополнительно включающая фармацевтически приемлемый буфер, способный обеспечить рН от приблизительно 4 до приблизительно 8. 3. Композиция по п.2, в которой интервал рН составляет от приблизительно 5 до приблизительно 7. 4. Композиция по п.2 или 3, в которой буфер является фосфатным, цитратным или ацетатным буфером. 5. Композиция по п.4, в которой буфером является двузамещенный натрийфосфат, двузамещенный калийфосфат, однозамещенный натрийфосфат, однозамещенный калийфосфат, фосфоновая кислота со щелочью, цитрат натрия, лимонная кислота со щелочью, ацетат натрия или уксусная кислота со щелочью. 6. Композиция по любому из пп.2-5, в которой количество буфера находится в пределах от приблизительно 1 до приблизительно 30 мг/мл. 7. Композиция по любому из пп.1-6, в которой цетиризин находится в форме соли. 8. Композиция по п.7, в которой соль является хлоридом, гидрохлоридом или солью азотной кислоты. 9. Композиция по п.8, в которой соль является цетиризин динитратом. 10. Композиция по п.8, в которой соль является гидрохлоридом. 11. Композиция по любому из пп.1-10, в которой количество цетиризина или соли, примененной при приготовлении композиции, составляет от приблизительно 1 до приблизительно 30 мг/мл в расчете на цвиттерионную форму. 12. Композиция по п.11, в которой количество составляет от приблизительно 5,5 до приблизительно 22 мг/мл. 13. Композиция по любому из пп.1-12, в которой полярный липид имеет природное происхождение,синтетическое/полусинтетическое происхождение или содержит смесь из них двух. 14. Композиция по любому из пп.1-13, в которой полярный липид включает или содержит фосфолипид или смесь фосфолипидов. 15. Композиция по п.14, в которой фосфолипид включает фосфолипид на основе фосфатидилхолина,фосфатидилглицерина, фосфатидилинозита, фосфатидной кислоты, фосфатидилсерина или их смесей. 16. Композиция по п.14 или 15, в которой фосфолипид включает фосфолипид, отвечающий общей формуле I где R1 и R2 независимо обозначают насыщенную или ненасыщенную, разветвленную или неразветвленную алкильную цепь с 7-23 атомами углерода иR3 обозначает амидную или сложноэфирную связывающую группу. 17. Композиция по п.16, в которой амидная или сложноэфирная связывающая группа является СН 2-СН(ОН)-СН 2 ОН-группой, -CH2-CH2-N(CH3)3-группой, -CH2-CH2-NH2-группой, атомом водорода или-CH2-CH(NH2)-COOH-группой. 18. Композиция по любому из пп.12-17, в которой фосфолипид включает мембранный липид, полученный из соевых бобов. 19. Композиция по п.18, в которой фосфолипид включает Lipoid S75, Lipoid S100 и/или Lipoid S75-3N. 20. Композиция по любому из пп.14-19, в которой фосфолипид включает дилаурилфосфатидилхолин, димиристолфосфатидилхолин, дипальмитоилфосфатидилхолин, дилаурилфосфатидилглицерин, димиристолфосфатидилглицерин, диолеоилфосфатидилхолин или диолеоилфосфатидилглицерин. 21. Композиция по любому из пп.1-13, в которой полярный липид включает или состоит из гликолипида или смеси гликолипидов. 22. Композиция по п.21, в которой гликолипид включает гликоглицеролипид. 23. Композиция по п.22, в которой гликоглицеролипид включает галактоглицеролипид. 24. Композиция по п.22, в которой гликоглицеролипид включает дигалактозилдиацилглицерин общей формулы II где R1 и R2 такие, как определено в п.16. 25. Композиция по любому из пп.21-24, в которой гликолипид включает дигалактозилдиацилглицерин. 26. Композиция по п.21, в которой гликолипид включает гликосфинголипид. 27. Композиция по п.26, в которой гликосфинголипид включает моногликозилсфингоид, олигогликозилсфингоид, олигогликозилцерамид, моногликозилцерамид, сиалогликосфинголипид, уроногликосфинголипид, сульфогликосфинголипид, фосфогликосфинголипид, фосфоногликосфинголипид, церамид,моногексозилцерамид, дигексозилцерамид, сфингомиелин, лизосфингомиелин, сфингозин или их смесь. 28. Композиция по п.27, в которой гликосфинголипид включает сфингомиелин или продукт, полученный из него. 29. Композиция по п.21, в которой гликолипид включает гликофосфатидилинозит. 30. Композиция по любому из предшествующих пунктов, в которой количество применяемой полярной липидной субстанции находится в пределах от приблизительно 10 до приблизительно 120 мг/мл. 31. Композиция по любому из пп.1-20 или 30, в которой количество фосфолипида составляет от приблизительно 17 до приблизительно 70 мг/мл. 32. Композиция по п.31, в которой количество фосфолипида составляет от приблизительно 20 до приблизительно 40 мг/мл. 33. Композиция по любому из пп.1-32, которая дополнительно включает антиоксидант. 34. Композиция по п.33, в которой антиоксидантом является -токоферол, аскорбиновая кислота,бутилированный гидроксианизол, бутилированный гидрокситолуол, лимонная кислота, фумаровая кислота, яблочная кислота, монотиоглицерин, пропионовая кислота, пропилгаллат, аскорбат натрия, бисульфит натрия, метабисульфит натрия, метабисульфит калия, сульфит натрия, винная кислота и/или витамин Е. 35. Композиция по любому из предшествующих пунктов, которая дополнительно включает хелатообразователь. 36. Композиция по п.35, в которой хелатообразователь является этилендиаминтетрауксусной кислотой, этилендиаминтриуксусной кислотой и/или диэтилентриаминпентауксусной кислотой. 37. Композиция по любому из пп.1-36, дополнительно включающая консервант.- 19014752 38. Композиция по п.37, в которой консервантом является бензалконийхлорид, бензойная кислота,бутилированный гидроксианизол, бутилпарабен, хлорбутанол, этилпарабен, метилпарабен, пропилпарабен, феноксиэтанол и/или фенилэтиловый спирт. 39. Композиция по любому из пп.1-38, дополнительно включающая увеличивающий вязкость агент. 40. Композиция по п.39, в которой увеличивающий вязкость агент является полиэтиленгликолем,поперечно-сшитым поливинилпирролидоном и/или гидроксипропилметилцеллюлозой. 41. Композиция по любому из пп.1-40, в которой диаметр липосом составляет менее 200 нм. 42. Композиция по п.41, в которой диаметр составляет от приблизительно 40 до приблизительно 100 нм. 43. Способ получения композиции по любому из пп.1-42, включающий:(а) прибавление полярного липида или смеси полярных липидов, который(е) при перемешивании способен(ны) набухать в водной среде до водного раствора цетиризина, и(б) гомогенизацию состава. 44. Способ по п.43, в котором перед стадией гомогенизации рН доводят до нужной величины прибавлением кислоты или основания. 45. Способ по п.43 или 44, в котором перед стадией гомогенизации к составу прибавляют воду, солевой раствор или буферный раствор с получением нужного окончательного объема серии. 46. Способ по п.45 (как зависимый от п.44), в котором прибавление воды, солевого раствора или буфера имеет место после стадии доведения рН. 47. Способ по любому из пп.43-46, в котором по меньшей мере один из растворов/жидкостей продувают азотом и/или аргоном. 48. Способ по любому из пп.43-47, в котором водный раствор цетиризина образуют или прибавлением буфера к водному раствору цетиризина или его соли, или прибавлением цетиризина или его соли к водному буферному раствору перед прибавлением липида. 49. Способ по любому из пп.43-48, в котором при применении смеси полярных липидов ее предварительно обрабатывают органическим растворителем. 50. Способ по любому из пп.43-49, в котором стадия гомогенизации (б) включает энергичное механическое перемешивание, высокоскоростную гомогенизацию, встряхивание, вихреобразное движение и/или вращение. 51. Способ по любому из пп.43-50, включающий дополнительную стадию уменьшения размера липосом. 52. Способ по п.51, в котором стадия уменьшения размера включает экструзию через мембранный фильтр. 53. Способ по любому из пп.43-49, 51 или 52, в которой стадия гомогенизации и/или стадия уменьшения размера включает гомогенизацию при высоком давлении. 54. Композиция по любому из пп.1-42 для применения в медицине. 55. Способ лечения ринита, включающий введение композиции по любому из пп.1-42 человеку,страдающему от данного заболевания или восприимчивого к нему. 56. Способ по п.55, в котором введение выполняют интраназально. 57. Способ по п.55, в котором осуществляют внутриглазное введение. 58. Применение композиции по любому из пп.1-42 для производства медикамента для лечения ринита, причем лечение включает введение такой композиции человеку, страдающему от данного заболевания или восприимчивого к нему. 59. Применение по п.58, в котором введение является интраназальным. 60. Применение по п.58, в котором осуществляют внутриглазное введение.
МПК / Метки
МПК: A61K 9/127, A61K 9/00, A61P 37/08, A61K 31/495
Метки: композиция, способ, лечения, ринита
Код ссылки
<a href="https://eas.patents.su/21-14752-sposob-i-kompoziciya-dlya-lecheniya-rinita.html" rel="bookmark" title="База патентов Евразийского Союза">Способ и композиция для лечения ринита</a>
Предыдущий патент: Способ нагрева проточной жидкости в трубопроводах систем отопления зданий и водоснабжения
Следующий патент: Средство для предотвращения прогрессирования апоптотических изменений в клетках различных органов и их перехода в некротическое поражение
Случайный патент: Способ и устройство для дозировки продуктов












