Способ синтеза диоксолановых нуклеозидов с бета-конфигурацией
Формула / Реферат
1. Способ получения соединения, представляющего собой аналог b -нуклеозида формулы (III)
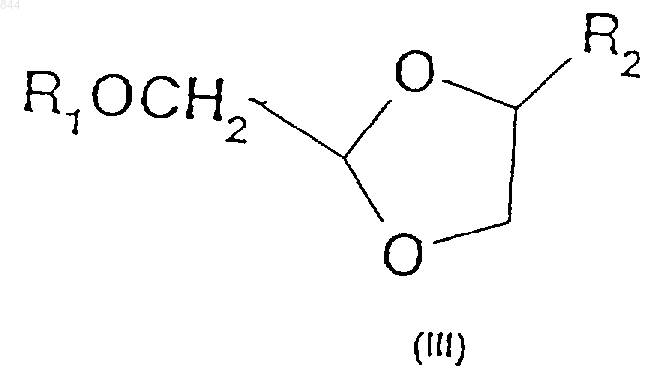
и его солей, где R1 является защитной группой гидроксила, a R2 представляет собой пуриновое или пиримидиновое основание либо его аналог или производное, при котором указанное пуриновое или пиримидиновое основание гликозилируют при температуре ниже примерно -10шС промежуточным соединением формулы (II)
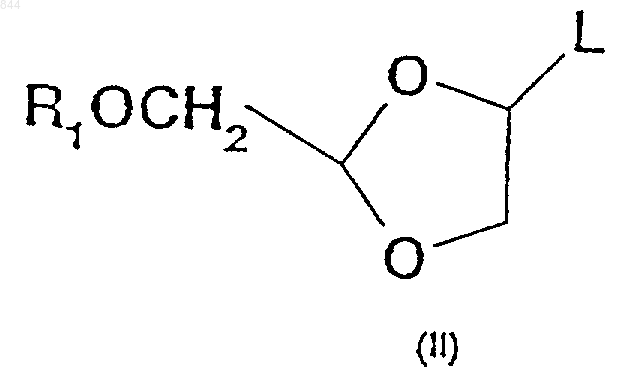
где L представляет собой галоген.
2. Способ по п.1, отличающийся тем, что L представляет собой йод-.
3. Способ по п.2, отличающийся тем, что R1 представляет собой бензил.
4. Способ по п.1, отличающийся тем, что R2 выбран из группы, состоящей из
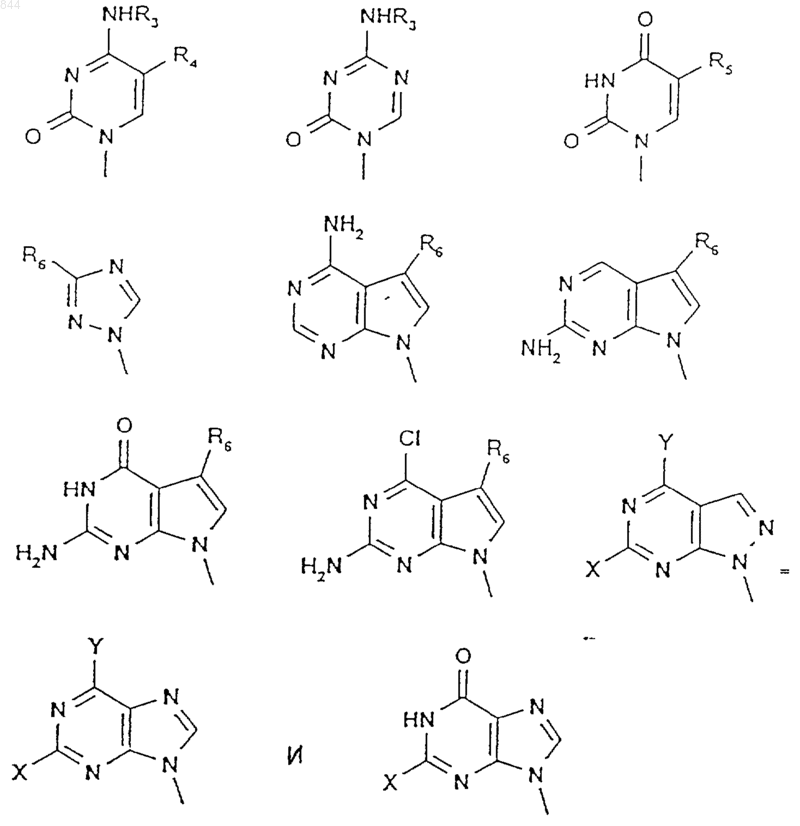
где R3 выбран из группы, состоящей из водорода, C1-6алкильный и C1-6ацильной групп;
R4 и R5 независимо выбраны из группы, состоящей из водорода, C1-6алкила, брома, хлора, фтора и йода;
R6 выбран из группы, состоящей из водорода, галогена, циано, карбокси, C1-6алкила, С1-6алкоксикарбонила, C1-6ацила, С1-6ацилокси, карбамоила и тиокарбамоила; и
Х и Y независимо выбраны из группы, состоящей из водорода, брома, хлора, фтора, йода, амино и гидроксильной групп.
5. Способ по п.1, отличающийся тем, что R2 представляет собой
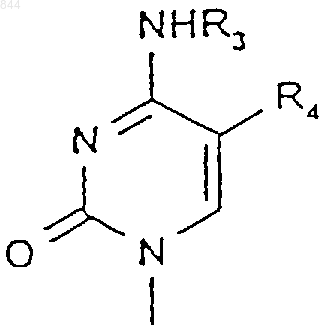
где R3 выбран из группы, состоящей из водорода, C1-6алкильной и C1-6ацильной групп; и
R4 выбран из группы, состоящей из водорода, C1-6алкила, брома, хлора, фтора и йода.
6. Способ по п.5, отличающийся тем, что R3 представляет собой Н или ацетил, a R4 представляет собой Н или F.
7. Способ по п.1, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -15шС.
8. Способ по п.1, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -20шС.
9. Способ по п.1, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -50шС.
10. Способ по п.1, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -78шС.
11. Способ по любому из пп.7-10, отличающийся тем, что L представляет собой йод-.
12. Способ по п.11, отличающийся тем, что R1 представляет собой бензил.
13. Способ по п.1, отличающийся тем, что затем удаляют защиту соединения формулы (III) с получением соединения формулы (I)
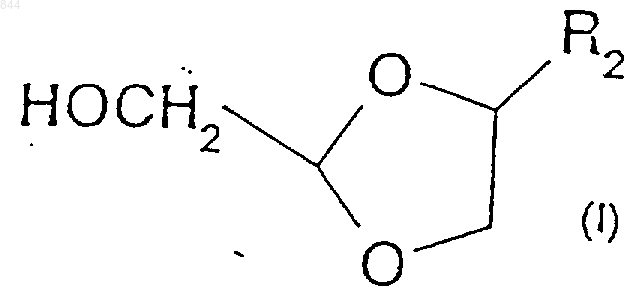
где R2 представляет собой пуриновое или пиримидиновое основание либо его аналог или производное.
14. Способ по п.1, отличающийся тем, что промежуточное соединение формулы (II) получают взаимодействием промежуточного соединения формулы (II')
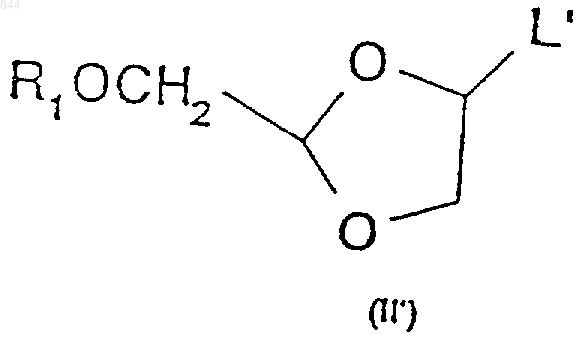
где L' является уходящей группой, с кислотой Льюиса формулы (VI)
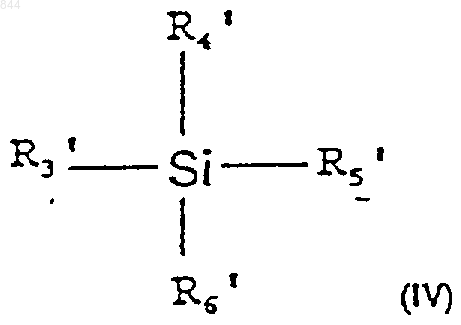
где R3', R4' и R5' независимо выбраны из группы, состоящей из водорода; С1-20алкила, возможно замещенного галогенами, С6-20алкокси или С6-20арилокси; С7-20аралкила, возможно замещенного галогеном, С1-20алкилом или С1-20алкокси; С6-20арила, возможно замещенного галогенами, С1-20алкилом или С1-20алкокси; триалкилсилила; фтора-; брома-; хлора- и йода-; и
R6' выбран из группы, состоящей из галогена; С1-20сульфонатных сложных эфиров, возможно замещенных галогенами; сложных С1-20алкил эфиров, возможно замещенных галогеном; моновалентных полигалидов; тризамещенных силильных групп общей формулы (R3')(R4')(R5')Si, где R3', R4', R5' являются такими, как определено выше; насыщенного или ненасыщенного селененил С6-20арила; замещенного или незамещенного С6-20арилсульфенила; замещенного или незамещенного С1-20алкоксиалкила и триалкилсилокси.
15. Способ по п.14, отличающийся тем, что кислота Льюиса выбрана из TMSI и SiH2I2.
16. Способ по п.15, отличающийся тем, что кислота Льюиса представляет собой TMSI.
17. Способ по п.14, отличающийся тем, что L представляет собой йод-.
18. Способ по п.17, отличающийся тем, что R1 представляет собой бензил.
19. Способ по любому из пп.14-18, отличающийся тем, что затем удаляют защиту соединения формулы (III) с получением соединения формулы (I)
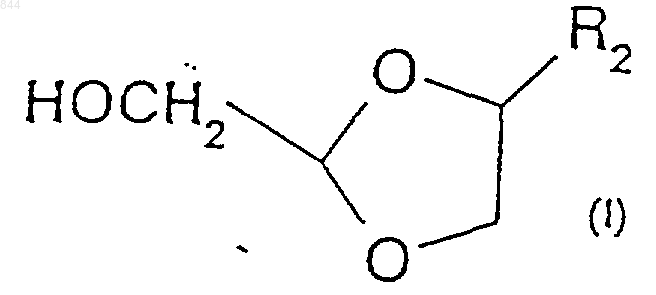
где R2 представляет собой пуриновое или пиримидиновое основание либо его аналог или производное.
20. Способ по п.19, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -15шС.
21. Способ по п.19, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -20шС.
22. Способ по п.19, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -50шС.
23. Способ по п.19, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -78шС.
Текст
1 Область изобретения Настоящее изобретение относится к способам и композициям для получения аналогов нуклеозидов, содержащих кольца диоксолановых сахаров. В частности, изобретение относится к стереоселективному синтезу 1,3 диоксолановых нуклеозидов, имеющих - или цис-конфигурацию. Предпосылки изобретения Нуклеозиды и их аналоги представляют собой важный класс химиотерапевтических агентов с противовирусной, противораковой,иммуномодулирующей и антибиотической активностью. Аналоги нуклеозидов, такие как 3'азидо-3'-дезокситимидин (AZT), 2',3'-дидезоксиинозин (ddI), 2',3'-дидезоксицитидин (ddC), 3'дезокси-2',3'-дидегидротимидин (d4T) и (-)-2'дезокси-3'-тиацитидин (3 ТС) клинически санкционированы для лечения инфекций, вызванных вирусом иммунодефицита человека. 2'Дезокси-2'-метилиденцитидин (DMCD) [Yamagami et al. Cancer Research 1991, 51, 2319] и 2'дезокси-2',2'-дифторцитидинal. Cell Immunol. 1987, 106, 318], стимулируют иммунную систему и индуцируют выработку интерферона. Все из вышеуказанных биологически активных нуклеозидов являются индивидуальными энантиомерами. Ранее сообщалось, что отдельные представители класса аналогов 2',3'-дидезоксинуклеозида, такие как 3 ТС [Coats et al. Antimicrob. Agents Chemother. 1992, 36, 202], (-)-FTCLett. 1992, 33, 6899] обладают сильной активностью против копирования ВИЧ (вируса иммунодефицита человека) и ВГВ (вируса гепатита В) и имеют абсолютную -L конфигурацию. Сообщалось [Grove et al. Cancer Res. 1995, 55,3008-3011], что (-)-диоксолан С обладает противоопухолевой активностью. Аналоги дидезоксинуклеозидов (-)-dOТС и (-)-dOTFC [Mansouret al. J.Med.Chem. 1995, 38, 1-4] проявили селективное действие против ВИЧ-1. Для стереоселективного синтеза существенно, чтобы нуклеооснование вводили преимущественно с желаемой соответственной стереохимией, не вызывая аномеризацию по карбогидратному участку. Один из подходов в достижении этого заключается в том, чтобы модифицировать карбогидратный участок предварительно собранного нуклеозида посредством ряда реакций дезоксигенирования [Chu et al.Starrett et al. Nucleosides Nucleotides 1990, 9, 885897; Bhat et al. Nucleosides Nucleotides 1990, 9,1061-1065]. Этот подход, однако, ограничен для синтеза тех аналогов, чья абсолютная конфигурация сходна с конфигурацией исходного нуклеозида, и он не будет иметь практического значения, если перед дезоксигенированием для получения исходного нуклеозида требуется растянутый технологический процесс, как это может быть в случае -L дезоксинуклеозидов. Известен альтернативный подход в достижении стереоселективности, который требует сборки аналога нуклеозида путем взаимодействия основания или его синтетического предшественника с карбогидратным участком в условиях процесса сочетания в присутствии кислоты Льюиса илиSN-2 подобных условиях. Специалистам известно, что гликозилирование оснований до дидезоксисахаров происходит с низкой стереоселективностью в отсутствие 2'-заместителя на карбогидратных кольцах,способного к соучастию с соседними группами.Okabe и его соавторы достигли [J.Org.Chem. 1988, 53, 4780-4786] самого высокого соотношения : изомеров ddC 60:40 при использовании этилалюминийдихлорида в качестве кислоты Льюиса. Однако с фенилселененильным заместителем по положению С-2 карбогидратаBeach et al. J.Org.Chem. 1992, 57, 3887-3894] или фенилсульфенильной группировкой [Wilson etal. Tetrahedron Lett. 1990, 31, 1815-1818] соотношение : увеличивается до 99:1. Решая проблему введения таких заместителей с желаемой-стереохимией, Kawakami и соавторы [Nucleosides Nucleotides 1992, 11, 1673-1682] установили, что дизамещение по положению С-2 кольца сахара,как в 2'2'-дифенилтио-2,3 дидезоксирибозе, приводит к нуклеозидам с соотношением : = 80:20, если взаимодействие с силилированными основаниями проводить в присутствии триметилсилилтрифлата (TMSOTf) в качестве катализатора. Хотя эта стратегия способствовала синтезу -аномера, удаление фенилтиогруппы оказалось проблематичным. Из-за ограниченных возможностей в стереоселективном введении С-2 заместителя были предложены [Kim et al. Tetrahedron Lett. 1992,33, 5733-5376; Kawakami et al. Heterocycles 1993,36, 665-669; Wang et al. Tetrahedron Lett. 1993,34, 4881-4884; El-laghdach et al. Tetrahedron Lett. 1993, 34, 2821-2822] методики синтеза на основе электрофильного присоединения фенилсульфенилгалидов или N-йодсукцинимидов и нуклеооснований к фураноидным гликалевым промежуточным соединениям. При этом подходе 2'заместитель вводят in situ, однако, для удаления таких заместителей требуется многостадийный процесс. Был исследован [Farina et al. Tetrahedronerocycles 1990, 31, 2041-2053] SN-2 подобный процесс сочетания 1-хлор и 1-бром 2,2 дидезоксисахаров. Однако самое высокое соотношение - и -нуклеозидов, как сообщалось,составляет 70:30, соответственно.In situ комплексирование металлических солей, таких как SnCl4 или Тi(O-Рr)2 Сl2 с плоскостью предшественника сахара, когда фрагмент сахара является оксатиоланильным или диоксоланильным производным, продуцирует -пиримидиновые нуклеозиды [Choi et al. J.Humber et al. Tetrahedron Lett. 1992, 32, 46254628; Hoong et al. J.Org.Chem. 1992, 57, 55635565]. Несмотря на высокое соотношение - и-аномеров, полученное при этом подходе, имеется серьезное ограничение в связи с энантиомерно чистым предшественником сахара, которое приводит к рацемическим нуклеозидам. Для того чтобы получить одноэнантиомерную форму рацемических нуклеозидов, требуются методы ферментативного и химического разделения. Даже если это удается, то такие методы с практической точки зрения могут страдать от недостатка, который заключается в отбрасывании половины полученного материала. Как продемонстрировано в вышеупомянутых примерах, данная область техники нуждается в эффективном способе производства нуклеозидов. В частности, в случае предшественников сахаров, несущих защитную гидроксиметильную группу по положению С-4', в процессе синтеза -изомеров приходится сталкиваться с проблемами низкой селективности или рацемизации. Конкретно, данная область техники нуждается в способе стереоселективного получения диоксоланов из промежуточныхcахаров, несущих С-2 защитную гидроксиметильную группировку, без рацемизации. Поэтому общий стереоселективный синтез биологически активных аналогов -нуклеозидов является важной задачей. В публикации Международной заявки WО 92/20669 раскрыт способ стереоселективного получения диоксоланов сочетанием промежуточных сахаров, несущих С-2 эфирные группировки, с силилированными нуклеооснованиями и последующим восстановлением С-2 эфирной группы до желаемой гидроксиметильной группы. Были раскрыты [Tse et al. Tetrahedron Lett. 1995, 36, 7807-7810], однако, чрезмерные проблемы восстановления в пиримидиновом основании. Аналоги нуклеозидов, содержащие 1,3 диоксоланильные сахара в качестве миметиков 2',3'-дидезоксифуранозильных колец, были получены гликозилированием силилированных пуриновых и пиримидиновых оснований 1,3 диоксоланами, содержащими С-2 гидроксиметил и С-4 ацетоксизаместители. Решающая ре 000844 4 акция сочетания опосредована триметилсилитрифлатом (TMSOTf) или йодтриметилсиланомBelleau et al. Tetrahedron Lett. 1992, 33, 69486952; и Evans et al. Tetrahedron Asymmetry 1992,4, 2319-2322]. При использовании металлических солей в качестве катализаторов преобладают -нуклеозиды [Choi et al. J. Am.Chem.Soc. 1991, 113, 9377-9379], однако рацемизация или потеря селективности становятся серьезным ограничением [Jin et al. Tetrahedron Asymmetry 1993, 4, 2111 -2114]. Сущность изобретения Согласно одному из аспектов настоящего изобретения предложен способ получения соединения, представляющего собой аналог нуклеозида формулы (III) и его солей, где R1 является защитной группой гидроксила, a R2 представляет собой пуриновое или пиримидиновое основание либо его аналог или производное, при котором указанное пуриновое или пиримидиновое основание гликозилируют при температуре ниже примерно -10 С промежуточным соединением формулы (II) где L представляет собой галоген. После гликозилирования соединение формулы (III) затем может быть подвергнуто удалению защитной группы гидроксила R1 с получением 1,3-диоксоланового аналога нуклеозида формулы (I) где R2 является таким, как определено ранее. Подробное описание изобретения Настоящее изобретение предусматривает новый способ получения аналогов диоксолановых нуклеозидов путем сочетания предшественников сахаров, несущих С-2 защитную гидроксиметильную группу, с пуриновыми или пиримидиновыми основаниями с высоким выходом и селективностью в пользу желаемых изомеров."Нуклеозид" определяют здесь как любое соединение, которое состоит из пуринового или пиримидинового основания либо его аналога или производного, связанного с пентозным сахаром."Нуклеозидный аналог или производное",как используется здесь, представляет собой соединение, содержащее 1,3-диоксолан, связанный с пуриновым или пиримидиновым основанием либо его аналогом, которое может быть модифицировано любым из следующих или комбинациями следующих способов: модификации основания, такие как присоединение заместителя (например 5-фторцитозина) или замещение одной группы одной изостерической группой (например 7-деазааденин); модификации сахара, такие как замещение гидроксильных групп любым заместителем или изменение сайта присоединения сахара к основанию (например пиримидиновые основания, как правило,присоединенные к сахару по положению N-1,могут быть присоединены, например, по положению N-3 или С-6, а пурины, как правило,присоединенные по положению N-9, могут быть присоединены, например, по N-7). Пуриновое и пиримидиновое основание означает пуриновое и пиримидиновое основание, обнаруженное в существующих в природе нуклеозидах. Аналогом его является основание,которое имитирует такие существующие в природе основания в том, что его структура (виды атомов и их взаимное расположение) подобна структуре существующих в природе оснований,однако, он может либо обладать дополнительными функциональными свойствами, либо ему может недоставать некоторых функциональных свойств существующих в природе оснований. Такие аналоги включают в себя те из них, которые получены замещением СН группировки атомом азота (например 5-азапиримидины, такие как 5-азацитозин) или наоборот (например 7-деазапурины, такие как 5-азааденин или 7 деазагуанин), или и тем и другим (например 7 деаза, 8-азапурины). Под производными таких оснований или аналогов подразумеваются те основания, в которых заместитель в кольце является либо включенным в него, удаленным из него, либо модифицированным традиционными заместителями, известными из уровня техники,например, галогеном, гидроксилом, амино,C1-6 алкилом. Такие пуриновые или пиримидиновые основания, аналоги и производные хорошо известны специалистам в данной области техники.R1 представляет собой защитную группу гидроксила. Подходящие защитные группы включают в себя те из них, которые подробно описаны в Protective Groups in Organic Synthesis,Green, John, J. Wiley and Sons, New York (1981). Предпочтительные защитные группы включают в себя группы, образующие сложные эфиры,такие как C1-6 ацил, т.е. формил, ацетил, замещенный ацетил, пропионил, бутаноил, пиваламидо, 2-хлорацетил; замещенный арилом С 1-6 ацил, т.е. бензоил, замещенный бензоил; 6 гие предпочтительные защитные группы гидроксила включают в себя группы, образующие простые эфиры, такие как С 1-6 алкил, т.е. метил,трет-бутил; арилС 1-6 алкил, т.е. бензил, дифенилметил, любой из которых является возможно замещенным, т.е. замещенным галогеном. Особенно предпочтительными защитными группами гидроксила являются трет-бутоксикарбонил,бензоил и бензил, каждый возможно замещенный галогеном. В особо предпочтительном воплощении защитная группа гидроксила R1 представляет собой бензил. В предпочтительном воплощении R2 выбран из группы, состоящей изR4 и R5 независимо выбраны из группы,состоящей из водорода, C1-6 алкила, брома, хлора, фтора и йода;R6 выбран из группы, состоящей из водорода, галогена, циано, карбокси, C1-6 алкила,C1-6 алкоксикарбонила, C1-6 ацила, C1-6 алкокси,карбамоила и тиокарбамоила; и Х и Y независимо выбраны из группы, состоящей из водорода, брома, хлора, фтора, йода,амино и гидроксильной групп. В особенно предпочтительном воплощении R2 представляет собой где R3 и R4 такие, как определено ранее. В особенно предпочтительном воплощении R2 представляет собой цитозин либо его аналог или производное. Наиболее предпочтительно R2 представляет собой цитозин, Nацетилцитозин или N-ацетил-5-фторцитозином. В предпочтительных воплощениях R4 и R5 независимо выбраны из водорода, С 1-4 алкила,такого как метил или этил, и галогена, такого 7 как F, Cl, I или Вr. В особенно предпочтительных воплощениях R4 и R5 представляют собойF. В предпочтительных воплощениях R6 выбран из водорода, галогена, карбоксила и С 1-4 алкила. В особенно предпочтительных воплощениях R6 представляет собой Н, F или Сl и наиболее предпочтительно Н. В предпочтительных воплощениях Х и Y независимо выбраны из группы, состоящей из Н, F или Сl. В особенно предпочтительном воплощении Х и Y представляют собой водород.L выбран из группы, состоящей из фтора-,брома-, хлора- и йода-. В особенно предпочтительном воплощении L представляет собой группу йод-. В этом случае уходящая группа (L) может быть получена замещением другой уходящей группы (L'),т.е. ацетокси, с использованием кислот Льюиса,содержащих йодную группировку. Предпочтительно такие кислоты Льюиса имеют формулу где R3', R4' и R5' независимо выбраны из группы,состоящей из водорода; С 1-20 алкила (например метила, этила, трет-бутила), возможно замещенного галогенами (F, Cl, Вr, I), С 6-20 алкоксиR6' выбран из группы, состоящей из галогена (F, Cl, Вr, I), предпочтительно I (йода-); С 1-20 сульфонатных эфиров, возможно замещенных галогенами (например трифторметансульфоната); С 1-20 алкиловых эфиров, возможно замещенных галогеном (например трифторацетата); моновалентных полигалидов (например трийодида); тризамещенных силильных групп общей формулы (R3')(R4')(R5')Si, где R3', R4', R5' такие, как определено выше; насыщенного или ненасыщенного селененил С 6-20 арила; замещенного или незамещенного С 6-20 арилсульфенила; замещенного или незамещенного С 1-20 алкоксиалкила; и триалкилсилокси;L' является уходящей группой, которая способна быть замещенной йодной уходящей группой с использованием кислоты Льюиса формулы (IV). Подходящие уходящие группы L' включают в себя ацилокси; алкокси; алкоксикарбонил; амидо; азидо; изоцианато; замещенные или незамещенные, насыщенные или ненасыщенные тиолаты; замещенные или незамещенные, насыщенные или ненасыщенные селено, селенинильные или селенонильные соединения; -OR, где R представляет собой замещен 000844 8 ную или незамещенную, насыщенную или ненасыщенную алкильную группу; замещенную или незамещенную, алифатическую или ароматическую ацильную группу; замещенную или незамещенную, насыщенную или ненасыщенную алкокси или арилоксикарбонильную группу,замещенный или незамещенный сульфонилимидазолид; замещенную или незамещенную,алифатическую или ароматическую аминокарбонильную группу; замещенную или незамещенную алкилимидиатную группу; замещенный или незамещенный, насыщенный или ненасыщенный фосфонат; и замещенную или незамещенную алифатическую или ароматическую сульфинильную или сульфонильную группу. В предпочтительном воплощении L' представляет собой ацетокси. В предпочтительном воплощении настоящее изобретение предусматривает стереоселективный способ получения аналогов нуклеозидов формулы (III) и их солей или эфиров, гликозилированием пуринового или пиримидинового основания либо его аналога или производного промежуточным соединением формулы (II), как определено ранее, в условиях низкой температуры. Предпочтительно реакция гликозилирования протекает при температурах ниже -10 С, т.е. примерно от -10 до -100 С, и более предпочтительно ниже -20 С. В наиболее предпочтительном воплощении реакция гликозилирования протекает между примерно от -20 до -78 С. Промежуточное соединение формулы II подвергают взаимодействию с силилированным пуриновым или пиримидиновым основанием,лучше в подходящем органическом растворителе, таком как углеводород, например толуол,галогенированный углеводород, такой как дихлорметан (ДХМ), нитрил, такой как ацетонитрил, амид, такой как диметилформамид, эфир,такой как тетрагидрофуран, или их смесь, при низкой температуре, такой как от -40 С до-78 С. Силилированные пуриновые или пиримидиновые основания или их аналоги и производные могут быть получены как описано в WO 92/20669, содержание которого включено сюда ссылкой. Такими силилирующими агентами являются 1,1,1,3,3,3-гексаметилдисилазан, триметилсилилтрифлат, трет-бутилдиметилсилилтрифлат или триметилсилилхлорид, с кислотным или основным катализатором, где как подходит. Предпочтительным силилирующим агентом является 1,1,1,3,3,3-гексаметилдисилазан. Для образования соединения формулы (I) соответствующие условия для удаления защиты включают в себя метанольный или этанольный аммиак или основание, такое как карбонат калия, в подходящем растворителе, таком как метанол или тетрагидрофуран, для N-4 деацетизации. Перенос деацетилирование-гидрогенолиз с донором водорода, таким как циклогексан или 9 формат аммония, в присутствии катализатора,такого как оксид палладия-на-угле, является подходящим для удаления 5'-арильной группы. Очевидно, что промежуточное соединение формулы (II) состоит из промежуточных соединений IIа и IIб Кроме того, очевидно, что, если стадию гликозилирования проводят с использованием эквимолярных количеств промежуточных соединений IIа и IIб, то получают рацемическую смесь -нуклеозидов формулы I. Специалистам в данной области техники будет ясно, что разделение полученной диастереомерной смеси, например, после реакции сочетания между соединениями формулы II и силилированным основанием, может быть достигнуто путем хроматографии на силикагеле или кристаллизации в подходящем растворителеand Sons, New York 1981]. Однако предпочтительно гликозилирование осуществлять с использованием оптически чистого соединения либо формулы IIа, либо IIб,посредством этого получая желаемый аналог нуклеозида высокой оптической чистоты. Соединения формулы IIа или IIб существуют в виде смеси двух диастереомеров, эпимерных по С-4 центру. Теперь мы обнаружили,что индивидуальный диастереомер, так же как любая смесь диастереомеров, содержащая соединения формулы IIа, взаимодействует с силилированными основаниями с получением -L нуклеозидов высокой оптической чистоты. Основание по С-4 имеет цис-стереохимию относительно гидроксиметильной группировки по С-2. Скорость этой реакции двух диастереомеров формулы IIа с силилированным основанием может, однако, быть неудовлетворительной. Открытия подобного рода существуют для промежуточных соединений формулы IIб для синтеза -D нуклеозидов. В предпочтительном воплощении настоящее изобретение предусматривает стадию получения аномерных йодидов формулы II взаимодействием известных аномерных 2Sбензилоксиметил-1,3-диоксолана-4S и -4R ацетоксипроизводных формулы (V) с йодтриметилсиланом или дийодсиланом при низких температурах (-78 С) перед стадией гликозилирования силилированным пиримидиновым или пуриновым основанием либо его аналогом или производным (схема 1)./Толуол TSHO/80%/ 2,7:1,0 цис/транс;2) MeOH/LiOH; 3) Колоночное разделение; 4) Рb(ОАс)4/МеСN/Ру/2 ч/КТ/80%; и 5) TMSI или SiH2I2/CH2Cl2/-78C. Подходящие способы получения аномерного ацетоксипромежуточного (VI) должны быть очевидны для специалистов в данной области техники, и они включают в себя оксидативную деградацию бензилоксиметилацеталей,производных от L-аскорбиновой кислоты [Belleau et al. Tetrahedron Lett. 1992, 33, 6949-6952] или D-маннитола [Evans et al. TetrahedronAsymmetry 1993, 4, 2319-2322]. Мы также обнаружили, что известная 2Sбензилоксиметил-1,3-диоксолан-4S-карбоновая кислота (V) может быть получена в предпочтении относительно ее 2S,4R изомера взаимодействием коммерчески доступной 2,2-диметил 1,3-диоксолан-4S-карбоновой кислоты с защищенным производным гидроксиацетальдегида,такого как бензилоксиацетальдегид, в кислотных условиях. Для диастереоселективного способа по данному изобретению предложены также следующие промежуточные соединения: Смесь, состоящую из 2S-бензилоксиметил 4S-ацетокси-1,3-диоксолана и 2S-бензилоксиметил-4R-ацетокси-1,3-диоксолана в соотношении 1:2 (6 г; 23,8 ммоль), сушили азеотропной дистилляцией с толуолом в вакууме. После удаления толуола остаточное масло растворяли в сухом дихлорметане (60 мл) и добавляли йодтриметилсилан (3,55 мл; 1,05 экв.) при-78 С при интенсивном перемешивании. После добавления баню сухой лед/ацетон удаляли и смеси давали возможность нагреться до комнатной температуры (15 мин). 1H ЯМР указал на образование 2S-бензилоксиметил-4R-йод-1,3 диоксолана и 2S-бензилоксиметил-4S-йод-1,3 диоксолана. 1 Н ЯМР (300 МГц, СDСl3)3.65-4.25 (2 Н,m); 4.50-4.75 (4 Н, m) 5.40-5.55 (1 Н, перекрытые триплеты); 6.60-6.85 (1 Н, dd); 7.20-7.32 (5 Н, m). Пример 1 б. 2S-Бензилоксиметил-4R-йод 1,3-диоксолан и 2S-бензилоксиметил-4S-йод 1,3-диоксолан (соединение 1). Смесь, состоящую из 2S-бензилоксиметил 4S-ацетокси-1,3-диоксолана и 2S-бензилоксиметил-4R-ацетокси-1,3-диоксолана в соотношении 1:2 (6 г; 23,8 ммоль), сушили азеотропной дистилляцией с толуолом в вакууме,остаточное масло растворяли в сухом дихлорметане (60 мл) и добавляли дийодсилан (2,4 мл; 1,05 экв.) при -78 С при интенсивном перемешивании. После добавления баню сухой лед/ацетон удаляли и смеси давали возможность нагреться до комнатной температуры (15 мин). 1H ЯМР указал на образование 2Sбензилоксиметил-4R-йод-1,3-диоксолана и 2Sбензилоксиметил-4S-йод-1,3-диоксолана. 1 Предварительно полученное йодное промежуточное соединение (пример 1) в дихлорметане охлаждали до -78 С. ПерсилилированныйN-ацетилцитозин (1,1 экв.), полученный кипячением с обратным холодильником в 1,1,1,3,3,3 гексаметилдисилазане (ГМДС) и сульфате аммония с последующим выпариванием ГМДС,растворяли в 30 мл дихлорметана и добавляли к промежуточному соединению йода. Реакционную смесь поддерживали при -78 С в течение 1,5 ч, затем вливали в водный бикарбонат натрия и экстрагировали дихлорметаном (225 мл). Органическую фазу сушили над сульфатом натрия, твердое вещество удаляли фильтрацией,а растворитель выпаривали в вакууме с получением 8,1 г неочищенной смеси. На основании анализа 1H ЯМР образовался -L-5'-бензил-2'дезокси-3'-оксацитидин и его -L изомер в соотношении 5:1, соответственно. Эту неочищен 000844 12 ную смесь разделяли хроматографией на силикагеле (5% МеОН в ЕtOАс) с получением чистого -L (цис)изомера (4,48 г). Альтернативно перекристаллизация этой смеси из этанола продуцирует 4,92 г чистогоизомера и 3,18 г смесии -изомеров в соотношении 1:1. 1 Защищенный -L изомер (4,4 г) из примера 2 суспендировали в насыщенном метанольном аммиаке (250 мл) и перемешивали при комнатной температуре в течение 18 ч в закрытом сосуде. Растворители удаляли в вакууме с получением деацетилированного нуклеозида в чистой форме. 1 Н ЯМР (300 МГц, CDCl3)3.85 (2H, m, H5'); 4.20 (2H, m, H-2'); 4.65 (2H, dd, ОСН 2 Рh); 5.18 (1H, t, H-4'); 5.43 (1H, d, H-5); 5.50-5.90 (1H,br, S, NH2); 6.28 (1H, m, Н-1'); 7.35-7.45 (5H, m,Ph); 7.95 (1H, m, H-6). Пример 4. -L-2'-Дезокси-3'-оксацитидин-L-5'-Бензилокси-2'-дезокси-3'-оксацитидин из предыдущего примера растворяли в ЕtOН (200 мл), затем добавляли циклогексан (6 мл) и оксид палладия (0,8 г). Реакционную смесь кипятили с обратным холодильником в течение 7 ч, затем ее охлаждали и фильтровали,чтобы удалить твердые вещества. Растворители удаляли из фильтрата вакуумной дистилляцией. Неочищенный продукт очищали флэшхроматографией на силикагеле (5% МеОН вEtOAc) с получением белого твердого вещества Ранее полученные йодные производные(пример 1) в дихлорметане охлаждали до -78 С. Персилилированный N-ацетил-5-фторцитозин(1,05 экв.), полученный кипячением с обратным холодильником в 1,1,1,3,3,3-гексаметилдисилазане (ГМДС) и сульфате аммония с последующим выпариванием ГМДС, растворяли в 20 мл дихлорметана (ДХМ) и добавляли к йодному промежуточному соединению. Реакционную смесь поддерживали при -78 С в течение 1,5 ч,затем вливали в водный бикарбонат натрия и экстрагировали дихлорметаном (225 мл). Органическую фазу сушили над сульфатом натрия,твердое вещество удаляли фильтрацией, а растворитель выпаривали в вакууме с получением 8,1 г неочищенной смеси. На основании 1H ЯМР анализа, образовались -L-5'-бензил-2'-дезокси 3'-окса-5-фтор-N4-ацетил-цитидин и его -L изомер в соотношении 5:1, соответственно. Эту неочищенную смесь разделяли хроматографией на силикагеле (5% МеОН в EtOAc) с получением чистого -L (цис) изомера (4,48 г). Альтернативно перекристаллизация смеси из этанола продуцирует 4,92 г чистого -изомера и 3,18 г смеси - и -изомеров в соотношении 1:1. 1(пример 5) суспендировали в метанольном аммиаке (100 мл) и перемешивали в течение 18 ч при комнатной температуре в закрытом реакционном сосуде. Растворители удаляли в вакууме с получением деацетилированной смеси, которую разделяли флэш-хроматографией на силикагеле (от 2% до 3% МеОН в EtOAc) с получением 1,21 г чистого -изомера (выход 45% в отношении этого изомера). Пример 7.(900 мг; 2,0 ммоль), полученный как описано в примере 6, растворяли в EtOH (40 мл), затем добавляли циклогексан (3 мл) и катализатор на основе оксида палладия (180 г). Реакционную смесь кипятили с обратным холодильником в течение 24 ч и катализатор удаляли фильтрацией. Растворители удаляли из фильтрата вакуумной дистилляцией. Неочищенный продукт очищали флэш-хроматографией на силикагеле (от 5 до 7% МеОН в EtOAc) с получением белого твердого вещества (530 мг; выход 82%). (D22) =(С-4'); 104.53 (С-1'); 124.90, 125.22 (С-4); 134.33,136.73 (С-5); 153.04 (С-2); 156.96, 157.09 (С-6). Пример 8. Определение изомерной чистоты аналогов -L-2'-дезокси-3'-оксацитидиновых нуклеозидов. Изомерную чистоту (изомеров -L противWaters HPLC, состоящей из регулятора подачи растворителя 600, детектора, чувствительного к УФ-излучению 486, автопробоотборника 412WISP и интегрирующего модуля 40 Waters. Использовали циклосвязанную I RSP колонку с аналитической хиральной обращенной фазой(Astec, 4,6250 мм i.d.), производителем заполненную -циклодекстрином, дериватизированным с использованием R'S-гидроксипропилового эфира. Подвижная фаза состояла из ацетонитрила (А) и воды, содержащей 0,05% триэтиламина (Б) с рН, доведенным до 7,05 ледяной уксусной кислотой. Колонка работала в изократических условиях при 0 С с использованием смеси 5% А и 95% Б. Такие условия являются модификациями условий, о которых сообщалиDiMarco et al. [J.Chromatography, 1993, 645, 107114]. Пропускная способность была 0,22 мл/мин, а давление поддерживали 648-660 фунт/кв. дюйм. Детектирование нуклеозидов контролировали УФ поглощением при 215 и 265 нм. Образцы -D изомера и рацемических соединений готовили известным [Belleau et al. Tetrahedron Lett. 1992, 33, 6948-6952] образом и использовали для внутренних эталонов и совместного впрыскивания. В этих условиях изомерная чистота соединения 4, полученного согласно примеру 4,была более 99%, а изомерная чистота соедине 15 ния 7, полученного согласно примеру 7, была более 96%. Изомерная чистота диоксолановых нуклеозидов, полученных согласно общей схеме 2 в различных условиях, т.е. при различных температуре и кислоте Льюиса, представлена ниже в таблице. Те из них, которые были получены при температурах выше -10 С, продемонстрировали пониженную стереоселективность. Схема 2 Таблица 1 Кислота Температура Цис Транс ЛьюисаTMSI а:-78 б:-78 5 1 Примечание: все реакции проведены в растворителе ДХМ, а основания силилированы ГМДС ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения, представляющего собой аналог -нуклеозида формулы (III) и его солей, где R1 является защитной группой гидроксила, a R2 представляет собой пуриновое или пиримидиновое основание либо его аналог или производное, при котором указанное пуриновое или пиримидиновое основание гликозилируют при температуре ниже примерно -10 С промежуточным соединением формулы (II)R4 и R5 независимо выбраны из группы,состоящей из водорода, C1-6 алкила, брома, хлора, фтора и йода;R6 выбран из группы, состоящей из водорода, галогена, циано, карбокси, C1-6 алкила,С 1-6 алкоксикарбонила, C1-6 ацила, С 1-6 ацилокси,карбамоила и тиокарбамоила; и Х и Y независимо выбраны из группы, состоящей из водорода, брома, хлора, фтора, йода,амино и гидроксильной групп. 5. Способ по п.1, отличающийся тем, чтоR3 представляет собой Н или ацетил, a R4 представляет собой Н или F. 7. Способ по п.1, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -15 С. 8. Способ по п.1, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -20 С. 9. Способ по п.1, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -50 С. 10. Способ по п.1, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -78 С. 11. Способ по любому из пп.7-10, отличающийся тем, что L представляет собой йод-. 12. Способ по п.11, отличающийся тем, что 13. Способ по п.1, отличающийся тем, что затем удаляют защиту соединения формулы (III) с получением соединения формулы (I) где R2 представляет собой пуриновое или пиримидиновое основание либо его аналог или производное. 14. Способ по п.1, отличающийся тем, что промежуточное соединение формулы (II) получают взаимодействием промежуточного соединения формулы (II') 18 щенных силильных групп общей формулы(R3')(R4')(R5')Si, где R3', R4', R5' являются такими,как определено выше; насыщенного или ненасыщенного селененил С 6-20 арила; замещенного или незамещенного С 6-20 арилсульфенила; замещенного или незамещенного С 1-20 алкоксиалкила и триалкилсилокси. 15. Способ по п.14, отличающийся тем, что кислота Льюиса выбрана из TMSI и SiH2I2. 16. Способ по п.15, отличающийся тем, что кислота Льюиса представляет собой TMSI. 17. Способ по п.14, отличающийся тем, чтоR1 представляет собой бензил. 19. Способ по любому из пп.14-18, отличающийся тем, что затем удаляют защиту соединения формулы (III) с получением соединения формулы (I) где L' является уходящей группой, с кислотой Льюиса формулы (VI) где R3', R4' и R5' независимо выбраны из группы,состоящей из водорода; С 1-20 алкила, возможно замещенного галогенами, С 6-20 алкокси или С 6-20 арилокси; С 7-20 аралкила, возможно замеили щенного галогеном,С 1-20 алкилом С 1-20 алкокси; С 6-20 арила, возможно замещенного галогенами, С 1-20 алкилом или С 1-20 алкокси; триалкилсилила; фтора-; брома-; хлора- и йода-; иR6' выбран из группы, состоящей из галогена; С 1-20 сульфонатных сложных эфиров, возможно замещенных галогенами; сложных С 1-20 алкил эфиров, возможно замещенных галогеном; моновалентных полигалидов; тризаме где R2 представляет собой пуриновое или пиримидиновое основание либо его аналог или производное. 20. Способ по п.19, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -15 С. 21. Способ по п.19, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -20 С. 22. Способ по п.19, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -50 С. 23. Способ по п.19, отличающийся тем, что реакцию гликозилирования проводят при температуре ниже примерно -78 С.
МПК / Метки
МПК: C07H 19/06, C07D 411/04
Метки: нуклеозидов, способ, диоксолановых, бета-конфигурацией, синтеза
Код ссылки
<a href="https://eas.patents.su/10-844-sposob-sinteza-dioksolanovyh-nukleozidov-s-beta-konfiguraciejj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза диоксолановых нуклеозидов с бета-конфигурацией</a>














