Пептид , выделенный из гемолимфы скорпиона androctonus australis, антибактериальная композиция, противогрибковая композиция, способ защиты растений и способ получения пептида.
Номер патента: 843
Опубликовано: 24.04.2000
Авторы: Сабатье Лоранс, Бюле Филипп, Хоффманн Жюль, Этрю Шарль
Формула / Реферат
1. Пептид, выделенный из гемолимфы скорпиона Androctonus australis, имеющий следующую структуру
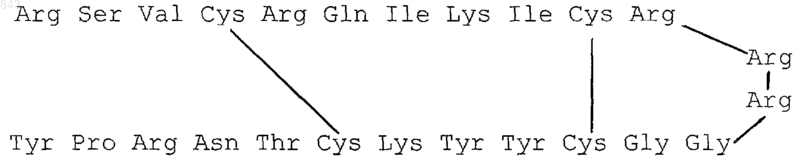
2. Антибактериальная композиция, отличающаяся тем, что в качестве действующего начала она содержит пептид по п.1 формулы.
3. Композиция по п.2, используемая для защиты растений от патогенных бактерий.
4. Композиция по п.2, используемая для терапевтического лечения человека или животного.
5. Противогрибковая композиция, отличающаяся тем, что в качестве действующего начала она содержит пептид по п.1 формулы.
6. Композиция по п.5, используемая для защиты растений от патогенных грибов.
7. Композиция по п.5, используемая для терапевтического лечения человека или животного.
8. Способ защиты растений от бактериальных заболеваний, отличающийся тем, что на растения наносят пептид по п.1 формулы.
9. Способ защиты растений от грибковых заболеваний, отличающийся тем, что на растения наносят пептид по п.1 формулы.
10. Способ получения пептида по п.1 формулы, заключающийся в том, что осуществляют следующие стадии:
а) отбирают гемолимфу у скорпиона Androctonus australis;
б) экстрагируют гемолимфому кислым раствором при перемешивании и далее центрифугированием;
в) фракционируют полученный супернатант с вымыванием гидрофильных молекул и элюированием гидрофобных молекул на разделительной колонке;
г) очищают активную фракцию, представляющую собой целевой продукт, и определяют аминокислотную последовательность пептида.
Текст
1 Предметом настоящего изобретения являются новый пептид, обладающий антибактериальными и противогрибковыми свойствами, и используемые в сельском хозяйстве и терапии человека или животного композиции, содержащие этот пептид в качестве действующего начала. Изобретение также относится к способам обработки растений с помощью этих композиций, а также к способам получения этого пептида. Давно известно, что насекомые обладают эффективной устойчивостью против бактерий. Эта защита в значительной степени базируется на быстром синтезе нескольких семейств пептидов. Эта защита вызвана быстрым синтезом нескольких семейств пептидов с широким спектром активности. Этот синтез индуцируется септической раной или инъекцией небольшой дозы бактерий. Из антибактериальных индуцированных пептидов лучше всего охарактеризованы секропины и дефензины насекомых. Некоторые другие антибактериальные пептиды охарактеризованы частично. Кроме класса насекомых, в отношении других членистоногих известно немного. Скорпионы являются более древними животными,чем насекомые, на филогенетическом уровне. В настоящее время выделен образовавшийся за счет индукции у скорпиона Androctnusaustralis пептид, который обладает замечательными характеристиками, также как антибактериальными и противогрибковыми свойствами. Более конкретно, первый аспект изобретения относится к пептиду формулы (I) В дальнейшем молекула формулы (I) будет называться андроктонин. Эта молекула в редуцированном виде включает 4 цистеиновых остатка, образующих два внутримолекулярных мостика. Другой аспект изобретения относится к первому способу получения и выделения вышеуказанного пептида, который отличается тем,что последовательно: а) отбирают гемолимфу у скорпиона Androctonus australis; б) экстрагируют гемолимфому кислым раствором при перемешивании и далее центрифугированием; в) фракционируют полученный супернатант с вымыванием гидрофильных молекул и элюированием гидрофобных молекул на разделительной колонке; г) очищают активную фракцию, представляющую собой целевой продукт, и определяют аминокислотную последовательность пептида. 2 Гемолимфу отбирают путем кутикулярного надреза. Ее собирают в пробирку, содержащую ингибитор протеазы. После центрифугирования для удаления клеток крови плазму хранят при температуре -30 С. Предпочтительно, во второй стадии (экстракция) гемолимфу Androctonus australis вводят в контакт с кислой средой, образованной кислым раствором кислоты (рН=2). Раствор может представлять собой раствор неорганической или органической кислоты, как, например, трифторуксусная кислота. Полученный экстракт затем центрифугируют на холоду с ускорением 30000g при температуре 4 С в течение 25 мин. Предпочтительно, в третьей стадии (фракционирование) экстракт помещают в патрон с обращенной фазой для реализации экстракции из твердой фазы. Вымывание растворимых в воде молекул осуществляют с помощью кислого разбавленного раствора, и элюирование гидрофобных молекул осуществляют с помощью соответствующего элюирующего средства. Хороших результатов достигают с помощью трифторуксусной кислоты для вымывания и элюирующего средства, содержащего возрастающие количества ацетонитрила в кислом разбавленном растворе. Предпочтительно, четвертую стадию (очистка) осуществляют с помощью пригодного элюирующего средства, которое может быть отличным или идентичным таковому предыдущей стадии. Предпочтительно, в третьей стадии (характеризация) природу пептида анализируют по методу секвенирования путем деградации по Эдману (Acta Chemica Scandinavia, 10, 761-768(1956. Согласно этому методу получают следующие структуры: В положениях 4, 10, 16 и 20 не обнаружено никакого сигнала (деградация по Эдману). Наличие цистеинов в этих положениях показано путем масс-спектрометрии, причем полученная тогда структура является следующей: Определенные массы вышеуказанного андроктонина составляют соответственно 3076,650,24 Да; однако, массы, рассчитанные на основании данных последовательности, составляют соответственно 3080,650,24 Да; дефект массы соответствует образованию двух внутримолекулярных дисульфидных мостиков. Для установления соединения дисульфидных мостиков молекулу расщепляют с помощью фермента эндопротеиназы Lys-C, который рас 3 щепляет пептидную цепь после лизина. Полученные пептиды выделяют,и массспектрометрия показывает, что речь идет о двух пептидах, связанных дисульфидным мостиком. Выведенными последовательностями являютсяGly Cys Туr Туr. Таким образом установлено соединение дисульфидных мостиков и цистеин 1 связан с цистеином 4, цистеин 2 связан с цистеином 3. Этот результат может быть схематически представлен следующим образом: Эти хорошие корреляции подтверждают предполагаемые последовательности. Пептиды согласно изобретению также могут быть получены без труда по второму способу путем химического синтеза FMOC ( Atherton и Sheppard(IRL, Оксфорд, UK) с последующей ренатурацией в 100 мМ растворе ацетата аммония с рН = 8,5 в течение 24 ч при перемешивании и при комнатной температуре. Полученный андроктонин обладает такими же хроматографическими свойствами, как и природная молекула, и соединение дисульфидных мостиков идентично таковому природной молекулы. Определенная после ренатурации масса (3076,61 0,67) очень сходна с таковой природной молекулы. Синтетическая молекула имеет такую же антибактериальную активность, как и природная молекула, в отношении бактерии Micrococcus liteus. При использовании синтетической молекулы реализуют совокупность антибактериальных и гемолитических тестов: 1. Андроктонин не обладает никаким лизирующим воздействием на эритроциты свиньи или быка. 2. Эти молекулы обладают антибактериальными свойствами по отношению к грамотрицательным и грамположительным бактериям(см. табл.1), фитопатогенным бактериям и фитопатогенным грибам. Следующие примеры иллюстрируют получение и антибактериальные свойства пептидов и композиций согласно изобретению. Пример 1. Выделение и характеризация пептида. Выделение и характеризацию пептида осуществляют согласно следующим стадиям: Экстракция и очистка: Гемолимфу (3,8 мл) отбирают путем кутикулярного надреза. Е переносят в поддерживаемую на холоду пробирку, содержащую ингибитор протеаз (апротинин), затем центрифугируют с ускорением 30 000 g в течение 25 мин 4 при температуре 4 С. Таким образом полученный супернатант немедленно подвергают различным стадиям очистки. Фракционирование экстракта при использовании патрона Sep-Pak C18: После внесения экстракта в патроны SepPak C18, молекулы с гидрофильным характером удаляют путем простой промывки с помощью 5 мл воды, подкисленной 0,05% трифторуксусной кислотой (ТФУК). Элюирование гидрофобных молекул осуществляют с помощью растворов с 10, 40 и 80% ацетонитрила в подкисленной воде (0,05 % ТФУК; 5 мл на патрон). Собранные фракции обозначают "элюирование 10%", "элюирование 40%" и "элюирование 80%" и концентрируют в вакууме. Фракции затем реконструируют с помощью воды качества "для ВЭЖХ" перед анализом ВЭЖХ (высокоэффективная жидкостная хроматография). Очистка путем ВЭЖХ молекул с антибактериальной активностью, первая стадия: Фракцию "элюирование 40%" анализируют на колонке с обращенной фазой AquaporeOD 300 C18 с линейным градиентом ацетонитрила 2-52% в подкисленной воде (ТФУК, 0,05%) в течение 90 мин (или увеличение содержания ацетонитрила на 0,44% в минуту) с расходом 1 мл/ мин. Полученные в результате активные фракции затем очищают на колонке "High PressureInert" (HPI) Delta Pak C18 (1503,9 мм). Элюирование осуществляют с линейным двухфазным градиентом ацетонитрила от 2 до 11% в подкисленной воде (6 мМ НСl) в течение 10 мин и от 11 до 21% в течение 50 мин, с расходом 1 мл/мин. Чистоту активной фракции контролируют путем капиллярного электрофореза перед определением последовательности методом деградации по Эдману и анализируют масс-спектрометрически. Пример 2. Тест ин витро: определение антибактериальной активности путем микроспектрофотометрии. Для каждого штамма используемой бактерии (Е. coli; М. luteus), выделенную колонку суспендируют в 10 мл среды РВ (обедненный бульон; среда Луриа-Бертани без дрожжевого экстракта) (ДИФКО) и инкубируют при 30 С в течение ночи при медленном перемешивании. Испытуемые бактерии доводят до оптической плотности 0,001 при 600 нм в свежей культуральной среде. По 10 мкл каждой фракции помещают в микротитрационные планшеты в присутствии 100 мкл бактериальной суспензии. После инкубации в течение 24 ч при температуре 25 С оценивают рост путем измерения поглощения при 600 нм с помощью устройства для считывания микротитрационных планшетов. В этих условиях наблюдают ингибирование на 50% при концентрациях, выраженных в мкмоль, указанных в следующей табл.1. Таблица 1 Бактерии Используя тот же самый протокол эксперимента, но при применении фитопатогенных бактерий, получают следующие результаты. Таблица 2 Бактерии Андроктонин MICXanthomonas phaseolica 1-2 Используя тот же самый протокол эксперимента, но при применении фитопатогенных грибов, получают следующие результаты: Таблица 3 Андроктонин ГрибыFusarium oxysporum meloni 2-4 среда, дополненная 1 ммоль СаСl2 и 20 ммоль КСl Из культур, которые могут составить объект антибактериальной обработки с помощью 6 соединения согласно изобретению, можно назвать в качестве примеров рис, зерновые культуры, особенно пшеницу и ячмень, также как древесные растения, плодоносящие растения,овощные растения. Из культур, которые могут составить объект противогрибковой обработки с помощью соединения согласно изобретению, можно назвать в качестве примеров тыквовидные, цветочные культуры (петунья) и овощные культуры(морковь, томаты, капуста). Эти результаты показывают превосходную антибактериальную активность пептида согласно изобретению, который можно применять по отношению к человеку, животному и растению. Предметом настоящего изобретения также являются композиции, используемые в качестве антибактериальных средств и содержащие в качестве действующего начала (действующих начал) одно (или несколько) соединение согласно изобретению, такое, как описанное выше, в смеси с твердыми или жидкими носителями,приемлемыми в сельском хозяйстве, и поверхностно-активными веществами, также приемлемыми в сельском хозяйстве. В особенности используют инертные и обычные носители и обычные поверхностно-активные вещества. Эти композиции охватывают не только композиции,готовые к нанесению на обрабатываемую культуру с помощью приспособленного для этой цели устройства, такого, как устройство для пульверизации, но также и продажные концентрированные композиции, которые нужно разбавлять перед нанесением на культуру. Эти композиции также могут содержать любого рода другие ингредиенты, такие как,например, защитные коллоиды, адгезивы, загустители, тиксотропные агенты, способствующие пенетрации агенты, стабилизаторы, комплексообразователи и т.д. Используемые согласно изобретению соединения обычно можно комбинировать со всеми твердыми или жидкими добавками, соответствующими обычным способам получения препаративных форм. Вообще, композиции согласно изобретению обычно содержат примерно 0,05-95 мас.% соединения согласно изобретению (называемого далее действующим началом), один или несколько твердых или жидких носителей и, в случае необходимости, одно или несколько поверхностно-активных веществ. Термином "носитель" в настоящем изложении обозначают органическое или неорганическое природное или синтетическое вещество,с которым соединение комбинируют для облегчения его нанесения на растение, на зерна или на почву. Этот носитель, следовательно, обычно является инертным, и он должен быть приемлем в сельском хозяйстве, особенно в отношении обрабатываемого растения. Носитель может быть твердым (глины, природные или синтетические силикаты, диоксид кремния, смолы, вос 7 ки, твердые удобрения и т.д.) или жидким (вода,спирты, особенно бутанол, и т.д.). Поверхностно-активным веществом может быть эмульгатор, диспергатор или смачиватель ионного или неионного типа или смесь таких поверхностно-активных веществ. Например,можно назвать соли полиакриловых кислот, соли лигносульфокислот, соли фенолсульфокислот или нафталин-сульфокислот, поликонденсаты этиленоксида с жирными спиртами или жирными кислотами или жирными аминами, замещенные фенолы (особенно алкилфенолы или арилфенолы), соли эфиров сульфоянтарных кислот, производные таурина (особенно алкилтаураты), эфиры фосфорной кислоты с полиоксиэтилированными спиртами или фенолами, эфиры жирных кислот с полиолами, производные с сульфатными функциями, сульфонаты и фосфаты предыдущих соединений. Присутствие, по крайней мере, одного поверхностно-активного вещества обычно необходимо, когда соединение и/или инертный носитель не растворимы в воде и когда векторным агентом нанесения является вода. Таким образом, следовательно, композиции для использования в сельском хозяйстве могут содержать действующие начала согласно изобретению в очень широких пределах от 0,05 до 95 мас.%. Содержание поверхностноактивного вещества в них предпочтительно составляет 5-40 мас.%. Эти композиции согласно изобретению сами находятся в довольно различных твердых или жидких формах. В качестве твердых форм композиций можно назвать порошки для опыливания (с содержанием соединения, которое может достигать 100%), и гранулы, особенно таковые, полученные путем экструзии, уплотнения, пропитки гранулированного носителя, гранулирования из порошка (содержание соединения в этих гранулах составляет 0,5-80% в этом последнем случае), таблетки или шипучие таблетки. Пептиды согласно изобретению могут быть ещ использованы в форме порошков для опыливания; можно также использовать композицию, содержащую 50 г действующего начала и 950 г талька; можно также использовать композицию, содержащую 20 г действующего начала, 10 г тонко измельченного диоксида кремния и 970 г талька; эти компоненты смешивают и размельчают и смесь наносят путем опыливания. В качестве жидких форм композиций или форм, предназначенных для получения жидких композиций во время нанесения, можно назвать растворы, в особенности растворимые в воде концентраты, эмульгируемые концентраты,эмульсии, концентрированные суспензии, аэрозоли, смачивающиеся порошки (или порошок для пульверизации), пасты, гели. 8 Эмульгируемые или растворимые концентраты чаще всего содержат 10-80% действующего начала, причем готовые к нанесению эмульсии или растворы содержат, что касается их, 0,001-20% действующего начала. Кроме растворителя, эмульгируемые концентраты могут содержать, когда это необходимо, 2-20% соответствующих добавок, как вышеуказанные стабилизаторы,поверхностноактивные вещества, агенты, способствующие проникновению ингибиторы коррозии, красители или адгезивные вещества. На основе этих концентратов путем разбавления водой можно получать эмульсии любой желательной концентрации, которые особенно пригодны для нанесения на культуры. В качестве примера ниже приводится состав нескольких эмульгируемых концентратов(ЭК): Пример ЭК 1: Действующее начало 400 г/л Додецилбензолсульфонат щелочного металла 24 г/л Нонилфенол, оксиэтилированный 10 молекулами этиленоксида 16 г/л Циклогексанон 200 г/л Ароматический растворитель до общего объема 1 л Согласно другой препаративной форме эмульгируемого концентрата, используют: Пример ЭК 2: Действующее начало 250 г Эпоксидированное растительное масло 25 г Смесь алкиларилсульфоната с простым полигликолевым эфиром и жирными спиртами 100 г Диэтилформамид 50 г Ксилол 575 г Концентрированные суспензии, также наносимые путем пульверизации, приготовляют по способу получения жидкого стабильного и не осаждающегося продукта, и они обычно содержат 10-75% действующего начала, 0,5-15% поверхностно-активных веществ, 0,1-10% тиксотропных агентов, 0-10% соответствующих добавок, как пеногасители, ингибиторы коррозии,стабилизаторы, агенты, способствующие проникновению, и адгезивы, и, в качестве носителя,воду или органическую жидкость, в которой действующее начало малорастворимо или не растворимо; некоторые твердые органические вещества или неорганические соли могут быть растворены в носителе для способствования предотвращению седиментации или в качестве антигелей для воды. Ниже приводится пример концентрированной суспензии (КС): Пример КС 1: Действующее начало 500 г 9 Полиэтоксилированный тристирилфенолфосфат 50 г Полиэтоксилированный алкилфенол 50 г Поликарбоксилат натрия 20 г Этиленгликоль 50 г Органополисилоксановое масло (пеногаситель) 1 г Полисахарид 1,5 г Вода 316,5 г Смачивающиеся порошки (или порошок для пульверизации) обычно приготовляют таким образом, что они содержат 20-95% действующего начала, и они обычно содержат, кроме твердого носителя, 0-30% смачивателя, 3-20% диспергатора и, когда это необходимо, 0,1-10% одного или нескольких стабилизаторов и/или других добавок, как способствующие пенетрации агенты, адгезивы, или препятствующие комкованию агенты, красители, и т.д. Для получения порошков для пульверизации или смачивающихся порошков в соответствующих смесителях тщательно смешивают действующие начала с добавками и размельчают с помощью мельниц или других соответствующих дробилок. Тем самым получают порошки для пульверизации, смачиваемость и суспендируемость которых предпочтительны; их можно суспендировать в воде до любой желательной концентрации, и эти суспензии очень предпочтительно используют в особенности для нанесения на листья растений. Вместо смачивающихся порошков можно приготовлять пасты. Условия и особенности получения и использования этих паст подобны таковым для смачивающихся порошков или порошков для пульверизации. В качестве примера ниже приводятся различные составы смачивающихся порошков (или порошков для пульверизации) (СП): Пример СП 1: Действующее начало 50% Этоксилированный жирный спирт (смачиватель) 2,5% Этоксилированный фенилэтилфенол (диспергатор) 5% Мел (инертный носитель) 42,5% Пример СП 2: Действующее начало 10% Синтетический оксо-спирт разветвленного типа с 13 атомами углерода, этоксилированный 8-10 молекулами этиленоксида(диспергатор) 12% Карбонат кальция (инертный наполнитель) до общего количества 100% 10 Пример СП 3: Этот смачивающийся порошок содержит те же ингредиенты, что и в предыдущем примере, в нижеуказанных пропорциях: Действующее начало 75% Смачиватель 1,50% Диспергатор 8% Карбонат кальция (инертный наполнитель) до общего количества 100% Пример СП 4: Действующее начало 90% Этоксилированный жирный спирт (смачиватель) 4% Этоксилированный фенилэтилфенол(диспергатор) 5% Каолин (инертный носитель) 42,5 % Водные дисперсии и эмульсии, например,композиции, получаемые путем разбавления водой смачивающегося порошка или эмульгируемого концентрата согласно изобретению,входят в общие рамки настоящего изобретения. Эмульсии могут быть типа вода-в-масле или масло-в-воде и они могут иметь густую консистенцию,аналогичную консистенции майонеза. Из соединений согласно изобретению можно получать композиции в форме диспергирующихся в воде гранул, которые также входят в рамки изобретения. Эти диспергирующиеся гранулы с кажущейся плотностью обычно около 0,3-0,6 имеют размер частиц, обычно составляющий примерно 150-2000 микрон и предпочтительно 300-1500 микрон. Содержание действующего начала в этих гранулах обычно составляет примерно 1-90% и предпочтительно 25-90%. Остальная часть гранулы образована по существу твердым наполнителем и, в случае необходимости, поверхностно-активными добавками, придающими грануле свойства диспергируемости в воде. Эти гранулы могут быть по существу двух различных типов, в зависимости от того, растворим или нет в воде содержащийся в них наполнитель. Когда наполнитель растворим в воде, он может быть минеральным или, предпочтительно, органическим. Превосходных результатов достигают при использовании мочевины. В случае нерастворимого наполнителя он предпочтительно является минеральным, как, например, каолин или бентонит. Тогда ему предпочтительно сопутствуют поверхностно-активные вещества (по 2-20 мас.% в расчете на массу гранулы), более половины которых 11 составляет, по крайней мере, один, главным образом, анионный диспергатор, такой как полинафталинсульфонат щелочного или щелочноземельного металла или лигносульфонат щелочного или щелочно-земельного металла, причем остаток образуют неионные или анионные смачиватели, такой как алкилнафталинсульфонат щелочного или щелочно-земельного металла. Кроме того, хотя это не является необходимым, можно добавлять другие добавки, такие,как пеногасители. Гранулы согласно изобретению могут быть получены путем смешения необходимых ингредиентов, затем гранулирования согласно нескольким самим по себе известным способам(дражирование, использование псевдоожиженного слоя, атомизация, экструзия и т.д.). Заканчивают обычно дроблением с последующим просеиванием до размера частиц, выбранного в вышеуказанных пределах. Можно ещ использовать гранулы, полученные как описано выше,затем пропитанные содержащей действующее начало композицией. Предпочтительно, диспергирующиеся гранулы (ДГ) получают путем экструзии, следуя указанным в нижеследующих примерах методикам. Пример ДГ 1: Диспергирующиеся гранулы. В смесителе смешивают 90 мас.% действующего начала с 10% мочевины в виде шариков. Смесь затем гомогенизируют в стержневой дробилке. Получают порошок, который увлажняют с помощью примерно 8 мас.% воды. Влажный порошок экструдируют в перфорированном валковом экструдере. Получают гранулы, которые сушат, затем дробят и просеивают,чтобы сохранить соответственно только гранулы величиной 150-2000 микрон. Пример ДГ 2: Диспергирующиеся гранулы. В смесителе смешивают следующие компоненты: Действующее начало 75% Смачиватель (алкилнафталинсульфонат натрия) 2% Диспергатор (полинафталинсульфонат натрия) 8% Инертный наполнитель,не растворимый в воде (каолин) 15% Эту смесь гранулируют в псевдоожиженном слое в присутствии воды, затем высушивают, дробят и просеивают, чтобы получить гранулы размером 0,15-0,80 мм. Эти гранулы могут быть использованы индивидуально, в виде раствора или дисперсии в воде, чтобы получить искомую дозу. Их также можно использовать для получения сочетаний с другими действующими началами, особенно антибактериальными, причем эти последние 12 находятся в форме смачивающихся порошков,или гранулами или водными суспензиями. В том, что касается композиций, предназначенных для хранения или транспортировки,то они более предпочтительно содержат 0,5-95 мас.% активного вещества. Изобретение также относится к способу терапевтической антибактериальной обработки человека или животного путем введения эффективной дозы пептида согласно изобретению, в свободной форме или, в случае необходимости,в виде фармацевтически приемлемых солей присоединения кислоты, Andallique-солей или солей присоединения основания, в чистом состоянии или в форме композиции, в которой пептид ассоциирован с любым другим фармацевтически приемлемым продуктом, который может быть инертным или физиологически активным. Лекарственные средства согласно изобретению можно вводить перорально, парентерально, ректально или локально. В качестве твердых композиций для введения перорально могут быть использованы таблетки, пилюли, порошки (особенно в желатиновых: капсулах или крахмальных облатках) или гранулы. В этих композициях активный продукт согласно изобретению смешан с одним или несколькими инертными разбавителями,такими как крахмал, целлюлоза, сахароза, лактоза или диоксид кремния. Эти композиции также могут включать другие вещества, например одну или несколько смазок, как стеарат магния или тальк, краситель, защитное покрытие (драже) или лак. В качестве жидких композиций для введения перорально можно использовать фармацевтически приемлемые растворы, суспензии,эмульсии, сиропы и эликсиры, содержащие инертные разбавители, такие как вода, этанол,глицерин, растительные масла или парафиновое масло. Эти композиции также могут включать другие вещества, как, например, смачиватели,подслащивающие средства, загустители, ароматизаторы или стабилизаторы. Стерильные композиции для парентерального введения могут представлять собой предпочтительно водные или неводные растворы,суспензии или эмульсии. В качестве растворителя или наполнителя можно использовать воду,пропиленгликоль, полиэтиленгликоль, растительные масла, в особенности оливковое масло,пригодные сложные органические эфиры. Эти композиции также могут содержать добавки, в особенности смачиватели, изотонизирующие средства, эмульгаторы, диспергаторы и стабилизаторы. Стерилизацию можно осуществлять различными способами, например путем асептизирующей фильтрации, путем введения в композицию стерилизующих компонентов, путем облучения или нагревания. Эти композиции могут быть также получены в форме твердых стерильных композиций, которые в момент употребления могут быть разбавлены в стерильной среде для инъекции. Композициями для ректального введения являются суппозитории или ректальные капсулы, которые содержат, кроме активного пептида, наполнители, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли. Стерильные композиции для локального введения могут представлять собой, например,кремы, мази, лосьоны, примочки для глаз, жидкости для полоскания полости рта и аппликации на десны, капли в нос или аэрозоли. В терапии человека, пептид, согласно изобретению, особенно пригоден для антибактериальных обработок. Дозы зависят от искомого эффекта и продолжительности обработки; они обычно составляют 50-1000 мг в день перорально для взрослого человека за один или несколько приемов. Вообще, врач определяет дозировку, которую он считает наиболее соответствующей, в зависимости от возраста, массы и всех других факторов, присущих обрабатываемому субъекту. Следующие примеры, данные в качестве не ограничивающих объема охраны изобретения, иллюстрируют композиции согласно изобретению. Пример А. Обычным способом готовят таблетки с дозой 50 мг активного пептида, имеющие следующий состав, мг: Пептид андроктонинM1 50 Крахмал 60 Лактоза 50 Стеарат магния 2 Пример Б. Готовят раствор для инъекции, содержащий 20 мг активного пептида и имеющий следующий состав: Пептид андроктонин М 2, мг 22,4 Дистиллированная вода до общего объема, см 3 2 14 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пептид, выделенный из гемолимфы скорпиона Androctonus australis, имеющий следующую структуру 2. Антибактериальная композиция, отличающаяся тем, что в качестве действующего начала она содержит пептид по п.1 формулы. 3. Композиция по п.2, используемая для защиты растений от патогенных бактерий. 4. Композиция по п.2, используемая для терапевтического лечения человека или животного. 5. Противогрибковая композиция, отличающаяся тем, что в качестве действующего начала она содержит пептид по п.1 формулы. 6. Композиция по п.5, используемая для защиты растений от патогенных грибов. 7. Композиция по п.5, используемая для терапевтического лечения человека или животного. 8. Способ защиты растений от бактериальных заболеваний, отличающийся тем, что на растения наносят пептид по п.1 формулы. 9. Способ защиты растений от грибковых заболеваний, отличающийся тем, что на растения наносят пептид по п.1 формулы. 10. Способ получения пептида по п.1 формулы, заключающийся в том, что осуществляют следующие стадии: а) отбирают гемолимфу у скорпионаAndroctonus australis; б) экстрагируют гемолимфому кислым раствором при перемешивании и далее центрифугированием; в) фракционируют полученный супернатант с вымыванием гидрофильных молекул и элюированием гидрофобных молекул на разделительной колонке; г) очищают активную фракцию, представляющую собой целевой продукт, и определяют аминокислотную последовательность пептида.
МПК / Метки
МПК: A01N 63/02, A61K 38/17, C07K 14/435
Метки: australis, способ, противогрибковая, пептид, растений, гемолимфы, защиты, выделенный, композиция, получения, пептида, androctonus, антибактериальная, скорпиона
Код ссылки
<a href="https://eas.patents.su/8-843-peptid-vydelennyjj-iz-gemolimfy-skorpiona-androctonus-australis-antibakterialnaya-kompoziciya-protivogribkovaya-kompoziciya-sposob-zashhity-rastenijj-i-sposob-polucheniya-peptida.html" rel="bookmark" title="База патентов Евразийского Союза">Пептид , выделенный из гемолимфы скорпиона androctonus australis, антибактериальная композиция, противогрибковая композиция, способ защиты растений и способ получения пептида.</a>
Предыдущий патент: Стабильные гербицидные композиции, содержащие хелаты гербицидных дионовых соединений с металлами
Следующий патент: Способ синтеза диоксолановых нуклеозидов с бета-конфигурацией
Случайный патент: Способ холодного гидрохимического разложения гидроалюмосиликата натрия












