Способ получения 4-замещенных 1н-индол-3-глиоксамидов
Формула / Реферат
1. Способ получения соединения формулы I или его фармацевтически приемлемой соли или пролекарственного производного

где R1 выбран из группы, включающей (C7-C20)алкил,
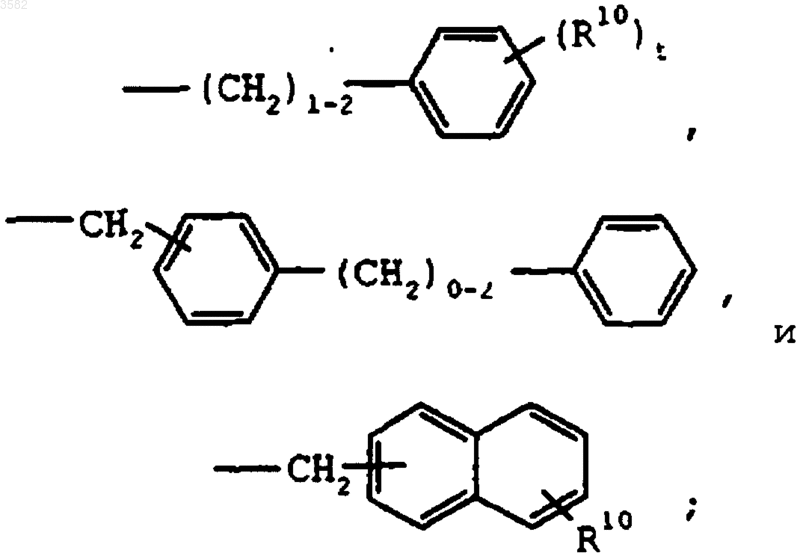
где R10 выбран из группы, включающей галоген, (C1-C10)алкил, (C1-C10)алкокси, -S-(C1-C10)алкил и галоген(C1-C10)алкил, и t представляет собой целое число от 0 до 5 включительно;
R2 выбран из группы, включающей водород, галоген, (C1-C3) алкил, (C3-C4)циклоалкил, (C3-C4)циклоалкенил, -O-(C1-C2)алкил, -S-(C1-C2)алкил, арил, арилокси и HET;
R4 выбран из группы, включающей -CO2H, -SO3H и -P(O)(OH)2 или их соли или пролекарства; и
R5 выбран из группы, включающей водород, (C1-C6)алкил, (C1-C6)алкокси, галоген(C1-C6)алкокси, галоген(C2-C6)алкил, бром, хлор, фтор, йод и арил,
который включает стадии
e) окисления соединения формулы V
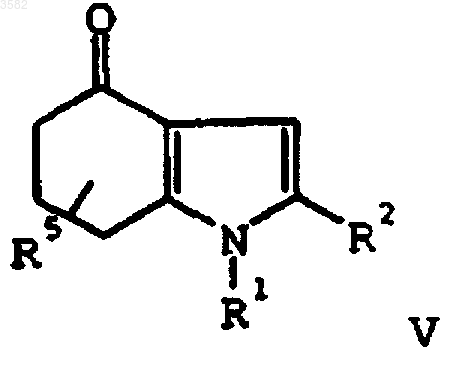
путем нагревания с основанием и соединением формулы RSOX, где R представляет собой (C1-C6)алкил или арил и X представляет собой (C1-C6)алкокси, галоген или -OCO2(C1-C6)алкил, с получением соединения формулы IV
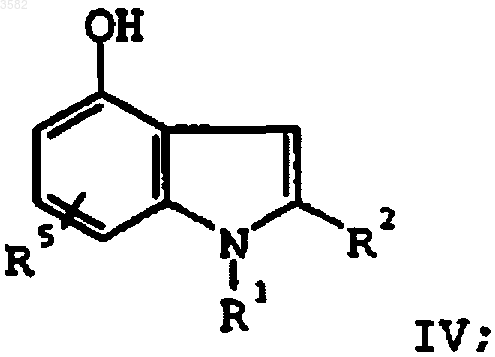
f) алкилирования соединения формулы IV
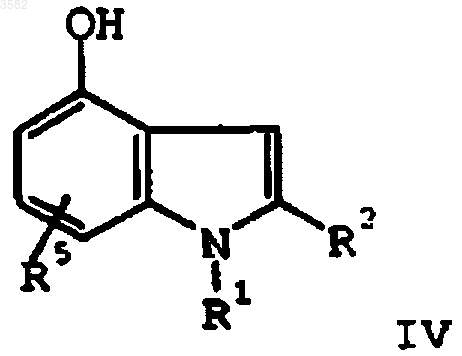
алкилирующим агентом формулы XCH2R4a, где X представляет собой удаляемую группу и R4a представляет собой -CO2R4b, -SO3R4b, -P(O)(OR4b)2 или -P(O)(OR4b)H, где R4b представляет собой защитную группу кислоты, с получением соединения формулы III
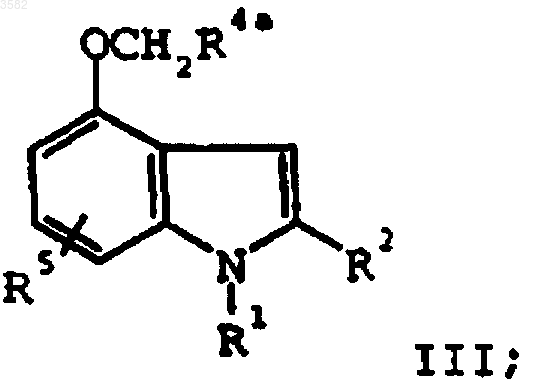
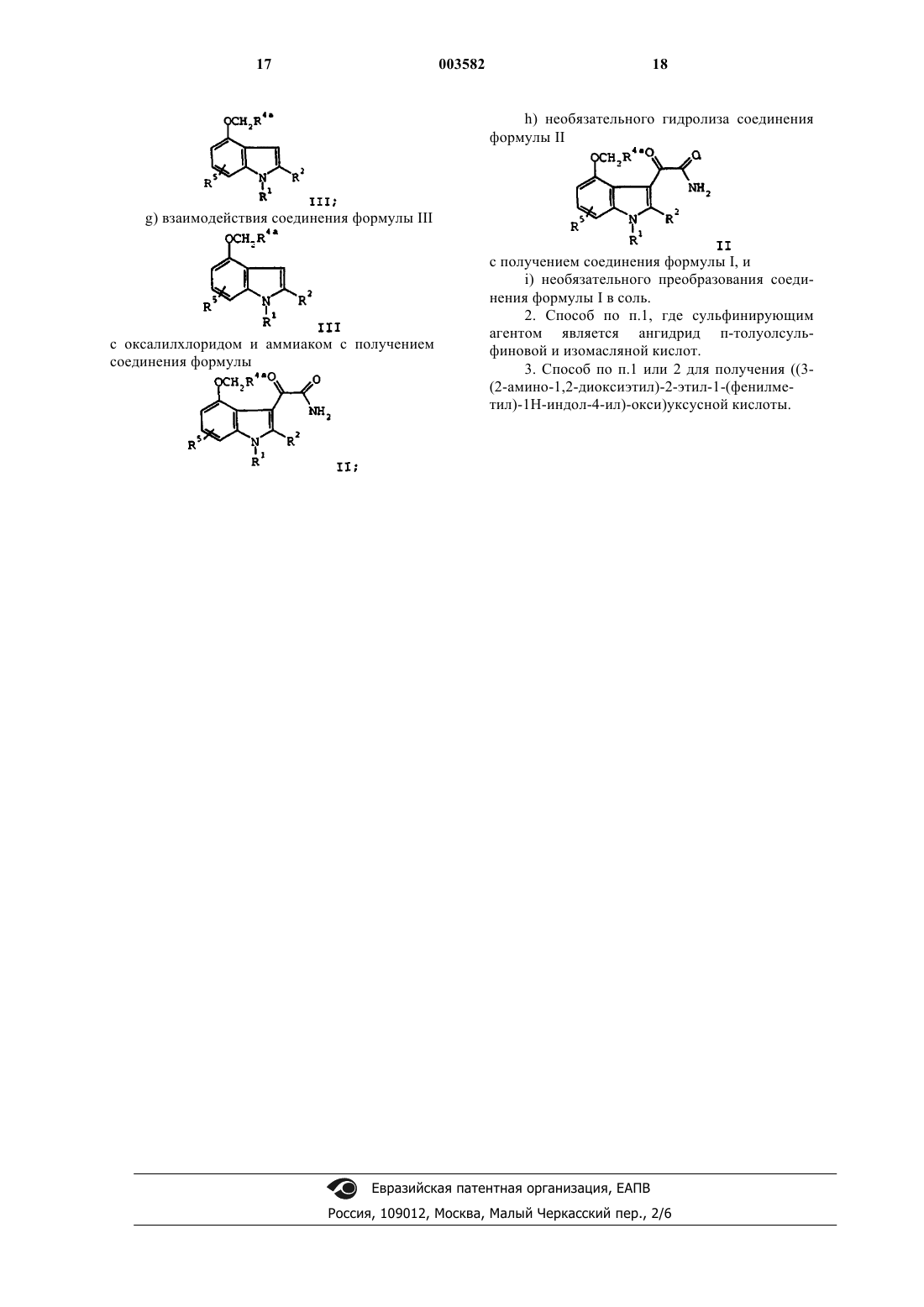
g) взаимодействия соединения формулы III

с оксалилхлоридом и аммиаком с получением соединения формулы

h) необязательного гидролиза соединения формулы II
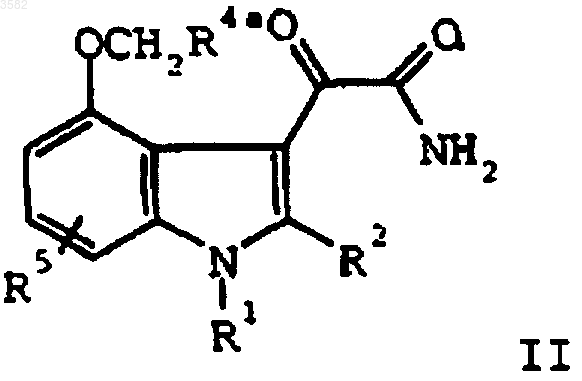
с получением соединения формулы I, и
i) необязательного преобразования соединения формулы I в соль.
2. Способ по п.1, где сульфинирующим агентом является ангидрид п-толуолсульфиновой и изомасляной кислот.
3. Способ по п.1 или 2 для получения ((3-(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1H-индол-4-ил)окси)уксусной кислоты.
Текст
1 Настоящее изобретение относится к способу получения некоторых 1H-индол-3-глиоксамидов, которые могут использоваться для ингибирования опосредствованного sPLA2 выделения жирных кислот при состояниях, таких как септический шок, и к промежуточным соединениям, которые используются при их получении. Известно, что некоторые 1H-индол-3 глиоксамиды являются эффективными и селективными ингибиторами sPLA2 у млекопитающих, и могут использоваться для лечения заболеваний, таких как септический шок, респираторный дистресс-синдром у взрослых, панкреатиты, травмы, бронхиальная астма, аллергические риниты, ревматоидные артриты и родственные индуцируемые sPLA2 заболевания. Такие соединения описаны, например, в публикации ЕРО 0675110. В различных патентах и публикациях описаны способы получения указанных соединений с использованием промежуточных соединений на основе 4-гидроксииндола. В статье "Researches en serie indolique. VIIgolen and Hanne Igolen, Bull. Soc. Chim. France,1962, pp. 1060-1068", описаны некоторые индол 3-глиоксиламиды и их преобразование в производные триптаминов. В статье "2-Aril-3-Indoleglyoxylamidesand Experimental Therapeutics, Vol. 262,3, (pp. 971-978) описаны некоторые 2-арил-3-индолглиоксиламиды, которые находят применение для исследований центральной нервной системы млекопитающих. В реферате "Fragmentation of Nbenzylindoles in Mass Spectrometry"; ChemicalAbstracts, Vol. 67, 1967, 73028h описаны различные бензилзамещенные фенолы, включая те,которые содержат глиоксиламидные группы в 3 положении индольных ядер. В патенте США 3449363 описаны трифторметилиндолы, содержащие глиоксиламидные группы в 3-положении индольных ядер. В патенте США 3351630 описаны альфа-замещенные производные 3-индолилуксусной кислоты и их получение, включая глиоксиламидные промежуточные соединения. В патенте США 2825734 описано получение 3-(2-амино-1-гидроксиэтил)индола с использованием 3-индолглиоксиламидных промежуточных соединений, таких как 1-фенетил-2 этил-6-карбокси-N-пропил-3-индолглиоксиламид (см. пример 30). В патенте США 4397850 описано получение изоксазолилиндоламинов с использованием глиоксиламидиндолов в качестве промежуточных соединений.Societe Chimique De France, 1974,12, pp. 2883-2888, описаны различные индолил-3 глиоксамиды, которые представляют собой замещенное водородом 6-членное кольцо индольных ядер. В статье "Indol-Umlagerung von 1-Diphenylamino-2,3-dihydro-2,3-pyrrolidonen" by Gert Kollenz and Christa Labes; Liebigs Ann. Chem., 1975,pp. 1979-1983, описаны фенилзамещенные 3 глиоксиламиды. Во многиех из этих способов используются 4-гидроксииндольные промежуточные соединения. Например, в патенте США 2825734, включенном здесь в качестве ссылки,описан способ получения 4-замещенных-1 Ниндол-3-глиоксамидных производных, включающий взаимодействие соответствующим образом замещенного 4-метоксииндола (полученного по способу Clark, R.D. et al. Synthesis, 1991,pp. 871-878, описание которого включено здесь в качестве ссылки) с гидридом натрия в диметилформамиде при комнатной температуре (2025 С), с последующей обработкой арилметилгалогенидом при комнатной температуре и получением 1-арилметилиндола, который Oдеметилируют с использованием трибромида бора в метиленхлориде (Tsung-Ying Shem andCharles A. Winter, Adv. Drug. Res., 1977, 12, 176,включено здесь в качестве ссылки) с получением 4-гидроксииндола. Алкилирование гидроксииндола осуществляют с помощью эфира альфа-бромалкановой кислоты в диметилформамиде, используя гидрид натрия в качестве основания. Преобразование глиоксамида осуществляют путем взаимодействия эфира [(индол-4-ил)окси]алкановой кислоты сначала с оксалилхлоридом, затем с аммиаком, с последующим гидролизом гидроксидом натрия в метаноле. Способ получения производных 4 замещенных-1 Н-индол-3-глиоксамидов,как было указано выше, известен. Однако в этом способе используют дорогостоящие реагенты и представляющие опасность для окружающей среды органические растворители, образуются фурансодержащие побочные продукты, и выход желаемого продукта относительно низкий. В альтернативном способе получения соответствующим образом замещенный пропионилацетат галогенируют сульфурилхлоридом. Галогенированное промежуточное соединение гидролизуют и декарбоксилируют, обрабатывая хлористо-водородной кислотой, и затем подвергают взаимодействию с соответствующим обра 3 зом замещенным циклогександионом. Обработка алкилированного диона соответствующим амином приводит к получению 4-кетоиндола,который окисляют путем кипячения с обратным холодильником в высококипящем полярном углеводородном растворителе, таком как карбитол, в присутствии катализатора, такого как палладий-на-угле, получая 4-гидроксииндол,который затем можно алкилировать и преобразовать в желаемый глиоксиламид, как указано выше. Однако этот способ ограничен тем, что требует высокой температуры окисления, а также необходима регенерация дорогостоящего металлического катализатора. Хотя описанные выше способы получения 4-гидроксииндольных промежуточных соединений и являются удовлетворительными, желателен более эффективный способ преобразования. Настоящее изобретение относится к усовершенствованному способу получения 1Hиндол-3-глиоксамидов. Способ по настоящему изобретению можно осуществить, используя недорогие, легко доступные реагенты в более мягких условиях, что приводит к более высокому общему выходу. Кроме того, способ по настоящему изобретению позволяет осуществлять преобразование с более широким кругом заместителей у индола. Другие цели, отличительные особенности и преимущества настоящего изобретения будут видны из описания и прилагаемой формулы изобретения. В настоящем изобретении предложен способ получения соединения формулы I или его фармацевтически приемлемой соли или пролекарственного производногоR4 выбран из группы, включающей -СO2 Н,-SО 3 Н и -Р(O)(ОН)2 или их соли или пролекарства; иR5 выбран из группы, включающей водород, (C1-С 6)алкил, (C1-С 6)алкокси, галоген(C1 С 6)алкокси, галоген(C2-С 6)алкил, бром, хлор,фтор, йод и арил,который включает стадии е) окисления соединения формулы V путем нагревания с основанием и соединением формулы RSOX, где R представляет собой (C1 С 6) алкил или арил, и Х представляет собой (C1 С 6)алкокси, галоген или -ОСO2(C1-С 6)алкил, с получением соединения формулы IVf) алкилирования соединения формулы IV алкилирующим агентом формулы XCH2R4a, где Х представляет собой удаляемую группу, и R4a представляет собой-Р(O)(OR )2 или -Р(O)(OR )H, где R представляет собой защитную группу кислоты, с получением соединения формулы IIIg) взаимодействия соединения формулы III где R10 выбран из группы, включающей галоген,(C1-С 10)алкил, (С 1-С 10)алкокси, -S-(С 1-С 10)алкил и галоген(С 1-С 10)алкил, и t представляет собой целое число от 0 до 5 включительно;h) необязательного гидролиза соединения формулы II с получением соединения формулы I, иi) необязательного преобразования соединения формулы I в соль. Для описания соединений по настоящему изобретению используют следующие термины. Как здесь используется, термин "алкил" сам по себе, или как часть другого заместителя,обозначает (если нет другого определения) разветвленную или неразветвленную цепь моновалентного углеводородного радикала, такого как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, гептил, гексил, октил, нонил, децил и т.п. Термин "(C1-С 10)алкокси", как здесь использован, обозначает группу, такую как метокси, этокси, н-пропокси, изопропокси, н-бутокси,трет-бутокси, н-пентокси, изопентокси, неопентокси, гептокси, гексокси, октокси, нонокси,децокси и т.п., присоединенные к остальной части молекулы через атом кислорода. Термин "(С 3-С 4)алкил" включает циклопропильную и циклобутильную группы. Термин "(С 3-С 4)циклоалкенил" включает циклопропенильное или циклобутенильное кольцо с двойной связью в положении 1 или 2. Термин "галоген" означает фтор, хлор,бром или йод. Термин "галоген(C1-С 10)алкил" означает(C1-С 10)алкильную группу, замещенную 1-3 атомами галогена, присоединенными к остальной части молекулы через алкильную группу. Термин галоген (C1-С 10)алкил включает термин галоген(С 2-С 6)алкил. Термин "галоген(C1-С 6)алкокси" означает замещенную галогеном алкоксигруппу, причем эта группа присоединена к остальной части молекулы через кислород алкоксигруппы. Термин "арил" означает группу, содержащую кольцевую структуру бензола, пенталена,индена, нафталина, азулена, гепталена, фенантрена, антрацена и т.д. Арильная группа может быть необязательно замещена 1-3 заместителями, выбранными из группы, включающей (C1-С 6)алкил(предпочтительно метил), (C1-С 6)алкокси или галоген (предпочтительно фтор или хлор). Термин "арилокси" означает арильную группу, присоединенную к остальной части молекулы через кислородный мостик. Термин "удаляемая группа" означает заместитель с неподеленной электронной парой,который удаляется из субстрата в процессе реакции нуклеофильного замещения. Термин 6 Термин НЕТ включает пиридин, пиразин,пиримидин, пиридазин, пиррол, пиразол, фуран,тиофен, тиазол, изотиазол, оксадиазол, тиадиазол, имидазол, триазол и тетразол. Гетероциклическое кольцо может быть присоединено к остальной части молекулы через любой углерод гетероциклического кольца. Соли соединений формулы I составляют дополнительный аспект настоящего изобретения. В тех случаях, когда соединения по настоящему изобретению содержат кислотные функциональные группы, можно получить различные соли,которые оказываются более растворимы в воде и более физиологически приемлемы, чем исходные соединения. Представителями фармацевтически приемлемых солей являются, но ими не ограничиваются, соли щелочных или щелочно-земельных металлов, такие как литий, натрий, калий, кальций, магний, алюминий и т.п. Соли удобно получать из свободной кислоты, обрабатывая кислоту в растворе основанием, или помещая кислоту на ионообменную смолу. В определение фармацевтически приемлемых солей включены также относительно нетоксичные соли присоединения неорганических и органических оснований к соединениям по настоящему изобретению, например, соли с катионами аммония, четвертичного аммония и аминов, полученных из азотсодержащих оснований, обладающих достаточной основностью,чтобы образовывать соли с соединениями по настоящему изобретению (см. например, S.М.Berqe et al., "Pharmaceutical Salts," J. Phar. Sci.,66: 1-19 (1977. Термин "защитная группа кислоты" используют здесь так, как она часто используется в органической химии для обозначения группы,которая предотвращает участие кислотной группы в реакции, осуществляемой в отношении какой-либо другой функциональной группы молекулы, но которую можно удалить, когда это понадобится. Такие группы описаны в книге Т.W. Greene в главе 5 Protective Groups in Organic Synthesis, John Wiley and Sons, New York,1981, включенной сюда в качестве ссылки. Примеры защитных групп кислоты включают сложноэфирные или амидные группы, такие как метил, метоксиметил, метилтиометил,тетрагидропиранил, метоксиэтоксиметил, бензилоксиметил, фениларил, этил, 2,2,2-трихлорэтил, 2-метилтиоэтил, трет-бутил, циклопентил, трифенилметил, парабромбензил, триметилсилил, N,N-диметил, пирролидинил, пиперидинил или о-нитроанилид. Предпочтительной защитной группой кислоты является метил. Пролекарствами являются производные соединений по настоящему изобретению, которые содержат химически или метаболически отщепляемые группы, и преобразуются при сольволизе или в других физиологических условиях в соединения по настоящему изобретению, которые фармацевтически активны in vivo. Производные со 7 единений по настоящему изобретению обладают активностью в виде производных как кислоты, так и оснований, но в виде производных кислот часто имеют преимущества с точки зрения растворимости, тканесовместимости или замедленного высвобождения в организме млекопитающего (см.Bundgard, Н., Design of Prodrugs, pp. 7-9, 21-24,Elsevier, Amsterdam, 1985). Пролекарства включают производные кислот, такие как сложные эфиры, полученные в результате взаимодействия исходных содержащих кислотную группу соединений с подходящими спиртами, или амиды, полученные в результате взаимодействия исходного содержащего кислотную группу соединения с подходящим амином. Предпочтительными пролекарствами являются алифатические сложные эфиры (например, метиловый, этиловый, пропиловый,изопропиловый, бутиловый, втор-бутиловый,трет-бутиловый) или ароматические сложные эфиры, полученные из кислотных групп, имеющихся в соединениях по настоящему изобретению. Другие предпочтительные сложные эфиры включают морфолиноэтилокси, диэтилгликольамид и диэтиламинокарбонилметокси. В некоторых случаях желательно получить пролекарства типа двойного сложного эфира,такие как (ацилокси)алкиловые сложные эфиры или алкоксикарбонил)окси)алкиловые сложные эфиры. Предпочтительной группой соединений формулы I, полученных по способу по настоящему изобретению, являются соединения, в которых R1 представляетR5, R6 и R7 представляют собой Н. Соединения, которые можно получить способами по настоящему изобретению, включают 3-(2-амино-1,2-диоксиэтил)-2-метил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту; 8 3-(2-амино-1,2-диоксиэтил)-1-4-фторфенил)метил)-2-метил-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2-метил-1 нафталенил)метил)-1H-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2-этил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-1-3-хлорфенил)метил)-2-этил-1 Н-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-1-1,1'-бифенил)-2-илметил)-2-этил-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-1-1,1'-бифенил)-2-илметил)-2-пропил-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2-циклопропил-1-(фенилметил)-1H-индол-4-ил)окси) уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-1-1,1'-бифенил)-2-илметил)-2-циклопропил-1 Н-индол-4-ил) окси)уксусную кислоту; 4-3-(2-амино-1,2-диоксиэтил)-2-этил-1(фенилметил)-1 Н-индол-4-ил)окси)бутановую кислоту; 3-(2-амино-1,2-диоксиэтил)-2-этил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2-этил-6 метил-1-(фенилметил)-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2,6-диметил 1-(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2-метил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-6-этил-2 метил-1-(фенилметил)-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2,6-диэтил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2-метил-6 фенокси-1-(фенилметил)-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(аминооксоацетил)-2-этил-6-метил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту; и 3-(2-амино-1,2-диоксиэтил)-2-этил-6-фенокси-1-(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту или их фармацевтически приемлемые соли. Из перечисленных соединений предпочтительными являются 3-(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота; 3-(2-амино-1,2-диоксиэтил)-2-этил-6-метил 1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота; 9 3-(2-амино-1,2-диоксиэтил)-2,6-диметил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота; 3-(2-амино-1,2-диоксиэтил)-2-метил-1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота; 3-(2-амино-1,2-диоксиэтил)-6-этил-2-метил 1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота; 3-(2-амино-1,2-диоксиэтил)-2,6-диэтил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота; 3-(2-амино-1,2-диоксиэтил)-2-метил-6-фенокси-1-(фенилметил)-1 Н-индол-4-ил)окси) уксусная кислота; 3-(аминооксоацетил)-2-этил-6-метил-1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота; и 3-(2-амино-1,2-диоксиэтил)-2-этил-6-фенокси-1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота или их фармацевтически приемлемые соли. Из этих соединений еще более предпочтительными являются 3-(2-амино-1,2-диоксиэтил)-2-метил-1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота и 3-(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота. Самым предпочтительным соединением, которое можно получить способом по настоящему изобретению, является 3-(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1H-индол-4-ил)окси) уксусная кислота или ее фармацевтически приемлемая соль. Способ по настоящему изобретению относится к усовершенствованному способу получения соединений формулы I с использованием недорогих, легко доступных реагентов, как представлено далее на схеме I. Схема I 10 растворители включают (но ими не ограничиваются) ДМФ, диоксан или толуол. Раствор субстрат/растворитель для облегчения растворения можно обработать ультразвуком или слегка нагреть. Используемое количество растворителя должно быть достаточным, чтобы обеспечить,чтобы все соединения оставались в растворе до завершения реакции. Раствор обрабатывают основанием, предпочтительно сильным основанием, таким как гидрид натрия, а затем сульфинирующим агентом формулы RSOX, где R представляет собой(С 1-С 6)алкил, арил или замещенный арил, и Х представляет собой (С 1-С 6)алкокси, галоген или-ОСO2(С 1-С 6)алкил. Сульфинирующий агент может быть получен по способу J.W. Wilt et al.,J. Org. Chem., 1967, 32, 2097. Предпочтительные сульфинирующие агенты включают метил птолилсульфинат, метилбензолсульфинат или изомасляный ангидрид п-толуолсульфиновой кислоты. Другие подходящие основания включают (но ими не ограничиваются) LDA, метоксид натрия или метоксид калия. Предпочтительно использовать два эквивалента основания. Когда используют гидрид натрия, предпочтительно, основание добавляют перед сульфинирующим агентом. Когда используют метоксид натрия, порядок добавления реагентов не важен. Реакцию можно проводить при температуре от около 25 С до температуры кипения с обратным холодильником, и она практически завершается за промежуток времени от 1 до 24 ч. Количество сульфинирующего реагента не является критическим, однако, реакция завершается наилучшим образом, если используют мольный эквивалент или его избыток по отношению к исходному пиррольному соединению(1). Вышеуказанные реакции можно осуществлять как процесс "в одном реакторе", причем реагенты добавляют в реакционный сосуд в указанном выше порядке. В процессе "в одном реакторе" предпочтительным растворителем является диоксан. Если используют процесс "в двух реакторах" тогда предпочтительными растворителями являются ТГФ и толуол, как представлено на схеме I(а) далее. Промежуточное соединение IV можно выделить и очистить, используя обычные методы кристаллизации или хроматографической обработки. Для контроля за ходом реакции для определения того, когда исходные материалы и промежуточные соединения превращаются в продукт, можно использовать обычные аналитические методы, такие как ТСХ или ВЭЖХ. В альтернативном способе получения сульфинирующий реагент можно заменить дисульфидным соединением формулы R20SSR20,где R20 представляет собой алкил или арил. 11 Окисление сульфидных промежуточных соединений можно затем легко осуществить, используя соответствующий окислитель, такой как пероксид водорода или м-хлорпербензойная кислота. Индол (IV) можно затем легко алкилировать алкилирующим агентом формулы XCH2R4a,где Х представляет собой стабильную удаляемую группу, и R4a представляет собой защищенную карбоксигруппу, сульфонильную или фосфонильную группу, предпочтительно, защищенную сложноэфирной группой, в присутствии основания. Предпочтительным алкилирующим агентом является метилбромацетат. Подходящие основания включают карбонат калия, карбонат натрия, карбонат лития, карбонат цезия, бикарбонат натрия, бикарбонат калия или гидрид калия. Предпочтительным является карбонат калия. Количество алкилирующего агента не является критическим, однако, реакцию лучше проводить, используя молярный избыток алкилирующего агента по отношению к исходному продукту. Реакцию предпочтительно проводят в органическом растворителе, таком как ацетон, ацетонитрил или диметилформамид. Другие подходящие растворители включают тетрагидрофуран, метилэтилкетон, ацетонитрил,толуол или трет-бутилметиловый эфир. Реакцию проводят при температуре от около 0 до 100 С, предпочтительно при комнатной температуре, и реакция практически завершается за промежуток времени от около 1 до 24 ч, в зависимости от используемых реагентов и таких условий, как температура реакции. Необязательно можно использовать реагент фазового переноса, такой как тетрабутиламмонийбромид. Получение глиоксамида II легко осуществить в двухстадийном процессе, вначале обрабатывая промежуточное III оксалилхлоридом в концентрации от около 0,2 до 1,5 ммоль, предпочтительно, в эквимолярных концентрациях по отношению к исходному материалу. Предпочтительны такие растворители, как метиленхлорид, хлороформ, трихлорэтилен, тетрахлорид углерода, эфир или толуол. Подходящими являются температуры от около -20 С до комнатной температуры, предпочтительно около -5 С. На второй стадии раствор обрабатывают аммиаком; либо барботируя в виде газа, либо,предпочтительно, используя молярный избыток 30% водного аммиака. Реакцию обычно проводят при температуре от около -25 до 25 С, предпочтительно, от около -2 до 0 С, и реакция практически завершается за промежуток времени от 10 мин до 1 ч. Гидролиз соединения II осуществляют, используя основание, такое как гидроксид калия,гидроксид лития или гидроксид натрия, предпочтительно гидроксид натрия, в низшем спирте в качестве растворителя, таком как метанол,этанол, изопропанол и т.д., или в таких раство 003582 12 рителях, как тетрагидрофуран, диоксан и ацетон. Используя обычные аналитические методы, такие как ВЭЖХ, можно контролировать ход реакций, представленных на схеме I, определяя момент, когда исходные продукты и промежуточные соединения преобразуются в продукт. Представленная далее схема I(а) иллюстрирует описанный выше протекающий в двух реакторах способ получения промежуточного соединения IV. Промежуточное соединение IV(а) можно выделить и очистить, используя обычные хроматографические методы. Схема I(а) Специалисту понятно, что исходные продукты для вышеуказанных способов являются либо коммерчески доступными, либо их легко можно получить известными способами из коммерчески доступных исходных продуктов. Например, сульфинирующий и сульфинилирующий реагенты можно получить по способу,описанному Patai, et al. The chemistry of sulphinic Соответствующий замещенный пропионилацетат Х сначала галогенируют, обрабатывая сульфурилхлоридом, предпочтительно в эквимолярных концентрациях по отношению к исходному продукту, при температурах от около 0 до 25 С, предпочтительно менее 15 С, с получением соединения IX. Гидролиз и декарбоксилирование IX осуществляют при кипячении с обратным холодильником с водной кислотой, такой как соляная кислота, в течение промежутка времени от 13 около 1 до 24 ч. Раствор, содержащий декарбоксилированный продукт VIII, нейтрализуют, доводя рН до около 7,0-7,5, затем подвергают взаимодействию с циклогександионом VII(предпочтительно, в эквимолярных концентрациях) и основанием, предпочтительно гидроксидом натрия, с получением моногидрата трикетона VI в виде осадка, который может быть при желании очищен и выделен. Реакцию предпочтительно проводят при температурах от-20 С до комнатных температур, и она практически полностью завершается за промежуток времени от около 1 до 24 ч. Вышеуказанные реакции, предпочтительно, проводят как процесс "в одном реакторе",причем реагенты добавляют в реактор в указанном выше порядке. Предпочтительно проводить реакции без выделения соединений формулы IX или VIII, тем самым, избегая экспонирования этим летучим лакриматорам. Получение V осуществляют путем кипячения с обратным холодильником соединения VI в высококипящем неполярном растворителе, образующим азеотроп с водой, предпочтительно, в толуоле, с эквимолярным количеством амина формулы R1NH2, где R1 имеет указанные выше значения. Предпочтительными являются растворители с температурой кипения, по крайней мере,100 С, такие как толуол, ксилол, цимол, бензол,1,2-дихлорэтан или мезитилен, что позволяет избежать необходимости в реакторе повышенного давления. Необходимо использовать достаточное количество растворителя, чтобы все соединения оставались в растворе до практически полного завершения реакции за промежуток времени от около 1 до 24 ч. Нижеследующие примеры более подробно иллюстрируют способ по настоящему изобретению. Примеры также иллюстрируют получение промежуточных соединений по настоящему изобретению. Примеры являются лишь иллюстративными, и никоим образом не предназначены для какого-либо ограничения объема настоящего изобретения. Пример 1. Получение метилового эфира 2-этил-1-(фенилметил)-1 Н-индол-4 ил)окси)уксусной кислоты. А. Получение 2-(2-оксобутил)-1,3-циклогександиона. 1-Бензил-2-этил-4-оксо-4,5,6,7 тетрагидроиндол (1000 г, 4,995 моль) суспендируют в толуоле (600 мл, 6 объемов). Полученную смесь нагревают до 85 С и перемешивают в течение 5 мин. По каплям добавляют бензиламин (562,6 г, 5,25 моль, 1,05 экв) в течение примерно 30-45 мин. После добавления смесь превращается в раствор янтарного цвета. Раствор нагревают, и воду азеотропно отгоняют до тех пор, пока температура реакционной смеси не достигает 110 С. Реакционную смесь оставляют при перемешивании при 110 С на 2 ч, и к этому 14 времени при атмосферном давлении отгоняется примерно 4000 мл растворителя. Раствор переносят в колбу, и затем упаривают с получением вязкого масла янтарного цвета, которое используют непосредственно на следующей стадии. Масса масла=1372,24 г; Теоретическая масса=1253,7 г; Эффективность=87%; Молярный выход=95,2%. В. Получение 2-этил-1-(фенилметил)-1 Ниндол-4-ола. Гидрид натрия (400 г, 9,96 моль, 2,5 экв) суспендируют в ТГФ (5000 мл, 5 об). К суспензии добавляют соединение, полученное в части А, выше, (1149 г, 3,98 моль, 1 экв) и оставляют при перемешивании при 20-25 С до прекращения выделения пузырьков. Добавляют метилтолуолсульфинат (1121 г, 6,59 моль, 1,65 экв) и полученную смесь нагревают до 30 С. Спустя примерно 2,5 ч смесь темнеет по мере выделения газа, и при 47 С наблюдается экзотерма. По данным ТСХ исходный продукт полностью расходуется. Затем реакционную смесь охлаждают до 0-5 С и гасят, медленно добавляя деионизированную воду (5000 мл, 5 об). Реакционную смесь далее гасят ледяной уксусной кислотой(600 г, 10 моль, 2,5 экв). Полученную смесь разбавляют толуолом (5000 мл, 5 об) и промывают насыщенным раствором бикарбоната натрия(2500 мл, 2,5 об). Верхний органический слой промывают дополнительным количеством 2500 мл насыщенного раствора бикарбоната натрия. Водные слои объединяют и осуществляют обратную экстракцию толуолом (5000 мл, 5 экв). Органические слои объединяют и нагревают до слабого кипения с обратным холодильником(примерно 80 С), и перемешивают в течение 2 ч, причем к этому времени реакция по данным ТСХ завершается. Темный раствор концентрируют при атмосферном давлении до примерно 4000 мл и промывают насыщенным раствором бикарбоната натрия (1500 мл х 2). Органическую часть сушат над сульфатом магния и концентрируют в вакууме до получения темного вязкого масла, которое используют непосредственно на следующей стадии. С. Получение метилового эфира 2-этил 1-(фенилметил)-1 Н-индол-4-ил)окси)уксусной кислоты. Соединение, полученное в части В, выше,растворяют в ацетоне (7500 мл, 7,5 об) и перемешивают при 20-25 С. Добавляют порошок карбоната калия (1360 г, 9,84 моль, 2,5 экв) и метилбромацетат (780 г, 5,09 моль, 1,3 экв), и полученную желто-коричневую смесь перемешивают в течение 16 ч при 20-25 С, причем к этому времени по данным ТСХ реакция завершается. Твердые остатки фильтруют над полипропиленом, и промывают ацетоном (1500 мл,1,5 объема). Полученный фильтрат упаривают в вакууме до темного масла. Это масло растворяют в изопропиловом спирте (10000 мл, 10 объе 15 мов), и полученную взвесь нагревают при кипении с обратным холодильником в течение 30 мин. Раствору дают остыть, при температуре примерно 38 С происходит кристаллизация. Взвесь охлаждают до 0-5 С и перемешивают в течение 2 ч. Взвесь фильтруют и промывают 3500 мл порциями охлажденного изопропилового спирта. Желто-коричневое твердое вещество сушат в вакуумном термостате при 50 С в течение 16 ч. Масса сухого продукта=691,53 г. Теоретический масса=1288,4 г. Выход=53,7%. Пример 2. Получение 2-этил-1-(фенилметил)-1 Н-индол-4-ола. А. Получение 4-метилбензолсульфиновой кислоты. Ангидрид 4-метилбензолсульфиновой кислоты, натриевую соль, (0,9 г, 5 ммоль) суспендируют в бензоле (5 мл). Добавляют НСl (1 экв). Отдельно, изобутилхлорформиат (0,65 мл, 5 ммоль) добавляют к охлажденному раствору пиридина (1,2 мл, 15 ммоль) в бензоле (5 мл). Порциями добавляют раствор сульфиновой кислоты. Полученный раствор перемешивают в течение 30 мин при комнатной температуре. Растворитель выпаривают и остаток распределяют между МТБЭ и водой. Органический слой сушат над сульфатом натрия, фильтруют и упаривают с получением бесцветного масла. Это масло снова растворяют в МТБЭ и промывают 0,1 н раствором НСl до удаления пиридина. После сушки над сульфатом натрия и фильтрования раствор упаривают с получением бесцветной жидкости (0,30 г). 1H ЯМР (500 МГц,СDСl3)7,64 (д, 2 Н), 7,35 (д, 2 Н) 3,83 (м, 1 Н),3,37 (м,1 Н), 2,45 (с, 3 Н), 1,94 (м, 1 Н), 0,95 (м,6 Н). В. Получение 2-этил-1-(фенилметил)-1 Ниндол-4-ола. Исходный продукт по примеру 1 В, выше,(0,3 г, 1,2 ммоль) растворяют в 5 мл ТГФ. Добавляют гидрид натрия (0,1 г, 2,6 ммоль). Добавляют 4-метилбензолсульфиновую кислоту,ангидрид с изобутилбикарбонатом (0,3 г, 1,25 ммоль) в 1 мл ТГФ. Полученную смесь кипятят с обратным холодильником в течение 1 ч, причем к этому моменту времени не наблюдается исходного продукта. Продолжая кипятить с обратным холодильником, получают целевой продукт. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулыI или его фармацевтически приемлемой соли или пролекарственного производного 16 где R1 выбран из группы, включающей (C7C20)алкил, где R10 выбран из группы, включающей галоген,(С 1-С 10)алкил, (С 1-С 10)алкокси, -S-(С 1-С 10)алкил и галоген(С 1-С 10)алкил, и t представляет собой целое число от 0 до 5 включительно;R4 выбран из группы, включающей -СO2 Н,-SО 3 Н и -Р(O)(ОН)2 или их соли или пролекарства; иR5 выбран из группы, включающей водород, (С 1-С 6)алкил, (С 1-С 6)алкокси, галоген(С 1 С 6)алкокси, галоген(С 2-С 6)алкил, бром, хлор,фтор, йод и арил,который включает стадии е) окисления соединения формулы V путем нагревания с основанием и соединением формулы RSOX, где R представляет собой (С 1 С 6)алкил или арил и Х представляет собой (С 1 С 6)алкокси, галоген или -OCO2(С 1-С 6)алкил, с получением соединения формулы IVf) алкилирования соединения формулы IV алкилирующим агентом формулы XCH2R4a, где Х представляет собой удаляемую группу и R4a представляет собой-P(O)(OR )2 или -Р(O)(OR )H, где R представляет собой защитную группу кислоты, с получением соединения формулы IIIh) необязательного гидролиза соединения формулы IIg) взаимодействия соединения формулы III с получением соединения формулы I, иi) необязательного преобразования соединения формулы I в соль. 2. Способ по п.1, где сульфинирующим агентом является ангидрид п-толуолсульфиновой и изомасляной кислот. 3. Способ по п.1 или 2 для получения 3(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1 Н-индол-4-ил)-окси)уксусной кислоты.
МПК / Метки
МПК: C07D 209/22
Метки: получения, способ, 1н-индол-3-глиоксамидов, 4-замещенных
Код ссылки
<a href="https://eas.patents.su/10-3582-sposob-polucheniya-4-zameshhennyh-1n-indol-3-glioksamidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 4-замещенных 1н-индол-3-глиоксамидов</a>
Предыдущий патент: Способ получения чистого циталопрама
Следующий патент: Способ защиты от старения гликоля или гликольэфира
Случайный патент: Карбоновые кислоты