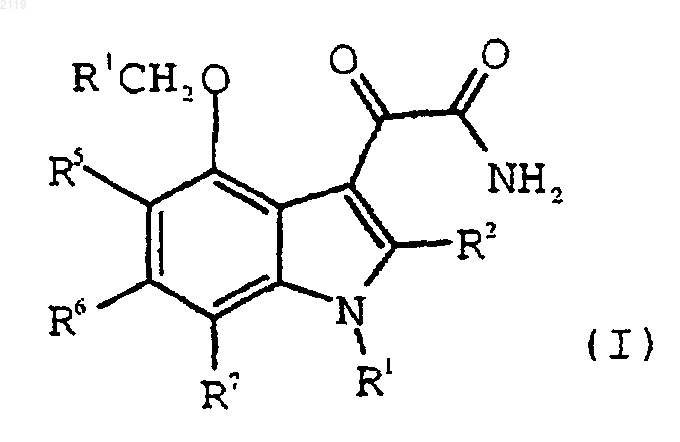
Способ получения 4-замещенных-1н-индол-3-глиоксамидов
Номер патента: 2119
Опубликовано: 24.12.2001
Авторы: Полак Джозеф Мэттью, Мартинелли Майкл Джон, Кхау Виен Ван
Формула / Реферат
1. Способ получения 4-замещенного-1Н-индол-3-глиоксамидного соединения формулы I, или его фармацевтически приемлемой соли, или его пролекарственного производного
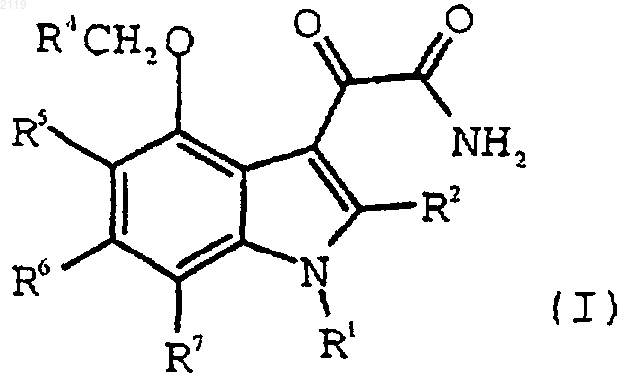
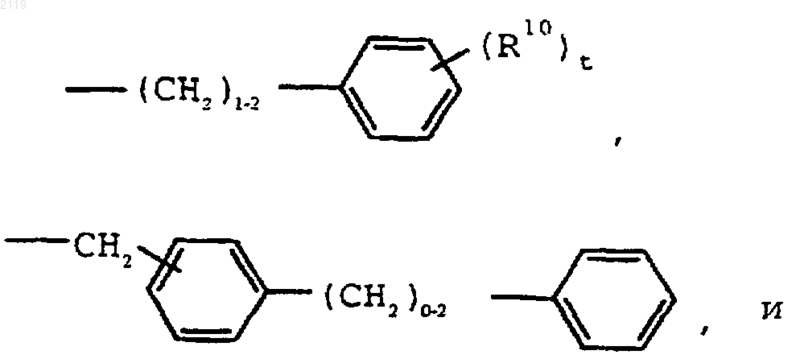
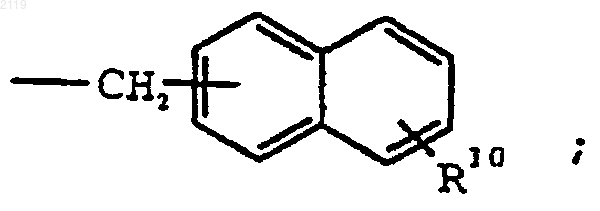
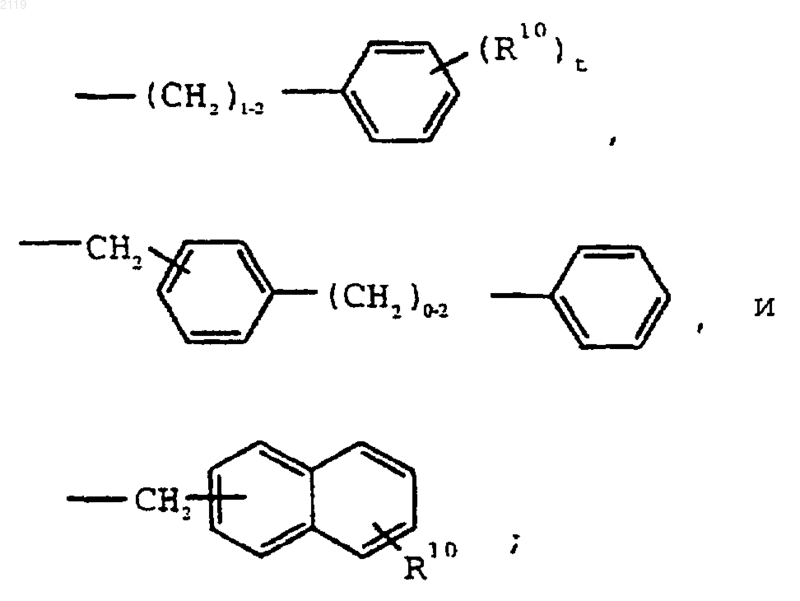
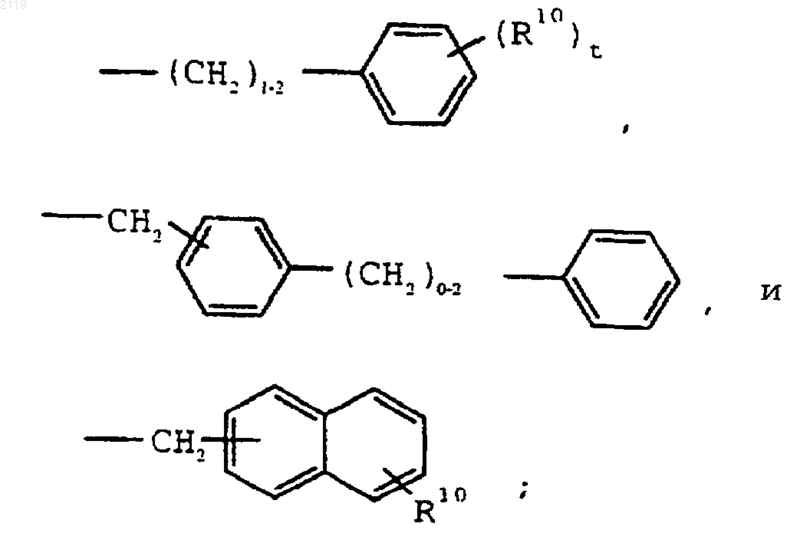
где R1 выбран из группы, состоящей из
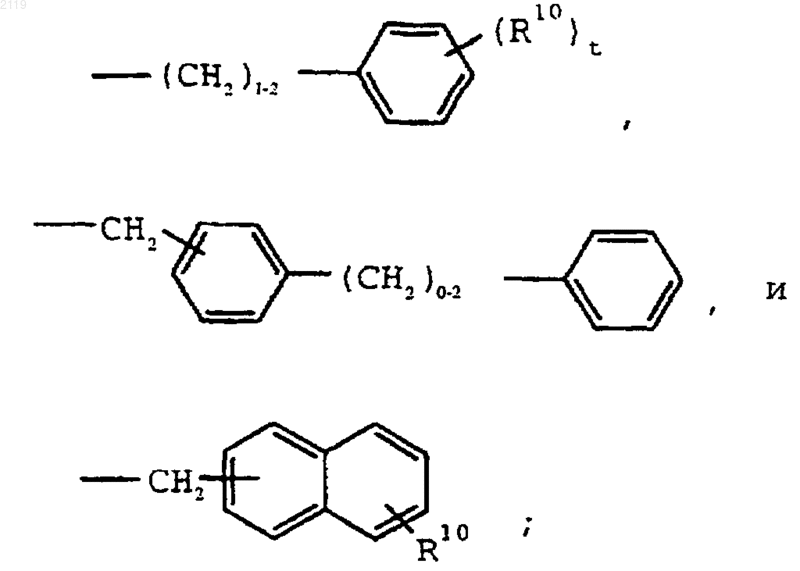
-С7-С20 алкила,

где R10 выбран из группы, состоящей из галогена, C1-С10 алкила, C1-С10 алкоксильной группы, -S-(C1-С10 алкила) и галоген (C1-С10) алкила, a t является целым числом от 0 до 5 включительно;
R2 выбран из группы, состоящей из водорода, галогена, C1-С3 алкила, С3-С4 циклоалкила, С3-С4 циклоалкенила, -О-(C1-С2 алкила), -S-(C1-С2 алкила), арила, арилоксильной группы и НЕТ;
R4 выбран из группы, состоящей из -CO2H, -SО3Н и -Р(O)(ОН)2, или из их солей и пролекарственных производных; и
R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С6) алкила, (C1-С6) алкоксильной группы, галоген (C1-С6) алкоксильной группы, галоген (C2-С6) алкила, брома, хлора, фтора, йода и арила;
включающий следующие стадии:
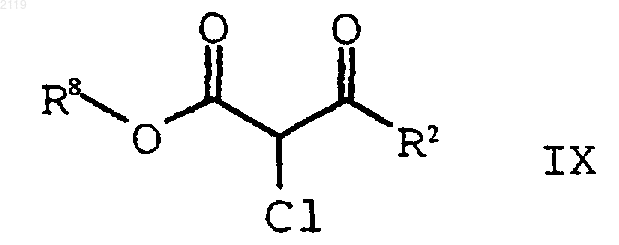
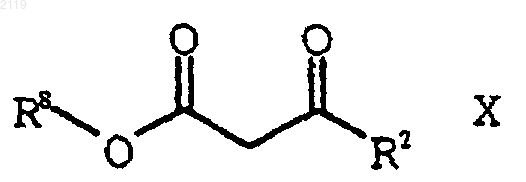
а) галогенирование соединения формулы Х
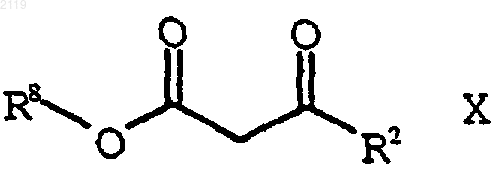
где R8 представляет собой (C1-С6) алкил, арил или НЕТ;
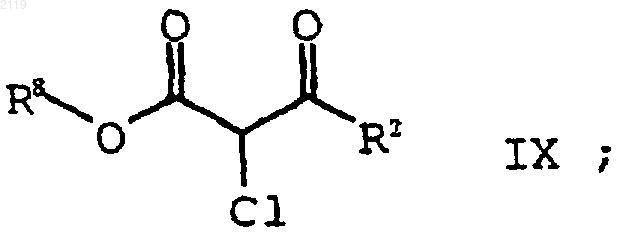
с использованием SO2Cl2 с получением соединения формулы IX

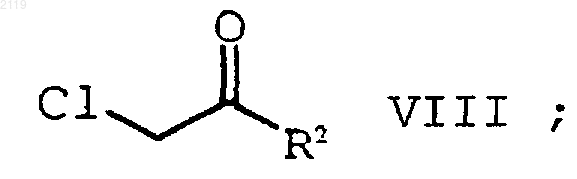
b) гидролиз и декарбоксилирование соединения формулы IX
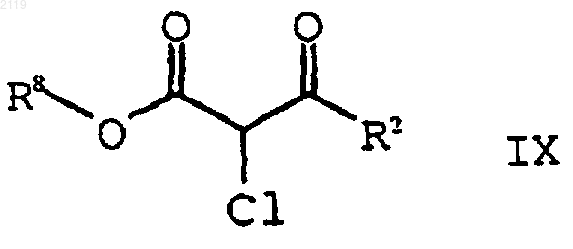
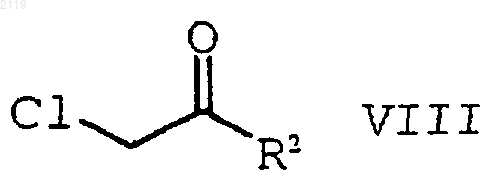
с образованием соединения формулы VIII
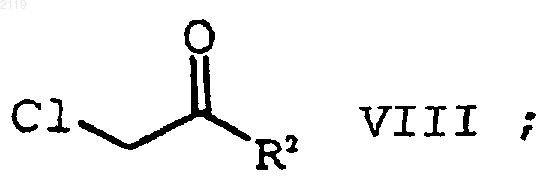
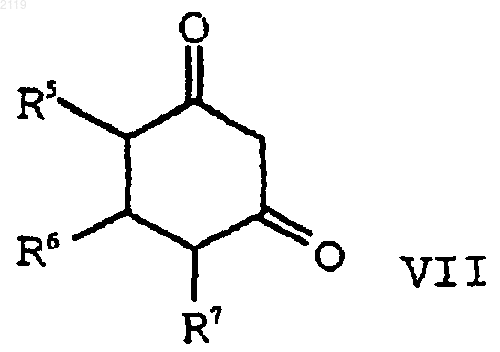
с) алкилирование соединения формулы VII
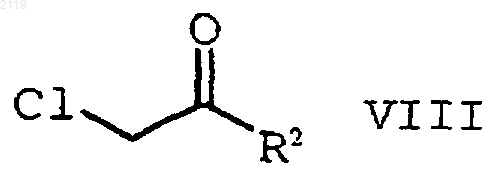
с помощью соединения формулы VIII
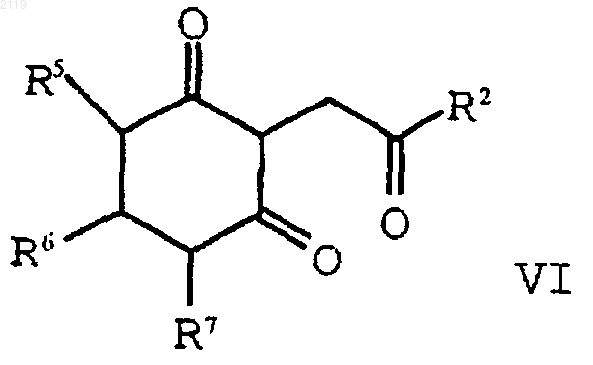
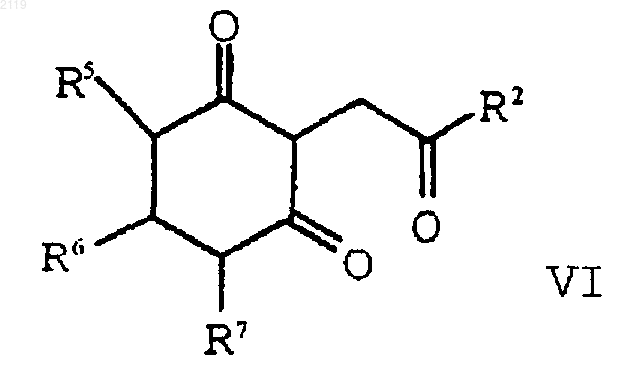
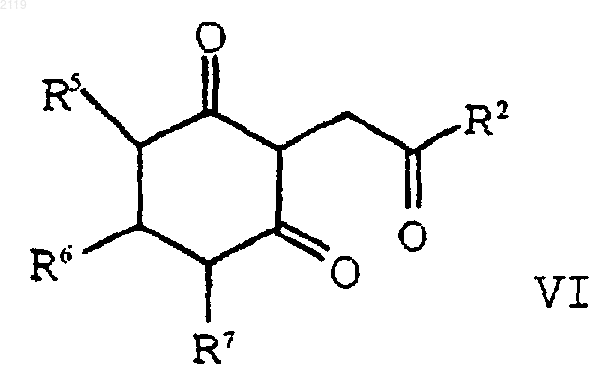
с образованием соединения формулы VI

d) аминирование и дегидратирование соединения формулы VI
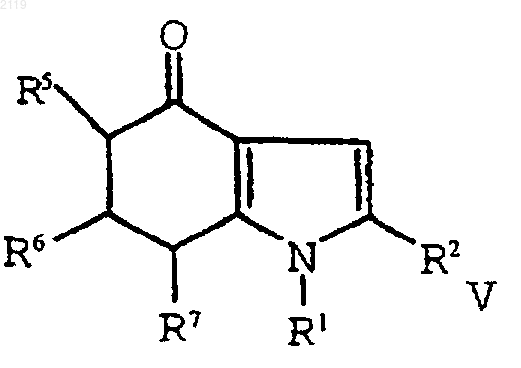
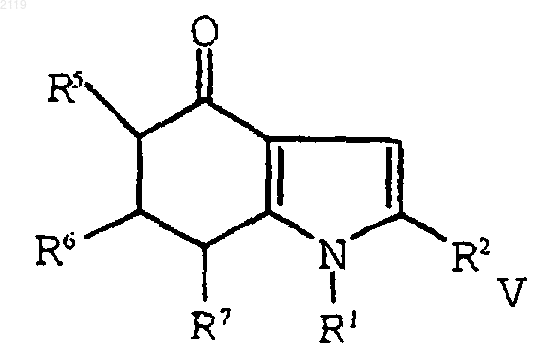
с использованием амина формулы R1NH2 в присутствии растворителя, который образует азеотропную смесь с водой с образованием соединения формулы V;
е) окисление соединения формулы V
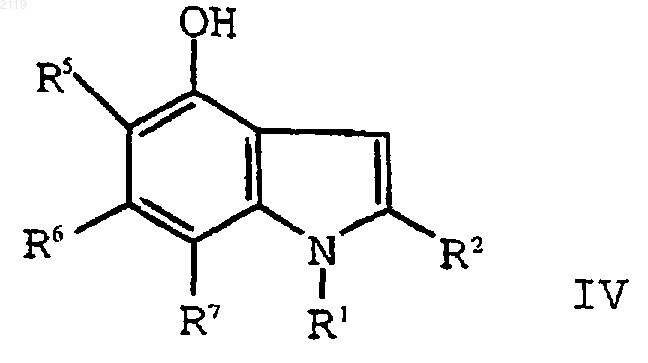
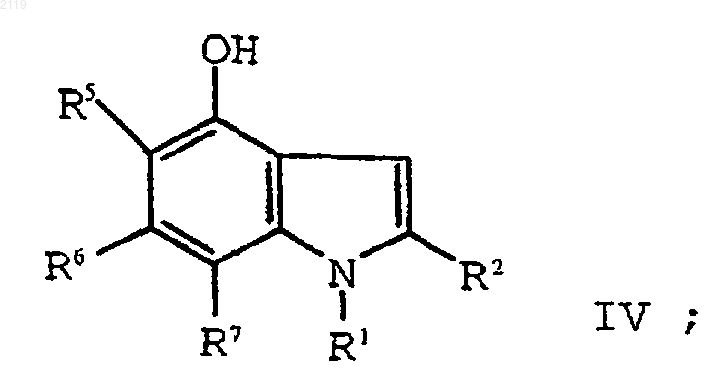
путем кипячения с обратным холодильником в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150шС и диэлектрическую константу, равную, по меньшей мере, 10, в присутствии катализатора с образованием соединения формулы IV
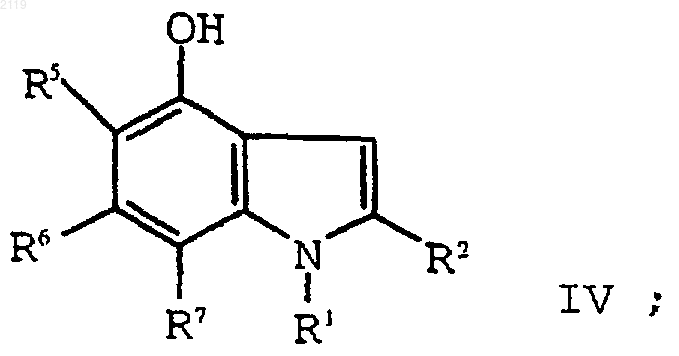
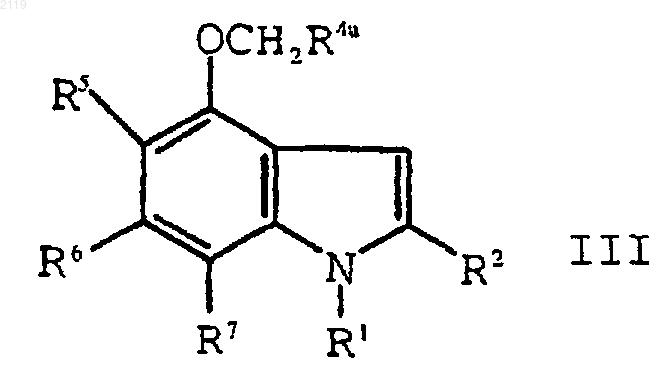
f) алкилирование соединения формулы IV
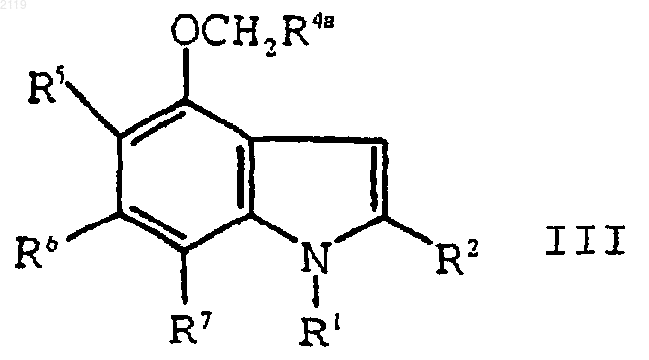
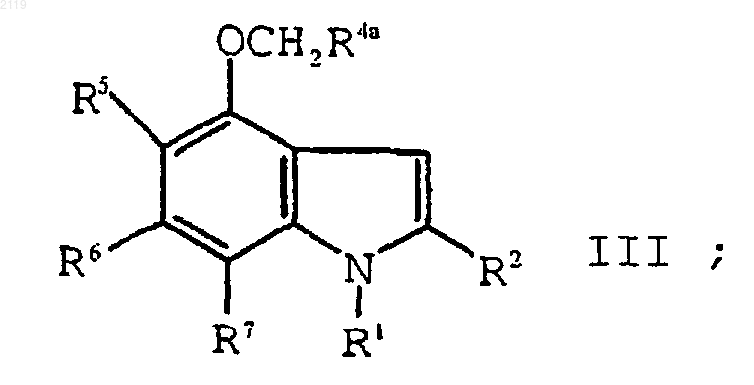
с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SО3R4b, -P(O)(OR4b)2 или -Р(О)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы III
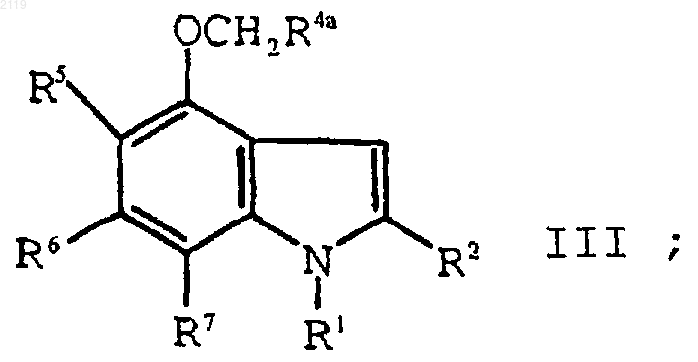
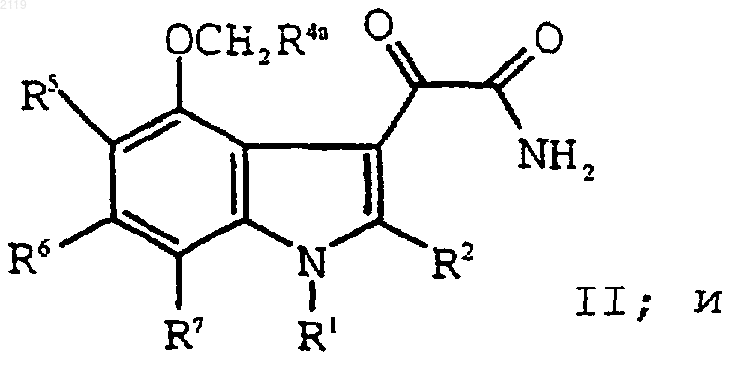
g) взаимодействие соединения формулы III
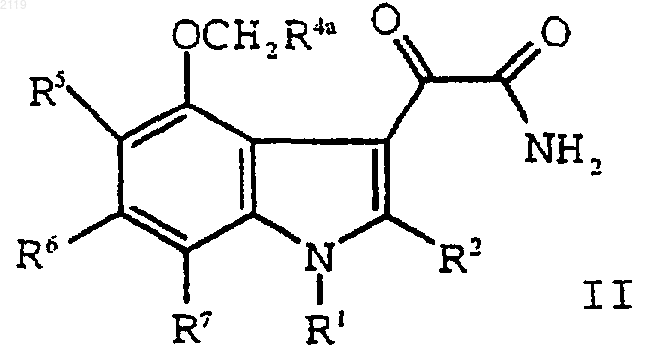
с оксалилхлоридом и аммиаком с образованием соединения формулы II
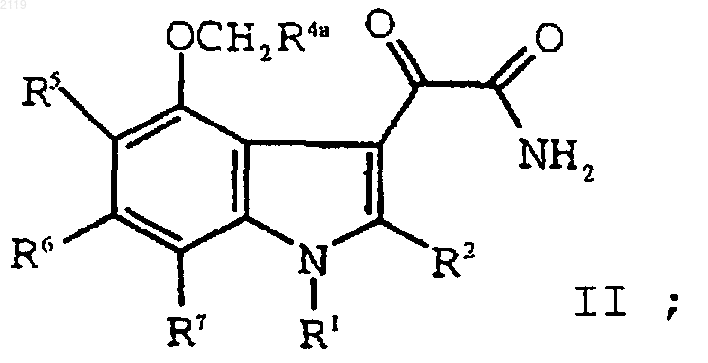
h) гидролиз соединения формулы II
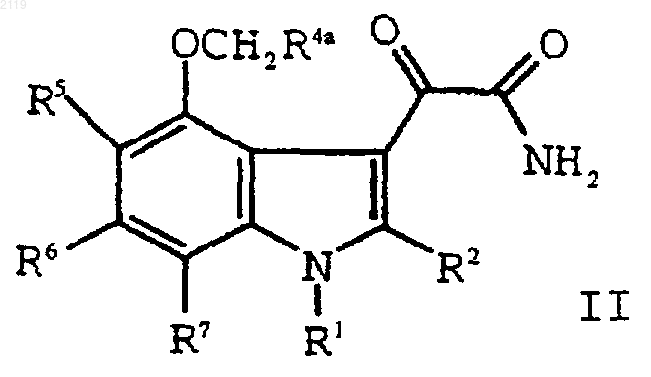
с образованием соединения формулы I;
и i) необязательное образование соли соединения формулы I.
2. Способ получения соединения формулы I, или его фармацевтически приемлемой соли, или его пролекарственного производного

где R1 выбран из группы, состоящей из
-С7-С20 алкила,
где R10 выбран из группы, состоящей из галогена, C1-С10 алкила, C1-С10 алкоксильной группы, -S-(C1-С10 алкила) и галоген (C1-С10) алкила, a t является целым числом от 0 до 5 включительно;
R2 выбран из группы, состоящей из водорода, галогена, C1-С3 алкила, С3-С4 циклоалкила, С3-С4циклоалкенила, -O-(C1-С2 алкила), -S-(C1-С2 алкила), арила, арилоксильной группы и НЕТ;
R4 выбран из группы, состоящей из -СО2Н, -SО3Н и -Р(O)(ОН)2, или из их солей и пролекарственных производных; и
R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С6) алкила, (C1-С6) алкоксильной группы, галоген (C1-С6) алкоксильной группы, галоген (C2-С6) алкила, брома, хлора, фтора, йода и арила;
включающий следующие стадии:
а) окисление соединения формулы V
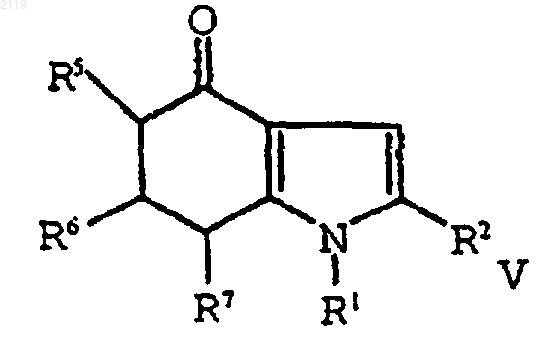
путем кипячения с обратным холодильником в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150шС и диэлектрическую константу, равную, по меньшей мере, 10, в присутствии катализатора с образованием соединения формулы IV
b) алкилирование соединения формулы IV
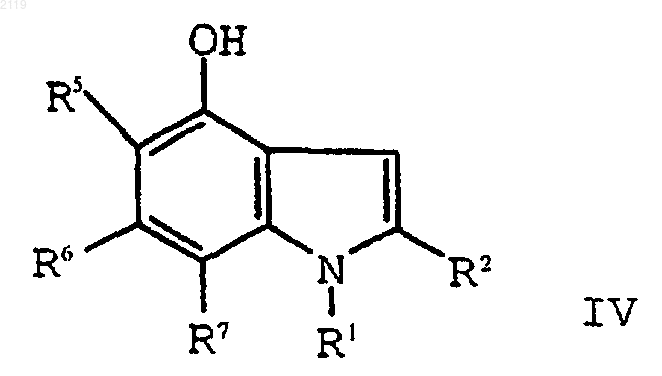
с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SO3R4b, -P(O)(OR4b)2 или -Р(O)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы III

с) взаимодействие соединения формулы III
с оксалилхлоридом и аммиаком с образованием соединения формулы II
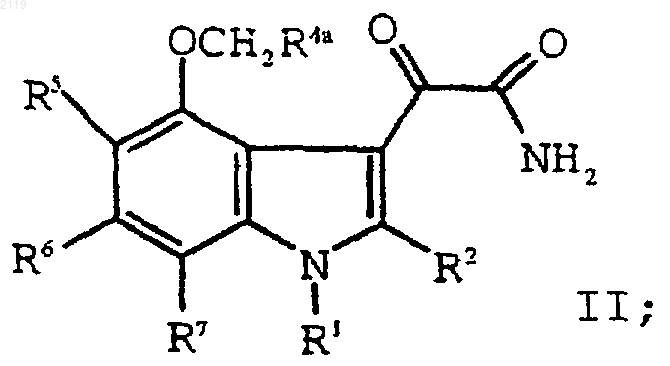
d) гидролиз соединения формулы II
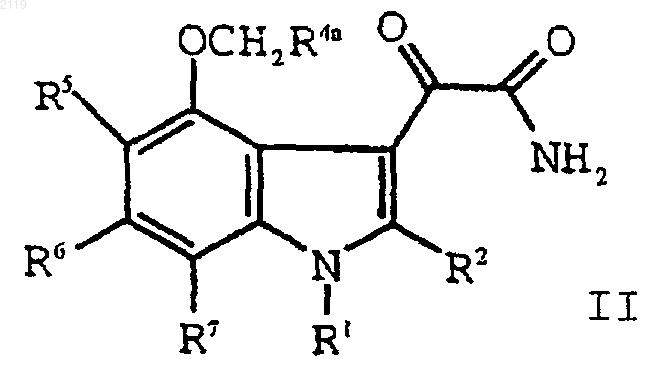
с образованием соединения формулы I; и
е) необязательное образование соли соединения формулы I.
3. Способ по п.1, где растворителем, образующим азеотропную смесь, является толуол, а полярный углеводородный растворитель имеет точку кипения 150-250шС и диэлектрическую константу 10-20.
4. Способ по п.1, где растворителем, образующим азеотропную смесь, является толуол, а полярный углеводородный растворитель имеет точку кипения 150-220шС и диэлектрическую константу 12-18.
5. Способ по любому из пп.1-4, который позволяет получать ((3-(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1Н-индол-4-ил)окси)уксусэую кислоту.
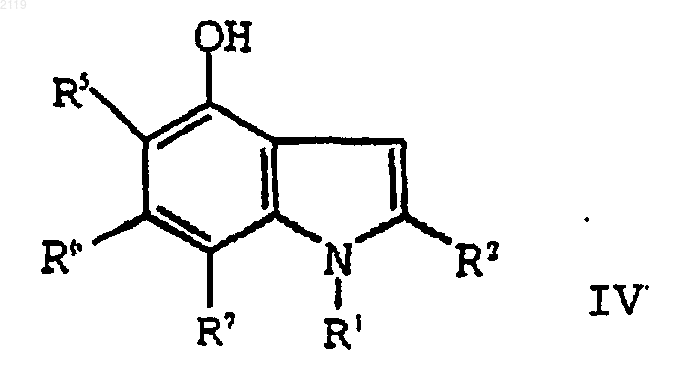
6. Способ получения 2-этил-1-(фенилметил)-4-гидрокси-1Н-индольного соединения формулы IV
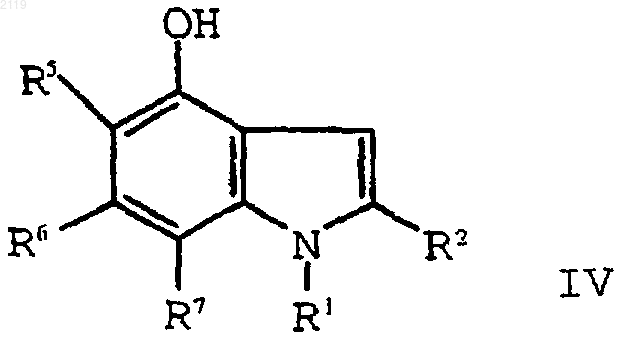
где R1 выбран из группы, состоящей из
-С7-С20 алкила;
где R10 выбран из группы, состоящей из галогена, C1-С10 алкила, C1-С10 алкоксильной группы, -S-(C1-С10 алкила) и галоген (C1-С10) алкила, a t является целым числом от 0 до 5 включительно;
R2 выбран из группы, состоящей из водорода, галогена, C1-С3 алкила, С3-С4 циклоалкила, С3-С4 циклоалкенила, -O-(C1-С2 алкила), -S-(C1-С2 алкила), арила, арилоксильной группы и НЕТ; и
R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С6) алкила, (C1-С6) алкоксильной группы, галоген (C1-С6) алкоксильной группы, галоген (C2-С6) алкила, брома, хлора, фтора, йода и арила;
включающий следующие стадии:
а) галогенирование соединения формулы Х

где R8 представляет собой (C1-С6) алкил, арил или НЕТ;
с использованием SO2Cl2 с получением соединения формулы IX
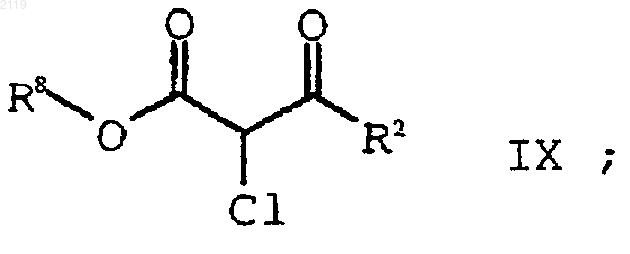
b) гидролиз и декарбоксилирование соединения формулы IX
с образованием соединения формулы VIII
с) алкилирование соединения формулы VII
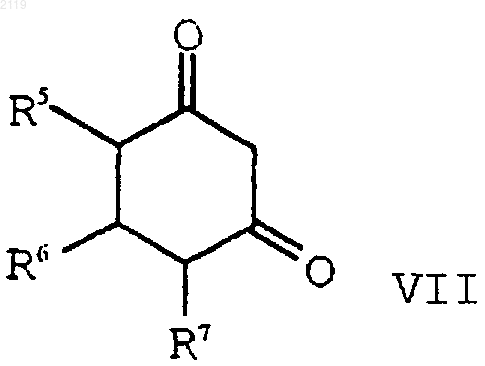
с помощью соединения формулы VIII

с образованием соединения формулы VI
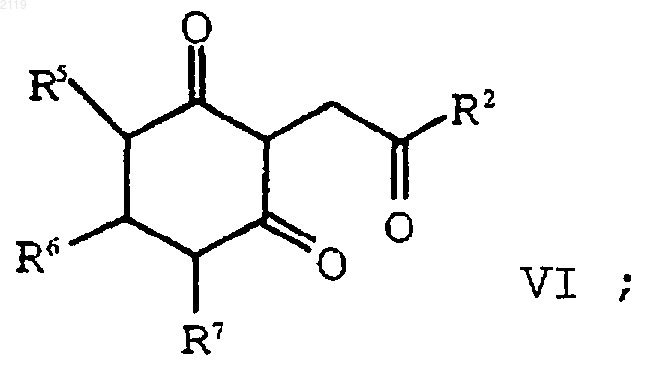
d) аминирование и дегидратирование соединения формулы VI
с использованием амина формулы R1NH2 в присутствии растворителя, который образует азеотропную смесь с водой с образованием соединения формулы V
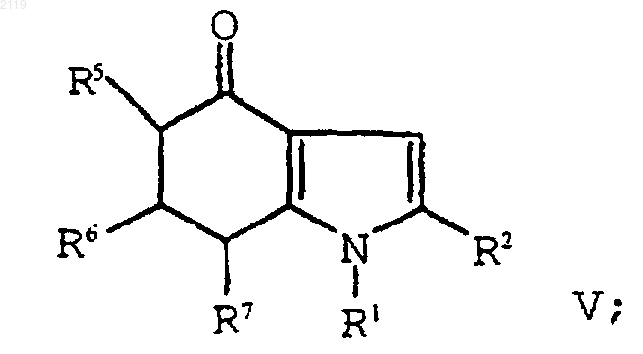
е) окисление соединения формулы V
путем кипячения с обратным холодильником в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150шС и диэлектрическую константу, равную, по меньшей мере, 10, в присутствии катализатора.
7. Способ получения 2-этил-1-(фенилметил)-4-гидрокси-1Н-индольного соединения формулы IV
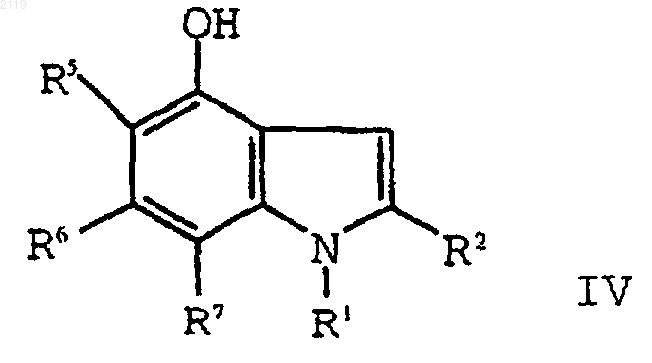
где R1 выбран из группы, состоящей из
-С7-С20 алкила,
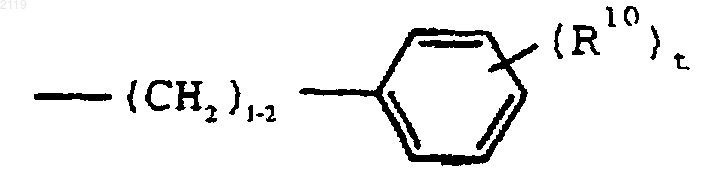
где R10 выбран из группы, состоящей из галогена, C1-С10 алкила, C1-С10 алкоксильной группы, -S-(C1-С10 алкила) и галоген (C1-С10) алкила, a t является целым числом от 0 до 5 включительно;
R2 выбран из группы, состоящей из водорода, галогена, C1-С3 алкила, С3-С4 циклоалкила, С3-С4 циклоалкенила, -O-(C1-С2 алкила), -S-(C1-С2 алкила), арила, арилоксильной группы и НЕТ; и
R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С6) алкила, (C1-С6) алкоксильной группы, галоген (C1-С6) алкоксильной группы, галоген (С2-С6) алкила, брома, хлора, фтора, йода и арила;
включающий окисление соединения формулы V
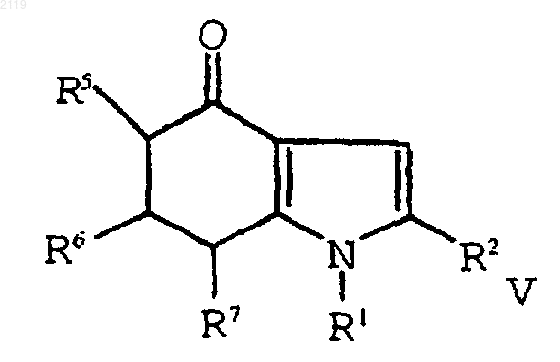
путем кипячения с обратным холодильником в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150шС и диэлектрическую константу, равную, по меньшей мере, 10, в присутствии катализатора.
8. Способ по п.6, где растворителем, образующим азеотропную смесь, является толуол, а полярный углеводородный растворитель имеет точку кипения 150-250шС и диэлектрическую константу 10-20.
9. Способ по любому из пп.6-8, который позволяет получать соединение 2-этил-1-(фенилметил)-4-гидрокси-1Н-индол.
10. Способ получения 4-замещенного-1Н-индол-3-глиоксамидного соединения формулы I, или его фармацевтически приемлемой соли, или его пролекарственного производного
где R1 выбран из группы, состоящей из
-С7-С20 алкила,
где R10 выбран из группы, состоящей из галогена, C1-С10 алкила, C1-С10 алкоксильной группы, -S-(C1-С10 алкила) и галоген (C1-С10) алкила, a t является целым числом от 0 до 5 включительно;
R2 выбран из группы, состоящей из водорода, галогена, C1-С3 алкила, С3-С4 циклоалкила, С3-С4 циклоалкенила, -O-(C1-С2 алкила), -S-(C1-С2 алкила), арила, арилоксильной группы и НЕТ;
R4 выбран из группы, состоящей из -CO2H, -SО3Н и -Р(O)(ОН)2, или из их солей и пролекарственных производных; и
R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С6) алкила, (C1-С6) алкоксильной группы, галоген (C1-С6) алкоксильной группы, галоген (C2-С6) алкила, брома, хлора, фтора, йода и арила;
включающий следующие стадии:
а) галогенирование соединения формулы Х
где R8 представляет собой (C1-С6) алкил, арил или НЕТ;
с использованием SO2Cl2 с получением соединения формулы IX
b) гидролиз и декарбоксилирование соединения формулы IX

с образованием соединения формулы VIII
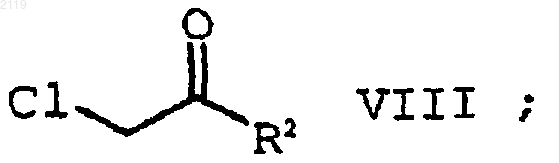
с) алкилирование соединения формулы VII
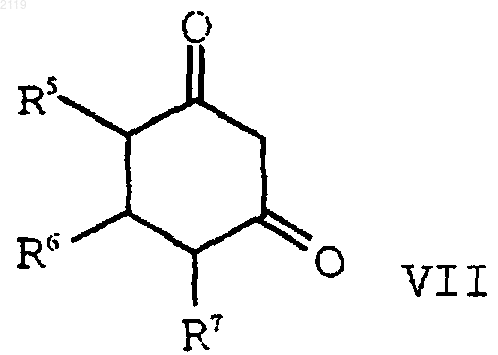
с помощью соединения формулы VIII

с образованием соединения формулы VI
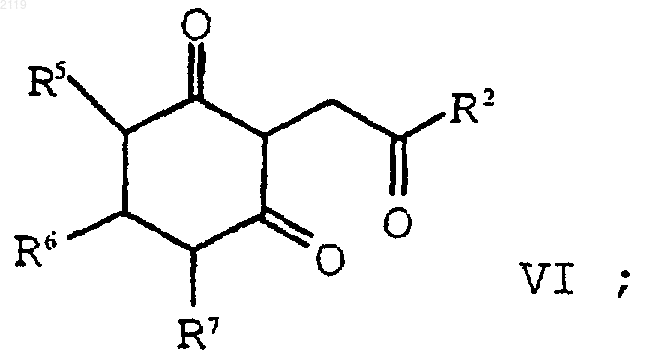
d) аминирование, дегидратирование и окисление соединения формулы VI
путем кипячения с обратным холодильником в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150шС и диэлектрическую константу, равную, по меньшей мере, 10, в присутствии катализатора и амина формуыы R1NH2;
с образованием соединения формулы IV
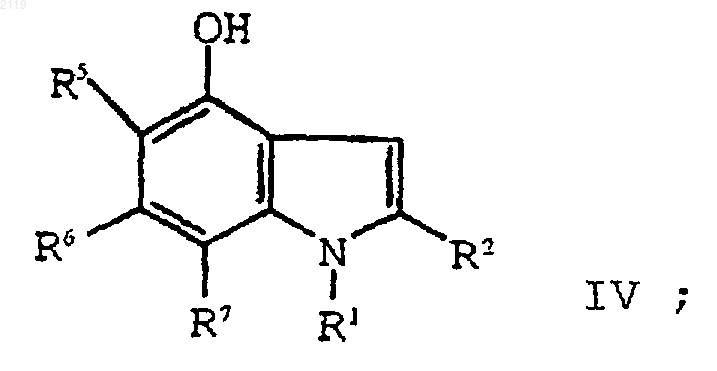
е) алкилирование соединения формулы IV

с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SО3R4b, -P(O)(OR4b)2 или -Р(O)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы III
f) взаимодействие соединения формулы III

с оксалилхлоридом и аммиаком с образованием соединения формулы II
g) гидролиз соединения формулы II
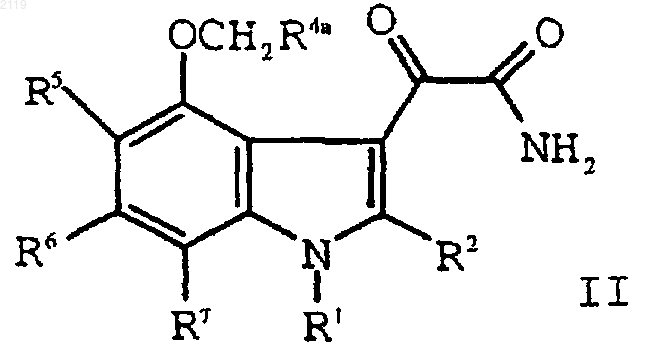
с образованием соединения формулы I; и
h) необязательное образование соли соединения формулы I.
11. Способ получения 4-замещенного-1Н-индол-3-глиоксамидного соединения формулы I, или его фармацевтически приемлемой соли, или его пролекарственного производного
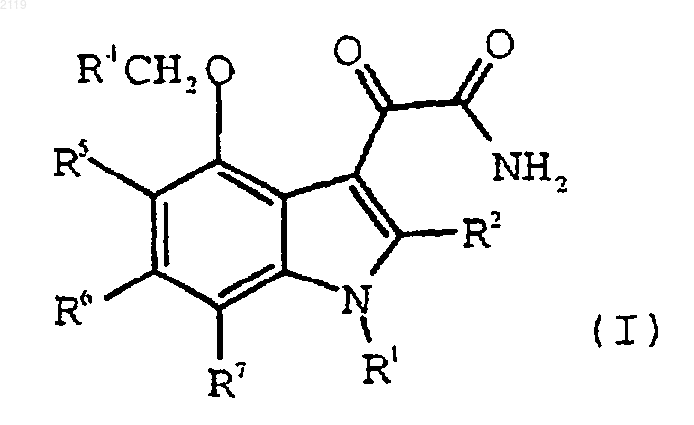
где R1 выбран из группы, состоящей из
-C7-С20 алкила,
где R10 выбран из группы, состоящей из галогена, C1-С10 алкила, C1-С10 алкоксильной группы, -S-(C1-С10 алкила) и галоген (C1-С10) алкила, a t является целым числом от 0 до 5 включительно;
R2 выбран из группы, состоящей из водорода, галогена, C1-С3 алкила, С3-С4 циклоалкила, С3-С4 циклоалкенила, -O-(C1-С2 алкила), -S-(C1-С2 алкила), арила, арилоксильной группы и НЕТ;
R4 выбран из группы, состоящей из -СO2Н, -SО3Н и -Р(O)(ОН)2, или из их солей и пролекарственных производных; и
R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С6) алкила, (C1-С6) алкоксильной группы, галоген (C1-С6) алкоксильной группы, галоген (C2-С6) алкила, брома, хлора, фтора, йода и арила;
включающий следующие стадии:
а) аминирование, дегидратирование и окисление соединения формулы VI
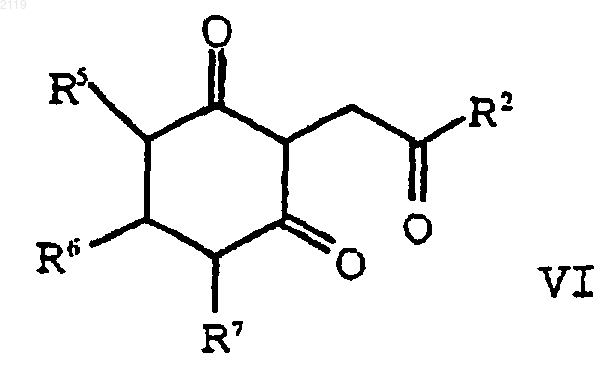
путем кипячения с обратным холодильником в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150шС и диэлектрическую константу, равную, по меньшей мере, 10, в присутствии катализатора и амина формулы R1NН2 с образованием соединения формулы IV

b) алкилирование соединения формулы IV
с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SO3R4b, P(O)(OR4b)2 или -Р(O)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы III

с) взаимодействие соединения формулы III
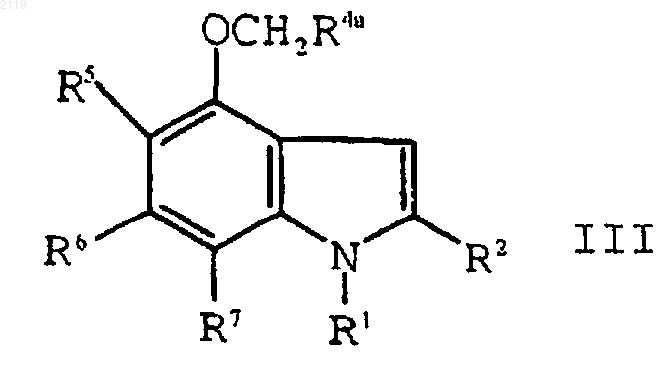
с оксалилхлоридом и аммиаком с образованием соединения формулы II
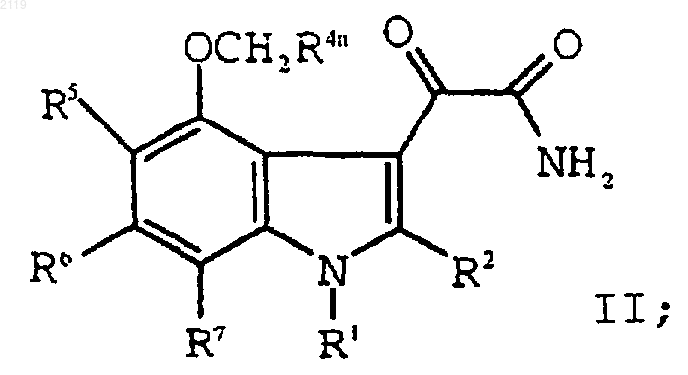
d) гидролиз соединения формулы II
с образованием соединения формулы I; и
е) необязательное образование соли соединения формулы I.
12. Способ по п.10 или 11, где полярный углеводородный растворитель имеет точку кипения 150-250шС и диэлектрическую константу 10-20.
13. Способ по п.10 или 11, где полярный углеводородный растворитель имеет точку кипения 150-220шС и диэлектрическую константу 12-18.
14. Способ по любому из пп.10-13, который позволяет получать ((3-(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1Н-индол-4-ил)окси)уксусную кислоту.
15. Способ получения 2-этил-1-(фенилметил)-4-гидрокси-1Н-индольного соединения формулы IV
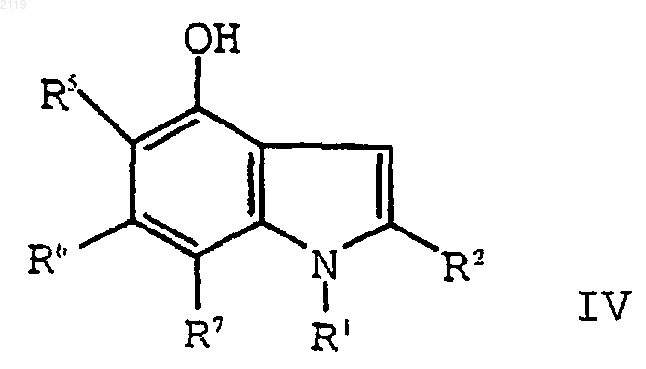
где R1 выбран из группы, состоящей из
-C7-C20 алкила,
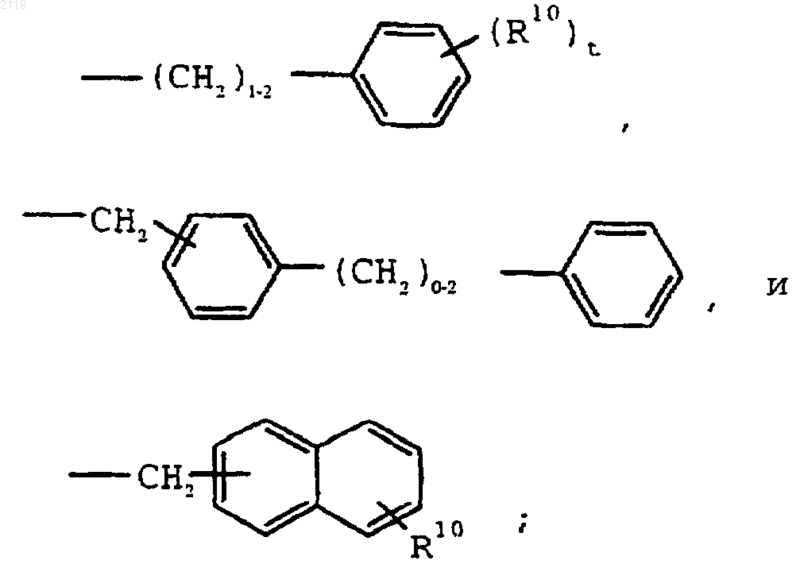
где R10 выбран из группы, состоящей из галогена, C1-С10 алкила, C1-С10 алкоксильной группы, -S-(C1-С10 алкила) и галоген (C1-С10) алкила, a t является целым числом от 0 до 5 включительно;
R2 выбран из группы, состоящей из водорода, галогена, C1-С3 алкила, C3-С4 циклоалкила, C3-С4 циклоалкенила, -O-(C1-С2 алкила), -S-(C1-С2 алкила), арила, арилоксильной группы и НЕТ; и
R5, R6 и R7 каждый независимо выбран из группы, состоящей из водорода, (C1-С6) алкила, (C1-С6) алкоксильной группы, галоген (C1-С6) алкоксильной группы, галоген (C2-С6) алкила, брома, хлора, фтора, йода и арила;
включающий следующие стадии:
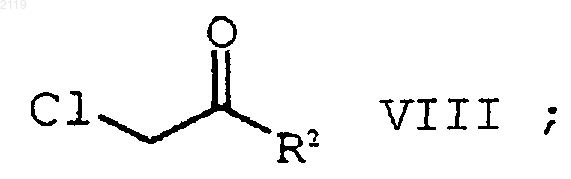
а) галогенирование соединения формулы Х
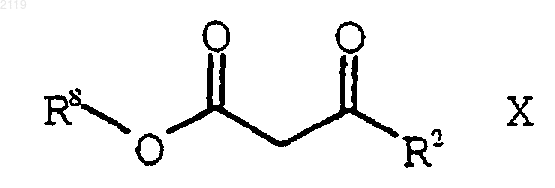
где R8 представляет собой (C1-С6) алкил, арил или НЕТ;
с использованием SO2Cl2 с получением соединения формулы IX

b) гидролиз и декарбоксилирование соединения формулы IX
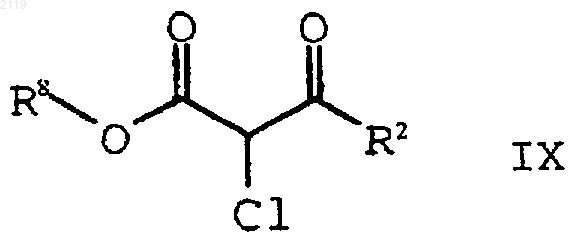
с образованием соединения формулы VIII
с) алкилирование соединения формулы VII
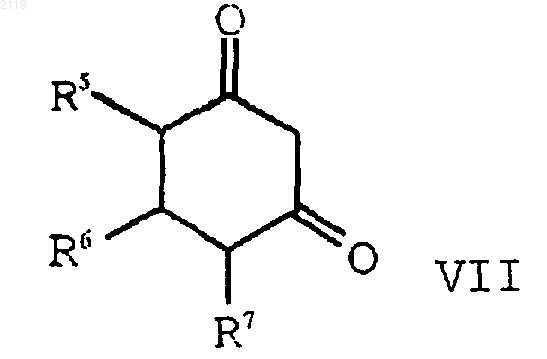
с помощью соединения формулы VIII
с образованием соединения формулы VI

d) аминирование, дегидратирование и окисление соединения формулы VI
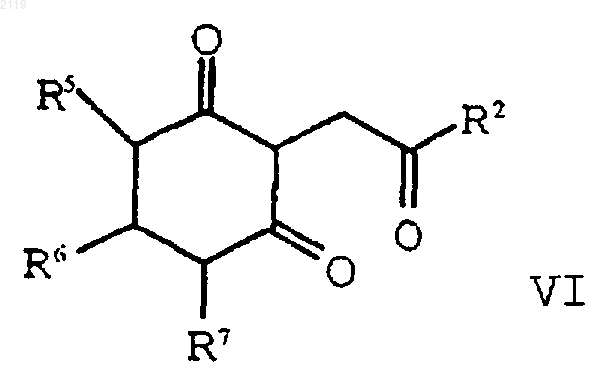
путем кипячения с обратным холодильником в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150шС и диэлектрическую константу, равную, по меньшей мере, 10, в присутствии катализатора и амина формулы R1NH2.
16. Способ получения 2-этил-1-(фенилметил)-4-гидрокси-1Н-индольного соединения формулы IV
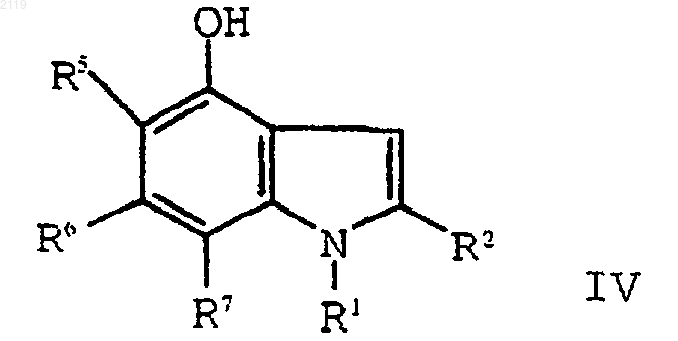
где R1 выбран из группы, состоящей из
-С7-С20 алкила,
где R10 выбран из группы, состоящей из галогена, C1-С10 алкиыр, C1-С10 алкоксильной группы, -S-(C1-С10 алкила) и галоген (C1-С10) алкила, a t является целым числом от 0 до 5 включительно;
R2 выбран из группы, состоящей из водорода, галогена, C1-С3 алкила, С3-С4 циклоалкила, С3-С4 циклоалкенила, -O-(C1-С2 алкила), -S-(C1-С2 алкила), арила, арилоксильной группы и НЕТ; и
R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С6) алкила, (C1-С6) алкоксильной группы, галоген (C1-С6) алкоксильной группы, галоген (C2-С6) алкила, брома, хлора, фтора, йода и арила;
включающий аминирование, дегидратирование и окисление соединения формулы V
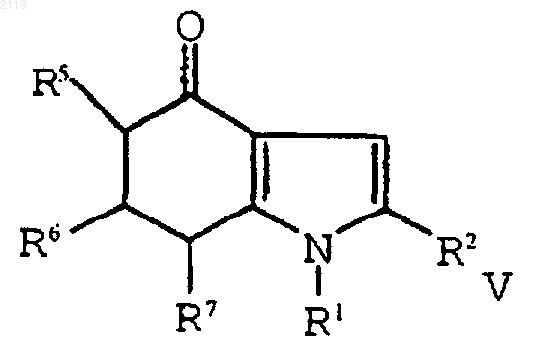
путем кипячения с обратным холодильником в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150шС и диэлектрическую константу, равную, по меньшей мере, 10, в присутствии катализатора и амина формулы R1NH2.
17. Способ по п.15, где растворитель, образующий азеотропную смесь, является толуолом, а полярный углеводородный растворитель имеет точку кипения 150-220шС и диэлектрическую константу 12-18.
18. Способ по любому из пп.15-17, который позволяет получать 2-этил-1-(фенилметил)-4-гидрокси-1Н-индол.
Текст
1 Область изобретения Это изобретение относится к способу получения некоторых 1H-индол-3-глиоксамидов,использующихся для ингибирования высвобождения жирных кислот, опосредованного sPLA2,при таких состояниях, как септический шок. Предпосылки создания изобретения Некоторые 1H-индол-3-глиоксамиды известны как мощные и селективные ингибиторыsPLA2 млекопитающих, использующиеся для лечения таких заболеваний, как септический шок, респираторный дистресс-синдром взрослых, панкреатит, травма, бронхиальная астма,аллергический ринит, ревматоидный артрит и родственные заболевания, вызванные sPLA2. Например, публикация ЕРО 0675110 раскрывает такие соединения. Различные патенты и публикации описывают способы получения индол-3 глиоксамидов. Статья "Recherches en serie indolique. VI surand Experimental Therapeutics, vol. 262, No. 3,(pp. 971-978) описывает некоторые 2-арил-3 индолглиоксиламиды, имеющие применение в исследованиях центральной нервной системы млекопитающих. В кратком сообщении "Fragmentation of Nbensylindoles in Mass Spectrometry"; ChemicalAbstracts, vol. 67, 1967, 73028h докладывается о различных бензилзамещенных фенолах, включающих соединения, имеющие глиоксиламидные группы в 3 положении индольного ядра. Патент США 3449363 описывает трифторметилиндолы, имеющие глиоксиламидные группы в 3 положении индольного ядра. Патент США 3351630 описывает соединения альфа-замещенной 3-индолил уксусной кислоты и их получение, включающие глиоксиламидные промежуточные соединения. Патент США 2825734 описывает получение 3-(2-амино-1-гидроксиэтил)индолов с использованием 3-индолглиоксиламидных промежуточных соединений, таких как 1-фенетил 2-этил-6-карбокси-N-пропил-3-индолглиоксиламид (см. пример 30). Патент США 4397850 описывает получение изоксазолилин-доламинов с использованием глиоксиламидиндолов в качестве промежуточных соединений. Патент США 3801594 описывает анальгетики, полученные с использованием 3-индолглиоксиламидов в качестве промежуточных веществ.La Societe Chimique De France, 1974,12, pp. 2883-2888, описывает различные индолил-3 глиоксамиды, которые являются водородзамещенными по 6-членному циклу индольного ядра. СтатьяChem., 1975, pp. 1979-1983, описывает фенилзамещенные 3-глиоксиламиды. Заявка США, по которой имеется решение о выдаче патента, с серийным номером 08/469954, полностью включенная в данный документ в качестве ссылки, раскрывает способ получения 4-замещенных-1H-индол-3-глиоксамидных производных, включающий взаимодействие соответственно замещенного 4 метоксииндола (получение описано в Clark,R.D. et al., Synthesis, 1991, pp. 871-878, раскрытие которого включено в данном документе в качестве ссылки) с гидридом натрия в диметилформамиде при комнатной температуре (2025 С), затем обработку арилметилгалогенидом при температуре окружающей среды, с получением 1-арил-метилиндола, который подвергаютO-деметилированию с помощью трибромида бора в метиленхлориде (Tsung-Ying Shem andCharles A. Winter, Adv. Drug Res., 1977, 12, 176,раскрытие которого включено в качестве ссылки), получая 4-гидроксииндол. Алкилирование проводят с помощью сложного эфира альфабромалкановой кислоты в диметилформамиде,используя гидрид натрия в качестве основания. Превращение глиоксамида проводят путем взаимодействия сложного эфира -[(индол-4 ил)окси]алкановой кислоты вначале с оксалилхлоридом, затем с аммиаком, после чего проводят гидролиз с помощью гидроксида натрия в метаноле. Способ получения 4-замещенных-1 Ниндол-3-глиоксамидных производных, как изложено выше, имеет применимость. Однако, в этом способе используются дорогие реагенты и опасные для окружающей среды органические растворители, продуцируется фуран, содержащий побочные продукты, и целевой продукт производится с относительно низким выходом. Настоящее изобретение предоставляет улучшенный способ получения 4-замещенных 1 Н-индол-3-глиоксамидных производных. Способ настоящего изобретения может быть проведен с использованием недорогих, легкодоступных реагентов, с применением водных систем растворителей, с улучшенным общим выходом,в то же время этот способ позволяет избежать продуцирования фурановых побочных продуктов. Другие предметы, черты и преимущества настоящего изобретения станут ясны из сле 3 дующего описания и прилагающейся формулы изобретения. Краткое содержание изобретения Настоящее изобретение предоставляет способ получения соединения формулы I, или его фармацевтически приемлемой соли, или его пролекарственного производного 4 с образованием соединения формулы VIII с) алкилирование соединения формулы VII с помощью соединения формулы VIII где R1 выбран из группы, состоящей из-C7-C20 алкила, с образованием соединения формулы VId) аминирование и дегидратирование соединения формулы VI где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R4 выбран из группы, состоящей из -СО 2 Н,-SО 3 Н и -Р(O)(ОН)2, или из их солей, или пролекарственных производных; иR5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген (C1-С 6) алкоксильной группы, галоген (C2-C6) алкила,брома, хлора, фтора, йода и арила. Этот способ включает стадии: а) галогенирование соединения формулы Х с использованием амина формулы R1NH2 в присутствии растворителя, который образует азеотропную смесь с водой с образованием соединения формулы V; е) окисление соединения формулы V путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную,по меньшей мере, 10, в присутствии катализатора с образованием соединения формулы IV где R8 представляет собой (C1-С 6) алкил, арил или НЕТ; с использованием SO2Cl2 с получением соединения формулы IXf) алкилирование соединения формулы IVb) гидролиз и декарбоксилирование соединения формулы IX с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SО 3R4b, 5-Р(O)(OR4b)2 или -Р(О)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы IIIg) взаимодействие соединения формулы III с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SО 3R4b,-Р(O)(OR4b)2 или -Р(O)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы III с оксалилхлоридом и аммиаком с образованием соединения формулы II с) взаимодействие соединения формулы IIIh) необязательный гидролиз соединения формулы II с образованием соединения формулы I; иi) необязательное образование соли соединения формулы I. В другом воплощении данного изобретения предоставляется способ получения соединения формулы I, включающий стадии: а) окисление соединения формулы V путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную,по меньшей мере, 10, в присутствии катализатора с образованием соединения формулы IV с оксалилхлоридом и аммиаком с образованием соединения формулы IId) необязательный гидролиз соединения формулы II с образованием соединения формулы I; и е) необязательное образование соли соединения формулы I. Далее настоящее изобретение предоставляет новые промежуточные соединения формулы IVb) алкилирование соединения формулы IV-С 7-С 20 алкила, с помощью соединения формулы VIII где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, и t является целым числом от 0 до 5 включительно;R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген-(C1-С 6) алкоксильной группы, галоген (C2-С 6) алкила,брома, хлора, фтора, йода и арила. Соединения формулы IV применяются как промежуточные соединения при получении соединений формулы I. Кроме того, настоящее изобретение предоставляет способ получения соединения формулы IV с образованием соединения формулы VId) аминирование и дегидратирование соединения формулы VI с использованием амина формулы R1NH2 в присутствии растворителя, который образует азеотропную смесь с водой, с образованием соединения формулы V е) окисление соединения формулы V включающий стадии: а) галогенирование соединения формулы Х где R8 представляет собой (C1-С 6) алкил, арил или НЕТ; с использованием SO2Cl2 с получением соединения формулы IXb) гидролиз и декарбоксилирование соединения формулы IX путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную,по меньшей мере, 10, в присутствии катализатора. В другом воплощении настоящее изобретение предоставляет способ получения соединения формулы IV, включающий окисление соединения формулы V с образованием соединения формулы VIII с) алкилирование соединения формулы VII путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную, 9 по меньшей мере, 10, в присутствии катализатора. Подробное описание изобретения В описании 1H-индол-3-глиоксиламидов данного изобретения некоторые определяющие термины используются следующим образом. Использующийся в данном документе термин "алкил" сам по себе или как часть другого заместителя, обозначает, если не оговорено иначе, моновалентный углеводородный радикал с прямой или разветвленной цепью, такой как метил, этил, н-пропил, изо-пропил, н-бутил,третичный бутил, изобутил, втор-бутил, третбутил, н-пентил, изопентил, неопентил, гептил,гексил, октил, нонил, децил и т.п. Термин "(C1-С 10) алкоксильная группа",использующийся в данном документе, обозначает такие группы, как метоксильная, этоксильная, н-пропоксильная, изопропоксильная, нбутоксильная, т-бутоксильная, н-пентоксильная,изопентоксильная, нео-пентоксильная, гептоксильная, гексоксильная, октоксильная, ноноксильная, декоксильная и тому подобные группы,присоединенные к остатку молекулы через атом кислорода. Термин "(С 3-С 4) циклоалкил" включает циклопропильную и циклобутильную группы. Термин "С 3-С 4 циклоалкенил" включает циклопропенильное или циклобутенильное кольцо, имеющее двойную связь в 1 или 2 положении. Термин "галоген" обозначает фтор, хлор,бром или йод. Термин "галоген (C1-С 10) алкил" обозначает (C1-С 10) алкильную группу, замещенную 1-3 атомами галогена, присоединенную к остатку молекулы через алкильную группу. Термин "галоген (С 1-С 10) алкил" включает термин "галоген(С 2-С 6) алкил". Термин "галоген (C1-С 6) алкоксильная группа" обозначает галогензамещенную алкоксильную группу, которая присоединена к остатку молекулы через кислород алкоксильной группы. Термин "арил" обозначает группу, имеющую характерную циклическую структуру бензола, пенталена, индена, нафталина, азулена,гепталена, фенантрена, антрацена и др. Арильная группа может быть необязательно замещена 1-3 заместителями, выбранными из группы, состоящей из (C1-С 6) алкила (предпочтительно метила), (C1-С 6) алкоксильной группы или галогена (предпочтительно фтора или хлора). Термин "арилоксильная группа" обозначает арильную группу, которая присоединена к остатку молекулы через кислородный мостик. Термин "уходящая группа" обозначает заместитель с неподеленной электронной парой,который уходит от субстрата в процессе реакции нуклеофильного замещения. Термин "уходящая группа" включает галоген, сульфонат,ацетат и т.п. 10 Термин HET включает пиридин, пиразин,пиримидин, пиридазин, пиррол, пиразол, фуран,тиофен, тиазол, изотиазол, оксадиазол, тиадиазол, имидазол, триазол и тетразол. Гетероциклическое кольцо может быть присоединено к остатку молекулы через атом углерода гетероциклического кольца. Соли соединений формулы I представляют собой дополнительный аспект данного изобретения. В тех примерах, где соединения данного изобретения обладают кислыми функциональными группами, могут быть получены разные соли, которые лучше растворяются в воде и являются физиологически более подходящими,чем родственное соединение. Типичные фармацевтически приемлемые соли включают, не ограничиваясь ими, соли щелочных и щелочноземельных металлов, таких как литий, натрий,калий, кальций, магний, алюминий и т.п. Соли обычно получают из свободных кислот путем обработки кислоты основанием в растворе или путем приведения в контакт кислоты с ионнообменной смолой. В определение фармацевтически приемлемые соли включены относительно нетоксичные соли присоединения органического и неорганического основания соединений настоящего изобретения, например аммония, четвертичного аммония и амино-катионов, полученных из азотистых оснований, с достаточной степенью основности для того, чтобы образовать соли с соединениями данного изобретения (см., например, S.M. Berge, et al., "Pharmaceutical Salts", J.Phar. Sci., 66: 1-19 (1977. Пролекарства являются производными соединений данного изобретения, которые имеют химически или метаболически отщепляемые группы, и в результате сольволиза или в физиологических условиях становятся фармацевтически активными in vivo соединениями данного изобретения. Производные соединений данного изобретения обладают активностью в виде как кислотных, так и основных производных форм,но кислотные производные часто являются преимущественными в отношении растворимости,тканевой совместимости и задержки высвобождения в организме млекопитающих (см. Bundgard, H., Design of Prodrugs, pp. 7-9, 21-24, Elsevier, Amsterdam, 1985). Пролекарства включают производные кислот, хорошо известные специалистам, практикующим в данной области, такие как, например, сложные эфиры, полученные путем взаимодействия исходного кислотного соединения с подходящим спиртом,или амиды, полученные путем взаимодействия исходного кислотного соединения с подходящим амином. Простые алифатические или ароматические сложные эфиры, образованные из кислотных групп соединений данного изобретения, являются предпочтительными пролекарствами. В некоторых случаях желательно получать пролекарство в виде двойных сложных(алкоксикарбонил)окси)алкиловые сложные эфиры. Термин "кислотная защитная группа" используется здесь так же, как он часто используется в синтетической органической химии, он относится к группе, защищающей кислотную группу от участия в реакции, которая проводится на каких-либо других функциональных группах молекулы, но которая может быть удалена при необходимости. Такие группы обсуждалисьT.W. Greene в главе 5 Protective Groups in Organic Synthesis, John Wiley and Sons, New York,1981, полностью включенной в данном документе в качестве ссылки. Примеры кислотных защитных групп включают сложно-эфирные или амидные производные кислотных групп, такие как метил, метоксиметил, метил-тиометил, тетрагидропиранил, метоксиэтокси-метил, бензилоксиметил,фениларил, этил, 2,2,2-трихлорэтил, 2-метилтиоэтил, т-бутил, циклопентил, трифенилметил,п-бром-бензил, триметилсилил, N,N-диметил,пирролидинил, пиперидинил или о-нитроанилид. Предпочтительной кислотной защитной группой является метил. Предпочтительные соединения, полученные по способу настоящего изобретения К предпочтительной группе соединений формулы I, полученных по способу настоящего изобретения, относятся такие соединения, в которых:R4 представляет собой -СO2 Н; и R5, R6 и R7 представляют собой Н. Соединения, которые могут быть получены по способу настоящего изобретения, включают: 3-(2-амино-1,2-диоксиэтил)-2-метил-1(фенилметил)-1H-индол-4-ил)окси)уксусную кислоту;-3-(2-амино-1,2-диоксиэтил)-2-этил-6 фенокси-1-(фенилметил)-1H-индол-4-ил)окси) уксусную кислоту или их фармацевтически приемлемые соли. Из этих соединений предпочтительные соединения включают: 3-(2-амино-1,2-диоксиэтил)-2-этил-1(фенилметил)-1H-индол-4-ил)окси)уксусную кислоту;-3-(2-амино-1,2-диоксиэтил)-2,6-диметил-1-(фенилметил)-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2-метил-1(фенилметил)-1H-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-6-этил-2 метил-1-(фенилметил)-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2,6-диэтил-1(фенилметил)-1 Н-индол-4-ил)окси)уксусную кислоту; 3-(2-амино-1,2-диоксиэтил)-2-метил-6 фенокси-1-(фенилметил)-1 Н-индол-4-ил)окси) уксусную кислоту; 3-(аминооксоацетил)-2-этил-6-метил-1(фенилметил)-1H-индол-4-ил)окси)уксусную кислоту; и 3-(2-амино-1,2-диоксиэтил)-2-этил-6 фенокси-1-(фенилметил)-1H-индол-4-ил)окси) уксусную кислоту или их фармацевтически приемлемые соли. Из этих соединений еще более предпочтительными являются 3-(2-амино-1,2-диоксиэтил)-2-метил-1-(фенилметил)-1 Н-индол-4-ил) окси)уксусная кислота и 3-(2-амино-1,2 диоксиэтил)-2-этил-1-(фенилметил)-1 Н-индол 4-ил)окси)уксусная кислота. Наиболее предпочтительным соединением,которое может быть получено по способу настоящего изобретения, является 3-(2-амино 1,2-диоксиэтил)-2-этил-1-(фенилметил)-1 Ниндол-4-ил)окси)уксусная кислота или ее фармацевтически приемлемая соль. Соединения формулы IV,где R1 представляет собой 2-метилтио-1-(4-фенилэтилфенилметил)-4 гидрокси-6-йод-1 Н-индол; 2-фенил-1-гептил-4-гидрокси-1 Н-индол; 2-нафтил-1-октил-4-гидрокси-6-гексил-1 Ниндол; 2-циклобутил-1-додецил-4-гидрокси-1 Ниндол; 2-(циклобут-1-енил)-1-(2-хлорфенилметил)-4-гидрокси-7-бутокси-1 Н-индол; 2-циклопропил-1-октадецил-4-гидрокси-5(3-фторгексокси)-1 Н-индол; 2-(циклопроп-1-енил)-1-(3-пентоксифенилэтил)-4-гидрокси-6-метил-1 Н-индол; 2-метокси-1-(2-фенилметилфенилметил)-4 гидрокси-7-(2-хлорэтил)-1 Н-индол; 2-этилтио-1-тетрадецил-4-гидрокси-5,7 дибром-1 Н-индол. Способ настоящего изобретения Способ настоящего изобретения предоставляет улучшенный способ синтеза соединений формулы I, использующий недорогие, легкодоступные реагенты, показанный на схеме I, приведенной ниже. Схема IR2 представляет собой галоген, циклопропил, метил, этил, пропил, O-метил или S-метил,и R5, R6 и R7 представляют собой Н, являются предпочтительными промежуточными соединениями в способе получения соединений формулы I. Наиболее предпочтительным соединением формулы IV является 2-этил-1-(фенилметил)-4 гидрокси-1H-индол. Дополнительные типичные примеры соединений формулы IV, которые используются в настоящем изобретении, включают: 2-хлор-1-(3-метилфенилэтил)-4-гидрокси 6-метокси-1 Н-индол; 2-циклопропил-1-(4-этилтиофенилметил)4-гидрокси-5-(2-фтор-бутокси)-1H-индол; 2-(пиклопроп-1-енил)-1-(5-хлоргептилфенилэтил)-4-гидрокси-5,7-дифтор-1H-индол; 2-метокси-1-(3-т-бутилфенилметил)-4 гидрокси-7-фенил-1 Н-индол; Соединение формулы V растворяют в полярном углеводородном растворителе, имеющем точку кипения, по меньшей мере, 150 С и диэлектрическую константу, равную, по меньшей мере, 10, таком как диэтиленгликоль, Cellosolve, Carbitol, глим, диглим или триглим. В настоящем способе предпочтителен Carbitol. Количество использующегося растворителя должно быть достаточным для того, чтобы все соединения оставались в растворе, пока желательная реакция не завершится. Предпочтительны растворители, имеющие точку кипения от 150 до 250 С и диэлектpическую константу, находящуюся в интервале от 10 до 20. Наиболее предпочтительны растворители, имеющие точку кипения в интервале от 150 до 220 С и диэлектрическую константу,находящуюся в интервале от 12 до 18. 15 Примеры других подходящих растворителей включают м-дихлорбензол, бромбензол, мтолуидин, о-толуидин, транс-3-метилциклогексанол, 1,1,2,2-тетрахлорэтан, 2-гептанол, 2 бутоксиэтанол, о-дихлорбензол, крезол, 1 октанол, 3-метилциклогексанол, бензиловый спирт, 2-метилциклогексанол, 4-метилциклогексанол, октаннитрил, гексаннитрил, альфатолунитрил, 1,1,2,2-тетраметилмочевину и триэтиленгликоль. Раствор нагревают, предпочтительно, до температуры кипения выбранного растворителя с обратным холодильником. Желательно проводить реакцию в присутствии катализатора, такого как Pd/C, Pt/C, PdO, PtO2, V2O5, CuO, NiO,DDQ или МnO2. Предпочтительными являются палладий на угле и окись палладия. Реакция по существу завершается в течение приблизительно от 30 мин до 24 ч. Индол (IV) можно затем легко проалкилировать с помощью алкилирующего агента формулы XCH2R4a, в которой Х является подходящей уходящей группой, a R4a является защищенной карбоксильной, сульфонильной или фосфонильной кислотной группой, предпочтительно защищенной сложно-эфирной группой, в присутствии основания. Метилбромацетат является предпочтительным алкилирующим агентом. Подходящие основания включают карбонат калия, карбонат натрия, карбонат лития, карбонат цезия, бикарбонат натрия, бикарбонат калия или гидроксид калия. Карбонат калия является предпочтительным. Количество алкилирующего агента не является критическим, однако, реакция лучше проходит при использовании молярного избытка алкилирующего агента по отношению к исходному веществу. Реакцию предпочтительно проводят в органическом растворителе, таком как ацетон, ацетонитрил или диметилформамид. Другие подходящие растворители включают тетрагидрофуран, метилэтилкетон, ацетонитрил или т-бутилметиловый эфир. Реакцию проводят при температурах приблизительно от 0 до 100 С, предпочтительно при температуре окружающей среды, и реакция по существу завершается в течение приблизительно от 1 до 24 ч, в зависимости от применяемых реагентов и таких условий, как температура реакции. Необязательно может быть применен реагент фазового переноса, такой как бромид тетрабутиламмония. Получение глиоксамида II легко достигается в процессе двустадийного способа, вначале путем обработки промежуточного соединенияIII оксалилхлоридом в концентрациях приблизительно от 0,2 до 1,5 ммоль, предпочтительно в эквимолярных концентрациях по отношению к исходному веществу. Предпочтительными являются такие растворители, как метиленхлорид,хлороформ, трихлорэтилен, четыреххлористый углерод, эфир или толуол. Подходящими явля 002119 16 ются температуры приблизительно от -20 С до температуры окружающей среды, предпочтительно около -5 С. На второй стадии раствор обрабатывают аммиаком, или барботируя его в газообразном виде, или используя молярный избыток 30% водного аммиака. Реакцию обычно проводят при температурах приблизительно от -25 до 25 С, предпочтительно приблизительно от -2 до 0 С, и реакция по существу завершается в течение от 10 мин до часа. Гидролиз соединения II проводят с использованием основания, такого как гидроксид калия, гидроксид лития или гидроксид натрия,предпочтительно, с гидроксидом натрия, в растворителе - низшем спирте, таком как метанол,этанол, изопропанол и т.п., или в таких растворителях, как тетрагидрофуран, диоксан и ацетон. С помощью стандартных аналитических методов, таких как ВЭЖХ, можно следить за протеканием реакций схемы I для того, чтобы определить, когда исходные вещества и промежуточные соединения превращаются в продукт. Исходное вещество V получают в соответствии со следующей процедурой Схема II Для получения соединения IX соответственно замещенный пропионилацетат Х вначале галогенируют путем обработки сульфурилхлоридом, предпочтительно в эквимолярных концентрациях по отношению к исходному веществу, при температуре приблизительно от 0 до 25 С, предпочтительно менее 15 С. Гидролиз и декарбоксилирование IX проводят путем нагревания с обратным холодильником с водным раствором кислоты, такой как хлористо-водородная кислота, в течение приблизительно от 1 до 24 ч. Раствор, содержащий декарбоксилированный продукт VIII, нейтрализуют, доводя рН приблизительно до 7,0-7,5, после чего проводят реакцию с циклогександионом VII (предпочтительно в эквимолярных концентрациях) и основанием, предпочтительно 17 гидроксидом натрия, получая трикетон моногидрат VI в виде осадка, который при желании может быть очищен и выделен. Эту реакцию предпочтительно проводят при температурах от-20 С до температуры окружающей среды, и реакция по существу завершается в течение приблизительно от 1 до 24 ч. Вышеперечисленные реакции протекают как процесс "в одном сосуде" с реагентами, добавляемыми в реакционный сосуд в указанной выше очередности. Предпочтительно реакции дают протекать без выделения соединений формул IX или VIII, таким образом, избегая выделения этих летучих лакриматоров (слезоточивых веществ). Соединение V получают путем нагревания с обратным холодильником соединения VI в неполярном растворителе с высокой точкой кипения, который образует азеотропную смесь с водой, предпочтительно в толуоле, с эквимолярным количеством амина формулы R1NH2,где R1 такой, как определен выше. Предпочтительны растворители с точкой кипения, равной,по меньшей мере, 100 С, такие как толуол, ксилол, кумол, бензол, 1,2-дихлорэтан или мезитилен, применение которых позволяет избежать использование реакторов, работающих под давлением. Количество применяемого растворителя должно быть достаточным для того, чтобы гарантировать, что все соединения останутся в растворе до тех пор, пока реакция по существу не завершится полностью в течение приблизительно от 1 до 24 ч. Альтернативно, промежуточное соединение IV может быть получено из соединения VI в процессе, протекающем в одном сосуде, без выделения промежуточного соединения V, посредством нагревания VI с использованием палладия на угле и соответственно замещенного амина формулы R1NH2, в полярном углеводородном растворителе, таком как Carbitol, как описано в схеме I, приведенной выше. Реакция предпочтительно протекает при нагревании с обратным холодильником и по существу завершается в течение от 1 до 24 ч. Способ получения промежуточного соединения формулы IV Промежуточное соединение IV может быть получено, как описано выше в схеме I,стадия а, или II, приведенных выше. Промежуточное соединение гидроксииндол IV может быть очищено с помощью стандартных методов кристаллизации. Например,фильтрование продукта реакции через диатомовую землю и затем промывание тбутилметиловым эфиром эффективно удаляет катализатор. Фильтрат затем можно разбавить дополнительным количеством т-бутилметилового эфира и промыть предпочтительно водой. Органическую фазу собирают, сушат и концентрируют с помощью общепринятых методов. Концентрат предпочтительно растворяют 18 в метиленхлориде/гексане, фильтруют через диоксид кремния и снова концентрируют. Стандартные аналитические методы, такие как ВЭЖХ, могут использоваться для контроля за протеканием реакции для того, чтобы определить, когда исходные материалы и промежуточные соединения превратятся в продукт. Специалисты в данной области могут легко оценить, что исходные вещества для всех вышеприведенных процедур либо являются коммерчески доступными, либо могут быть легко получены путем известных способов из коммерческих исходных веществ. Например, исходное вещество Х может быть легко получено по способу, описанному D.W. Brooks et al.,Angew. Chem. Int. Ed. Eng 1979, 18, 72. Другие способы получений описаны R.J. Cregge, et al.,Tetrahedron Lett. 1973, 26, 2425; M.W. Rathke etTaber, et al., J. Am. Chem. Soc. 1987, 109, 7488; и Т. Hanken, Chem Ind. 1973, 325. Получение исходного вещества VII можно проводить, например, путем циклизации Дикмана, как описано Gramatiga P., et al., Heterocycles 24(3), 743-750 (1986) или Frank R.L. et al., J.Am. Chem. Soc., 72, p. 1645, 1950. Дополнительные способы получения могут быть обнаружены, среди прочих, в Venkar Y.D. et al., Tetrahedron Lett., 28, р. 551, 1987; H.E. Zimmerman et.(10), 2232-2233 (1990); или Berry N.M. et al.,Synthesis-Stuttgart (6), 476-480 (1986). Следующие примеры дополнительно иллюстрируют способ настоящего изобретения. Примеры также иллюстрируют способы получения промежуточных соединений данного изобретения. Эти примеры являются только иллюстративными и подразумевается, что они не ограничивают каким-либо образом сферу изобретения. В приведенных ниже примерах используются следующие сокращения: НСl - хлористо-водородная кислота,NaOH - гидроксид натрия,Pd/C - палладий на угле,t-BuOMe - т-бутилметиловый эфир,MgSO4 - сульфат магния,CH2Cl2 - дихлорметан,SiO2 - диоксид кремния,К 2 СО 3 - карбонат калия,i-PrOH - изопропиловый спирт,NН 3(г) - газообразный аммиак,МеОН - метанол,EtOH - этанол,МТВЕ - трет-бутилметиловый эфир. В колбу емкостью 22 л добавляют при перемешивании 750 г (4,12 моль) 2-(2-оксобутил)1,3-циклогександиона, затем 75 г 10% Pd/C и затем 7,5 л карбитола (лот 119WC7). В колбу добавляют 462 г (4,32 моль) бензиламина и нагревают до 200 С приблизительно в течение 1 ч. Реакционную смесь оставляют при температуре кипения с обратным холодильником (при 197 С) в течение 1 ч. ТСХ показывает отсутствие исходных веществ. Реакционную смесь охлаждают до комнатной температуры, фильтруют через целит для удаления катализатора,твердые вещества промывают 6,0 л толуола,затем 2 л воды. К фильтрату добавляют 12 л толуола и 6 л воды. Смесь перемешивают и слои разделяют. Водный слой снова экстрагируют 24 л метиленхлорида. Все органические слои объединяют и концентрируют до образования масла весом 1008 г. Это масло фильтруют через слой силикагеля, используя метиленхлорид для элюирования продукта из оксида кремния. Все фракции, содержащие продукт, объединяют и концентрируют до образования твердого вещества (775 г). Твердое вещество растворяют в 2 л толуола при 65 С, перемешивают в течение 15 мин, после чего разбавляют 15 л циклогексана и перемешивают 10 мин при 65-70 С. После охлаждения до комнатной температуры продукт кристаллизуют и помещают в холодильник(0 С) на ночь, затем перемешивают на холоде в течение 15-30 мин, фильтруют и промывают 2,0 л циклогексана. Продукт высушивают под вакуумом до постоянного веса, 547,4 г. Выход = 52,9%. Пример 1. 3-(Аминооксоацетил)-2-этил 1-(фенилметил)-1 Н-индол-4-ил)окси)уксусная кислота. А. Получение 2-(2-оксобутил)-1,3-циклогександиона. Метилпропионилацетат (130,15 г, 1,0 моль) помещают в колбу Мортона емкостью 2 л,оборудованную механической мешалкой, вводом для азота и термопарой. Применяют внешнее охлаждение до тех пор, пока внутренняя температура не достигнет 10 С. Сульфурилхлорид (135 г, 1,0 моль) добавляют по каплям с такой скоростью, чтобы поддерживать температуру 15 С. После того как добавление полностью завершено, хроматографический анализ показывает, что произошло полное превращение в целевое хлорсодержащее соединение. Затем добавляют 1 М НСl (205 мл) и реакционную смесь 20 перемешивают при нагревании с обратным холодильником в течение 18 ч. После охлаждения до комнатной температуры добавляют 4 н. NaOH для доведения рН до значения в интервале от 7,0 до 7,5. Добавляют циклогександион (112,13 г, 1,0 моль) и смесь охлаждают в бане со льдом. Затем добавляют по каплям 5 н. NaOH (200 мл,1,0 моль) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Полученный плотный осадок фильтруют, промывают водой и сушат под вакуумом, получая указанный в подзаголовке моногидрат трикетона,101 г, 56%. т.пл. 96-98 С.(CHCl3) 3018, 1707, 1613, 1380, 1189, 1127 см-1. УФ (EtOH) mах = 262 (14500). ЭА Теория: С, 59,98 Н, 8,05 Обнаружено: С, 59,71 Н, 7,82. МС для С 10 Н 14O3: m/z = 183 (m + 1). В. Получение 2-этил-1,5,6,7-тетрагидро-1(фенилметил)-4 Н-индол-4-она. Полученный описанным выше способом трикетон 101,14 г (0,51 моль) помещают в колбу емкостью 2000 мл, оборудованную сепаратором воды Дина-Старка, механической мешалкой и капельной воронкой. Добавляют толуол (600 мл) и смесь нагревают до температуры кипения с обратным холодильником, пока дистиллят не станет прозрачным и вся вода не удалится. Реакционную смесь слегка охлаждают, так как добавляемый по каплям бензиламин (55 г, 0,51 моль) вызывает экзотермическую реакцию с образованием воды. После завершения реакции реакционную смесь подвергают нагреванию с обратным холодильником, продолжая азеотропное удаление воды (3 ч). Хроматографический анализ показывает, что трикетон полностью израсходован. Затем светло-желтый раствор охлаждают до комнатной температуры, при этом цвет изменяется до коричневого. Толуольный раствор концентрируют досуха и полученное коричневое масло (133,8 г) непосредственно используют в следующем окислении. т.пл. 59-61 С. 21 МС для C17H19NO: m/z = 253. С. Получение 2-этил-(фенилметил)-1 Ниндол-4-ола. 3-Горлая колба Мортона емкостью 2000 мл оборудована механической мешалкой, обратным холодильником и заглушкой. В колбу загружают 10% Pd/C (26,8 г), затем раствор соединения стадии В, описанной выше (133,8 г), вCarbitol (800 мл, 2-этокси-(этокси)этанол). Полученную смесь затем подвергают нагреванию с обратным холодильником в течение 18 ч. После охлаждения фильтрация через диатомовую землю с последующей промывкой t-BuOMe позволяет эффективно удалить катализатор. Фильтрат разбавляют общим объемом 1 л tBuOMe и промывают водой (32 л). Органическую фазу сушат над МgSO4 и концентрируют,получая 166 г темно-коричневого масла. Масло растворяют в смеси CH2Cl2: гексан (3:1) и фильтруют через SiO2 (325 г), элюируя дополнительным количеством растворителя до обесцвечивания. Концентрированно дает 132,7 г указанного в подзаголовке индола. т.пл. 98,5-100 С.D. Получение сложного метилового эфира 2-этил-1-(фенилметил)-1 Н-индол-4-ил)окси) уксусной кислоты. Соединение части С, описанной выше, (3,0 г, 12,0 ммоль), К 2 СО 3 (3,31 г, 24,0 ммоль) и ацетон (24 мл) загружают в круглодонную колбу емкостью 100 мл, оборудованную магнитной мешалкой. Гетерогенную реакционную смесь перемешивают при комнатной температуре в течение 20 мин. По каплям через шприц добавляют метилбромацетат (1,7 мл, 18,0 ммоль) и реакционную смесь перемешивают в течение еще 15 ч. Реакционную смесь фильтруют на воронке Бюхнера, твердое вещество промывают ацетоном и фильтрат пропускают через гофрированную фильтровальную бумагу. Ацетон концентрируют в вакууме, получая 4,1 г твердого вещества белого цвета. Кристаллизация из iPrOH (30 мл) приводит к получению 3,28 г(84,5%) целевого, указанного в подзаголовке,промежуточного соединения в виде бесцветного кристаллического твердого вещества. т.пл. 95,5-97 С.(9600), 283 (7800), 293 (7700). ЭА Теория: С, 74,28 Н, 6,55 N, 4,33 Обнаружено: С, 73,32 Н, 6,64 N, 4,19. МС для С 20 Н 21NO3: m/z = 324 (m + 1). Е. Получение сложного метилового эфира 3-(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1 Н-индол-4-ил)окси)уксусной кислоты. Соединение части D, описанной выше (4,0 г, 0,0124 моль), загружают в 3-горлую круглодонную колбу емкостью 100 мл, оборудованную вводом для N2, магнитной мешалкой и газораспределительной трубкой, связанной с резервуаром с NН 3. Добавляют дихлорметан (28 мл),получая желтый раствор, который охлаждают в бане со льдом. К охлажденному раствору медленно, через шприц, добавляют неразбавленный оксалилхлорид (1,1 мл, 0,012 моль), получая темно-зеленый раствор. После перемешивания реакционного раствора в течение 20 мин при температуре бани со льдом, хроматографический анализ (ТСХ SiO2, CH2Cl2) показывает отсутствие исходного вещества. Затем через газодисперсионную трубку вводят NH3 (г) в течение 15 мин, после чего из темно-зеленого раствора образуется светло-желтый осадок, который перемешивают при температуре бани со льдом в течение дополнительных 20 мин. Реакционную смесь разбавляют CH2Cl2 (56 мл), фильтруют через диатомовую землю, промывают CH2Cl2(50 мл) и фильтрат концентрируют в вакууме,получая 4,65 г твердого вещества желтого цвета. Повторная кристаллизация из МеОН (15 об-в) дает 3,0 г (61,3%) в виде светло-желтых игл. т.пл. 179-181 С.F. Получение натриевой соли 3-(2-амино 1,2-диоксиэтил)-2-этил-1-(фенилметил)-1 Ниндол-4-ил)окси)уксусной кислоты. Соединение части F, описанной выше, загружают в 3-горловую круглодонную колбу емкостью 500 мл, оборудованную магнитной мешалкой и обратным холодильником. Твердое вещество суспендируют в EtOH (150 мл). Во время энергичного перемешивания суспензии при комнатной температуре добавляют 5 н.NaOH (9,1 мл, 45,7 ммоль). Реакционную смесь нагревают до температуры кипения с обратным холодильником, получая плотный белый осадок. Реакционную смесь нагревают с обратным холодильником в течение 20 мин и охлаждают до комнатной температуры. Добавляют EtOH (150 мл), твердое вещество отфильтровывают на воронке Бюхнера и сушат в высоковакуумной печи при 60 С в течение 4 ч, получая 13,67 г(14900), 337 (5836). ЭА Теория: С, 62,68 Н, 4,76 N, 6,96 Обнаружено: С, 62,43 Н, 4,78 N, 6,69. МС для C21H19N2O5: m/z = 381 (m - 21,Na/+H). Пример 2. Натриевая соль 3-(аминооксоацетил)-2-этил-6-метил-1-(фенилметил)-1 Ниндол-4-ил)окси)уксусной кислоты. А. Получение натрий 4-этоксикарбонил-5 метил-1,3-циклогександион енолата. В трехгорлой колбе емкостью 250 мл объединяют этилкротонат (32,26 г, 1,06 моль) и этилацетоацетат (35,45 г, 1,02 моль). При перемешивании добавляют этоксид натрия в течение 2 мин. Смесь нагревают до 78 С и поддерживают при этой температуре в течение 1 ч и 45 мин. Реакцию оставляют медленно охлаждаться, затем охлаждают в бане, содержащей воду со льдом, до 14 С. Реакционную смесь фильтруют,промывают дважды этанолом, затем сушат под вакуумом, получая 36,7 г (63,7%) указанного в подзаголовке соединения. В. Получение 5-метилциклогександиона. В пятилитровой колбе нагревают с обратным холодильником 495,9 г (2,25 моль) соединения части А, описанной выше, и раствор гидроксида калия (311,0 г в 1250 мл воды). Через 6,5 ч добавляют 6 М НСl (1 л) в течение 25 мин и смесь оставляют кипеть с обратным холодиль 002119 24 ником до тех пор, пока газ не перестанет выделяться приблизительно на 1 ч. Добавляют еще 100 мл 6 М НСl и снова реакционную смесь оставляют кипеть с обратным холодильником до тех пор, пока газ не перестанет выделяться. Добавляют последние 75 мл 6 М НСl и цвет изменяется с оранжевого на желтый. Реакционную смесь оставляют охлаждаться до 56 С и жидкость упаривают, получая 2728 г вещества. Добавляют этилацетат (2,6 л) и раствор переносят в колбу с донным выводом емкостью 22 л и промывают 500 мл этилацетата, затем 500 мл МТВЕ и 500 мл воды. После перемешивания слоям дают разделиться. Органический слой промывают насыщенным солевым раствором(1,5 л), затем сушат над сульфатом натрия и фильтруют, органический материал упаривают до образования густой взвеси (377 г). Взвесь фильтруют и промывают пентаном (6,5 л) для удаления желтого цвета требуется минимальное количество этилацетата. Полученный продукт сушат в вакуумной печи, получая 161,7 гA-F примера 1, используя (160,5 г) соединения части В, получают 7,62 г (91,2%) указанного в заголовке соединения в виде натриевой соли. Элементный анализ для C22H21N2O5Na Теория: С, 63,46 Н, 5,08 N, 6,72 Обнаружено: С, 63,69 Н, 5,16 N, 6,79. ЯМР (CD3OD)1,15 (т, 3 Н, J=7,2 Гц), 2,33I, или его фармацевтически приемлемой соли,или его пролекарственного производного-С 7-С 20 алкила, 25 где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R4 выбран из группы, состоящей из -CO2H,-SО 3 Н и -Р(O)(ОН)2, или из их солей и пролекарственных производных; иR5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген (C1-С 6) алкоксильной группы, галоген (C2-С 6) алкила,брома, хлора, фтора, йода и арила; включающий следующие стадии: а) галогенирование соединения формулы Х где R8 представляет собой (C1-С 6) алкил, арил или НЕТ; с использованием SO2Cl2 с получением соединения формулы IXb) гидролиз и декарбоксилирование соединения формулы IX с образованием соединения формулы VIII 26 тропную смесь с водой с образованием соединения формулы V; е) окисление соединения формулы V путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную,по меньшей мере, 10, в присутствии катализатора с образованием соединения формулы IVf) алкилирование соединения формулы IV с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SО 3R4b,-P(O)(OR4b)2 или -Р(О)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы IIIg) взаимодействие соединения формулы III с) алкилирование соединения формулы VII с оксалилхлоридом и аммиаком с образованием соединения формулы II с помощью соединения формулы VIII с образованием соединения формулы VIh) гидролиз соединения формулы IId) аминирование и дегидратирование соединения формулы VI с использованием амина формулы R1NH2 в присутствии растворителя, который образует азео с образованием соединения формулы I; иi) необязательное образование соли соединения формулы I. 2. Способ получения соединения формулыI, или его фармацевтически приемлемой соли,или его пролекарственного производного с) взаимодействие соединения формулы III с оксалилхлоридом и аммиаком с образованием соединения формулы II где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R4 выбран из группы, состоящей из -СО 2 Н,-SО 3 Н и -Р(O)(ОН)2, или из их солей и пролекарственных производных; иR5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген (C1-С 6) алкоксильной группы, галоген (C2-С 6) алкила,брома, хлора, фтора, йода и арила; включающий следующие стадии: а) окисление соединения формулы V путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную,по меньшей мере, 10, в присутствии катализатора с образованием соединения формулы IVd) гидролиз соединения формулы II с образованием соединения формулы I; и е) необязательное образование соли соединения формулы I. 3. Способ по п.1, где растворителем, образующим азеотропную смесь, является толуол, а полярный углеводородный растворитель имеет точку кипения 150-250 С и диэлектрическую константу 10-20. 4. Способ по п.1, где растворителем, образующим азеотропную смесь, является толуол, а полярный углеводородный растворитель имеет точку кипения 150-220 С и диэлектрическую константу 12-18. 5. Способ по любому из пп.1-4, который позволяет получать 3-(2-амино-1,2-диоксиэтил)-2-этил-1-(фенилметил)-1 Н-индол-4-ил) окси)уксусную кислоту. 6. Способ получения 2-этил-1-(фенилметил)-4-гидрокси-1 Н-индольного соединения формулы IVb) алкилирование соединения формулы IV где R1 выбран из группы, состоящей из с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SO3R4b,-P(O)(OR4b)2 или -Р(O)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы III 29 где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген (C1-С 6) алкоксильной группы, галоген (C2-С 6) алкила,брома, хлора, фтора, йода и арила; включающий следующие стадии: а) галогенирование соединения формулы Х где R8 представляет собой (C1-С 6) алкил, арил или НЕТ; с использованием SO2Cl2 с получением соединения формулы IXb) гидролиз и декарбоксилирование соединения формулы IX 30 тропную смесь с водой с образованием соединения формулы V е) окисление соединения формулы V-С 7-С 20 алкила, с образованием соединения формулы VIII с) алкилирование соединения формулы VII с помощью соединения формулы VIII с образованием соединения формулы VI где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген (C1-С 6) алкоксильной группы, галоген (С 2-С 6) алкила,брома, хлора, фтора, йода и арила; включающий окисление соединения формулы Vd) аминирование и дегидратирование соединения формулы VI с использованием амина формулы R1NH2 в присутствии растворителя, который образует азео путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную, 31 по меньшей мере, 10, в присутствии катализатора. 8. Способ по п.6, где растворителем, образующим азеотропную смесь, является толуол, а полярный углеводородный растворитель имеет точку кипения 150-250 С и диэлектрическую константу 10-20. 9. Способ по любому из пп.6-8, который позволяет получать соединение 2-этил-1(фенилметил)-4-гидрокси-1 Н-индол. 10. Способ получения 4-замещенного-1 Ниндол-3-глиоксамидного соединения формулыI, или его фармацевтически приемлемой соли,или его пролекарственного производногоb) гидролиз и декарбоксилирование соединения формулы IX с образованием соединения формулы VIII с) алкилирование соединения формулы VII с помощью соединения формулы VIII с образованием соединения формулы VI где R1 выбран из группы, состоящей из-С 7-С 20 алкила,d) аминирование, дегидратирование окисление соединения формулы VI где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R4 выбран из группы, состоящей из -CO2H,-SО 3 Н и -Р(O)(ОН)2, или из их солей и пролекарственных производных; иR5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген (C1-С 6) алкоксильной группы, галоген (C2-С 6) алкила,брома, хлора, фтора, йода и арила; включающий следующие стадии: а) галогенирование соединения формулы Х где R8 представляет собой (C1-С 6) алкил, арил или НЕТ; с использованием SO2Cl2 с получением соединения формулы IX путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную,по меньшей мере, 10, в присутствии катализатора и амина формулы R1NH2; с образованием соединения формулы IV е) алкилирование соединения формулы IV с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b, -SО 3R4b,-P(O)(OR4b)2 или -Р(O)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы IIIf) взаимодействие соединения формулы III 34 а) аминирование, дегидратирование окисление соединения формулы VI с оксалилхлоридом и аммиаком с образованием соединения формулы IIg) гидролиз соединения формулы II с образованием соединения формулы I; иh) необязательное образование соли соединения формулы I. 11. Способ получения 4-замещенного-1 Ниндол-3-глиоксамидного соединения формулыI, или его фармацевтически приемлемой соли,или его пролекарственного производного путем кипячения с обратным холодильником в полярном углеводородном растворителе,имеющем точку кипения, по меньшей мере,150 С и диэлектрическую константу, равную,по меньшей мере, 10, в присутствии катализатора и амина формулы R1NН 2 с образованием соединения формулы IVb) алкилирование соединения формулы IV с использованием алкилирующего агента формулы XCH2R4a, где Х является уходящей группой, a R4a представляет собой -CO2R4b,-SO3R4b, P(O)(OR4b)2 или -Р(O)(OR4b)H, где R4b является кислотной защитной группой, с образованием соединения формулы III-C7-С 20 алкила, с) взаимодействие соединения формулы III где R выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R4 выбран из группы, состоящей из -СO2 Н,-SО 3 Н и -Р(O)(ОН)2, или из их солей и пролекарственных производных; и с оксалилхлоридом и аммиаком с образованием соединения формулы IId) гидролиз соединения формулы II с образованием соединения формулы I; и е) необязательное образование соли соединения формулы I. 12. Способ по п.10 или 11, где полярный углеводородный растворитель имеет точку кипения 150-250 С и диэлектрическую константу 10-20. 35 13. Способ по п.10 или 11, где полярный углеводородный растворитель имеет точку кипения 150-220 С и диэлектрическую константу 12-18. 14. Способ по любому из пп.10-13, который позволяет получать 3-(2-амино-1,2 диоксиэтил)-2-этил-1-(фенилметил)-1 Н-индол 4-ил)окси)уксусную кислоту. 15. Способ получения 2-этил-1(фенилметил)-4-гидрокси-1 Н-индольного соединения формулы IV с помощью соединения формулы VIII с образованием соединения формулы VId) аминирование, дегидратирование окисление соединения формулы VI-C7-C20 алкила, где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген (C1-С 6) алкоксильной группы, галоген (C2-С 6) алкила,брома, хлора, фтора, йода и арила; включающий следующие стадии: а) галогенирование соединения формулы Х где R8 представляет собой (C1-С 6) алкил, арил или НЕТ; с использованием SO2Cl2 с получением соединения формулы IXb) гидролиз и декарбоксилирование соединения формулы IX с образованием соединения формулы VIII с) алкилирование соединения формулы VII-С 7-С 20 алкила, где R10 выбран из группы, состоящей из галогена, C1-С 10 алкила, C1-С 10 алкоксильной группы,-S-(C1-С 10 алкила) и галоген (C1-С 10) алкила, a t является целым числом от 0 до 5 включительно;R5, R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, (C1-С 6) алкила,(C1-С 6) алкоксильной группы, галоген (C1-С 6) алкоксильной группы, галоген (C2-С 6) алкила,брома, хлора, фтора, йода и арила; включающий аминирование, дегидратирование и окисление соединения формулы V 38 17. Способ по п.15, где растворитель, образующий азеотропную смесь, является толуолом,а полярный углеводородный растворитель имеет точку кипения 150-220 С и диэлектрическую константу 12-18. 18. Способ по любому из пп.15-17, который позволяет получать 2-этил-1-(фенилметил)4-гидрокси-1 Н-индол.
МПК / Метки
МПК: C07D 209/08
Метки: получения, способ, 4-замещенных-1н-индол-3-глиоксамидов
Код ссылки
<a href="https://eas.patents.su/20-2119-sposob-polucheniya-4-zameshhennyh-1n-indol-3-glioksamidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 4-замещенных-1н-индол-3-глиоксамидов</a>
Предыдущий патент: Фунгицидная смесь
Следующий патент: Алатрофлоксациновые парентеральные составы
Случайный патент: Способ извлечения золота












