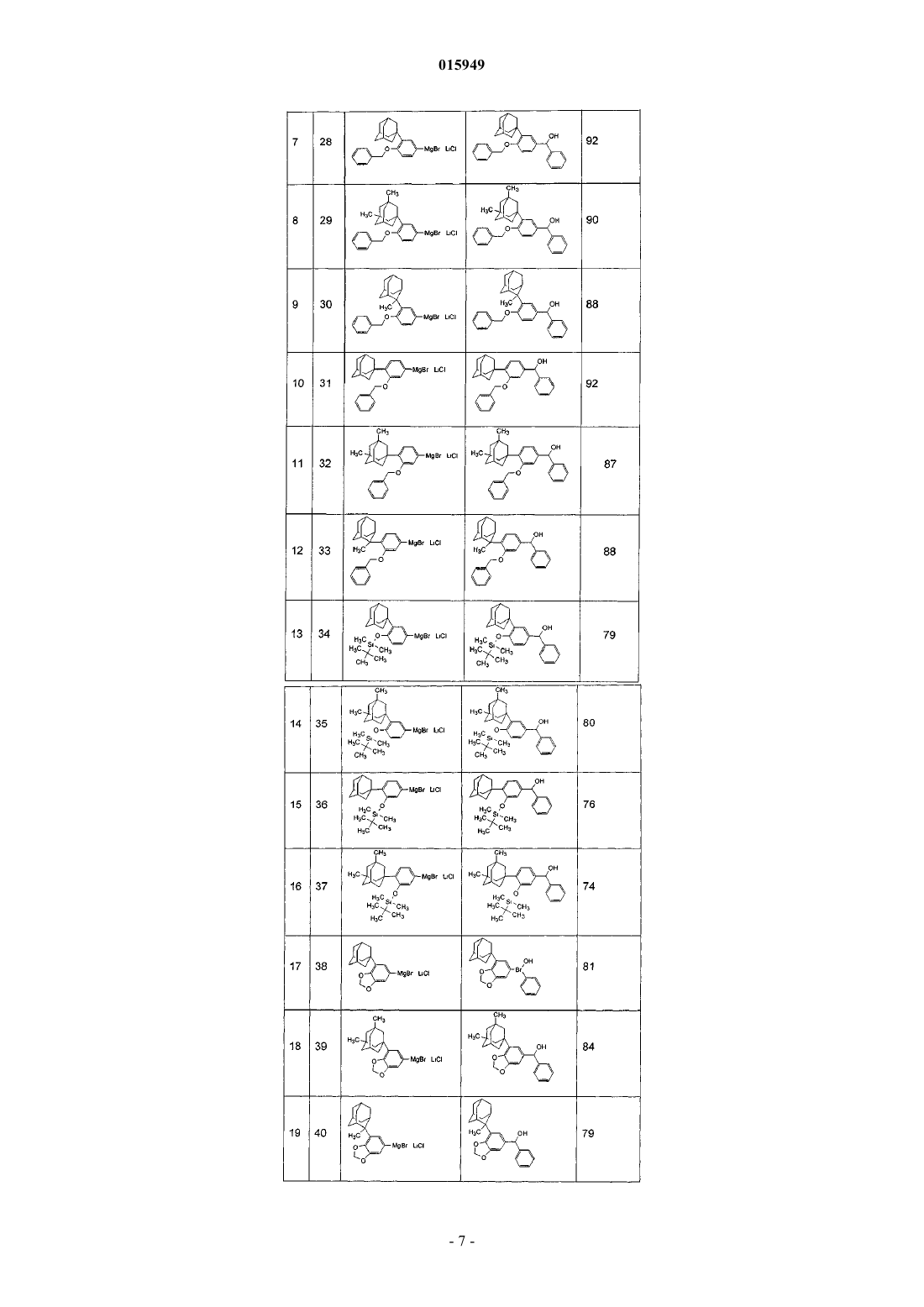
Способ получения замещенных адамантиларилмагний галогенидов
Номер патента: 15949
Опубликовано: 30.12.2011
Авторы: Чернобровый Александр, Трибулович Вячеслав, Калвиньш Иварс, Лабейш Владимир
Формула / Реферат
1. Способ получения соединения формулы (I)
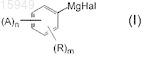
в котором
А является 1-адамантил или 2-адамантил, который необязательно может быть замещен от нуля до шести заместителями, где заместитель является метилом;
Hal является Br;
R является
Н, С1-С10алкокси, бензилокси или две R группы вместе образуют метилендиоксигруппу, -OSiR2R3R4, где R2, R3, R4, каждый независимо, является C1-С10алкилом, -(CH2)t(С6-С10арилом), -(CH2)t(4-10-членным гетероциклом), где t является числом от 0 до 5; и 4-10-членный гетероцикл содержит О;
n является 1 или 2;
m является от 0 до 3;
включающий реакцию соединения формулы (II)
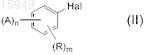
где A, Hal, R, n и m соответствуют значениям, описанным для формулы (I), с магнием в апротонном инертном растворителе (прямая реакция Гриньяра) в присутствии безводного лития хлорида.
2. Способ по п.1, отличающийся тем, что апротонный инертный растворитель является тетрагидрофураном.
3. Способ по любому из пп.1-2, отличающийся тем, что безводный лития хлорид используют в стехиометрическом соотношении с замещенным адамантиларилгалогенидом формулы (II) в интервале от 1 до 1,2 моль/моль.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩННЫХ АДАМАНТИЛАРИЛМАГНИЙ ГАЛОГЕНИДОВ Изобретение относится к тонкому органическому синтезу, в частности к способу получения замещнных адамантиларилмагний галогенидов путм добавления хлорида лития в синтез реагента Гриньяра при реакции металлического магния в сухом тетрагидрофуране под аргоном с замещнным адамантиларилгалогенидом. Добавление хлорида лития к адамантиларилгалогениду в соотношении от 1:1 до 1:2 приводит к стабильному высокому выходу требуемого конечного продукта. Замещнные адамантиларилгалогениды являются активными промежуточными соединениями, которые при взаимодействии с различными электрофилами приводят к получению широкого ряда биологически активных соединений.(71)(73) Заявитель и патентовладелец: ГРИНДЕКС, ДЖОИНТ СТОК КАМПАНИ (LV) 015949 Область изобретения Данное изобретение относится к тонкому органическому синтезу, особенно к способам получения замещнных адамантиларилмагний галогенидов. Уровень техники Магнийорганические соединения особенно важны в современной препаративной органической химии. С открытия Гриньяра в 1900 году способы получения и дальнейшего превращения этих синтетических интермедиатов находятся в постоянном развитии и углублении. Стандартным препаративным способом получения магнийорганических соединений (реагентов Гриньяра) является прямое взаимодействие органических галогенидов с металлическим магнием в апротонном полярном растворителе, таком как тетрагидрофуран (THF) или диэтиловый эфир [С. Т. Иоффе,А. Н. Несмеянов. Методы элементоорганической химии. Магний, бериллий, кальций, стронций, барий. Изд. АН СССР М. 1963, 14-27]. Целью данного изобретения является разработка способа получения замещнных адамантиларилмагний галогенидов, удовлетворяющего следующим требованиям: стабильные высокие выходы продукта; возможность масштабирования - простота технологии. Получаемые соединения являются активными промежуточными соединениями, которые могут взаимодействовать с различными электрофилами с образованием субстратов, пригодных для синтеза широкого ряда биологически активных соединений [Charpentier, В.; Bernardon, J.-M.; Eustache, J. et al.subtypes. J. Med. Chem. 1995, 38 (26), 4993-5006. Cincinelli, R.; Dallavalle, S.; Nannei, R. Synthesis and structure-activity relationships of a new series of retinoid-related biphenyl-4-ylacrylic acids endowed with antiproliferative and proapoptotic activity. J. Med. Chem. 2005, 48 (15), 4931-4946. Pfahl, M.; Tachdjian, С. et al. Heterocyclic derivatives for the treatment of cancer and other proliferative diseases. US 2002/0143182 A1]. Важным представителем замещнных адамантиларилмагний галогенидов является 3-(1-адамантил)4-метоксифенилмагний бромид Адапален является фармацевтическим препаратом, широко применяемым в дерматологии в качестве эффективного средства лечения acne vulgaris [Waugh, J.; Noble, S.; Scott, L. Spotlight on adapalene inHe менее важным представителем является 3-(1-адамантил)-4-(трет-бутилдиметилсилилокси)фенилмагний бромид 3-(1-Адамантил)-4-(трет-бутилдиметилсилилокси)фенилмагний бромид или 3-(1-адамантил)-4 бензилоксифенилмагний бромид также могут быть использованы для синтеза 4-[3-(1-адамантил)-4 гидроксифенил]-3-хлоркоричной кислоты (3-Cl-AHPC),которая также, как 6-[3-(1-адамантил)-4-гидроксифенил]-2-нафтойная кислота (AHPN, CD 437) запатентована в качестве противоракового препарата [Dawson, M.; Fontana, J.; Zhang, X. et al. Induction ofapoptosis in cancer cells. WO 03/048101 A1]. Синтез замещнных адамантиларилмагний галогенидов, содержащих электронодорные заместители в ароматическом цикле, классическим способом, т.е., взаимодействием арилгалогенида с металлическим магнием в апротонном полярном растворителе, таком как THF или диэтиловый эфир, обеспечивает выход, не превышающий 11%. Основной реакционный продукт образуется при восстановлении арилгалогенида. Так, из 2-(1-адамантил)-4-броманизола получается 2-(1-адамантил)анизол с 78% выходом (см. пример 1). Газохроматографический анализ реакционной смеси подтверждает полную конверсию 2-(1 адамантил)-4-броманизола. Это означает, что исходное вещество очень эффективно реагирует с металлическим магнием в условиях классической реакции Гриньяра. Подобный эксперимент с 2-(1-адамантил)-5-броманизолом приводит к похожим результатам (см. пример 2). Восстановление адамантиларил галогенида в качестве главной реакции исходного вещества в условиях реакции Гриньяра может быть результатом нестабильности адамантиларилмагний галогенида или следствием низкой реакционоспособности реагента Гриньяра с используемым электрофилом. Изменение температуры и времени приготовления реагента Гриньяра практически не приводит ни к какому существенному изменению в в составе продуктов реакции (см. пример 4). Способ добавления(одновременное добавление исходного арилбромида и дибромэтана), [D.E.Pearson et al., J.Org.Chem., 24,504 (1959)] не привело к позитивному результату (см. пример 5). Замена органического электрофила не меняет существенным образом соотношение продуктов: продукт восстановления/замещнный адамантиларилмагний бромид (см. пример 6). Использование неорганического электрофила наподобие D2SO4 - D2O, предотвращающего возможное взаимодействие адамантиларилмагний галогенида с органическим электрофилом привело к такому же результату. Так, разложение реагента Гриньяра, полученного из 2-(1-адамантил)-4-броманизола с смесью D2SO4 - D2O, привело к получению смеси продуктов, в которой содержание дейтерированного 2-(1-адамантил)анизола, который является конечным продуктом в этом случае, составляет 9% (данные ЯМР, см. пример 7). Эти результаты показывают, что реагент Гриньяра, образованный из 2-(1-адамантил)-4-броманизола, является нестабильным соединением и претерпевает формальное восстановление до взаимодействия с любым электрофилом. Ближайшим известным уровнем техники для данного изобретения является обменный способ получения магнийорганических реагентов [Krasovskiy, A.; Knochel, P. A. LiCl-mediated Br/Mg exchange reaction for the preparation of functionalized aryl - and heteroarylmagnesium compounds from organic bromides.Br/Mg exchange. Angew. Chem. Int. Ed. 2006, 45 (1), 159-162.]. Этот способ основан на полученииAlkMgClLiCl или Alk2MglLiCl комплексов и их взаимодействии с замещнными арил- или гетероарил-2 015949 галогенидами. Как бы то ни было, реакция 2-(1-адамантил)-4-броманизола (см. Пример 8 - в соответствии с уровнем техники) и 3-(1-адамантил)-5-бромвератрола (см. Пример 9 - в соответствии с уровнем техники) с изо-PrMgClLiCl в условиях, соответствующих известному уровню техники, приводит к конверсии от 6 до 9% в течение двух дней. Таким образом, экспериментальные данные подтверждают как нестабильность замещнного адамантиларилмагний галогенида, так и низкую реакционоспособность замещнного адамантиларилмагний галогенида в реакции обмена с использованием изо-PrMgClLiCl. При исследовании получения арилмагний галогенидов с электронодонорными заместителями в цикле, некоторые авторы [Krasovskiy, A.; Straub, В. F.; Knochel, P. Highly efficient reagents for Br/Mg exchange. Angew. Chem. Int. Ed. 2006, 45 (1), 159-162] использовали реактанты с высокой реакционной способностью в обменном синтезе магнийорганических соединений, так что равновесие в уравнении Шленка было смещено к изо-Pr2MgClLiCl или диалкилмагний производному путм связывания MgCl2 различными реактантами, например диоксаном. Использование этого способа при получении магнийорганического производного из 2-(1-адамантил)-4-броманизола (см. пример 10 - в соответствии с уровнем техники) привело к 13% конверсии через два дня. Полученные результаты показывают, что наиболее активным реактантом при получении металлоорганических производных из адамантиларилгалогенидов является металлический магний, но образовывающийся адамантиларилмагний галогенид должен быть стабилизирован для предотвращения дальнейших нежелательных реакций. Поставленная задача, т.е. разработка эффективного и технологически целесообразного способа получения замещнных адамантил-арилмагний галогенидов была достигнута при использовании хлорида лития в процессе синтеза реагента Гриньяра - при реакции металлического магния с замещнными адамантиларилгалогенидами под аргоном в безводном THF. (см. примеры 11-42). Данный способ получения замещнных адамантил-арилмагний галогенидов основан на предположении, что в стандартных условиях магнийорганического синтеза, т.е. воздействии арилгалогенидов на металлический магний, добавление хлорида лития стабилизирует замещнный адамантиларилмагний галогенид путм образования комплекса и предотвращает дальнейшие нежелательные реакции, но не приводит к полному угнетению реакционной способности замещнного адамантиларилмагний галогенида. Способ в соответствии с данным изобретением проиллюстрирован нижеследующими примерами. Пример 1. В колбу объмом 1 л, оборудованную мешалкой, обратным холодильником и капельной воронкой поместили 8 г (0,33 моль) магниевых стружек и 200 мл сухого тетрагидрофурана. Воздух в колбе заменили аргоном и все дальнейшие операции проводили под небольшим током инертного газа. При интенсивном перемешивании добавили 11 г (5 мл, 0,06 моль) 1,2-дибромэтана. После интенсивной реакции, горячую реакционную смесь обработали раствором 50 г (0,16 моль) 2-(1-адамантил)-4 броманизола в 400 мл сухого тетрагидрофурана с такой скорость, чтобы поддерживать небольшое кипение. После добавления всего раствора 2-(1-адамантил)-4-броманизола, реакционную смесь кипятили в течении ещ 30 мин. Перемешивание прекратили и раствор приготовленного реагента Гриньяра декантировали от остатка магния в коническую колбу с притртой пробкой, продутую аргоном. Для дальнейшей функционализации триметилбората, использовался стандартный реактант для приготовления фенилборных кислот. В колбе объемом 1 л, оборудованную мешалкой, обратным холодильником и капельной воронкой получили раствор 33 г (36 мл, 0,35 моль) триметилбората в 100 мл сухого тетрагидрофурана, охладили до-50 С и при интенсивном перемешивании добавили раствор реагента Гриньяра в течение 30 мин при от-40 до - 50 С. Реакционную смесь разложили раствором 50 мл соляной кислоты в 50 мл воды при интенсивном перемешивании в отсутствии внешнего охлаждения. Смесь перенесли в разделительную воронку и разделили водный и органический слои. К водному слою добавили 200 мл воды после чего дважды проэкстрагировали с помощью 100 мл диэтилэфира. Объединнные органические растворы высушили с помощью безводного сульфата натрия, растворители удалили при пониженном давлении при температуре около 50 С на водяной бане. Остаток обработали с 200 мл гексана и оставили в холодильнике на ночь. Осадок отфильтровали,промыли холодным этилацетатом и высушили при температуре 100 С. Получили 3-(1-адамантил)-4 метоксифенилборную кислоту с температурой плавления 300 С, выход 2,5 г (5,7%). Газовый хроматографический анализ реакционной смеси показал присутствие только основного продукта. Выход, по данным газовой хроматографии, составил 78%. Вещество было выделено и идентифицировано в качестве 2-(1-адамантил)анизола. Препаративный выход составил 67%, т.пл. 100-102 С. Пример 2. Реакцию проводили как описано в примере 1. В качестве адамантиларилгалогенйда использовали 50 г (0,16 моль) 2-(1-адамантил)-5-броманизола. Получили 4-(1-адамантил)-3-метоксифенилборную кислоту, 3 г (6,8%). По данным газовой хроматографии выход 2-(1-адамантил)анизола составил 81%. Продукт формального восстановления 2-(1-адамантил)-5-броманизола выделили установили его идентичность с 2-(1-адамантил)анизолом, полученным в примере 1, подтвердив таким образом приписанную структуру. Пример 3. Реакцию проводили как описано в примере 1. В качестве адамантиларилгалогенида использовали 56 г (0,16 моль) 3-(1-адамантил)-5-бромвератрола. Получили 3-(1-адамантил)-4,5-метоксифенилборную кислоту, 3,7 г (7.3%). По данным газовой хроматографии выход 3-(1-адамантил) вератрола составил 74%. Пример 4. Реакцию проводили как описано в примере 1. Изменение температуры и времени реакции не повлияли на результат. Пример 5. Реакцию проводили как описано в примере 1. Одновременное добавление арилгалогенида и 1,2-дибромэтана не повлияло на результат. Использование бензальдегида в качестве электрофила который количественно реагирует с арилмагний галогенида с образованием арилфенилметанола не повлияло на результат. Реакционная смесь, по данные газовой хроматографии содержала 70-75% производного адамантилбензола и 3-11% ожидаемого арилфенилметанола Пример 6. Реагент Гриньяра приготовили из 51 г (0,16 моль) 2-(1-адамантил)-4-броманизол как в примере 1. В следующей стадии в колбу объмом 1 л оборудованную мешалкой, обратным холодильником и капельной воронкой поместили 17 г (16,5 мл, 0,16 моль) бензальдегида и 100 мл сухого тетрагидрофуран, раствор охладили до 0 С и при перемешивании добавили раствор реагента Гриньяра в течение 10 мин. Смесь оставили на 16 ч в холодильнике при температуре около 0 С. Реакционную смесь разложили раствором 25 мл соляной кислоты в 25 мл воды при интенсивном перемешивании в отсутствии внешнего охлаждения. Смесь перенесли в разделительную воронку и разделили водный и органический слои, водный слой проэкстрагировали 2 порциями по 100 мл диэтилового эфира. Объединнные органические слои высушили над сульфатом натрия. Выход 3-(1-адамантил)-4-метоксифенилметанола по данным газовой хроматографии составил 11%. Пример 7. Реагент Гриньяра приготовили из 10 г (0,032 моль) 2-(1-адамантил)-4-броманизола как в примере 1. В качестве электрофила для функционализации и идентификации использовали смесь D2SO4D2O. Реакционную смесь разложили раствором 2 мл D2SO4 в 10 мл тяжлой воды при интенсивном перемешивании в отсутствии внешнего охлаждения. Смесь перенесли в разделительную воронку и разделили водный и органический слои, водный слой проэкстрагировали 2 порциями по 50 мл диэтилового эфира. Объединнные органические слои высушили над сульфатом натрия и удалили растворители при пониженном давлении. Пример 8 (в соответствии с известным уровнем техники). В колбу объемом 200 мл с магнитной мешалкой и капельной воронкой поместили 5,14 г (0,016 моль) 2-(1-адамантил)-4-броманизола и 60 мл сухого тетрагидрофурана. Воздух в колбе заменили аргоном и все дальнейшие операции проводили под небольшим током инертного газа. Смесь охладили до температуры -5 С и добавили 3 эквивалента 0,5 молярного раствора изо-PrMgCl LiCL в тетрагидрофуране, поддерживая температуру реакции в интервале от -5 до 0 С. Раствор изо-PrMgCl LiCL в тетрагидрофуране приготовили заранее, его концентрацию определили титрацией по известному способу [Krasovskiy, A.; Knochel, P. Convenient titration method for organometallic zinc, magnesium, and lanthanide reagents. Synthesis 2006, 5, 890-891]. После добавления раствора изо-PrMgCl LiCL в тетрагидрофуране, реакционную смесь выдерживали в течение 1 ч при 0 С и оставили при комнатной температуре на 48 ч. По данным газовой хроматографии конверсия 2-(1-адамантил)-4-броманизола составила 9%.-4 015949 Пример 9 (в соответствии с известным уровнем техники). Реакцию проводили как описано в примере 8. В качестве адамантиларилгалогенида использовали 5.62 г (0,016 моль) 3-(1-адамантил)-5-бромвератрола. По данным газовой хроматографии конверсия 3-(1-адамантил)-5-бромвератрола составила 6%. Если реакцию проводят в смеси тетрагидрофурана и диоксана (диоксан 10% по объму), конверсия адамантиларилгалогенида увеличивается незначительно. Пример 10 (в соответствии с известным уровнем техники). Реакцию проводили как описано в примере 8. В качестве растворителя для 5,14 г (0,016 моль) 2-(1 адамантил)-4-броманизола использовали смесь 54 мл тетрагидрофурана и 6 мл диоксана. По данным газовой хроматографии конверсия 2-(1-адамантил)-4-броманизола составила 13%. Пример 11. В 100 мл колбу с магнитной мешалкой, обратным холодильником и капельной воронкой поместили 1 г (0,042 моль) магниевых стружек и добавили 20 мл сухого тетрагидрофурана. Добавили порошкообразный безводный лития хлорид, 0,81 г (0,019 моль). Воздух в колбе заменили аргоном и все дальнейшие операции проводили под небольшим током инертного газа. При интенсивном перемешивании добавили 1,1 г (0,5 мл, 0,006 моль) 1,2-дибромэтана. После интенсивной реакции, к горячей реакционной смеси по каплям в течение 30 мин добавили раствор 5,14 г (0,016 моль) 2-(1-адамантил)-4 броманизола в 40 мл сухого тетрагидрофурана, поддерживая температуру реакционной смеси в интервале от 55 до 60 С. Смесь затем слабо кипятили ещ 30 мин. Перемешивание прекратили и раствор приготовленного реагента Гриньяра декантировали от остатка магния в коническую колбу с притртой пробкой, продутую аргоном. Колбу хранили при 0 С в течение 2 ч. В колбу объемом 250 мл с магнитной мешалкой, обратным холодильником и капельной воронкой поместили раствор 3,4 г (3,3 мл, 0,032 моль) бензальдегида в 20 мл сухого тетрагидрофурана, охладили до 0 С и при перемешивании добавили раствор реагента Гриньяра в течение 10 мин. Смесь оставили в холодильнике при температуре около 0 С на 16 ч. Реакционную смесь разложили раствором 5 мл HCl в 5 мл воды при интенсивном перемешивании в отсутствии внешнего охлаждения. Смесь перенесли в разделительную воронку и разделили водный и органический слои, водный слой проэкстрагировали 2 порциями 20 мл диэтилового эфира. Объединнные органические слои высушили над сульфатом натрия. Выход 3-(1-адамантил)-4-метоксифенил)фенилэтанола, по данным газовой хроматографии, составил 88%. Оптимальное соотношение замещнного адамантиларилгалогенида и лития хлорида в реакции Гриньяра было экспериментально определено как 1:1,2. Результаты в табл. 1 (примеры 4, 10, 11-12) показывают, что увеличение молярного отношения лития хлорида от 0,1 до 1,2 увеличивает выход реагента Гриньяра, но дальнейшее увеличение до 2 эквивалентов существенного увеличения выхода реагента Гриньяра не вызывает. Таблица 1. Влияние соотношения арилгалогенида и лития хлорида на выход арилмагний галогенида Пример 12. Реакцию проводили как описано в примере 11. Реагент Гриньяра получили с добавлением 0,07 г (0,0016 моль, 1 эквивалент) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:0,1. Выход по данным газовой хроматографии составил 16%. Пример 13. Реакцию проводили как описано в примере 11. Реагент Гриньяра получили с добавлением 0,34 г (0,008 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:0,5. Выход по данным газовой хроматографии составил 30%. Пример 14. Реакцию проводили как описано в примере 11. Реагент Гриньяра получили с добавлением 0,68 г (0,016 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:1. Выход по данным газовой хроматографии составил 75%. Пример 15. Реакцию проводили как описано в примере 11. Реагент Гриньяра получили с добавлением 1,02 г (0,024 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:1,5. Выход по данным газовой хроматографии составил 87%. Пример 16. Реакцию проводили как описано в примере 11. Реагент Гриньяра получили с добавлением 1,36 г (0,032 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:2. Выход по данным газовой хроматографии составил 85%.-5 015949 Пример 17. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 5,58 г (0,016 моль) 2-(3,5-диметиладамантил)-4-броманизола. Реакцию проводили без добавления LiCl. Выход (3-[1-(3,5-диметиладамантил)-4-метоксифенил)фенилэтанола по данным газовой хроматографии составил 13%. Пример 18. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 5,58 г (0,016 моль) 2-(3,5-диметиладамантил)-4-броманизола. Порошкообразный безводный лития хлорид 0,07 г (0,0016 моль) использовали в реакции Гриньяра. Молярное соотношение субстрат:LiCl составляет 1:0,1. Выход по данным газовой хроматографии составил 18%. Пример 19. Реакцию проводили как описано в примере 18. Реагент Гриньяра получили с добавлением 0,34 г (0,008 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:0,5. Выход по данным газовой хроматографии составил 34%. Пример 20. Реакцию проводили как описано в примере 18. Реагент Гриньяра получили с добавлением 0,68 г (0,016 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:1. Выход по данным газовой хроматографии, составил 74%. Пример 21. Реакцию проводили как описано в примере 18. Реагент Гриньяра получили с добавлением 0,81 г (0,019 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:1,2. Выход по данным газовой хроматографии составил 89%. Пример 22. Реакцию проводили как описано в примере 18. Реагент Гриньяра получили с добавлением 1,02 г (0,024 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:1,5. Выход по данным газовой хроматографии составил 89%. Пример 23. Реакцию проводили как описано в примере 18. Реагент Гриньяра получили с добавлением 1,36 г (0,032 моль) порошкового безводного LiCl. Молярное соотношение субстрат:LiCl составляет 1:2. Выход по данным газовой хроматографии составил 84%. Данный способ получения адамантиларилмагний галогенидов был проверен с различными субстратами. Молярное соотношение адамантиларилгалогенида и лития хлорида было 1:1,2. В качестве электрофила использовали бензальдегид. Выход определяли методом газовой хроматографии (примеры 11,21, 24-43). Результаты приведены в табл. 2. Таблица 2. Выход адамантиларилгалогенида при молярном соотношении адамантиларилгалогенида и лития хлорида 1:1.2 Номер примераДанные газовой хроматографии Пример 24. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 5,36 г (0,016 моль) 2-[2-(2-метиладамантил)]-4-броманизол. Выход по данным газовой хроматографии составил 84%. Пример 25 Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 5,14 г (0,016 моль) 2-(1-адамантил)-5-броманизола. Выход по данным газовой хроматографии составил 92%. Пример 26. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 5,6 г (0,016 моль) 2-[1-(3,5-диметиладамантил)]-5-броманизола. Выход по данным газовой хроматографии составил 91%. Пример 27. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 5,36 г (0,016 моль) 2-[2-(2-метиладамантил)-5-броманизола. Выход по данным газовой хроматографии составил 90%. Пример 28. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 6,35 г (0,016 моль) 3-(1-адамантил)-4-бензилоксибромбензола. Выход по данным газовой хроматографии составил 92%. Пример 29. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 6,8 г (0,016 моль) 3-[1-(3,5-диметиладамантил)]-4-бензилоксибромбензола. Выход по данным газовой хроматографии составил 90%. Пример 30. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 6,58 г (0,016 моль) 3-[2-(2-метиладамантил)]-4-бензилоксибромбензола. Выход поданным газовой хроматографии составил 88%. Пример 31. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 6,35 г (0,016 моль) 3-бензилокси-4-(1 -адамантил)бромбензола. Выход по данным газовой хроматографии составил 92%. Пример 32. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 6,8 г (0,016 моль) 3-бензилокси-4-[1-(3,5-диметиладамантил)бромбензола. Выход по данным газовой хроматографии составил 87%. Пример 33. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 658 г (0,016 моль) 3-бензилокси-4-[2-(2-метиладамантил)бромбензола. Выход по данным газовой хроматографии составил 88%. Пример 34 Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 674 г (0,016 моль) 3-(1-адамантил)-4-[1-(трет-бутилдиметилсилилокси)]бром 6 ензола. Выход по данным газовой хроматографии составил 79%. Пример 35. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 7,18 г (0,016 моль) 3-[1-(3,5-диметиладамантил)]-4-(трет-бутилдиметилсилилокси)бромбензола. Выход по данным газовой хроматографии составил 80%. Пример 36. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 6 74 г (0,016 моль) 3-(трет-6 утилдиметилсилилокси)-4-(1-адамантил)бромбензола. Выход по данным газовой хроматографии составил 76%. Пример 37. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 7,18 г (0,016 моль) 3-(трет-бутилдиметилсилилокси)-4-[1-(3,5-диметиладамантил)бромбензола. Выход по данным газовой хроматографии составил 74%. Пример 38. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 5,36 г (0,016 моль) 3,4-метилендиокси-5-(1-адамантил)бромбензола. Выход по данным газовой хроматографии составил 81%. Пример 39. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 5,81 г (0,016 моль) 3,4-метилендиокси-5-[1-(3,5-диметиладамантил)бромбензола. Выход по данным газовой хроматографии составил 84%.-8 015949 Пример 40. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 5,58 г (0,016 моль) 3,4-метилендиокси-5-[2-(2-метиладамантил)бромбензола. Выход по данным газовой хроматографии составил 79%. Пример 41. Реакцию проводили как описано в примере 11. В качестве адамантиларилгалогенида использовали 5,62 г (0,016 моль) 3-(1-адамантил)-5-бромвератрола. Выход по данным газовой хроматографии составил 82%. Пример 42. Реакцию проводили как описано в примере 11. В качестве исходного адамантиларилгалогенида использовали 5,84 г (0,016 моль) 3-[2-(2-метиладамантил)-5-бромвератрола. Выход по данным газовой хроматографии составил 77%. Представленные выше результаты показывают, что при использовании хлорида лития в реакции получения адамантиларилмагний галогенидов путм реакции металлического магния с адамантиларилгалогенидом в сухом тетрагидрофуране можно получить желаемый продукт со стабильными высокими выходами. Данный способ получения замещнных адамантиларилмагний галогенидов характеризуется стабильными и высокими выходами, технологической выполнимостью и возможностью масштабирования ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I) в котором А является 1-адамантил или 2-адамантил, который необязательно может быть замещн от нуля до шести заместителями, где заместитель является метилом;R является Н, С 1-С 10 алкокси, бензилокси или две R группы вместе образуют метилендиоксигруппу,-OSiR2R3R4, где R2, R3, R4, каждый независимо, является C1-С 10 алкилом, -(CH2)t(С 6-С 10 арилом), -(CH2)t(410-членным гетероциклом), где t является числом от 0 до 5; и 4-10-членный гетероцикл содержит О;m является от 0 до 3; включающий реакцию соединения формулы (II) где A, Hal, R, n и m соответствуют значениям, описанным для формулы (I), с магнием в апротонном инертном растворителе (прямая реакция Гриньяра) в присутствии безводного лития хлорида. 2. Способ по п.1, отличающийся тем, что апротонный инертный растворитель является тетрагидрофураном. 3. Способ по любому из пп.1-2, отличающийся тем, что безводный лития хлорид используют в стехиометрическом соотношении с замещнным адамантиларилгалогенидом формулы (II) в интервале от 1 до 1,2 моль/моль.
МПК / Метки
МПК: C07F 3/02
Метки: получения, способ, галогенидов, замещенных, адамантиларилмагний
Код ссылки
<a href="https://eas.patents.su/10-15949-sposob-polucheniya-zameshhennyh-adamantilarilmagnijj-galogenidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения замещенных адамантиларилмагний галогенидов</a>
Предыдущий патент: Лопасть вентилятора градирни
Следующий патент: Машина транспортная с краном-манипулятором и платформой
Случайный патент: Способ электролитического восстановления оксидов металлов, таких как диоксид титана, и применения способа