Способ получения сбраживаемого сусла и способ производства алкоголя или содержащего алкоголь напитка
Формула / Реферат
1. Способ получения сбраживаемого сусла, предусматривающий стадии:
(а) разжижения злакового материала с помощью вещества, имеющего альфа-амилазную и/или эндопротеазную активность с получением ожиженного затора,
(б) осахаривания ожиженного затора в присутствии альфа-амилазы, и
(в) фильтрования ожиженного и осахаренного затора с получением сбраживаемого сусла,
отличающийся тем, что, по меньшей мере, одну из стадий (а) или (б) проводят в присутствии фермента, имеющего экзопептидазную активность.
2. Способ по п.1, отличающийся тем, что злаковый материал содержит, по меньшей мере, 20% несоложенных злаков.
3. Способ по п.2, отличающийся тем, что злаковый материал содержит, по меньшей мере, 20% несоложенного сорго.
4. Способ по п.3, отличающийся тем, что злаковый материал содержит, по меньшей мере, 50% несоложенного сорго.
5. Способ по любому из пп.1-4, отличающийся тем, что используют эндопротеазу, полученную из Bacillus amyloliquefaciens.
6. Способ по любому из пп.1-5, отличающийся тем, что фермент, имеющий экзопептидазную активность, используют на стадии разжижения злакового материала.
7. Способ по любому из пп.1-6, отличающийся тем, что фермент, имеющий экзопептидазную активность, представляет собой экзопептидазу из грибов.
8. Способ по п.7, отличающийся тем, что грибы представляют собой грибы рода Aspergillus.
9. Способ по п.8, отличающийся тем, что грибы рода Aspergillus представляют собой Aspergillus sojae.
10. Способ по любому из пп.1-9, отличающийся тем, что экзопептидаза представляет собой аминопептидазу.
11. Способ производства алкоголя или содержащего алкоголь напитка, предусматривающий стадию сбраживания сусла в присутствии дрожжей, способных продуцировать этиловый спирт, отличающийся тем, что используют сусло, полученное способом по любому из пп.1-10.
12. Способ по п.11, отличающийся тем, что содержащим алкоголь напитком является пиво.
Текст
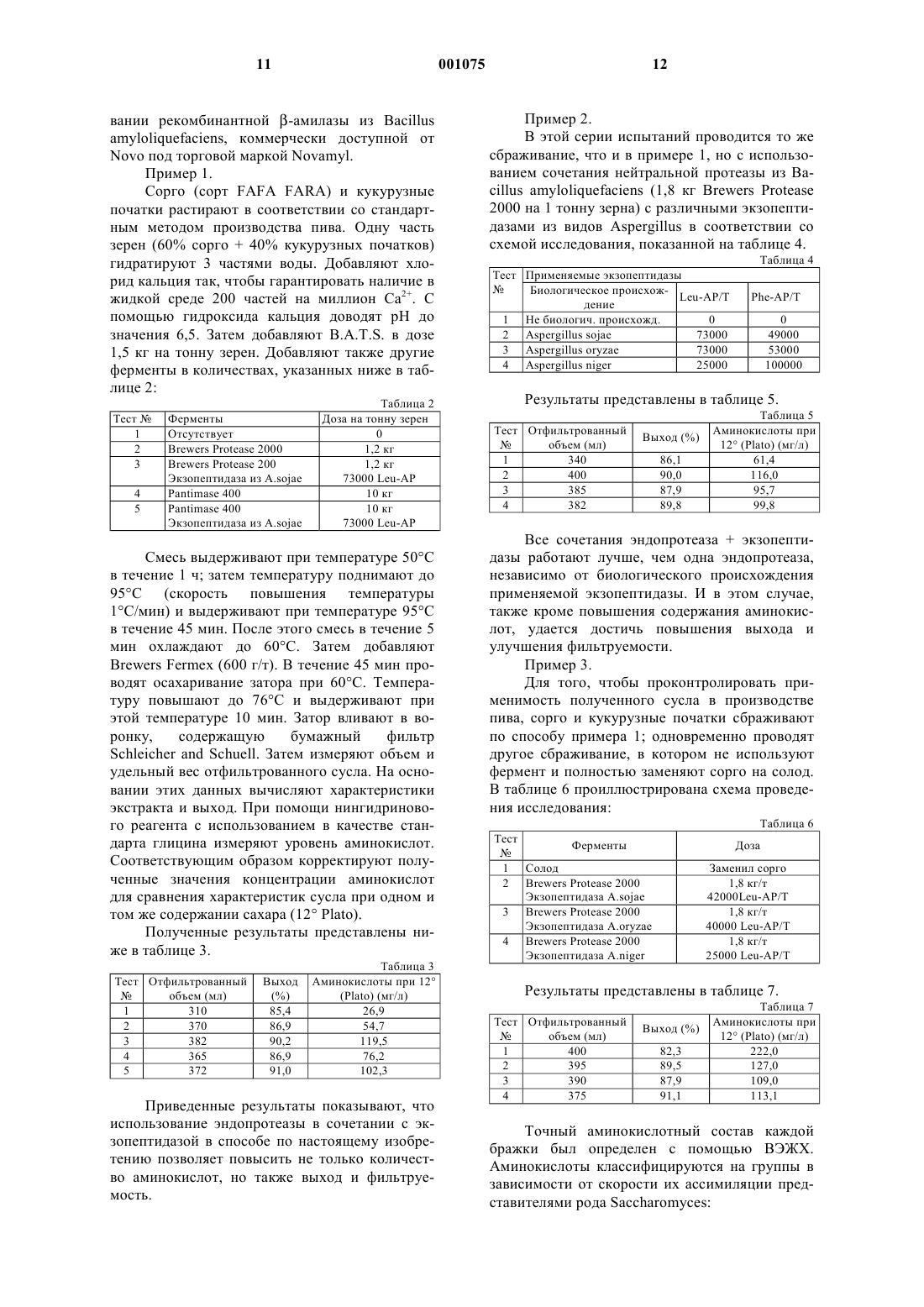
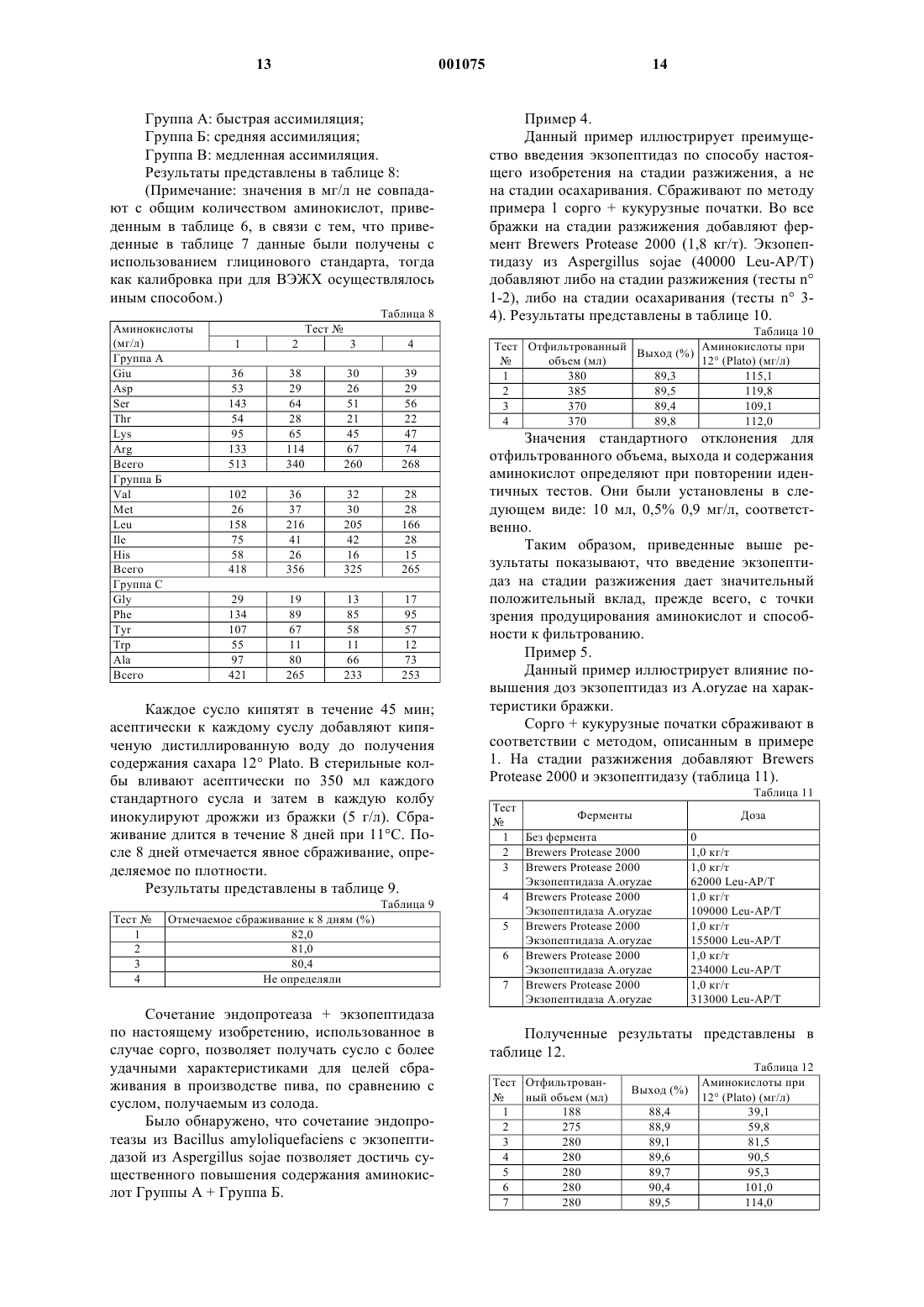
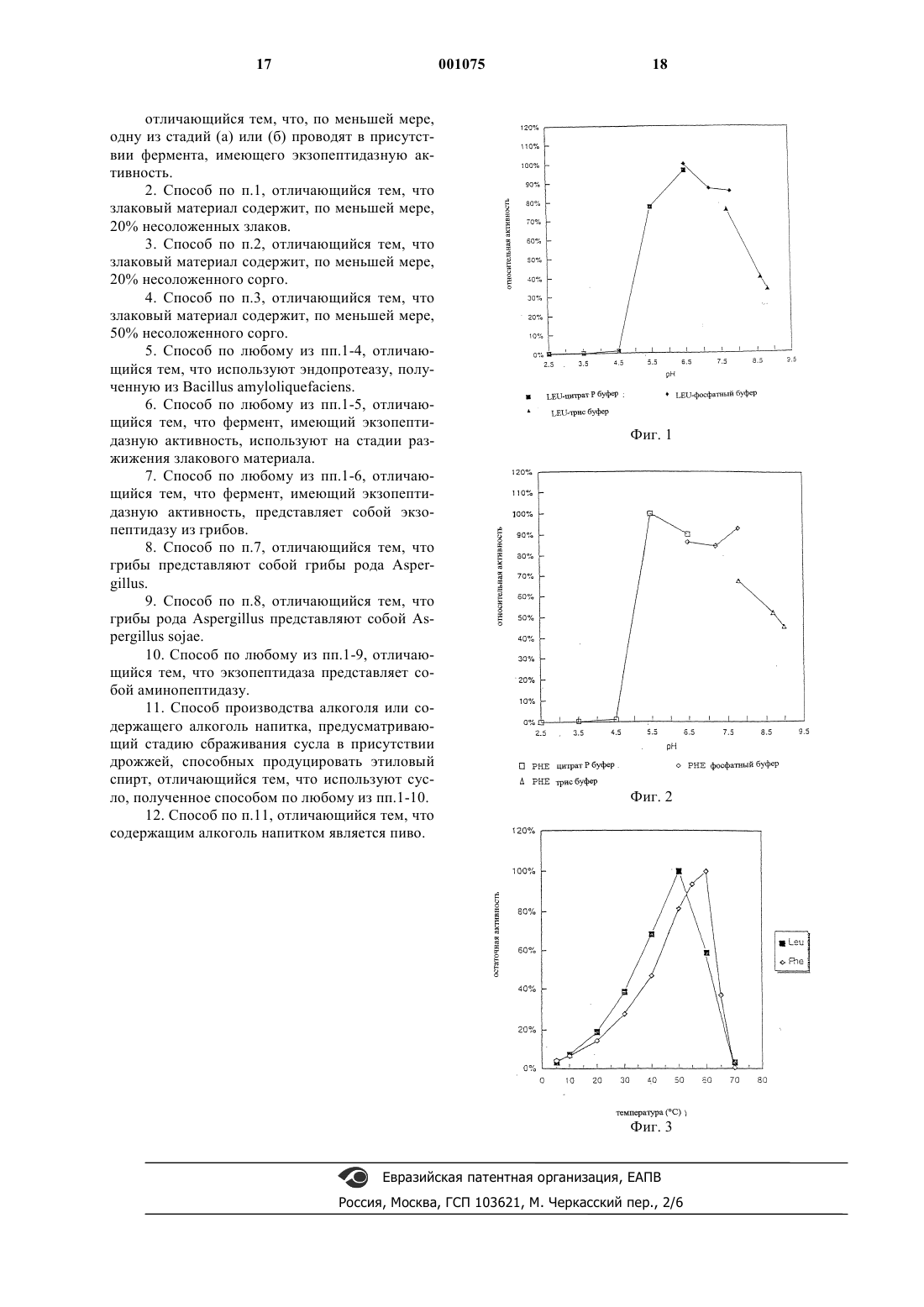
1 Изобретение касается способа получения сбраживаемого сусла, а именно сусла, получаемого из зерен злаковых культур, особенно из несоложенных зерен. Другим объектом изобретения является способ производства алкоголя и содержащего алкоголь напитка, использующий данный способ получения сусла. Пиво производят при сбраживании либо соложенных, либо несоложенных зерен. В последнем случае зерна разжижают и осахаривают с помощью коммерческих ферментных препаратов, получая сусло, которое содержит ферментируемые сахара и аминокислоты или другие формы азота (вместе называемые как формы свободно доступного азота (СДА, необходимые для ферментации дрожжей. Так, например, МакФадден с соавт.and Beverage Industries International (1989), 1, 7781) предлагают при варке пива вносить ферменты из неосоложенного сорго, такие как альфаамилаза, протеаза, бета-глюканаза, целлюлаза,альфа-амилаза грибов, аминоглюкозидаза и др. Кроме того, МакФадден с соавт. рекомендуют также при использовании несоложнного сорго добавлять для ферментации пекарские дрожжи. Байомо с соавт. (Bajomo, M.F. and Young,T.W., J. Inst. Brew. (1992) 98, 515-523; Bajomo,M.F. and Young, T.W., J. Inst.Brew. (1994) 100,79-84 3) приводят данные о варке пива из 100% несоложенных зерен сорго, несмотря на то, что уровень СДА в сусле из несоложенного сорго(51 мг/л) ниже значения, необходимого для сбраживания сусла, полученного из соложенного ячменя. В международной патентной заявке WO 92/20777 описан способ получения этанола,включающий разжижение зернового материала из несоложенных зерен кукурузы или сорго с помощью амилазы, осахаривание затора с применением глюкоамилазы и кислой протеазы грибов. Способ предусматривает добавление протеазы на стадии ферментации и на стадии осахаривания. Значение рН в сбраживаемой среде варьирует в диапазоне 4-5, что означает,что экзопептидазы грибов неактивны (Labbe,J.P., Rebeyrotte, Р., Biochimie (1974) 56, 839-844;Z.PhysioLChem. (1969) 350, 99-104). Недостаток указанного способа состоит в том, что в этих условиях используемые протеазы грибов осуществляют только эндопротеолиз, приводя к выходу, главным образом, олигопептидов и небольшого количества свободных аминокислот. В качестве основного источника для получения общего представления в данной области следует упомянуть обзор Палмера (G.H. Palmer,Cereal Science and Technology. In: Cereal Science 2 Краткое описание сущности изобретения Настоящее изобретение относится к способу изготовления сусла из несоложенных зерен злаковых, которое, как выяснилось, обладает неожиданно хорошими свойствами, такими как высокий уровень свободно доступного азота(обозначаемый далее как СДА), хорошая фильтруемость и хороший выход сусла. Указанный способ может также применяться в производстве сусла из соложенных зерен зерновых, но особенно заметны его достоинства при использовании в производстве сусла из несоложенных зерен, таких как несоложенное сорго или смесь несоложенного сорго и кукурузы. Преимущества заметны также при использовании сусла, полученного из так называемой смешанной бражки, которая представляет собой сочетание соложнных злаковых (таких как соложенный ячмень) и несоложенных злаковых (таких как кукуруза, рис или сорго). Таким образом, настоящее изобретение относится к способу получения сбраживаемого сусла, предусматривающему стадии:(а) разжижения злакового материала с помощью вещества, имеющего альфа-амилазную и/или эндопротеазную активность с получением ожиженного затора,(б) осахаривания ожиженного затора в присутствии альфа-амилазы, и(а) или (б) проводят в присутствии фермента,имеющего экзопептидазную активность. Применимы в качестве таких ферментов с экзопептидазной активностью экзопептидазы,предпочтительно термостабильные экзопептидазы, такие как аминопептидазы грибов, однако,могут использоваться и термостабильные карбоксипептидазы. Особенно предпочтительными по настоящему изобретению являются аминопептидазы, эндогенные для грибов из рода Aspergillus и более предпочтительны среди нихA.niqer, A.oryzae или A.sojae. Указанный способ особенно полезен в том случае, когда применяются зерна злаковых,включающие, пo меньшей мере, 20% несоложенных злаковых, предпочтительно более чем 50% несоложенных злаковых, таких как зерна сорго с добавками из несоложенных целых початков кукурузы, риса или других несоложенных злаковых. Было обнаружено, что в соответствии с настоящим изобретением очень благоприятно сказывается наличие экзопептидазы при разжижении зерен злаковых. Совместно с экзопептидазой используют эндопротеазу, предпочтительно, полученную из 3 из грибов, предпочтительно из грибов рода Aspergillus, а именно Aspergillus sojae. Предпочтительно, экзопептидаза представляет собой аминопептидазу. В соответствии с другим объектом, изобретение относится к способу производства алкоголя или содержащего алкоголь налитка, предусматривающего стадию сбраживания сусла в присутствии дрожжей, способных продуцировать этиловый спирт, причем используют сусло,полученное вышеописанным способом. Предпочтительно, содержащим алкоголь напитком является пиво, однако понятно, что из сусла может быть получен и другой алкоголь содержащий напиток, например, питьевой спирт. Ниже приводится описание фигур, иллюстрирующих настоящее изобретение. Описание фигур На фиг. 1 показан профиль рН для лейцинамикопептидазы из Aspergillus niger; На фиг. 2 показан профиль рН для фенилаланин-аминопептидазы из Aspergillus niger; На фиг. 3 показан температурный профиль для обеих аминопептидаз. Ниже дано более детальное описание изобретения. Подробное описание изобретения Способ разработан для изготовления сбраживаемого сусла из злаковых, отличительной чертой которого является то, что в используемых условиях хотя бы один имеющийся белок обладает экзопептидазной активностью. Применяются аминопептидазы, эндогенные для грибов, в особенности для грибов рода Aspergillus, поскольку они достаточно стабильны при значениях рН от 5 до 8, что совпадает с тем диапазоном значений, до которого падает рН на стадии разжижения. В условиях таких значений температуры и рН карбоксипептидазы менее полезны. На стадии осахаривания преобладают несколько более кислые условия, чем на стадии разжижения, и поэтому на данной стадии может с успехом применяться и карбоксипептидаза,при условии, что она обладает достаточной стабильностью в диапазоне температур 50-60 С,предпочтительно 50-70 С. Использование экзопептидаз по способу настоящего изобретения ведет не только к повышению уровня свободно доступного азота(СДА) в сусле, но также сказывается на улучшении фильтруемости и повышении выхода сусла в сравнении с вариантом осуществления процесса без добавления экзопептидаз. Способ по настоящему изобретению особенно выгодно использовать при получении сбраживаемого сусла из несоложенных злаковых, еще более предпочтительно из несоложенного сорго с необязательными добавками других злаков, таких как кукуруза, пшеница, овес или рис. В контексте настоящего описания тер 001075 4 мин злаковые включает сорго, пшеницу, ячмень, овес, рис, кукурузу и др. Использование экзопептидаз по настоящему изобретению дает преимущества также в случае применения смешанной бражки, в которой используется, как правило, соложенный злаковый материал, а также несоложенный материал из злакового сырья (содержащий, например, до 80% или даже до 90% соложенных злаковых, тогда как остаток включает несоложенные злаковые), поскольку было показано,что экзопептидазы оказывают положительное воздействие на органолептические показатели(вкус и/или запах). Было показано в соответствующих исследованиях, что указанные преимущества проявляются при использовании в пивоварении как несоложенных, так и соложенных злаковых, а также их смесей. Те злаковые, на которых особенно очевидны преимущества использования экзопептидаз,такие как уровень СДА, фильтруемость, выход и органолептические показатели, относятся к злаковым с относительно высоким содержанием фракций белков глютелина и проламина. К этой категории, кроме сорго, относится также рис(около 80% глютелина). При использовании сорго нужно обращать внимание на сорта с тем,чтобы использовать те из них, которые содержат сравнительно мало полифенола. За исключением добавления экзопептидаз,процесс изготовления сусла, например пивного сусла, осуществляется обычным способом. В основном, он включает разжижение необработанного злакового материала с получением затора, затем осахаривание указанного затора с получением сусла. Важно провести фильтрование перед сбраживанием сусла. Стадия разжижения обычно включает размалывание необработанного злакового материала с получением муки с частицами приемлемого размера, гидратирование их добавлением от примерно 1 до примерно 4, предпочтительно примерно 3 частей воды и необязательно, в зависимости от вида используемой эндопротеазы,добавление от примерно 50 до примерно 300 частей на миллион кальция, предпочтительно 200 частей на миллион Са 2+. При этом ферменты из Bacillus stearothermophilus считаются менее зависимыми от кальция. И, следовательно, в этом случае нет необходимости добавлять Са 2+. Размер частиц измельченных злаковых не должен превышать 3 мм; не более 3,5% могут превышать 1,3 мм; не более 1,5% должны быть меньше чем 0,25 мм. В дополнение к ним могут использоваться ферменты, такие как целлюлазы,-глюканазы и/или другие ферменты, разрушающие растительные клеточные стенки. Среду для ожижения обычно доводят до значения рН от примерно 5 до 8, предпочтительно от примерно 6 до 7, с использованием для этого, например, гидроксида кальция. Важ 5 но к среде для ожижения добавить -амилазу,предпочтительно термостабильную -амилазу, а также эндопротеазу, в дозировке, достаточной для того, чтобы провести, по меньшей мере,частичное разжижение крахмала зерна и вызвать, по меньшей мере, частичную деградацию белка. Подходящие дозировки -амилазы при использовании B.A.T.S. составляют от примерно 0,5 до примерно 2,0, предпочтительно в диапазоне примерно 1-1,5 кг на тонну. Подходящие дозировки протеаз, в случае использованияBrewers протеазы 2000, составляют более, чем 0,5 кг/т зерна (кг/т), предпочтительно больше чем 1 кг/т. При использовании Pantismase 400 ее следует добавлять в дозе более 2 кг/т, предпочтительно более чем 5 и еще более предпочтительно более чем 10 кг/т. В процессе разжижения множество стадий осуществляют при повышенной температуре: после добавления -амилазы и протеазы смесь выдерживают при температуре от примерно 40 С до примерно 65 С, предпочтительно от примерно 45 до 55 С и наиболее предпочтительно при 50 С, до тех пор, пока не будет достигнута достаточная степень разжижения. Нужное для этого время зависит от того, какое злаковое или какая смесь злаковых используется, и обычно период от примерно 30 мин до примерно 2 ч является удовлетворительным в этом отношении. После этого температуру постепенно повышают до примерно 90-95 С, при этом скорость повышения не является существенным фактором, и выдерживают при указанной температуре от примерно 30 мин до примерно 1 ч. Затем смесь охлаждают до температуры, при которой осуществляется осахаривание: обычно она составляет от примерно 50 С до примерно 70 С, предпочтительно от 55 С до 65 С, и наиболее предпочтительно около 60 С. Возможно применение несколько более высоких температур, чем 70 С, что зависит от термостабильности ферментов, используемых на стадии осахаривания. По достижению предпочтительной температуры добавляют осахаривающие ферменты, такие как Brewers Fermex (-амилаза) или Novamyl (рекомбинантная -амилаза), в количествах, которые обычно варьируют от примерно 400 г/т до примерно 1 кг/т в случаеBrewers Fermex. Часто также используют глюкоамилазы. Процесс осахаривания занимает от примерно 30 мин до примерно 2 ч, после чего температуру повышают до 75 С-85 С, в частности для того, чтобы инактивировать ферменты и нежелательные микроорганизмы, и выдерживают смесь при указанной предпочтительной температуре в течение примерно 10 мин; время выдерживания не является решающим фактором. Полученный таким образом затор далее фильтруют с использованием для этого известного в технике оборудования; удовлетворительные результаты дает воронка с фильтровальной 6 бумагой SchleicherSchuell. После фильтрования проводят сбраживание сусла с использованием подходящих дрожжей, при этом условия выбирают в зависимости от используемого штамма дрожжей и от конечной цели процесса; кроме использования в пивоварении, в настоящем изобретении рассматривается применение способа в производстве спирта в качестве биотоплива или в качестве алкогольного напитка. Подходящие штаммы и подходящие условия известны каждому специалисту в данной области. Было показано, что использование экзопептидазы при получении сусла, например, с целью изготовления пива, дает особенно хорошие результаты на стадии разжижения зернового материала. Однако, в сравнении со случаем отсутствия экзопептидазы добавление ее на стадии осахаривания также ведет к появлению уже упомянутых положительных результатов, таких как повышение уровня форм СДА, улучшение фильтруемости и повышение выхода сусла. Способ по изобретению позволяет выбрать фазу, которая имеет рН и температурные условия, способствующие проявлению активности экзопептидаз. Подходящими являются экзопептидазы, эндогенные для грибов в целом, особеннно представителей рода Aspergillus. Было показано, что особенно полезны аминопептидазы из рода Aspergillus, включая A.niger,A.sojae и A.oryzae. Как будет ясно из приведенного описания,добавление ферментов, проявляющих экзопептидазную активность, на стадии разжижения и/или осахаривания при изготовлении сусла приводит к получению сусла с хорошей фильтруемостью, высоким выходом и высоким уровнем СДА. В свою очередь, это позволяет в пивоварении, в производстве алкогольных напитков (жидкостей) и в производстве спирта (в качестве биотоплива) использовать значительный процент несоложенных злаковых или даже исключительно несоложнные злаковые. Последнее обстоятельство особенно выгодно для пивоварения в тех странах, где импорт солода ограничен или экономически менее выгоден. Особенно это существенно для Африки, где пиво производят из (смеси) злакового сырья, которое включает большой процент сорго. Кроме того, было показано улучшение органолептических характеристик (вкуса и запаха) пива, произведенного из сусла, в процессе получения которого на стадии разжижения или осахаривания (или на обеих) использовались экзопептидазы. Исследованиями было установлено, что указанное преимущество может быть достигнуто при производстве пива из соложенных злаковых, таких как обычный ячменный солод или смешанная пивная бражка (например,при использовании сочетания соложенных и несоложенных злаковых). 7 Экспериментальные данные А. Термостабильная -амилаза (стадия разжижения). Используемая на стадии разжижения в процессе по способу настоящего изобретения амилаза в общем представляет собой фермент,который расщепляет в крахмале -1,4-глюкозаглюкозные связи. Ее выбирают из числа термостабильных -амилаз. Очень хорошие результаты дает -амилаза из Bacillus licheni-formis,коммерчески доступная от Gist-Brocades под торговой маркой Brewer's Amyliq Thermo Stable(B.A.T.S.). Б. Эндопротеаза (стадия разжижения). Используемая на стадии разжижения в процессе по способу настоящего изобретения эндопротеаза в общем представляет собой фермент, который расщепляет в белках пептидные связи в условиях рН и температуры, имеющихся в начале стадии разжижения (рН 5-6; t 4555C). Очень хорошие результаты могут быть получены с использованием нейтральной пептидазы из Bacillus amyloliquefaciens, коммерчески доступной от Gist-Brocades под торговой маркой Brewer's Protease 2000. Может быть также использован протеолитический фермент изPanstimase SARL под торговой маркой Panstimase 400. В. Экзопептидазы (стадия разжижения и/или осахаривания). Используемые на стадии разжижения в процессе по способу настоящего изобретения экзопептидазы в общем представляют собой ферменты, которые расщепляют N-концевые связи в пептидах или белках. Очень хорошие результаты могут быть получены с использованием препаратов из видов Aspergillus. Ниже приведен способ получения аминопептидаз изB.1 Определение энзиматической активности. Экзопептидазную активность выражают в единицах лейцин-аминопептидазы или единицах фенилаланин-аминопептидазы: 1 Leu-AP единица обозначает количество фермента, необходимое для получения 1 мкмоля п-нитроанилина в минуту при рН 7,2 и при 20 С из L-лейцин-п-нитроанилида.Фенилаланинаминопептидазная единица. 1 Фенилаланинаминопептидазная единица обозначает количество фермента, необходимое для получения 1 мкмоля п-нитроанилина в минуту при рН 7,2 и при 20 С из L-фенилаланинп-нитроанилида.B.1.1 Фениланинаминопептидаза (Phe-AP). Фенилаланинпаранитроанилид растворяют в 7,5 мМ НСl до концентрации 0,9 мМ. 1 мл такого раствора субстрата смешивают с 1,5 мл 0,1 М фосфатного буфера, рН 7,2. В момент времени t=0 добавляют 0,5 мл фермента и оставляют смесь для прохождения реакции при 20 С. 8 Через 15 мин добавляют 1 мл 1N HCl. Слепую пробу ставят с 1N HCl, вводимой в момент времени t=0. Измеряют при 400 нм величину оптической плотности слепой пробы (ОПсл.пр) и исследуемого образца (ОПтест). Активность вычисляют по следующей формуле: В.1.2 Лейцин-аминопептидаза (Leu-АР). Лейцинпаранитроанилид растворяют в воде до концентрации 9 мМ. 1 мл такого раствора субстрата смешивают с 1,5 мл 0,1 М фосфатного буфера, рН 7,2. В момент времени t=0 добавляют 0,5 мл фермента и оставляют смесь для прохождения реакции при 20 С. Через 15 мин добавляют 1 мл 1N HCl. Слепую пробу ставят с 1NHCl, вводимой в момент времени t=0. Измеряют при 400 нм величину оптической плотности слепой пробы (ОПсл.пр) и исследуемого образца (ОПтест). Активность вычисляют по следующей формуле: В.1.3 Эндопротеаза (РU). Указанную активность измеряют при проведении гидролиза казеина при рН 6,0 и 40 С в течение 1 ч. Одна единица PU обозначает количество фермента, которое необходимо для того,чтобы высвободить эквивалент 1 мкмоля тирозина в минуту после осаждения оставшихся белков трихлоруксусной кислотой. В.2 Скрининг штаммов Aspergillus niger. 200 штаммов Aspergillus niger, выделенных из различных источников или полученных из коллекции культур, растят в среде, содержащей 15 г/л картофельной муки, 20 г/л бактопептона,7 г/л дрожжевого экстракта, 4 г/л дигидрофосфата калия, 0,5 г/л сульфата магния, 0,5 г/л хлорида кальция и 0,5 г/л хлорида цинка. рН среды составляет 4,8. Супернатанты, полученные при центрифугировании при 30 С 24-часовой прекультуры при 240 об/мин и 96-часовой культуры при 275 об/мин (и той же температуре) собирают и анализируют на наличие лейцин-, фенилаланин- и валинаминопептидазной активностей, как было описано ранее. Как следует из приведенной ниже таблицы 1, ряд штаммов Aspergillus niger обладают высоким потенциалом по продуцированию, по крайней мере, одной из указанных ферментативных активностей (каждое из значений представляет собой среднюю величину из четырех индивидуальных результатов): Таблица 1 Номер штамма 1053 1085 1103 1108 1444 1497 1502 9 Из указанных штаммов штаммы 1108 и 1502 были получены из коллекции культур и были депонированы под номерами, соответственно, NRRL 3112 и CBS 115.39. Штамм NRRL 3112 использовался для получения амилоглюкозидазы, -амилазы и глюкоамилазы. ШтаммCBS 115.39 использовался для продуцирования амилазы. В.3 Получение экзопептидазы в лабораторных масштабах. Несколько штаммов из набора для скрининга в примере 1 использовали для сбраживания в лабораторных ферментерах (10 л). В Примере ниже представлены полученные при этом результаты. Споры Aspergillus niger штамм 1502 собирают на чашках с ПДА (парафениламиндиамидом) после инкубации в течение 7-10 дней при 30 С. Инокулирование осуществляют в качалочной колбе, которая содержит среду, включающую глюкозу (20 г/л) и кукурузный экстракт (20 г/л) при рН 4,8, в течение 24 ч. Основную ферментацию проводят в периодическом режиме. Для этого используют следующие питательные ингредиенты: 100 г/л мальтодекстрина, 40 г/л соевой муки, 40 г/л гидролизованного казеина, 5 г/л кукурузного экстракта, 2 г/л желатина, 2 г/л дигидрофосфата калия, 1,3 г/л нитрата натрия, 1 г/л хлорида аммония, 0,01 г/л сульфата железа и 0,5 г/л пеногасителя. Вначале все питательные ингредиенты, за исключением мальтодекстрина, смешивают друг с другом. Доводят значение рН до 4,80,1. Затем ферментер стерилизуют при температуре 125 С в течение 40 мин. Раствор мальтодекстрина стерилизуют отдельно и добавляют к стерильной и охлажденной среде. Основную ферментацию осуществляют в лабораторном ферментере, заполненном 6 литрами описанной выше среды и инокулируют в нее культуру из колбы. Проводят перемешивание и аэрирование, с тем чтобы поддерживать как можно более высокую концентрацию растворенного кислорода. Температуру поддерживают на уровне 30 С. Как только все питательные компоненты будут потреблены, примерно через 130 ч, останавливают процесс ферментации. Бульон после сбраживания фильтруют для удаления микроорганизмов. В фильтрате измеряют аминопептидазную и эндопротеазную активности: 0,15 Leu-AP/мл 1,0 Phe-AP/мл 0,05 Val-AP/мл 0,1 PU/мл Для получения препарата жидкой аминопептидазы с глицерином (50%) в качестве стабилизирующего агента используют концентрации после ультрафильтрации. Полученный раствор так называемой Пептидазы L2 имеет следующие активности: 10 0,5 Leu-AP/мл 3,2 Phe-AP/мл 0,05 Val-AP/мл 0,1 PU/мл Приведенные результаты показывают, что выбранный штамм Aspergillus niger при выращивании в указанных условиях продуцирует аминопептидазы, не содержащие в значительных количествах эндопротеазу. В.4 рН профили ферментативных активностей. Активности Leu-AP и Phe-AP определяют исходя из пептидазы L2 (см. пример 2), но с использованием разных буферов для скрининга активности в диапазоне рН от 2,5 до 9,0. рН профиль лейцинаминопептидазы изAspergillus niger показан на фиг. 1. рН профиль фенилаланинаминопептидазы из Aspergillus niger показан на фиг. 2. Приведенные фигуры демонстрируют, чтоLeu-AP активна в диапазоне рН от 5 до 8,5, тогда как Phe-AP активна в диапазоне рН от 5,5 до 9, что соответствует данным, полученным для аминопептидаз из других видов Aspergillus. В.5 Температурные профили ферментативных активностей. Активности Leu-AP и Phe-AP определяют исходя из пептидазы L2 (см. пример 2), но с использованием различных температур инкубации для скрининга активности в диапазоне температур от 5 до 70 С. Температурные профили приведены на фиг. 3. Результаты показывают, что каждый фермент имеет оптимальную для активности температуру, т.е. 50 С для Leu-AP и 60 С дляPhe-AP. Ниже раскрывается способ продуцирования аминопептидаз из культуры Aspergillus niger. Указанные аминопептидазы имеют оптимальную активность в диапазоне рН 6-8 и в диапазоне температур 50-60 С; более того, в рассматриваемых условиях культивирования можно получать аминопептидазы, которые не содержат заметные или значительные количества эндопротеазы. Этот метод позволяет добиться превышения активности аминопептидазы над активностью эндопротеазы, предпочтительно первая из них в 10 раз выше, более предпочтительно в 30 раз выше. Г. Мальтогенная амилаза (стадия осахаривания). Амилаза, используемая на стадии осахаривания по способу настоящего изобретения,представляет собой фермент, расщепляющий связи -1,4-глюкоза-глюкоза в декстринах или крахмале с получением в качестве основных продуктов мальтозы и/или глюкозы. Очень хороших результатов можно достичь при использовании -амилазы из Aspergillus oryzae, коммерчески доступной от Gist-Brocades под торговой маркой Brewer's Fermex, или при использо 11Novo под торговой маркой Novamyl. Пример 1. Сорго (сорт FAFA FARA) и кукурузные початки растирают в соответствии со стандартным методом производства пива. Одну часть зерен (60% сорго + 40% кукурузных початков) гидратируют 3 частями воды. Добавляют хлорид кальция так, чтобы гарантировать наличие в жидкой среде 200 частей на миллион Са 2+. С помощью гидроксида кальция доводят рН до значения 6,5. Затем добавляют B.A.T.S. в дозе 1,5 кг на тонну зерен. Добавляют также другие ферменты в количествах, указанных ниже в таблице 2: Тест 1 2 3 4 5 Таблица 2 Доза на тонну зерен 0 1,2 кг 1,2 кг 73000 Leu-AP 10 кг 10 кг 73000 Leu-AP Смесь выдерживают при температуре 50 С в течение 1 ч; затем температуру поднимают до 95 С (скорость повышения температуры 1 С/мин) и выдерживают при температуре 95 С в течение 45 мин. После этого смесь в течение 5 мин охлаждают до 60 С. Затем добавляютBrewers Fermex (600 г/т). В течение 45 мин проводят осахаривание затора при 60 С. Температуру повышают до 76 С и выдерживают при этой температуре 10 мин. Затор вливают в воронку,содержащую бумажный фильтрSchleicher and Schuell. Затем измеряют объем и удельный вес отфильтрованного сусла. На основании этих данных вычисляют характеристики экстракта и выход. При помощи нингидринового реагента с использованием в качестве стандарта глицина измеряют уровень аминокислот. Соответствующим образом корректируют полученные значения концентрации аминокислот для сравнения характеристик сусла при одном и том же содержании сахара (12 Plato). Полученные результаты представлены ниже в таблице 3. Тест Отфильтрованный Приведенные результаты показывают, что использование эндопротеазы в сочетании с экзопептидазой в способе по настоящему изобретению позволяет повысить не только количество аминокислот, но также выход и фильтруемость. 12 Пример 2. В этой серии испытаний проводится то же сбраживание, что и в примере 1, но с использованием сочетания нейтральной протеазы из Bacillus amyloliquefaciens (1,8 кг Brewers Protease 2000 на 1 тонну зерна) с различными экзопептидазами из видов Aspergillus в соответствии со схемой исследования, показанной на таблице 4. Таблица 4 Тест Применяемые экзопептидазы Все сочетания эндопротеаза + экзопептидазы работают лучше, чем одна эндопротеаза,независимо от биологического происхождения применяемой экзопептидазы. И в этом случае,также кроме повышения содержания аминокислот, удается достичь повышения выхода и улучшения фильтруемости. Пример 3. Для того, чтобы проконтролировать применимость полученного сусла в производстве пива, сорго и кукурузные початки сбраживают по способу примера 1; одновременно проводят другое сбраживание, в котором не используют фермент и полностью заменяют сорго на солод. В таблице 6 проиллюстрирована схема проведения исследования: Таблица 6 Тест Ферменты Доза Заменил сорго 1,8 кг/т 42000Leu-AP/T 1,8 кг/т 40000 Leu-AP/T 1,8 кг/т 25000 Leu-AP/T Точный аминокислотный состав каждой бражки был определен с помощью ВЭЖХ. Аминокислоты классифицируются на группы в зависимости от скорости их ассимиляции представителями рода Saccharomyces:(Примечание: значения в мг/л не совпадают с общим количеством аминокислот, приведенным в таблице 6, в связи с тем, что приведенные в таблице 7 данные были получены с использованием глицинового стандарта, тогда как калибровка при для ВЭЖХ осуществлялось иным способом.) Таблица 8 Аминокислоты Каждое сусло кипятят в течение 45 мин; асептически к каждому суслу добавляют кипяченую дистиллированную воду до получения содержания сахара 12 Plato. В стерильные колбы вливают асептически по 350 мл каждого стандартного сусла и затем в каждую колбу инокулируют дрожжи из бражки (5 г/л). Сбраживание длится в течение 8 дней при 11 С. После 8 дней отмечается явное сбраживание, определяемое по плотности. Результаты представлены в таблице 9. Таблица 9 Тест 1 2 3 4 Сочетание эндопротеаза + экзопептидаза по настоящему изобретению, использованное в случае сорго, позволяет получать сусло с более удачными характеристиками для целей сбраживания в производстве пива, по сравнению с суслом, получаемым из солода. Было обнаружено, что сочетание эндопротеазы из Bacillus amyloliquefaciens с экзопептидазой из Aspergillus sojae позволяет достичь существенного повышения содержания аминокислот Группы А + Группа Б. 14 Пример 4. Данный пример иллюстрирует преимущество введения экзопептидаз по способу настоящего изобретения на стадии разжижения, а не на стадии осахаривания. Сбраживают по методу примера 1 сорго + кукурузные початки. Во все бражки на стадии разжижения добавляют фермент Brewers Protease 2000 (1,8 кг/т). Экзопептидазу из Aspergillus sojae (40000 Leu-AP/T) добавляют либо на стадии разжижения (тесты n 1-2), либо на стадии осахаривания (тесты n 34). Результаты представлены в таблице 10. Таблица 10 Тест Отфильтрованный Аминокислоты при Выход (%) Значения стандартного отклонения для отфильтрованного объема, выхода и содержания аминокислот определяют при повторении идентичных тестов. Они были установлены в следующем виде: 10 мл, 0,5% 0,9 мг/л, соответственно. Таким образом, приведенные выше результаты показывают, что введение экзопептидаз на стадии разжижения дает значительный положительный вклад, прежде всего, с точки зрения продуцирования аминокислот и способности к фильтрованию. Пример 5. Данный пример иллюстрирует влияние повышения доз экзопептидаз из A.oryzae на характеристики бражки. Сорго + кукурузные початки сбраживают в соответствии с методом, описанным в примере 1. На стадии разжижения добавляют Brewers Полученные результаты представлены в таблице 12. Тест Отфильтрован ный объем (мл) 1 188 2 275 3 280 4 280 5 280 6 280 7 280 Чем больше вносится экзопептидазы, тем более высокий выход и более высокие количества свободных аминокислот удается получить. Тогда как эффект фильтруемости достигает оптимального значения уже при низком уровне экзопептидазы. Пример 6. Данный пример иллюстрирует действие повышающихся доз экзопептидаз из A.niger на сбраживание. В соответствии с методикой примера 1 проводят сбраживание сорго + кукyрузные початки. Фермент Brewers Protease 2000 добавляют на стадии разжижения. Таблица 13 Тест Ферменты Полученные результаты представлены в таблице 14. Тест И здесь также, чем больше вносится экзопептидазы, тем более высокий выход и более высокие количества свободных аминокислот удается получить. Эти результаты показывают,что экзопептидаза из A.oryzae работает несколько лучше, чем экзопептидаза из A.niger. Пример 7. Ячмень (сорт PLAISANT) размельчают в тонкую муку, пригодную для поступления на фильтр-пресс в варочном цеху. Суспендируют при 50 С 57 мг муки в 30 мл воды, содержащей: 9 мг B.A.T.S. 2 мг Filtrase L3000(+) -глюканаза из Bacillus amyloliquefaciens, коммерчески доступная от Gist-Brocades); 4 мг Brewers Protease 2000; и соответствующее количество экзопептидазы из Aspergillus sojae. Затем температуру поднимают до 63 С (скорость повышения температуры 1 С/мин) и выдерживают при 63 С в течение 30 мин. После этого температуру повышают до 90 С (скорость повышения температуры 1 С/мин) и выдерживают при 90 С в течение 20 мин. Затем бродильную смесь охлаждают до 25 С и центрифугируют при 7000g в течение 15 мин. Супернатант анализируют на содержание растворимых белков и свободных аминокислот. 16 Полученные результаты представлены в таблице 15. Тест Уровень аминокислот при 12 Таблица 15 Уровень растворимых белков (% от сухого вещества 4,21 4,75 4,99 5,42 6,63 7,55 Приведенные результаты показывают, что применение экзо-пептидазы из Aspergillus sojae,в том случае, когда ее вносят на стадии разжижения, позволяет достичь такого же высокого уровня свободных кислот в ячменной бражке,как и при работе с солодовой бражкой. Пример 8. Ячмень сбраживают, как описано в примере 7, но с заменой экзопептидазы из Aspergillussojae экзопептидазой из Aspergillus niger. Полученные результаты представлены в таблице 16. Тест Уровень аминокислот при 12 Таблица 16 Уровень растворимых белков (% от сухого вещества 4,37 4,20 4,25 4,16 4,50 4,18 Даже несмотря на то, что экзопептидаза изAspergillus niger, по всей видимости, работает несколько менее эффективно, чем фермент изAspergillus oryzae, она позволяет получать в ячменном сусле до 100 мг/л аминокислот при 12Plato, что вполне достаточно для брожения. Депонирование микроорганизмов Штаммы, использованные как продуценты экзопептидаз, депонированы в Коллекции культур в Нидерландах (Centraal Bureau voor Schimmelcultures, Oosterstraat 1, Baarn, The Netherlands) под депозитными номерами CBS 115.39(A.sojae (DS 8351); дата депонирования 12 февраля 1996 г.) и CBS 210.96 (A.oryzae (DS 23617); дата депонирования 12 февраля 1996 г.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения сбраживаемого сусла,предусматривающий стадии:(а) разжижения злакового материала с помощью вещества, имеющего альфа-амилазную и/или эндопротеазную активность с получением ожиженного затора,(б) осахаривания ожиженного затора в присутствии альфа-амилазы, и отличающийся тем, что, по меньшей мере,одну из стадий (а) или (б) проводят в присутствии фермента, имеющего экзопептидазную активность. 2. Способ по п.1, отличающийся тем, что злаковый материал содержит, по меньшей мере,20% несоложенных злаков. 3. Способ по п.2, отличающийся тем, что злаковый материал содержит, по меньшей мере,20% несоложенного сорго. 4. Способ по п.3, отличающийся тем, что злаковый материал содержит, по меньшей мере,50% несоложенного сорго. 5. Способ по любому из пп.1-4, отличающийся тем, что используют эндопротеазу, полученную из Bacillus amyloliquefaciens. 6. Способ по любому из пп.1-5, отличающийся тем, что фермент, имеющий экзопептидазную активность, используют на стадии разжижения злакового материала. 7. Способ по любому из пп.1-6, отличающийся тем, что фермент, имеющий экзопептидазную активность, представляет собой экзопептидазу из грибов. 8. Способ по п.7, отличающийся тем, что грибы представляют собой грибы рода Aspergillus. 9. Способ по п.8, отличающийся тем, что грибы рода Aspergillus представляют собой Aspergillus sojae. 10. Способ по любому из пп.1-9, отличающийся тем, что экзопептидаза представляет собой аминопептидазу. 11. Способ производства алкоголя или содержащего алкоголь напитка, предусматривающий стадию сбраживания сусла в присутствии дрожжей, способных продуцировать этиловый спирт, отличающийся тем, что используют сусло, полученное способом по любому из пп.1-10. 12. Способ по п.11, отличающийся тем, что содержащим алкоголь напитком является пиво.
МПК / Метки
МПК: C12C 7/00
Метки: способ, сбраживаемого, алкоголь, содержащего, сусла, получения, производства, напитка, алкоголя
Код ссылки
<a href="https://eas.patents.su/10-1075-sposob-polucheniya-sbrazhivaemogo-susla-i-sposob-proizvodstva-alkogolya-ili-soderzhashhego-alkogol-napitka.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения сбраживаемого сусла и способ производства алкоголя или содержащего алкоголь напитка</a>
Предыдущий патент: Способ получения твердой композиции
Следующий патент: Настойка avena sativa l. молочной спелости, средства на основе avena sativa l. молочной спелости и способ их получения
Случайный патент: Шарнирный узел сопряжения деревянных элементов в ферме