Способ получения бензил-замещенных производных роданина.
Номер патента: 663
Опубликовано: 29.12.1999
Авторы: Слэттери Брайан Дж., Копп Джеймс Д., Гинах Фрэнсис О., Кжелл Дуглас П., Хансен Марвин М.
Формула / Реферат
1. Способ получения соединения формулы I
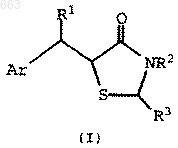
где Аr представляет собой (i) фенил, (ii) фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C8 алкила, C2-С6 алкенила, C2-C6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо является C1-С6 алкилом, или (iii) 1- или 2-нафтил;
R1 представляет собой Н, C1-C6 алкил, C1-C4 алкилфенил, фенил или фенил, имеющий от одного до двух заместителей, независимо выбранных из Cl, F, C1-C4 алкила, C1-C4 алкокси, трифторметила, -N(C1-C4 алкил)2 или C1-C4 алкилтио;
R2 представляет собой Н, C1-C6 алкил, бензил или a-метилбензил; и
R3 представляет собой (i) Н, (ii) C1-C6 алкил, (iii) фенил, (iv) фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-С8 алкила, С2-С6 алкенила, C2-C6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо является C1-C6 алкилом, или (v) 1- или 2-нафтил;
который включает взаимодействие соединения формулы III
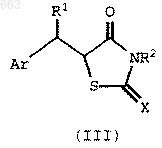
где
Ar, R1 и R2 такие, как определены выше, а Х представляет собой S, NH или О;
с альдегидом формулы
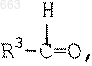
в котором R3 представляет собой (i) H, (ii) C1-С6 алкил, (iii) фенил, (iv) фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C8 алкила, С2-С6 алкенила, C2-C6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо представляет собой C1-C6 алкил, или (v) 1- или 2-нафтил;
где указанную реакцию проводят в присутствии амина формулы H2NR6, где R6 представляет H, C1-C6 алкил, бензил или a-метилбензил.
2. Способ по п.1, отличающийся тем, что в качестве амина используют аммиак и в качестве альдегида - формальдегид.
3. Способ по п.1 или 2, отличающийся тем, что способ проводят при температуре от приблизительно 60 до приблизительно 80шС в течение интервала времени от приблизительно 10 до приблизительно 20 ч, путем смешивания соединения формулы III, альдегида и амина в жидкой среде под давлением, превышающем атмосферное, используют от 10 до 14 молей аммиака и от приблизительно 0,5 до приблизительно 2,0 молей формальдегида на моль соединения формулы III.
4. Способ по пп.1, 2 или 3, отличающийся тем, что получают 5-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]метил-4-тиазолидинон.
5. Соединение формулы II
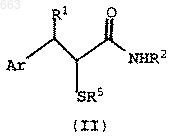
где Аr представляет собой (i) фенил, (ii) фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C8 алкила, С2-С6 алкенила, C2-C6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо является C1-C6 алкилом, или (iii) 1- или 2-нафтил;
R1 представляет собой водород, C1-C6 алкил, C1-C4 алкилфенил, фенил или фенил, имеющий от одного до двух заместителей, независимо выбранных из Cl, F, C1-C4 алкила, C1-C4 алкокси, трифторметила, -N(C1-C4 алкил)2 или C1-C4 алкилтио;
R2 представляет собой Н, C1-C6 алкил, бензил или a-метилбензил; и
R5 представляет собой Н или -CHR3OH, где R3 представляет собой (i) Н, (ii) C1-С6 алкил, (iii) фенил, (iv) фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C8 алкила, С2-С6 алкенила, С2-С6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо является C1-C6 алкилом, или (v) 1- или 2-нафтил.
6. Соединение по п.5, отличающееся тем, что Аr представляет собой фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C8 алкила, C1-C8 алкокси, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси или C1-C4 алкилтиофенила;
R2 представляет собой Н; и
R5 представляет собой Н или -СН2ОН.
7. Соединение по п.6, которое представляет собой 4-гидрокси-3,5-бис (1,1-диметилэтил)-a-[(гидроксиметил)тио]бензолэтанамид.
8. Соединение по п.6, которое представляет собой 4-гидрокси-a-меркапто-3,5-(1,1-диметилэтил)бензолэтанамид.
Текст
1 Область изобретения Это изобретение касается способа получения некоторых бензил-замещенных производных роданина, которые могут использоваться для лечения воспалений, воспалительных заболеваний кишечного тракта, аллергий, артритов,гипогликемии, мышечной дистрофии и предотвращения повреждения клеток, вызванного ишемией. Предпосылки создания изобретения Известно, что бензил-замещенные производные роданина обладают активностью при лечении воспалений, воспалительных заболеваний кишечного тракта (далее ВЗК), аллергий,артритов, гипогликемии, мышечной дистрофии и предотвращения повреждения клеток при ишемии. Например, U.S. Patent5216002 описывает применение некоторых бензилзамещенных производных роданина при лечении ВЗК; U.S. Patent5158966 описывает применение этих соединений при лечении диабетов типа I; EPO Publication391644 описывает эффективность таких соединений при лечении воспалений, мышечной дистрофии и для предотвращения повреждения клеток при ишемии;EPO Publication343643 описывает использование таких соединений в лечении аллергий и воспалений; тогда как EPO Publication587377 описывает эффективность этих соединений в лечении гипогликемии. Все вышеперечисленные патенты и публикации описывают различные способы получения бензил-замещенных производных роданина,описанных в них. Например, U.S. Patent5 158 966, включенный здесь в качестве ссылки,описывает способ получения бензилзамещенных производных роданина, включающий взаимодействие 3,5-ди-трет-бутил-4 гидроксибензальдегида с роданином в уксусной кислоте с получением 5[3,5-бис(1,1 диметилэтил)-4-гидроксифенил]метилен-2-тиоксо-4-тиазолидинона и восстановление полученного 2-тиоксо-4-тиазолидинона водородом с использованием в качестве катализатора палладия на угле. Альтернативно,алкен 2-тиоксо-4 тиазолидинона может быть восстановлен в результате кипячения с обратным холодильником с диэтил-1,4-дигидро-2,6-диметил-3,5-пиридиндикарбоксилатом, с последующим восстановлением тиоксо-группы водородом в присутствии палладия на угле. В другом способе восстановление тиоксо-группы может завершаться нагреванием метил-2-тиоксо-4-тиазолидинона в смеси с уксусной кислотой в присутствии цинка. Известные в настоящее время способы получения бензил-замещенных производных роданина, как установлено ранее, находят применение. Однако эти способы либо требуют больших количеств дорогого катализатора, либо приводят к образованию избыточного количест 000663 2 ва опасных для окружающей среды отходов цинка. Настоящее изобретение предоставляет улучшенный способ получения бензилзамещенных производных роданина. Способ настоящего изобретения может быть реализован с недорогими, легко доступными реагентами и исключает образование цинковых отходов. Другие объекты, признаки и преимущества настоящего изобретения становятся очевидными из нижеследующего описания и прилагающейся формулы изобретения. Краткое описание изобретения Настоящее изобретение касается способа получения соединений формулыAr представляет собой (i) фенил, (ii) фенил, имеющий от одного до трех заместителей,независимо выбранных из: C1-C8 алкила, С 2-С 6 алкенила, C2-С 6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила,фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо представляет собой C1-C6 алкил или (iii) 1- или 2-нафтил;R1 представляет собой Н, C1-С 6 алкил, C1C4 алкилфенил, фенил или фенил, замещенный одним или двумя заместителями, независимо выбранными из Cl, F, C1-C4 алкил, C1-C4 алкокси, трифторметила, -N(C1-C4 алкил)2 или C1-C4 алкилтио;R3 представляет собой (i) Н, (ii) C1-С 6 алкил, (iii) фенил, (iv) фенил, имеющий от одного до трех заместителей, независимо выбранных изC1-C8 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила,C1-C8 алкокси, C1-C8 алкилтио, трифторметила,C1-C4 алкилфенила, фенила, F, Cl, гидрокси,фенокси, C1-C4 алкилоксифенила, тиофенила,C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо представляет собой C1-С 6 алкил или(v) 1- или 2-нафтил; который включает взаимодействие соединения формулы III где R3 такой, как определено выше,причем указанная реакция проводится в присутствии амина формулы H2NR6, где R6 представляет собой H, C1-C6 алкил, бензил или-метилбензил. Далее настоящее изобретение предлагает новые промежуточные соединения формулы II где Аr представляет собой (i) фенил, (ii) фенил, имеющий от одного до трех заместителей,независимо выбранных из: C1-C8 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила,фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо представляет собой C1-C6 алкил или (iii) 1- или 2-нафтил;R1 представляет собой Н, C1-C6 алкил, C1C4 алкилфенил, фенил или фенил, имеющий от одного до двух заместителей, независимо выбранных из Cl, F, C1-C4 алкила, C1-C4 алкокси,трифторметила, -N(C1-C4 алкил)2 или C1-C4 алкилтио;R5 представляет собой Н, -CHR3OH, где R3 представляет собой (i) Н, (ii) C1-C6 алкил, (iii) фенил, (iv) фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C8 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси,C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо представляет собой C1-C6 алкил или (v) 1 или 2-нафтил. Соединения формулы II применяются в качестве промежуточных соединений формулыI. Подробное описание изобретения Использующийся здесь термин "C1-C8 алкил" относится к алифатическим радикалам с прямой и разветвленной цепью, состоящей из 18 углеродных атомов. Типичные C1-C8 алкильные группы включают метил, этил, пропил,изопропил, бутил, изобутил, втор-бутил, третбутил, н-пентан, изо-пентан, н-гексан, изогексан и тому подобные. Термин "C1-C8 алкил" включает в рамках своего определения термины 4 Термин "C1-C8 алкокси" представляет прямую или разветвленную алкильную цепь,имеющую от 1 до 8 атомов углерода, к концу которой присоединен атом кислорода. Типичные C1-C8 алкокси группы включают метокси,этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентокси,гексокси и подобные им. Термин "C1-C8 алкокси" включает в рамках своего определения "C1C4 алкокси". Термин "С 2-С 6 алкенил" относится к прямым и разветвленным цепям, имеющим от 2 до 6 углеродных атомов включительно и содержащим двойную связь. Как таковой, этот термин включает этилен, пропилен, изопропилен, 1 бутен, 2-бутен, 2-метил-1-пропен, 1-пентен, 2 пентен, 2-метил-2-бутен и им подобные. Термин "С 2-С 6 алкинил" относится к прямым и разветвленным цепям, имеющим от 2 до 6 углеродных атомов включительно и содержащим тройную связь. Как таковой, этот термин включает ацетилен, пропин, 1-бутин, 2-бутин, 1 пентин, 2-пентин, З-метил-1-бутин, 1-гексин, 2 гексин, 3-гексин и им подобные. Термин "C1-С 8 алкилтио" представляет прямую или разветвленную алкильную цепь,имеющую от 1 до 8 атомов углерода, к концу которой присоединен атом серы. Типичные C1C8 алкилтио группы включают метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио,трет-бутилтио и им подобные. Термин "C1-C8 алкилтио" включает в пределах своего определения "C1-C4 алкилтио"."C1-C4 алкилфенил" представляет прямую или разветвленную алкильную цепь, имеющую от одного до четырех атомов углерода, присоединенную к фенильному кольцу. Типичные C1C4 алкилфенильные группы включают метилфенил, этилфенил, н-пропилфенил, изопропилфенил, н-бутилфенил, изобутилфенил и третбутилфенил. Термин "C1-C4 алкилтиофенил" представляет алкильную группу с прямой или разветвленной цепью, имеющей от одного до четырех атомов углерода, присоединенную к тиофенильному остатку. Типичные C1-C4 алкилтиофенильные группы включают метилтиофенил,этилтиофенил, изобутилтиофенил и им подобные. Подобным образом, термин "C1-C4 алкилоксифенил" представляет алкильную группу с прямой или разветвленной цепью, имеющую от одного до четырех атомов углерода, присоединенную к фенокси-группе. Типичные C1-C4 алкилоксифенильные группы включают метилоксифенил, этилоксифенил, пропилоксифенил и подобные им. Предпочтительные соединения, полученные по способу данного изобретения Предпочтительные группы соединений формулы I, которые могут быть получены по способу настоящего изобретения, имеют заме 5 щающие группы, независимо выбранные из следующих: Ar - представляет собой фенил,имеющий от одного до трех заместителей, независимо выбранных из: C1-C8 алкила, C1-C8 алкокси, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилтиофенила; и R1, R2 иR3, каждый из которых независимо представляет собой водород. Из этой группы предпочтительных соединений до некоторой степени более предпочтительные соединения формулы (I), которые могут быть получены по способу настоящего изобретения, представляют собой такие соединения, в которых Аr является замещенным фенилом,имеющим от одного до трех заместителей, независимо выбранных из C1-C4 алкила, C1-C6 алкокси- или гидрокси-группы. Еще более предпочтительными соединениями формулы I, которые могут быть получены по заявляемому способу, являются такие соединения, в которых Аr представляет собой фенил, имеющий в качестве заместителей гидрокси-группу в 4 положении и C1-C4 алкильную группу в 3 и 5 положениях. Наиболее предпочтительным соединением,которое может быть получено по данному способу, является 5-[3,5-бис(1,1-диметилэтил)-4 гидроксифенил]метил-4-тиазолидинон. Способ изобретения Способ настоящего изобретения предлагает улучшенный способ синтеза соединений формулы I с использованием недорогих, легко доступных реагентов, исключающий образование избыточных цинковых отходов и включающий реакцию 2-тиоксо-4-тиазолидинона, 2,4 тиазолидиндиона или 2-имино-4-тиазолидинона формулы III с альдегидом формулы где R3 такой, как определен выше, в присутствии амина формулы H2NR6, где R6 такой, как определен прежде. Способ изобретения иллюстрируется следующей схемой I: Схема I По одному пути схемы I, показанной выше, соединение формулы III растворяют в жидкой среде, затем смешивают с альдегидом в присутствии амина с образованием соединения формулы IIа. IIа далее реагирует с альдегидом с образованием соединения формулы IIb, которое 6 затем циклизуется с образованием целевого соединения формулы I. По альтернативному пути соединение формулы IIа может непосредственно реагировать с альдегидом и амином непосредственно с образованием соединений формулы I, без получения промежуточного соединения IIb. В соответствии со способом настоящего изобретения 2-тиоксо-4-тиазолидинон, 2,4 тиазолидиндион или 2-имино-4-тиазолидиноновое соединение формулы III (исходное вещество) растворяют в протонном растворителе,предпочтительно спирте с низким молекулярным весом, например спирте формулы HO(C1-C6 алкил). В данном способе метанол является предпочтительным. Количество используемого растворителя должно быть достаточным для обеспечения растворенного состояния всех соединений до полного завершения целевой реакции. После растворения исходного вещества к реакционной смеси добавляют амин с низким молекулярным весом (например, амин формулыH2NR6, где R6 представляет собой водород, C1 С 6 алкил, бензил или -метилбензил) с образованием тиоламидного соединения IIа. По данному способу аммиак является предпочтительным амином и может быть добавлен к реакционной смеси в газообразном состоянии. Количество амина не является критическим, однако,для лучшего завершения реакцию с 2-тиоксо-4 тиазолидиноном, 2,4-тиазолидиндионом или 2 имино-4-тиазолидиноном проводят в присутствии молярного избытка амина по отношению к исходному веществу. Предпочтительным является использование 10-14 молей амина на моль исходного вещества формулы III. По завершении реакции с соответствующим образом замещенным альдегидом промежуточный тиоламид IIа может быть сначала превращен в IIb, который циклизуется с образованием целевого соединения формулы I. По альтернативному пути соединение формулы IIа может непосредственно реагировать с альдегидом и амином с образованием соединений формулы I без получения промежуточного соединения IIb. Предпочтительным является использование формальдегида в количестве от примерно 0,5 до примерно 2,0 молей на моль исходного вещества формулы III, предпочтительно, примерно 1,1 моля. Пригодные для реакции вещества включают соединения, которые в условиях реакции образуют исходные альдегид и амин, например,параформальдегид, NH4OH и т.п. По способу настоящего изобретения реакцию затем проводят до тех пор, пока практически все количества исходных веществ 2-тиоксо 4-тиазолидинона, 2,4-тиазолидиндиона или 2 имино-4-тиазолидинона не прореагируют, и соединения формулы II (а именно, IIа и IIb) превратятся в соединение I через приблизительно 7 10-20 ч. Стандартные аналитические методики,такие как ВЭЖХ, могут применяться для контроля за ходом реакции, чтобы определить, когда исходное вещество и промежуточные соединения IIа и IIb превратятся в продукт I. Целевое соединение формулы I может быть очищено с использованием стандартных методик кристаллизации. Для проведения кристаллизации целевого продукта и увеличения растворимости в метаноле нежелательных побочных продуктов к реакционной смеси предпочтительно добавляют уксусную кислоту, а затем воду в качестве антирастворителя. Твердое вещество затем фильтруют и промывают предпочтительно водой. Полученный продукт может быть ресуспендирован с помощью обычных средств. Предпочтительно продукт ресуспендируют в толуоле, этилацетате или этилацетат/гептане и промывают этилацетат/гептаном для повышения чистоты. Альтернативно гептан может быть заменен гексаном или подобным алкановым растворителем. Альтернативно полученный продукт может быть растворен в одном из вышеперечисленных растворителей или в смеси растворителей и перекристаллизован. Кристаллизация может быть облегчена внесением в раствор небольшого количества целевого продукта. Способ настоящего изобретения можно проводить при любой температуре от примерно 60 до примерно 80 С. В случае применения реактора, работающего под давлением, можно использовать давление выше атмосферного и температуру выше точки кипения растворителя,в среде которого проводят реакцию. Реакцию предпочтительно проводят в реакторе, работающем под давлением, при температуре приблизительно 80 С в течение примерно 17 ч. В случае особенно предпочтительного способа в "одном сосуде" альдегидный и аминный реагенты добавляют в любом порядке или одновременно с реагентом формулы III в зону реакции, такую как нагреваемый реакционный сосуд, имеющий средства ввода и вывода, причем реакцию проводят без выделения соединений формулы IIа или IIb. Реакция достигается объединением (например, смешиванием) реагентов способа с использованием общепринятых средств перемешивания. Способ может проводиться как периодический или непрерывный процесс. Реакция с тиазолидиноном как исходным веществом по способу настоящего изобретения приводит к образованию тиомочевины как побочного продукта, который удаляют во время перекристаллизации. Способ настоящего изобретения может также быть осуществлен на практике с использованием как 2,4 тиазолидиндиона, так и 2-имино-4-тиазолидинона в качестве исходных веществ, что исключает образование тиомочевины как побочного продукта. 8 Специалисту в этой области должно быть ясно, что могут присутствовать другие таутомеры соединений формулы III, в частности, когда заместитель R2 в соединениях формулы III представляет собой водород. Поэтому использование этих таутомеров в качестве исходных веществ рассматривается как часть этого изобретения. Исходные вещества формулы III - 2-тиоксо-4-тиазолидинон, 2,4-тиазолидиндион и 2 имино-4-тиазолидинон являются либо известными для специалистов, или могут быть легко приготовлены из коммерчески доступных альдегидов и роданина или тиазолидиндионов. Например, Panetta et al., J. Org. Chem. (1992), 57,4047 получили 2-тиоксо-4-тиазолидиноновые соединения роданина или соответственно замещенного производного роданина с соответственно замещенным ароматическим альдегидом или альдегидным производным в ледяной уксусной кислоте с использованием плавленого ацетата натрия в качестве катализатора с последующей реакцией полученного соединения с диэтил-1,4-дигидро-2,6-диметил-3,5-пиридиндикарбоксилатом с получением тиазолидинона. Исходное вещество 2,4-тиазолидиндион может быть приготовлено подобным образом конденсацией соответственно замещенного производного диона с соответственно замещенным ароматическим альдегидом или альдегидным производным в ледяной уксусной кислоте с использованием плавленого ацетата натрия в качестве катализатора с последующим восстановлением бензильной двойной связи соответствующим восстановителем, таким как водород или палладий на угле. Исходное вещество 2-имино-4-тиазолидинон может быть приготовлено обработкой 2-тиоксо-4-тиазолидинонового соединения формулы III избытком амина, такого как аммиак, с последующим выделением имина из реакционной смеси методом препаративной ВЭЖХ с использованием силикагеля в качестве неподвижной фазы и этилацетат/гексана в качестве подвижной фазы. Все другие реагенты, используемые для получения соединений формул II и III, являются коммерчески доступными, также как все реагенты, применяемые в способе настоящего изобретения. Предпочтительные промежуточные соединения Соединения формулы II (IIа и IIb), где Аr представляет собой фенил, имеющий от одного до трех заместителей, независимо выбранных изC1-C8 алкила, C1-C8 алкокси, C1-C4 алкилфенила,фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилтиофенила, R1 и R2 являются водородом, а R5 представляет собой Н или -СНR3OH, где R3 является Н, представляют собой предпочтительные промежуточные соединения в способе получения соединений формулы I. 9 Из этой предпочтительной группы соединений формулы II до некоторой степени более предпочтительными являются соединения, в которых Аr представляет собой фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C4 алкил, C1-C6 алкокси или гидрокси, а R5 представляет собой Н или-CHR3OH. Еще более предпочтительными являются такие соединения формулы II, в которых Аr представляет собой фенил, замещенный в 4 положении гидрокси-группой, а в 3 и 5 положениях - C1-C4 алкильной группой, а R5 представляет собой Н или -CHR3OH, где R3 является таким,как определено ранее. Самыми предпочтительными соединениями формулы II, которые могут быть получены по данному способу, являются 4-гидрокси-3,5 бис(1,1-диметилэтил)[(гидроксиметил)тио]бензолэтанамид и 4-гидроксимеркапто-3,5(1,1-диметилэтил)бензолэтанамид. Способ получения промежуточных соединений Соединения формулы II получают по следующему общему способу: Схема II По приведенной выше схеме II тиокарбонильное, дионовое или иминное производное формулы III обрабатывают амином формулыIIа. В данном способе вода является предпочтительной средой для реакции. Реакцию проводят при любой температуре от приблизительно 60 до 100 С в течение периода от примерно 12 до 36 ч, предпочтительно при 90 С в течение 12 ч. В настоящем способе предпочтительным амином является аммиак. Количество амина не имеет критического значения, однако, реакция протекает наилучшим образом, если 2-тиоксо-4 тиазолидинон, 2,4-тиазилидиндион или 2 иминотиазолидинон реагируют в присутствии молярного избытка амина относительно исходного вещества. Предпочтительно используют от 10 до 14 молей амина на моль исходного вещества формулы III. Целевое тиоламидное соединение формулы IIа может быть очищено по стандартной методике перекристаллизации в подходящем органическом растворителе, предпочтительно в толуоле или в этилацетат/гептановых смесях. Тиоламид IIa может быть легко превращен в гемитиоацеталь IIb путем смешивания с подходящим количеством полярного растворителя,такого как вода, ацетон или диоксан, для обра 000663 где R3 такой, как определен ранее. В качестве альдегида предпочтительно используют формальдегид в количестве от примерно 0,9 до примерно 1,2 молей относительно исходного вещества, предпочтительно примерно 1,1 моля. В качестве катализатора добавляют от 1 до 3 молей (по отношению к тиоламиду) подходящей неорганической кислоты, такой как хлористоводородная кислота, или органической кислоты,такой как паратолуолсульфоновая кислота. Реакцию предпочтительно проводят при температурах от примерно 20 до примерно 30 С в течение от примерно 15 мин до 12 ч, предпочтительно при 25 С в течение 1 ч. Продукт реакции может быть затем отфильтрован и промыт водой. Соединения формулы II могут использоваться как промежуточные соединения для получения соединений формулы I. Следующие примеры далее иллюстрируют способ настоящего изобретения. Примеры также иллюстрируют получение соединений этого изобретения так же, как и соединений, используемых в способе изобретения. Примеры являются только иллюстративными и в любом случае не подразумевают ограничение объема изобретения. Пример 1. Этот пример иллюстрирует способ изобретения. Получение 5-[3,5-(бис(1,1-диметилэтил)-4 гидроксифенил)]метил-4-тиазолидинона. К 3,22 г (9,2 ммоля) 5-[3,5-бис(1,1 диметилэтил)-4-гидроксифенил]метил-2-тиоксо-4-тиазолидинона в работающем под давлением автоклаве объемом 25 мл, снабженным магнитной мешалкой, добавляют 13 мл метанола. Полученную реакционную смесь охлаждают до 0 С и медленно добавляют газообразный аммиак (1,6 г, 91 ммоль). Затем добавляют формалин (0,76 мл, 0,8 г, 10 ммолей). Автоклав,работающий под давлением, герметично закрывают и нагревают при перемешивании до 80 С в течение примерно 17 ч. Реакцию считают завершенной, когда количество тиоламида становится менее 4%, что определяют методом ВЭЖХ. Затем по каплям добавляют деионизированную воду (12 мл) с последующим добавлением уксусной кислоты (6 мл). Через 30 мин реакционную смесь охлаждают до 0 С в течение 1 ч. Реакционную смесь фильтруют и полученный кристаллический продукт растворяют в этилацетате (5 объемах). Растворение облегчают нагреванием до 66 С. Полученный раствор фильтруют и вносят в него небольшое количество 5-[3,5-бис(1,1-диметилэтил)-4-гидрокси 11 фенил]метил-4-тиазолидинона по мере того, как раствор медленно охлаждается до температуры окружающей среды. Происходит кристаллизация и получившуюся взвесь перемешивают в течение приблизительно 4 ч. Взвесь концентрируют при пониженном давлении (1 объем этилацетата) и перемешивают дополнительно в течение 16 ч. Взвесь фильтруют и влажный осадок промывают водой (210 мл) и 1/4 этилацетат/гексаном (210 мл). Продукт высушивают в сушильном шкафу при 50 С и получают 2,07 г(выход 70%) соединения, указанного в заголовке. Пример 2. Этот пример описывает способ изобретения и получение соединений формулы III. Получение 5-[3,5-(бис(1,1-диметилэтил)-4 гидроксифенил)]метил-4-тиазолидинона. А. 5-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]метилен-2,4-тиазолидиндион. В колбу, содержащую 41,7 г (0,18 молей) 3,5-ди-трет-бутил-4-гидроксибензальдегида, добавляют 25 г (0,21 молей) 2,4-тиазолидиндиона и 29,5 г (0,36 молей) безводного ацетата натрия. К этим твердым веществам добавляют 175 мл ледяной уксусной кислоты, смесь перемешивают и кипятят с обратным холодильником в течение 18 ч. Смеси дают остыть до комнатной температуры и выпавшее в осадок твердое вещество собирают путем фильтрации. Осадок промывают смесью 1:1 вода/этанол и высушивают. Сухой осадок суспендируют в 300 мл метилен хлорида в течение 5 ч, затем собирают и высушивают, получая 38,7 г промежуточного соединения, указанного в подзаголовке. Б. 5-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]метил-2,4-тиазолидиндион. К 15,0 г (0,045 молей) 5-[3,5-бис(1,1 диметилэтил)-4-гидроксифенил]метилен-2,4 тиазолидиндиона в 375 мл этилацетата добавляют 3,0 г 10% палладия на угле. Смесь нагревают до 80 С в присутствии водорода под давлением 50 фунт/кв. дюйм (psi) (345 КРа) в течение 4,5 ч. Добавляют еще 3,0 г 10% палладия на угле и смесь снова нагревают до 80 С в присутствии водорода под давлением 50 фунт/кв. дюйм (psi) (345 КРа) в течение 2 ч. Катализатор удаляют путем фильтрации и фильтрат упаривают досуха. Твердый осадок перекристаллизовывают из толуола и высушивают при 60 С,получая 8,93 г (выход 59%) соединения, указанного в подзаголовке. В. 5-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]метил-4-тиазолидинон. К 2,78 г (9,2 ммоля) 5-[3,5-бис(1,1 диметилэтил)-4-гидроксифенил]метил-2,4 тиазолидиндиона в автоклаве, работающем под давлением, добавляют 13 мл метанола. Смесь охлаждают до 0-5 С и добавляют 2,2 г (130 ммолей) аммиака и 0,76 мл (10 ммолей) формалина (водный раствор формальдегида). Авто 000663 12 клав герметично закрывают и нагревают до 80 С при перемешивании в течение 20 ч. Смесь охлаждают до температуры окружающей среды,затем подвергают колоночной флэшхроматографии, используя смесь 1:1 этилацетат:гептан. Анализы методами 1H-ЯMP и ВЭЖХ показали, что 60% образца представляет собой соединение, указанное в заголовке. Пример 3. Этот пример описывает способ изобретения и получение соединений формулы III. Получение 5-[3,5-бис(1,1-диметилэтил)-4 гидроксифенил]метил-4-тиазолидинона. А. 5[4-гидрокси-3,5-бис(1,1-диметилэтил)фенил]метил 2-имино-4-тиазолидинон. Смесь 50 г 5-[3,5-бис(1,1-диметилэтил)-4 гидроксифенил]-метил-2-тиоксо-4-тиазолидинона и 258 мл концентрированного гидроксида аммония медленно нагревают до температуры кипения раствора с обратным холодильником в колбе, оборудованной системой холодильник/ловушка с сухим льдом. После двух часов нагревания сухой лед оставляют плавиться и температуру повышают до 97 С. Эту температуру поддерживают в течение 15 ч. Реакционную смесь охлаждают до 10 С и полученные белые кристаллы собирают путем фильтрации. Осадок на фильтре промывают деионизированной водой и сушат под вакуумом при 60 С. Соединение, указанное в подзаголовке выделяют из белых кристаллов методом препаративной ВЭЖХ, используя силикагель в качестве неподвижной фазы и этилацетат/гексан в качестве подвижной фазы. Масс-спектр, М+ = 334; Элементный анализ: Вычислено: С 64,64, Н 7,84, N 8,38; Найдено: С 65,67, Н 7,76, N 8,64. Б. 5-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]метил-4-тиазолидинон. К 0,265 г 5[4-гидрокси-3,5-бис(1,1-диметилэтил)фенил]-метил 2-имино-4-тиазолидинона в 1,3 мл метанола добавляют 1,0 мл метанола, насыщенного газообразным аммиаком, и 0,08 мл водного формальдегида (формалина). Смесь герметично закрывают и нагревают при 80 С в течение ночи. Образование 5-[3,5 бис(1,1-диметилэтил)-4-гидроксифенил]метил 4-тиазолидинона подтверждают сравнением времени удерживания при ВЭЖХ со временем удерживания стандарта при их совместном введении. Количественная обработка данных ВЭЖХ при сравнении со стандартным образцом показала, что выход равен примерно 39%. Пример 4. Этот пример описывает получение 4 гидроксимеркапто-3,5-(1,1-диметилэтил)бензолэтанамида (тиоламид IIа). Смесь 50 г 5-[3,5-бис(1,1-диметилэтил)-4 гидроксифенил]-метил-2-тиоксо-4-тиазолидинона и 285 мл концентрированного гидроксида аммония медленно нагревают до температуры 13 кипения раствора с обратным холодильником в колбе, оборудованной системой холодильник/ловушка с сухим льдом. После двух часов нагревания сухой лед оставляют плавиться и температуру повышают до 97 С. Эту температуру поддерживают в течение 15 ч. Реакционную смесь охлаждают до 10 С и полученные белые кристаллы собирают путем фильтрации. Осадок на фильтре промывают деионизированной водой и сушат под вакуумом при 60 С, получая 40,3 г продукта, указанного в заголовке(выход 91,5%). Масс-спектр, М+ = 309; Элементный анализ: Вычислено: С 65,98, Н 8,79, N 4,53; Найдено: С 65,50, Н 8,83, N 4,65. Пример 5. Этот пример описывает получение 5-[3,5 бис(1,1-диметилэтил)-4-гидроксифенил]метил 4-тиозолидинона из тиоламида IIа. В автоклав, работающий под давлением,объемом 25 мл, оборудованный магнитной мешалкой, вносят 2,85 г (9,2 ммоля) 4-гидрокси-меркапто-3,5-(1,1-диметилэтил)бензолэтанамид и 13 мл метанола. Полученную реакционную смесь охлаждают до 0 С и медленно добавляют аммиак (1,6 г, 91 ммоль). Затем добавляют формалин (0,76 мл, 0,8 г, 10 ммолей), и автоклав,работающий под давлением, герметично закрывают и нагревают до 80 С в течение приблизительно 8 ч. После чего добавляют по каплям деионизированную воду (12 мл) и затем уксусную кислоту (6 мл). Через 30 мин реакционную смесь охлаждают до 0 С в течение 1 ч. Полученную кристаллическую взвесь фильтруют,промывают водой (10 мл) и высушивают при 40 С, получая 1,69 г продукта, указанного в заголовке, с выходом 57%. Пример 6. Этот пример описывает получение 4 гидрокси-3,5-бис(1,1-диметилэтил)[(гидроксиметил)тио]бензолэтанамида (полутиоацеталь,IIb). К взвеси 4-гидроксимеркапто-3,5-(1,1 диметилэтил)-бензолэтанамида (1,12 г, 3,62 ммоля) в 5 мл деионизированной воды и 0,54 мл(7,24 ммоля, 2,0 экв) формалина добавляют соляную кислоту (конц.) (0,6 мл, 7,24 ммоля, 2,0 экв). Взвесь разжижается и затем опять становится густой. После перемешивания в течение ночи при комнатной температуре полученную взвесь фильтруют и осадок на фильтре промывают деионизированной водой, получая 1,2 г продукта, указанного в заголовке (выход 97%),в виде белых кристаллов. Масс-спектр, М+ = 339; Элементный анализ: Вычислено: С 63,68, Н 8,61, N 4,13, S 9,44; Найдено: С 63,98, Н 8,52, N 4,26, S 9,54. 14 Пример 7. Этот пример описывает получение 5-[3,5 бис(1,1-диметилэтил)-4-гидроксифенил]метил 4-тиазолидинона из полутиоацеталя IIb. 4-гидрокси-3,5-бис(1,1-диметилэтил)-[(гидроксиметил)-тио]бензолэтанамид (3,0 г) в 10 мл метанола охлаждают до 0 С и полученный раствор насыщают безводным газообразным аммиаком. Затем реакционную смесь помещают в герметично закрытый автоклав и нагревают на масляной бане до 60 С. После перемешивания в герметично закрытом автоклаве в течение ночи при 60 С, реакционную смесь охлаждают до комнатной температуры и получившуюся взвесь фильтруют и промывают метанолом. Полученный осадок на фильтре высушивают под вакуумом и получают 2,5 г соединения, указанного в заголовке (выход 88%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы где Аr представляет собой (i) фенил, (ii) фенил, имеющий от одного до трех заместителей,независимо выбранных из: C1-C8 алкила, C2-С 6 алкенила, C2-C6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила,фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо являетсяR1 представляет собой Н, C1-C6 алкил, C1C4 алкилфенил, фенил или фенил, имеющий от одного до двух заместителей, независимо выбранных из Cl, F, C1-C4 алкила, C1-C4 алкокси,трифторметила, -N(C1-C4 алкил)2 или C1-C4 алкилтио;R3 представляет собой (i) Н, (ii) C1-C6 алкил, (iii) фенил, (iv) фенил, имеющий от одного до трех заместителей, независимо выбранных изC1-С 8 алкила, С 2-С 6 алкенила, C2-C6 алкинила,C1-C8 алкокси, C1-C8 алкилтио, трифторметила,C1-C4 алкилфенила, фенила, F, Cl, гидрокси,фенокси, C1-C4 алкилоксифенила, тиофенила,C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо является C1-C6 алкилом, или (v) 1 или 2-нафтил; который включает взаимодействие соединения формулы III в котором R3 представляет собой (i) H, (ii) C1-С 6 алкил, (iii) фенил, (iv) фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C8 алкила, С 2-С 6 алкенила, C2-C6 алкинила,C1-C8 алкокси, C1-C8 алкилтио, трифторметила,C1-C4 алкилфенила, фенила, F, Cl, гидрокси,фенокси, C1-C4 алкилоксифенила, тиофенила,C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо представляет собой C1-C6 алкил, или(v) 1- или 2-нафтил; где указанную реакцию проводят в присутствии амина формулы H2NR6, где R6 представляет H,C1-C6 алкил, бензил или -метилбензил. 2. Способ по п.1, отличающийся тем, что в качестве амина используют аммиак и в качестве альдегида - формальдегид. 3. Способ по п.1 или 2, отличающийся тем,что способ проводят при температуре от приблизительно 60 до приблизительно 80 С в течение интервала времени от приблизительно 10 до приблизительно 20 ч, путем смешивания соединения формулы III, альдегида и амина в жидкой среде под давлением, превышающем атмосферное, используют от 10 до 14 молей аммиака и от приблизительно 0,5 до приблизительно 2,0 молей формальдегида на моль соединения формулы III. 4. Способ по пп.1, 2 или 3, отличающийся тем, что получают 5-[3,5-бис(1,1-диметилэтил)4-гидроксифенил]метил-4-тиазолидинон. 5. Соединение формулы II Аr представляет собой (i) фенил, (ii) фенил, имеющий от одного до трех заместителей,независимо выбранных из C1-C8 алкила, С 2-С 6 алкенила, C2-C6 алкинила, C1-C8 алкокси, C1-C8 алкилтио, трифторметила, C1-C4 алкилфенила,фенила, F, Cl, гидрокси, фенокси, C1-C4 алкилоксифенила, тиофенила, C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо являетсяR1 представляет собой водород, C1-C6 алкил, C1-C4 алкилфенил, фенил или фенил,имеющий от одного до двух заместителей, независимо выбранных из Cl, F, C1-C4 алкила, C1-C4 алкокси, трифторметила, -N(C1-C4 алкил)2 илиR5 представляет собой Н или -CHR3OH,где R3 представляет собой (i) Н, (ii) C1-С 6 алкил,(iii) фенил, (iv) фенил, имеющий от одного до трех заместителей, независимо выбранных изC1-C8 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила,C1-C8 алкокси, C1-C8 алкилтио, трифторметила,C1-C4 алкилфенила, фенила, F, Cl, гидрокси,фенокси, C1-C4 алкилоксифенила, тиофенила,C1-C4 алкилтиофенила, N(R4)2, где каждый R4 независимо является C1-C6 алкилом, или (v) 1 или 2-нафтил. 6. Соединение по п.5, отличающееся тем,что Аr представляет собой фенил, имеющий от одного до трех заместителей, независимо выбранных из C1-C8 алкила, C1-C8 алкокси, C1-C4 алкилфенила, фенила, F, Cl, гидрокси, фенокси или C1-C4 алкилтиофенила;R5 представляет собой Н или -СН 2 ОН. 7. Соединение по п.6, которое представляет собой 4-гидрокси-3,5-бис (1,1-диметилэтил)-[(гидроксиметил)тио]бензолэтанамид. 8. Соединение по п.6, которое представляет собой 4-гидроксимеркапто-3,5-(1,1 диметилэтил)бензолэтанамид.
МПК / Метки
МПК: C07D 277/14, C07C 323/41
Метки: роданина, получения, бензил-замещенных, производных, способ
Код ссылки
<a href="https://eas.patents.su/9-663-sposob-polucheniya-benzil-zameshhennyh-proizvodnyh-rodanina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения бензил-замещенных производных роданина.</a>
Предыдущий патент: Способы формирования заготовки из сложного полиэфира и устройство инжекционного формования.
Следующий патент: Устройство с циркуляционным кипящим слоем для химических и физических процессов
Случайный патент: Способ блокировки развития, или снижения тяжести, или проявлений заболевания, "трасплантат против хозяина"













