Калийная соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона и ее применение в качестве противодиабетического лекарственного средства
Формула / Реферат
1. Калийная соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемый сольват, отличающаяся тем, что характеризуется одним или более из
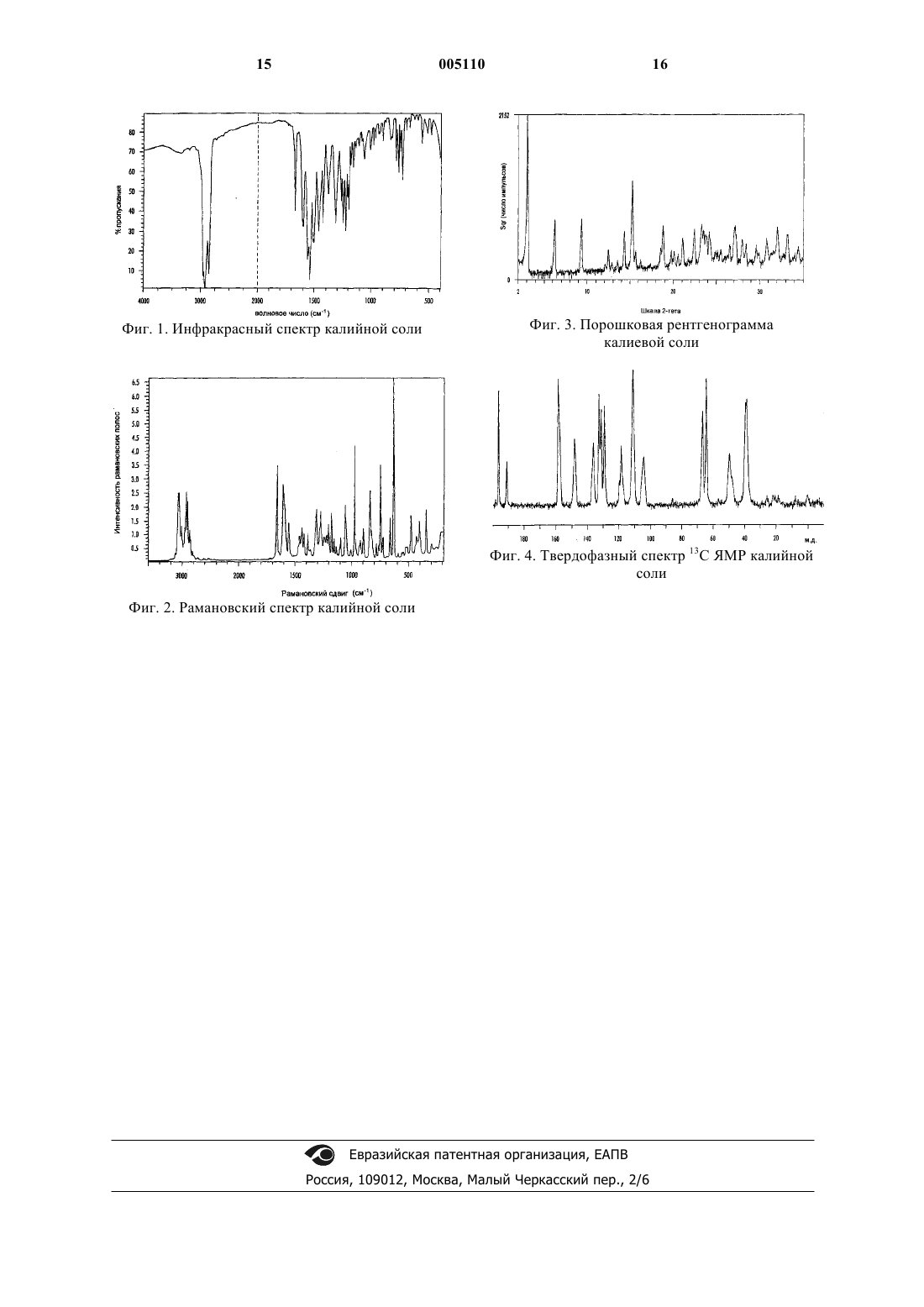
(i) инфракрасным спектром практически в соответствии с фиг.1;
(ii) рамановским спектром практически в соответствии с фиг. 2;
(iii) порошковой рентгенограммой (XRPD) практически в соответствии с таблицей и фиг. 3;
(iv) спектром твердофазного 13C ЯМР практически в соответствии с фиг.4 и
(v) температурой плавления в интервале 194-201шC.
2. Соединение по п.1, отличающееся тем, что характеризуется двумя или более из
(i) инфракрасным спектром практически в соответствии с фиг.1;
(ii) рамановским спектром практически в соответствии с фиг. 2;
(iii) порошковой рентгенограммой (XRPD) практически в соответствии с таблицей и фиг. 3 и
(iv) спектром твердофазного 13C ЯМР практически в соответствии с фиг.4.
3. Соединение по п.1 в твердой дозированной форме.
4. Соединение по п.1 или 2 в объемной измельченной форме.
5. Фармацевтическая композиция, включающая калийную соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (калийную соль) или ее фармацевтически приемлемый сольват по п.1 в количестве, обеспечивающем 1, 2, 3, 4, 4-8 или 8-12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона и его фармацевтически приемлемый носитель.
6. Фармацевтическая композиция по п.5, включающая калийную соль или ее фармацевтически приемлемый сольват в количестве, обеспечивающем 1, 2, 3 или 4 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
7. Фармацевтическая композиция по п.5, включающая калийную соль или ее фармацевтически приемлемый сольват в количестве, обеспечивающем 2 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
8. Фармацевтическая композиция по п.5, включающая калийную соль или ее фармацевтически приемлемый сольват в количестве, обеспечивающем 4 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
9. Фармацевтическая композиция по п.5, в количестве, обеспечивающем 8 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
10. Фармацевтическая композиция, включающая калийную соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемый сольват по п.1 в комбинации с одним или более из других противодиабетических агентов и необязательно фармацевтически приемлемым носителем.
11. Способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений у людей или других млекопитающих, включающий введение калийной соли 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемого сольвата по п.1 нуждающемуся в этом человеку или другому млекопитающему в количестве, обеспечивающем 1, 2, 3, 4, 4-8 или 8-12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
12. Способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений, у людей или других млекопитающих, который включает введение эффективного нетоксичного количества калийной соли 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемого сольвата по п.1 в комбинации с одним или более из других противодиабетических агентов.
13. Калийная соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемый сольват по п.1 для использования в качестве активного терапевтического вещества.
14. Применение калийной соли 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее сольвата по п.1 в количестве, обеспечивающем 1, 2, 3, 4, 4-8 или 8-12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона для приготовления лекарства для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений.
Текст
1 Настоящее изобретение относится к новому фармацевтическому препарату, к способу получения фармацевтического препарата и к использованию фармацевтического препарата в медицине. Европейская патентная заявка, опубликованная под номером 0306228, относится к некоторым производным тиазолидиндиона, которые раскрыты как соединения, обладающие гипогликемической и гиполипидемической активностями. Соединение примера 30 ЕР 0306228 является 5-[4-[2-(N-метил-N-(2-пиридил)амино) этокси]бензил]тиазолидин-2,4-дионом (здесь и далее именуемым как "соединение (I)"). В международной патентной заявке, номер публикации WO 94/05659, раскрыты некоторые соли соединений ЕР 0306228. Предпочтительной солью WO 94/05659 является соль малеиновой кислоты. В настоящее время было обнаружено, что соединение (I) образует новую калийную соль(здесь и далее именуемую как "калийная соль"),которая отличается особенной стабильностью и,следовательно, пригодна для массового получения и удобна в обращении. Эта калийная соль отличается также высокой температурой плавления и демонстрирует чрезвычайно высокую растворимость в воде. Поэтому эта калийная соль неожиданно легко поддается крупномасштабной фармацевтической обработке и особенно измельчению в больших количествах. Новую соль можно получить эффективным,экономичным и воспроизводимым способом,особенно подходящим для крупномасштабного производства. Новая калийная соль также обладает полезными фармацевтическими характеристиками, и, в частности, существуют показания к ее применению для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений. Соответственно, в настоящем изобретении предложены 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, его калийная соль или ее сольват. В одном из предпочтительных аспектов инфракрасный спектр калийной соли практически соответствует спектру, представленному на фиг. 1. В одном из предпочтительных аспектов рамановский спектр рассеяния калийной соли практически соответствует спектру, представленному на фиг. 2. В одном из предпочтительных аспектов диффракционная картина рассеяния рентгеновских лучей (XRPD) калийной соли практически соответствует данным таблицы и картине, представленной на фиг. 3. В одном из предпочтительных аспектов твердофазный 13 С ЯМР спектр калийной соли 2 практически соответствует спектру, представленному на фиг. 4. Предпочтительный аспект настоящего изобретения, в котором предложены 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион, его калийная соль или ее сольват, отличается тем, что в нем:(i) инфракрасный спектр практически соответствует спектру, представленному на фиг. 1;(ii) рамановский спектр практически соответствует спектру, представленному на фиг. 2;(iii) рентгенограмма (XRPD) практически соответствует данным таблицы или картине,представленной на фиг. 3; и(iv) твердофазный 13 С ЯМР спектр практически соответствует спектру, представленному на фиг. 4. Настоящее изобретение охватывает калийную соль или ее сольват, выделенные в чистой форме или в смеси с другими материалами. Таким образом, в одном из аспектов предложена калийная соль или ее сольват в выделенной форме. В другом аспекте изобретения предложена калийная соль или ее сольват в очищенной форме. Еще в одном аспекте изобретения предложена калийная соль или ее сольват в кристаллической форме. Кроме того, в настоящем изобретении предложена калийная соль или ее сольват в твердой фармацевтически приемлемой форме,такой как твердая лекарственная форма, особенно такая, которая предназначена для перорального введения. Более того, в настоящем изобретении предложена калийная соль или ее сольват в фармацевтически приемлемой форме, особенно в объемной форме, причем такую форму в частности можно измельчить. В настоящем изобретении также предложена калийная соль в измельченной форме. Подходящим сольватом является гидрат. В настоящем изобретении предложен также способ получения калийной соли или ее сольвата, отличающийся тем, что 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион (соединение (I или его соль,предпочтительно диспергированные или растворенные в подходящем растворителе, подвергают взаимодействию с источником ионов калия и после этого, при необходимости, получают сольват образовавшейся калийной соли; и выделяют калийную соль или ее сольват. Подходящими растворителями для реакции являются алканол, например пропан-2-ол,или углеводород, такой как толуол, кетон, такой как ацетон, сложный эфир, такой как этилацетат, эфир, такой как тетрагидрофуран, нитрил,такой как ацетонитрил, или галогенированный 3 углеводород, такой как дихлорметан, или вода; или их смеси. Удобно, чтобы источником ионов калия был гидроксид калия. Гидроксид калия предпочтительно добавляют в твердом виде или в растворе, например в воде или в низшем спирте,таком как метанол, этанол или пропан-2-ол, или в смеси этих растворителей. Альтернативным источником ионов калия является соль алкоксида калия, например трет-бутоксид калия. Концентрация соединения (I) предпочтительно находится в интервале от 2 до 25% масса/объем, более предпочтительно в интервале от 5 до 20%. Концентрация растворов гидроксида калия предпочтительно находится в интервале от 2 до 110% масса/объем. Реакцию обычно ведут при комнатной температуре или при повышенной температуре,например при температуре кипения с обратным холодильником растворителя, хотя можно использовать любые удобные температуры, при которых можно получить нужный продукт. Сольваты, такие как гидраты, калийной соли получают обычными способами. Выделение требуемого соединения обычно включает кристаллизацию из подходящего растворителя, удобно, чтобы это был растворитель реакции, обычно с сопровождением кристаллизации охлаждением. Например, калийную соль можно кристаллизовать из спирта, такого как пропан-2-ол, кетона, такого как ацетон; сложного эфира, такого как этилацетат, и эфира, такого как тетрагидрофуран, или воды, или их смесей. Повышенного выхода соли можно достичь, выпаривая весь или часть растворителя или осуществляя кристаллизацию при повышенной температуре с последующим контролируемым охлаждением, необязательно постадийно. Тщательный контроль температуры осаждения и введение затравки можно использовать для повышения воспроизводимости формы продукта. Кристаллизацию можно также инициировать, вводя затравки кристаллов калийной соли или ее сольвата, но это не существенно. Соединение (I) получают известными способами, такими как те, что раскрыты в ЕР 0306228 и WO 94/05659. Раскрытие ЕР 0306228 и WO 94/05659 включено сюда для ссылки. Гидроксид калия и трет-бутоксид калия являются коммерчески доступными соединениями. Используемый здесь термин "Тначала" обычно определяют с помощью дифференциальной сканирующей калориметрии и он имеет значение обычно понятное специалистам, как например, определенное в "PharmaceuticalThermal Analysis, Techniques and Applications",Ford and Timmins, 1989 как "Температура, соответствующая пересечению препереходной базовой линии с экстраполированным ведущим краем перехода". 4 Используемый здесь термин "Профилактика состояний, связанных с сахарным диабетом" включает состояния, такие как инсулинорезистентность, нарушенная толерантность к глюкозе, гиперинсулинэмия и диабет при беременности. Сахарный диабет предпочтительно означает сахарный диабет II типа. Состояния, связанные с диабетом, включают гипергликемию, инсулинорезистентность и ожирение. Другие состояния, связанные с диабетом, включают гипертонию, сердечнососудистые заболевания, особенно атеросклероз, некоторые нарушения приема пищи, в частности нарушения аппетита и приема пищи у субъектов, страдающих нарушениями, связанными с недостаточным питанием, такими как анорексия невроза, и нарушениями, связанными с перееданием, такими как ожирение и анорексия булимия. Дополнительные условия, связанные с диабетом, включают синдром поликистоза яичников и индуцируемую стероидами инсулинорезистентность. Включенные сюда осложнения состояний,связанных с сахарным диабетом, включают заболевания почек, особенно заболевания почек,связанные с развитием диабета типа II, включая диабетическую невропатию, гломерулонефрит,гломерулярный склероз, нефротический синдром, гипертензивный нефросклероз, и конечную стадию заболевания почек. Как было указано выше, соединение настоящего изобретения обладает полезными терапевтическими свойствами: в настоящем изобретении предложены калийная соль или ее сольват для использования в качестве активного терапевтического вещества. Более конкретно, в настоящем изобретении предложена калийная соль или ее сольват для использования для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений. Калийную соль или ее сольват можно вводить саму по себе или, предпочтительно, в виде фармацевтических композиций, включающих также фармацевтически приемлемый носитель. Подходящие способы получения композиций калийной соли или ее сольвата обычно те же,что раскрыты для соединения (I) в указанных выше публикациях. Соответственно, в настоящем изобретении предложена также фармацевтическая композиция калийной соли или ее сольвата и ее фармацевтически приемлемого носителя. Калийную соль или ее сольват обычно вводят в единичной дозированной форме. Активное соединение можно вводить любым удобным способом, но обычно перорально или парентерально. Для такого введения соединение обычно используют в форме фармацевтической композиции с фармацевтически прием 5 лемым носителем, разбавителем и/или эксципиентом, хотя конкретная форма композиции естественно будет зависеть от способа введения. Композиции приготавливают путем смешивания и соответствующим образом адаптируют для перорального, парентерального или местного введения, и как таковые они могут быть в форме таблеток, капсул, жидких препаратов для перорального введения, порошков,гранул, лепешек, пастилок, воссоздаваемых порошков, растворов для инъекций и вливаний,или суспензий, суппозиториев и приспособлений для чрескожного введения. Композиции для перорального введения предпочтительны, особенно в форме для перорального введения, так как они более удобны при употреблении. Таблетки и капсулы для перорального введения обычно бывают в единичной дозированной форме и содержат обычные эксципиенты,такие как связующие агенты, наполнители, разбавители, агенты, способствующие таблетированию, смазывающие агенты, разрыхлители,красители, вкусовые агенты и смачивающие агенты. На таблетки может быть нанесена оболочка способами, хорошо известными специалистам. Подходящие для использования наполнители включают целлюлозу, маннит, лактозу и другие подобные агенты. Подходящие разрыхляющие агенты включают крахмал, поливинилпирролидон и производные крахмала, такие как натрийгликолят крахмала. Подходящие смазывающие агенты включают, например, стеарат магния. Подходящие фармацевтически приемлемые смачивающие агенты включают натрийлаурилсульфат. Твердые композиции для перорального введения можно приготовить обычными способами смешивания, заполнения, таблетирования и т.п. Повторные операции смешивания можно использовать для более равномерного распределения активного агента в композиции, используя большие количества наполнителя. Такие операции естественно, являются обычными для специалистов. Жидкие препараты для перорального введения могут быть, например, в форме водных или масляных суспензий, растворов, эмульсий,сиропов или эликсиров или могут быть представлены в виде сухого продукта для воссоздания препарата при добавлении воды или другого подходящего носителя перед использованием. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлоза, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия или гидрированные пищевые жиры, эмульгирующие агенты, например лецитин, сорбитанмоноолеат или смола акации; не водные носители (которые могут включать пищевые жиры), например миндальное масло, фракционированное кокосо 005110 6 вое масло, сложные эфиры масел, такие как сложные эфиры глицерина, пропиленгликоль или этиловый спирт; консерванты, например метил- или пропил р-гидроксибензоат или сорбиновая кислота, и, при желании, обычные вкусовые агенты или красители. Для парентерального введения приготавливают формы жидких единичных доз, содержащие соединение настоящего изобретения, и стерильный наполнитель. Такое соединение, в зависимости от наполнителя и концентрации,можно либо суспендировать, либо растворить. Растворы для парентерального введения обычно приготавливают, растворяя активное соединение в наполнителе, и стерилизуют фильтрованием перед заполнением в подходящие пробирки или ампулы, а затем герметизируют. Выгодно также растворять в носителе адьюванты, такие как локальные анестезирующие агенты,консерванты и буферирующие агенты. Для повышения стабильности композицию можно заморозить после заполнения в ампулы, и воду удалить в вакууме. Суспензии для парентерального введения приготавливают практически таким же образом,за исключением того, что активное соединение суспендируют в носителе вместо растворения и стерилизуют, обрабатывая этиленоксидом перед суспендированием в стерильном носителе. Выгодно, чтобы поверхностно активный агент или смачивающий агент были включены в композицию для облегчения равномерного распределения активного соединения. На практике принято обычно сопровождать композиции письменными или печатными инструкциями для использования для терапевтического применения. В том смысле, как здесь использован, термин "фармацевтически приемлемый" охватывает соединения, композиции и ингредиенты для использования как в медицине, так и в ветеринарии: например, термин "фармацевтически приемлемая соль" включает используемые в ветеринарии соли. Далее в настоящем изобретении предложен способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений, у людей или других млекопитающих,который включает введение эффективного, нетоксичного количества калийной соли или ее сольвата нуждающемуся в этом человеку или млекопитающему. Удобно, чтобы активный ингредиент можно было вводить в виде определенной выше фармацевтической композиции, и это составляет конкретный аспект настоящего изобретения. В другом аспекте настоящего изобретения предложено использование калийной соли или ее сольвата для приготовления лекарственного средства для лечения и/или профилактики сахарного диабета, состояний, связанных с сахар 7 ным диабетом, и некоторых осложнений, связанных с сахарным диабетом. При лечении или при профилактике сахарного диабета, состояний, связанных с сахарным диабетом, и связанных с ним некоторых осложнений калийную соль или ее сольват можно вводить в таких количествах, чтобы обеспечить соответствующие дозы соединения (I), например такие, которые указаны в ЕР 0306228, WO 94/0565 или WO 98/55122. Единичная доза композиций настоящего изобретения включает калийную соль или ее фармацевтически приемлемый сольват в таком количестве, которое обеспечивает введение вплоть до 12 мг, включая 1-12 мг, например 2-12 мг, соединения (I), особенно 2-4 мг, 4-8 мг или 8-12 мг соединения (I), например 1, 2, 3, 4, 5, 6,7, 8, 9, 10, 11 или 12 мг соединения (I). Так, в частности, предложена фармацевтическая композиция, включающая калийную соль или ее сольват и фармацевтические приемлемый носитель, где калийная соль или ее фармацевтически приемлемый сольват присутствует в количестве 1, 2, 4, 8, 4-8 или 8-12 мг соединения (I); например 1 мг соединения (I); например 2 мг соединения (I); например 4 мг соединения (I); например 8 мг соединения (I); например 12 мг соединения (I). В настоящем изобретении предложена также фармацевтическая композиция, включающая калийную соль или ее фармацевтически приемлемый сольват в комбинации с одним или более из противодиабетических агентов и необязательно фармацевтически приемлемый носитель. В настоящем изобретении предложен также способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений у людей и других млекопитающих, который включает введение эффективного, нетоксичного количества калийной соли или ее фармацевтически приемлемого сольвата в комбинации с одним или более из других противодиабетических агентов. В другом аспекте настоящего изобретения предложено использование калийной соли или ее фармацевтически приемлемого сольвата в комбинации с одним или более из других противодиабетических агентов для приготовления лекарства для лечения и/или профилактики сахарного диабета,состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений. При вышеуказанных способах лечения введение калийной соли или ее фармацевтически приемлемого сольвата и другого противодиабетического агента или агентов включает совместное введение или последовательное введение активных агентов. Желательно, чтобы вышеуказанные композиции, включая единичные дозы, или способы лечения калийной солью или ее фармацевтически 8 приемлемым сольватом, включали ее в количестве, обеспечивающем вплоть до 12 мг, включая 112 мг, например 2-12 мг соединения (I), особенно 2-4 мг, 4-8 мг или 8-12 мг соединения (I), например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 мг соединения (I). Так, например, в вышеуказанных композициях, включая единичные дозы и способы лечения калийной солью или ее фармацевтически приемлемым сольватом, калийная соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем например 1 мг соединения (I); калийная соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем 2 мг соединения (I); калийная соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем 3 мг соединения (I); калийная соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем 4 мг соединения (I); или калийная соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем 8 мг соединения (I). Другие противодиабетические агенты выбирают из бигуанидов, сульфонилмочевин и ингибиторов альфа-глюкозидазы. Другим противодиабетическим агентом является бигуанид. Другим противодиабетическим агентом являются сульфонилмочевины. Другим противодиабетическим агентом является ингибитор альфаглюкозидазы. Подходящими противодиабетическими агентами являются агенты, раскрытые вWO 98/57649, WO 98/57634, WO 98/57635, WO 98/57636, WO 99/03477, WO 99/03476. Содержание вышеуказанных публикаций включено в описание в качестве ссылки. При лечении вышеуказанными соединениями настоящего изобретения не обнаружено никаких вредных токсикологических эффектов. Приводимые далее примеры являются лишь иллюстративными и никоим образом не ограничивают настоящее изобретение. ПРИМЕРЫ Пример 1. 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, калийная соль. Раствор гидроксида калия (0,56 г) в воде (5 мл) добавляют к перемешиваемому раствору 5[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (3,0 г) в тетрагидрофуране (30 мл) при 50 С. Раствор охлаждают при перемешивании до 21 С в течение примерно 1 ч перед тем, как растворитель выпаривают при пониженном давлении, получая калийную соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (2,90 г) в виде кристаллического твердого вещества. Пример 2. 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, калийная соль. Перемешиваемую суспензию 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиа 9 золидин-2,4-диона (3,0 г) в ацетоне (30 мл) нагревают до кипения с обратным холодильником перед тем, как добавляют раствор гидроксида калия (0,56 г) в воде (5 мл). Через 5 мин образуется прозрачный раствор, и температуру перемешиваемого раствора снижают до 21 С примерно в течение 1 ч. Растворитель выпаривают при пониженном давлении, получая калийную соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, (3,25 г) в виде кристаллического твердого вещества. Пример 3. 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, калийная соль. Раствор гидроксида калия (0,56 г) в воде (1 мл) добавляют к перемешиваемой суспензии 5[4-[2-(N-метил-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (3,0 г) в пропан-2-оле(30 мл) при кипении с обратным холодильником. Через 5 мин раствор становится прозрачным, прежде чем начинает образовываться осадок. Перемешиваемую смесь охлаждают до 21 С примерно за 90 мин. Твердый осадок собирают фильтрованием, промывают пропанол 2-олом (10 мл) и сушат в вакууме в течение 16 ч, получая калийную соль 5-[4-[2-(N-метил-N(2-пири-дил)амино)этокси]бензил]тиазолидин 2,4-диона, (3,14 г) в виде твердого кристаллического вещества белого цвета. Найдено (%): С 54,44, Н 4,53, N 10,45. Рассчитано: С 54,52, Н 4,83, N 10,60. Уровень содержания ионов калия определен как 9,9 вес.% (рассчитано: 9,9%) по данным ионной хроматографии. Содержание воды (определено по способуKarl-Fisher): 0,2 вес.%. Пример 4. 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, калийная соль. Трет-бутоксид калия (1,41 г) добавляют к перемешиваемой суспензии 5-[4-[2-(N-метил-N(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона (3,0 г) в этилацетате (30 мл) при кипении с обратным холодильником. Перемешиваемую смесь выдерживают при кипении с обратным холодильником в течение 15 мин, а затем охлаждают до 21 С примерно за 1 ч. Твердый продукт собирают фильтрованием, промывают этилацетатом (10 мл) и сушат в вакууме при 50 С в течение 72 ч, получая калийную соль 5[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, (3,30 г) в виде твердого кристаллического вещества белого цвета. Пример 5. 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, калийная соль. 10 Раствор гидроксида калия (4,71 г) в воде(5,0 мл) добавляют к перемешиваемой суспензии 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (25,0 г) в пропан-2-оле (250 мл) при кипении с обратным холодильником. Перемешиваемую смесь выдерживают при кипении с обратным холодильником в течение 15 мин, затем охлаждают до 21 С примерно в течение 1 ч. Твердый продукт собирают фильтрованием, промывают пропанол-2 олом (50 мл) и сушат в вакууме при 60 С в течение 16 ч, получая калийную соль 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, (26,6 г) в виде кристаллического твердого вещества белого цвета. Характеристики продукта примера 3. Инфракрасный спектр поглощения дисперсии в минеральном масле продукта получен с использованием спектрофотометра Nicolet 710FT-IR с разрешением 2 см-1 (фиг. 1). Данные регистрировали с интервалами 1 см-1. Положения полос поглощения: 1668, 1605, 1596, 1559,1537, 1512, 1504, 1424, 1311, 1263, 1247, 1224,1206, 1199, 1178, 1156, 1061, 1008, 977, 964, 896,830, 783, 764, 746, 731, 692, 663, 559, 510, 479 см-1. Инфракрасный спектр твердого продукта получен на спектрометре Perkin-Elmer SpectrumOne FT-IR, снабженном универсальным ATR приспособлением. Положения полос поглощения: 2924, 2867, 1667, 1595, 1557, 1534, 1501,1462, 1438, 1422, 1389, 1364, 1309, 1262, 1244,1220, 1206, 1197, 1178, 1155, 1106, 1080, 1060,1007, 977, 963, 922, 896, 829, 782, 764, 746, 729,692, 662 см-1. Рамановский спектр рассеяния (фиг. 2) записан для образца в ампуле для ЯМР спектров на спектрометре Nicolet 960 E.S.P. FT-Ramanspectrometer, при разрешении 4 см-1 с возбуждением от лазера Nd:VO4 (1064 нм) с выходной мощностью 400 мВт. Наблюдаемые частоты полос: 3068, 3055, 3012, 2925, 2900, 2868, 1663,1611, 1560, 1463, 1439, 1424, 1387, 1313, 1275,1206, 1179, 1158, 1099, 1057, 977, 923, 897, 842,783, 750, 726, 663, 633, 480, 405, 347 см-1. Порошковая рентгенограмма лучей порошка продукта (фиг. 3) была получена в следующих условиях накопления: анод трубки: Сu,напряжение генератора: 40 kV, ток генератора: 40 мА, начальный угол: 2,0 2, конечный угол: 35,0 2, шаг: 0,02 2 , время на шаг: 2,5 с. Характеристические XRPD углы и относительные интенсивности представлены в таблице. 12 ный Kel-F крышкой, и скорость вращения ротора составила примерно 10 кГц. I3C MAS спектр получен с накоплением при перекрестной поляризации протонов по Hartmann-Hahn (CP время контакта 3 мс, время повтора 15 с) и развязка протонов при накоплении осуществлялась в последовательности two-pulse phase modulated(ТРРМ) composite. Химические сдвиги измерены в отношении внешнего стандарта - сигнала карбоксилата глицина при 176,4 мд (относительно ТМС) и расположены при: 38,8, 49,7, 64,3, 66,7, 103,9,110,9, 118,1, 129,1, 131,1, 132,4, 136,2, 148,3,158,6, 191,1, 196,3 мд. Характеристики калийной соли продукта примера 5 Стабильность калийной соли в твердом состоянии Стабильность калийной соли в твердом состоянии определяют при хранении примерно 1,00 г материала в незакрытой стеклянной бутыли при а) 40 С/75% относительной влажности(RH) в течение 1 месяца и b) в закрытой бутыли при 50 С в течение 1 месяца. Затем материал исследуют с помощью ВЭЖХ в отношении конечного содержания и продуктов разложения в обоих случаях.a) 40 С/75% RH: не наблюдается значительного разложения (ВЭЖХ анализ, 101% исходно).b) 50 С: не наблюдается значительного разложения (ВЭЖХ анализ, 99% исходно). Растворимость калийной соли Растворимость материала определяют, добавляя аликвоты воды от 1 до 1000 мл к примерно 100 мг лекарственного вещества до растворения порошков. Визуально регистрируемую растворимость контролируют с помощью ВЭЖХ анализа насыщенного раствора. Растворимость: 100 мг/мл. Интервал температур плавления калийной соли Интервал температур плавления калийной соли определяют по способу, раскрытому в U.S.range or temperature, Procedure for Class Ia", используя прибор для определения температуры плавления Buchi 545. Интервал температур плавления: 196,4200,6 С. Тначала для калийной соли Тначала для лекарственного вещества определяют с помощью диференциального сканирующего калориметра, используя прибор PerkinElmer DSC7. Тначала (10 С/мин, закрытый контейнер): 205 С Твердофазый спектр ЯМР продукта (фиг.4) получен на приборе Bruker AMX3 с рабочей частотой 90,55 МгГц: твердый продукт помещали в 4 мм циркониевый MAS ротор, снабжен ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Калийная соль 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона или ее фармацевтически приемлемый 13 сольват, отличающаяся тем, что характеризуется одним или более из(i) инфракрасным спектром практически в соответствии с фиг.1;(ii) рамановским спектром практически в соответствии с фиг. 2;(v) температурой плавления в интервале 194-201 С. 2. Соединение по п.1, отличающееся тем,что характеризуется двумя или более из(i) инфракрасным спектром практически в соответствии с фиг.1;(ii) рамановским спектром практически в соответствии с фиг. 2;(iv) спектром твердофазного 13 С ЯМР практически в соответствии с фиг.4. 3. Соединение по п.1 в твердой дозированной форме. 4. Соединение по п.1 или 2 в объемной измельченной форме. 5. Фармацевтическая композиция, включающая калийную соль 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона (калийную соль) или ее фармацевтически приемлемый сольват по п.1 в количестве, обеспечивающем 1, 2, 3, 4, 4-8 или 8-12 мг 5-[4-[2(N-метил-N-(2-пиридил)амино)этокси]бензил] тиазолидин-2,4-диона и его фармацевтически приемлемый носитель. 6. Фармацевтическая композиция по п.5,включающая калийную соль или ее фармацевтически приемлемый сольват в количестве,обеспечивающем 1, 2, 3 или 4 мг 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона. 7. Фармацевтическая композиция по п.5,включающая калийную соль или ее фармацевтически приемлемый сольват в количестве,обеспечивающем 2 мг 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона. 8. Фармацевтическая композиция по п.5,включающая калийную соль или ее фармацевтически приемлемый сольват в количестве,обеспечивающем 4 мг 5-[4-[2-(N-метил-N-(2-пи 005110 14 ридил)амино)этокси]бензил]тиазолидин-2,4-диона. 9. Фармацевтическая композиция по п.5, в количестве, обеспечивающем 8 мг 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона. 10. Фармацевтическая композиция, включающая калийную соль 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона или ее фармацевтически приемлемый сольват по п.1 в комбинации с одним или более из других противодиабетических агентов и необязательно фармацевтически приемлемым носителем. 11. Способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений у людей или других млекопитающих, включающий введение калийной соли 5[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемого сольвата по п.1 нуждающемуся в этом человеку или другому млекопитающему в количестве, обеспечивающем 1, 2, 3, 4,4-8 или 8-12 мг 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-диона. 12. Способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений, у людей или других млекопитающих, который включает введение эффективного нетоксичного количества калийной соли 5-[4-[2(N-метил-N-(2-пиридил)амино)этокси]бензил] тиазолидин-2,4-диона или ее фармацевтически приемлемого сольвата по п.1 в комбинации с одним или более из других противодиабетических агентов. 13. Калийная соль 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона или ее фармацевтически приемлемый сольват по п.1 для использования в качестве активного терапевтического вещества. 14. Применение калийной соли 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее сольвата по п.1 в количестве, обеспечивающем 1, 2, 3, 4, 4-8 или 812 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона для приготовления лекарства для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых связанных с ним осложнений. Фиг. 1. Инфракрасный спектр калийной соли Фиг. 3. Порошковая рентгенограмма калиевой соли Фиг. 4. Твердофазный спектр 13 С ЯМР калийной соли Фиг. 2. Рамановский спектр калийной соли
МПК / Метки
МПК: A61P 3/10, C07D 417/12, A61K 31/4439
Метки: применение, соль, 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, качестве, противодиабетического, калийная, средства, лекарственного
Код ссылки
<a href="https://eas.patents.su/9-5110-kalijjnaya-sol-5-4-2-n-metil-n-2-piridilaminoetoksibenziltiazolidin-24-diona-i-ee-primenenie-v-kachestve-protivodiabeticheskogo-lekarstvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Калийная соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона и ее применение в качестве противодиабетического лекарственного средства</a>
Предыдущий патент: Натриевая соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона
Следующий патент: Композиции n-(метилэтиламинокарбонил)-4-(3-метилфениламино)-3-пиридилсульфонамида и циклических олигосахаридов
Случайный патент: Способ и устройство для цифровой обработки текстильного материала