Натриевая соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона
Формула / Реферат
1. Соединение, представляющее собой натриевую соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемый сольват, отличающееся тем, что натриевая соль является негигроскопичной или мало гигроскопичной.
2. Соединение по п.1, отличающееся тем, что оно имеет одну или несколько характеристик:
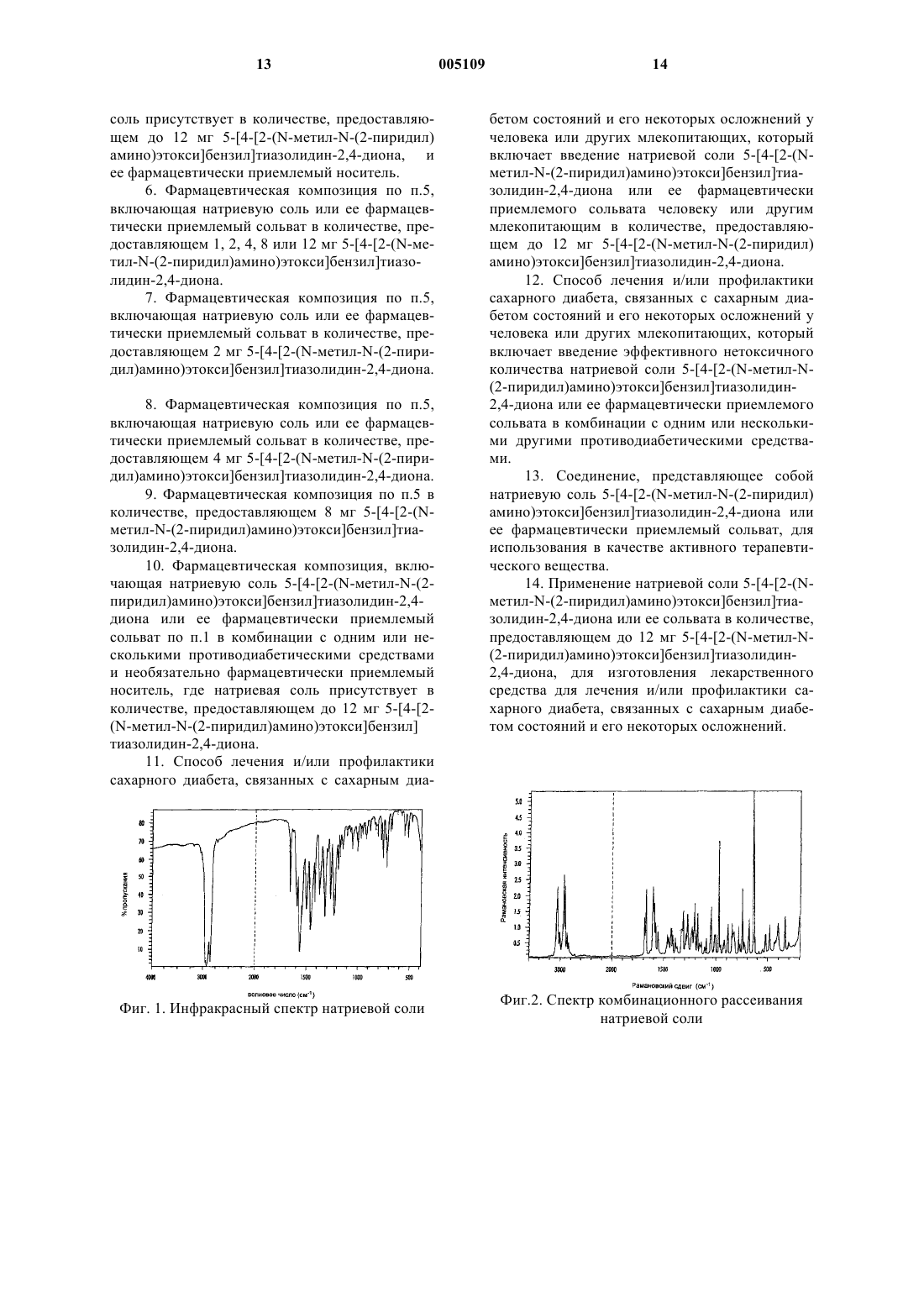
(i) инфракрасный спектр по существу в соответствии с фиг. 1;
(ii) спектр комбинационного рассеяния по существу в соответствии с фиг. 2;
(iii) порошковую рентгенограмму (XRPD) по существу в соответствии с таблицей или фиг. 3;
(iv) спектр ЯМР 13C в твердой фазе по существу в соответствии с фиг. 4 и
(v) температуру плавления в диапазоне от 245 до 250шC.
3. Соединение по любому из пп.1-2 в твердой лекарственной форме.
4. Соединение по любому из пп.1-3 в сыпучей измельченной форме.
5. Фармацевтическая композиция, включающая натриевую соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (натриевую соль) или ее фармацевтически приемлемый сольват по п.1, где натриевая соль присутствует в количестве, предоставляющем до 12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, и ее фармацевтически приемлемый носитель.
6. Фармацевтическая композиция по п.5, включающая натриевую соль или ее фармацевтически приемлемый сольват в количестве, предоставляющем 1, 2, 4, 8 или 12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
7. Фармацевтическая композиция по п.5, включающая натриевую соль или ее фармацевтически приемлемый сольват в количестве, предоставляющем 2 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
8. Фармацевтическая композиция по п.5, включающая натриевую соль или ее фармацевтически приемлемый сольват в количестве, предоставляющем 4 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
9. Фармацевтическая композиция по п.5 в количестве, предоставляющем 8 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
10. Фармацевтическая композиция, включающая натриевую соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемый сольват по п.1 в комбинации с одним или несколькими противодиабетическими средствами и необязательно фармацевтически приемлемый носитель, где натриевая соль присутствует в количестве, предоставляющем до 12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
11. Способ лечения и/или профилактики сахарного диабета, связанных с сахарным диабетом состояний и его некоторых осложнений у человека или других млекопитающих, который включает введение натриевой соли 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемого сольвата человеку или другим млекопитающим в количестве, предоставляющем до 12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона.
12. Способ лечения и/или профилактики сахарного диабета, связанных с сахарным диабетом состояний и его некоторых осложнений у человека или других млекопитающих, который включает введение эффективного нетоксичного количества натриевой соли 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемого сольвата в комбинации с одним или несколькими другими противодиабетическими средствами.
13. Соединение, представляющее собой натриевую соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемый сольват, для использования в качестве активного терапевтического вещества.
14. Применение натриевой соли 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее сольвата в количестве, предоставляющем до 12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, для изготовления лекарственного средства для лечения и/или профилактики сахарного диабета, связанных с сахарным диабетом состояний и его некоторых осложнений.
Текст
1 Данное изобретение относится к новому фармацевтическому препарату, к способу получения фармацевтического препарата и к использованию фармацевтического препарата в медицине. Европейская заявка на патент, номер публикации 0306228 относится к определенным производным тиазолидиндиона, которые, как описывается, имеют гипогликемическую и гиполипидемическую активность. Соединение из примера 30 ЕР 0 306 228 представляет собой 5[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион (в дальнейшем именуемый соединение (I. Международная заявка на патент, номер публикации WO 94/05659 описывает определенные соли соединений ЕР 0306228. Предпочтительной солью WO 94/05659 является соль малеиновой кислоты. Неожиданно было обнаружено, что соединение I образует новую натриевую соль (в дальнейшем именуемую натриевой солью). Новая натриевая соль является стабильным кристаллическим материалом с высокой температурой плавления, поэтому подходит для массового производства и обращения. Натриевая соль подходит для крупномасштабной фармацевтической переработки, особенно при способе изготовления, который требует или приводит к выделению тепла, например при измельчении,сушке в псевдоожиженном слое, сушке распылением, переработке горячего расплава и стерилизации в автоклаве. Новую соль можно получить эффективным, экономичным и воспроизводимым способом, особенно подходящим для крупномасштабного производства. Кроме того,новая натриевая соль является негигроскопичной и показывает хорошую стабильность в твердом состоянии, особенно в условиях влажности. Новая натриевая соль также имеет полезные фармацевтические свойства и, в частности показано, что она является полезной для лечения и/или профилактики сахарного диабета,состояний, связанных с сахарным диабетом, и некоторых его осложнений. Соответственно, настоящее изобретение предлагает натриевую соль 5-[4-[2-(N-метил-N(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона, в особенности негигроскопичную натриевую соль или ее сольват. В одном благоприятном аспекте натриевая соль дает инфракрасный спектр по существу в соответствии с фиг. 1. В одном аспекте натриевая соль дает спектр комбинационного рассеяния по существу в соответствии с фиг. 2. В одном аспекте натриевая соль дает порошковую рентгенограмму (XRPD) по существу в соответствии с таблицей или фиг. 3. 2 В одном аспекте натриевая соль дает спектр ЯМР 13 С в твердой фазе по существу в соответствии с фиг. 4. В предпочтительном аспекте изобретение предлагает натриевую соль 5-[4-[2-(N-метил-N(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона, или ее сольват, характеризующуюся тем, что она дает:(i) инфракрасный спектр по существу в соответствии с фиг. 1;(ii) спектр комбинационного рассеяния по существу в соответствии с фиг. 2;(iv) спектр ЯМР 13 С в твердой фазе по существу в соответствии с фиг. 4. Натриевая соль имеет температуру плавления в диапазоне от 245 до 250 С, такую как от 246 до 249 С, например 246 или 249 С. Настоящее изобретение охватывает натриевую соль или ее сольват, которые выделены в чистой форме или смешаны с другими материалами. Таким образом, в одном аспекте предлагается натриевая соль или ее сольват в изолированной форме. В дальнейшем аспекте предлагается натриевая соль или ее сольват в очищенной форме. В еще одном дальнейшем аспекте предлагается натриевая соль или ее сольват в кристаллической форме. Кроме того, изобретение предлагает натриевую соль или ее сольват в твердой фармацевтически приемлемой форме, такой как твердая лекарственная форма, особенно когда она адаптирована для орального введения. Более того, изобретение также предлагает натриевую соль или ее сольват в фармацевтически приемлемой форме, особенно в сыпучей форме, причем такая форма особенно способна к фармацевтической переработке, особенно в способах получения, которые требуют тепла или выделяют тепло, например при измельчении; например при тепловой сушке, особенно при сушке в псевдоожиженом слое или распылительной сушке; например при переработке горячего расплава; например при стерилизации теплом, такой как обработка в автоклаве. Кроме того, изобретение также предлагает натриевую соль или ее сольват в фармацевтически приемлемой форме, особенно в сыпучей форме и особенно в форме, перерабатываемой в способе получения, который требует или приводит к выделению тепла, например в измельченной форме; например в форме подвергнутой тепловой сушке, особенно в форме, высушенной в псевдоожиженном слое, или форме, подвергнутой распылительной сушке; например в форме, переработанной в горячем расплаве; например в форме, подвергнутой стерилизации теплом, такой как обработка в автоклаве. 3 Как показано выше, натриевая соль по изобретению негигроскопична. Далее изобретение включает негигроскопичные или мало гигроскопичные фармацевтически приемлемые сольваты, включая гидраты, натриевой соли. Настоящее изобретение также предлагает способ получения натриевой соли или ее сольвата, характеризующийся тем, что 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион (соединение (I или его соль,предпочтительно диспергированный или растворенный в подходящем растворителе, реагирует с источником иона натрия и затем, если требуется, получают сольват, полученной в результате натриевой соли; и натриевую соль или ее сольват выделяют. Подходящим растворителем для реакции является алканол, например пропан-2-ол, или эфир, такой как тетрагидрофуран, углеводород,такой как толуол, кетон, такой как ацетон,сложный эфир, такой как этилацетат, нитрил,такой как ацетонитрил, или галогенированный углеводород, такой как дихлорметан, или вода; или их смесь. Подходящим источником иона натрия является гидроксид натрия. Гидроксид натрия предпочтительно добавляют в виде твердого вещества или в растворе, например в воде или в низшем спирте, таком как метанол, этанол, или пропан-2-ол, или смеси растворителей. Концентрация соединения (I) предпочтительно находится в диапазоне от 2 до 25 % масса/объем, более предпочтительно, в диапазоне от 5 до 20%. Концентрация растворов гидроксида натрия предпочтительно находится в диапазоне от 2 до 111% масса/объем. Реакцию обычно проводят при температуре окружающей среды или при повышенной температуре, например при 50-60 С, или при температуре кипения растворителя, хотя может быть использована любая температура, которая дает требуемый продукт. Сольваты натриевой соли, такие как гидраты, получают согласно традиционным процедурам. Выделение требуемого соединения в основном включает кристаллизацию из подходящего растворителя, удобно из реакционного растворителя, обычно сопровождаемую охлаждением. Например, натриевая соль может быть кристаллизована из спирта, такого как пропан 2-ол, эфира, такого как тетрагидрофуран, или воды, или их смеси. Повышенный выход соли можно получить путем выпаривания части или всего растворителя или путем кристаллизации при повышенной температуре с последующим контролируемым охлаждением, необязательно,постадийно. Для улучшения воспроизводимости получаемого продукта можно использовать тщательный контроль температуры осаждения и кристаллизации. 4 Кристаллизацию также можно инициировать путем внесения затравки кристаллов натриевой соли или ее сольвата, но это не является существенным. Соединение (I) готовят согласно известным процедурам, таким как процедуры, описанные в ЕР 0 306 228 и WO 94/05659. Описания ЕР 0 306 228 и WO 94/05659 включаются ссылкой. Гидроксид натрия является коммерчески доступным соединением. Используемый термин"Tonset" обычно определяют методом Дифференциальной сканирующей калориметрии и он имеет значение, обычно понятное специалистам, как например, изложено в издании "Pharmaceutical Thermal Analysis, Techniques and Applications", Ford and Timmins, 1989, как "Температура, относящаяся к пересечению предпереходной базовой линии с экстраполированным передним фронтом перехода". Используемый в описании термин "профилактика состояний, связанных с сахарным диабетом" включает лечение состояний, таких как резистентность к инсулину, ухудшенная толерантность к глюкозе, гиперинсулинемия и обусловленный беременностью диабет. Используемые здесь термины, относящиеся к гигроскопичности, применяются в соответствии с известными критериями, изложенными в работе J.C. Callahan et al., Drug Developmentand Industrial Pharmacy, 1982, 8 (3), 355-69, которая классифицирует гигроскопичность по отношению к % увеличению веса тестируемого соединения при контролируемых условиях температуры и влажности (25 С и 75% относительной влажности), при которых тестируемому соединению дают достичь приблизительно постоянного веса. Используется следующая классификация.% Увеличения веса Классификация 2% негигроскопичное 2-10% мало гигроскопичное 10-20% умеренно гигроскопичное 20% очень гигроскопичное Во избежание сомнений используемые здесь термины "негигроскопичное", "мало гигроскопичное", "умеренно гигроскопичное" и"очень гигроскопичное" следует определять согласно вышеуказанным критериям. Кроме того, термин "мало гигроскопичное" может в частности обозначать соединение,показывающее % увеличения веса при вышеуказанных критериях, равный любому значению из диапазона 2-9%, 2-8%, 2-7%, 2-6%, 2-5%, 24% и 2-3%. Используемый здесь термин "фармацевтически приемлемый" охватывает соединения,композиции и ингредиенты для использования с целью лечения людей и в ветеринарии: например термин "фармацевтически приемлемая соль" охватывает ветеринарно приемлемую соль."Сахарный диабет" предпочтительно означает сахарный диабет тип II. Состояния, связанные с диабетом, включают гипергликемию, резистентность к инсулину и ожирение. Далее состояния, связанные с диабетом, включают повышенное кровяное давление, сердечно-сосудистое заболевание, особенно атеросклероз, некоторые расстройства питания, в частности регулирование аппетита и приемы пищи у пациентов, страдающих от расстройств, связанных с недоеданием, таких как нервная анорексия, и расстройств, связанных с перееданием, таких как ожирение и анорексия булимия. Дополнительные состояния, связанные с диабетом, включают синдром поликистоза яичника и вызванную стероидами резистентность к инсулину. Охватываемые здесь осложнения состояний, которые связаны с сахарным диабетом,включают почечную болезнь, особенно почечную болезнь, связанную с развитием диабета типа II, включая обусловленную диабетом нефропатию, гломерулонефрит, гломерулосклероз,нефротический синдром, гипертензивный нефросклероз и почечную болезнь последней стадии. Как указано выше, соединение по изобретению обладает полезными терапевтическими свойствами. Соответственно, настоящее изобретение предлагает его натриевую соль для использования в качестве активного терапевтического вещества. Более конкретно, настоящее изобретение предлагает натриевую соль для использования при лечении и/или профилактике сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых его осложнений. Натриевую соль можно вводить саму по себе или, предпочтительно, в виде фармацевтической композиции, также включающей фармацевтически приемлемый носитель. Подходящие способы составления рецептуры натриевой соли обычно являются идентичными описанным для соединения (I) в вышеуказанных публикациях. Кроме того, настоящее изобретение также предлагает фармацевтическую композицию,включающую натриевую соль и ее фармацевтически приемлемый носитель. Натриевую соль обычно вводят в виде стандартной лекарственной формы. Активное соединение можно вводить любым подходящим способом, но обычно оральным или парентеральным способом. Для такого использования обычно соединение будет применяться в форме фармацевтической композиции в сочетании с фармацевтическим носителем, разбавителем и/или наполнителем, хотя конкретная форма композиции естественно будет зависеть от способа введения. Композиции готовят смешиванием и, соответственно, адаптируют для орального, парентерального или местного введения и, по сущест 005109 6 ву, они могут быть в форме таблеток, капсул,оральных жидких препаратов, порошков, гранул, лепешек, пастилок, разбавляемых порошков, растворов или суспензий для инъекций и вливаний, суппозиториев и лекарственных форм для трансдермального введения. Предпочтительными являются орально вводимые композиции, в частности формованные оральные композиции, поскольку они более удобны для общего использования. Таблетки и капсулы для орального введения обычно присутствуют в виде стандартной дозы и содержат традиционные наполнители,такие как связующие вещества, наполнители,разбавители, вещества, облегчающие изготовление таблеток, смазывающие вещества, вещества, способствующие распадаемости лекарственной формы, красители, корригенты и увлажняющие вещества. Таблетки могут быть покрыты оболочкой известными из уровня техники методами. Подходящие для использования наполнители включают целлюлозу, маннит, лактозу и другие подобные вещества. Подходящие вещества, способствующие распадаемости лекарственной формы, включают крахмал, поливинилпирролидон и производные крахмала, такие как натрий гликолят крахмала. Подходящие смазывающие вещества включают, например, стеарат магния. Подходящие фармацевтически приемлемые увлажняющие вещества включают лаурилсульфат натрия. Твердые оральные композиции можно приготовить традиционными методами смешения, наполнения, таблетирования или аналогичными. Для распределения активного вещества по всему объему композиций можно использовать повторяющиеся операции смешивания,применяя значительные количества наполнителей. Конечно, такие операции являются традиционными из уровня техники. Оральные жидкие препараты могут быть в любой форме, например представлять собой водные или масляные суспензии, растворы,эмульсии, сиропы или эликсиры, или могут быть представлены в виде сухого продукта для разбавления водой или другим подходящим растворителем перед использованием. Данные жидкие препараты могут содержать традиционные добавки, такие как суспендирующие вещества, например сорбит, сироп, метилцеллюлоза,желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия или гидрогенизированные пищевые жиры, эмульгаторы, например лецитин, моноолеат сорбитана или гуммиарабик; неводные растворители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры,такие как сложные эфиры глицерина, пропиленгликоля или этилового спирта; консерванты,например метил- или пропил-п-гидроксибензоат 7 или сорбиновая кислота и, если желательно,традиционные корригенты или красители. Для парентерального введения готовят жидкие стандартные лекарственные формы,содержащие соединение по настоящему изобретению и стерильный наполнитель. Соединение в зависимости от наполнителя и концентрации может быть либо суспендированным, либо растворенным. Парентеральные растворы обычно готовят растворением активного соединения в наполнителе и стерилизацией фильтрацией перед заполнением в подходящий сосуд или ампулу, и герметизацией. Преимущественно, вспомогательные лекарственные средства, такие как местные анестезирующие вещества, консерванты и буферные вещества также растворяют в растворителе. Для увеличения стабильности композицию можно заморозить после заполнения сосуда, а воду удалить под вакуумом. Парентеральные суспензии готовят по существу таким же образом за исключением того,что активное соединение суспендируют в растворителе вместо растворения и стерилизуют этиленоксидом перед суспендированием в стерильном растворителе. Преимущественно в композицию включают поверхностно-активное вещество или увлажняющее вещество, для облегчения однородного распределения активного соединения. Как является традиционной практикой,композиции обычно будут сопровождаться письменными или напечатанными указаниями для использования при проводимом медицинском лечении. Далее настоящее изобретение предлагает способ лечения и/или профилактики сахарного диабета, связанных с сахарным диабетом состояний и его некоторых осложнений у человека или других млекопитающих, который включает введение эффективного, нетоксичного количества натриевой соли или ее сольвата человеку или другим млекопитающим при необходимости этого. Активный ингредиент можно просто вводить в виде фармацевтической композиции, определенной выше, и это формирует особый аспект настоящего изобретения. В дальнейшем аспекте настоящее изобретение предлагает использование натриевой соли для производства лекарственного средства для лечения и/или профилактики сахарного диабета,состояний, связанных с сахарным диабетом, и некоторых их осложнений. Для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений натриевая соль или ее сольват могут быть взяты в таких количествах, чтобы обеспечить соединение(I) в подходящих дозах, таких как описанные в ЕР 0 306 228, WO 94/05659 или W0 98/55122. Композиции стандартной дозы по изобретению включают натриевую соль или ее фарма 005109 8 цевтически приемлемый сольват в количестве,обеспечивающем до 12 мг, включая 1-12 мг,например 2-12 мг соединения (I), особенно 2-4 мг, 4-8 мг или 8-12 мг соединения (I), например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 мг соединения (I). Таким образом, в частности предлагается фармацевтическая композиция, включающая натриевую соль или ее фармацевтически приемлемый сольват и ее фармацевтически приемлемый носитель, где натриевая соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем 1, 2, 4, 8, 12, от 4 до 8 или от 8 до 12 мг соединения (I); таком как 1 мг соединения (I); таком как 2 мг соединения(I). Изобретение также предлагает фармацевтическую композицию, включающую натриевую соль или ее фармацевтически приемлемый сольват в комбинации с одним или несколькими другими противодиабетическими средствами и необязательно их фармацевтически приемлемым носителем. Изобретение также предлагает способ лечения и/или профилактики сахарного диабета,состояний, связанных с сахарным диабетом, и некоторых его осложнений, у людей и других млекопитающих, который включает введение эффективного, нетоксичного количества натриевой соли или ее фармацевтически приемлемого сольвата в комбинации с одним или несколькими другими противодиабетическими средствами. В дальнейшем аспекте настоящее изобретение предлагает применение натриевой соли или ее фармацевтически приемлемого сольвата в комбинации с одним или более другими противодиабетическими средствами для производства лекарственного средства для лечения и/или профилактики сахарного диабета, состояний,связанных с сахарным диабетом, и некоторых их осложнений. В вышеупомянутых методах лечения введение натриевой соли или ее фармацевтически приемлемого сольвата и другого противодиабетического средства или средств включает совместное введение или последовательное введение активных средств. Соответственно, в вышеуказанных композициях, включая стандартные дозы, или методах лечения, натриевая соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем до 12 мг, включая 1-12 мг, например 2-12 мг соединения (I), особенно 2-4 мг, 4-8 мг или 8-12 мг соединения (I), например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 мг соединения (I) или от 4 до 8 или от 8 до 12 мг соединения (I). Таким образом, например, в вышеуказанных композициях, включая стандартные дозы, или методах лечения натриевая соль или ее фармацевтически приемлемый сольват 9 присутствует в количестве, обеспечивающем 1 мг соединения (I); натриевая соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем 2 мг соединения(I); натриевая соль или ее фармацевтически приемлемый сольват присутствует в количестве,обеспечивающем 3 мг соединения (I); натриевая соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем 4 мг соединения (I); натриевая соль или ее фармацевтически приемлемый сольват присутствует в количестве, обеспечивающем 8 мг соединения (I). Соответственно, другие противодиабетические средства выбраны из бигуанидов, сульфонилмочевин и ингибиторов альфа глюкозидазы. Другим противодиабетическим средством,соответственно, является бигуанид. Другим противодиабетическим средством, соответственно, является сульфонилмочевина. Другим антидиабетическим средством, соответственно,является ингибитор альфа глюкозидазы. Подходящими антидиабетическими средствами являются средства, заявленные в WO 98/57649, WO 98/57634, WO 98/57635, WO 98/57636, WO 99/03477, WO 99/03476. Содержание вышеуказанных публикаций включается ссылкой. Никаких неблагоприятных токсикологических эффектов в вышеупомянутых методах лечения для соединений по изобретению не наблюдали. Следующие примеры иллюстрируют изобретение, но никоим образом его не ограничивают. ПРИМЕРЫ Пример 1. 5-[4-[2-(N-Метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, натриевая соль. К перемешиваемому раствору 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (3,0 г) в тетрагидрофуране(ТГФ, 30 мл) при 50 С добавляют раствор гидроксида натрия (0,40 г) в воде (5 мл). Прозрачный раствор охлаждают до 21 С в течение приблизительно 1 ч и растворитель выпаривают при пониженном давлении, получая натриевую соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-диона (3,2 г) в виде кристаллического твердого вещества. Пример 2. 5-[4-[2-N-Метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, натриевая соль. Перемешиваемую суспензию 5-[4-[2-(Nметил-N-(2-пиридил)-амино)этокси]бензил]тиазолидин-2,4-диона (3,0 г) в пропан-2-оле (30 мл) нагревают до 60 С прежде чем добавить раствор гидроксида натрия (0,40 г) в воде (5 мл). Перемешиваемую смесь кипятят с обратным холодильником, получая прозрачный раствор, и затем охлаждают до 21 С в течение приблизительно 1 ч. Твердый осадок собирают фильтра 005109 10 цией, промывают пропан-2-олом (10 мл) и сушат под вакуумом при 50 С в течение 2 ч, получая натриевую соль 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона, (2,09 г) в виде белого кристаллического твердого вещества. Найдено: С 56,82, Н 4,73, N 10,95. Рассчитано: С 56,97, Н 4,78, N 11,08.H-NMR (d6-ДМСО): согласующийся с натриевой солью 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-диона. Пример 3. 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион, натриевая соль. К перемешиваемой суспензии 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (25,0 г) в пропан-2-оле (250 мл) при кипячении с обратным холодильником добавляют раствор гидроксида натрия (3,36 г) в воде (10 мл). Перемешиваемую смесь кипятят с обратным холодильником в течение 15 мин и затем охлаждают до 21 С в течение приблизительно 1 ч. Белый твердый осадок собирают фильтрацией, промывают пропан-2-олом (2x50 мл) и сушат под вакуумом над пентоксидом фосфора в течение 16 ч, чтобы получить натриевую соль 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-диона(24,83 г) в виде белого кристаллического твердого вещества. Данные, характеризующие продукт примера 2. Спектр инфракрасного поглощения продукта, диспергированного в минеральном масле,получают с использованием ИК-спектрометраNicolet 710 FT-IR с разрешением 2 см-1 (фиг. 1). Данные оцифровывают с интервалом 1 см-1. Полосы наблюдают при: 1664, 1595, 1566, 1547,1504, 1462, 1423, 1325, 1271, 1238, 1198, 1179,1152, 1059, 1008, 977, 928, 816, 784, 765, 741,729, 721, 556, 520 см-1. Инфракрасный спектр твердого продукта регистрируют с использованием спектрометра(фиг. 2) измеряют на образце в ЯМР трубке с использованием спектрометра комбинационного рассеивания с Nicolet 960 E.S.P., с разрешением 4 см-1 с возбуждением лазером Nd: VO4 11 условий получения: Трубчатый анод: Сu, напряжение генератора: 40 кВ, ток генератора: 40 мА, начальный угол: 2,0 2, конечный угол: 35,0 2, размер шага: 0,02 2, время шага: 2,5 с. Характеристические XRPD углы и относительные интенсивности записаны в таблице. 12 повтора 15 мс) и расщепление на протонах получают с использованием сложной последовательности с двухимпульсной фазовой модуляцией (ТРРМ). Химические сдвиги по внешнему стандарту относят к карбоксильному сигналу глицина при 176,4 м.д. относительно ТМС и наблюдают при: 37,2; 41,4; 51,1; 62,7; 68,9; 102,9; 109,8; 112,1; 119,2; 130,7; 132,1; 132,9; 138,5; 148,9; 159,5; 191,6; 197,7 м.д. Свойства натриевой соли Температура плавления натриевой соли, измеренная для продукта примера 3 Температуру плавления натриевой соли определяют согласно методу, описанному в U.S.range or temperature, Procedure for Class Ia", с использованием прибора измерения температуры плавления Buchi 545. Наблюдают, что образец обесцвечивается выше 200 С. Коричневое твердое вещество образуется при 230 С. Температура плавления коричневого твердого вещества: 246 С.Tonset натриевой соли, измеренная для продукта примера 2Tonset лекарственного вещества определяют методом Дифференциальной Сканирующей Калориметрии с использованием прибора PerkinElmer DSC 7. Спектр ЯМР твердого тела натриевой соли(фиг. 4) измеряют на приборе Bruker AMX360 при 90,55 МГц: твердое вещество помещали в 4 мм циркониевый MAS ротор с колпачком Kel-F и вращением ротора примерно при 10 кГц. Спектр 13 С MAS получают путем кроссполяризации от Хартманн-Хан соответствующих протонов (СР время контакта 3 мс, время 1. Соединение, представляющее собой натриевую соль 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемый сольват, отличающееся тем, что натриевая соль является негигроскопичной или мало гигроскопичной. 2. Соединение по п.1, отличающееся тем,что оно имеет одну или несколько характеристик:(i) инфракрасный спектр по существу в соответствии с фиг. 1;(ii) спектр комбинационного рассеяния по существу в соответствии с фиг. 2;(iv) спектр ЯМР 13 С в твердой фазе по существу в соответствии с фиг. 4 и(v) температуру плавления в диапазоне от 245 до 250 С. 3. Соединение по любому из пп.1-2 в твердой лекарственной форме. 4. Соединение по любому из пп.1-3 в сыпучей измельченной форме. 5. Фармацевтическая композиция, включающая натриевую соль 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона (натриевую соль) или ее фармацевтически приемлемый сольват по п.1, где натриевая 13 соль присутствует в количестве, предоставляющем до 12 мг 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-диона, и ее фармацевтически приемлемый носитель. 6. Фармацевтическая композиция по п.5,включающая натриевую соль или ее фармацевтически приемлемый сольват в количестве, предоставляющем 1, 2, 4, 8 или 12 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона. 7. Фармацевтическая композиция по п.5,включающая натриевую соль или ее фармацевтически приемлемый сольват в количестве, предоставляющем 2 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона. 8. Фармацевтическая композиция по п.5,включающая натриевую соль или ее фармацевтически приемлемый сольват в количестве, предоставляющем 4 мг 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона. 9. Фармацевтическая композиция по п.5 в количестве, предоставляющем 8 мг 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона. 10. Фармацевтическая композиция, включающая натриевую соль 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона или ее фармацевтически приемлемый сольват по п.1 в комбинации с одним или несколькими противодиабетическими средствами и необязательно фармацевтически приемлемый носитель, где натриевая соль присутствует в количестве, предоставляющем до 12 мг 5-[4-[2(N-метил-N-(2-пиридил)амино)этокси]бензил] тиазолидин-2,4-диона. 11. Способ лечения и/или профилактики сахарного диабета, связанных с сахарным диа Фиг. 1. Инфракрасный спектр натриевой соли 14 бетом состояний и его некоторых осложнений у человека или других млекопитающих, который включает введение натриевой соли 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемого сольвата человеку или другим млекопитающим в количестве, предоставляющем до 12 мг 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-диона. 12. Способ лечения и/или профилактики сахарного диабета, связанных с сахарным диабетом состояний и его некоторых осложнений у человека или других млекопитающих, который включает введение эффективного нетоксичного количества натриевой соли 5-[4-[2-(N-метил-N(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона или ее фармацевтически приемлемого сольвата в комбинации с одним или несколькими другими противодиабетическими средствами. 13. Соединение, представляющее собой натриевую соль 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-диона или ее фармацевтически приемлемый сольват, для использования в качестве активного терапевтического вещества. 14. Применение натриевой соли 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или ее сольвата в количестве,предоставляющем до 12 мг 5-[4-[2-(N-метил-N(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона, для изготовления лекарственного средства для лечения и/или профилактики сахарного диабета, связанных с сахарным диабетом состояний и его некоторых осложнений. Фиг.2. Спектр комбинационного рассеивания натриевой соли Фиг. 3. Порошковая рентгенограмма натриевой соли
МПК / Метки
МПК: C07D 417/12, A61P 3/10, A61K 31/4439
Метки: натриевая, соль, 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона
Код ссылки
<a href="https://eas.patents.su/9-5109-natrievaya-sol-5-4-2-n-metil-n-2-piridilaminoetoksibenziltiazolidin-24-diona.html" rel="bookmark" title="База патентов Евразийского Союза">Натриевая соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона</a>
Предыдущий патент: Способ обработки скважины
Следующий патент: Калийная соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона и ее применение в качестве противодиабетического лекарственного средства
Случайный патент: Способ получения глимепирида и соответствующего промежуточного соединения