Гранула с контролируемым высвобождением, способ ее изготовления и включающая ее композиция из множества единиц
Номер патента: 5074
Опубликовано: 28.10.2004
Авторы: Рингберг Андерс, Грен Торкель, Викберг Мартин, Уолд Рэнди Дж.
Формула / Реферат
1. Гранула с контролируемым высвобождением, включающая
(i) единицу ядра, по существу, из водорастворимого или набухающего в воде инертного материала;
(ii) первый слой на единице ядра, по существу, из не растворимого в воде полимера, где количество первого слоя составляет более чем 2 мас.% от количества окончательной композиции гранулы;
(iii) второй слой, покрывающий первый слой и содержащий активный ингредиент, выбранный из 3,3-дифенилпропиламинов; и
(iv) третий слой полимера на втором слое, эффективный для контролируемого высвобождения активного ингредиента,
где указанный первый слой обеспечивает регулирование проникновения воды в ядро.
2. Гранула по п.1, в которой количество полимера в указанном первом слое является достаточным, чтобы в значительной степени задержать проникновение воды в ядро.
3. Гранула по п.1 или 2, в которой толщина указанного первого слоя является достаточной, чтобы воздействовать на скорость высвобождения лекарственного средства из гранулы.
4. Гранула по пп.1, 2 или 3, в которой количество первого слоя составляет более чем 3% (мас./мас.) окончательной композиции гранулы.
5. Гранула по любому из пп.1-4, в которой количество указанного второго слоя обычно составляет от примерно 0,05 до примерно 60% (мас./мас.), предпочтительно от примерно 0,1 до примерно 30% (мас./мас.) окончательной композиции гранулы.
6. Гранула по любому из пп.1-5, в которой количество указанного третьего слоя обычно составляет от примерно 1 до примерно 50% (мас./мас.), предпочтительно от примерно 2 до примерно 25% (мас./мас.) окончательной композиции гранулы.
7. Гранула по любому из пп.1-6, в которой указанный третий полимерный слой покрывают четвертым слоем водорастворимого полимера или дополнительным функциональным покрытием.
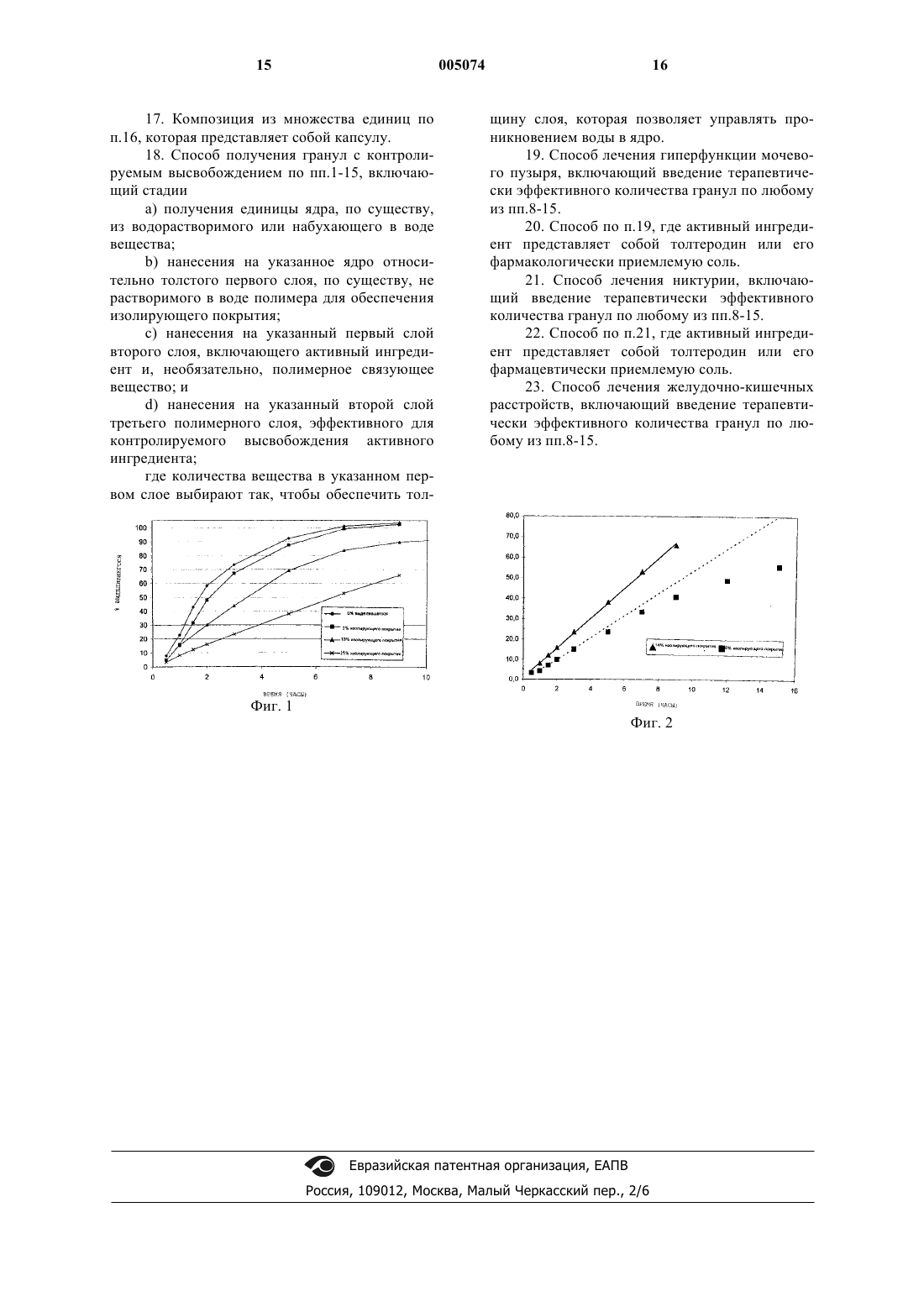
8. Гранула по любому из пп.1-7, в которой указанный активный ингредиент выбирают из соединений, имеющих общую формулу
где R1 обозначает водород или метил; R2, R3 и R4 независимо обозначают водород, метил, метокси, гидроксил, гидроксиметил, карбамоил, сульфамоил или галоген; и X представляет третичную аминогруппу -NR5, R6, где R5 и R6 обозначают неароматические гидрокарбильные группы, которые могут быть одинаковыми или различными, особенно C1-6алкил или адамантил, и которые вместе содержат по меньшей мере 3, предпочтительно по меньшей мере 4 атома углерода, причем каждый из них может нести гидроксильный заместитель, и где R5 и R6 могут образовывать кольцо вместе с атомом азота амина, предпочтительно неароматическое кольцо, не имеющее другого гетероатома, кроме азота амина, их солей с физиологически приемлемыми кислотами и когда соединения могут быть в форме оптических изомеров, рацемической смеси и индивидуальных энантиомеров.
9. Гранула по п.8, в которой указанный активный ингредиент выбирают из толтеродина, 5-гидроксиметильного метаболита толтеродина, (S)-энантиомера толтеродина, 5-гидроксиметильного метаболита (S)-энантиомера толтеродина, рацемата толтеродина и их форм пролекарства и фармакологически приемлемых солей.
10. Гранула по п.9, в которой указанный активный ингредиент представляет собой толтеродин или его фармакологически приемлемую соль.
11. Гранула по п.10, в которой доля активного ингредиента, которая высвобождается in vitro, равна не более чем примерно 30% после 1 ч, от примерно 40 до примерно 85% после 3 ч и не менее чем примерно 80% после 7 ч.
12. Гранула по любому из пп.1-11, в которой полимерный материал указанного первого слоя включает этилцеллюлозу.
13. Гранула по любому из пп.1-12, в которой указанный второй слой дополнительно включает гидроксипропилметилцеллюлозу в качестве связующего вещества.
14. Гранула по любому из пп.1-13, в которой полимерный материал указанного третьего слоя включает комбинацию гидроксипропилметилцеллюлозы и этилцеллюлозы.
15. Гранула по любому из пп.1-14, в которой единица ядра имеет размер от примерно 0,05 до примерно 2 мм.
16. Композиция из множества единиц, включающая гранулы с контролируемым высвобождением по любому из пп.1-15.
17. Композиция из множества единиц по п.16, которая представляет собой капсулу.
18. Способ получения гранул с контролируемым высвобождением по пп.1-15, включающий стадии
a) получения единицы ядра, по существу, из водорастворимого или набухающего в воде вещества;
b) нанесения на указанное ядро относительно толстого первого слоя, по существу, не растворимого в воде полимера для обеспечения изолирующего покрытия;
c) нанесения на указанный первый слой второго слоя, включающего активный ингредиент и, необязательно, полимерное связующее вещество; и
d) нанесения на указанный второй слой третьего полимерного слоя, эффективного для контролируемого высвобождения активного ингредиента;
где количества вещества в указанном первом слое выбирают так, чтобы обеспечить толщину слоя, которая позволяет управлять проникновением воды в ядро.
19. Способ лечения гиперфункции мочевого пузыря, включающий введение терапевтически эффективного количества гранул по любому из пп.8-15.
20. Способ по п.19, где активный ингредиент представляет собой толтеродин или его фармакологически приемлемую соль.
21. Способ лечения никтурии, включающий введение терапевтически эффективного количества гранул по любому из пп.8-15.
22. Способ по п.21, где активный ингредиент представляет собой толтеродин или его фармацевтически приемлемую соль.
23. Способ лечения желудочно-кишечных расстройств, включающий введение терапевтически эффективного количества гранул по любому из пп.8-15.
Текст
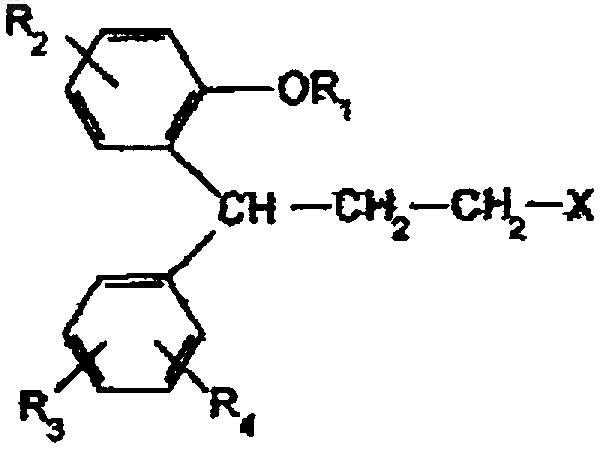
1 Настоящее изобретение относится к фармацевтическим гранулам с контролируемым высвобождением, включающим лекарственное средство, к композиции, содержащей указанные гранулы с контролируемым высвобождением, и к способу получения указанных гранул. Обычный тип гранул с контролируемым высвобождением включает инертное ядро, такое как сахарная сфера, покрытое содержащим лекарственное средство внутренним слоем, и внешний мембранный слой, управляющий высвобождением лекарственного средства из внутреннего слоя. Пример таких гранул с контролируемым высвобождением описывается в US-A-5783215,где каждая гранула включает (i) единицу ядра из растворимого или нерастворимого инертного материала, (ii) первый слой на единице ядра,содержащий активный ингредиент, диспергированный в гидрофильном полимере, (iii) необязательный второй слой из гидрофильного полимера, покрывающий первый слой, и (iv) наиболее удаленный от центра мембранный слой, эффективный для контролируемого высвобождения активного ингредиента. В вышеописанных и аналогичных гранулах с контролируемым высвобождением не является необычным наносить "изолирующее покрытие" в форме небольшого количества (например, 1-3%) водорастворимого полимера,такого как гидроксипропилметилцеллюлоза(ГПМЦ) или поливинилпирролидон (ПВП), между инертным ядром и содержащим активный ингредиент слоем. Его цель, как правило, состоит в изолировании лекарственного средства от поверхности ядра в случае, если возможно химическое взаимодействие лекарственного средства с ядром, и/или чтобы выровнять поверхность инертного ядра так, чтобы площадь поверхности была более вязкой от партии к партии, чтобы посредством этого улучшить качество покрытия, когда наносятся слой лекарственного средства и мембранные слои для контролируемого высвобождения. В соответствии с настоящим изобретением неожиданно было обнаружено, что, нанося относительно толстый слой не растворимого в воде полимера на инертное ядро в качестве изолирующего покрытия, можно получить, кроме вышеупомянутого, дополнительное преимущество. Прежде всего, например, в случае растворимого ядра, подобного ядру из сахара, количество времени, в течение которого раствор внутри гранулы насыщался бы лекарственным средством, можно максимально увеличить. Таким образом, предотвращая превращение растворимого ядра в резервуар для растворения лекарственного средства, можно было бы значительно увеличить относительное время нахождения насыщенного раствора внутри гранулы в течение периода высвобождения. Это значит, что будет получена в значительной степени более 2 длинная фаза высвобождения лекарственного средства нулевого порядка (фаза, когда скорость высвобождения лекарственного средства является, по существу, постоянной, и меньшая фаза нежелательного понижения скорости высвобождения). Другими словами, как правило, использование толстого слоя изолирующего покрытия будет позволять изменять профиль высвобождения лекарственного средства предсказуемым образом, в частности для лекарственных средств с растворимостью в воде от умеренной до высокой. Кроме того, без миграции лекарственного средства в изолирующее покрытие все лекарственное средство будет высвобождено. Во-вторых, можно свести к минимуму потенциальное влияние вещества ядра на высвобождение лекарственного средства, в частности осмотическое давление или набухание вещества ядра, которое могло бы потенциально вызвать внутреннее давление и разрыв пленки. В-третьих, существенная начальная фаза запаздывания (отсутствие или незначительное высвобождение лекарственного средства на ранней стадии), которое обычно наблюдается в гранулах с контролируемым высвобождением из предшествующего уровня техники, особенно для композиций более медленного высвобождения, где приток воды является более медленным, может быть значительно уменьшена или исключена относительно независимо от равновесного состояния скорости высвобождения. Следовательно, в первом аспекте настоящее изобретение предоставляет гранулу с контролируемым высвобождением, включающую(i) единицу ядра из, по существу, водорастворимого или набухающего в воде инертного материала;(ii) первый слой на единице ядра из, по существу, нерастворимого в воде полимера;(iii) второй слой, покрывающий первый слой и содержащий активный ингредиент; и(iv) третий слой на втором слое из полимера, эффективного для контролируемого высвобождения активного ингредиента, где указанный первый слой адаптируют для управления проникновением воды в ядро. Используемый выше термин "управление проникновением воды в ядро" означает, что приток воды к ядру следует задерживать контролируемым способом до такой степени, чтобы профиль высвобождения лекарственного средства изменялся предсказуемым образом. Таким образом, в то время, как во многих случаях может быть предпочтительным, чтобы проникновение воды в ядро в значительной степени или полностью исключалось, в других случаях может быть приемлем определенный, контролируемый приток воды в ядро. Вышеупомянутый первый слой не растворимого в воде вещества также может служить 3 для обеспечения механической целостности ядра. Необязательно, вышеуказанный третий слой, или слой, контролирующий высвобождение, покрывают одним или более дополнительными слоями растворимого или не растворимого в воде полимера, например нетермопластичным растворимым полимером для уменьшения липкости гранул при последующей переработке,такой как отверждение и заполнение в капсулы,или вторичным функциональным покрытием,таким как энтеросолюбильное покрытие, которое задерживает начало высвобождения лекарственного средства. Необязательно, такой дополнительный слой может содержать лекарственное средство для немедленного высвобождения. Обычно вышеуказанный первый слой (ii) составляет более чем примерно 2% (маc./маc.) от окончательной композиции гранулы, предпочтительно более чем примерно 3% (маc./маc.),например от примерно 3 до примерно 80%(маc./маc.). Количество вышеуказанного второго слоя(iii) обычно составляет от примерно 0,05 до примерно 60% (маc./маc.), предпочтительно от примерно 0,1 до примерно 30% (маc./маc.) от окончательной композиции гранулы. Количество вышеуказанного третьего слоя(iv) обычно составляет от примерно 1 до примерно 50% (маc./маc.), предпочтительно от примерно 2 до примерно 25% (маc./маc.) от окончательной композиции гранулы. Единица ядра обычно имеет размер в диапазоне от примерно 0,05 до примерно 2 мм. Во втором аспекте настоящее изобретение предлагает композицию из множества единиц,включающую указанные гранулы с контролируемым высвобождением, такую как капсула или таблетка. Ядра предпочтительно представляют собой водорастворимое или набухающее в воде вещество и могут являться любым таким веществом, которое традиционно используют в качестве ядер, или любым другим фармацевтически приемлемым водорастворимым или набухающим в воде веществом, из которого изготовлены гранулы или шарики. В частности, гранулы представляют собой сферы сахарозы/крахмала(Sugar Spheres NF), кристаллы сахарозы или экструдированные и высушенные сферы, типично состоящие из наполнителей, таких как микрокристаллическая целлюлоза и лактоза. По существу, не растворимое в воде вещество в первом слое или слое изолирующего покрытия обычно представляет собой "GI нерастворимый" или "GI частично нерастворимый" пленкообразующий полимер (латекс или растворенный в растворителе). В качестве примеров можно указать этилцеллюлозу, ацетат целлюлозы, целлюлозаацетатбутират, полиметакрилаты, такие как сополимер этилакри 005074 4 лат/метилметакрилат (Eudragit NE-30-D), и аммонийметакрилатный сополимер типов А и В(Eudragit RL30D и RS30D), и кремнийсодержащие эластомеры. Обычно вместе с полимером используют пластификатор. Примеры пластификаторов включают дибутилсебацат, пропиленгликоль, триэтилцитрат, трибутилцитрат,касторовое масло, ацетилированные моноглицериды, ацетилтриэтилцитрат, ацетилбутилцитрат, диэтилфталат, дибутилфталат, триацетин,фракционированное масло кокосового ореха(триглицериды со средней длиной цепи). Второй слой, содержащий активный ингредиент, может состоять из активного ингредиента (лекарственного средства) с полимером или без полимера в качестве связующего вещества. Связующее вещество, когда оно используется, обычно является гидрофильным, но может быть растворимым или не растворимым в воде. Примерами полимеров, которые можно использовать в содержащем активное лекарственное средство втором слое, являются гидрофильные полимеры, такие как поливинилпирролидон(ПВП), полиалкиленгликоль, такой как полиэтиленгликоль, желатин, поливиниловый спирт,крахмал и его производные, производные целлюлозы, такие как гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, карбоксиэтилцеллюлоза,карбоксиметилгидроксиэтилцеллюлоза, полимеры акриловой кислоты, полиметакрилаты или другие фармацевтически приемлемые полимеры. В сочетании с настоящим изобретением можно использовать широкое разнообразие терапевтически активных веществ. В то время как терапевтический агент обычно представляет собой лекарственное средство с низкой или средней дозой, для использования в настоящем изобретении можно также рассматривать лекарственные средства с высокой дозой. Терапевтический агент предпочтительно представляет собой растворимое или умеренно водорастворимое лекарственное средство (например,имеющее растворимость, соответствующую растворимости от менее чем 1 до примерно 30 мл воды на грамм растворенного вещества при температуре между 15 и 25 С). Отношение лекарственного средства к гидрофильному полимеру во втором слое обычно находится в диапазоне от 1:100 до 100:1(мас./мас.). Подходящие полимеры для использования в третьем слое, или мембране, для управления высвобождением лекарственного средства можно выбрать из не растворимых в воде полимеров или из полимеров с растворимостью, зависящей от рН, таких как, например, этилцеллюлоза,гидроксипропилметилцеллюлозафталат, целлюлозаацетатфталат, целлюлозаацетаттримеллитат, полиметакрилаты, или их смесей, необяза 5 тельно, объединенных с пластификаторами,такими как вышеуказанные. Необязательно,слой контролируемого высвобождения включает, в добавление к вышеуказанным полимерам,другое(ие) вещество(ва) с другими характеристиками растворимости, чтобы регулировать проницаемость и, посредством этого, скорость высвобождения слоя, управляющего высвобождением. Примеры полимеров, которые можно использовать в качестве модификаторов, например, вместе с этилцеллюлозой включают ГПМЦ, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, карбоксиметилцеллюлозу, полиэтиленгликоль, поливинилпирролидон (ПВП), поливиниловый спирт, полимеры с растворимостью, зависящей от рН,такие как целлюлозаацетатфталат или аммонийметакрилатный сополимер и сополимер метакриловой кислоты, или их смеси. Также в слой для контролируемого высвобождения могут включаться добавки, такие как сахароза,лактоза и поверхностно-активные вещества фармакологических сортов, если это желательно. В третьем аспекте настоящее изобретение предлагает способ изготовления гранул с контролируемым высвобождением и композицию соответственно. Этот способ включает следующие стадии:a) получение единицы ядра из, по существу, водорастворимого или набухающего в воде вещества;b) нанесение на указанное ядро первого слоя, по существу, не растворимого в воде полимера;c) нанесение на указанный первый слой второго слоя, включающего активный ингредиент и, необязательно, полимерное связующее вещество; иd) нанесение на указанный второй слой третьего полимерного слоя, эффективного для контролируемого высвобождения активного ингредиента; где количество вещества в указанном первом слое выбирают так, чтобы обеспечить толщину слоя, которая позволяет управлять проникновением воды в ядро. Необязательно, способ включает дополнительную стадию нанесения одного или более дополнительных полимерных слоев на ядро, как было указано выше. Приготовление композиции из множества единиц включает дополнительную стадию превращения приготовленных гранул в фармацевтическую композицию, такую как заполнение капсулы предварительно определенным количеством гранул или прессование гранул в таблетки. Операции нанесения слоев или покрытия предпочтительно осуществляют распылением раствора или дисперсии соответствующих материалов слоя на ядро, предпочтительно в аппаратуре для покрытия из псевдоожиженного слоя. 6 После заключительной стадии нанесения покрытия, гранулы, необязательно, "отверждают", обычно в системе псевдоожиженного слоя или в системе сушильного подноса, например,нагревая до температуры примерно 30-80 С, в течение от 30 до 180 мин. Соответственно, гранулы затем охлаждают до температуры ниже примерно 35 С перед окончанием процесса. Фармацевтическая композиция по настоящему изобретению может вводиться перорально. Являющийся примером класс соединений,которые можно использовать в качестве активных ингредиентов в настоящем изобретении,включает 3,3-дифенилпропиламины, описанные в US-A-5382600, US-A-5559269 и US-A-5686464(полные описания которых включаются в заявку в качестве ссылки) и имеющие общую формулу где R1 обозначает водород или метил; R2, R3 иR4 независимо обозначают водород, метил, метокси, гидроксил, гидроксиметил, карбамоил,сульфамоил или галоген; и Х представляет третичную аминогруппу -NR5, R6, где R5 и R6 обозначают неароматические гидрокарбильные группы, которые могут быть одинаковыми или различными, особенно C1-6 алкил или адамантил,и которые вместе содержат, по меньшей мере, 3,предпочтительно, по меньшей мере, 4 атома углерода, причем каждый из них может нести гидроксильный заместитель, и где R5 и R6 могут образовывать кольцо вместе с атомом азота амина, предпочтительно неароматическое кольцо, не имеющее гетероатома другого, кроме азота амина, их соли с физиологически приемлемыми кислотами и, когда соединения могут быть в форме оптических изомеров, рацемическую смесь и индивидуальные энантиомеры. Примером конкретного соединения является толтеродин, т.е. (R)-N,N-диизопропил-3-(2 гидрокси-5-метилфенил)-3-фенилпропанамин, а также его соответствующий (S)-энантиомер,рацемат и активные 5-гидроксиметильные метаболиты, формы пролекарства и фармацевтически приемлемые соли. Полезные аналоги вышеуказанных соединений описываются в WO 98/43942 (полное описание которого включается в заявку в качестве ссылки). Описанные выше, а также впоследствии,соединения имеют антихолинергическую активность и могут использоваться для лечения,помимо прочего, мочевых расстройств, включая повышенную активность мочевого пузыря. Состояние повышенной активности мочевого пузыря приводит к частоте мочеиспускания, неотложному и/или побудительному недержанию 7 мочи. Расстройства, связанные с повышенной активностью мочевого пузыря, также включают никтурию, т.е. просыпание ночью для мочеиспускания. В то время как повышенная активность мочевого пузыря часто связана с подвижностью мышцы детрузора, расстройства функции мочевого пузыря также могут обусловливаться заболеванием центральной нервной системы (гиперрефлексия детрузора), включая поражения спинного мозга и головного мозга, такие как рассеянный склероз и удар. Симптомы повышенной активности мочевого пузыря также могут быть результатом, например, непроходимости выходного отверстия мочевого пузыря у мужчин (обычно из-за гипертрофии простаты),внутритканевого цистита, местного отека и раздражения из-за очагового рака мочевого пузыря,радиационного цистита вследствие радиотерапии таза и цистита. Соединения также имеют спазмолитическую активность и могут быть полезными для лечения желудочно-кишечных расстройств, включая желудочно-кишечную гиперфункцию. Конкретно, гранулы и, соответственно,композиции из множества единиц по настоящему изобретению оказались очень удобными для введения вышеуказанного лекарственного средства толтеродина, химическое название которого (R)-N,N-диизопропил-3-(2-гидрокси-5-метилфенил)-3-фенилпропанамин, и подобным образом были бы подходящими для его родственных соединений, т.е. главного, активного метаболита толтеродина, т.е. (R)-N,N-диизопропил-3-(2-гидрокси-5-гидроксиметилфенил)-3-фенилпропанамина; соответствующего (S)-энантиомера толтеродина, т.е. (S)-N,N-диизопропил-3-(2-гидрокси-5-метилфенил)-3-фенилпропанамина; 5-гидроксиметильного метаболита (S)-энантиомера,т.е. (S)-N,N-диизопропил-3-(2-гидрокси-5-гидроксиметилфенил)-3-фенилпропанамина; а также соответствующего рацемата толтеродина, т.е.(R,S)-N,N-диизопропил-3-(2-гидрокси-5-метилфенил)-3-фенилпропанамина; и их форм пролекарства и фармакологически приемлемых солей. Толтеродин поставляется для лечения нестабильного мочевого пузыря или его гиперфункции с симптомами, включающими недержание мочи, неотложное и побудительное недержание мочи. Вышеуказанный 5-гидроксиметильный метаболит толтеродина вносит значительный вклад в терапевтический эффект толтеродина. Характерная черта толтеродина заключается в том, что он имеет значительно меньше побочных эффектов, чем обычно использовавшееся ранее лекарственное средство,оксибутинин, особенно что касается предрасположенности вызывать сухость во рту. Когда толтеродин является активным ингредиентом в грануле с контролируемым высвобождением, доля активного ингредиента,которая высвобождается in vitro, предпочтительно равна не более чем примерно 30% после 8 1 ч, примерно от 40 до примерно 85% после 3 ч и не менее чем примерно 80% после 7 ч. Введение композиции с контролируемым высвобождением по настоящему изобретению дает возможность хорошо управлять высвобождением толтеродина и, таким образом, у пациента поддерживается, по существу, постоянный уровень активной составляющей или составляющих в сыворотке крови в течение по меньшей мере 24 ч. Термин "активная составляющая или составляющие" означает, в случае толтеродина и его родственных соединений, сумму свободных или несвязанных (т.е. не связанных белком) концентраций (i) толтеродина и его активных метаболитов, когда вводят толтеродин (или форму пролекарства); или (ii) толтеродина и его активного метаболита и/или (S)-энантиомера толтеродина и его активного метаболита, когда вводят соответствующий рацемат (или форму пролекарства); или (iii) активного метаболита,когда вводят (R)-5-гидроксиметильный метаболит толтеродина (или форму пролекарства); или(или пролекарство); или (v) (S)-активного метаболита, когда вводят (S)-5-гидроксиметильный метаболит. Термин "по существу, постоянный" в отношении уровня активной составляющей или составляющих в сыворотке, означает, что профиль в сыворотке после приема композиции с контролируемым высвобождением, по существу, не показывает каких-либо пиковых значений. Это также можно выразить математически с ссылкой к "индексу флуктуации" (FI) для концентрации в сыворотке (несвязанной) активной составляющей (или суммы активных составляющих, когда это уместно), где индекс флуктуации FI вычисляют какFI=(Cmax-Cmin)/AUC/ где Сmах и Сmin представляют собой максимум и минимум концентраций активной составляющей, соответственно, AUC представляет собой площадь под профилем концентрации в сыворотке (кривая концентрация от времени) иявляется продолжительностью интервала между приемами лекарства в течение времени . Композиция с контролируемым высвобождением по настоящему изобретению легко позволяет получить средний индекс флуктуации (для n, равного по меньшей мере 30), который не выше, чем примерно 2,0, более предпочтительно не выше, чем примерно 1,5, в особенности не выше, чем примерно 1,0, например не выше, чем примерно 0,8. Для толтеродина и его 5-гидроксиметильного метаболита 24-часовое воздействие, выраженное как AUC несвязанной активной составляющей (толтеродин плюс метаболит), обычно находится в диапазоне от примерно 5 до примерно 150 нМч, предпочтительно от примерно 9 10 до примерно 120 нМч, в зависимости от необходимой для конкретного пациента дозировки. Показанные пределы основываются на вычислении несвязанных концентраций активной составляющей, предполагая несвязанную долю 3,7% для толтеродина и 36% для 5-гидроксиметильного метаболита (Nilvebrant, L., et al., LifeSciences, Vol.60, Nos.13/14 (1997) 1129-1136). Соответственно, для толтеродина и его 5 гидроксиметильного метаболита средние несвязанные уровни активной составляющей (толтеродин плюс метаболит) в сыворотке (крови) или плазме обычно находятся в диапазоне от примерно 0,2 до примерно 6,3 нМ, предпочтительно в диапазоне от примерно 0,4 до примерно 5,0 нМ. Толтеродин, его соответствующий (S)энантиомер и рацемат и их препараты описываются, например, в вышеуказанном US-A5382600. Для описания активного (R)-5-гидроксиметильного метаболита толтеродина (а также(S)-5-гидроксиметильного метаболита), можно сослаться на указанный выше US-A-5559269.(S)-энантиомер, его нехолинергическая спазмолитическая активность и использование при лечении мочевых и желудочно-кишечных расстройств описываются в WO 98/03067. Далее изобретение будет описано более подробно следующими неограничивающими примерами. Будет сделана ссылка к сопровождающим фигурам, где фиг. 1 представляет собой диаграмму, показывающую долю высвободившегося лекарства во времени для гранул толтеродина по примеру 1, приведенному ниже, с различной толщиной изолирующего покрытия; и фиг. 2 представляет собой диаграмму, показывающую долю высвободившегося лекарства во времени для гранул толтеродина по примеру 1, приведенному ниже, с 14% (мас./мас.) и 0% (мас./мас.) изолирующего покрытия соответственно. Состав полимера в третьем слое гранул с 0% изолирующего покрытия отрегулировали так, чтобы обеспечить приблизительно одинаковое начальное высвобождение лекарственного средства, как из гранул с 14% изолирующего покрытия. Пример 1. Служащая в качестве примера гранула, содержащая толтеродин L-тартрат в качестве активного ингредиента, имеет следующую структуру. Ядро: содержащая крахмал сахарная сфера с диаметром около 0,8 мм (коммерчески доступная); составляет 73% мас./мас. окончательной гранулы; цель: подложка для покрытия. Первый слой: Surelease "изолирующее покрытие" (Surelease представляет собой водную дисперсию пленочного покрытия, примерно 25% твердых веществ, состоящую, в основном, из этилцеллюлозы, пластифицированной фракционированным маслом кокосового ореха,и производимую Colorcon, Inc, USA); составляет 10 примерно 12% маc./маc. окончательной гранулы; цель: обеспечить более вязкую поверхность ядра; в течение фазы высвобождения лекарственного средства увеличивает до предела время,в течение которого лекарственное средство насыщается внутри гранулы, и сводит к минимуму осмотические эффекты; управляет скоростью высвобождения лекарственного средства вместе с третьим слоем. Второй слой: толтеродин L-тартрат/гидроксипропилметилцеллюлоза (ГПМЦ); составляет около 3% мас./мас. окончательной гранулы; отношение толтеродин:ГПМЦ равно 5:1; цель: поставка лекарственного средства. Третий слой: Surеlеаsе/ГПМЦ; составляет примерно 12% маc./маc. окончательной гранулы; отношение Surelease:ГПМЦ равно 6:1; цель: управление скоростью высвобождения лекарственного средства. Гранулы с трехслойным покрытием,имеющие приведенные выше характеристики,готовят следующим образом. 1200 г сахарных сфер, 20-25 меш, загружают в псевдоожиженный слой Wurster и затем покрывают при номинальной температуре продукта от 36 до 40 С следующими тремя жидкостями покрытия:(2) содержащим лекарственное средство раствором, приготовленным сначала растворением 35,0 г толтеродин L-тартрата в 2190 г очищенной воды и затем смешиванием раствора с 6,6 г гидроксипропилметилцеллюлозы(3) жидкостью покрытия для пролонгированного высвобождения, приготовленной смешиванием 29 г ГПМЦ 5 сП (510-3 Пас) с 375 г очищенной воды и затем смешиванием с 695 гSurelease. После сушки в сушильном подносе в течение 3 ч при 70 С покрытыми сферами заполняют желатиновые капсулы размера 4 или размера 3, чтобы получить 2 или 4 мг капсулы толтеродин L-тартрата, соответственно, состава 2 мг 4 мг капсулы капсулы Толтеродин L-тартрат 2,0 мг 4,0 мгSurelease 21,2 мг 42,4 мг 2,0 мг 4,0 мг ГПМЦ 5 сП; (510-3 Пас) Необязательно, перед сушкой на гранулу можно нанести четвертый слой покрытиемWurster. Четвертый слой: ГПМЦ; составляет примерно 1% (маc./маc.) окончательной гранулы; цель: уменьшение прилипания гранул для последующей переработки (отверждение и заполнение капсулы). 11 В случае вышеописанной гранулы, такой четвертый слой можно наносить раствором покрытия, приготовленным растворением 16,4 г ГПМЦ в 234 г воды. Изучение влияния толщины изолирующего покрытия Влияние толщины изолирующего покрытия на высвобождение лекарственного средства исследовали следующим образом. Готовили четыре партии гранул 20-25 меш, которые включали (i) слой изолирующего покрытия Surelease с уровнем 0, 2, 10 или 14%,(ii) слой ГПМЦ/лекарственное средство (толтеродин L-тартрат) с 4% уровнем (отношение лекарственное средство/ГПМЦ=5:4), (iii) слой Surеlеаsе/ГПМЦ с 10% уровнем (отношениеSurelease:ГПМЦ 6:1) и (iv) последний слой ГПМЦ с уровнем 1%. Гранулы готовили, по существу, также, как описано выше, и отверждали в течение 1 ч при 70 С. Следует обратить внимание, что уровень покрытия для слоя (i) выражают относительно суммы ядро плюс изолирующее покрытие, в то время как уровень покрытия для слоев (ii-iv) выражают относительно окончательной массы покрытой гранулы. Пятую партию гранул также изготавливали идентичной вышеописанной партии с 0% изолирующего покрытия, за исключением того,что модифицировали третий слой покрытия(увеличение в слое Surelease:ГПМЦ от 6:1 до 11:1) так, чтобы начальная скорость высвобождения лекарственного средства была аналогичной скорости для вышеописанной композиции с 14% изолирующим слоем. Измеряли высвобождение лекарственного средства in vitro при 37 С в фосфатном буфере рН 6,8 с добавлением 0,22 М хлорида калия. Использовали прибор 1 для испытания растворения в соответствии с Фармакопеей США. Результаты показаны на диаграммах на фиг. 1 и 2. Как показано на фиг. 1, при увеличении толщины слоя изолирующего покрытия скорость высвобождения лекарственного средства замедляется, а также становится более близкой к нулевому порядку. Фиг. 2 показывает сравнение композиции с 0% изолирующего покрытия (11:1 Surelease: ГПМЦ) и композиции с 14% изолирующим слоем (6:1 Surelease:ГПМЦ). Можно увидеть, что после небольшого периода запаздывания, наблюдаемого у гранул с 0% изолирующего слоя,начальные скорости высвобождения лекарственного средства являются похожими. Однако после приблизительно 15-20% высвобождения лекарственного средства скорость высвобождения из гранул с 0% изолирующего слоя падает,в то время как скорость высвобождения из 14% изолирующего покрытия остается экстремально нулевого порядка. Действительно, для гранул с 0% изолирующего покрытия скорость высвобождения между 45-60% равна приблизительно 12 только половине начальной скорости высвобождения (первые 20%). При сравнении, для партии с 14% изолирующим покрытием скорость высвобождения в диапазоне между 45-60% является идентичной скорости в течение первых 20%. Аналогично процедуре, описанной выше в примере 1, другие примеры композиций, содержащих толтеродин-L-тартрат в качестве активного ингредиента, готовили, как описано в примерах 2 и 3 ниже. Пример 2. 400 г сахарных сфер (20-25 меш, EdwardMendell Co, USA) загружали в машину для нанесения покрытия в пседоожиженном слое с верхним распылением (Nica, Sweden), и покрывали Surelease, и затем отверждали в сушильной камере при 70 С в течение 5 ч. На покрытые ядра напыляли раствор толтеродин-L-тартрата и гидроксипропилцеллюлозы (ГПЦ) в воде. Полученные сферы затем покрывали смесью этилцеллюлозы, гидроксипропилцеллюлозы и триэтилцитрата (пластификатор). Вещества покрытия растворяли в смеси дихлорметана и этанола. Полученные в результате гранулы имели следующий состав, выраженный в % (маc./маc.): Сахарные сферы 75,7Surelease 13 Толтеродин L-тартрат 4,9 ГПЦ 1,5 Этилцеллюлоза 4,3 Триэтилцитрат 0,6 Полученные сферы показали пролонгированное высвобождение толтеродин L-тартрата в течение по меньшей мере 10 ч. Скорость высвобождения была, по существу, постоянной. Пример 3. 4800 г сахарных сфер (18-20 меш, Mendell,USA) покрывали Surelease в псевдоожиженном слое Wurster до теоретического привеса 10% и затем отверждали в сушильной камере при 60 С в течение 6 ч. На 1200 г покрытых сферических ядер напыляли раствор толтеродин L-тартрата и гидроксипропилметилцеллюлозы (ГПМЦ) в воде. 1000 г полученных сфер затем покрывали с помощью распыления водной дисперсии сшитого латекса полидиметилсилоксана с блокированными концевыми гидроксилами (PDMS, DowCorning; USA) до теоретического привеса 15%. Полученные в результате гранулы имели следующий состав, выраженный в % (маc./маc.): Сахарные сферы 76 13 Полученные сферы показали пролонгированное высвобождение толтеродин L-тартрата в течение по меньшей мере 11 ч. Скорость высвобождения была примерно постоянной. В то время как изобретение было описано выше со ссылкой на его конкретные варианты реализации, оно ни в коей мере не ограничивается ими. Наоборот, как будет понято специалистами в данной области, могут быть сделаны различные изменения, модификации, замены и изъятия без отклонения от основной концепции изобретения, как определено в формуле изобретения, которая следует далее. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гранула с контролируемым высвобождением, включающая(i) единицу ядра, по существу, из водорастворимого или набухающего в воде инертного материала;(ii) первый слой на единице ядра, по существу, из не растворимого в воде полимера, где количество первого слоя составляет более чем 2 мас.% от количества окончательной композиции гранулы;(iii) второй слой, покрывающий первый слой и содержащий активный ингредиент, выбранный из 3,3-дифенилпропиламинов; и(iv) третий слой полимера на втором слое,эффективный для контролируемого высвобождения активного ингредиента, где указанный первый слой обеспечивает регулирование проникновения воды в ядро. 2. Гранула по п.1, в которой количество полимера в указанном первом слое является достаточным, чтобы в значительной степени задержать проникновение воды в ядро. 3. Гранула по п.1 или 2, в которой толщина указанного первого слоя является достаточной,чтобы воздействовать на скорость высвобождения лекарственного средства из гранулы. 4. Гранула по пп.1, 2 или 3, в которой количество первого слоя составляет более чем 3%(мас./мас.) окончательной композиции гранулы. 5. Гранула по любому из пп.1-4, в которой количество указанного второго слоя обычно составляет от примерно 0,05 до примерно 60%(мас./мас.), предпочтительно от примерно 0,1 до примерно 30% (мас./мас.) окончательной композиции гранулы. 6. Гранула по любому из пп.1-5, в которой количество указанного третьего слоя обычно составляет от примерно 1 до примерно 50%(мас./мас.), предпочтительно от примерно 2 до примерно 25% (мас./мас.) окончательной композиции гранулы. 7. Гранула по любому из пп.1-6, в которой указанный третий полимерный слой покрывают четвертым слоем водорастворимого полимера или дополнительным функциональным покрытием. 14 8. Гранула по любому из пп.1-7, в которой указанный активный ингредиент выбирают из соединений, имеющих общую формулу где R1 обозначает водород или метил; R2, R3 иR4 независимо обозначают водород, метил, метокси, гидроксил, гидроксиметил, карбамоил,сульфамоил или галоген; и Х представляет третичную аминогруппу -NR5, R6, где R5 и R6 обозначают неароматические гидрокарбильные группы, которые могут быть одинаковыми или различными, особенно С 1-6 алкил или адамантил,и которые вместе содержат по меньшей мере 3,предпочтительно по меньшей мере 4 атома углерода, причем каждый из них может нести гидроксильный заместитель, и где R5 и R6 могут образовывать кольцо вместе с атомом азота амина, предпочтительно неароматическое кольцо, не имеющее другого гетероатома, кроме азота амина, их солей с физиологически приемлемыми кислотами и когда соединения могут быть в форме оптических изомеров, рацемической смеси и индивидуальных энантиомеров. 9. Гранула по п.8, в которой указанный активный ингредиент выбирают из толтеродина,5-гидроксиметильного метаболита толтеродина,(S)-энантиомера толтеродина, 5-гидроксиметильного метаболита (S)-энантиомера толтеродина, рацемата толтеродина и их форм пролекарства и фармакологически приемлемых солей. 10. Гранула по п.9, в которой указанный активный ингредиент представляет собой толтеродин или его фармакологически приемлемую соль. 11. Гранула по п.10, в которой доля активного ингредиента, которая высвобождается invitro, равна не более чем примерно 30% после 1 ч, от примерно 40 до примерно 85% после 3 ч и не менее чем примерно 80% после 7 ч. 12. Гранула по любому из пп.1-11, в которой полимерный материал указанного первого слоя включает этилцеллюлозу. 13. Гранула по любому из пп.1-12, в которой указанный второй слой дополнительно включает гидроксипропилметилцеллюлозу в качестве связующего вещества. 14. Гранула по любому из пп.1-13, в которой полимерный материал указанного третьего слоя включает комбинацию гидроксипропилметилцеллюлозы и этилцеллюлозы. 15. Гранула по любому из пп.1-14, в которой единица ядра имеет размер от примерно 0,05 до примерно 2 мм. 16. Композиция из множества единиц,включающая гранулы с контролируемым высвобождением по любому из пп.1-15. 17. Композиция из множества единиц по п.16, которая представляет собой капсулу. 18. Способ получения гранул с контролируемым высвобождением по пп.1-15, включающий стадииa) получения единицы ядра, по существу,из водорастворимого или набухающего в воде вещества;b) нанесения на указанное ядро относительно толстого первого слоя, по существу, не растворимого в воде полимера для обеспечения изолирующего покрытия;c) нанесения на указанный первый слой второго слоя, включающего активный ингредиент и, необязательно, полимерное связующее вещество; иd) нанесения на указанный второй слой третьего полимерного слоя, эффективного для контролируемого высвобождения активного ингредиента; где количества вещества в указанном первом слое выбирают так, чтобы обеспечить тол 16 щину слоя, которая позволяет управлять проникновением воды в ядро. 19. Способ лечения гиперфункции мочевого пузыря, включающий введение терапевтически эффективного количества гранул по любому из пп.8-15. 20. Способ по п.19, где активный ингредиент представляет собой толтеродин или его фармакологически приемлемую соль. 21. Способ лечения никтурии, включающий введение терапевтически эффективного количества гранул по любому из пп.8-15. 22. Способ по п.21, где активный ингредиент представляет собой толтеродин или его фармацевтически приемлемую соль. 23. Способ лечения желудочно-кишечных расстройств, включающий введение терапевтически эффективного количества гранул по любому из пп.8-15.
МПК / Метки
МПК: A61P 13/10, A61K 9/16
Метки: изготовления, способ, единиц, включающая, множества, композиция, контролируемым, гранула, высвобождением
Код ссылки
<a href="https://eas.patents.su/9-5074-granula-s-kontroliruemym-vysvobozhdeniem-sposob-ee-izgotovleniya-i-vklyuchayushhaya-ee-kompoziciya-iz-mnozhestva-edinic.html" rel="bookmark" title="База патентов Евразийского Союза">Гранула с контролируемым высвобождением, способ ее изготовления и включающая ее композиция из множества единиц</a>
Предыдущий патент: Применение 3-фенил-4-(4-метилсульфонилфенил)-2-(5н)-фуранона для лечения или профилактики аденомы толстой кишки
Следующий патент: Пищевой продукт для поверхностного обжаривания в виде эмульсии на основе воды и масла
Случайный патент: Способ производства концентрата молодого сыра с большой массовой долей сухого вещества, а также предназначенная для этого установка