Способ получения аминокротонильных соединений и лекарственное средство
Номер патента: 16624
Опубликовано: 30.06.2012
Авторы: Шнаубельт Юрген, Калинна Кристиан, Зойка Райнер, Зигер Петер, Ралль Вернер
Формула / Реферат
1. Способ получения соединения общей формулы (VII)
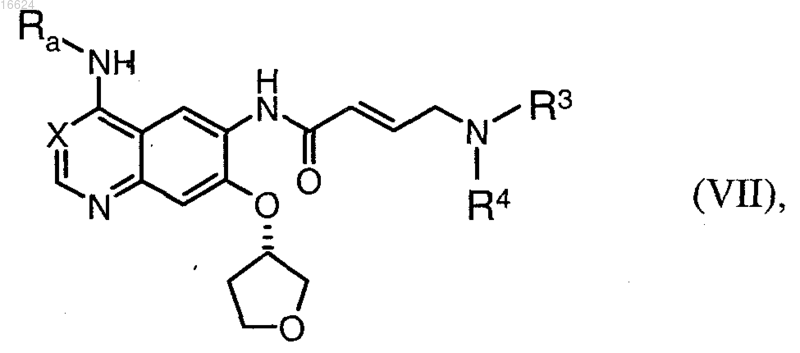
в которой X обозначает метиновую группу или атом азота, Ra обозначает бензильную, 1-фенилэтильную или 3-хлор-4-фторфенильную группу и R3 и R4 обозначают прямую или разветвленную С1-С4алкильную группу, заключающийся в том, что
а) соединение общей формулы (V)
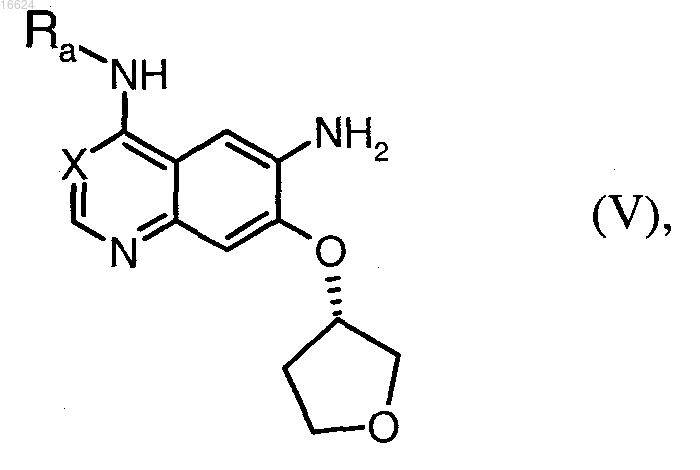
в которой X обозначает метиновую группу или атом азота, Ra обозначает бензильную, 1-фенилэтильную или 3-хлор-4-фторфенильную группу, после активации подвергают в пригодных растворителях взаимодействию с ди-(С1-С4алкил)фосфоноуксусной кислотой и
б) полученное соединение общей формулы (VI)
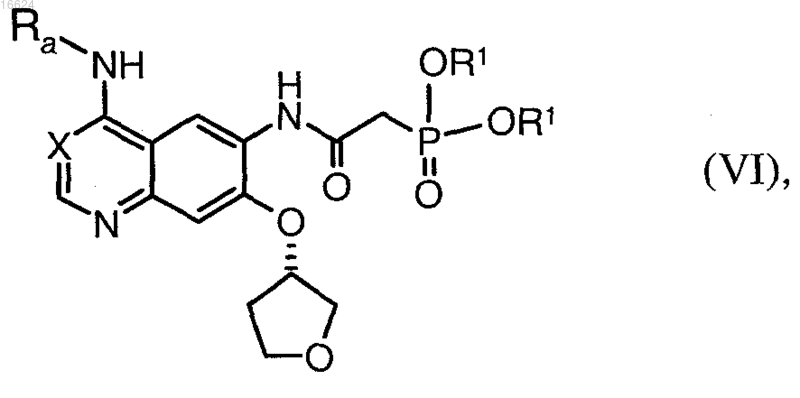
в которой X обозначает метиновую группу или атом азота, Ra обозначает бензильную, 1-фенилэтильную или 3-хлор-4-фторфенильную группу и R1 обозначает прямую или разветвленную С1-С4алкильную группу, подвергают взаимодействию с альдегидом формулы
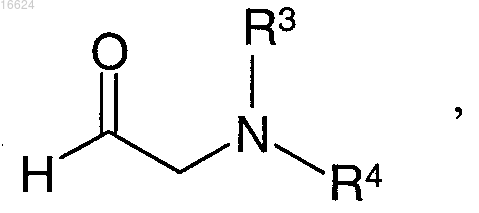
в которой каждый из R3 и R4 обозначает прямую или разветвленную С1-С4алкильную группу, при этом остатки могут быть одинаковыми или разными, или с эквивалентом альдегида, таким как гидрат или ацеталь, с использованием пригодных органических или неорганических оснований.
2. Способ получения 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолина, заключающийся в том, что
а) N4-(3-хлор-4-фторфенил)-7-(тетрагидрофуран-3-илокси)хинозолин-4,6-диамин после активации подвергают в пригодных растворителях взаимодействию с ди-(С1-С4алкил)фосфоноуксусной кислотой и
б) полученный диалкиловый эфир {[4-(3-хлор-4-фторфениламино)-7-((S)-тетрагидрофуран-3-илокси)хиназолин-6-илкарбамоил]метил}фосфоновой кислоты подвергают взаимодействию с альдегидом, полученным in situ из соответствующего (диметиламино)ацетальдегид-диалкилацеталя, с использованием пригодных органических или неорганических оснований.
3. Способ по п.2, в котором на стадии а) в качестве реагента используют диэтилфосфоноуксусную кислоту.
4. Способ по п.1 или 2, отличающийся тем, что на стадии б) в качестве основания используют 1,5-диазабицикло[4.3.0]нон-5-ен (ДБН), гидроксид натрия или гидроксид калия.
5. Способ по п.4, отличающийся тем, что на стадии б) в качестве основания используют гидроксид калия.
6. Способ получения дималеата 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолина, включающий стадии а) и б) способа по п.1, а также стадию в), на которой полученный 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолин переводят в дималеат взаимодействием с малеиновой кислотой в пригодном растворителе при нагревании.
7. Способ по п.6, отличающийся тем, что в качестве растворителя используют этанол или изопропанол, необязательно при добавлении воды.
8. Способ по п.6 или 7, отличающийся тем, что используют по меньшей мере 2 экв. малеиновой кислоты.
9. Дималеат 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолина.
10. Лекарственное средство, содержащее дималеат 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолина и необязательно один или несколько инертных носителей и/или разбавителей.
11. Применение дималеата 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолина для получения лекарственного средства, предназначенного для лечения доброкачественных и злокачественных опухолей, для предупреждения и лечения заболеваний дыхательных путей и легких, а также для лечения заболеваний желудочно-кишечного тракта, желчных путей и желчного пузыря.
Текст
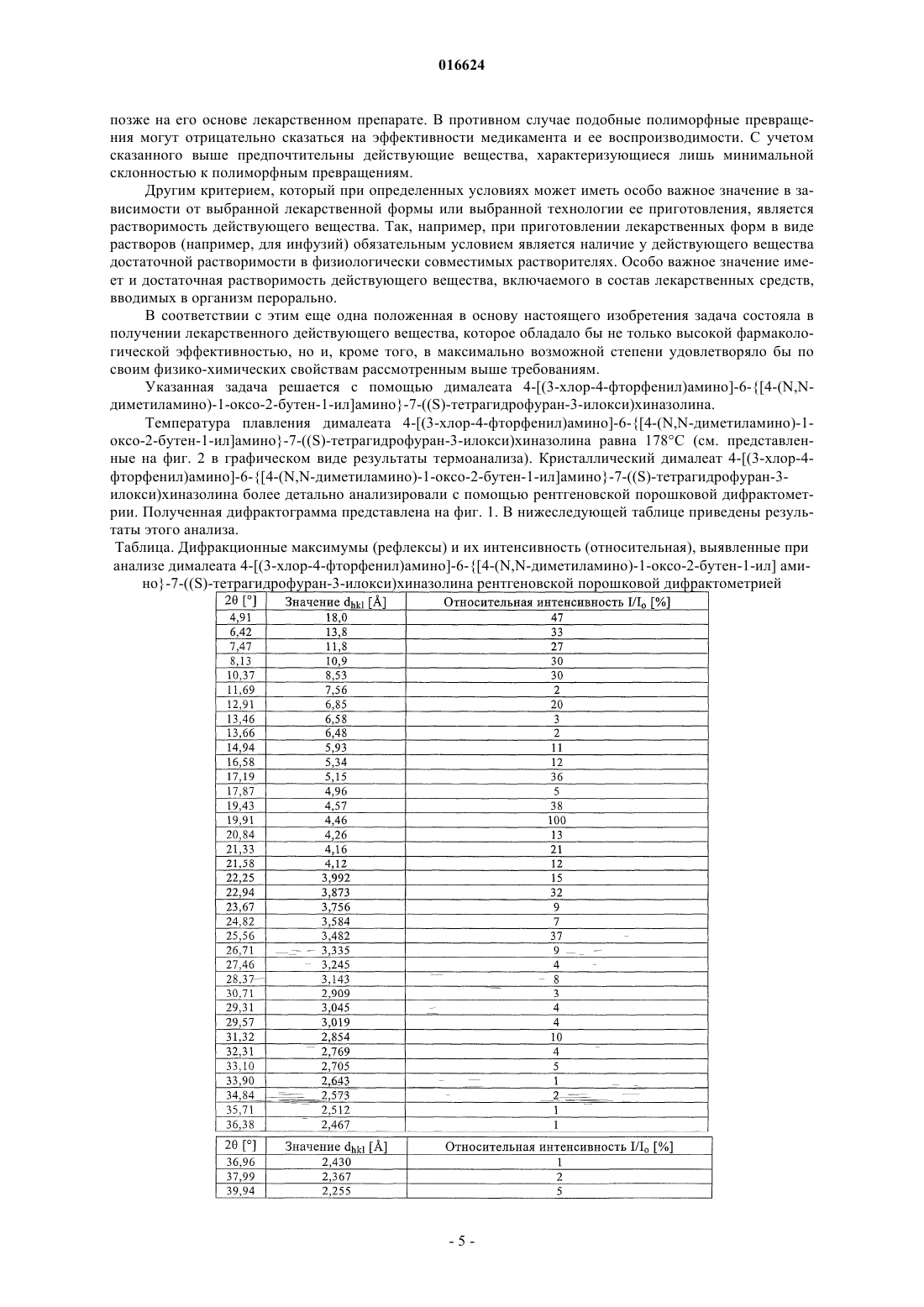
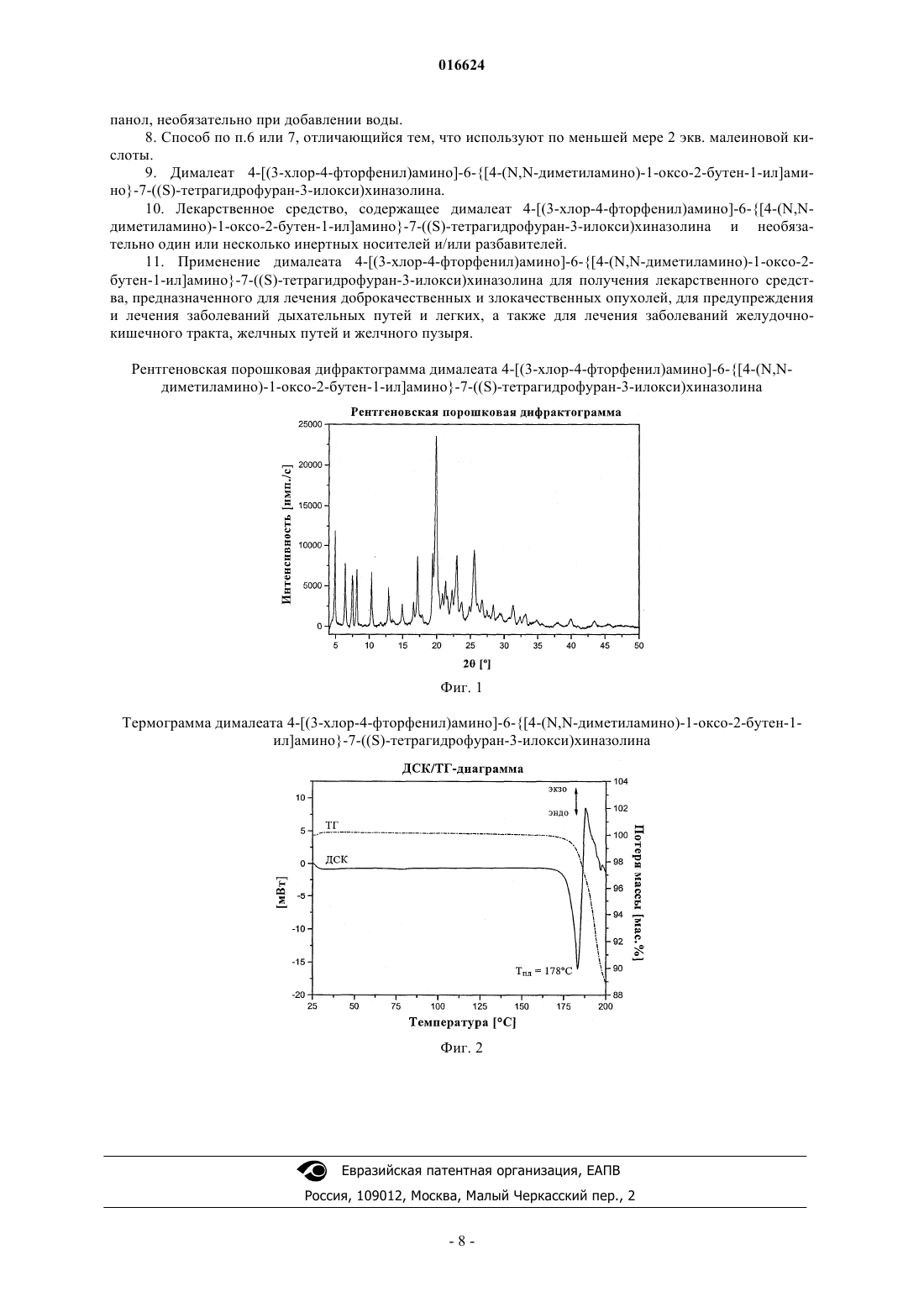
СПОСОБ ПОЛУЧЕНИЯ АМИНОКРОТОНИЛЬНЫХ СОЕДИНЕНИЙ И ЛЕКАРСТВЕННОЕ СРЕДСТВО В патенте описаны усовершенствованный способ получения 4-[(3-хлор-4-фторфенил)амино]-6[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина и родственных аминокротонильных соединений, а также получение соответствующей соли 4-[(3 хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)тетрагидрофуран-3-илокси)хиназолина, предназначенной для применения в качестве действующего вещества в составе лекарственных средств.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) 016624 Изобретение относится к усовершенствованному способу получения аминокротонильных соединений, таких, например, как 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1 ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолин, и их физиологически совместимых солей, прежде всего дималеата 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина, а также к дималеату 4-[(3-хлор-4-фторфенил)амино]6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина и к его применению для получения лекарственных средств. 4-[(3-Хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)тетрагидрофуран-3-илокси)хиназолин имеет следующую структурную формулу: и уже известно из заявки WO 02/50043, где описываются соединения с ценными фармакологическими свойствами, к которым прежде всего относятся ингибирующее действие на опосредуемую тирозинкиназами трансдукцию сигналов и ингибирующее действие на опосредуемую рецептором эпидермального фактора роста (EGF-R) трансдукцию сигналов. Поэтому соединения такого типа пригодны для лечения определенных заболеваний, прежде всего для лечения онкологических заболеваний, заболеваний легких и дыхательных путей, равно как и заболеваний желудочно-кишечного тракта, а также желчных путей и желчного пузыря. В заявке WO 02/50043 предлагается способ получения аминокротонильных соединений (IV), таких,например, как 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7S)-тетрагидрофуран-3-илокси)хиназолин, заключающийся в том, что указанные соединения получают по реакции, проводимой в одном аппарате, из соответствующего анилинового структурного фрагмента Этот способ обеспечивал максимум 50%-ный выход продукта. Кроме того, предусматривалась, как правило, очистка с помощью колоночной хроматографии, поэтому возможность реализации данного способа получения 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина в промышленном масштабе исключалась. Еще один недостаток предложенного подхода состоял в том, что требуемая для его осуществления бромкротоновая кислота не поставляется на рынок в больших количествах, а соответствующий метиловый эфир бромкротоновой кислоты доступен лишь с 80%-ной степенью чистоты. Эти факторы также не позволяют применять способ получения 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил] амино-7-S)-тетрагидрофуран-3-илокси)хиназолина в промышленном масштабе. С учетом вышеописанных недостатков известного способа в основу настоящего изобретения была положена задача предложить способ, который обеспечивал бы получение аминокротонилариламидов,прежде всего 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7S)-тетрагидрофуран-3-илокси)хиназолина, с использованием легкодоступных исходных веществ, с высокой степенью чистоты и без значительных производственных затрат. Таким образом, новый способ предназначается для осуществления синтеза в промышленном масштабе и тем самым для получения коммерчески доступных продуктов. Указанная задача решается с помощью предлагаемого в изобретении способа получения 4-[(3-хлор 4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-1 016624 илокси)хиназолина и других аминокротонильных соединений. Наряду с промышленной применимостью предлагаемого в изобретении синтеза, обеспечивающего высокий выход, к его другим преимуществам следует отнести исключительно высокую химическую чистоту получаемых продуктов и низкое содержание цис-изомеров, составляющее менее 0,1%. Согласно предлагаемому в изобретении способу соответствующее аминоарильное соединение формулы (V) подвергают взаимодействию с ди-(С 1-С 4 алкил)фосфоноуксусной кислотой, предпочтительно с диэтилфосфоноуксусной кислотой, в пригодных для этих целей растворителях, после соответствующей активации, предпочтительно 1,1-карбонилдиимидазолом, 1,1-карбонилдитриазолом или ангидридом пропанфосфоновой кислоты, особенно предпочтительно 1,1-карбонилдиимидазолом, как это показано на схеме 2. В качестве растворителей могут использоваться, например, тетрагидрофуран (ТГФ), диметилформамид (ДМФ) и этилацетат. Активацию можно проводить с использованием всех обычных методов амидного присоединения,т.е., например, с помощью 1,1-карбонилдиимидазола, 1,1-карбонилдитриазола, ДЦК (N,N-дициклогексилкарбодиимида), ДЭК (N'-(диметиламинопропил)-N-этилкарбодиимида), ТБТУ (тетрафторбората О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония), тиазолидин-2-тиона или переводом в соответствующий хлорангидрид кислоты, например, с помощью тионилхлорида. При определенных условиях активацию проводят с использованием органических оснований, таких как триэтиламин или пиридин, при этом дополнительно можно добавлять ДМАП (диметиламинопиридин). В качестве растворителей в этих случаях приемлемы ДМФ, ТГФ, этилацетат, толуол, хлорированные углеводороды либо их смеси. В приведенных ниже формулах заместители имеют следующие значения: X обозначает метиновую группу или атом азота, Ra обозначает бензильную, 1-фенилэтильную или 3-хлор-4-фторфенильную группу и R1 обозначает С 1-С 4 алкильную группу с прямой или разветвленной цепью. Предлагаемый в изобретении способ предпочтительно использовать для получения соединений, в которых X обозначает атом азота, Ra обозначает 3-хлор-4-фторфенильную группу и R1 обозначает этильную группу. Схема 2 а) Ди-(С 1-С 4 алкил)фосфоноуксусная кислота, активатор. Полученный описанным путем с высоким выходом и высокой степенью чистоты ариламид формулы (VI) подвергают по реакции Виттига-Хорнера-Эммонса взаимодействию с 2-аминоацетальдегидом с использованием соответствующих органических или неорганических оснований (схема 3). Эту реакцию можно проводить непосредственно после получения соединения формулы (VI) либо после его выделения, например путем осаждения добавлением, например, трет-бутилметилового эфира. К пригодным для указанной цели основаниям относятся среди прочих ДБН (1,5-диазабицикло[4.3.0]нон-5-ен), гидроксид натрия и гидроксид калия, предпочтительными из которых являются гидроксид натрия и гидроксид калия, особенно предпочтителен гидроксид калия. Вместо альдегида можно использовать также соответствующий эквивалент, например гидрат или ацеталь, из которого альдегид высвобождают (предварительно или in situ). Схема 3 б) Альдегид, основание, ТГФ/вода. В качестве ацеталей могут использоваться, например, соединения следующего общего типа: в которых каждый из R2-R5 обозначает прямоцепочечную или разветвленную С 1-С 4 алкильную группу, при этом такие остатки могут быть идентичными либо разными. В предпочтительном варианте каждый из R3 и R4 обозначает метильную группу, а каждый из R2 и R5 обозначает этильную группу.-2 016624 Полученный описанным путем аминокротонилариламид формулы (VII), например 4-[(3-хлор-4 фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3 илокси)хиназолин формулы (I), можно затем по известной методике переводить в его соли, прежде всего в его физиологически совместимые соли. Предпочтителен перевод в фумараты, тартраты или малеаты. Особенно предпочтительным является дималеат 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина структурной формулы(Ia) и соответственно перевод 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен 1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина в его дималеат, как это показано на схеме 4. С этой целью соединение формулы (I) растворяют в соответствующем растворителе, таком, например, как метанол, изопропанол, н-бутанол или этанол, необязательно с добавлением воды, предпочтительно в этаноле, и при нагревании смешивают с кристаллической малеиновой кислотой либо с раствором малеиновой кислоты. При использовании в качестве растворителя этанола предпочтительно работать при температуре в интервале от 60 до 75 С с использованием раствора малеиновой кислоты в этаноле. Условия реакции целесообразно выбирать с таким расчетом, чтобы обеспечить предельно быстрое выкристаллизовывание требуемой соли. Предпочтительно использовать примерно 2 эквивалента малеиновой кислоты. После начала кристаллизации смесь охлаждают до комнатной температуры, перемешивают и отделяют образовавшийся кристаллизат, представляющий собой соединение формулы (Ia). Схема 4 в) Малеиновая кислота, этанол. Исходное соединение формулы (V) можно получать, например, по следующим методам, известным из литературы. Хинолиновые структурные фрагменты формулы (V), в которой X обозначает СН, можно получать исходя из доступного в качестве коммерческого продукта 3-фтор-6-нитрофенола формулы (XIV) путем алкилирования, обмена атома фтора на аминогруппу и взаимодействием с эфирами этоксиакриловой кислоты, эфирами этоксиметиленциануксусной кислоты или эфирами этоксиметиленмалоновой кислоты(схема 5 а). Затем полученное описанным путем соединение формулы (XVII) переводят в соединение формулы (XVIII), как это показано на схеме 6 на примере аналога хиназолина. Схема 5 а При получении соединения формулы (V), где X обозначает N, работают следующим образом. Исходя из доступной в качестве коммерческого продукта 4-хлорантраниловой кислоты (формулаVIII, X обозначает Cl), взаимодействием с формамидинацетатом получают хиназолинон формулы (IX),который затем нитруют с использованием серной кислоты и концентрированной азотной кислоты (схема 5 б). В другом варианте можно исходить из 4-фторантраниловой кислоты. Схема 5 б-3 016624 г) Формамидин-ацетат. д) H2SO4, HNO3 концентрированная. Требуемый региоизомер формулы (X) полученных описанным путем продуктов нитрования затем хлорируют и продукт хлорирования формулы (XI) подвергают in situ взаимодействию с соответствующим амином (схема 6). Схема 6 е) SOCl2, ацетонитрил. ж) RaNH2. Полученное описанным путем соединение формулы (XII) взаимодействием с (S)-(+)-3 гидрокситетрагидрофураном превращают в соединение формулы (XIII). Последующим гидрированием соединения формулы (XIII), соответственно соединения формулы (XVIII) из схемы 5 а получают исходное соединение формулы (V) (схема 7). Схема 7 з) (S)-(+)-3-Гидрокситетрагидрофуран. и) Н 2. Еще одним объектом изобретения является дималеат 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,Nдиметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина. Эта соль особенно пригодна для применения в фармацевтике, поскольку она существует лишь в одной единственной кристаллической модификации, которая помимо прочего не содержит воды и отличается исключительной стабильностью. Действующее вещество для возможности его фармацевтического применения в качестве лекарственного средства не только должно обладать необходимым действием, но и по многим критериям должно отвечать и иным требованиям. Подобные критерии большей частью связаны с физико-химическими свойствами действующего вещества. В качестве не ограничивающих примеров подобных критериев можно назвать стабильное сохранение исходным веществом своего действия в различных окружающих условиях, в процессе приготовления фармацевтического препарата и в составе конечных лекарственных средств. Поэтому лекарственное действующее вещество, используемое для приготовления лекарственных композиций, должно обладать высокой стабильностью, сохраняющейся даже в различных окружающих условиях. Обязательное соблюдение этого требования обусловлено необходимостью исключить применение лекарственных композиций, в которых наряду с собственно действующим веществом присутствуют, например, и продукты его разложения. В подобном случае содержание действующего вещества в фармацевтических препаратах может оказаться меньше указанного производителем. В результате абсорбции влаги содержание лекарственного действующего вещества уменьшается изза обусловленного поглощением влаги увеличения его массы. Поэтому лекарственные средства, проявляющие склонность к поглощению влаги, необходимо на время хранения защищать от влаги, например,за счет добавления приемлемых осушителей либо хранения лекарственного средства в условиях, в которых он защищен от контакта с влагой. Помимо этого поглощение влаги может привести к уменьшению содержания лекарственного действующего вещества в процессе изготовления фармацевтического препарата, если лекарственное действующее вещество не защищено от контакта с влагой и непосредственно подвергается воздействию факторов окружающей среды. По этой причине лекарственное действующее вещество предпочтительно должно обладать лишь минимально возможной гигроскопичностью. Поскольку для получения лекарственной формы с постоянно воспроизводимым содержанием в ней действующего вещества важное значение имеет его кристаллическая модификация, изначально необходимо получать максимально полную информацию о любом возможном полиморфизме действующего вещества, представленного в кристаллической форме. Если действующее вещество может существовать в различных полиморфных модификациях, то необходимо удостовериться в том, что определенная кристаллическая модификация действующего вещества не претерпит никаких изменений в изготовленном-4 016624 позже на его основе лекарственном препарате. В противном случае подобные полиморфные превращения могут отрицательно сказаться на эффективности медикамента и ее воспроизводимости. С учетом сказанного выше предпочтительны действующие вещества, характеризующиеся лишь минимальной склонностью к полиморфным превращениям. Другим критерием, который при определенных условиях может иметь особо важное значение в зависимости от выбранной лекарственной формы или выбранной технологии ее приготовления, является растворимость действующего вещества. Так, например, при приготовлении лекарственных форм в виде растворов (например, для инфузий) обязательным условием является наличие у действующего вещества достаточной растворимости в физиологически совместимых растворителях. Особо важное значение имеет и достаточная растворимость действующего вещества, включаемого в состав лекарственных средств,вводимых в организм перорально. В соответствии с этим еще одна положенная в основу настоящего изобретения задача состояла в получении лекарственного действующего вещества, которое обладало бы не только высокой фармакологической эффективностью, но и, кроме того, в максимально возможной степени удовлетворяло бы по своим физико-химических свойствам рассмотренным выше требованиям. Указанная задача решается с помощью дималеата 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,Nдиметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина. Температура плавления дималеата 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1 оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина равна 178 С (см. представленные на фиг. 2 в графическом виде результаты термоанализа). Кристаллический дималеат 4-[(3-хлор-4 фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3 илокси)хиназолина более детально анализировали с помощью рентгеновской порошковой дифрактометрии. Полученная дифрактограмма представлена на фиг. 1. В нижеследующей таблице приведены результаты этого анализа. Таблица. Дифракционные максимумы (рефлексы) и их интенсивность (относительная), выявленные при анализе дималеата 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил] амино-7-S)-тетрагидрофуран-3-илокси)хиназолина рентгеновской порошковой дифрактометрией-5 016624 В приведенной выше таблице величина "2 []" обозначает угол дифракции в градусах, а величина"dhkl []" обозначает определенные межплоскостные расстояния в ангстремах []. Для получения рентгеновской порошковой дифрактограммы предлагаемого в изобретении соединения использовали дифрактометр Bruker D8 Advanced, оснащенный позиционно-чувствительным детектором (детектором оптического излучения) и медным анодом в качестве источника рентгеновского излучения (К-излучение меди, = 1,5418 , 40 кВ, 40 мА). Ниже изобретение более подробно поясняется на примерах. Примеры Пример 1. Диэтиловый эфир [4-(3-хлор-4-фторфениламино)-7-S)-тетрагидрофуран-3-илокси)хиназолин-6-илкарбамоил]метилфосфоновой кислоты 3,58 кг 1,1-карбонилдиимидазола (22,16 моль) добавляют в 12,8 л тетрагидрофурана и при 40 С смешивают с раствором 4,52 кг (22,16 моля) диэтилфосфоноуксусной кислоты в 6,5 Л тетрагидрофурана. Затем в течение 30 мин перемешивают при 40 С. Полученный таким путем раствор обозначают далее как раствор A. 6,39 кг (17,05 моль) N4-(3-хлор-4-фторфенил)-7-(тетрагидрофуран-3-илокси)хиназолин-4,6-диамина добавляют в 26,5 л тетрагидрофурана и при 40 С смешивают с раствором A c последующим перемешиванием в течение 2 ч при 30 С. К образовавшейся суспензии добавляют 64 л трет-бутилметилового эфира и после охлаждения до 20 С осадок отделяют центрифугированием. В завершение сначала промывают смесью из 16 л тетрагидрофурана и 16 л трет-бутилметилового эфира, а затем 32 л воды и сушат при 50 С. Выход: 6,58 кг (69,8%) белых кристаллов, чистота согласно данным ЖХВР (жидкостная хроматография высокого разрешения): 99,1%, приходящихся на площадь поверхности под пиком. Пример 2. [4-(3-Хлор-4-фторфениламино)-7-S)-тетрагидрофуран-3-илокси)хиназолин-6-ил]амид К 4,4 л воды добавляют 5,6 л 30%-ной соляной кислоты (53,17 моль). Затем при 30 С в течение 20 мин по каплям добавляют 4,28 кг 95%-ного (диметиламино)ацетальдегиддиэтилацеталя (26,59 моль). Реакционную смесь перемешивают в течение 8 ч при 35 С, охлаждают до 5 С и в последующем хранят в атмосфере аргона. Этот раствор обозначают далее как раствор Б. 4,55 кг (68,06 моль) гидроксида калия растворяют в 23,5 л воды и охлаждают до -5 С. Этот раствор обозначают далее как раствор В. 5,88 кг (10,63 моль) диэтилового эфира 4-(3-хлор-4-фторфениламино)-7-(тетрагидрофуран-3 илокси)хиназолин-6-илкарбамоил)метил)фосфоновой кислоты и 0,45 кг хлорида лития (10,63 моля) добавляют в 23,5 л тетрагидрофурана и охлаждают до -7 С. Далее в течение 10 мин добавляют холодный раствор В. Затем при -7 С в течение 1 ч добавляют раствор Б. После 1-часового перемешивания при -5 С реакционную смесь нагревают до 20 С и смешивают с 15 л воды. После охлаждения до 3 С суспензию подвергают вакуум-фильтрации и остаток промывают водой и сушат. Выход: 5,21 кг (100%) сырого продукта, влагосодержание: 6,7%. Кристаллизацию сырого продукта осуществляют с использованием бутилацетата/метилциклогексана. Выход: 78%, чистота согласно данным ЖХВР: 99,4%, приходящихся на площадь поверхности под пиком, влагосодержание: 5,4%. Пример 3. Дималеат [4-(3-хлор-4-фторфениламино)-7-S)-тетрагидрофуран-3-илокси)хиназолин-6 ил] амида (Е)-4-диметиламинобут-2-еновой кислоты. 6,0 кг (12,35 моль) [4-(3-хлор-4-фторфениламино)-7-S)-тетрагидрофуран-3-илокси)хиназолин-6 ил]амида (Е)-4-диметиламинобут-2-еновой кислоты добавляют в 84 л этанола, нагревают до 70 С и смешивают с раствором 2,94 кг (25,31 моль) малеиновой кислоты в 36 л этанола. После начала кристаллизации смесь сначала охлаждают до 20 С и перемешивают в течение 2 ч, а затем в течение 3 ч при 0 С. Осадок отделяют вакуум-фильтрацией, промывают 19 л этанола и сушат в вакууме при 40 С. Выход: 8,11 кг (91,5%), tпл. 178C.H-ЯМР (CD3OD):= 2,47 + 2,27 (m+m, 2H), 2,96 (s, 6H), 4,03 (m, 2H), 4,07 + 3,92 (m+m, 2 Н), 4,18 + 4,03 (m+m, 2H), 5,32 (m, 1H), 6,26 (s, 4H), 6,80 (m, 1H), 6,99 (m, 1H), 7,27(s, 1H), 7,30 (t, 1H), 7,66 (m, 1H),7,96 (dd, 1H), 8,62 (s, 1H), 9,07 (s, 1H) ч./млн. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения общей формулы (VII) в которой X обозначает метиновую группу или атом азота, Ra обозначает бензильную, 1-фенилэтильную или 3-хлор-4-фторфенильную группу и R3 и R4 обозначают прямую или разветвленную С 1-С 4 алкильную группу, заключающийся в том, что а) соединение общей формулы (V) в которой X обозначает метиновую группу или атом азота, Ra обозначает бензильную, 1-фенилэтильную или 3-хлор-4-фторфенильную группу, после активации подвергают в пригодных растворителях взаимодействию с ди-(С 1-С 4 алкил)фосфоноуксусной кислотой и б) полученное соединение общей формулы (VI) в которой X обозначает метиновую группу или атом азота, Ra обозначает бензильную, 1 фенилэтильную или 3-хлор-4-фторфенильную группу и R1 обозначает прямую или разветвленную С 1-С 4 алкильную группу, подвергают взаимодействию с альдегидом формулы в которой каждый из R3 и R4 обозначает прямую или разветвленную С 1-С 4 алкильную группу, при этом остатки могут быть одинаковыми или разными, или с эквивалентом альдегида, таким как гидрат или ацеталь, с использованием пригодных органических или неорганических оснований. 2. Способ получения 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1 ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина, заключающийся в том, что а) N4-(3-хлор-4-фторфенил)-7-(тетрагидрофуран-3-илокси)хинозолин-4,6-диамин после активации подвергают в пригодных растворителях взаимодействию с ди-(С 1-С 4 алкил)фосфоноуксусной кислотой и б) полученный диалкиловый эфир [4-(3-хлор-4-фторфениламино)-7-S)-тетрагидрофуран-3 илокси)хиназолин-6-илкарбамоил]метилфосфоновой кислоты подвергают взаимодействию с альдегидом, полученным in situ из соответствующего (диметиламино)ацетальдегид-диалкилацеталя, с использованием пригодных органических или неорганических оснований. 3. Способ по п.2, в котором на стадии а) в качестве реагента используют диэтилфосфоноуксусную кислоту. 4. Способ по п.1 или 2, отличающийся тем, что на стадии б) в качестве основания используют 1,5 диазабицикло[4.3.0]нон-5-ен (ДБН), гидроксид натрия или гидроксид калия. 5. Способ по п.4, отличающийся тем, что на стадии б) в качестве основания используют гидроксид калия. 6. Способ получения дималеата 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо 2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина, включающий стадии а) и б) способа по п.1, а также стадию в), на которой полученный 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолин переводят в дималеат взаимодействием с малеиновой кислотой в пригодном растворителе при нагревании. 7. Способ по п.6, отличающийся тем, что в качестве растворителя используют этанол или изопро-7 016624 панол, необязательно при добавлении воды. 8. Способ по п.6 или 7, отличающийся тем, что используют по меньшей мере 2 экв. малеиновой кислоты. 9. Дималеат 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина. 10. Лекарственное средство, содержащее дималеат 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,Nдиметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина и необязательно один или несколько инертных носителей и/или разбавителей. 11. Применение дималеата 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2 бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина для получения лекарственного средства, предназначенного для лечения доброкачественных и злокачественных опухолей, для предупреждения и лечения заболеваний дыхательных путей и легких, а также для лечения заболеваний желудочнокишечного тракта, желчных путей и желчного пузыря. Рентгеновская порошковая дифрактограмма дималеата 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,Nдиметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина
МПК / Метки
МПК: A61K 31/517, C07D 405/12, A61P 35/00, A61K 31/505
Метки: средство, лекарственное, аминокротонильных, способ, соединений, получения
Код ссылки
<a href="https://eas.patents.su/9-16624-sposob-polucheniya-aminokrotonilnyh-soedinenijj-i-lekarstvennoe-sredstvo.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения аминокротонильных соединений и лекарственное средство</a>