Совместные кристаллы пирролидинонов
Формула / Реферат
1. Совместный кристалл, включающий пирролидинон, который представляет собой 2-[4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид или (2S)-2-(2-оксо-4-н-пропил-1-пирролидинил)бутанамид, и соль, выбранную из группы, включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2, MgHPO4, Mg(H2PO4)2, MgCO3, Mg(HCO3)2.
2. Совместный кристалл по п.1, в котором солью является MgCl2.
3. Совместный кристалл по п.2, который является гидратом.
4. Совместный кристалл по любому из пп.1-3, в котором пирролидинон представляет собой (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид
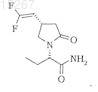
5. Совместный кристалл по п.4, имеющий стехиометрию (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид ´ 0,5MgCl2 ´ 2Н2О.
6. Совместный кристалл по п.5, характеризующийся любым одним, любыми двумя, любыми тремя, любыми четырьмя или большим количеством пиков порошковой рентгенограммы, включая, но не ограничиваясь только ими: 7,61, 11,57, 12,60, 13,85, 15,41, 17,21, 19,21, 20,25, 21,30, 23,81, 26,57, 30,69, 30,66, 35,93 и 40,49 градусов 2-тэта.
7. Совместный кристалл по любому из пп.1-3, в котором пирролидинон представляет собой (2S)-2-((4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид
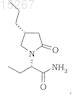
8. Совместный кристалл по п.7, имеющий стехиометрию (2S)-2-((4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид ´ 0,5MgCl2 ´ 2Н2О.
9. Совместный кристалл по п.8, характеризующийся следующими данными порошковой рентгенограммы: 7,44, 11,74, 12,26, 13,40, 14,92, 15,82, 18,64, 21,40, 21,80, 22,14, 22,68, 23,60, 23,70, 25,12 и 26,80 градусов 2-тэта.
10. Фармацевтическая композиция, включающая совместный кристалл по любому из пп.1-9, а также фармацевтически приемлемый инертный наполнитель.
11. Применение совместного кристалла по любому из пп.1-9 для приготовления лекарственного средства, предназначенного для лечения эпилепсии, эпилептогенеза, припадков, судорог и других неврологических нарушений, включая биполярные нарушения, мании, депрессии, тревоги, мигрени, тригеминальной и другой невралгии, хронической боли, невропатической боли, ишемии головного мозга, сердечной аритмии, миотонии, злоупотребления кокаином, удара, миоклонии, эссенциального тремора и других нарушений движений, кровоизлияния в мозг у новорожденных, бокового амиотрофического склероза, спастичности, болезни Паркинсона и других дегенеративных заболеваний, бронхиальной астмы, астматического статуса и аллергического бронхита, астматического синдрома, бронхиальной гиперреактивности и бронхоспастических синдромов, а также аллергического и вазомоторного ринита и риноконъюнктивита.
Текст
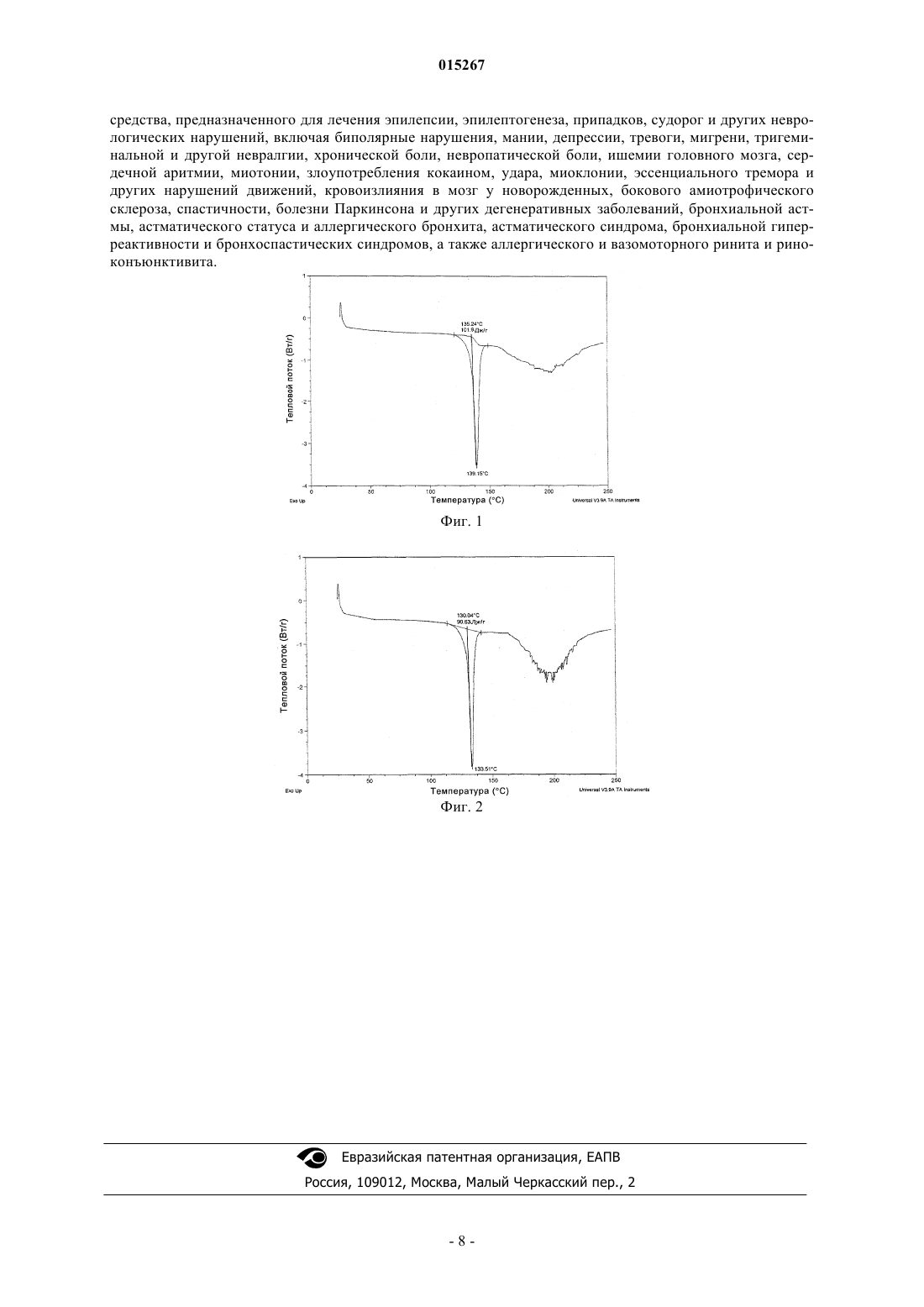
В патенте описаны новые совместные кристаллы пирролидинона, который представляет собой 2[4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид или 015267 Введение Активные фармацевтические ингредиенты (АФИ), содержащиеся в фармацевтических композициях, можно получить во многих различных формах. Такие АФИ можно получить во многих различных химических формах, включая химические производные и соли. Такие АФИ также можно получить в различных физических формах. АФИ могут, например, быть аморфными, они могут содержать разные кристаллические полиморфные формы или могут находиться в разных состояниях сольватации или гидратации. Путем изменения формы АФИ можно менять его физические характеристики. Например, кристаллические полиморфные формы обычно обладают, например, разной растворимостью, так что при данной температуре термодинамически более стабильная полиморфная форма менее растворима, чем термодинамически менее стабильная полиморфная форма. Фармацевтические полиморфные формы также могут различаться по таким характеристикам, как срок годности при хранении, биологическая доступность,морфология, давление пара, плотность, цвет, вязкость, температура плавления и сжимаемость. В соответствии с этим изменение кристаллического состояния АФИ является одним из многих путей изменения его физических характеристик. Часто необходимы новые формы этих АФИ, которые обладают улучшенными характеристиками, в частности, применительно к пероральному введению. Точнее, может потребоваться обнаружение улучшенных форм АФИ, которые обладают значительно улучшенными характеристиками, включая повышенную растворимость в воде, температуру плавления твердой формы, а также стабильность АФИ. Кроме того, необходимо улучшить технологические характеристики или получение фармацевтических препаратов. Например, игольчатые кристаллы АФИ могут привести к агрегации даже в композициях, в которых смешано с другими веществами, вследствие чего образуется неоднородная смесь. Также может потребоваться увеличение или уменьшение скорости растворения содержащих АФИ фармацевтических композиции в воде, усиление или обеспечение более быстрого или в большей степени отложенного начала терапевтического воздействия или регулирование биологической доступности вводимой перорально композиций для исключения какого-либо системного всасывания и обеспечения только местного воздействия. Также необходима форма АФИ, которая при введении субъекту обеспечивает более быстрое или более медленное достижение максимального содержания в плазме, обеспечивает более продолжительное максимальное содержание в плазме и большее или меньшее суммарное воздействие по сравнению с эквивалентными количествами АФИ в известной в настоящее время форме. Наконец, может потребоваться форма АФИ, обладающая повышенной температурой плавления, так чтобы ее можно было легче приготовить в виде доступного при пероральном введении препарата.WO 01/62726 относится к пирролидинонам, их синтезу, а также к их применению в медицине для лечения различных нарушений ЦНС (центральная нервная система), таких как эпилепсия. В частности, вWO 01/62726 описан синтез двух диастереоизомеров 2-[4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамида. В ней также описан синтез двух диастереоизомеров (2S)-2-(2-оксо-4-н-пропил-1 пирролидинил)бутанамида. Краткое изложение сущности изобретения Изобретение относится к новым совместным кристаллам пирролидинонов, представляющих собой 2-[4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид или (2S)-2-(2-оксо-4-н-пропил-1-пирролидинил) бутанамид и соли, выбранной из группы, включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2, MgHPO4,Mg(H2PO4)2, MgCO3, Mg(HCO3)2. Настоящее изобретение также относится к фармацевтической композиции, содержащей новые совместные кристаллы пирролидинонов, а также к применению указанной композиции для лечения эпилепсии, эпилептогенеза, припадков, судорог и других неврологических нарушений, включая биполярные нарушения, мании, депрессии, тревоги, мигрени, тригеминальной и другой невралгии, хронической боли,невропатической боли, ишемии головного мозга, сердечной аритмии, миотонии, злоупотребления кокаином, удара, миоклонии, эссенциального тремора и других нарушений движений, кровоизлияния в мозг у новорожденных, бокового амиотрофического склероза, спастичности, болезни Паркинсона и других дегенеративных заболеваний, бронхиальной астмы, астматического статуса и аллергического бронхита,астматического синдрома, бронхиальной гиперреактивности и бронхоспастических синдромов, а также аллергического и вазомоторного ринита и риноконъюнктивита. Совместные кристаллы АФИ, предлагаемые в настоящем изобретении, обладают значительно более высокой температурой плавления, чем АФИ, описанные в WO 01/62726. Описание чертежей На фиг. 1 приведена полученная с помощью ДСК термограмма совместного кристалла (2S)-2-[(4S)4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид:MgCl2:H2O (2:1:4). На фиг. 2 приведена полученная с помощью ДСК термограмма совместного кристалла (2S)-2-4R)2-оксо-4-н-пропил-1-пирролидинил)бутанамид: MgCl2:H2O (2:1:4). Подробно описание изобретения В предпочтительном варианте осуществления настоящее изобретение относится к новым совместным кристаллам пирролидинонов, представляющих собой 2-[4-(2,2-дифторвинил)-2-оксопирролидинил] бутанамид или (2S)-2-(2-оксо-4-н-пропил-1-пирролидинил)бутанамид, полученным кристаллизацией с-1 015267 солью, выбранной из группы, включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2, MgHPO4, Mg(H2PO4)2,MgCO3, Mg(HCO3)2) Mg(HCO3)2. Соли с MgCl2, MgSO4, MgBr2 являются особенно предпочтительными. В одном варианте осуществления настоящее изобретение относится к конкретному АФИ, который представляет собой 2-[4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид. Соответственно, первым объектом настоящего изобретения является совместный кристалл 2-[4(2,2-дифторвинил)-2-оксопирролидинил]бутанамида и любого из соединений, выбранных из группы,включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2, MgHPO4, Mg(H2PO4)2, MgCO3, Mg(HCO3)2. Вторым объектом настоящего изобретения является фармацевтическая композиция, включающая совместный кристалл 2-[4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамида и MgCl2, MgSO4, MgBr2,Mg3(PO4)2, MgHPO4, Mg(H2PO4)2, MgCO3, Mg(HCO3)2. В предпочтительном варианте осуществления АФИ представляет собой конкретный диастереоизомер, проходящий клинические исследования, которому присвоено международное непатентованное название (МНП) селетрацетам, а именно (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид. В другом варианте осуществления настоящее изобретение относится к конкретному АФИ, который представляет собой (2S)-2-(2-оксо-4-н-пропил-1-пирролидинил)бутанамид. Соответственно, четвертым объектом настоящего изобретения является совместный кристалл (2S)2-(2-оксо-4-н-пропил-1-пирролидинил)бутанамида и любого из соединений, выбранного из группы,включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2, MgHPO4, Mg(H2PO4)2, MgCO3, Mg(HCO3)2. Пятым объектом настоящего изобретения является фармацевтическая композиция, включающая совместный кристалл (2S)-2-(2-оксо-4-н-пропил-1-пирролидинил)бутанамида и любого из соединений,выбранных из группы, включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2, MgHPO4, Mg(H2PO4)2, MgCO3,Mg(HCO3)2. В предпочтительном варианте осуществления АФИ представляет собой конкретный диастереоизомер, проходящий клинические исследования, которому присвоено МНП бриварацетам, а именно 2S)-24R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид. В еще одном варианте осуществления совместный кристалл представляет собой гидрат АФИ формулы (I) и любого из соединений, выбранных из группы, включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2,MgHPO4, Mg(H2PO4)2, MgCO3, Mg(HCO3)2, CaCl2, CaSO4, CaBr2, CaCO3, Mg(HCO3)2. Конкретный АФИ - (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамида имеет следующую стехиометрию совместного кристалла с MgCl2: (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид 0,5MgCl22H2O. Конкретный АФИ - 2S)-2-4R)-2-оксо-4-H-пропил-l-пирролидинил)бутанамида имеет следующую стехиометрию совместного кристалла с MgCl2: (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид 0,5 MgCl22 H2O. Совместные кристаллы АФИ обладают значительно более высокой температурой плавления, чем сам АФИ. Это является значительным преимуществом при использовании АФИ для приготовления фармацевтической композиции. Нежелательно использовать АФИ, который обладает низкой температурой плавления. Обычно низкая температура плавления не входящего в комплекс АФИ приводит к затруднениям при изготовлении таблеток. Таблетки являются наиболее предпочтительной формой лекарственного средства для перорального введения. Таким образом, для совместного кристалла с MgCl2 температура плавления (2S)-2-[(4S)-4-(2,2 дифторвинил)-2-оксопирролидинил]бутанамида повышается от 77 С до примерно 139 С. Таким образом, для совместного кристалла с MgCl2 температура плавления 2S)-2-4R)-2-оксо-4 н-пропил-1-пирролидинил)бутанамида повышается от 78 С до примерно 134 С. Способ получения совместных кристаллов пирролидинона включает стадию кристаллизации пирролидинона, представляющего собой 2-[4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид или (2S)-2(2-оксо-4-н-пропил-1-пирролидинил)бутанамид, в растворителе, который содержит любое из соединений, выбранных из группы, включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2, MgHPO4, Mg(H2PO4)2,MgCO3, Mg(HCO3)2. Способ очистки указанных пирролидинонов включает методику совместной кристаллизации.-2 015267 Предпочтительным растворителем для получения совместных кристаллов является вода, более предпочтительным является спиртовый растворитель, например, водная смесь, содержащая метанол, или чистый метанол, толуол, этилацетат или изопропилацетат. Фармацевтическая композиция, предлагаемая в настоящем изобретении, применима для лечения эпилепсии, эпилептогенеза, припадков, судорог и других неврологических нарушений, включая биполярные нарушения, мании, депрессии, тревоги, мигрени, тригеминальной и другой невралгии, хронической боли, невропатической боли, ишемии головного мозга, сердечной аритмии, миотонии, злоупотребления кокаином, удара, миоклонии, эссенциального тремора и других нарушений движений, кровоизлияния в мозг у новорожденных, бокового амиотрофического склероза, спастичности, болезни Паркинсона и других дегенеративных заболеваний, бронхиальной астмы, астматического статуса и аллергического бронхита, астматического синдрома, бронхиальной гиперреактивности и бронхоспастических синдромов, а также аллергического и вазомоторного ринита и риноконъюнктивита. Фармацевтическая композиция, предлагаемая в настоящем изобретении, необязательно может содержать один или более фармацевтически приемлемых связывающих агентов или клеящих средств в качестве инертных наполнителей, в особенности для композиций таблеток. Такие связывающие агенты или клеящие средства предпочтительно обеспечивали достаточную когезию таблетируемого порошка, что позволяет провести обычные операции обработки, такие как сортировка по крупности, смазывание,прессование и упаковка, но все же обеспечивают распад таблетки и всасывание композиции после проглатывания. Такие связывающие агенты также могут предупредить или подавить кристаллизацию или перекристаллизацию совместного кристалла, предлагаемого в настоящем изобретении, после растворения соли в растворе. Подходящие связывающие агенты или клеящие средства включают, но не ограничиваются только ими, по отдельности или в комбинации, камедь акации; трагакантовую камедь; сахарозу; желатин; глюкозу; крахмалы, такие как, но не ограничиваясь только ими, предварительно желатинизированные крахмалы (например, National ТМ 1511 и National Tm1500); целлюлозы, такие как, но не ограничиваясь только ими, метилцеллюлозу (например, Tylose) и натриевую соль кармелозы, альгиновую кислоту и соли альгиновой кислоты; алюмосиликат магния; ПЭГ (полиэтиленгликоль); гуаровую камедь; кислотные полисахариды; бентониты; повидон, например, повидон К-15, К-30 и К-29/32; полиметакрилаты; гидроксипропилметилцеллюлозу; гидроксипропилцеллюлозу (например, Klucel, выпускающуюся фирмой Aqualon); и этилцеллюлозу (например, Ethocel, выпускающуюся фирмой DowChemical Company). Многие из связывающих агентов являются полимерами, содержащими амидные, сложноэфирные,простые эфирные, спиртовые или кетогруппы и, как таковые, предпочтительно включаются в фармацевтические композиции, предлагаемые в настоящем изобретении. Поливинилпирролидоны, такие как повидон К-30, являются особенно предпочтительными. Полимерные связывающие агенты могут обладать различными молекулярными массами, степенями сшивки и содержать разные марки полимера. Полимерные связывающие агенты также могут быть сополимерами, такими как блок-сополимеры, которые содержат смесь этиленоксидных и пропиленоксидных звеньев. Изменение отношения содержаний этих звеньев в данном полимере влияет на свойства и рабочие характеристики. Примерами блок-сополимеров с разным составом образующих блок звеньев являются полоксамер 188 и полоксамер 237 (BASF Corporation). Фармацевтическая композиция, предлагаемая в настоящем изобретении, необязательно включает один или более фармацевтически приемлемых смачивающих агентов в качестве инертных наполнителей. Такие смачивающие агенты предпочтительно выбирают так, чтобы поддерживать совместный кристалл в хорошей ассоциации с водой, такое состояние предположительно улучшает биологическую доступность композиции. Такие смачивающие агенты также можно использовать для солюбилизации или улучшения растворимости совместных кристаллов. Неограничивающие примеры поверхностно-активных веществ, которые можно использовать в качестве смачивающих агентов в фармацевтической композиции, предлагаемой в настоящем изобретении,включают четвертичные аммониевые соединения, например бензалконийхлорид, бензэтонийхлорид и цетилпиридинийхлорид, диоктилнатрийсульфосукцинат, полиоксиэтиленалкилфениловые простые эфиры, например, ноноксинол 9, ноноксинол 10, и марки Ctoxynol 9, полоксамеры (блок-сополимеры оксиэтилена и оксипропилена), глицериды полиоксиэтилена 9 и жирных кислот и масла, например, моно- и диглицериды полиоксиэтилена(8)каприловой/каприновой кислот (например, Labrasol, выпускающийся фирмой Gattefosse), полиоксиэтиленовые (35) производные касторового масла и полиоксиэтиленовые(40) производные гидрированного касторового масла; полиоксиэтиленалкиловые простые эфиры, например, полиоксиэтилен(20)цетостеариловый эфир, сложные эфиры полиоксиэтилена и жирных кислот, например, полиоксиэтилен(40)стеарат, сложные эфиры полиоксиэтилена и сорбита, например, полисорбат 20 и полисорбат 80 (например, Tween 80 , выпускающийся фирмой ICI), сложные эфиры пропиленгликоля и жирных кислот, например, пропиленгликольлаурат (например, Lauroglycol выпускающийся фирмой Gattefosse), лаурилсульфатнатрия, жирные кислоты и их соли, например, соли олеиновой кислоты, олеат натрия и триэтаноламинолеат, глицериловые эфиры жирных кислот, например глицерилмоно-3 015267 стеарат, сложные эфиры сорбита, например сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат и сорбитанмоностеарат, тилоксапол и их смеси. Смачивающие агенты, являющиеся анионогенными поверхностно-активными веществами, являются предпочтительными. Лаурилсульфат натрия является особенно предпочтительным смачивающим агентом. Фармацевтическая композиция, предлагаемая в настоящем изобретении, в качестве инертных наполнителей необязательно включает один или более фармацевтически приемлемых смазывающих средств (включая агенты, препятствующие слипанию, и/или агенты, придающие скользкость). Подходящие смазывающие средства включают, но не ограничиваются только ими, по отдельности или в комбинации, глицерилбегенат (например, Compritol888, выпускающийся фирмой Gattefosse); стеариновую кислоту и ее соли, включая стеараты магния, кальция и натрия; гидрированные растительные масла (например, Sterotexof Abitec); коллоидный диоксид кремния; тальк; воска; борную кислоту; бензоат натрия; ацетат натрия; фумарат натрия; хлорид натрия; DL-лейцин; ПЭГ (например, Carbowax 4000 и Carbowax 6000, выпускающиеся фирмой Dow Chemical Company); олеат натрия; лаурилсульфат натрия; и лаурилсульфат магния. Стеарат магния является предпочтительным смазывающим средством, применяющимся,например, для уменьшения трения между оборудованием и гранулированной смесью во время прессования или приготовления композиции для таблетки. Подходящие агенты, препятствующие слипанию, включают, но не ограничиваются только ими,тальк, кукурузный крахмал, DL-лейцин, лаурилсульфат натрия и стеараты металлов. Тальк является предпочтительным агентом, препятствующим слипанию, или агентом, придающим скользкость, применяющимся, например, для уменьшения прилипания композиции к поверхностям оборудования, а также для уменьшения образования статического электричества в смеси. Агенты, придающие скользкость,можно использовать для улучшения сыпучести потока порошка твердой композиции. Подходящие агенты, придающие скользкость, включают, но не ограничиваются только ими, коллоидный диоксид кремния, крахмал, тальк, трикальцийфосфат, порошкообразную целлюлозу и трисиликат магния. Коллоидный диоксид кремния является особенно предпочтительным. Другие инертные наполнители, такие как красители, ароматизаторы и подсластители, известны фармацевтике и могут использоваться в фармацевтических композициях, предлагаемых в настоящем изобретении. На таблетки можно нанести покрытие, например энтеросолюбильное покрытие, или не наносить покрытие. Композиции, предлагаемые в настоящем изобретении, также могут включать, например, буферные агенты. Один или более шипучих агентов необязательно можно использовать в качестве разрыхлителей и/или улучшения органолептических характеристик фармацевтических композиций, предлагаемых в настоящем изобретении. В одном варианте осуществления настоящего изобретения шипучий агент, содержащийся в твердой дозированной форме в количестве, меньшем обеспечивающего распад дозированной формы, обеспечивает улучшенное диспергирование АФИ в водной среде."Шипучий агент" в настоящем изобретении означает агент, включающий один или более соединений, которые вместе или по отдельности при взаимодействии с водой выделяют газ. Выделяющимся газом обычно является кислород или, чаще, диоксид углерода. Предпочтительные шипучие агенты включают кислоту и основание, которые взаимодействуют в присутствии воды и выделяют газообразный диоксид углерода. Предпочтительное основание представляет собой карбонат или бикарбонат щелочного металла или щелочно-земельного металла, а кислотой является алифатическая карбоновая кислота. Неограничивающие примеры подходящих оснований, как компонентов шипучих агентов, применимых в настоящем изобретении, включают карбонаты (например, карбонат кальция), бикарбонаты (например, бикарбонат натрия), сесквикарбонаты их смеси. Неограничивающие примеры подходящих кислот, как компонентов шипучих агентов, и/или твердых органических кислот, применимых в настоящем изобретении, включают лимонную кислоту, винную кислоту (в виде D-, L- или D/L-винной кислоты),яблочную кислоту (в виде D-, L- или DL-яблочной кислоты), малеиновую кислоту, фумаровую кислоту,адипиновую кислоту, янтарную кислоту, ангидриды таких кислот, кислые соли таких кислот и их смеси. Лимонная кислота является предпочтительной кислотой. Инертные наполнители, которые солюбилизируют АФИ, обычно содержат и гидрофильные, и гидрофобные фрагменты или предпочтительно являются амфифильными или содержат амфифильные фрагменты. Одним типом амфифильного или частично амфифильного инертного наполнителя является амфифильный полимер. Предпочтительным амфифильным полимером является полиалкиленгликоль, который обычно содержит этиленгликолевые и/или пропиленгликолевые субъединицы. Такие полиалкиленгликоли можно этерифицировать по концевым группам карбоновой кислотой, сложным эфиром, ангидридом кислоты или другим подходящим реагентом. Примеры таких инертных наполнителей включают полоксамеры (симметричные блок-сополимеры этиленгликоля и пропиленгликоля; например, полоксамер 237), полиалкиленгликолированные сложные эфиры токоферола (включая эфиры, образованные из диили полифункциональных карбоновых кислот; например, d-альфа-токоферолполиэтиленгликоль-1000-4 015267 сукцинат), и макроголглицериды (образующиеся путем алкоголиза масла и этерификации полиалкиленгликоля с образованием смеси моно-, ди- и триглицеридов и сложных моно- и диэфиров; например, стеароилмакрогол-32-глицеридов). Такие фармацевтические композиции эффективно вводить перорально. Твердые дозированные формы, предлагаемые в настоящем изобретении, можно получить любым подходящим способом, не ограничиваясь способами, описанными в настоящем изобретении. Иллюстративный способ включает (а) стадию смешивания АФИ, предлагаемых в настоящем изобретении, с одним или большим количеством инертных наполнителей с образованием смеси и (b) стадию таблетирования или капсулирования смеси с образованием таблеток или капсул соответственно. В предпочтительном способе твердые дозированные формы получают способом, включающим (а) стадию смешивания совместного кристалла, предлагаемого в настоящем изобретении, с одним или большим количеством инертных наполнителей с образованием смеси (b) стадию гранулирования с образованием гранулята и (с) стадию таблетирования или капсулирования смеси с образованием таблеток или капсул соответственно. Стадию (b) можно выполнить по технологии сухого или мокрого гранулирования, известной в данной области техники, но предпочтительно использовать стадию сухого гранулирования. Один или более разбавителей, один или более разрыхлителей и один или более связывающих агентов предпочтительно прибавляют, например на стадии смешивания, необязательно можно прибавить смачивающий агент, например на стадии гранулирования, и один или более разрыхлителей предпочтительно прибавляют после стадии гранулирования, но до таблетирования или капсулирования. Смазывающее средство предпочтительно прибавляют до таблетирования. Смешивание и гранулирование можно проводить независимо при низком или высоком сдвиговом усилии. Предпочтительно выбирают такую технологию, при которой образуется гранулят с равномерным распределением АФИ, который легко распадается, который является достаточно сыпучим, так чтобы при заполнении капсулы или таблетировании можно было легко регулировать массу, и который в объеме является достаточно плотным, так чтобы партию можно было обработать на выбранном оборудовании и поместить отдельные дозы в необходимые капсулы или матрицы для таблеток. В альтернативном варианте осуществления твердые дозированные формы получают способом, который включает стадию распылительной сушки, на которой АФИ суспендируют с одним или более инертных наполнителей в одной или более распыляемых жидкостей, предпочтительно непротонных (например, неводных или неспиртовых) распыляемых жидкостей, и затем подвергают быстрой распылительной сушке в потоке теплого воздуха. Гранулированный или подвергнутый испарительной сушке порошок, полученный любым из приведенных выше иллюстративных способов, можно спрессовать или сформовать для получения таблеток или капсулировать для получения капсул. Можно использовать обычное оборудование для таблетирования, известное в данной области техники. Если требуются таблетки с покрытием, то подходящими являются обычные методики нанесения покрытий. Инертные наполнители для таблеток композиций, предлагаемых в настоящем изобретении, предпочтительно выбирают так, чтобы время распада, определенное с помощью стандартной методики изучения распада, составляло менее примерно 30 мин, предпочтительно примерно 25 мин или менее, более предпочтительно примерно 20 мин или менее, и еще более предпочтительно примерно 15 мин или менее. Фармацевтически приемлемые совместные кристаллы можно вводить с помощью препаратов регулируемого, замедленного или отложенного высвобождения. Фармацевтически препараты регулируемого высвобождения обычно предназначены для улучшения лекарственного лечения по сравнению с обеспечивающимся средствами нерегулируемого высвобождения. В идеальном случае применение для лечения обладающего оптимальными характеристиками препарата регулируемого высвобождения характеризуется минимальным количеством лекарственного вещества, использующегося для излечивания или лечения патологического состояния за минимальное количество времени. Преимущества препаратов регулируемого высвобождения включают: 1) продление активности лекарственного средства; 2) уменьшение частоты введения; 3) улучшения соблюдения пациентом режима лечения; 4) применение меньшего полного количества лекарственного средства; 5) уменьшение местных или системных побочных эффектов; 6) сведение к минимуму накопления лекарственного средства; 7) уменьшение колебаний содержания лекарственного средства в крови; 8) повышение эффективности лечения; 9) уменьшение усиления действия или снижения активности лекарственного средства; 10) повышение скорости лечения заболеваний или патологических состояний. (Kim,Cherngju, Controlled llelease Dosage Form Design, Technomic Publishing, Lancaster, Pa. : 2000). Экспериментальная часть Пример 1. Получение совместного кристалла (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамида с MgCl2 151 мг (0,65 ммоля) (2S)-2-[(4S)-4-(2,2-Дифторвинил)-2-оксопирролидинил]бутанамида и 31 мг(0,325 ммоля) MgCl2 растворяют примерно в 3 мл метанола. Медленное выпаривание растворителя дает призматические и бесцветные таблетки совместного кристалла (2S)-2-[(4S)-4-(2,2-дифторвинил)-2 оксопирролидинил]бутанамид:MgCl2:H2O (2:1:4).-5 015267 Совместный кристалл можно проанализировать с помощью ДСК и рентгенографии монокристалла. Термический анализ (Q-1000, ТА instrument) проводят для определения температуры плавления/поведения совместного кристалла (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид:MgCl2:H2O (2:1:4). Температура плавления найдена равной 138-145 С. Данные рентгенографии монокристалла (NONIUS CAD-4/MACH3) : С 20 Н 36 С 12 F4 Mg N4 08, М = 631,74, тригональная Р 32 21, а = 8,850(2) ангстремов, b = 8,850(2) ангстремов, с = 34,827(5) ангстремов,альфа = 90, бета = 90, гамма = 120, V = 2362,3(8) кубических ангстремов, Т = 293(2) К, Z = 3, Dc = 1,332 г/см 3,= 1,54178 ангстремов. Конечные остаточные погрешности для 194 параметров составляютR1 I2 сигма(I) = 0,0498 и wR2 = 0,147. Кристаллическая решетка совместного кристалла (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид:MgCl2:H2O (2:1:4) совместного кристалла состоит из липофильных слоев, образованных этильными и дифторвинильными цепями. Стабилизации связывания молекул способствуют притягивательные ван-дер-ваальсовы силы между этими слоями, а также прочная сеть Н-связей в полярных слоях, образованных полимерными цепями координационных сфер катионов магния. Модельная порошковая рентгенограмма этой структуры характеризуется следующими пиками: 7,60, 11,54, 11,82, 12,60, 13,84, 15,38, 17,18, 19,16, 20,06, 20,20, 21,28, 23,48, 23,80, 26,52, 28,74, 30,54,30,66, 31,28, 35,84 и 40,46 градусов 2-тэта (данные получены моделированием с помощью программыMercury 1.4.1). Альтернативная методика получения совместного кристалла (2S)-2-[(4S)-4-(2,2-дифторвинил)-2 оксопирролидинил]бутанамид:MgCl2:H2O (2:1:4): 4,96 г (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамида (0,0214 моль) растворяют в 15 мл МеОН. К этому раствору прибавляют 1,01 г MgCl2(0,011 моль). Раствор выдерживают в течение нескольких дней при комнатной температуре. Прибавляют 20 мл трет-бутилметилового эфира. Этот раствор становится белым и вязким и твердое вещество можно отфильтровать. После выдерживания в вакууме в течение ночи при 30 С это дает 5,90 г белого порошкообразного вещества. Порошкообразное вещество можно охарактеризовать с помощью ДСК, порошковой рентгенограммы, ИК. На термограмме ДСК (Q-1000, ТА instrument) обнаруживается эндотермический фазовый переход соответствующий плавлению совместного кристалла примерно при 139 С (пик, начало при 135 С), (см. фиг. 1). Это означает составляющее примерно 62 С повышение температуры плавления по сравнению с известной кристаллической формой (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамида. Экспериментальные значения, полученные с помощью порошковой рентгенографии (PW3710 Philips Analytical X-Ray B.V.,= 1,54178 ангстремов): Совместный кристалл (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид:MgCl2:H2O (2:1:4) можно охарактеризовать любым одним, любыми двумя, любыми тремя, любыми четырьмя или большим количеством пиков, включая, но не ограничиваясь только ими, расположенные при: 7,61, 11,57, 12,60, 13,85, 15,41, 17,21, 19,21, 20,25, 21,30, 23. 81,26,57, 30,69, 30,66, 35,93, и 40,49 градусах 2-тэта (данные приведены в том виде, в котором они получены). ИК спектроскопия (Perkin Elmer System 2000 FTIR) обнаруживает поглощения при: 3307, 3193,2974, 2943, 1756, 1659, 1625, 1420, 1310, 1269 и 926 см-1. Пример 2. Получение совместного кристалла 2S)-2-4R)-2-оксо-4-H-пропил-1-пирролидинил)бутанамида с MgCb. К 300 мкл воды, содержащей 36 мг (0,12 ммоля) 2S)-2-4R)-2-оксо-4-H-пропил-1-пирролидинил) бутанамида, прибавляют 31 мг (0,33 ммоля) MgCl2. Медленное выпаривание растворителя дает призматические и бесцветные кристаллы совместного кристалла 2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид:MgCl2:H2O (2:1:4). Совместный кристалл можно проанализировать с помощью ДСК и рентгенографии монокристалла. Термический анализ (Q-1000, ТА instrument) проводят для определения температуры плавления/поведения совместного кристалла 2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид :MgCl2:H2O (2:1:4). Температура плавления найдена равной примерно 135 С. Данные рентгенографии монокристалла (NONIUS CAD-4/MACH3): С 22 Н 48 С 12 Mg N4 O8, М = 591,85, моноклинная Р 21, а = 8,863(1) ангстремов, b =23,742(2) ангстремов, с = 8,907(1) ангстремов, альфа = 90, бета = 116,86(1), гамма = 90, V = 1672,1(3) кубических ангстремов, Т = 293(2) К, Z = 2, Dc=1,176 г/см 3, = 1,54178 ангстремов. Конечные остаточные погрешности для 338 параметров составляютR1 I2 сигма(I) = 0,0528 и wR2 =0,150. Кристаллическая решетка совместного кристалла (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид: MgCl2:H2O (2:1:4) состоит из множества липофильных слоев, образованных этильными и пропильными цепями. Стабилизации связывания молекул способствуют притягивательные ван-дерваальсовы силы между этими слоями, а также прочная сеть Н-связей в полярных слоях, образованных полимерными цепями координационных сфер катионов магния.-6 015267 Модельная порошковая рентгенограмма этой структуры характеризуется следующими пиками: 7,44, 11,74, 12,26, 13,40, 14,92, 15,82, 18,64, 21,40, 21,80, 22,14, 22,68, 23,60, 23,70, 25,12, 26,80 градусов 2-тэта (данные получены моделированием с помощью программы Mercury 1.4.1). Альтернативная методика получения совместного кристалла (2S)-2-4R)-2-оксо-4-н-пропил-lпирролидинил)бутанамид: MgCl2:H2O (2:1:4): 4,96 г (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамида (0,023 моля) растворяют в 5 мл МеОН. К этому раствору прибавляют 1,01 г MgCl2 (0,010 моль). Раствор выдерживают 30 мин при комнатной температуре. Прибавляют 20 мл третбутилметилового эфира. Этот раствор становится белым и вязким. После выпаривания растворителей твердое вещество промывают гексаном и оставляют кристаллизоваться. После выдерживания в вакууме в течение ночи при 30 С это дает 5 г белого порошкообразного вещества. Кристаллы можно охарактеризовать с помощью ДСК, порошковой рентгенограммы, ИК. На термограмме ДСК (Q-1000, ТА instrument) обнаруживается эндотермический фазовый переход соответствующий плавлению совместного кристалла примерно при 133,5 С (пик, начало при 130 С), (см. фиг. 2). Это означает составляющее примерно 56 С повышение температуры плавления по сравнению с известной кристаллической формой (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида. Экспериментальные значения получены с помощью порошковой рентгенографии (PW3710 PhilipsAnalytical X-Ray B.V.,= 1,54178 ангстремов). Рентгенограмму совместного кристалла (2S)-2-4R)-2 оксо-4-н-пропил-1-пирролидинил)бутанамид:MgCl2:H2O (2:1:4) можно охарактеризовать любым одним,любыми двумя, любыми тремя, любыми четырьмя или большим количеством пиков, включая, но не ограничиваясь только ими: 7,57, 11,21, 11,77, 12,29, 13,45, 15,05, 15,93, 18,77, 21,45, 22,21, 22,89, 25,21 и 26,89 градусов 2-тэта (данные приведены в том виде, в котором они получены). ИК спектроскопия (Perkin Elmer System 2000 FTIR) обнаруживает поглощения при: 3311, 3180,2966, 2936, 2875, 1654, 1494, 1458, 1420, 1291, 1273, 1206 и 938 см-1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Совместный кристалл, включающий пирролидинон, который представляет собой 2-[4-(2,2 дифторвинил)-2-оксопирролидинил]бутанамид или (2S)-2-(2-оксо-4-н-пропил-1-пирролидинил)бутанамид, и соль, выбранную из группы, включающей MgCl2, MgSO4, MgBr2, Mg3(PO4)2, MgHPO4,Mg(H2PO4)2, MgCO3, Mg(HCO3)2. 2. Совместный кристалл по п.1, в котором солью является MgCl2. 3. Совместный кристалл по п.2, который является гидратом. 4. Совместный кристалл по любому из пп.1-3, в котором пирролидинон представляет собой (2S)-2[(4S)-4-(2,2-дифторвинил)-2-оксопирролидинил]бутанамид 5. Совместный кристалл по п.4, имеющий стехиометрию (2S)-2-[(4S)-4-(2,2-дифторвинил)-2 оксопирролидинил]бутанамид 0,5MgCl22 Н 2 О. 6. Совместный кристалл по п.5, характеризующийся любым одним, любыми двумя, любыми тремя,любыми четырьмя или большим количеством пиков порошковой рентгенограммы, включая, но не ограничиваясь только ими: 7,61, 11,57, 12,60, 13,85, 15,41, 17,21, 19,21, 20,25, 21,30, 23,81, 26,57, 30,69, 30,66,35,93 и 40,49 градусов 2-тэта. 7. Совместный кристалл по любому из пп.1-3, в котором пирролидинон представляет собой (2S)-24R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид 8. Совместный кристалл по п.7, имеющий стехиометрию (2S)-2-4R)-2-оксо-4-н-пропил-1 пирролидинил)бутанамид 0,5MgCl22 Н 2 О. 9. Совместный кристалл по п.8, характеризующийся следующими данными порошковой рентгенограммы: 7,44, 11,74, 12,26, 13,40, 14,92, 15,82, 18,64, 21,40, 21,80, 22,14, 22,68, 23,60, 23,70, 25,12 и 26,80 градусов 2-тэта. 10. Фармацевтическая композиция, включающая совместный кристалл по любому из пп.1-9, а также фармацевтически приемлемый инертный наполнитель. 11. Применение совместного кристалла по любому из пп.1-9 для приготовления лекарственного-7 015267 средства, предназначенного для лечения эпилепсии, эпилептогенеза, припадков, судорог и других неврологических нарушений, включая биполярные нарушения, мании, депрессии, тревоги, мигрени, тригеминальной и другой невралгии, хронической боли, невропатической боли, ишемии головного мозга, сердечной аритмии, миотонии, злоупотребления кокаином, удара, миоклонии, эссенциального тремора и других нарушений движений, кровоизлияния в мозг у новорожденных, бокового амиотрофического склероза, спастичности, болезни Паркинсона и других дегенеративных заболеваний, бронхиальной астмы, астматического статуса и аллергического бронхита, астматического синдрома, бронхиальной гиперреактивности и бронхоспастических синдромов, а также аллергического и вазомоторного ринита и риноконъюнктивита.
МПК / Метки
МПК: A61P 25/08, A61K 31/4015, C07D 207/26
Метки: кристаллы, совместные, пирролидинонов
Код ссылки
<a href="https://eas.patents.su/9-15267-sovmestnye-kristally-pirrolidinonov.html" rel="bookmark" title="База патентов Евразийского Союза">Совместные кристаллы пирролидинонов</a>
Предыдущий патент: Способ получения зрелых дендритных клеток для индуцирования иммунного ответа и применение полученных клеток
Следующий патент: Замороженное кондитерское изделие
Случайный патент: Сэндвич-элемент