Соединения фенилпиридилпиперазина, способ их получения и фармацевтические композиции, содержащие их
Формула / Реферат
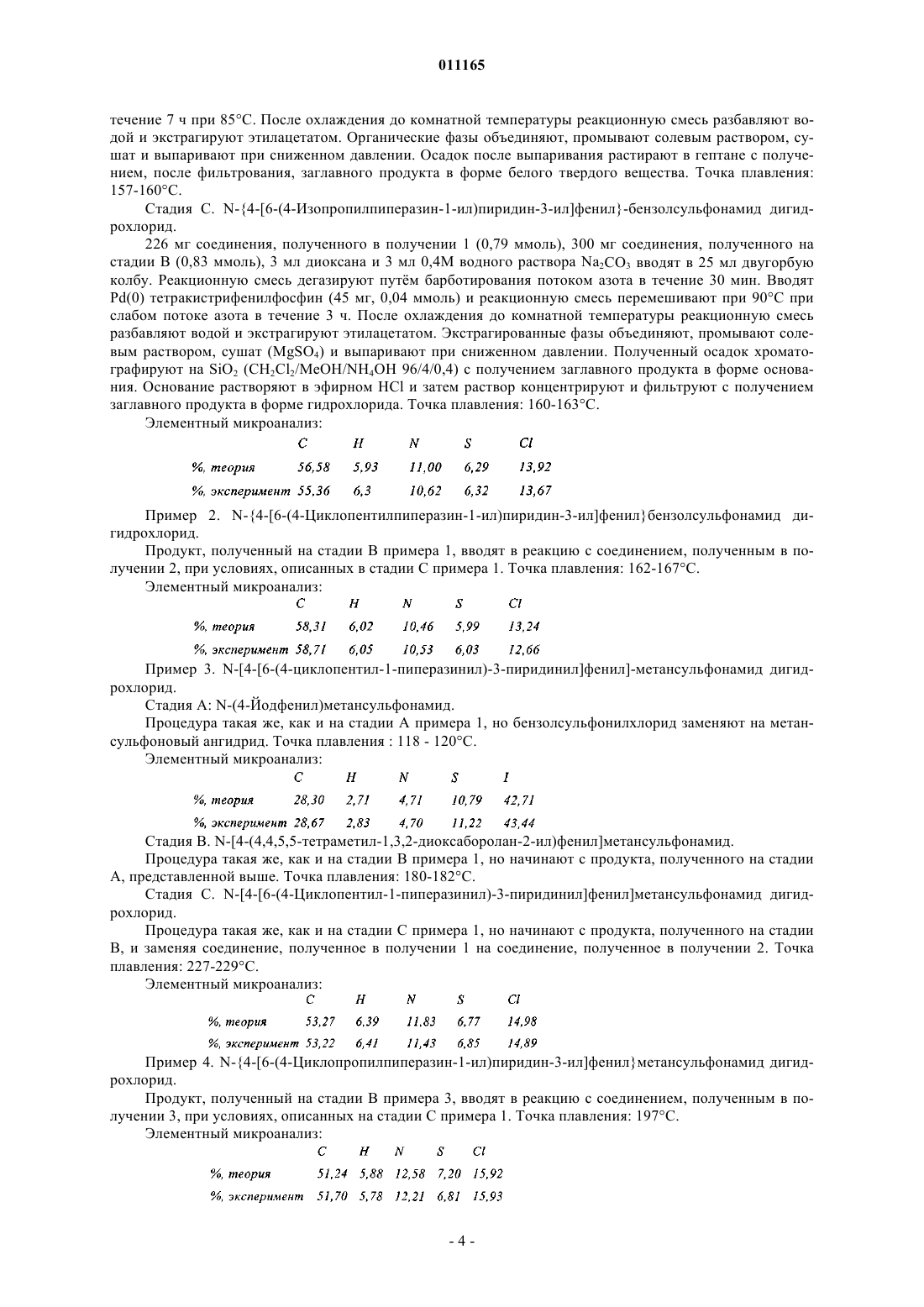
1. Соединения формулы (I)
в которой
R1 представляет собой NR3SO2R4 группу, где
R3 представляет собой атом водорода,
R4 представляет собой линейную или разветвлённую (С1-С6)алкильную группу, фенил, необязательно замещенный галогеном, или NR5R6 группу, где R5 и R6 вместе с несущим их атомом азота образуют 6-членное кольцо, в котором один из атомов углерода заменён на атом кислорода,
R2 представляет собой линейную или разветвлённую (С1-С6)алкильную группу или (С3-С8)циклоалкильную группу,
их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, в которых R4 представляет собой алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, в которых R2 представляет собой изопропильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, в которых R2 представляет собой циклопропильную или циклопентильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
5. Соединение формулы (I) по п.1, которое представляет собой N-[4-[6-(4-циклопентил-1-пиперазинил)-3-пиридинил]фенил]метансульфонамид дигидрохлорид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием.
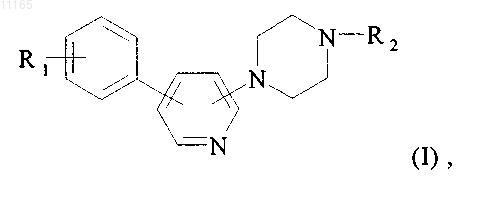
6. Способ получения соединений формулы (I), определенных в п.1, отличающийся тем, что в качестве исходного материала используют соединение формулы (II)
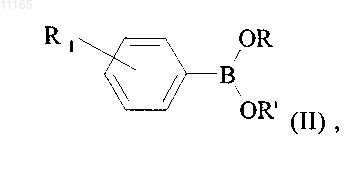
в которой R1 принимает значения, указанные для формулы (I), и R и R', которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвлённую (С1-С6)алкильную группу или вместе образуют линейную или разветвленную (С1-С6)алкиленовую цепь, которое конденсируют в присутствии палладия (0) с соединением формулы (III)
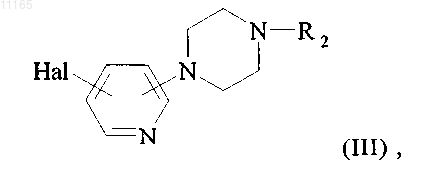
в которой R2 принимает значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы (I),
где соединение формулы (I) очищают, при необходимости, в соответствии с обычными способами очистки, разделяют, если приемлемо, на его изомеры в соответствии с обычными способами разделения и превращают, при желании, в его соли присоединения с фармацевтически приемлемой кислотой или основанием.
7. Фармацевтическая композиция, обладающая активностью антагониста центральных гистаминовых рецепторов типа Н3, которая включает в качестве активного ингредиента соединение по любому из пп.1-5 в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями.
8. Фармацевтическая композиция по п.7, используемая при изготовлении лекарственного средства - антагониста центральных гистаминовых рецепторов типа Н3.
9. Фармацевтическая композиция по п.7, которая содержит по крайней мере один активный ингредиент по любому из пп.1-5 и предназначена для использования в качестве лекарственного средства для лечения когнитивных недостаточностей, связанных со старением головного мозга и с нейродегенеративными болезнями, и для лечения расстройств настроения, приступов конвульсий, синдрома гиперактивности с недостатком внимания, ожирения, боли и нарколептических состояний.
10. Фармацевтическая композиция по п.7, которая содержит по крайней мере один активный ингредиент по любому из пп.1-5 и предназначена для использования в качестве лекарственного средства для лечения когнитивных недостаточностей, связанных с болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика, болезнью Корсакова и фронтальной или суб-кортикальной деменций васкулярного или другого происхождения.
Текст
011165 Настоящее изобретение относится к новым соединениям фенилпиридилпиперазина, к способу их получения и к фармацевтическим композициям, содержащим их. Соединения настоящего изобретения являются особенно ценными с фармакологической точки зрения из-за их специфического взаимодействия с центральными гистаминовыми рецепторами типа Н 3 и могут применяться в лечении невропатологий, связанных со старением головного мозга, расстройствами настроения, пищевым поведением и циклом бодрствование-сон, и синдрома гиперактивности с недостатком внимания. Старение населения из-за повышенной продолжительности жизни с рождения принесло с собой большое увеличение количества связанных с возрастом невропатологий и в особенности болезни Альцгеймера. Основными клиническими проявлениями старения головного мозга и в особенности связанных с возрастом невропатологий являются недостаточности в памяти и когнитивных функциях, которые могут привести к деменции. Недавние нейрофармакологические исследования показали, что в центральной нервной системе гистамин, через центральные гистаминергические системы, играет роль нейротрансмиттера или нейромодулятора в физиологической или физиопатологической ситуациях (Annu. Rev. Neurosci., 1986, 9, 209254; Physiol. Rev., 1991, 21, 1-51). Таким образом, было показано, что гистамин вовлечн в различные физиологические и поведенческие процессы, такие как терморегуляция, нейроэндокринная регуляция,циркадный ритм, каталептические состояния, моторика, агрессивность, пищевое поведение, обучение и запоминание и синоптическая пластичность (Hass и др., histaminergic neurones : morphology and function,Boca Raton, FL : CRC Press, 1991, стор. 196-208 ; Prog. Neurobiology, 2001, 63, 637-672). Из 3 подтипов гистаминового рецептора (H1, Н 2 и Н 3), вначале было показано, что рецептор типа Н 3 представляет собой пресинаптический ауторецептор, который контролирует высвобождение гистамина(Nature, 1987, 327, 117-123). Его активация ингибирует высвобождение и синтез гистамина с помощью механизма отрицательной обратной связи (Neuroscience, 1987, 23, 149-157). Впоследствии было продемонстрировано существование пресинаптических гетерорецепторов, способных модулировать высвобождение некоторых нейропептидов и многих нейротрансмиттеров, таких как норадреналин, серотонин,допамин, GABA, ацетилхолин и глутамат (TiPS, 1998, 19, 177-183). Исследования, проведнные на животных, показали, что повышение эндогенных экстрасинаптических уровней гистамина через блокирование рецепторов типа Н 3 с помощью Н 3 антагонистов делает возможным промотирование состояний бодрствования, обучения и процессов памяти, регулирования прима пищи и борьбы с приступами конвульсий (Prog. Neurobiol., 2000, 63, 637-672; Neurosci. Biobehav. Rev., 2000, 24, 107-113). Как результат,потенциальными терапевтическими показаниями для Н 3 антагонистов является лечение когнитивных недостаточностей, связанных со старением головного мозга и с нейродегенеративными болезнями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, болезнь Корсакова и фронтальная или субкортикальная деменции васкулярного или другого происхождения, а также лечение расстройств настроения, приступов конвульсий, синдрома гиперактивности с недостатком внимания, ожирения, боли и нарколептических состояний. Соединения настоящего изобретения, кроме того, что они имеют новую структуру, обладают фармакологическими свойствами, которые являются абсолютно неожиданными и ценными в данной области. Более конкретно, настоящее изобретение относится к соединениям формулы (I)R3 представляет собой атом водорода,R4 представляет собой линейную или разветвлнную (С 1-С 6)алкильную группу, фенил, необязательно замещенный галогеном, или NR5R6 группу, где R5 и R6, вместе с несущим их атомом азота, образуют 6-членное кольцо, в котором один из атомов углерода заменн на атом кислорода, R2 представляет собой линейную или разветвлнную (С 1-С 6)алкильную группу или (С 3-С 8)циклоалкильную группу,их энантиомерам и диастереоизомерам, а также их солям присоединения с фармацевтически приемлемой кислотой или основанием. Из числа фармацевтически приемлемых кислот можно отметить, не подразумевая никаких ограничений, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту и т. д. Среди фармацевтически приемлемых оснований можно отметить, не подразумевая никаких ограни-1 011165 чений, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Более особенно данное изобретение относится к соединениям формулы (I), в которой R4 представляет собой алкильную группу, например метильную группу. Предпочтение отдатся группе R3, которая представляет собой атом водорода. Преимущественно данное изобретение относится к соединениям формулы (I), в которой R5 и R6,вместе с атомом азота, несущим их, образуют 5- - 8-членное кольцо, в котором один из атомов углерода может быть заменн на атом азота, кислорода или серы или на SO или SO2 группу, например морфолиновую группу. Предпочтение отдатся R2 группе, которая представляет собой изопропильную, циклопропильную или циклопентильную группу. Ещ более особенно, данное изобретение относится к соединениям формулы (I), которые представляют собой:N-4-[6-(4-изопропилпиперазин-1-ил)пиридин-3-ил]фенилбензолсульфонамид дигидрохлорид,N-4-[6-(4-циклопентилпиперазин-1-ил)пиридин-3-ил]фенилбензолсульфонамид дигидрохлорид,N-4-[6-(4-циклопентил-1-пиперазинил)-3-пиридинил]фенил]метансульфонамид дигидрохлорид,N- 4-[6-(4-циклопропилпиперазин-1-ил)пиридин-3-ил]фенилметансульфонамид дигидрохлорид,N-4-[6-(4-изопропилпиперазин-1-ил)пиридин-3-ил]фенилморфолин-4-сульфонамид дигидрохлорид,N-4-[6-(4-изопропилпиперазин-1-ил)пиридин-3-ил]фенилметансульфонамид дигидрохлорид,N-4-[6-(4-изопропилпиперазин-1-ил)пиридин-3-ил]фенилпропан-2-сульфонамид дигидрохлорид,N-4-[6-(4-циклопентилпиперазин-1-ил)пиридин-3-ил]фенил-4-фторбензолсульфонамид дигидрохлорид,N-4-[6-(4-циклопентилпиперазин-1-ил)пиридин-3-ил]фенил-3-фторбензолсульфонамид дигидрохлорид,N-4-[6-(4-циклопентилпиперазин-1-ил)пиридин-3-ил]фенил-2-фторбензолсульфонамид дигидрохлорид. Данное изобретение также относится к способу получения соединений формулы (I), где способ характеризуется тем, что в качестве исходного материала используют соединение формулы (II): в которой R1 принимает значения, указанные для формулы (I), и R и R', которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвлнную(С 1-С 6)алкильную группу или вместе образуют линейную или разветвлнную (С 1-С 6)алкиленовую цепь,которое конденсируют в присутствии палладия(0) с соединением формулы (III): в которой R2 принимает значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы (I), где соединение формулы (I) очищают, при необходимости в соответствии с обычными способами очистки, разделяют, если приемлемо, на его изомеры в соответствии с обычными способами разделения и превращают, при желании, в его соли присоединения с фармацевтически приемлемой кислотой или основанием. Соединения формул (II) и (III), как показано выше, являются или коммерчески доступными, или их получают с помощью обычных реакций органической химии. Благодаря их фармакологическим свойствам как лигандов гистаминового рецептора Н 3, соединения настоящего изобретения являются полезными для лечения когнитивных недостаточностей, связанных со старением головного мозга и с нейродегенеративными болезнями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, болезнь Корсакова и фронтальная или субкортикальная деменции васкулярного или другого происхождения, а также для лечения расстройств настроения, приступов конвульсий, синдрома гиперактивности с недостатком внимания, ожирения, боли и нарколептических состояний. Настоящее изобретение относится также к фармацевтическим композициям, которые включают в качестве активного ингредиента по крайней мере одно соединение формулы (I), его изомер или его соль присоединения с фармацевтически приемлемой кислотой или основанием, отдельно или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями. Из числа фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются подходящими для перорального, парэнтерального (внутривенного, внутримышечного или-2 011165 подкожного), чрес- или транс-кожного, интравагинального, ректального, назального, подъязычного,глазного или респираторного применения. Фармацевтические композиции согласно изобретению для парэнтеральных инъекций в особенности включают водные и неводные стерильные растворы, дисперсии, суспензии или эмульсии, так же как и стерильные порошки для восстановления до инъекционных растворов или дисперсий. Фармацевтические композиции согласно изобретению для твердого перорального применения в особенности включают таблетки или драже, подъязычные таблетки, саше, капсулы и гранулы, и для жидкого перорального, назального, буккального или глазного применения в особенности включают эмульсии, растворы, суспензии, капли, сиропы и аэрозоли. Фармацевтические композиции для ректального или вагинального применения предпочтительно представляют собой суппозитории, и композиции для чрез- или транс-кожного применения в особенности включают порошки, аэрозоли, кремы, мази, гели и пластыри. Указанные выше фармацевтические композиции иллюстрируют изобретение, но никоим образом не ограничивают его. Среди инертных, нетоксичных, фармацевтически приемлемых наполнителей или носителей можно отметить, не подразумевая никаких ограничений, разбавители, растворители, консерванты, смачивающие агенты, эмульгаторы, дисперсанты, связующие агенты, агенты набухания, агенты, вызывающие дезинтеграцию, замедлители, лубриканты, поглощающие агенты, суспензионные агенты, красители, ароматизаторы и т.п. Полезная дозировка изменяется в соответствии с возрастом и весом пациента, путм применения,используемой фармацевтической композицией, природой и серьзностью расстройства, и применением каких-либо связанных видов лечения. Дозировка изменяется в пределах от 10 мг до 1 г в сутки в одно или больше применений. Следующие получения и примеры иллюстрируют изобретение, но никаким образом не ограничивают его. Используемые исходные материалы являются известными продуктами или продуктами, полученными согласно известным способам. Структуры соединений, описанных в примерах, были определены согласно обычным спектрофотометрическим способам (инфракрасная спектрометрия, ядерный магнитный резонанс (ЯМР), масс-спектрометрия и т.д.). Получение 1. 1-(5-Бромпиридин-2-ил)-4-изопропилпиперазин. Раствор, содержащий 12,1 г 2,5-дибромпиридина (51,1 ммоль), 8,8 мл 1-изопропилпиперазина (61,5 ммоль) и 9,2 мл DBU (61,5 ммоль), перемешивают в течение ночи при 100 С. Температуру реакционной смеси доводят до комнатной температуры и раствор разбавляют водой и экстрагируют этилацетатом. Органические фазы собирают, промывают солевым раствором, сушат (MgSO4) и выпаривают при сниженном давлении. Осадок хроматографируют на колонке SiO2, элюируя смесью CH2Cl2/MeOH 98/2 и затем 96/4, с получением заглавного продукта. Точка плавления: 76-78 С Элементный микроанализ: Получение 2. 1-(5-Бромпиридин-2-ил)-4-циклопентилпиперазин. Процедура такая же, как и в получении 1, но 1-изопропилпиперазин заменяют на 1-циклопентилпиперазин. Точка плавления: 127-128 С. Получение 3. 1-(5-Бромпиридин-2-ил)-4-циклопропилпиперазин. Процедура такая же, как и в получении 1, но 1-изопропилпиперазин заменяют на 1-циклопропилпиперазин. Точка плавления: 110-115 С. Пример 1. N-4-[6-(4-Изопропилпиперазин-1-ил)пиридин-3-ил]фенилбензолсульфонамид дигидрохлорид. Стадия А. N-(4-Йодфенил)бензолсульфонамид. К раствору 2,0 г 4-йоданилина (9,13 ммоль) в 40 мл ацетонитрила добавляют 1,48 мл пиридина(18,26 ммоль) и затем, по каплям, раствор 1,28 мл бензолсульфонилхлорида (10 ммоль) в 20 мл ацетонитрила. Реакционную смесь перемешивают в течение ночи при комнатной температуре и ацетонитрил выпаривают при сниженном давлении. Осадок переносят в 1N HCl и экстрагируют этилацетатом. Органическую фазу промывают солевым раствором, сушат (MgSO4) и выпаривают при сниженном давлении. Полученный маслянистый осадок растирают в изопропиловом эфире до того, как выкристаллизуется заглавный продукт. Точка плавления:141-143 С. Стадия В. N-[4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил]бензолсульфонамид. 500 мг соединения, полученного на стадии А (1,39 ммоль), 389 мг бис(пинаколато)диборана (1,53 ммоль), 410 мг ацетата калия (4,18 ммоль) и 5 мл диметилформамида вводят в 25 мл двугорлую колбу. Реакционную смесь дегазируют путм барботирования потоком азота в течение 30 мин и затем добавляют 16 мг ацетата палладия (0,07 ммоль). Реакционную смесь перемешивают при слабом потоке азота в-3 011165 течение 7 ч при 85C. После охлаждения до комнатной температуры реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органические фазы объединяют, промывают солевым раствором, сушат и выпаривают при сниженном давлении. Осадок после выпаривания растирают в гептане с получением, после фильтрования, заглавного продукта в форме белого твердого вещества. Точка плавления: 157-160 С. Стадия С. N-4-[6-(4-Изопропилпиперазин-1-ил)пиридин-3-ил]фенил-бензолсульфонамид дигидрохлорид. 226 мг соединения, полученного в получении 1 (0,79 ммоль), 300 мг соединения, полученного на стадии В (0,83 ммоль), 3 мл диоксана и 3 мл 0,4 М водного раствора Na2CO3 вводят в 25 мл двугорбую колбу. Реакционную смесь дегазируют путм барботирования потоком азота в течение 30 мин. ВводятPd(0) тетракистрифенилфосфин (45 мг, 0,04 ммоль) и реакционную смесь перемешивают при 90 С при слабом потоке азота в течение 3 ч. После охлаждения до комнатной температуры реакционную смесь разбавляют водой и экстрагируют этилацетатом. Экстрагированные фазы объединяют, промывают солевым раствором, сушат (MgSO4) и выпаривают при сниженном давлении. Полученный осадок хроматографируют на SiO2 (CH2Cl2/MeOH/NH4OH 96/4/0,4) с получением заглавного продукта в форме основания. Основание растворяют в эфирном HCl и затем раствор концентрируют и фильтруют с получением заглавного продукта в форме гидрохлорида. Точка плавления: 160-163 С. Элементный микроанализ: Пример 2. N-4-[6-(4-Циклопентилпиперазин-1-ил)пиридин-3-ил]фенилбензолсульфонамид дигидрохлорид. Продукт, полученный на стадии В примера 1, вводят в реакцию с соединением, полученным в получении 2, при условиях, описанных в стадии С примера 1. Точка плавления: 162-167 С. Элементный микроанализ: Пример 3. N-[4-[6-(4-циклопентил-1-пиперазинил)-3-пиридинил]фенил]-метансульфонамид дигидрохлорид. Стадия А: N-(4-Йодфенил)метансульфонамид. Процедура такая же, как и на стадии А примера 1, но бензолсульфонилхлорид заменяют на метансульфоновый ангидрид. Точка плавления : 118 - 120 С. Элементный микроанализ: Стадия В. N-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метансульфонамид. Процедура такая же, как и на стадии В примера 1, но начинают с продукта, полученного на стадии А, представленной выше. Точка плавления: 180-182 С. Стадия С. N-[4-[6-(4-Циклопентил-1-пиперазинил)-3-пиридинил]фенил]метансульфонамид дигидрохлорид. Процедура такая же, как и на стадии С примера 1, но начинают с продукта, полученного на стадии В, и заменяя соединение, полученное в получении 1 на соединение, полученное в получении 2. Точка плавления: 227-229 С. Элементный микроанализ: Пример 4. N-4-[6-(4-Циклопропилпиперазин-1-ил)пиридин-3-ил]фенилметансульфонамид дигидрохлорид. Продукт, полученный на стадии В примера 3, вводят в реакцию с соединением, полученным в получении 3, при условиях, описанных на стадии С примера 1. Точка плавления: 197C. Элементный микроанализ:-4 011165 Пример 5. N-4-[6-(4-Изопропилпиперазин-1-ил)пиридин-3-ил]фенилморфолин-4-сульфонамид дигидрохлорид. Стадия А. N-(4-Йодфенил)морфолин-4-сульфонамид. К раствору 10 г 4-йоданилина (45,6 ммоль) в 200 мл ацетонитрила добавляют 6,41 мл Et3N (45,6 ммоль) и 8,47 г морфолин-4-сульфонилхлорида (45,6 ммоль). Реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Ацетонитрил выпаривают в вакууме и осадок переносят в 1N HCl и экстрагируют с помощью CH2Cl2. Органические фазы объединяют, промывают солевым раствором, сушат (MgSO4) и обрабатывают с помощью животного угля с получением заглавного продукта. Точка плавления: 91 С. Стадия В. N-[4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил]морфолин-4-сульфонамид. Процедура такая же, как и на стадии В примера 1, но начинают с продукта, полученного на стадии А. Точка плавления: 158-161 С. Стадия С: N-4-[6-(4-Изопропилпиперазин-1-ил)пиридин-3-ил]фенил-морфолин-4-сульфонамид дигидрохлорид. Процедура такая же, как и на стадии С примера 1, но начинают с продукта, полученного на стадии В. Точка плавления: 194-198C. Элементный микроанализ:-5 011165 Стадия А. N-4-[6-(4-Циклопентилпиперазин-1-ил)пиридин-3-ил]фениламин. Процедура такая же, как и в стадии С примера 1, используя [4-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)фенил]амин. Точка плавления: 160-162 С. Стадия В. N-4-[6-(4-Циклопентилпиперазин-1-ил)пиридин-3-ил]фенил-4-фторбензолсульфонамид дигидрохлорид. Суспензию, содержащую 200 мг (0,620 ммоль) продукта, полученного в стадии А, и 302 мг (1,55 ммоль) хлорангидрида 4-фторфенилсульфоновой кислоты в 2 мл пиридина перемешивают в течение 3 ч при 80 С. После охлаждения до комнатной температуры реакционную смесь осаждают путм добавления воды. Осадок собирают фильтрованием, растворяют в смеси CH2Cl2/MeOH, абсорбируют на приблизительно 1 г кремнезма и хроматографируют на кремнеземной колонке, элюируя смесьюCH2O2/MeOH/NH3 98/2/0,2. Дигидрохлорид образуется путм перенесения основания в этанол и добавления эфирного HCl. Точка плавления : 256 - 262 С. Элементный микроанализ: Фармакалогическое исследование соединений изобретения Пример А. Уровни N-метилгистамина в головном мозге NMRI мыши. Цель настоящего исследования, которое выполняли в соответствии со способом Taylor и других(Biochem. Pharm., 1992, 44, 1261-1267), заключается в оценивании ex vivo активности соединений настоящего изобретения в качестве антагонистов центральных гистаминовых рецепторов типа Н 3. Эту активность выявляют путм измерения, после лечения внутрибрюшинно с помощью тестовых соединений,уровней N-метилгистамина в головном мозге, который является основным метаболитом гистамина. Увеличение в концентрациях N-метилгистамина в головном мозге показывает увеличение в обороте гистамина путм блокировки центральных гистаминовых рецепторов типа Н 3.NMRI мышей (18-20 г) обрабатывают внутрибрюшинно или перорально соединениями настоящего изобретения или их носителем (20 мл/кг). Через 1 ч после фармакологической обработки животных умерщвляют, и их головной мозг извлекают, замораживают в жидком азоте, взвешивают и гомогенизируют в 0,1 N HClO4 при 4C. Гомогенизированные продукты центрифугируют (15000 g, 17 мин, 4 С). Надосадочную жидкость выделяют и разделяют на аликвоты. Аликвоты замораживают в жидком азоте и хранят при - 80 С до проведения анализа. Определение уровней N-метилгистамина в головном мозге проводят с помощью радиоиммунологического анализа (RIA), используя соответствующий набор реактивов. Уровни N-метилгистамина в тканях выражают в мкг/г свежего головного мозга. Сравнение уровней N-метилгистамина в головном мозге между животными, обработанными носителем (контрольная группа), и животными, обработанными соединениями настоящего изобретения, проводят с помощью однофакторного дисперсионного анализа, который сопровождается, при необходимости, комплементарным анализом (тест Даннета). Результаты показывают, что, при дозах от 1 до 10 мг/кг перорально, соединения настоящего изобретения способны повышать эндогенные концентрации N -метил-гистамина в головном мозге на 100%.-6 011165 В качестве примера, соединения примеров 4 и 7, которые применяют в дозах 10 мг/кг и 3 мг/кг перорально, соответственно, позволяют получить повышение в эндогенных концентрациях Nметилгистамина в головном мозге на 162 и 138%, соответственно. Эти результаты показывают, что соединения настоящего изобретения являются мощными антагонистами центральных гистаминовых рецепторов типа Н 3. Пример В. Электроэнцефалографические записи на свободно двигающихся крысах. Взрослым крысам Уистара мужского пола на вс время анализа имплантируют электроды, расположенные над лобной и теменной корой. Кортикальную электроэнцефалограмму (EEG) записывают для крыс, помещнных внутрь клеток в комнате с шумоподавлением. Соединения и носитель применяют случайным образом в 10:00 утра в те же самые дни с минимальным интервалом в 3 дня между каждым применением, при этом каждая крыса сама себе служит контролем. Абсолютную мощность активности дельта полосы медленной волны (1-4 Гц), которая преобладает в течение сна медленной волны и исчезает в течение бодрствования и быстрого сна, усредняют за следующие один за другим периоды по 30 мин. В течение 30 мин, низкие и высокие значения дельта мощности медленной волны обозначают признаки бодрствования и сна, соответственно. Результаты показывают, что соединения настоящего изобретения повышают бодрствование (понижают активность дельта полосы) для доз, которые находятся в интервале между 0,3 и 3 мг/кг внутрибрюшинно. Пример С. Фармацевтическая композицияR3 представляет собой атом водорода,R4 представляет собой линейную или разветвлнную (С 1-С 6)алкильную группу, фенил, необязательно замещенный галогеном, или NR5R6 группу, где R5 и R6 вместе с несущим их атомом азота образуют 6-членное кольцо, в котором один из атомов углерода заменн на атом кислорода,R2 представляет собой линейную или разветвлнную (С 1-С 6)алкильную группу или (С 3 С 8)циклоалкильную группу,их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1, в которых R4 представляет собой алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, в которых R2 представляет собой изопропильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, в которых R2 представляет собой циклопропильную или циклопентильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединение формулы (I) по п.1, которое представляет собой N-[4-[6-(4-циклопентил-1-пиперазинил)-3-пиридинил]фенил]метансульфонамид дигидрохлорид, а также его соли присоединения с фар-7 011165 мацевтически приемлемой кислотой или основанием. 6. Способ получения соединений формулы (I), определенных в п.1, отличающийся тем, что в качестве исходного материала используют соединение формулы (II) в которой R1 принимает значения, указанные для формулы (I), и R и R', которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвлнную(С 1-С 6)алкильную группу или вместе образуют линейную или разветвленную (С 1-С 6)алкиленовую цепь,которое конденсируют в присутствии палладия (0) с соединением формулы (III) в которой R2 принимает значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы (I),где соединение формулы (I) очищают, при необходимости, в соответствии с обычными способами очистки, разделяют, если приемлемо, на его изомеры в соответствии с обычными способами разделения и превращают, при желании, в его соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Фармацевтическая композиция, обладающая активностью антагониста центральных гистаминовых рецепторов типа Н 3, которая включает в качестве активного ингредиента соединение по любому из пп.1-5 в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями. 8. Фармацевтическая композиция по п.7, используемая при изготовлении лекарственного средства антагониста центральных гистаминовых рецепторов типа Н 3. 9. Фармацевтическая композиция по п.7, которая содержит по крайней мере один активный ингредиент по любому из пп.1-5 и предназначена для использования в качестве лекарственного средства для лечения когнитивных недостаточностей, связанных со старением головного мозга и с нейродегенеративными болезнями, и для лечения расстройств настроения, приступов конвульсий, синдрома гиперактивности с недостатком внимания, ожирения, боли и нарколептических состояний. 10. Фармацевтическая композиция по п.7, которая содержит по крайней мере один активный ингредиент по любому из пп.1-5 и предназначена для использования в качестве лекарственного средства для лечения когнитивных недостаточностей, связанных с болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика, болезнью Корсакова и фронтальной или суб-кортикальной деменций васкулярного или другого происхождения.
МПК / Метки
МПК: A61K 31/496, C07D 213/74, A61P 25/00
Метки: получения, фармацевтические, содержащие, способ, фенилпиридилпиперазина, соединения, композиции
Код ссылки
<a href="https://eas.patents.su/9-11165-soedineniya-fenilpiridilpiperazina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения фенилпиридилпиперазина, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Производные пиримидина для профилактики вич-инфекции
Следующий патент: Композиции слитых белков-аналогов glp-1
Случайный патент: Лечебно-профилактическое средство, обладающее антибактериальным и спермицидным действием