Противоопухолевые составы, содержащие производные таксанов
Формула / Реферат
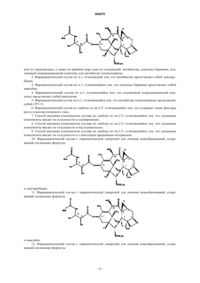
1. Фармацевтический состав, содержащий соединение формулы 1
или его производное, а также по крайней мере одно из соединений: антибиотик, алкалоид барвинка, платиновый координационный комплекс или ингибитор топоизомеразы.
2. Фармацевтический состав по п.1, отличающий тем, что антибиотик представляет собой доксорубицин.
3. Фармацевтический состав по п.1, отличающийся тем, что алкалоид барвинка представляет собой навелбин.
4. Фармацевтический состав по п.1, отличающийся тем, что платиновый координационный комплекс представляет собой цисплатин.
5. Фармацевтический состав по п.1, отличающийся тем, что ингибитор топоизомеразы представляет собой СРТ-11.
6. Фармацевтический состав по любому из пп.2-5, отличающийся тем, что содержит также факторы роста гематопоэтического типа.
7. Способ введения компонентов состава по любому из пп.2-5, отличающийся тем, что указанные компоненты вводят по отдельности и одновременно.
8. Способ введения компонентов состава по любому из пп.2-5, отличающийся тем, что указанные компоненты вводят по отдельности и последовательно.
9. Способ введения компонентов состава по любому из пп.2-5, отличающийся тем, что указанные компоненты вводят по отдельности и с некоторым временным интервалом.
10. Фармацевтический состав с терапевтической синергией для лечения новообразований, содержащий соединение формулы
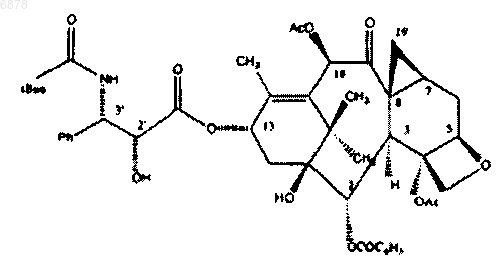
и доксорубицин.
11. Фармацевтический состав с терапевтической синергией для лечения новообразований, содержащий соединение формулы
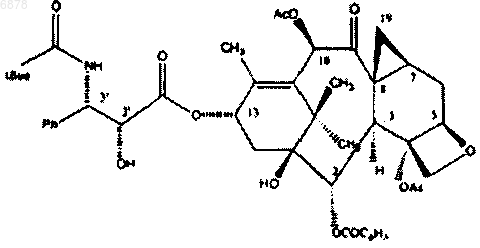
и навелбин.
12. Фармацевтический состав с терапевтической синергией для лечения новообразований, содержащий соединение формулы
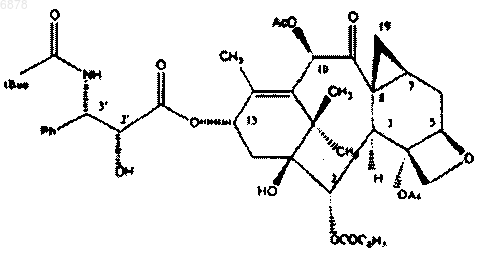
и цисплатин.
13. Фармацевтический состав с терапевтической синергией для лечения новообразований, содержащий соединение формулы
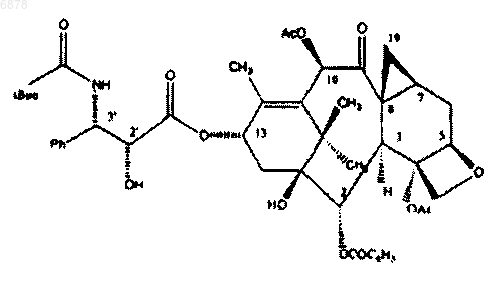
и СРТ-11.
14. Способ введения компонентов состава по любому из пп.10-13, отличающийся тем, что компоненты состава вводятся одновременно.
15. Способ введения компонентов состава по любому из пп.10-13, отличающийся тем, что компоненты состава вводятся по отдельности и одновременно.
16. Способ введения компонентов состава по любому из пп.10-13, отличающийся тем, что компоненты состава вводятся по отдельности и с некоторым временным интервалом.
17. Способ введения компонентов состава по любому из пп.10-13, отличающийся тем, что компоненты состава вводятся по отдельности и последовательно.
18. Фармацевтический состав по п.10 или 11, отличающийся тем, что новообразование представляет собой рак молочной железы.
19. Фармацевтический состав по п.12 или 13, отличающийся тем, что новообразование представляет собой рак толстой кишки.
Текст
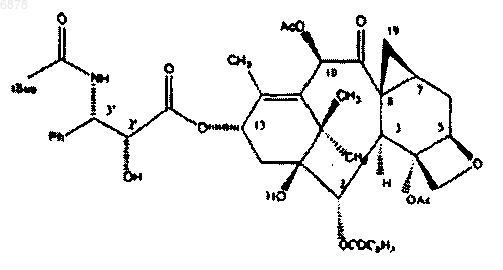
006878 Заявка является частичным продолжением заявки на патент США 09/705,739, поданной 6 ноября 2000 г., которая является выделенной заявкой 09/371,520, поданной 10 августа 1999 г., которая является продолжением заявки 09/182,900, поданной 30 октября 1998 г., в настоящее время отозванной, которая является выделенной заявкой 08/967,036, поданной 10 ноября 1997 г., в настоящее время патент США 5908835, который является выделенной заявкой 08/424,470, поданной 9 мая 1995 г., в настоящее время патент США 5728687. Настоящее изобретение относится к комбинациям таксола, таксотера, а также их аналогов и веществ, имеющих терапевтический эффект при лечении новообразований. Таксол, таксотер и их аналоги, которые обладают значительными противоопухолевыми и антилейкозными свойствами, являются особенно эффективными при лечении раковых заболеваний толстой кишки, яичника, молочной железы или легкого. Способы приготовления таксола, таксотера и их производных являются предметами изобретения,например, европейских патентов ЕР 0253738 и ЕР 0253739 и международной заявки РСТ WO 92/09589. Как правило, используемые дозы в зависимости от характерных особенностей пациента варьируются между 1 и 10 мг/кг при интраперитонеальном введении или между 1 и 3 мг/кг при внутривенном введении. В настоящее время установлено, что эффективность таксола, таксотера и их аналогов может быть значительно повышена при введении в комбинации по меньшей мере с одним веществом, обладающим терапевтическим эффектом при лечении раковых заболеваний и имеющим механизм действия, идентичный или отличный от этих производных таксанов. Такие комбинации и составляют предмет настоящего изобретения. Среди веществ, которые могут быть использованы в сочетании или в комбинации с таксолом, таксотером или их аналогами, можно назвать алкилирующие средства типа циклофосфамида, изосфамида,мелфалана, гексаметилмеламина, тиотепы или дакарбазина, антиметаболиты типа аналогов пиримидина,например 5-фторурацил и цитарабин, или его аналоги типа 2-фтордезоксицитидина, или аналогов фолиевой кислоты типа метотрексата, идатрексата или триметрексата, веретенные яды (структура которых состоит из микротрубочек и ассоциированных с ними белков), включая алкалоиды барвинка типа винбластина или винкристина, или их синтетические аналоги типа навелбина или эстрамустина, или таксоиды,эпидофиллотоксины типа этопозида или тенипозида, антибиотики типа даунорубицина, доксорубицина,блеомицина или митомицина, ферменты типа L-аспарагиназы, ингибиторы топоизомеразы типа производных камптотецина, в качестве которых могут выступать СРТ-11 и топотекан, или производных пиридобензоиндола и различных средств типа прокарбазина и митоксантрона, платиновые координационные комплексы типа цисплатина или карбоплатина и модификаторы биологических реакций или ингибиторы факторов роста типа интерферонов или интерлейкинов. Кроме того, так как активность лекарственных средств зависит от применяемых доз, то возможно использование более высоких доз и повышение активности при уменьшении явлений токсичности или отсрочки их появления в результате комбинаций факторов роста гематопоэтического типа, таких как гранулоцитарный (G-CSF) и гранулоцитарномакрофагальный (GM-CSF) колоние-стимулирующие факторы, или определенных интерлейкинов с таксолом, таксотером, их аналогами или их комбинациями с другими терапевтически активными веществами. Комбинации или сочетания согласно изобретению позволяют избежать или задержать явление плейотропной резистентности или "множественной лекарственной резистентности". Более конкретно, изобретение относится к области уровня техники, касающейся комбинаций таксола, таксотера и их аналогов с алкалоидами барвинка, циклофосфамидом, 5-фторурацилом, доксорубицином, цисплатином, навелбином, камптотецином и этопозидом. Повышенная эффективность комбинации согласно изобретению может быть продемонстрирована путем определения терапевтической синергии. Комбинация проявляет терапевтическую синергию, если по терапевтическому эффекту она превышает один или другой из компонентов, используемых в своих оптимальных дозах (Т.Х. Корбетт и др. Отчеты о методах лечения рака, 66: 1187 (1982. Для демонстрации эффективности комбинации, по-видимому, необходимо сравнить предельно допустимую дозу комбинации с предельно допустимой дозой каждого из отдельных компонентов в рассматриваемом исследовании. Эта эффективность может быть определена количественно, например, поlog10 гибели клеток, который вычисляется по следующей формуле:log10 гибели клеток = Т-С (в днях)/3,32 Тd,в которой Т-С представляет собой время роста клеток, являющееся средним временем в днях для групп(Т) и (С), прошедших курс лечения, в течение которого опухоли достигали определенной массы (1 г например), а Тd - время в днях, необходимое для удвоения объема опухоли у контрольных животных [Т.Х. Корбетт и др. Рак, 40, 2660-2680 (1977); Ф.М. Шебель и др. Разработка лекарственных средств от рака,часть В, Способы исследования рака, 17, 3-51, Нью-Йорк, Академик Пресс Инк. (1979)]. Лекарственное средство считается активным, если log10 гибели клеток составляет не менее 0,7, и очень активным, еслиlog10 гибели клеток превышает 2,8. Комбинация, используемая в своей собственной предельно допустимой дозе, в которой каждый из-1 006878 компонентов будет присутствовать в дозе, как правило, не превышающей предельно допустимой дозы,будет проявлять терапевтическую синергию, если log10 гибели клеток больше значения log10 гибели клеток лучшего компонента при его отдельном применении. Эффективность комбинаций при лечении твердых опухолей может быть определена экспериментально следующим образом. Животные, участвующие в эксперименте, большей частью мыши, в 0-й день подвергаются двусторонней подкожной пересадке фрагмента опухоли массой 30-60 мг. Перед проведением различных видов лечения и контроля привитые опухолями животные перемешиваются. В случае лечения запущенных опухолей им позволяют развиться до требуемого размера, а животные с недостаточно развившимися опухолями исключаются из эксперимента. Для проведения лечения и контроля отобранные животные распределяются произвольно. Животные, не привитые опухолями, могут также быть подвергнуты тем же самым видам лечения, как и привитые опухолями животные, чтобы можно было отделить токсический эффект от специфического эффекта на опухоль. Химиотерапия, как правило, начинается с 3-го по 22-й день после пересадки, в зависимости от типа опухоли, и наблюдение за животными осуществляется каждый день. Различные группы животных взвешиваются 3 или 4 раза в неделю до достижения максимальной потери в весе, после чего взвешивание осуществляется по меньшей мере один раз в неделю до конца испытания. Опухоли измеряются 2 или 3 раза в неделю, пока опухоль не достигает приблизительно 2 г или пока животное не погибает, если это происходит прежде, чем опухоль достигает 2 г. После умерщвления животные подвергаются патологоанатомическому исследованию. Противоопухолевая активность определяется в соответствии с различными зарегистрированными параметрами. Для исследования комбинаций на лейкемиях животным прививается определенное количество клеток, и противоопухолевая активность определяется увеличением времени выживания мышей, прошедших курс лечения, по отношению к контрольным. Лекарственное средство считается активным, если увеличение времени выживания превышает 27%, и считается очень активным, если это увеличение превышает 75% в случае лейкемий Р 388. Результаты, полученные с комбинациями таксотера и различных химиотерапевтических средств типа циклофосфамида (алкилирующее средство), 5-фторурацила (антиметаболит), этопозида (полусинтетический подофиллотоксин) и винкристина (алкалоид барвинка), использованными в своих оптимальных дозах, приведены в качестве примеров в следующих таблицах. Таблица 1 Эксперименты также проводились с использованием аналога таксотера N-дебензоил-N-t-бутоксикарбонил-7-дезокси-8-десметил-7,8-циклопропатаксотера (в дальнейшем ацетоциклопропилтаксотер) и нескольких химиотерапевтических средств. Ацетоциклопропилтаксотер имеет следующую структуру: Оценка комбинаций ацетоциклопропилтаксотера и различных химиотерапевтических средств типа доксорубицина (антибиотик), цисплатина (платиновый координационный комплекс), навелбина (веретенный яд) и СРТ-11 (ингибитор топоизомеразы) была проведена на мышах с подкожно пересаженными опухолями. Выбор модели опухоли для оценки каждой комбинации лекарственного средства, в общем,осуществлялся на основе ее реактивности к каждому из средств при его применении в качестве монотерапевтического. Для каждого отдельного средства и каждой комбинации были проведены исследования реакции на полную дозу с использованием прерывистых графиков внутривенного введения. В дополнение к параметрам, описанным выше, определялся показатель токсичности комбинации(ПТК). См. Корбетт Т.X. и др. Реакция пересаженных мышам опухолей на производные антраценедиона в отдельности и в комбинации с клинически полезными средствами. Отчеты о методах лечения рака, 66: 1187-1200 (1982). ПТК представляет собой сумму фракций 10%-ных летальных доз (LDsub10) каждого отдельного средства, используемого в оптимальной комбинации, и показывает степень перекрытия токсичности главного компонента. Например, ПТК 1 указывает на то, что только 50% LD10 каждого отдельного средства (или в любом из соотношений 70:30, 40:60 и т.д.) может быть использовано в комбинациях, не вызывая дополнительной токсичности, а ПТК 2 указывает на возможность использования в комбинации 100% LD10 каждого отдельного средства. В следующей ниже табл. 5 приведены результаты исследования терапевтической реакции для каждой комбинации и наивысшие нетоксические дозы компонентов как при использовании в качестве отдельных средств, так и в комбинациях.-3 006878 Таблица 5 Исследование комбинаций циклопропатоксола при оптимальной дозе Использованные аббревиатуры: Td - время удвоения объема опухоли, ПТК - показатель токсичности комбинации, ВБПЗ - выживаемость без признаков заболевания. Комбинация с доксорубицином при оптимальной концентрации у мышей, привитых МА 13/С, позволила получить log10 гибели клеток 5,3 и достичь полной (100%) регрессии, в то время как отдельные средства имели более низкий log10 гибели клеток. Так, log10 гибели клеток для ацетоциклопропилтаксотера составил 2,9, а для доксорубицина - 3,0. Показатель токсичности комбинации составил 1,42, что указывает на возможность использовать в комбинации приблизительно 70% наивысших нетоксичных доз-4 006878 каждого отдельного средства, не вызывая при этом дополнительной токсичности. Применение оптимальной комбинации с цисплатином на мышах, привитых Colon 51, позволило получить log10 гибели клеток 3,6 и выживаемость без признаков заболевания 2/7 на 122-й день. В случаях отдельного применения log10 гибели клеток для ацетоциклопропилтаксотера составил 1,4, а для цисплатина - 2,7 при отсутствии выживших животных без признаков заболевания. Было получено значительное перекрытие токсичности главного компонента. ПТК 0,68 указывает на возможность использовать в комбинации менее 35% каждого отдельного средства. Однако при получении цисплатина мыши не были гипергидратированы, что может объяснять такую степень токсичности. Комбинация ацетоциклопропилтаксотера с СРТ-11 продемонстрировала, по меньшей мере, такие же хорошие результаты, как лучшее отдельное средство в комбинациях (log10 гибели клеток 1,7 для комбинации против 1,5 для ацетоциклопропилтаксотера и 1,1 для СРТ-11). Однако ПТК 0,6 указывает на значительное перекрытие токсичности главного компонента. Наконец, был получен очень хороший синергический эффект между ацетоциклопропилтаксотером и навелбином на мышах, привитых МА 17/А. Так, для комбинации log10 гибели клеток составил 8,1 (и 2 выживших животных без признаков заболевания на 123-й день) против 4,8 для ацетоциклопропилтаксотера и 5,5 для навелбина. Комбинация имеет умеренное перекрытие токсичности главного компонента с ПТК 1,42. В целом для всех четырех исследованных комбинаций ацетоциклопропилтаксотера было установлено наличие синергического эффекта, т.е. противораковая активность в комбинации была выше, чем у отдельного средства при наивысшей нетоксической дозе. С точки зрения переносимости комбинация ацетоциклопропилтаксотера с доксорубицином или навелбином, ПТК которой составил приблизительно 1,4, продемонстрировала хорошие результаты, в то время как в случае комбинации ацетоциклопропилтаксотера с цисплатином или с СРТ-11 (ПТК 1) требуется сокращение дозы. Поэтому настоящее изобретение также относится к фармацевтическим составам, содержащим комбинации согласно изобретению. Для получения максимальной эффективности компоненты в составе комбинации могут применяться одновременно, почти одновременно, по отдельности или с некоторым временным интервалом, что позволяет варьировать длительность каждого приема от скоростного до непрерывной перфузии. В результате, предметами настоящего изобретения являются не только комбинации, полученные физическим сочетанием компонентов, но также и комбинации, допускающие введение компонентов по отдельности, которое может осуществляться одновременно или с некоторым временным интервалом. Согласно изобретению составы в предпочтительном варианте могут применяться парентерально. Однако в случаях проведения ограниченной локальной терапии эти составы могут использоваться перорально или интраперитонеально. Составы для парентерального введения, как правило, являются фармацевтически переносимыми стерильными растворами или суспензиями, которые могут быть по выбору приготовлены при необходимости применения. Для приготовления неводных растворов или суспензий могут быть использованы природные растительные масла типа оливкового или кунжутного, или нефть или впрыскиваемые органические сложные эфиры типа этилолеата. Стерильные водные растворы могут представлять собой растворы лекарственного препарата в воде. Водные растворы для внутривенного введения должны иметь соответствующий рН и быть изотоническими, например с достаточным количеством хлористого натрия или глюкозы. Стерилизация может быть выполнена путем нагрева или любым другим способом, не оказывающим неблагоприятного воздействия на состав. Комбинации могут также быть выполнены в форме липосом или в сочетании с такими носителями как циклодекстрилы или полиэтиленгликоли. Составы для перорального или интраперитонеального введения в предпочтительном варианте являются водными суспензиями или растворами. В комбинациях согласно изобретению введение компонентов может осуществляться одновременно,по отдельности или с некоторым временным интервалом, что является особенно удобным с точки зрения возможности варьировать количество производной таксанов по массе от 10 до 90% и позволяет изменять ее количество в соответствии с природой другого вещества, используемого в комбинации, требуемой эффективностью и характером ракового заболевания у пациента. Комбинации согласно изобретению характеризуются особенной эффективностью при лечении раковых заболеваний толстой кишки, молочной железы, яичника или легкого, а также меланомы и лейкемии. В частности, такие комбинации обеспечивают возможность использования компонентов в значительно более низких дозах, чем при их отдельном применении. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтический состав, содержащий соединение формулы 1 или его производное, а также по крайней мере одно из соединений: антибиотик, алкалоид барвинка, платиновый координационный комплекс или ингибитор топоизомеразы. 2. Фармацевтический состав по п.1, отличающий тем, что антибиотик представляет собой доксорубицин. 3. Фармацевтический состав по п.1, отличающийся тем, что алкалоид барвинка представляет собой навелбин. 4. Фармацевтический состав по п.1, отличающийся тем, что платиновый координационный комплекс представляет собой цисплатин. 5. Фармацевтический состав по п.1, отличающийся тем, что ингибитор топоизомеразы представляет собой СРТ-11. 6. Фармацевтический состав по любому из пп.2-5, отличающийся тем, что содержит также факторы роста гематопоэтического типа. 7. Способ введения компонентов состава по любому из пп.2-5, отличающийся тем, что указанные компоненты вводят по отдельности и одновременно. 8. Способ введения компонентов состава по любому из пп.2-5, отличающийся тем, что указанные компоненты вводят по отдельности и последовательно. 9. Способ введения компонентов состава по любому из пп.2-5, отличающийся тем, что указанные компоненты вводят по отдельности и с некоторым временным интервалом. 10. Фармацевтический состав с терапевтической синергией для лечения новообразований, содержащий соединение формулы и доксорубицин. 11. Фармацевтический состав с терапевтической синергией для лечения новообразований, содержащий соединение формулы и навелбин. 12. Фармацевтический состав с терапевтической синергией для лечения новообразований, содержащий соединение формулы и цисплатин. 13. Фармацевтический состав с терапевтической синергией для лечения новообразований, содержащий соединение формулы и СРТ-11. 14. Способ введения компонентов состава по любому из пп.10-13, отличающийся тем, что компоненты состава вводятся одновременно. 15. Способ введения компонентов состава по любому из пп.10-13, отличающийся тем, что компоненты состава вводятся по отдельности и одновременно. 16. Способ введения компонентов состава по любому из пп.10-13, отличающийся тем, что компоненты состава вводятся по отдельности и с некоторым временным интервалом. 17. Способ введения компонентов состава по любому из пп.10-13, отличающийся тем, что компоненты состава вводятся по отдельности и последовательно. 18. Фармацевтический состав по п.10 или 11, отличающийся тем, что новообразование представляет собой рак молочной железы. 19. Фармацевтический состав по п.12 или 13, отличающийся тем, что новообразование представляет собой рак толстой кишки.
МПК / Метки
МПК: A61P 35/00, A61K 31/337
Метки: производные, противоопухолевые, содержащие, таксанов, составы
Код ссылки
<a href="https://eas.patents.su/8-6878-protivoopuholevye-sostavy-soderzhashhie-proizvodnye-taksanov.html" rel="bookmark" title="База патентов Евразийского Союза">Противоопухолевые составы, содержащие производные таксанов</a>
Предыдущий патент: Производные гидроксамовой кислоты
Следующий патент: Вирус, вызывающий заболевание дыхательных путей у восприимчивых млекопитающих
Случайный патент: Способ загрузки мелкозернистых металлов в электрическую дуговую печь