Способ получения циталопрама
Формула / Реферат
1. Способ получения циталопрама, включающий стадии
a) восстановительного гидролиза соединения формулы IV
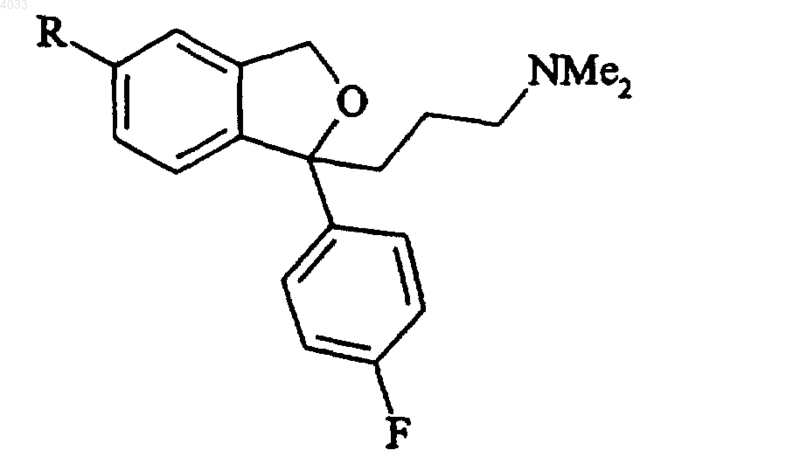
Формула IV
где R представляет собой группу
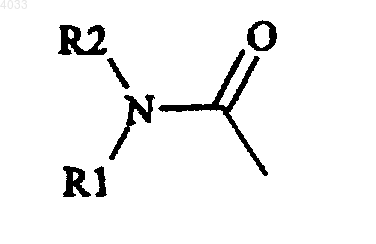
где R1 и R2 независимо выбирают из C1-6алкила, моно- или бициклической карбоциклической ароматической группы и моно- или бициклической гетероциклической ароматической группы, или R1 и R2 соединены и вместе обозначают 4- или 5-членную цепочку, необязательно содержащую атом S, O или N,
4,5-дигидро-1,3-оксазол-2-ил, необязательно замещенный в 4-ом и/или 5-ом положении одной или несколькими C1-6алкильной, моно- или бициклической карбоциклической ароматической или моно- или бициклической гетероциклической ароматической группами,
и
b) превращения полученного 5-формильного производного формулы V
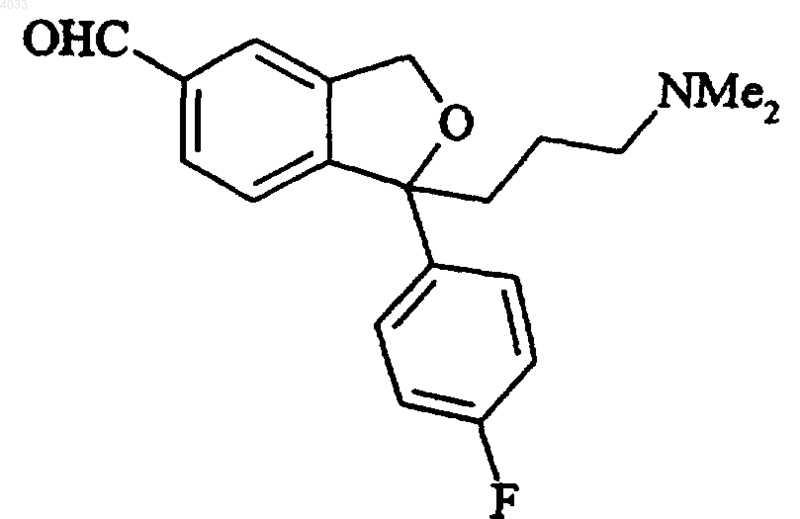
Формула V
в соответствующее 5-цианопроизводное, циталопрам
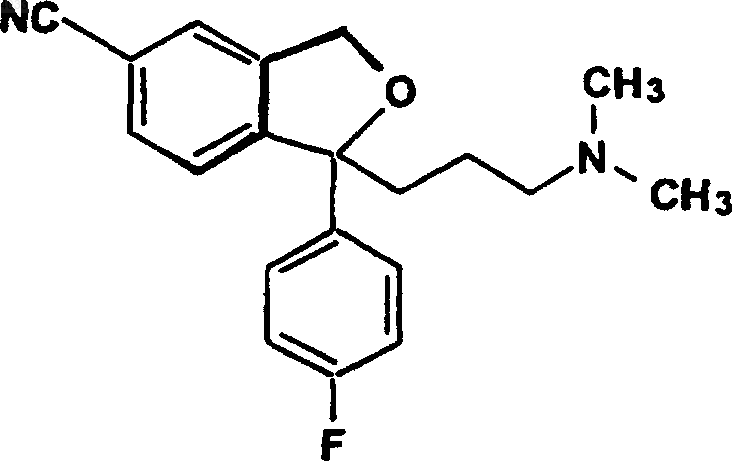
Формула I
которое выделяют в виде основания или его фармацевтически приемлемой соли.
2. Способ по п.1, где превращение 5-формильного производного формулы V в циталопрам осуществляют преобразованием формильной группы путем реакции с реагентом R3-X-NH2, где R3 представляет собой водород, C1-6алкил, моно- или бициклическую карбоциклическую ароматическую группу или моно- или бициклическую гетероциклическую ароматическую группу и X представляет собой O, N или S, с последующей дегидратацией дегидратирующим агентом.
3. Способ по п.1 или 2, где R представляет собой группу
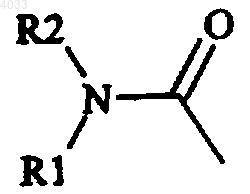
4. Способ по п.3, где R1 и R2 представляют собой C1-6 алкил или R1 и R2 соединены и вместе обозначают 4- или 5-членную цепочку, необязательно содержащую атом S, O или N.
5. Способ по п.4, где R1 и R2 оба представляют собой метил или R1 и R2 вместе с атомом N, с которым они соединены, образуют морфолинильную группу.
6. Способ по п.1 или 2, где R представляет собой необязательно замещенную 4,5-дигидро-1,3-оксазол-2-ильную группу.
7. Способ по п.6, где R представляет собой 4,5-дигидро-4,4-диметил-1,3-оксазол-2-ил.
8. Способ по любому из пп.1-7, отличающийся тем, что промежуточное соединение формулы IV получают в результате замыкания цикла у соответствующего соединения формулы VI
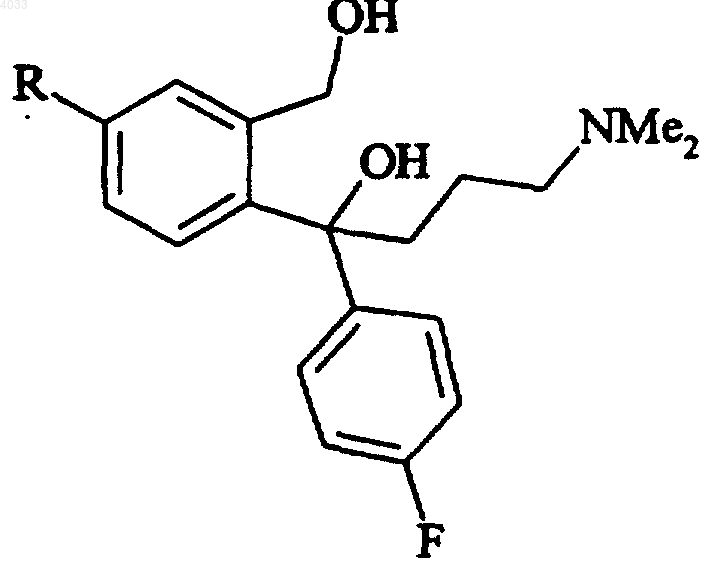
Формула VI
где R является таким, как определено в п.1.
9. Способ по п.8, отличающийся тем, что соединение формулы VI получают из соответствующего производного 5-замещенного фталида в результате проведения двух последовательных реакций Гриньяра, то есть с реактивом Гриньяра, полученным из 4-галогенфторфенила, и с реактивом Гриньяра, полученным из 3-галоген-N,N-диметилпропиламина соответственно.
10. Способ по пп.6 и 8, отличающийся тем, что соединение формулы VI получают из 4-диметиламино-1-(4-фторфенил)-бутан-1-она реакцией Гриньяра с надлежащим образом защищенным производным галогенида 2-(гидроксиметил)-4-(1,3-оксазол-2-ил) фенилмагния.
11. Способ по пп.8-10, где замыкание цикла у соединения формулы VI осуществляют путем кислотного замыкания цикла, происходящего под действием неорганической кислоты, такой как серная или фосфорная кислота, или органической кислоты, такой как метилсульфоновая, п-толуолсульфоновая или трифторуксусная кислота.
12. Способ по любому из пп.8-10, где замыкание цикла у соединения формулы VI осуществляют путем основного замыкания цикла через неустойчивый сложный эфир предпочтительно с одновременной этерификацией и добавлением основания.
13. Способ по п.12, где неустойчивым сложным эфиром является метансульфонильный, п-толуолсульфонильный, 10-камфорсульфонильный, трифторацетильный или трифторметан-сульфонильный сложный эфир и основанием является триэтиламин, диметиланилин или пиридин.
14. Способ по любому из пп.11-13, где перед проведением последующей реакции, промежуточное соединение формулы VI разделяют на его энантиомеры, получая таким образом энантиомер, из которого образуется S-циталопрам.
15. Промежуточное соединение для получения циталопрама, имеющее формулу V
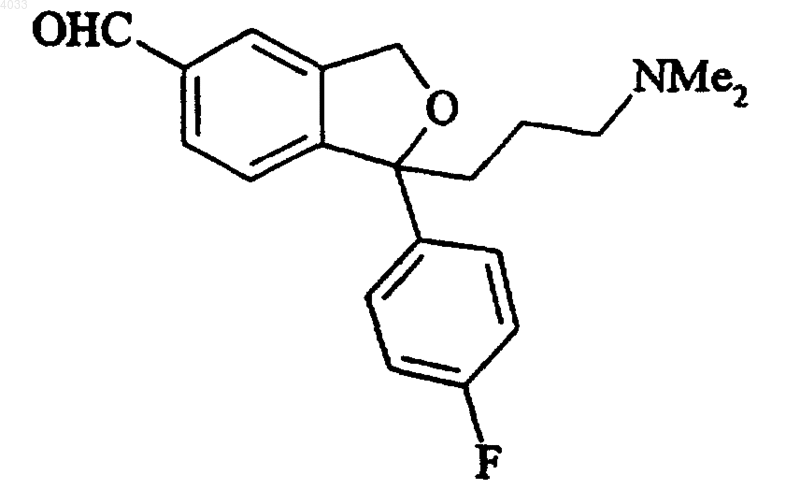
Формула V
16. Промежуточное соединение для получения циталопрама, имеющее формулу IV
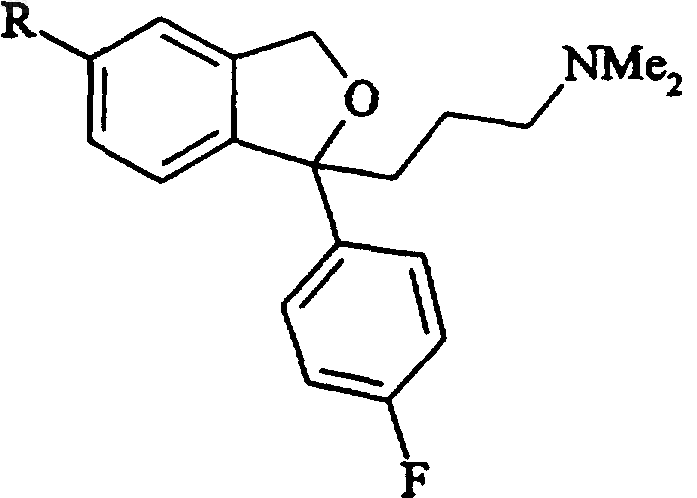
Формула IV
где R принимает значения, определенные по п.1.
17. Применение промежуточного соединения по п.15 для получения циталопрама.
18. Применение промежуточного соединения по п.16 для получения циталопрама.
Текст
1 Настоящее изобретение относится к способу получения хорошо известного антидепрессантного лекарственного средства циталопрама,1-[3-(диметиламино)пропил]-1-(4-фторфенил)1,3-дигидро-5-изобензофуранкарбонитрила. Предпосылки изобретения Циталопрам является хорошо известным антидепрессантным лекарственным средством,которое в настоящее время присутствует на рынке уже в течение нескольких лет, и который имеет следующую структуру:N,N-диметиламинопропилмагния,соответственно. Новый и удивительный способ и промежуточное соединение для получения циталопрама были описаны в патенте США 4650884, в соответствии с которым промежуточное соединение формулы Это селективный ингибитор повторного усвоения серотонина (5-гидрокситриптамина; 5 НТ) центрального действия, соответственно обладающий антидепрессантной активностью. Об антидепрессантной активности данного соединения сообщалось в нескольких публикациях, например, J. Hyttel, Prog. Neuro Psychopharmacol.Biol. Psychiat., 1982, 6, 277-295 и А.Gravem, Acta Psychiatr. Scand., 1987, 75, 478-486. Кроме того, сообщалось, что данное соединение демонстрирует эффекты при лечении слабоумия и цереброваскулярных расстройств, ЕР-А 474580. Циталопрам впервые был описан в DE 2657013, соответствующей US 4136193. Данная патентная публикация описывает получение циталопрама одним способом и обрисовывает другой способ, который может быть использован для получения циталопрама. В соответствии с описанным способом соответствующий 1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрил подвергают взаимодействию с 3-(N,N-диметиламино)пропилхлоридом в присутствии метилсульфинилметила, в качестве конденсирующего агента. Исходное вещество получают из соответствующего 5 бромпроизводного путем реакции с цианидом меди (I). В соответствии со способом, который был обрисован только в общих положениях, циталопрам может быть получен в результате замыкания цикла у соединения: в присутствии дегидратирующего агента и последующего обмена 5-бромгруппы с цианидом меди (I). Исходное вещество формулы II получают из 5-бромфталида в результате проведения двух последовательных реакций Гриньяра, то подвергают реакции замыкания цикла путем дегидратации сильной серной кислотой с получением циталопрама. Промежуточное соединение формулы III получают из 5-цианофталида путем проведения двух последовательных реакций Гриньяра, то есть, реакций с галогенидом 4 фторфенилмагния и галогенидом N,N-диметиламинопропилмагния, соответственно. Другие способы описываются в Международных патентных заявкахWO 98019511,WO 98019512 и WO 98019513. WO 98019512 иWO 98019513 относятся к способам, в которых 5-амино-, 5-карбокси - или 5-(втор-аминокарбонил)фталид подвергают двум последовательным реакциям Гриньяра, замыканию цикла и превращению получаемого в результате производного 1,3-дигидроизобензофурана в соответствующее 5-цианопроизводное, то есть, циталопрам. Международная патентная заявкаWO 98019511 описывает способ получения циталопрама, где соединение (4-замещенный-2 гидроксиметилфенил-(4-фторфенил)метанол подвергают замыканию цикла, и получаемый в результате 5-замещенный-1-(4 -фторфенил)-1,3 дигидроизобензофуран превращают в соответствующее 5-цианопроизводное, которое алкилируют (3-диметиламино)пропилгалогенидом для получения циталопрама. Наконец, способы получения индивидуальных энантиомеров циталопрама описываются в патенте США 4943590, из которого также следует, что замыкание цикла у промежуточного соединения формулы III может быть проведено с использованием основания через неустойчивый сложный эфир. В настоящее время к удивлению было обнаружено, что циталопрам может быть получен по новой выгодной и безопасной методике при использовании обычных исходных веществ. Краткое изложение изобретения Соответственно, настоящее изобретение относится к новому способу получения циталопрама, включающему стадии: а) восстановительного гидролиза соединения формулы IV где R1 и R2 независимо выбирают из C1-6 алкила, моно- или бициклической карбоциклической ароматической группы, и моно- или бициклической гетероциклической ароматической группы,или R1 и R2 соединены и вместе обозначают 4 или 5-членную цепочку, необязательно содержащую атом S, О или N, или 4,5-дигидро-1,3-оксазол-2-ил, необязательно замещенный в 4- и/или 5-положении одной или несколькими C1-6 алкильной, моно- или бициклической карбоциклической ароматической, или моно- или бициклической гетероциклической ароматической группами,и которое выделяют в виде основания или его фармацевтически приемлемой соли. В другом аспекте настоящее изобретение предлагает новое промежуточное соединение формулы V. Следующий аспект изобретения относится к новому промежуточному соединению для получения циталопрама, имеющему формулу IV. Еще в одном аспекте изобретение относится к описанному выше способу, в котором соединением формулы IV является S-энантиомер. Во всем описании и формуле изобретения,низший алкил обозначает разветвленную или неразветвленную алкильную группу, имеющую от одного до шести углеродных атомов, включительно, такую как метил, этил, 1-пропил, 2 пропил, 1-бутил, 2-бутил, 2-метил-2-пропил,2,2-диметил-1-этил и 2-метил-1-пропил. Термин арил относится к моно- или бициклической карбоциклической ароматической 4 группе, такой как фенил и нафтил, в особенности фенил. Термин гетероарил относится к моно- или бициклической гетероциклической ароматической группе, такой как индолил, тиенил, пиримидил, оксазол, изоксазол, тиазолил, изотиазолил, имидазолил, бензофуранил, бензотиенил,пиридил и фуранил, в особенности пиримидил,индолил и тиенил. Галоген обозначает фтор, хлор, бром или иод. Восстановительный гидролиз обозначает восстановление группы R с последующей обработкой с помощью Н 2 О с получением таким образом альдегидной группы. Когда R1 и R2 соединены и вместе обозначают 4- или 5-членную цепочку, необязательно содержащую атом S, О или N, R1 и R2 вместе с атомом N, с которым они соединены, образуют 5- или 6-членное кольцо, необязательно содержащее гетероатом, выбранный из О, S и N, в дополнение к атому N, с которым соединены R1 и R2. Примерами таких групп являются морфолинил, пиперидил и тому подобные. В предпочтительном воплощении изобретения, R представляет собой морфолинокарбонил, ди(С 1-6 алкил)аминокарбонил или 4,4-ди(С 1-6 алкил)-1,3-оксазолидин-2-ил,наиболее предпочтительно морфолинокарбонил, диметиламинокарбонил или 4,4-диметил-1,3 оксазолидин-2-ил. В предпочтительном воплощении изобретения промежуточное соединение формулы IV получают в результате замыкания цикла у соответствующего соединения формулы VI Предпочтительно, соединение формулы VI получают из соответствующего производного 5R-замещенного фталида в результате проведения двух последовательных реакций Гриньяра,то есть, с реактивом Гриньяра, полученным из 4-галогенфторфенила, и реактивом Гриньяра,полученным из 3-галоген-N,N-диметилпропиламина, соответственно. Когда R представляет необязательно замещенную 4,5-дигидро-1,3 оксазол-2-ильную группу, соединение формулыVI альтернативным способом может быть получено из 4-диметиламино-1-(4-фторфенил)бутан 1-она реакцией Гриньяра с надлежащим образом защищенным производным галогенида 2(гидроксиметил)-4-(4,5-дигидро-1,3-оксазол-2 ил)фенилмагния. Восстановительный гидролиз соединения формулы IV подходящим образом проводят путем восстановления соединения формулы IV подходящим восстановителем, таким как алю 5 миний - или борсодержащий агент, подходяще при помощи Dibal-H, супергидрида, LiAlH4,BH4- (Li+, Na+ или K+) и тому подобного, с последующим добавлением Н 2O. Когда R представляет 4,5-дигидро-1,3-оксазол-2-ильную группу, реакцию можно проводить путем алкилирования подходящим алкилирующим агентом, таким как MeI, диалкилсульфат или тому подобное, с последующим восстановлением и гидролизом, как описанно выше. Во всех случаях восстановление проводят в строго контролируемых условиях, предпочтительно при приблизительно 0 С. Превращение 5-формильного производного формулы V в циталопрам проводят путем преобразования формильной группы в оксимную или подобную группу реакцией с реагентомR3-X-NH2, где R3 представляет собой водород,C1-6 алкил, моно- или бициклическую карбоциклическую ароматическую группу, или моно- или бициклическую гетероциклическую ароматическую группу, X представляет собой О, N или S,с последующей дегидратацией обычным дегидратирующим агентом, например, тионилхлорид,уксусный ангидрид/пиридин, пиридин/HCl или пентахлорид фосфора. Предпочтительными реагентами R3-X-NH2 являются гидроксиламин и соединения, в которых R3 представляет собойC1-6 алкил или моно- или бициклическую карбоциклическую ароматическую группу, и X представляет собой N или О. Замыкание цикла соединения формулы VI может быть осуществлено кислотой или при помощи основания через неустойчивый сложный эфир. Кислотное замыкание цикла проводят неорганической кислотой, такой как серная или фосфорная кислота, или органической кислотой, такой как метилсульфоновая, птолуолсульфоновая или трифторуксусная кислота. Основное замыкание цикла проводят через неустойчивый сложный эфир, такой как метансульфонильный,п-толуолсульфонильный,10-камфорсульфонильный, трифторацетильный или трифторметансульфонильный сложный эфир, путем добавления основания, такого как триэтиламин, диметиланилин, пиридин, тому подобное. Реакцию проводят в инертном растворителе, предпочтительно при охлаждении, в особенности при приблизительно 0 С, и ее предпочтительно проводят по методике проведения реакции в одной емкости, то есть, с этерификацией и одновременным добавлением основания. Перед проведением последующей реакции промежуточное соединение формулыVI может быть разделено на его энантиомеры с получением таким образом энантиомера, из которого образуется S-циталопрам. Реактивы Гриньяра, полученные из 4 галогенфторфенила, которые могут быть использованы при получении соединения формулы VI, представляют собой галогениды магния,такие как хлорид, бромид или иодид. Предпоч 004033 6 тительно использование бромида магния. Реактивы Гриньяра, полученные из 3-галоген-N,Nдиметилпропиламина, которые могут быть использованы, представляют собой галогениды магния, такие как хлорид, бромид или иодид,предпочтительно хлорид магния. Предпочтительно, две реакции проводят последовательно без выделения промежуточного соединения. Другие условия реакции, растворители и тому подобное представляют собой обычные условия для таких реакций, и они легко могут быть определены специалистом в данной области. 5-R-замещенные фталидные исходные соединения, используемые в реакциях Гриньяра,могут быть получены из 5-хлоркарбонилфталида реакцией с подходящими аминовыми соединениями. 5-хлоркарбонилфталид может быть снова получен из 5-карбоксифталида реакцией с тионилхлоридом. 5-карбоксифталид коммерчески доступен и может быть получен по хорошо известным методикам (Tirouflet, J.; Bull. Soc. Sci.Bretagne 26, 1959, 35). Соединение общей формулы I может быть использовано в виде свободного основания или в виде его фармацевтически приемлемой кислотно-аддитивной соли. В качестве кислотноаддитивных солей могут быть использованы такие соли, полученные с использованием органических или неорганических кислот. Примерами таких органических солей являются соли малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой,уксусной, пропионовой, винной, салициловой,лимонной, глюконовой, молочной, яблочной,миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислот, а также 8-галогентеофиллины, например, 8-бромтеофиллин. Примерами таких неорганических солей являются соли хлористоводородной, бромистоводородной, серной, сульфамовой, фосфорной и азотной кислот. Кислотно-аддитивные соли соединений могут быть получены по способам, известным в уровне техники. Основание взаимодействует либо с рассчитанным количеством кислоты в смешиваемом с водой растворителе, таком как ацетон или этанол, с последующим выделением соли концентрированием и охлаждением, либо с избытком кислоты в несмешиваемом с водой растворителе, таком как этиловый простой эфир, этилацетат или дихлорметан, с самопроизвольным выделением соли. На основе циталопрама могут быть изготовлены фармацевтические композиции, которые могут быть введены любым подходящим способом и в любом подходящем виде, например, перорально в виде таблеток, капсул, по 7 рошков или сиропов, или парентерально в виде обычных стерильных растворов для инъекции. Такие фармацевтические композиции могут быть получены обычными способами, известными из уровня техники. Например, таблетки могут быть получены смешиванием активного ингредиента с обычными адъювантами и/или разбавителями с последующим прессованием смеси в обычной таблетировочной машине. Примеры адъювантов или разбавителей включают: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и тому подобное. Могут быть использованы и любой другой адъювант или окрашивающие, ароматизирующие добавки, консерванты и тому подобное при условии, что они совместимы с активными ингредиентами. Растворы для инъекций могут быть получены путем растворения активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно в стерильной воде,доведения раствора до требуемого объема, стерилизации раствора и заполнения им подходящих ампул или пузырьков. Могут быть введены любые подходящие добавки, обычно используемые в уровне техники, такие как тонизирующие агенты, консерванты, антиоксиданты и тому подобное. Примеры Далее изобретение будет проиллюстрировано следующими примерами. Пример 1. 5-(4-Морфолилкарбонил)фталид. К раствору морфолина (22 г, 0,25 моль) и триэтиламина (26 г, 0,25 моль) в ТГФ (200 мл) при 0 С добавляют раствор 5-хлоркарбонилфталида (39 г, 0,2 моль) в ТГФ (400 мл). Смесь перемешивают в течение 1 ч и дают ей нагреться до комнатной температуры. После этого реакционную смесь выливают в ледяную воду(500 мл). ТГФ выпаривают в вакууме, а рН раствора доводят до рН = 2. Раствор охлаждают до 5 С и осажденные кристаллы отфильтровывают и промывают водой (100 мл). Выход 38,0 г, 78%. Начало для ДСК: 83 С и 107 С. Чистота: 99,6% (ВЭЖХ, площадь пика). 1 Н ЯМР (ДМСО-d6, 250 МГц): 3.2-3.7 (8 Н,ц), 5.45(2 Н,с) 7.60 (1 Н, д, J=7.5 Гц), 7.72(1 Н,с),7.92(1 н, д, J=7.5 Гц). 13 С ЯМР (ДМСО-d6,62.9 МГц):42.1, 47.7, 66.1, 70.0, 121.6, 125.3, 125.7,127.7, 141.7, 168.0, 170.1. Аналитическое вычисление дляC13H13O4N1: С 63,15; Н 5,30; N 5,66. Обнаружено С 62,94; Н 5,52 : N 5,53. Пример 2. 5-(N,N-диметилкарбамил)фталид. Раствор 5-хлоркарбонилфталида (32 г, 0,16 моль) в ТГФ (300 мл) добавляют к диметиламину (40% об./об. в воде, 300 мл) и льду (100 г). Смесь перемешивают в течение 1 ч. ТГФ выпаривают в вакууме, и осажденные кристаллы от 004033(26 г, 0,25 моль) в ТГФ (200 мл) при 0 С добавляют раствор 5-хлоркарбонилфталида (39 г, 0,2 моль) в ТГФ (400 мл). Смесь перемешивают в течение 1 ч и дают ей нагреться до комнатной температуры. После этого реакционную смесь выливают в ледяную воду (500 мл). ТГФ выпаривают в вакууме, и рН раствора доводят до рН= 2. Раствор охлаждают до 5 С и оставляют на ночь. Осажденные кристаллы отфильтровывают и промывают холодной водой (100 мл). Выход 34,0 г, 68%. Начало для ДСК: 165 С. Чистота: 99,7% (ВЭЖХ, площадь пика). 1 Н ЯМР (ДМСО-d6, 250 МГц): 1.33 (6 Н,с),3.54 (2 Н,с), 5.47 (2 Н,с), 7.84 (1 Н,с), 7.90 (1 Н, д,J=7.5 Гц), 7.97 (1 Н, д, J=7.5 Гц), 13 С ЯМРC13H15O4N1: С 62,64: Н 6,07 : N 5,62. Обнаружено С 62,37; Н 6,13; N 5,53. Способ В. К раствору 2-амино-2-метилпропан-1-ола(44,6 г, 0,5 моль) в толуоле (100 мл) добавляют 5-этоксикарбонилфталид (82 г, 0,4 моль). Смесь нагревают при температуре флегмы в течение 24 ч. При охлаждении титульное соединение отфильтровывают и перекристаллизовывают из горячего толуола. Выход 85,0 г, 85%. Чистота: 95,0%(ВЭЖХ, площадь пика). Пример 4. Оксалат 5-(4-морфолилкарбонил)-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофурана. К суспензии 5-4-морфолилкарбонил)фталида(36 г, 0,15 моль) в сухом ТГФ (150 мл) по каплям добавляют раствор бромида 4-фторфенилмагния, полученный из 4-фторбромбензола (31 г, 0,17 моль) и магниевых стружек(6 г, 0,24 моль) в сухом ТГФ (100 мл). Температуру поддерживают ниже 5 С. После завершения добавления реакционную смесь перемешивают в течение 1,5 ч при комнатной температуре. К реакционной смеси добавляют второй раствор Гриньяра, полученный из хлорида 3 диметиламинопропила (22,3 г, 0,17 моль) и магниевых стружек (6 г, 0,24 моль) в сухом ТГФ(150 мл). Во время добавления температуру поддерживают ниже 10 С. Реакционную смесь оставляют перемешиваться в течение ночи при комнатной температуре. Реакционную смесь выливают в ледяную воду (300 мл) и насыщенный раствор хлорида аммония (100 мл). ТГФ выпаривают в вакууме. Добавляют дихлорметан (DCM) (300 мл), органическую фазу отделяют и промывают ее водой(2x100 мл) и рассолом (50 мл). Органическую фазу экстрагируют, используя 2 М HCl (2x100 мл). К водной фазе добавляют 4 М NaOH (100 мл) до получения конечного рН, равного 9 или более. Водный слой экстрагируют, используяDCM (дихлорметан) (400 мл), и органическую фазу промывают водой (100 мл), рассолом(50 мл) и высушивают MgSO4 (20 г). К органической фазе добавляют триэтиламин (20 г, 0,2 моль) и раствор охлаждают до 5 С. По каплям добавляют хлорид метансульфонила (12 г, 0,11 моль) в DCM (100 мл) и после добавления реакционную смесь оставляют перемешиваться в течение одного часа. Реакционную смесь промывают 0,1 М NaOH (2x100 мл),органическую фазу высушивают (MgSO4, 10 г),и растворитель выпаривают в вакууме. Полученное таким образом вещество растворяют в ацетоне (100 мл), обрабатывают безводной щавелевой кислотой (13,5 г, 0,15 моль) и растворяют в ацетоне (100 мл). Смесь оставляют на ночь при комнатной температуре и осажденный оксалат отфильтровывают. Выход 19 г, 26%. Начало для ДСК: 166 С. 1 Н ЯМР(ДМСО-д 6, 250 МГц): 1.35-1.63C24H29N1F1O31,1 С 2 Н 2O4: С 61,52; Н 6,15; N 5,48. Обнаружено С 61,53; Н 6,22; N 5,40. Пример 5. Оксалат 5-(N,N-диметилкарбамил)-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофурана. К суспензии 5-N,N-диметилкарбамилфталида (16,5 г, 0,08 моль) в сухом ТГФ (50 мл) по каплям добавляют раствор бромида 4-фторфенилмагния, полученный из 4-фторбромбензола (16,5 г, 0,09 моль) и магниевых стружек (3 г, 0,12 моль) в сухом ТГФ (50 мл) . Температуру поддерживают ниже 5 С. После завершения добавления реакционную смесь перемешивают в течение 1,5 ч при комнатной температуре. К реакционной смеси добавляют второй раствор Гриньяра, полученный из хлорида 3 диметиламинопропила (12 г, 0,09 моль) и магниевых стружек (3 г, 0,12 моль) в сухом ТГФ(50 мл). Во время добавления температуру поддерживают ниже 10 С. Реакционную смесь оставляют перемешиваться в течение 2 ч при комнатной температуре. 10 Реакционную смесь выливают в ледяную воду (100 мл) и насыщенный раствор хлорида аммония (50 мл). ТГФ выпаривают в вакууме. Добавляют дихлорметан (100 мл), органическую фазу отделяют и промывают водой (2x50 мл) и рассолом (50 мл). Органическую фазу экстрагируют, используя 2 М HCl (2 х 100 мл). К водной фазе добавляют 4 М NaOH (100 мл) до получения конечного рН, равного 9 или более. Водный слой экстрагируют дихлорметаном (200 мл), и органическую фазу промывают водой (50 мл),рассолом (50 мл) и высушивают MgSO4 (20 г). Дихлорметан выпаривают в вакууме. К полученному таким образом веществу добавляютDCM (250 мл) и триэтиламин (20 г, 0,2 моль). Раствор охлаждают до 5 С. По каплям добавляют хлорид метансульфонила (18 г, 0,16 моль) и после добавления реакционную смесь оставляют перемешиваться в течение одного часа. Реакционную смесь промывают 0,1 М NaOH (2 х 100 мл), органическую фазу высушивают(3H, дд+д, J=8.5 Гц J=6 Гц J=7.5 Гц). Оксалатную соль осаждают из ацетона. Пример 6. 5-Формил-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофуран. Амид из примера 4 (0,025 моль) растворяют в толуоле (100 мл). Раствор охлаждают до 0 С. По каплям добавляют Dibal - Н (30 мл, 1 М раствор в толуоле, 0,03 моль), в то время как температуру поддерживают при 0 С. Охлаждение убирают и раствор перемешивают в течение дополнительных 2 ч. Осторожно добавляют ледяную воду (5 г) и перемешивание продолжают в течение 30 мин. Добавляют K2 СO3 (20 г), и перемешивание продолжают в течение 10 мин. Суспензию фильтруют и органическую фазу промывают водой (30 мл). В вакууме выпаривают толуол и получают титульное соединение (в форме свободного основания) в виде прозрачного масла. Выход: 7 г, 88%. Из ацетона получают оксалатную соль: начало для ДСК: 128 С. 1(150 мл) и рН доводят до рН = 10 при помощиNaOH (28% (вод Смесь оставляют перемешиваться в течение 14 ч. EtOH удаляют в вакууме,добавляют EtOAc (200 мл) и воду (100 мл) и проводят разделение фаз. В результате выпаривания из органической фазы растворителей остается оксим в виде масла. Выход: 33 г, 96%. 1 Н ЯМР (ДМСО-d6, 250 МГц): 1.15-1.43(1 Н, с). Из ацетона кристаллизуют оксалат титульного соединения. ДСК: начало реакции. 1 Н ЯМР (ДМСО-d6, 250 МГц): 1.36-1.63C20H23N2O2F11,05 С 2 Н 2O4: С 60,75; Н 5,79; N 6,41. Обнаружено С 60,55; Н 6,06; N 5,93. Пример 8. 1-(3-диметиламинопропил)-1-(4 фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил и его оксалатная соль. Способ А. Оксим или оксалатную соль 5 формил-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофурана (12 г) растворяют в ангидриде уксусной кислоты (20 мл) и пиридине (80 мл). Раствор нагревают при температуре флегмы в течение 2 ч. Летучие соединения выпаривают в вакууме и остаток выпаривают совместно с толуолом (2x100 мл). Полученное таким образом вещество растворяют в ацетоне и добавляют щавелевую кислоту (5 г). Раствор оставляют на 14 ч при 0 С. В результате фильтрования получают титульное соединение в виде кислой оксалатной соли. Выход: 9,6 г,66%. Начало для ДСК: 155 С. Способ В. Оксим, оксалатную соль 5 формил-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофурана (1,0 г) суспендируют в толуоле (10 мл). Добавляют SOCl2(2 мл) и смесь нагревают при температуре флегмы в течение 15 мин. В результате выпаривания в вакууме летучих растворителей остается масло. Масло поглощают толуолом (10 мл) и промывают при помощи 2 н. NaOH (5 мл (вод. и воды (5 мл). В результате выпаривания толуольной фазы остается титульное соединение (свободное основание) в виде масла. Выход = 0,62 г,83%. Чистота: 98,0% (ВЭЖХ, площадь пика). 12 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения циталопрама, включающий стадии а) восстановительного гидролиза соединения формулы IV где R1 и R2 независимо выбирают из C1-6 алкила, моно- или бициклической карбоциклической ароматической группы и моно- или бициклической гетероциклической ароматической группы,или R1 и R2 соединены и вместе обозначают 4 или 5-членную цепочку, необязательно содержащую атом S, О или N,4,5-дигидро-1,3-оксазол-2-ил, необязательно замещенный в 4-ом и/или 5-ом положении одной или несколькими C1-6 алкильной, моноили бициклической карбоциклической ароматической или моно- или бициклической гетероциклической ароматической группами, иb) превращения полученного 5 формильного производного формулы V которое выделяют в виде основания или его фармацевтически приемлемой соли. 2. Способ по п.1, где превращение 5 формильного производного формулы V в циталопрам осуществляют преобразованием формильной группы путем реакции с реагентом R3X-NH2, где R3 представляет собой водород, C1-6 алкил, моно- или бициклическую карбоциклическую ароматическую группу или моно- или бициклическую гетероциклическую ароматическую группу и X представляет собой О, N или S,с последующей дегидратацией дегидратирующим агентом. 3. Способ по п.1 или 2, где R представляет собой группу 4. Способ по п.3, где R1 и R2 представляют собой C1-6 алкил или R1 и R2 соединены и вместе обозначают 4- или 5-членную цепочку,необязательно содержащую атом S, О или N. 5. Способ по п.4, где R1 и R2 оба представляют собой метил или R1 и R2 вместе с атомом N, с которым они соединены, образуют морфолинильную группу. 6. Способ по п.1 или 2, где R представляет собой необязательно замещенную 4,5-дигидро 1,3-оксазол-2-ильную группу. 7. Способ по п.6, где R представляет собой 4,5-дигидро-4,4-диметил-1,3-оксазол-2-ил. 8. Способ по любому из пп.1-7, отличающийся тем, что промежуточное соединение формулы IV получают в результате замыкания цикла у соответствующего соединения формулы 14 кой как серная или фосфорная кислота, или органической кислоты, такой как метилсульфоновая, п-толуолсульфоновая или трифторуксусная кислота. 12. Способ по любому из пп.8-10, где замыкание цикла у соединения формулы VI осуществляют путем основного замыкания цикла через неустойчивый сложный эфир предпочтительно с одновременной этерификацией и добавлением основания. 13. Способ по п.12, где неустойчивым сложным эфиром является метансульфонильный, п-толуолсульфонильный, 10-камфорсульфонильный, трифторацетильный или трифторметансульфонильный сложный эфир и основанием является триэтиламин, диметиланилин или пиридин. 14. Способ по любому из пп.11-13, где перед проведением последующей реакции, промежуточное соединение формулы VI разделяют на его энантиомеры, получая таким образом энантиомер, из которого образуется S-циталопрам. 15. Промежуточное соединение для получения циталопрама, имеющее формулу V где R является таким, как определено в п.1. 9. Способ по п.8, отличающийся тем, что соединение формулы VI получают из соответствующего производного 5-замещенного фталида в результате проведения двух последовательных реакций Гриньяра, то есть с реактивом Гриньяра, полученным из 4-галогенфторфенила, и с реактивом Гриньяра, полученным из 3-галогенN,N-диметилпропиламина соответственно. 10. Способ по пп.6 и 8, отличающийся тем,что соединение формулы VI получают из 4 диметиламино-1-(4-фторфенил)бутан-1-она реакцией Гриньяра с надлежащим образом защищенным производным галогенида 2-(гидроксиметил)-4-(1,3-оксазол-2-ил)фенилмагния. 11. Способ по пп.8-10, где замыкание цикла у соединения формулы VI осуществляют путем кислотного замыкания цикла, происходящего под действием неорганической кислоты, та Формула V 16. Промежуточное соединение для получения циталопрама, имеющее формулу IV где R принимает значения, определенные по п.1. 17. Применение промежуточного соединения по п.15 для получения циталопрама. 18. Применение промежуточного соединения по п.16 для получения циталопрама.
МПК / Метки
МПК: C07D 307/87
Метки: способ, циталопрама, получения
Код ссылки
<a href="https://eas.patents.su/8-4033-sposob-polucheniya-citaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циталопрама</a>
Предыдущий патент: Фармацевтические композиции лекарственных веществ с быстрым высвобождением
Следующий патент: Новые содержащие тиотропий порошки для ингаляции
Случайный патент: Антагонисты рецепторов простагландина d2












