Противоопухолевое средство
Формула / Реферат
1. Применение 4-циклопентен-1,3-диона формулы (I)
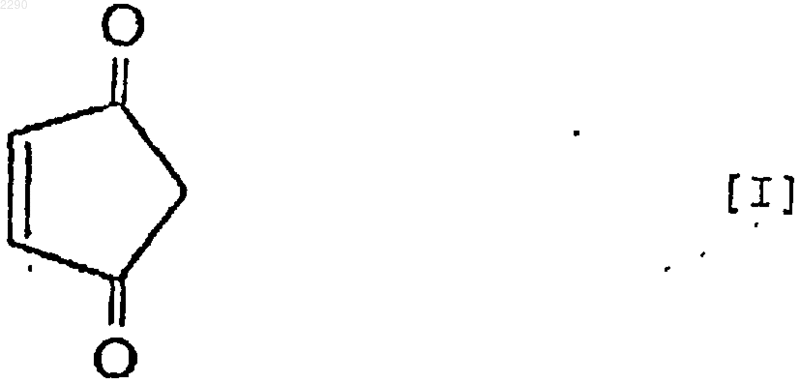
и/или 4-гидрокси-2-циклопентенона формулы (II)

в качестве противоопухолевого средства.
2. Применение 4-циклопентен-1,3-диона формулы (I)
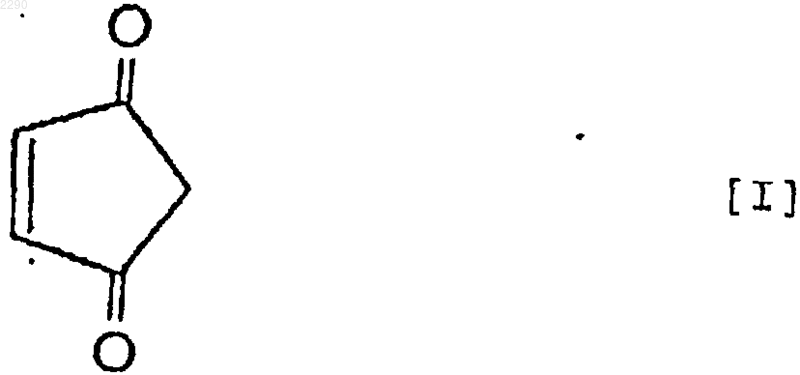
и/или 4-гидрокси-2-циклопентенона формулы (II) в качестве

апоптоз-индуцирующего средства.
3. Применение 4-циклопентен-1,3-диона формулы (I)
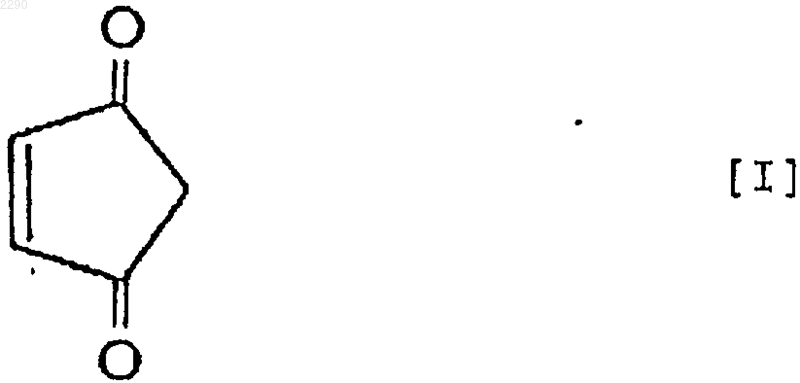
и/или 4-гидрокси-2-циклопентенона формулы (II)

в качестве ингибитора топоизомеразы.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к лекарственным средствам, в которых в качестве действующего компонента использовано специфическое средство, обладающее противоопухолевым действием и апоптоз-индуцирующим действием. Известный уровень техники Лекарственные средства, используемые в клинической терапии, включают многие средства, такие как противоопухолевые средства, антибиотики, иммуностимуляторы, иммуномодуляторы и т.д. (такие, как алкилирующие средства, антиметаболиты и растительные алкалоиды),но было бы преувеличением говорить, что такая лекарственная терапия уже полностью создана. Как уже сообщалось, из указанных средств в качестве высокобезопасных противоопухолевых средств могут быть использованы простагландины (среди простагландинов, полученных из природных веществ) А и J, имеющие циклопентеноновое кольцо, благодаря их способности ингибировать синтез ДНК и различные их производные уже синтезированы (см. выложенную публикацию патента Японии Sho-62/96438). В последние годы привлек внимание такой вид гибели тканей клеток, как апоптоз. В отличие от некроза, представляющего собой патогенную гибель клеток, апоптоз, как полагают, - это гибель, изначально запрограммированная в гене самой клетки. Так, какиелибо внешние или внутренние причины активируют ген, который программирует апоптоз, в результате чего на основе гена запрограммированной гибели клетки продуцируется белок этого гена и затем сама клетка распадается и гибнет под воздействием этого выработанного белка. Если можно обеспечить проявление такого апоптоза в нужных тканях или клетках, то можно избавиться от ненужных или патогенных клеток в живом организме естественным путем,что очень важно. Проблемы, решаемые изобретением Целью настоящего изобретения является создание противоопухолевого и апоптозиндуцирующего средств в которых действующим компонентом является соединение, имеющее в своем пятичленном кольце , ненасыщенную карбонильную группу. Способ решения проблем Создатели настоящего изобретения провели интенсивные исследования для достижения указанной цели и в результате нашли соединения, обладающие противоопухолевым действием, апоптоз-индуцирующим действием и т.д.,которые и послужили основой создания настоящего изобретения. Первый признак настоящего изобретения касается противоопухолевого средства, в котором активным(и) компонентом(ами) является(ются) 4-циклопентен-1,3-дион, представлен 002290 2 ный следующей формулой (I) и/или 4-гидрокси 2-циклопентенон, представленный следующей формулой (II). Второй признак настоящего изобретения касается апоптоз-индуцирующего средства, в котором активным(и) компонентом(ами) является(ются) 4-циклопентен-1,3-дион, представленный приведенной выше формулой (I) и/или 4-гидрокси-2-циклопентенон, представленный приведенной выше формулой (II). Наилучший способ осуществления изобретения Ниже дано конкретное описание настоящего изобретения. 4-Циклопентен-1,3-дион, представленный формулой (I), и 4-гидрокси-2-циклопентенон,представленный формулой (II), являются известными соединениями и могут быть получены известными методами или же могут быть использованы коммерчески доступные соединения. Что касается 4-циклопентен-1,3-диона, то его можно получить методом G. H. de Puy, et al.Pract. Chem., 317, 807 (1975)] или можно использовать коммерчески доступное вещество,такое как продукт от Aldrich (16, 168-3). Что касается 4-гидрокси-2-циклопентенона, то его можно получить путем восстановления 4-циклопентен-1,3-диона хлоридом церия (III) или борогидридом натрия. Известными методами его синтеза являются метод Tanaka, et al. [Tetrahedron, 32, 1713 (1976)], методNara, et al. [Tetrahedron, 36, 3161 (1980)] и метод М. Gill, et al. [Aust. J. Chem., 34, 2587 (1981)]. В качестве 4-гидрокси-2-циклопентенона можно использовать (R)-вещество, (S)-вещество или их смесь. 4-Циклопентен-1,3-дион и 4-гидрокси-2 циклопентенон обладают противоопухолевым действием и ингибирующим действием по отношению к росту опухолевых клеток, таких как клетки HL-60 промиелоцитарного лейкоза человека, клетки MOLT-3 острого лимфобластного лейкоза человека, клетки А-549 рака легких,SV40-трансформированные клетки WI38VA13 рака легких, клетки Нер G2 гепатомы, клетки НСТ 116 рака толстой кишки, клетки SW 480 рака толстой кишки человека, клетки WiDr рака толстой кишки человека, клетки AGS рака желудка и клетки миеломы. Эти соединения могут 3 быть использованы в противоопухолевом средстве в качестве действующего компонента, а также обладают апоптоз-индуцирующим действием по отношению к указанным опухолевым клеткам. Механизм ингибирования роста опухолевых клеток указанных соединений, используемых в настоящем изобретении, ни в коей мере не ограничивает объема настоящего изобретения, и настоящее изобретение охватывает также апоптоз-индуцирующее действие по отношению к опухолевым клеткам. В противоопухолевом средстве по настоящему изобретению используют в качестве действующего(их) компонента(ов) 4-циклопентен 1,3-дион и/или 4-гидрокси-2-циклопентенон,обладающий(ие) противоопухолевым действием, и теперь можно изготовить противоопухолевое средство в виде фармацевтического препарата путем смешивания этих компонентов с известными фармацевтическими носителями. Обычно, по крайней мере, одно из указанных соединений смешивают с фармацевтически приемлемым жидким или твердым носителем и,если это необходимо, добавляют в смесь растворитель, диспергирующий агент, эмульгатор,буфер, стабилизатор, наполнитель, связывающее вещество, дезинтегрирующее вещество,смазывающее вещество и т.д. для получения противоопухолевого средства, которое может быть твердым, таким как таблетки, гранулы,разбавленные порошки, порошки, капсулы и т.д., или жидкими, такими как растворы, суспензии, эмульсии и т.д. Кроме того, оно может быть изготовлено в виде сухого препарата, который может быть превращен в жидкий путем добавления подходящего носителя перед употреблением. Фармацевтический носитель может быть выбран в зависимости от вышеописанного способа применения и формы лекарственного средства. В случае пероральных лекарственных форм можно использовать крахмал, лактозу,сахар, маннит, карбоксиметилцеллюлозу, кукурузный крахмал, неорганические соли и т.д. При изготовлении пероральных препаратов могут быть добавлены связывающие вещества, дезинтегрирующие вещества, поверхностно-активные вещества, смазывающие вещества, промоторы сыпучести, вкусовые корригенты, красящие вещества, ароматизаторы и т. д. С другой стороны, в случае парентеральных лекарственных форм они могут быть изготовлены обычными методами, при которых 4 циклопентен-1,3-дион и/или 4-гидрокси-2 циклопентенон как действующий компонент по настоящему изобретению растворяют или суспендируют в разбавителе, таком как дистиллированная вода для инъекции, физиологический солевой раствор, водный раствор глюкозы, растительное масло для инъекции, кунжутное масло, арахисовое масло, соевое масло, кукурузное масло, пропиленгликоль, полиэтиленгликоль и 4 т.д., с последующим добавлением, если это необходимо, бактерицидов, стабилизаторов, изотонических средств, анальгетиков и т.д. Противоопухолевое средство по настоящему изобретению вводят подходящим способом, зависящим от формы лекарственного средства. Нет особого ограничения на способ введения препарата и потому он может быть использован путем перорального приема, наружного применения и инъекции. Инъекционные препараты вводят, например, внутривенно, внутримышечно, подкожно, внутрикожно и т.д., а препараты для наружного применения включают суппозитории и т. д. Доза препарата как противоопухолевого средства зависит от формы препарата, способа введения, цели применения и возраста, массы тела и симптомов пациента, проходящего курс лечения, и не является постоянной, но обычно количество 4-циклопентен-1,3-диона и/или 4 гидрокси-2-циклопентенона в препарате составляет от 0,1 мкг/кг до 5 мг/кг в сутки (для взрослых) . Разумеется, дозу можно изменять в зависимости от различных условий, причем в некоторых случаях может быть достаточной доза меньше указанной выше, а в других случаях может оказаться необходимой доза больше указанной. Лекарственное средство по настоящему изобретению может быть введено как таковое перорально, а может быть добавлено к любому пищевому продукту и напитку, так что средство может быть принято обычным образом. 4-Циклопентен-1,3-дион и/или 4-гидрокси 2-циклопентенон по настоящему изобретению обладают(ет) апоптоз-индуцирующим действием и потому можно изготовить апоптозиндуцирующее средство (стимулятор апоптоза),содержащее 4-циклопентен-1,3-дион и/или 4 гидрокси-2-циклопентенон в качестве действующего компонента. Индуктор апоптоза может быть изготовлен в виде фармацевтических препаратов также, как и описанное выше противоопухолевое средство, и также введен, как это средство. Доза индуктора апоптоза зависит от формы препарата, способа введения, цели применения и возраста, массы тела и симптомов пациента, проходящего курс лечения, и не является постоянной, но обычно количество 4 циклопентен-1,3-диона и/или 4-гидрокси-2 циклопентенона в препарате составляет от 0,1 мкг/кг до 2 мг/кг в сутки (для взрослых). Разумеется, дозу можно изменять в зависимости от различных условий, причем в некоторых случаях может быть достаточной доза меньше указанной выше, а в других случаях может оказаться необходимой доза больше указанной. Лекарственное средство по настоящему изобретению может быть введено как таковое перорально, а может быть добавлено к любому пищевому продукту и напитку, так что средство может быть принято обычным образом. 5 Индуктор апоптоза по настоящему изобретению очень полезен, поскольку он способен вызывать апоптоз в нужных тканях и клетках и может удалять ненужные или патогенные клетки из живых организмов естественным образом. Так, индуктор апоптоза по настоящему изобретению эффективен в удалении, например,клеток, пораженных вирусом, опухолевых клеток и аутореактивных лимфоцитов у пациентов,страдающих от аутоиммунных заболеваний, и благодаря возбуждению апоптоза в нужных тканях или клетках можно теперь удалять ненужные или вредные клетки из живого организма естественным образом. Примерами заболеваний, по отношению к которым индуктор апоптоза по настоящему изобретению эффективен, являются системная красная волчанка, аутоиммунный гломерулярный нефрит, рассеянный склероз, коллагеновая болезнь и другие аутоиммунные заболевания, а также ревматизм. Индуктор апоптоза по настоящему изобретению может быть использован в методе индуцирования апоптоза. Таким образом, при использовании в качестве действующего компонента 4-циклопентен-1,3-диона и/или 4 гидрокси-2-циклопентенона можно индуцировать апоптоз, причем указанный метод пригоден, например, для объяснения механизма индуцирования и для скрининга индукторов апоптоза и ингибиторов индуцирования апоптоза. Кроме того, 4-циклопентен-1,3-дион и 4 гидрокси-2-циклопентенон обладают ингибирующим действием на топоизомеразу. Оба эти соединения имеют , -ненасыщенную карбонильную группу. Создатели настоящего изобретения провели дополнительные исследования ингибирующего действия на топоизомеразу соединений, имеющих , -ненасыщенную карбонильную группу как таковую, и нашли, что соединение, имеющее , -ненасыщенную карбонильную группу, оказывает сильное ингибирующее действие на топоизомеразу. Поэтому в соответствии с настоящим изобретением предлагается ингибитор топоизомеразы, содержащий в качестве действующего компонента соединение, имеющее , -ненасыщенную карбонильную группу. Нет особого ограничения на использование соединения с , -ненасыщенной карбонильной группой, в качестве для указанного ингибитора топоизомеразы, но как пример можно, в дополнение к 4-циклопентен-1,3 диону и 4-гидрокси-2-циклопентенону, назвать малеинимид, 4,5-дигидрокси-2-циклопентен-1 он и простой 4-трет-бутилциклопентеноновый эфир, представленный следующей формулой 6 Указанный ингибитор топоизомеразы изготавливают в виде фармацевтического препарата с использованием в качестве действующего компонента соединения, имеющего , ненасыщенную карбонильную группу, так же,как уже описано в абзацах, относящихся к противоопухолевому средству, и его можно вводить способами, аналогичными способам введения противоопухолевого средства. Вышеописанный ингибитор топоизомеразы ингибирует, в частности, топоизомеразу II, которая неустойчиво экспрессируется только на стадии деления нормальных клеток, но в результате злокачественного перерождения клетки становится сильно экспрессируемой в течение всего периода существования клетки, и полезен как высокоизбирательный ингибитор топоизомеразы II. Он также полезен как противоопухолевое средство благодаря его специфическому ингибирующему действию на топоизомеразу II. Кроме того, метод ингибирования топоизомеразы с использованием указанного ингибитора топоизомеразы полезен в биохимических исследованиях, в скрининге противоопухолевых средств и т.д. 4-Циклопентен-1,3-дион и 4-гидрокси-2 циклопентенон, используемые в настоящем изобретении, являются соединениями, обладающими различными физиологическими действиями, такими как противоопухолевое действие, угнетающее действие на рост опухолевых клеток, угнетающее действие на рост анормальных клеток, апоптоз-индуцирующее действие,ингибирующее действие на топоизомеразу и угнетающее действие на синовиальные клетки,и потому в виде фармацевтических препаратов,содержащих такие соединения в качестве действующих компонентов, могут быть предложены не только противоопухолевое средство, апоптоз-индуцирующее средство и ингибитор топоизомеразы, но и средство подавления роста опухолевых клеток, средство угнетения роста анормальных клеток, средство подавления синовиальных клеток и т. д. 4-Циклопентен-1,3-дион и 4-гидрокси-2 циклопентенон, используемые в настоящем изобретении, обладают подавляющим действием на рост опухолевых клеток, апоптозиндуцирующим действием и т.д. и пищевой продукт или напиток, который содержит разведенное в нем или добавленное к нему, по крайней мере, одно соединение, выбранное из указанных соединений, полезен как пищевой продукт или напиток, обладающий противоопухолевым и апоптоз-индуцирующим действиями. Нет особого ограничения на способ изготовления пищевого продукта или напитка по настоящему изобретению, но можно привести в качестве примера изготовление путем варки,переработки и широко используемого способа изготовления пищевого продукта и напитка,лишь бы изготовленный этими способами пищевой продукт и напиток содержал 4 7 циклопентен-1,3-дион и 4-гидрокси-2 циклопентенон, обладающие противоопухолевым и апоптоз-индуцирующим действиями. При использовании в настоящем изобретении 4-циклопентен-1,3-диона не было случая смерти даже при разовом пероральном введении мышам дозы 10 мг/кг. При использовании 4 гидрокси-2-циклопентенона не было случая смерти даже при разовом пероральном введении мышам дозы 100 мг/кг. Кроме того, в случаях использования 4,5-дигидрокси-2-циклопентен 1-она и 4-трет-бутилциклопентенонового эфира не было случая смерти при разовом пероральном введении мышам дозы 10 мг/кг каждого из них. Примеры Далее настоящее изобретение будет проиллюстрировано более конкретно на следующих примерах, но эти примеры ни в коей мере не ограничивают изобретение. Пример 1.(1) В каждую ячейку пластины микротитратора с 96 ячейками вводили по 10 мкл 250 мМ, 125 мМ, 62,5 мМ, 31,3 мМ, 15,6 мМ, 7,81 мМ, 3,91 мМ, 1,95 мМ, 977 мкМ, 488 мкМ, 244 мкМ, 122 мкМ, 61,0 мкМ, 30,5 мкМ или 15,3 мкМ раствора (в 70%-ном водном растворе этанола) 4-циклопентен-1,3-диона или 4-гидрокси 2-циклопентенона или 70%-ного водного раствора этанола в качестве контрольного и сушили раствор воздухом. Штамм HL-60 (АТССCCL-240) клеток промиелоцитарного лейкоза суспендировали при концентрации 1 х 105 клеток/мл в среде RPMI 1640 (производство фирмой BioWhittaker), содержащей 10% фетальной коровьей сыворотки (производство фирмы JPH),обрабатывали при 56 С в течение 30 мин, в каждую ячейку указанной пластины микротитратора помещали по 100 мкл суспензии и культивировали клетки при 37 С в течение 48 ч в присутствии 5% СO2. Затем в каждую ячейку добавляли водный раствор хлорида натрия (10 мкл) с фосфатным буфером, содержащим 5 мг/мл 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида (МТТ; производство фирмыSigma), продолжали инкубирование еще четыре часа и смотрели под микроскопом состояние роста клеток. Добавляли 100 мкл 2-пропанола,содержащего 0,04 н. НСl, с последующим тщательным перемешиванием и измеряли спектральную поглощательную способность при 590 нм. В результате оказалось, что рост клеток(конечная концентрация: 12,2 мкМ), наблюдалось образование апоптического тела. На участках, где вводили более высокие, чем указанные концентрации, рост клеток не наблюдался, а на участках, где вводили более низкие концентра 002290 8 ции, наблюдался такой же рост клеток, как на участке, где вводили 70%-ный водный раствор этанола (контрольный раствор).(2) Штамм HL-60 (ATCC CCL-240), выдержанный при 37 С в среде RPMI 1640, содержащей 10% фетальной коровьей сыворотки, суспендировали в среде RPMI 1640 при концентрации 2,5 х 105 клеток/мл. К 5 мл этой суспензии добавляли по 10 мкл 70% этанолового раствора 0,05 мМ, 0,5 мМ,5 мМ и 50 мМ 4-циклопентен-1,3-диона и 0,05 мМ, 0,5 мМ, 5 мМ и 50 мМ 4-гидрокси-2 циклопентенона и затем осуществляли культивирование при 37 С в течение 24 ч в присутствии 5% диоксида углерода. Культивированные клетки рассматривали под оптическим микроскопом и увидели агрегацию ядер, сморщивание клеток и образование апоптического тела в культивированных клетках, к которым добавляли 1 мкМ (конечная концентрация) 4-циклопентен-1,3-диона или 10 мкМ (конечная концентрация) 4-гидрокси-2 циклопентенона. Между прочим, в культивированных клетках, к которым добавляли 10 мкл 70%-ного раствора этанола (контрольный раствор), таких явлений не наблюдалось. Затем, использовав клетки, культивированные в течение 24 и 48 ч таким же методом,как описанный выше, проводили определение апоптозных клеток с использованием FACScan методом, описанным на страницах 129-130"Protocol for Experiments on Apoptosis" (в "Experimental Protocol Series" - специальном выпуске Saibo Kogaku, опубликованном by Shujunsha),и анализ фрагментации ДНК методом, описанным на страницах 61-63 "Biomanual UP Series New Experimental Method of Apoptosis" (публикация Yodosha). В результате были обнаружены апоптозные клетки в культивированных клетках, к которым добавляли 1 мкМ (конечная концентрация) или больше 4-циклопентен-1,3 диона или 10 мкМ (конечная концентрация) или больше 4-гидрокси-2-циклопентенона, и наблюдалась фрагментация ДНК в культивированных клетках, к которым добавляли 1 мкМ 4 циклопентен-1,3-диона или 10 мкМ 4-гидрокси 2-циклопентенон. Между прочим, в культивированных клетках, к которым добавляли 10 мкл 70%-ного раствора этанола (контрольный раствор), таких явлений не наблюдалось.(3) Часть клеток, культивированных в течение 24 ч таким же методом, как в примере 1(2), отбирали в виде образца, окрашивали 0,4% синим красителем Trypan Blue и наблюдали под оптическим микроскопом, подсчитывали количество живых клеток, которые не были окрашены, и количество мертвых клеток, которые были окрашены синим цветом, и вычисляли концентрации 4-циклопентен-1,3-диона и 4-гидрокси 2-циклопентенона, при которых выживаемость составляла 50%. Эти концентрации (мкМ при выживаемости 50%) показаны в табл. 1. Из табл. 1 видно, что 4-циклопентен-1,3 дион и 4-гидрокси-2-циклопентенон оказывают подавляющее действие на рост опухолевых клеток и апоптоз-индуцирующее действие при указанных выше концентрациях. Пример 2.(1) D-Глюкуроновую кислоту (10 г; производство фирмы Sigma) растворяли в одном литре воды, нагревали при 121 С в течение четырех часов и концентрировали в вакууме до примерно 10 мл. К полученному остатку добавляли 40 мл верхнего слоя смеси бутилацетата, уксусной кислоты и воды (3:2:2), после чего смесь перемешивали и подвергали центробежному разделению и полученный супернатант концентрировали в вакууме до примерно 10 мл. Полученный экстракт наносили на силикагель BW-300 SP (2 х 28 см; производство фирмыFuji Silisia Kagaku) для колоночной хроматографии и разделяли при скорости потока 5 мл/мин с использованием верхнего слоя смеси (3:2:2) бутилацетата, уксусной кислоты и воды в качестве элюента при давлении 0,2 кг/см 2, пользуясь компрессором. Производили разделение на фракции по 10 мл каждая и часть каждой фракции анализировали путем тонкослойной хроматографии, что показало содержание 4,5 дигидрокси-2-циклопентен-1-она высокой частоты в фракциях от 61-ой до 80-ой. Эти фракции собирали, концентрировали в вакууме и экстрагировали 40 мл хлороформа и экстракт концентрировали с получением 100 мг 4,5-дигидрокси 2-циклопентен-1-она.(2) 4,5-Дигидрокси-2-циклопентен-1-он (44 мг) и 287 мг трет-бутил 2,2,2-трихлорацетимидата (36, 478-9; производство фирмы Aldrich) растворяли в 2,5 мл дихлорметана в потоке аргона. К полученному раствору постепенно добавляли 1 мл раствора 28 мкл/мл комплекса трифторида бора с диэтиловым эфиром в дихлорметане при перемешивании. После перемешивания при комнатной температуре в течение 8 ч смесь концентрировали в вакууме и 4 трет-бутилциклопентеноновый эфир очищали путем тонкослойной хроматографии на силикагеле с использованием хлороформа и метанола 10 активность по отношению к топоизомеразе следующим образом.(i) Смесь 2 мкл топоизомеразы II (2 единицы/мкл; производство фирмы TopoGEN), 2 мкл буфера в 10-кратной концентрации [0,5 М ТрисHCl (рН 8,0), 1,2 М КСl, 0,1 М MgCl2, 5 мМ аденозинтрифосфата и 5 мМ дитиотрейтола], 2 мкл бычьего сывороточного альбумина (производство фирмы Takara Shuzo), 11 мкл дистиллированной воды и 2 мкл дистиллированной воды(контрольный опыт) или 4-циклопентен-1,3 диона, 4-гидрокси-2-циклопентенона, малеинимида, 4,5-дигидрокси-2-циклопентен-1-она или 4-трет-бутилциклопентенонового эфира, приготовленного в различных концентрациях с водой,подвергали взаимодействию с 1 мкл 0,25 мкг/мл ДНК pBR322 (продукт фирмы Takara Shuzo) при 37 С. Через 30 мин реакцию прекращали путем добавления 2 мкл водного раствора 1% додецилсульфата натрия, 50% глицерина и 0,02% бромфенолового синего красителя. Полученный реакционный раствор (20 мкл) наносили на 1% агарозный гель, полученный из агарозы L03 (производство фирмы Takara Shuzo) и ТАЭ буфера [40 мМ Трис, 5 мМ ацетата натрия и 1 мМ этилендиаминтетраацетата динатрия (ЭДТА); доведен до рН 7,8 уксусной кислотой], и осуществляли электрофорез в ТАЭ буфере. После электрофореза гель погружали в 1 мкг/мл водный раствор бромида этидия и подвергали ультрафиолетовому облучению,чтобы увидеть электрофоретическую картину ДНК. Между прочим, в контрольном опыте, где добавляли воду, ДНК была полностью изменена от суперспирального к редактированному типу,но при ингибировании активности топоизомеразы II изменение от суперспирального типа к редактированному типу частично или полностью ингибируется. В результате оказалось, что в контрольном опыте, где добавляли воду, ДНК полностью сменилась с суперспиральной на релаксированную, в случаях добавления 50 мкМ или более 4 циклопентен-1,3-диона, 100 мкМ или более 4 гидрокси-2-циклопентенона, 1 мкМ или более малеинимида, 50 мкМ или более 4,5 дигидрокси-2-циклопентен-1-она и 500 мкМ или более 4-трет-бутилциклопентенонового эфира изменение ДНК от суперспирального типа к релаксированному типу было частично или полностью ингибировано, что подтвердило ингибирующую активность по отношению к топоизомеразе II соединений, имеющих , ненасыщенную карбонильную группу.(ii) Ингибирующую активность каждого из соединений по отношению к топоизомеразе I измеряли таким же методом, как в примере 2(3)-(i), за исключением того, что вместо топоизомеразы II использовали топоизомеразу I [продукт фирмы TopoCEN; 0,01 единицы/мкл] и в качестве буфера 10-кратной концентрации ис 11 пользовали 100 мМ Трис-НСl (рН 7,9), 10 мМ ЭДТА, 1 мМ спермидина и 50% глицерин. В результате оказалось, что в контрольном опыте, где добавляли воду, ДНК полностью сменилась с суперспиральной на релаксированную, в случаях добавления 1000 мкМ или более 4-циклопентен-1,3-диона, 1000 мкМ или более 4,5-дигидрокси-2-циклопентен-1-она и 1000 мкМ или более малеинимида изменение ДНК от суперспирального типа к релаксированному типу было частично ингибировано, что подтвердило их ингибирующую активность по отношению к топоизомеразе I. Как таковые соединения, имеющие , ненасыщенную карбонильную группу, проявили специфическую ингибирующую активность по отношению к топоизомеразе 11, которая лишь неустойчиво экспрессируется на стадии деления нормальных клеток и становится сильно экспрессируемой во всем цикле существования клетки в результате опухолевого перерождения клетки. Пример 3. Клетки Meth А твердой опухоли мыши (2 х 106 клеток/мышь) трансплантировали подкожно в область спины женской особи мыши BALB/c возрастом 8 недель (масса тела: примерно 20 г). Затем, в течение пяти последующих дней в ту же самую область вводили подкожно 4 гидрокси-2-циклопентенон (0,3 мг/кг/сутки или 1 мг/кг/сутки) или 4-циклопентен-1,3-дион (0,03 мг/кг/сутки или 0,1 мг/кг/сутки). С другой стороны, контрольной группе аналогичным образом вводили подкожно физиологический солевой раствор. Через 7 дней после трансплантации опухолевых клеток измеряли длинный и короткий диаметры раковых тканей, образовавшихся на спине мыши, и вычисляли размер опухоли(мм 3) по формуле (длинный диаметр) х (короткий диаметр) 2/2. Кстати, в этом опыте одна группа состояла из 8 мышей. Результаты показаны в табл. 2. Как показано в табл. 2, 4-гидрокси-2-циклопентенон и 4 циклопентен-1,3-дион обладают противоопухолевой активностью. Таблица 2 Группа Контрольная группа Группа, которой вводили 4-гидрокси 2-циклопентенон Группа, которой вводили 4-циклопентен 1,3-дион(1) Изготавливали таблетку, содержащую 1 мг 4-гидрокси-2-циклопентенона и подходящее количество микрокристаллической целлюлозы,и покрывали ее сахаром, получив в результате препарат в форме таблетки.(2) Изготавливали таблетку, содержащую 0,1 мг 4-циклопентенон-1,3-диона, 10 мг глицирризата дикалия и подходящее количество микрокристаллической целлюлозы, и покрывали ее сахаром, получив в результате препарат в форме таблетки. Достоинство изобретения В соответствии с настоящим изобретением предлагается лекарственное средство, обладающее противоопухолевым и апоптозиндуцирующим действиями, которое выбрано из 4-циклопентен-1,3-диона и 4-гидрокси-2 циклопентенона. Кроме того, пищевой продукт или напиток, содержащий указанные соединения, добавленные к нему и/или разведенные в нем, полезен как пищевой продукт или напиток,обладающий противоопухолевым и апоптозиндуцирующим свойствами. Можно также исследовать механизм индуцирования апоптоза и разработать апоптозингибирующее средство, содержащее указанные соединения. Лекарственное средство по настоящему изобретению может быть использовано для создания способа индуцирования апоптоза и полезно также и в таком применении. Кроме того, в соответствии с настоящим изобретением предлагается ингибитор, содержащий в качестве действующего компонента соединение, имеющее , -ненасыщенную карбонильную группу, который, в частности, ингибирует топоизомеразу II. Указанный ингибитор полезен также в качестве противоопухолевого средства. Кроме того, предлагаемый в соответствии с настоящим изобретением способ ингибирования топоизомеразы с использованием соединения, имеющего , -ненасыщенную карбонильную группу, полезен для биохимических исследований и для скрининга противоопухолевых средств и т.д.(1) К физиологическому раствору (приготовленному по правилам фармакопеи Японии) добавляли 4-циклопентенон-1,3-дион в концентрации 0,1% с получением инъекционного препарата.
МПК / Метки
МПК: A61K 31/122, A61P 35/00
Метки: противоопухолевое, средство
Код ссылки
<a href="https://eas.patents.su/8-2290-protivoopuholevoe-sredstvo.html" rel="bookmark" title="База патентов Евразийского Союза">Противоопухолевое средство</a>
Предыдущий патент: Сейсмостойкая несущая оболочка морского основания
Следующий патент: Способ очистки воды в осветлителях со взвешенным осадком
Случайный патент: Система дистанционного управления для сосуда высокого давления












