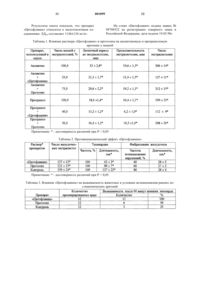
Инъекционное лекарственое средство “цитофлавин”, обладающее цитопротекторным действием
Номер патента: 1099
Опубликовано: 30.10.2000
Авторы: Алексеева Людмила Евгеньевна, Коваленко Алексей Леонидович
Формула / Реферат
Инъекционное лекарственное средство, обладающее цитопротекторным действием, содержащее активную композицию естественных метаболитов и коферментов в растворителе, отличающееся, тем что в качестве естественных метаболитов содержит янтарную кислоту и рибоксин (инозин), в качестве коферментов - никотинамид и рибофлавин-5-мононуклеотид натрия, в качестве растворителя воду для инъекций, и также дополнительно содержит натрия гидроокись и N-метилглюкамин при следующем соотношении компонентов, мас.%:
| Янтарная кислота | 9,5-10,5 |
| Рибоксин (инозин) | 1,9-2,1 |
| Никотинамид | 0,95-1,05 |
| Рибофлавин-5- мононуклеотид натрия | 0,19-0,21 |
| Натрия гидроокись | 3,3-3,7 |
| N-метилглюкамин | 15,7-17,3 |
| Вода для инъекций | До 100 |
Текст
1 Изобретение относится к медицине, в частности, к комплексному лекарственному инъекционному препарату, обладающему цитопротекторным действием. Препарат может быть использован для лечения острого инфаркта миокарда, ишемии головного мозга, гипоксического инсульта, коронарной недостаточности, ишемической болезни сердца, заболеваний печени и почек. Известно большое количество различных фармакологических активностей янтарной кислоты, е солей - сукцинатов и производных. Среди них антигипоксическое средство на основе сукцината янтарной кислоты для лечения внутриутробной патологии плода, связанной с гипоксией и инфекцией (патент России 2056842, МПК А 61 К 31/19, 30.06.92); гепатопротекторное средство на основе производных янтарной кислоты (патент Японии 09/188.664,МПК С 07 С 323/51, 22.07.97); лекарственное средство для лечения ишемии мозга на основе сукцината янтарной кислоты (патент России 2108095, МПК А 61 К 31/19, 22.11.94). Однако в списке разрешенных к медицинскому применению и внедрнных в медицинскую практику лекарственных средств, содержащих янтарную кислоту в качестве основного активного компонента, значится единственная лекарственная форма - таблетки Лимонтар,(0,2 г свободной янтарной кислоты и 0,05 г лимонной кислоты), применяемые у взрослых в качестве диагностического средства для исследования секреторной способности желудка.- Изд. 13-е, новое - Харьков, Торсинг, 1997,с.494). Широкий спектр фармакологической активности янтарной кислоты обусловлен тем, что она является естественным метаболитом организма, участвуя в окислительно-восстановительном цикле дикарбоновых кислот (цикл Кребса) и обеспечивая тем самым нормальную жизнедеятельность клетки. Известны также комплексные препараты на основе природных пуриновых нуклеозидов,например, инозин (рибоксин), гуанозин, аденозин, которые используются в качестве лекарственных средств узконаправленного действия или кардиопротекторного (патент России 1769428, МПК А 61 К 31/70, 09.04.90); (патент России 2035908, МПК А 61 К 31/52, 24.09.91) или гепатопротекторного (патент Японии 61,277619, МПК А 61 К 3 1/505, 04.01.85). Наиболее близким к заявляемому является комплексный инъекционный лекарственный препарат узконаправленного гепатопротекторного действия, содержащий в свом составе смесь метоболитов и витаминов (патент Великобритании 1178984, МПК А 61 К 25/00,23.06.66), следующего состава: Кальциевая соль 1-L-5-формилтетрагидрофолиевой кислоты 0,9 мг 2 Гидроксикобаламина гидрохлорид Цианкобаламин Рибоксин Аденин Никотинамид Рибофлавин-5-мононуклеотид натрия Остальное дистиллированная стерильная вода для инъекций Однако при тяжлых патологиях возникает потребность в комплексных лекарственных препаратах, защищающих поражнную клетку и одновременно нормализующих е жизнедеятельность. При различных патологических процессах в организме нормальная жизнедеятельность клеток нарушается, что выражается в ухудшении дыхательной (окислительно-восстановительной) функции клеток, уменьшении или прекращении синтеза белков и ферментов клеткой,другими нарушениями. В конечном итоге эти нарушения приводят к повреждению клеточных мембран, снижению уровня утилизации метаболитов, гибели клетки. Поэтому создание комплексных лекарственных препаратов, защищающих клетку от разрушения и гибели и способствующих е нормальной жизнедеятельности, так называемых цитопротекторов, является актуальной и важной задачей. Такие препараты должны содержать как вещества, способствующие усилению метаболических процессов, так и компоненты, способствующие быстрой и эффективной утилизации метаболитов в клетках поврежднных органов и тканей. В связи с этим заявитель разработал комплексный препарат, обладающий цитопротекторным действием, в состав которого включены как компоненты метаболитной природы (янтарная кислота и рибоксин), так и коферметные компоненты - витамины (никотинамид и рибофлавин-5-мононуклеотид натрия), при следующем соотношении компонентов, мас.%: Янтарная кислота 9,5-10,5 Рибоксин (инозин) 1,9-2,1 Никотинамид 0,95-1,05 Рибофлавин-5-мононуклеотид натрия 0,19-0,21 Натрия гидроокись 3,3-3,7N-Метилглюкамин 15,7-17,3 Вода для инъекций До 100 Пример конкретного получения Цитофлавина для инъекций В стеклянный аппарат с мешалкой мкостью 100 л загружают 50,0 л воды для инъекций,10,0 кг янтарной кислоты, 3,4 кг едкого натрия,0,6 кг рибофлавина-5- мононуклеотида натрия,16,5 кг N-метилглюкамина, 1,0 кг никотинамида, 2,0 кг рибоксина. Полученную смесь перемешивают до полного растворения компонентов 3 и далее добавляют воду для инъекций до получения объма 100 л. Полученный раствор фильтруют через стерилизующий фильтр типа Палл, разливают в стерильные ампулы объмом 5 мл и запаивают. Получают 18000 ампул объмом 5 мл. Выход 90%. Каждая ампула содержит - янтарной кислоты 500 мг (10%), рибоксина 100 мг (2%),никотинамида 50 мг (1%), рибофлавина-5 мононуклеотида натрия 10 мг (0,2%), натрия гидроокиси 170 мг (3,4%), N-метилглюкамина 825 мг (16,5%), воды для инъекций до 100%. Использование данного лекарственного средства позволило получить высокий цитопротекторный эффект на различных моделях повреждения клеток при патологии сердца, печени и почек. Изучение цитопротекторной активности препарата Изучение заявленного лекарственного средства проводили в сравнении с прототипом. Опыт 1. Изучение кардиопротекторного действия на модели антиаритмической активности. Учитывая, что аритмии являются одним из первых показателей развития патологии клеток миокарда при различных сердечно-сосудистых заболеваниях, сопровождающихся повреждением клеток миокарда, таких как острый инфаркт миокарда и ишемическая болезнь сердца, для оценки цитопротекторного действия Цитофлавина на клетки миокарда представлялось необходимым изучить и оценить прежде всего антиаритмическую активность предлагаемого лекарственного средства. Опыт проводили на линейных белых мышах СВА, разбитых на пять групп по 25 животных. Экспериментальную аритмию сердца моделировали общепринятым методом - введением алкалоида аконитина подкожно в разовой дозе 200 мкг/кг массы животного и пропранола подкожно в разовой дозе 40 мг/кг. Введение алкалоида аконитина в организм вызывает стойкое повышение натриевой проницаемости мембран кардиомиоцитов (Орлов Б. Н. Ядовитые животные и растения СССР. - М.,Высшая школа, 1990, с. 192 - 194). Введение пропранола вызывает брадикардию и остановку сердца за счет блокады адренорецепторов в миокарде и изменения внутриклеточного соотношения ионов калия и натрия. (Working Group on Arithmias-Circulation. 1991, V.84,4. р.1831 - 1851). Цитофлавин, прототип и контроль 0,9% изотонический раствор хлорида натрия вводили внутривенно в хвостовую вену в разовой дозе 1,2 мл/кг массы животного, однократно за пять минут до введения аконитина или пропранола. Запись электрокардиограммы у мышей проводилась в начале опыта, а далее через 10, 30 и 60 мин после введения препаратов. 4 Для определения времени возникновения и продолжительности экстрасистолии во время опыта проводился мониторинг электрокардиограммы в течение 60 мин. Полученные экспериментальные данные обработаны статистически с использованием критерия Стьюдента при Р 0,05. Данные по испытанию антиаритмической активности препаратов представлены в таблице 1. При моделировании аконитиновой аритмии введение аконитина вызывало политонную экстрасистолию у 100% животных (см. табл. 1). При введении Цитофлавина в дозе 1,2 мл/кг за 5 мин до введения аконитина экстрасистолия развивалась лишь у 25% мышей, при этом латентный период экстрасистолии уменьшился на 35%, а само число экстрасистол уменьшилось в 2,4 раза. Таким образом Цитофлавин проявил выраженное цитопротекторное антиаритмическое действие на клетки миокарда на модели аконитиновой аритмии. Учитывая механизм действия алкалоида аконитина, механизм защитного действия Цитофлавина обусловлен стабилизацией мембран клеток кардиомиоцитов и понижением их проницаемости для ионов натрия. Напротив, при введении раствора прототипа за 5 мин до введения аконитина развивалась совершенно противоположная картина: экстрасистолия наблюдалась у 75% мышей, а латентный период, продолжительность и общее число экстрасистол вообще не изменилось по сравнению с аконитином. Таким образом, прототип проявлял слабо выраженную защитную антиаритмическую активность на клетки миокарда на модели аконитиновой аритмии и не обладает на данной модели стабилизирующим действием на клетки кардиомиоцитов. При аритмии, вызванной введением пропранола политонная экстрасистолия также вызывалась у 100% мышей. При предварительном введении Цитофлавина в дозе 1,2 мл/кг в хвостовую вену за пять минут до введения пропранола экстрасистолия развивалась у 40% животных, причм латентный период экстрасистолии уменьшился на 29%, а общее число экстрасистол уменьшилось в 3,2 раза. Полученные данные говорят о высоком цитопротективном эффекте Цитофлавина на клетки миокарда на модели аритмии, вызванной введением пропранола. Механизм защитного действия обусловлен нормализацией биохимии натрий/калиевого обмена через мембрану клетки. При введении раствора прототипа политонная экстасистолия выявлялась у 50% мышей,латентный период экстрасистолии практически не изменился, а среднее число экстрасистол уменьшилось только в 1,7 раза (табл. 1.). Это 5 свидетельствует об умеренном защитном действии прототипа на клетки миокарда. Таким образом на модели пропраноловой аритмии Цитофлавин также проявляет выраженное цитопротективное антиаритмическое действие, а раствор - прототип имеет только слабый защитный антиаритмический эффект. Такое различие объясняется созданием оптимальной комбинации естественных метаболитов - янтарной кислоты (энергетический компонент), рибоксина (субстрат для синтеза АТФ) и коферментов-витаминов для получения цитопротекторного эффекта. Вследствие ускорения усвоения клетками организма метаболитов,происходит ускорение биохимических процессов внутри клетки и оказывается протекторное действие на клетки миокарда-кардиомиоциты. Опыт 2. Изучение кардиопротекторного действия на модели ишемии миокарда. Ишемия (недостаток кислорода) в клетках миокарда приводит к нарушению биохимических процессов внутри кардиомиоцитов, связанных с потреблением энергии с последующим некрозом (разрушением) клеточной мембраны. Исследование противоишемической активности Цитофлавина по сравнению с раствором-прототипом проводили на белых линейных крысах породы Вистар. Все животные были разделены на три группы по 25 голов. Для исследования использовали общепринятую модель ишемии, вызванной окклюзией- перевязкой) левой коронарной артерии (Winslow E. Methods for the detection and assessment ofantiarrhythmic activity. / Pharmacology and therapy. 1984, V. 84, p. 401-433). Данная модель наиболее хорошо иллюстрирует развитие острого инфаркта миокарда у человека. Крыс наркотизировали внутрибрюшинным введением этаминала натрия в дозе 50 мг/кг,фиксировали и осуществляли регистрацию электрокардиограммы. Крыс с нарушениями ритма из опыта выводили. Всего было отобрано 36 крыс, разбитых на три группы по 12 животных. У оставшихся животных катетеризировали бедренную вену и бедренную артерию. Далее при искусственной вентиляции легких крысам вскрывали грудную клетку и перевязывали нисходящую ветвь левой коронарной артерии у нижнего края ушка левого предсердия. У всех животных регистрировали среднее артериальное давление в бедренной артерии с помощью ртутного манометра и осуществляли 30-минутное мониторирование электрокардиограммы для выявления ранних желудочковых аритмий, развивающихся на фоне ишемии миокарда. В первой группе животных вводили Цитофлавин в хвостовую вену в дозе 1,2 мл/кг чрез пять минут после перевязки. 6 Во второй группе вводили раствор прототипа в дозе 1,2 мл/кг. В третьей контрольной группе вводили в хвостовую вену 0,9% физиологический раствор хлорида натрия в дозе 1,2 мл/кг. В течение всего опыта продолжали искусственную вентиляцию легких с целью профилактики остановки дыхания, вызванной постоперационным пневмотораксом. По данным электрокардиограммы оценивали частоту сердечных сокращений, среднее артериальное давление, частоту возникновения и суммарную длительность периодов фибрилляции желудочков и желудочковой тахикардии. Эффективность препаратов по общезащитному цитопротективному действию на клетки организма оценивали по летальности в каждой группе. В течение всего опыта у всех животных регистрировали артериальное давление в бедренной вене и снимали электрокардиограмму через 1, 5, 15, 30, 45 и 60 мин от начала введения растворов в хвостовую вену. Статистическую значимость оценивали с помощью критерия Стьюдента. Обобщенные данные по эксперименту представлены в табл. 2. Результаты исследования противоишемической активности Цитофлавина показали,что при ишемии сердца препарат достоверно в 2,62 раза снижает количество желудочковых экстрасистолий по сравнению с контролем и в 1,6 раза по сравнению с прототипом. Длительность тахикардии уменьшилась в 3 раза по сравнению с контролем и в 2,1 раза по сравнению с прототипом, хотя частота возникновения тахикардии не уменьшилась во всех случаях. Цитофлавин также достоверно уменьшал частоту фибрилляции желудочков в 2,2 раза по сравнению с контролем и в 1,5 раза по сравнению с прототипом, хотя и практически не влиял на длительность времени фибрилляции. Полученные данные свидетельствуют о высокой цитопротективной активности Цитофлавина на клетки миокарда в условиях ишемии. Данные по выживаемости животных в условиях эксперимента также свидетельствуют о высокой цитопротективной активности Цитофлавина, при введении которого после операции перевязки выжило 100 % (12 крыс), при введении прототипа - 50 % (6 крыс), а при введении контрольного физиологического раствора- всего 25 % (3 крысы) (см. табл. 3). Мониторинг среднего артериального давления и частоты сердечных сокращений (см. табл. 4) показал, что Цитофлавин быстрее,чем прототип восстанавливал среднее артериальное давление в раннем периоде после окклюзии, практически не влияя на частоту сердечных сокращений. Такой эффект говорит о более выраженном компенсаторном действии Цитофлавина по сравнению с контролем и прототипом 7 в восстановлении биохимических процессов,протекающих в клетках при ишемии кардиомиоцитов, а следовательно, об общем цитопротекторном действии на миокард. Опыт 3. Исследование гепатопротекторной и ренопротекторной активности Цитофлавина при отравлении этиленгликолем. Для моделирования поражений клеток печени и почек использовали общеизвестную модель токсического гепатита и нефрозо-нефрита отравление 1,2-этиленгликолем. (Воспроизведение заболеваний у животных для экспериментально-терапевтических исследований. Под ред. Н.В. Лазарева. М.: Медгиз, 1964, 392 с.). В опыте было сформировано 6 экспериментальных групп животных по 12 крыссамцов: А-интактные животные, которым вводился физиологический раствор; Б - интактные животные, которым вводился Цитофлавин; В- интактные животные, которым вводился прототип; Г-животные с интоксикацией этиленгликолем без лечения; Д - животные с интоксикацией этиленгликолем и лечением Цитофлавином; Е- животные с интоксикацией этиленгликолем и лечением прототипом. Этиленгликоль вводили однократно внутрижелудочно через атравматический зонд в дозе 1,5 г/кг. Цитофлавин, прототип и физиологический раствор в контроле вводили в хвостовую вену крыс один раз в сутки в течение пяти дней в дозе 1,2 мл/кг. Биохимические исследования проводили по стандартным методикам (Стальная И.Д., Гаришвили Т.Г. Современные методы в биохимии. М.: Медицина, 1978, 95 с Клиническая оценка лабораторных тестов / Под ред. Н.У.Тица, М.: Медицина, 1986, 480 с.). Полученные экспериментальные данные обрабатывали статистическими методами по СтьюдентуФишеру. Клиническая картина в группе крыс, получавших этиленгликоль без лечения характеризовалась гиподинамией, заторможенностью реакций, взъерошенностью шерсти и неопрятностью животных. На 2-й день у них развилась макрогематурия, а с 4-го дня олигурия. Биохимический и гистологический анализ печени и почек подтвердил развитие поражения почек и печени - нефрозо-нефрита и токсического гепатита. Интоксикация этиленгликолем нарушала все функции печени: белково-синтезирующую и пигментную, что сопровождалось биохимическими признаками цитолиза. У всех животных без исключения развивались выраженные симптомы поражения почек: в анализе мочи определялись эритроциты, белок,цилиндры, кристаллы щавелево-кислого кальция, клетки почечного эпителия. Страдали все функции почек - выделительная, экстреторная и секреторная, а в крови нарастали продукты азотистого обмена, показатели цитолиза. При морфологическом обследовании в почках обнаруживались дегенеративные изме 001099 8 нения и мелкие кровоизлияния в паренхиму органов, наблюдалась жировая дистрофия нейроэпителия, в цитоплазме клеток извитых канальцев были видны мелкие капли жира. Об гепатопротекторной эффективности Цитофлавина в сравнении с прототипом судили по клинической картине, содержанию общего билирубина, аланинаминотрансферазы(АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы, общего белка, липидов сыворотки крови, гликогена, глутатиона в печени и нагрузочной пробе - гексеналовому тесту. Экспериментальные данные по гепатопротекторному действию Цитофлавина представлены в таблице 5. Исследования показали, что введение Цитофлавина и прототипа здоровым животным(группы А, Б, В) не вызывает нарушений функций печени и поведенческих реакций крыс. Введение этиленгликоля (группа Г) сопровождалось серьезным нарушением всех функций печени. Снижение общего белка и липидов и запаса гликогена в печени свидетельствует о нарушении белковосинтезирующей функции печени. Нарастание уровня аминотрансфераз, щелочной фосфатазы, билирубина и тимоловой пробы говорит о значительном разрушении клеток печени - гепатоцитов и нарушении пигментной функции. Увеличение времени гексеналового сна,снижение уровня восстановленного глутатиона и креатинфосфата показывает уменьшение детоксицирующей функции печени. Использование Цитофлавина для лечения поражения печени, вызванного этиленгликолем (группа Д) показало достоверную нормализацию всех функций печени: белковосинтезирующей (общий белок, липиды, гликоген) до 8091% от нормы, пигментной (билирубин, аминотрансферазы, щелочная фосфатаза, тимоловая проба) до 62-97% от нормы, детоксицирующей(гексеналовый сон, глутатион, креатинфосфат) на уровень 82-97% от нормы (группа А). Лечение прототипом (группа Е) также имело положительный эффект после отравления этиленгликолем, однако прототип восстанавливал белковосинтезирующую функцию печени на 60-90%, пигментную на 68-71%, а детоксицирующую всего на 50-70%. Таким образом, Цитофлавин обладает выраженным цитопротективным действием на клетки печени - гепатоциты при отравлении этиленгликолем (смотри таблицу 5). Эффективность Цитофлавина в качестве ренопротектора (защиты клеток почек) оценивали по комплексу биохимических показателей в сравнении с нормой, контрольной группой и прототипом: относительной массе почек, суточному диурезу, белку мочи, хлоридам мочи, сахару мочи,плотности мочи, мочевине, креатинину, лактатдегидрогеназе. 9 Экспериментальные данные по ренопротекторному действию Цитофлавина представлены в таблице 6. Экспериментальные данные показали, что введение как Цитофлавина, так и прототипа здоровым животным (группы А, Б, В) не оказывало негативного влияния на функциональную активность почек. В условиях патологии - отравления этиленгликолем (группа Г) у крыс увеличивалась масса почек, что свидетельствует об отеке. Достоверное увеличение в моче содержания белка,хлоридов, сахара, мочевины и увеличение плотности мочи свидетельствует о нарушении экстреторной и секреторной функции почек. Резкое уменьшение суточного объема мочи на фоне повышения уровня креатинина и фермента лактатдегидрогеназы говорит о разрушении клеток почечных канальцев, развитии нефрозо-нефрита и вследствие этого анурии. Использование Цитофлавина (группа Д) для лечения поражения почек, вызванного этиленгликолем, показало восстановление функциональной активности почек по всем показателям: отек резко уменьшился (масса почек стала 94% от нормы), экскреторная функция (диурез,плотность мочи, креатинин) восстановилась на 62-100% секреторная функция (содержание в моче белка, сахара, хлоридов, мочевины, уровень лактатдегидрогеназы) улучшилась до 6282% от нормы. Применения прототипа (группа Е) для лечения также имело положительный лечебный эффект при нефрозо-нефрите, но по различным показателям действие прототипа было менее эффективно чем у Цитофлавина : масса почек была 73% от нормы, экскреторная функция восстановилась 51-93% а секреторная функция на 45-60% от нормы (смотри табл. 6). Анализ гистологических данных у животных групп Д и Е также показал резкое уменьшение дистрофических изменений в ткани почек и печени, более ярко выраженное в группе Д при лечении Цитофлавином. Таким образом, Цитофлавин оказывает выраженный цитопротекторный эффект на клетки нефроэпителия и гепатоциты, превосходящий действие прототипа при экспериментальном гепатите и нефрозо-нефрите, вызванном применением этиленгликоля. Таким образом, изучение биологической активности препарата показало, что он обладает цитопротекторным действием, то есть оказывает защитный эффект на клетки сердца, печени и почек, нормализуя работу этих органов при различных патологиях. Для создания стабильной лекарственной формы экспериментально подобраны необходимые количества N-метилглюкамина и натрия гидроокиси. Эти компоненты не являются активными компонентами лекарственной формы, 001099 10 но обеспечивают необходимые физикохимические параметры. Опыт 4. Изучение влияния содержания Nметилглюкамина и гидроокиси натрия на стабильность Цитофлавина. Учитывая сложный многокомпонентный состав Цитофлавина и наличие в нм легко гидролизующихся в водных растворах по Nгликозидной связи в кислой и щелочной средеN-нуклеозида - Рибоксина (инозина) и Рибофлавина мононуклеотида (Справочник биохимика: перевод с англ. / Досон Р., Эллиот Д., Джонс К.М.: МИР, 1991, с. 71-88, 115.), было проведено исследование влияния содержания стабилизатора и комплексообразователя N-метилглюкамина на рН раствора и стабильность (отсутствие распада компонентов) при двухлетнем хранении при комнатной температуре водного раствора. Цитофлавин - препарат, предназначенный для внутривенного введения. Вводимые в кровяное русло растворы должны физиологически сочетаться с физико-химическими параметрами крови, в частности, с рН. Введение кислых и/или щелочных растворов в кровяное русло недопустимо, так как это может привести к образованию тромбов, повреждению стенок вен,выпадению в осадок лекарственных веществ и закупорке крупных и мелких кровеносных сосудов (И.А. Муравьв. -Технология лекарств, Т.2,Москва, Медицина, 1980, с. 622-689, Государственная фармакология СССР, М., Медицина,1990 - с. 140). Нами было исследовано влияние количества натрия гидроокиси на величину рН раствора препарата и свойства лекарственной формы(таблица 8). Проведнные исследования показали, что оптимальным для данной лекарственной формы является содержание натрия гидроокиси в количестве 3,3 - 3,7%. Экспериментальные данные опыта представлены в таблице 7. Проведенные исследования показали, что для создания стабильного лекарственного средства оптимальным является содержание Nметилглюкамина в Цитофлавине от 15,7 до 17,3 % - варианты Г, Д (табл.7) и содержание гидроокиси натрия от 3,3 - 3,7% - варианты Г, Д(табл.8). Опыт 5. Определение острой токсичности Цитофлавина. Определение острой токсичности Цитофлавина проводили на линейных белых мышахсамцах СВА в группах по 10 животных. Препарат вводили в хвостовую вену в возрастающих дозах по Вилкоксону-Литчфилду и определяли показатель ЛД 50 - дозу препарата,вызывающую гибель 50 % животных. Результаты исследования представлены в таблице 9. 11 Результаты опыта показали, что препарат Цитофлавин относится к малотоксичным соединениям: ЛД 50 составляет 1146124 мг/кг. 12 На слово Цитофлавин подана заявка 98708522 на регистрацию товарного знака в Российской Федерации, дата подачи 19.05.98 г. Таблица 1. Влияние раствора Цитофлавин и прототипа на аконитиновую и пропраноловую аритмию у мышей Примечание:- достоверность различий при Р 0,05 Таблица 2. Противоишемический эффект Цитофлавина Примечание:- достоверность различий при Р 0,05 Таблица 3. Влияние Цитофлавина на выживаемость животных в условиях возникновения ранних постишемических аритмий Таблица 4. Влияние Цитофлавина на среднее артериальное давление (САД) и частоту сердечных сокращений (ЧСС) в ранних в условиях возникновения ранних постишемических аритмий Примечание:- достоверность различий при Р 0,05 Таблица 5 Гепатопротекторный эффект Цитофлавина в сравнении с прототипом Примечание:- достоверность различий при Р 0,05ACT - аспартатаминотрасфераза ЩФ - щелочная фосфатаза КФ - креатин фосфат АЛТ - аламиннаминотрансфераза Таблица 6. Ренопротекторный эффект Цитофлавина в сравнении с прототипом, Мм. Примечание:- достоверные отличия от интактных животных при Р 0,05 Таблица 8. Влияние содержания натрия гидроокиси на рН раствора Цитофлавина ФОРМУЛА ИЗОБРЕТЕНИЯ Инъекционное лекарственное средство,обладающее цитопротекторным действием, содержащее активную композицию естественных метаболитов и коферментов в растворителе,отличающееся, тем что в качестве естественных метаболитов содержит янтарную кислоту и рибоксин (инозин), в качестве коферментов - никотинамид и рибофлавин-5-мононуклеотид натрия, в качестве растворителя воду для инъек ций, и также дополнительно содержит натрия гидроокись и N-метилглюкамин при следующем соотношении компонентов, мас.%: Янтарная кислота 9,5 -10,5 Рибоксин (инозин) 1,9-2,1 Никотинамид 0,95-1,05 Рибофлавин-5 мононуклеотид натрия 0,19-0,21 Натрия гидроокись 3,3-3,7N-Метилглюкамин 15,7-17,3 Вода для инъекций До 100
МПК / Метки
МПК: A61P 39/00, A61K 31/675, A61K 31/194, A61K 31/455, A61K 31/708
Метки: инъекционное, лекарственое, цитопротекторным, действием, цитофлавин, обладающее, средство
Код ссылки
<a href="https://eas.patents.su/9-1099-inekcionnoe-lekarstvenoe-sredstvo-citoflavin-obladayushhee-citoprotektornym-dejjstviem.html" rel="bookmark" title="База патентов Евразийского Союза">Инъекционное лекарственое средство “цитофлавин”, обладающее цитопротекторным действием</a>
Предыдущий патент: Устройство в статоре вращающейся электрической машины
Следующий патент: Фракция обогащенного лизином гистонового тимусного фактора (tf), способ получения фракции и способ выявления вич-инфекции у человека
Случайный патент: Устройство для ухода за полостью рта