Способ получения производных циклогексанола
Номер патента: 7486
Опубликовано: 27.10.2006
Авторы: Чай Ки-Байунг, Ким Кеун-Сик, Ким Кванг-Ил, Парк Дзин-Соо, Ли Сунг-Воо
Формула / Реферат
1. Способ получения производных циклогексанола формулы I
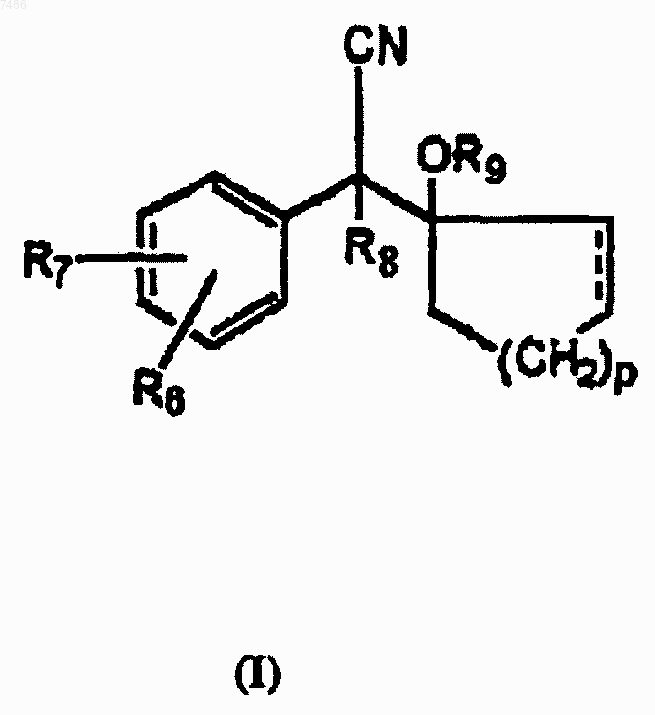
в которой R6 и R7 представляют собой орто- или паразаместители, независимо выбранные из группы, состоящей из водорода, гидроксила, C1-С6алкила, C1-С6алкокси, С7-С9аралкокси, С2-С7алканоилокси, C1-С6алкилмеркапто, галогена или трифторметила; R8 представляет водород или C1-С6алкил; р является одним из целых чисел 0, 1, 2, 3 или 4; a R9 представляет водород или C1-С6алкил;
включающий взаимодействие соединения формулы II с соединением формулы III

в присутствии неметаллоорганических основных катализаторов, представленных формулой IV или V, в присутствии или в отсутствии растворителя

в которой А представляет -(СН2)n-, где n является целым числом от 2 до 4; В представляет -(СН2)m-, где m является целым числом от 2 до 5; X представляет СН2, NH или NR', где R' представляет С1-С4алкил или ацил; каждый из R1-R4 независимо представляет водород, С1-С4алкил, циклогексилалкил или С1-С4алкил- или циклогексилалкилнесущий полимер, и все от R1 до R4 не являются водородом, a R5 является С1-С4алкилом, циклогексилалкилом или С1-С4алкил- или циклогексилалкилнесущим полимером, и где R9 представляет С1-С6алкил, причем алкильную группу вводят алкилированием.
2. Способ по п.1, в котором соединение формулы II представляет собой п-метоксифенилацетонитрил.
3. Способ по п.1, в котором соединение формулы III представляет собой циклогексанон.
4. Способ по любому из пп.1-3, в котором неметаллоорганический основный катализатор является смесью катализаторов, выбранных из одного или более амидинов или гуанидинов формулы (IV) или (V).
5. Способ по любому из пп.1-4, в котором основный катализатор является либо гомогенным, либо иммобилизованным на полимерном носителе.
6. Способ по любому из пп.1-5, в котором неметаллоорганическое основание выбирают из группы, состоящей из 1,8-диазабицикло[5,4,0]ундец-7-ена (DBU), 1,5-диазабицикло[4,3,0]нон-5-ена (DBN), 1,5,7-триазабицикло[4,4,0]дец-5-ена (TBD), 7-метил-1,5,7-триазабицикло[4,4,0]дец-5-ена (MTBD), тетраметилгуанидина (TMG) и N'-бутил-N'',N''-дициклогексилгуанидина.
7. Способ по любому из пп.1-6, в котором количество используемого неметаллоорганического основания находится в интервале от около 0,005 до около 0,5 эквивалентов относительно 1 эквивалента соединения формулы II.
8. Способ по любому из пп.1-7, в котором не используют растворитель.
9. Способ по любому из пп.1-8, в котором температура реакции находится в интервале от около -20 до 80шС.
10. Способ по п.9, в котором температура реакции находится в интервале от около 10 до 30шС.
11. Способ по любому из пп.1-10, в котором соединения формул II и III и основные катализаторы используют в эквивалентных соотношениях 1:1 ~ 1,5:0,005 ~ 0,5.
Текст
007486 Настоящее изобретение относится к способу получения производных циклогексанола, таких как 1[циано(4-метоксифенил)метил]циклогексанол. Состояние относящейся к проблеме области техники Производные циклогексанола, такие как 1-[циано(4-метоксифенил)метил]циклогексанол, представляют собой полезные промежуточные соединения для получения соединений типа венлафаксина, которые обладают антидепрессантным эффектом за счет ингибирования повторного поглощения нейромедиаторов, норепинефрина и серотонина. Как описано в патенте США 4535186, производные циклогексанола можно получить путем взаимодействия циклоалканона или циклоалкенона с анионом соответствующим образом замещенного (орто или пара)фенилацетонитрила. Способ получения, описанный в патенте США '186, включает использование металлоорганического основания, такого как н-бутиллитий, для образования в данной реакции аниона фенилацетонитрила. Металлоорганическое основание является дорогим, должно использоваться в количестве, по меньшей мере,1 эквивалента реагента при низкой температуре ниже -50 С, обычно чувствительно к влаге воздуха с риском возгорания или взрыва и дает низкий выход продукта, менее 50%. Поэтому металлоорганические основания считаются неудобными для синтеза в промышленном масштабе. В патенте США 5043466 описан способ получения производных циклогексанола, в котором используют металлоорганическое основание, такое как диизопропиламид лития, что показано следующим механизмом реакции. В патенте США '466 изменяют пропорцию смешения углеводородных растворителей,пытаясь улучшить температуру и выход реакции, но проблема, связанная с основанием, все же остается,причем диизопропиламид лития неудобен для синтеза в промышленном масштабе, поскольку он является слишком дорогим, сложным в обращении и может стать причиной возникновения пожара или взрыва. В китайской патентной публикации 1225356 (CNO1225356A) описано использование таких оснований, как метилат натрия, этилат натрия, гидрид натрия и амид натрия, для получения производных циклогексанола, чтобы повысить температуру реакции до интервала от 0 до 5 С. Однако описанные основания использовали в количествах, по меньшей мере, 1 эквивалента реагента, и, кроме того, они опасны, поскольку также склонны к возгоранию или взрыву. Приведенные выше известные способы состоят из двух стадий, то есть взаимодействия фенилацетонитрила с основанием для образования аниона и присоединения данного аниона к кетонному соединению. В частности, реакция на стадии образования аниона включает некоторые сложности в отношении конечной точки данной стадии и количественного анализа полученного аниона. Подобные проблемы приводят к колебаниям выхода на стадии присоединения, и, таким образом, по этой причине они также сложны для промышленного использования. Соответственно, настоящее изобретение направлено на способ получения производных циклогексанола, который в значительной степени преодолевает трудности и недостатки обычной области техники. Целью настоящего изобретения является предоставление способа получения производных циклогексанола путем взаимодействия фенилацетонитрила с циклогексанолом, чтобы сделать возможным экономичное и разумное промышленное массовое производство. Следующая цель настоящего изобретения заключается в предоставлении способа получения производных циклогексанола, который является безопасным и благоприятным по отношению к окружающей среде без риска пожара или взрыва и более простым, чем обычные синтезы, поскольку все реагенты смешивают в одной реакции. Одним из аспектов настоящего изобретения является способ получения производных циклогексанола формулы I-1 007486 в которой R6 и R7 представляют собой орто- или паразаместители, независимо выбранные из группы, включающей водород, гидроксил, C1-С 6 алкил, C1-C6 алкокси, С 7-С 9 аралкокси, С 2-С 7 алканоилокси, C1 С 6 алкилмеркапто, галоген или трифторметил; R8 представляет водород или C1-С 6 алкил; р является одним из целых чисел 0, 1, 2, 3 или 4; a R9 представляет водород или C1-С 6 алкил; включающий взаимодействие соединения формулы II с соединением формулы III в присутствии неметаллоорганических основных катализаторов, представленных формулой IV илиV, в присутствии или в отсутствие реакционного растворителя, где А представляет -(СН 2)n-, где n является целым числом от 2 до 4; В представляет -(СН 2)m-, где m является целым числом от 2 до 5; X является СН 2, О, NH или NR', где R' представляет C1-C4 алкил или ацил или алкилнесущий полимер; каждый из R1 до R4 независимо представляет водород, алкил, циклоалкил или алкил- или циклоалкилнесущий полимер, и все от R1 до R4 не являются водородами, R5 является алкилом, циклоалкилом или алкил- или циклоалкилнесущим полимером, и где R9 представляет алкил,причем алкильная группа вводится алкилированием. Используемое в настоящем изобретении неметаллоорганическое основание включает амидины или гуанидины, представленные формулой IV или V. Более конкретно, примеры неметаллоорганических оснований настоящего изобретения включают амидины, например 1,8-диазабицикло[5,4,0]ундец-7-ен(DBU) и 1,5-диазабицикло[4,3,0]нон-5-ен (DBN); циклические гуанидины, например 1,5,7-триазабицикло[4,4,0]дец-5-ен (TBD) и 7-метил-1,5,7-триазабицикло[4,4,0]дец-5-ен (MTBD); алкилгуанидины, например тетраметилгуанидин (TMG), тетрабутилгуанидин, пентаметилгуанидин, пентабутилгуанидин и N'бутил-N,N-дициклогексилгуанидин. Основной катализатор настоящего изобретения может являться гомогенным катализатором или может представлять собой катализатор, содержащий органическое аминное основание на основе амидина или гуанидина, иммобилизованное на полимерном носителе (например, полистироле) или неорганическом носителе (например, оксиде кремния). Неметаллоорганическое основание настоящего изобретения представляет собой по меньшей мере одно основание, выбранное из группы, состоящей из упомянутых выше оснований. Количество используемого неметаллоорганического основания специально не ограничено и может находиться в интервале от около 0,0001 до около 2 эквивалентов, а более предпочтительно от около 0,005 до около 0,5 эквивалентов относительно 1 эквивалента соединения формулы II. Реакцию настоящего изобретения можно успешно осуществить при использовании основных катализаторов лишь в каталитическом количестве, что является предпочтительным. В настоящем изобретении можно по выбору не использовать органический растворитель, включающий углеводороды или простые эфиры, которые требуются при обычном синтезе. Использовать органический растворитель или нет, оптимально решается специалистом в данной области, но обычно предпочитают не использовать органический растворитель. При получении производных циклогексанола, таких как 1-[циано(4-метоксифенил)метил]циклогексанол, представленных формулой I, в соответствии с настоящим изобретением температура реакции предпочтительно находится в интервале от около -20 до 80 С, более предпочтительно от около 10 до 30 С. Способ настоящего изобретения можно осуществлять даже при комнатной температуре, что является предпочтительным. Настоящее изобретение представляет способ получения производных циклогексанола путем взаимодействия соответствующим образом замещенного парафенилацетонитрила и циклогексанона в присутствии неметаллоорганического аминного основания (например, DBU, DBN, TBN, MTBD, TMG или В приведенной выше реакции R6-R9 и р такие, как определено выше, а где R9 является алкилом, его вводят алкилированием. При получении производных циклогексанола, таких как 1-[циано(4-метоксифенил)метил]циклогексанол, представленных формулой I, для образования аниона фенилацетонитрила используют неметаллоорганическое основание, такое как DBU, DBN, TBD, MTBD, TMG или N'-бутил-N,N-дициклогексилгуанидин, представляющее собой аминное основание, вместо металлоорганического основания, такого как н-бутиллитий или диизопропиламид лития, используемых в обычных способах. Использование неметаллоорганического основания в относительно небольшом количестве, которое сравнительно недорого, менее чувствительно к гидратации, с которым можно работать при комнатной температуре, без риска пожара или взрыва, дает возможность осуществлять производство в промышленном масштабе при помощи безопасного и относительно простого промышленного способа. Лишь каталитические количества неметаллоорганического основания требуются в настоящем изобретении, по которому получают производные циклогексанола высокой чистоты, с высоким выходом. Кроме того, настоящее изобретение является более простым и благоприятным по отношению к окружающей среде, не приводит к металлоорганическим побочным продуктам, поскольку в нем избегают использования органических растворителей. Теперь настоящее изобретение будет подробно описано со ссылкой на следующие примеры, которые не предназначены для ограничения объема настоящего изобретения. Пример 1. В колбу помещали 100 г (0,68 моль) п-метоксифенилацетонитрила, 100 г (1,02 моль) циклогексанона и 32 г (0,21 моль) 1,8-диазабицикло[5,4,0]ундец-7-ена (DBU) и выдерживали при 15-20 С при перемешивании в течение 48 ч. Затем к полученному раствору добавляли 1 н НСl для доведения рН до кислого уровня. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 140 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола(выход 84%, температура плавления 123,7 С). Анализ 1 Н ЯМР (ДMCO-d6):7,27-6,93 (4 Н, кв, ароматические), 4,85 (1 Н, с, OН), 4,05 (3 Н, с,ОСН 3), 3,76 (1H, c, CHCN), 1,69-1,08 (10 Н, м, циклогексил). Анализ 1 Н ЯМР (CDCl3):7,23-6,89 (4 Н, кв, ароматические), 3,82 (3 Н, с, ОСН 3), 3,73 (1H, c, CHCN),1,72-1,16 (10 Н, м, циклогексил). Анализ 13 С ЯМР (ДМСO-d6):159,4, 131,3, 125,8, 121,4, 114,1, 72,2, 55,8, 48,8, 36,0, 34,7, 25,9, 22,0, 21,9. Масс-спектральный анализ: молекулярная масса 245 [М+ по C.I.M.S.]. ИК (таблетка КВr): 3408 см-1 (-ОН), 2249 см-1 (-CN). Пример 2. В колбу помещали 52,7 г (0,36 моль) п-метоксифенилацетонитрила, 35,8 г (0,36 моль) циклогексанона и 28,6 г (0,19 моль) 1,8-диазабицикло[5,4,0]ундец-7-ена и выдерживали при 15-20 С при перемешивании в течение 90 ч. Затем к полученному раствору добавляли 1 н НСl для доведения рН до кислого уровня. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 62 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 70%). Пример 3. Действия осуществляли аналогично тем, как описано в примере 1, за исключением того, что использовали 0,5 эквивалента 1,8-диазабицикло[5,4,0]ундец-7-ена в 6-дневной реакции, получая 67 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола(выход 80%). Пример 4. В колбу помещали 100 г (0,68 моль) п-метоксифенилацетонитрила, 167 г (1,70 моль) циклогексанона и 52 г (0,34 моль) 1,8-диазабицикло[5,4,0]ундец-7-ена и выдерживали при 0 С при перемешивании в течение 60 ч. Затем к полученному раствору добавляли 1 н НСl для доведения рН до кислого уровня. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 147 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 88%).-3 007486 Пример 5. Действия осуществляли аналогично тем, как описано в примере 1, за исключением того, что использовали 0,5 эквивалента 1,8-диазабицикло[5,4,0]ундец-7-ена в 8-часовой реакции, получая 116 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола(выход 70%). Пример 6. В колбу помещали 25,4 г (0,17 моль) п-метоксифенилацетонитрила, 41,8 г (0,42 моль) циклогексанона и 13,2 г (0,087 моль) 1,8-диазабицикло[5,4,0]ундец-7-ена и выдерживали при 25 С при перемешивании в течение 24 ч. Затем к полученному раствору добавляли 1 н НСl для доведения рН до кислого уровня. После добавления 50 мл метилового спирта и 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 23,7 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил) метил]циклогексанола (выход 56,1%). Пример 7. В колбу помещали 50,3 г (0,34 моль) п-метоксифенилацетонитрила, 34,8 г (0,35 моль) циклогексанона и 43,3 г (0,35 моль) 1,5-диазабицикло[4,3,0]нон-5-ена (DBN) и выдерживали при 20-25 С при перемешивании в течение 90 ч. К полученному раствору добавляли 50 мл метилового спирта и 200 мл очищенной воды. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 116 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола(выход 70%). Пример 8. В колбу помещали 20 г (0,14 моль) п-метоксифенилацетонитрила, 13,7 г (0,14 моль) циклогексанона и 21,2 г (0,14 моль) 1,8-диазабицикло[5,4,0]ундец-7-ена, разбавляли 100 мл метилового спирта и выдерживали при 15-20 С при перемешивании в течение 20 ч. К полученному раствору добавляли 20 мл метилового спирта и 150 мл очищенной воды. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 17,4 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил) метил]циклогексанола (выход 52%). Пример 9. Действия осуществляли аналогично тем, как описано в примере 1, за исключением того, что использовали 0,1 эквивалента 1,8-диазабицикло[5,4,0]ундец-7-ена в 6-дневной реакции, получая 76,1 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 90,5%). Пример 10. В колбу помещали 25,4 г (0,17 моль) п-метоксифенилацетонитрила, 83,6 г (0,85 моль) циклогексанона и 26,7 г (0,17 моль) 1,8-диазабицикло[5,4,0]ундец-7-ена и выдерживали при 20-25 С при перемешивании в течение 24 ч. К полученному раствору добавляли 50 мл метилового спирта и 200 мл очищенной воды. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 18,0 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 42,6%). Пример 11. Действия осуществляли аналогично тем, как описано в примере 1, за исключением того, что температуру реакции поддерживали в интервале от 35 до 40 С, получая 30,6 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 36,8%). Пример 12. В колбу помещали 100 г (0,68 моль) п-метоксифенилацетонитрила, 100 г (1,02 моль) циклогексанона и 0,47 г (0,0034 моль) 1,5,7-триазабицикло[4,4,0]дец-5-ена (TBD) и выдерживали при 20-25 С при перемешивании в течение от 10 до 12 ч. К полученному раствору добавляли 1 н НСl для доведения рН до кислого уровня. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 128 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола(выход 77%). Пример 13. Действия осуществляли аналогично тем, как описано в примере 1, за исключением того, что использовали 0,03 эквивалента 7-метил-1,5,7-триазабицикло[4,4,0]дец-5-ена (MTBD) в 20-22-часовой реакции, получая 128 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил) метил]циклогексанола (выход 77%). Пример 14. В колбу помещали 50 г (0,34 моль) п-метоксифенилацетонитрила, 50 г (0,51 моль) циклогексанона и 0,24 г (0,0017 моль) 1,5,7-триазабицикло[4,4,0]дец-5-ена (TBD) и выдерживали при 20-25 С при перемешивании в течение 19 ч. Реакционную смесь растворяли в 500 мл этилацетата и, после добавления 200 мл-4 007486 очищенной воды, нейтрализовывали 6 н НСl. После разделения фаз при 30-35 С органический растворитель удаляли в вакууме, а к фильтрату добавляли 500 мл этилацетата и 200 мл очищенной воды. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 74 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 89%). Пример 15. В колбу помещали 25 г (0,17 моль) п-метоксифенилацетонитрила, 25 г (0,25 моль) циклогексанона и 2,5 г (0,0090 моль) N'-бутил-N,N-дициклогексилгуанидина и выдерживали при 20-25 С при перемешивании в течение 24 ч. К полученному раствору добавляли 1 н НСl для доведения рН до кислого уровня. После 1 ч перемешивания при комнатной температуре образовавшийся осадок отделяли фильтрованием и промывали очищенной водой, затем этилацетатом и н-гексаном, получая 30 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 72%). Сравнительный пример 1. 50 г (0,34 моль) п-метоксифенилацетонитрила разбавляли 250 мл сухого тетрагидрофурана (ТГФ) и охлаждали до -70 С в атмосфере азота. К полученному раствору прибавляли по каплям 210 мл (0,34 моль) н-бутиллития (n-BuLi), поддерживая температуру раствора ниже -50 С. После этого раствор перемешивали в течение 30 мин и, после добавления 50 г (0,51 моль) циклогексанона, перемешивали еще 45 мин, в то время как температуру раствора поддерживали ниже -50 С. После этого температуру реакционного раствора подняли до 0 С и добавили насыщенный раствор хлорида аммония, чтобы вызвать разделение фаз. Водный слой экстрагировали диэтиловым эфиром и объединяли с органическим слоем. Затем органический растворитель удаляли при пониженном давлении, получая 25,2 г целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 34,2%). Температура плавления: от 123 до 126 С. Масс-спектральный анализ: молекулярная масса 245 [М+ по C.I.M.S]. Анализ 1 Н ЯМР (ДМСО-dб):7,32, 6,95 (4 Н, кв, п-замещенная ароматика), 3,8 (3 Н, с, O-СН 3), 3,76(1H, с, CH-CN), 1,56 (10 Н, м, алифатический циклогексил). Сравнительный пример 2. Поддерживая внутреннюю температуру ниже 10 С, 76,5 г п-метоксифенилацетонитрила, разбавленного 75 мл толуола, медленно прибавляли к раствору диизопропиламида лития, полученного при добавлении 73 мл диизопропиламина к 325 мл 6 М BuLi и 300 мл толуола в атмосфере азота. После 30 мин перемешивания медленно прибавляли 46,0 г циклогексанона, разбавленного 50 мл толуола, поддерживая внутреннюю температуру ниже 10 С, и перемешивали еще около 30 мин. После этого полученный раствор прибавляли к 100 мл водного раствора 12 н НСl и 1 л холодной очищенной воды. После фильтрования фильтрат разбавляли хлористым метиленом и промывали очищенной водой. Заменив хлористый метилен на диизопропиловый эфир, растворитель удаляли при пониженном давлении, фильтрат охлаждали и фильтровали, получая 91,0 г белого твердого вещества в качестве целевого соединения, 1-[циано(4-метоксифенил)метил]циклогексанола (выход 79%). Ссылочный пример. 12 г (0,05 моль) 1-[циано(4-метоксифенил)метил]циклогексанола, полученного в примере 1, растворяли в 250 мл смеси аммиака и этанола при соотношении смешения 2:8 (об/об) и добавляли 2,8 г 5%-ного родия на оксиде алюминия, чтобы вызвать реакцию гидрирования. Катализатор отфильтровывали и промывали этанолом, фильтрат концентрировали при пониженном давлении, получая соединение в виде масла, которое затем разбавляли 100 мл толуола и подкисляли до рН 2. После фильтрования получали 9 г белого твердого вещества в качестве целевого соединения, 1-[2-амино-1-(4-метоксифенил)этил]циклогексанола (выход 57%). Температура плавления: от 168 до 172 С. Масс-спектральный анализ: молекулярная масса 250 [М+ по C.I.M.S]. Анализ 1 Н ЯМР (ДMCO-d6):7,85 (3H, c, NH3+), 3,75 (3 Н, с, O-СН 3), 3,20 (3 Н, м, СНСН 2), 1,35(10 Н, м, алифатический циклогексил). Как описано выше, в настоящем изобретении представлен безопасный и относительно простой способ производства в промышленном масштабе производных циклогексанола, таких как 1-[циано(4 метоксифенил)метил]циклогексанол, согласно формуле I. Настоящее изобретение применяет действительно недорогое, неметаллоорганическое основание в небольших количествах, которое является благоприятным по отношению к окружающей среде и позволяет избежать использования органических растворителей, для получения 1-[циано(4-метоксифенил)метил]циклогексанола высокой чистоты с высоким выходом. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения производных циклогексанола формулы I в которой R6 и R7 представляют собой орто- или паразаместители, независимо выбранные из группы, состоящей из водорода, гидроксила, C1-С 6 алкила, C1-С 6 алкокси, С 7-С 9 аралкокси, С 2-С 7 алканоилокси,C1-С 6 алкилмеркапто, галогена или трифторметила; R8 представляет водород или C1-С 6 алкил; р является одним из целых чисел 0, 1, 2, 3 или 4; a R9 представляет водород или C1-С 6 алкил; включающий взаимодействие соединения формулы II с соединением формулы III в присутствии неметаллоорганических основных катализаторов, представленных формулой IV или в которой А представляет -(СН 2)n-, где n является целым числом от 2 до 4; В представляет -(СН 2)m-,где m является целым числом от 2 до 5; X представляет СН 2, NH или NR', где R' представляет С 1-С 4 алкил или ацил; каждый из R1-R4 независимо представляет водород, С 1-С 4 алкил, циклогексилалкил или С 1 С 4 алкил- или циклогексилалкилнесущий полимер, и все от R1 до R4 не являются водородом, a R5 является С 1-С 4 алкилом, циклогексилалкилом или С 1-С 4 алкил- или циклогексилалкилнесущим полимером, и где R9 представляет С 1-С 6 алкил, причем алкильную группу вводят алкилированием. 2. Способ по п.1, в котором соединение формулы II представляет собой пметоксифенилацетонитрил. 3. Способ по п.1, в котором соединение формулы III представляет собой циклогексанон. 4. Способ по любому из пп.1-3, в котором неметаллоорганический основный катализатор является смесью катализаторов, выбранных из одного или более амидинов или гуанидинов формулы (IV) или (V). 5. Способ по любому из пп.1-4, в котором основный катализатор является либо гомогенным, либо иммобилизованным на полимерном носителе. 6. Способ по любому из пп.1-5, в котором неметаллоорганическое основание выбирают из группы,состоящей из 1,8-диазабицикло[5,4,0]ундец-7-ена (DBU), 1,5-диазабицикло[4,3,0]нон-5-ена (DBN), 1,5,7 триазабицикло[4,4,0]дец-5-ена (TBD), 7-метил-1,5,7-триазабицикло[4,4,0]дец-5-ена (MTBD), тетраметилгуанидина (TMG) и N'-бутил-N,N-дициклогексилгуанидина. 7. Способ по любому из пп.1-6, в котором количество используемого неметаллоорганического основания находится в интервале от около 0,005 до около 0,5 эквивалентов относительно 1 эквивалента соединения формулы II. 8. Способ по любому из пп.1-7, в котором не используют растворитель. 9. Способ по любому из пп.1-8, в котором температура реакции находится в интервале от около -20 до 80 С. 10. Способ по п.9, в котором температура реакции находится в интервале от около 10 до 30 С. 11. Способ по любому из пп.1-10, в котором соединения формул II и III и основные катализаторы используют в эквивалентных соотношениях 1:11,5:0,0050,5. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07C 253/30
Метки: способ, получения, производных, циклогексанола
Код ссылки
<a href="https://eas.patents.su/7-7486-sposob-polucheniya-proizvodnyh-ciklogeksanola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных циклогексанола</a>
Предыдущий патент: Производные ксантина, способ их получения, фармацевтическая композиция на их основе и способ ее получения
Следующий патент: Способ получения глюкозаминового соединения
Случайный патент: Катионные виросомы в качестве системы для переноса генетического материала











