Способ получения производных 4-броманилина
Номер патента: 6293
Опубликовано: 27.10.2005
Авторы: Кайл Михаэль, Гебхардт Йоахим, Лохтман Рене, Ракк Михаель, Фон Дейн Вольфганг
Формула / Реферат
1. Способ получения производных 4-броманилина формулы I
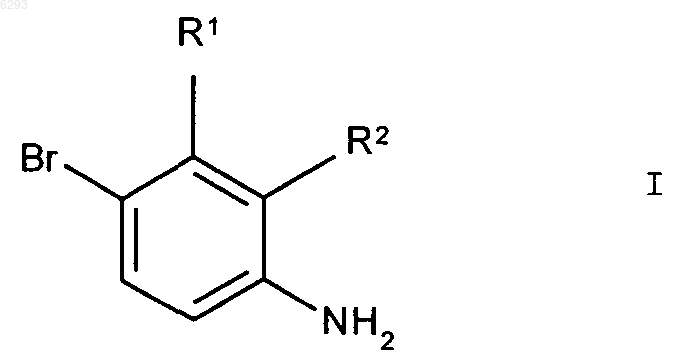
где заместители имеют следующее значение:
R1 означает C1-C6алкил, C1-C6галогеналкил, C1-C6алкокси, C1-C6галогеналкокси, C3-C8циклоалкил, галоген,
R2 означает C1-C6алкил, C1-C6алкокси, C3-C8циклоалкил, C2-C6алкенил, циано или гетероциклический остаток,
отличающийся тем, что соединение формулы II
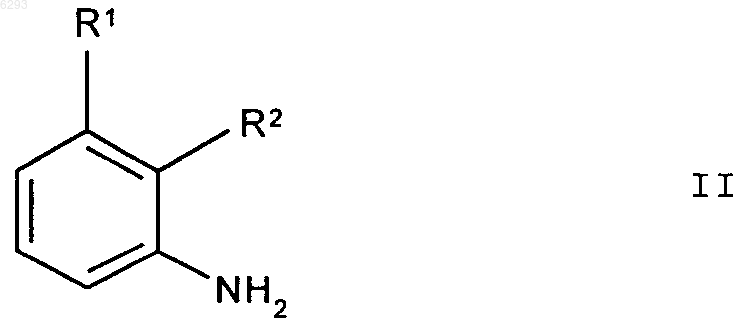
в котором R1 и R2 имеют вышеприведенное значение, подвергают взаимодействию с бромирующим агентом в пиридине в качестве растворителя или в смеси растворителей по меньшей мере с 55 мас.% пиридина.
2. Способ по п.1, отличающийся тем, что в качестве бромирующего агента применяют бром.
3. Способ по п.1, отличающийся тем, что в качестве бромирующего агента применяют бромид водорода.
4. Способ по пп.1-3, отличающийся тем, что в качестве растворителя применяют пиридин.
5. Способ по одному из пп.1-4, при котором R1 означает C1-C6алкил.
6. Способ по п.5, при котором R1 означает метил или этил.
7. Способ по одному из пп.1-6, при котором R2 означает гетероциклическое кольцо.
8. Способ по п.7, при котором R2 означает изоксазоловое, изоксазолиновое или изоксазолидиновое кольцо.
9. Способ по п.8, при котором R2 означает 4,5-дигидроизоксазол-3-ил или 4,5-дигидроизоксазол-5-ил.
10. Способ по одному из пп.1-8 для получения 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина.
Текст
006293 Изобретение относится к способу получения производных 4-броманилина. Производные 4-броманилина являются ценными соединениями, которые применяются в качестве промежуточных продуктов в химической промышленности. Они пригодны, например, для получения действующих веществ, которые используются в области защиты растений или для получения фармацевтических действующих веществ. В публикации WO 99/58509 описывается, например, способ получения изоксалин-3-илацилбензолов, в которых производные 4-броманилина применяются в качестве промежуточных продуктов для получения гербицидных действующих веществ. В публикации WO 98/31681 такие действующие вещества (2-алкил-3-(4,5-дигидроизоксазол-3-ил)-ацилбензолы) приводятся в качестве гербицидных действующих веществ. Из литературных источников известно, что селективное бромирование анилинов в пара-положении невозможно или возможно только с большими трудностями (см. публикацию Houben-Weyl 5/4, стр. 241,274 и далее). Бромирование элементарным бромом происходит, как правило, не селективно, а часто связано с образованием значительного количества дибромзамещенных соединений. Селективность монобромзамещенных соединений к дибромзамещенным соединениям составляет порядка 9:1, т.е. доля нежелательных дибромзамещенных соединений составляет около 10%. Только с помощью очень дорогих реагентов, таких, как например, тетрабутиламмонийтрибромид, получают, например, при -30 С соединение 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилин с выходом прибл. 50% (ср. публикацию WO 99/58509). Задачей изобретения является разработка альтернативного способа получения производных 4 броманилина. Описанный в публикации WO 99/58509 способ получения 4-бром-2-(4,5 дигидроизоксазол-3-ил)-3-метиланилина не дает удовлетворительного выхода продукта и не обеспечивает удовлетворительную чистоту продукта. Поэтому описанный в WO 99/58509 способ не пригоден для получения подобных соединений в крупных промышленных масштабах. Объектом изобретения является способ получения производных 4-броманилина формулы I где заместители имеют следующее значение:R1 означает C1-С 6 алкил, С 1-С 6 галогеналкил, C1-С 6 алкокси, C1-C6-галогеналкокси, С 3-С 8 циклоалкил,галоген,R2 означает С 1-С 6 алкил, C1-С 6 алкокси, С 3-С 8-циклоалкил, С 2-С 6 алкенил, циано или гетероциклический остаток,отличающийся тем, что соединение формулы II в котором R1 и R2 имеют вышеприведенное значение, подвергают взаимодействию с бромирующим агентом в пиридине в качестве растворителя или в смеси растворителей по меньшей мере с 55 мас.% пиридина. С помощью заявляемого способа можно получать производные анилина формулы I с более высоким выходом продукта, чем это имеет место при известных до сих пор способах. Так например, при описанном в WO 99/58509 способе (ср. приведенный в нем пример 10) соединение 4-бром-2-(4,5 дигидроизоксазол-3-ил)-3-метиланилина получают только с 47%-ым выходом, в то время как согласно заявляемому способу выход составляет по меньшей мере 60%, предпочтительно по меньшей мере 70%,соответственно 80%, и особенно предпочтительно по меньшей мере 90%. Кроме того, соединения формулы 1 получают с более высокой чистотой. Бромирование производится при этом с высокой селективностью в 4-положении фенильного кольца. Селективность (соотношение моно- к дизамещенному соединению) составляет по меньшей мере 92:8, в частности, по меньшей мере 95:5. Неожиданным образом доля загрязнений, например, дибромидов (при этих бромидах речь идет о производных формулы I, которые в 5- или 6-положении замещены еще одним атомом брома), которые с трудом отделимы от возникающей реакционной смеси, соответственно требуют для этого относительно высоких технических затрат, составляет ниже 5%. Число других дополнительных стадий очистки для выделения и обработки полученных способом по изобретению соединений формулы I может вследствие этого снижаться. Это имеет преимущество, в частности, тогда, когда соединения формулы I получают в крупных технических масштабах, так как за счет этого может обеспечиваться эффективный и экономичный способ.-1 006293 Вследствие высокой селективности и малой доли диброзамещенных соединений продукт реакции может передаваться без дополнительной очистки на последующие стадии взаимодействия для получения пригодных конечных продуктов. При этом C1-С 6 алкил означает разветвленную или неразветвленную алкильную группу с 1 - 6 атомов углерода, как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил или н-гексил; предпочтительно С 1-С 4-алкил, как например, метил, этил, н-пропил, изопропил, н-бутил,изобутил или трет-бутил.C1-С 6-галогеналкил означает разветвленную или неразветвленную C1-C6-алкильную группу, приведенную выше, которая частично или полностью замещена фтором, хлором, бромом и/или йдом, например, хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил,дихлорфторметил, хлордифторметил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-йодэтил, 2,2-дифторэтил,2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2,-дифторэтил, 2,2-дихлоро-2-фторэтил, 2,2,2 трихлорэтил, пентафторэтил, 2-фторпропил, 3-фторпропил, 2,2-дифторпропил, 2,3-дифторпропил, 2 хлорпропил, 3-хлорпропил, 2,3-дихлорпропил, 2-бромпропил, 3-бромпропил, 3,3,3-трифторпропил, 3,3,3 трихлорпропил, 2,2,3,3,3-пентафторпропил, гептафторпропил, 1-(фторметил)-2-фторэтил, 1-(хлорметил)2-хлорэтил, 1-(бромметил)-2-бромэтил, 4-фторбутил, 4-хлорбутил, 4-бромбутил, нонафторбутил, 5 фторпентил, 5-хлорпентил, 5-бромпентил, 5-йодпентил, ундекафторпентил, 6-фторгексил, 6-хлоргексил,6-бромгексил, 6-йодгексил или додекафторгексил; предпочтительным является C1-C4-гелогеналкил, такой как хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-йодэтил, 2,2 дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2,-дифторэтил, 2,2-дихлор-2-фторэтил,2,2,2-трихлорэтил, пентафторэтил, 2-фторпропил, 3-фторпропил, 2,2-дифторпропил, 2,3-дифторпропил,2-хлорпропил, 3-хлорпропил, 2,3-дихлорпропил, 2-бромпропил, 3-бромпропил, 3,3,3-трифторпропил,3,3,3-трихлорпропил, 2,2,3,3,3-пентафторпропил, гептафторпропил, 1-(фторметил)-2-фторэтил, 1(хлорметил)-2-хлорэтил, 1-(бромметил)-2-бромэтил, 4-фторбутил, 4-хлорбутил, 4-бромбутил или нона-фторбутил;C1-C6-алкокси означает разветвленную или неразветвленную алкил-O-группу, содержащую 1-6 атомов углерода, такую, как например, метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси,изобутилокси, трет-бутилокси, н-пентилокси или н-гексилокси; предпочтительным является С 1-С 4 алкокси, такой как, например, метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси или трет-бутилокси;C1-С 6-галогеналкокси означает разветвленную или неразветвленную C1-C6-алкокси-группу, приведенную выше, которая частично или полностью замещена фтором, хлором, бромом и/или йодом, как например, фторметокси, дифторметокси, трифторметокси, хлордифторметокси, бромдифторметокси, 2 фторэтокси, 2-хлорэтокси, 2-бромметокси, 2-йодэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 2-хлор 2-фтороэтокси, 2-хлор-2,2,-дифторэтокси, 2,2-дихлоро-2-фтороэтокси, 2,2,2-трихлорэтокси, пентафторэтокси, 2-фторпропокси, 3-фторпропокси, 2-хлорпропокси, 3-хлорпропокси, 2-бромпропокси, 3 бромпропокси, 2,2-дифторпропокси, 2,3-дифторпропокси, 2,3-дихлорпропокси, 3,3,3-трифторпропокси,3,3,3-трихлорпропокси, 2,2,3,3-пентафторпропокси, гептафторпропокси, 1-(фторметил)-2-фторэтокси, 1(хлорметил)-2-хлорэтокси, 1-(бромметил)-2-бромэтокси, 4-фторбутокси, 4-хлорбутокси, 4-бромбутокси,нонафторбутокси, 5-фторпентокси, 5-хлорпентокси, 5-бромпентокси, 5-йодпентокси, ундекафторпентокси, 6-фторгексокси, 6-хлоргексиокси, 6-бромгексокси, 6-йодгексокси или додекафторгексокси; предпочтителен C1-C4-гелогеналкокси, как например фторметокси, дифторметокси, трифторметокси, хлородифторметокси, бромодифторметокси, 2-фтороэтокси, 2-хлорэтокси, 2-бромметокси, 2-йодэтокси, 2,2 дифторэтокси, 2,2,2-трифторэтокси, 2-хлор-2-фторэтокси, 2-хлоро-2,2,дифторэтокси, 2,2-дихлор-2 фторэтокси, 2,2,2-трихлорэтокси, пентафторэтокси, 2-фторпропокси, 3-фторпропокси, 2-хлорпропокси,3-хлорпропокси, 2-бромпропокси, 3-бромпропокси, 2,2-дифторпропокси, 2,3-дифторпропокси, 2,3 дихлорпропокси, 3,3,3-трифторпропокси, 3,3,3-трихлорпропокси, 2,2,3,3-пентафторпропокси, гептафторпропокси, 1-(фторметил)-2-фторэтокси, 1-(хлорметил)-2-хлорэтокси, 1-(бромметил)-2-бромэтокси, 4 фторбутокси, 4-хлорбутокси, 4-бромбутокси или нонафторбутокси; С 3-С 8-циклоалкил означает разветвленный или неразветвленный циклоалкильный цикл с 3-8 атомами углерода, как например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил. В качестве заместителей пригодны, например, C1-С 6 алкил, C1-С 6 алкокси или галоген; предпочтительным является незамещенный С 3-С 6 циклоалкил, как например циклопропил, циклопентил или циклогексил; С 2-С 6-алкенил означает разветвленную или неразветвленную алкенильную группу с 2-6 атомами углерода в цепи, причем двойные связи находятся в положении соединения, как например этенил, проп 1-ен-1-ил, 1-метилэтенил, бутен-1-ил, 1-метилпроп-1-ен-1-ил, 2-метилпроп-1-ен-1-ил, пентен-1-ил, 1 метил-бут-1-ен-1-ил, 2-метил-бут-1-ен-1-ил, 3-метил-бут-1-ен-1-ил, 1,2-диметил-проп-1-ен-1-ил, гекс-1 ен-1-ил, 1-метилпент-1-ен-1-ил, 2-метилпент-1-ен-1-ил, 3-метилпент-1-ен-ил, 4-метилпент-1-ен-1-ил, 1,2 диметилбут-1-ен-1-ил, 1,3-ил, 2,3-диметилбут-1-ен-1-ил, 3,3-диметилбут-1-ен-1-ил, 1-этилбут-1-ен-1-ил,2-этилбут-1-ен-1-ил или 1-этил-2-метилпроп-1-ен-1-ил;"Гетероциклическое кольцо" означает насыщенный, ненасыщенный или частично ненасыщенный гетороцикл с 3-8 кольцевыми атомами и одним, двумя или тремя атомами кислорода, серы или азота. Предпочтительными являются гетероциклы, которые содержат по меньшей мере один атом кислорода и/или атом азота. Далее предпочтительны гетероциклы с 5 или 6 кольцевыми атомами. Соединение гетероцикла с фенильным кольцом может осуществляться в любом месте гетероцикла, например, через гетероциклический N- атом цикла или С-атом цикла. Гетероциклы являются незамещенными или моно-, диили тризамещенными. В качестве заместителей пригодны такие, которые при выбранных условиях реакции являются химически инертными, например такие, как C1-С 6 алкил, C1-С 6 алкокси или галоген. В качестве гетероциклических колец пригодны согласно изобретению следующие гетероциклы: пирроллил,пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиперидинил, морфолинил, оксазинил, изоксазолинил, изоксазолидинил и т.п. Предпочтение отдается при этом следующим гетероциклам: изоксазолилу, изоксазолинилу или изоксазолидинилу, в частности, 4,5-дигидроизоксазол-3-илу или 4,5-дигидроизоксазол-5-илу. Способ по изобретению пригоден предпочтительно для получения соединений формулы I, где заместители имеют следующее значение:R2 C1-С 6 алкил, C1-С 6 алкокси, С 3-С 8 циклоалкил, циано или гетероциклический остаток. Заявляемый способ пригоден предпочтительно для получения следующих соединений формулы I: 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилин,4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-этиланилин,4-бром-2-(4,5-дигидроизоксазол-3-ил-)3-метоксианилин,4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-этоксианилин,4-бром-2-(3-метил-4,5-дигидроизоксазол-5-ил)-3-метиланилин,4-бром-2-(3-метил-4,5-дигидроизоксазол-5-ил)-3-этиланилин,4-бром-2-(3-метил-4,5-дигидроизоксазол-5-ил-)3-метоксианилин,4-бром-2-(3-метил-4,5-дигидроизоксазол-5-ил)-3-этоксианилин,4-бром-2-(изоксазол-3-ил)-3-метиланилин,4-бром-2-(изоксазол-3-ил)-3-этиланилин,4-бром-2-(изоксазол-3-ил-)3-метоксианилин,4-бром-2-(изоксазол-3-ил)-3-этоксианилин,4-бром-2-(5-метилизоксазол-3-ил)-3-метиланилин,4-бром-2-(5-метилизоксазол-3-ил)-3-этиланилин,4-бром-2-(5-метилизоксазол-3-ил-)3-метоксианилин,4-бром-2-(5-метилизоксазол-3-ил)-3-этоксианилин,4-бром-2-циано-3-метиланилин,4-бром-2-циано-3-метоксианилин. Взаимодействие соединений формулы II с бромирующим агентом происходит предпочтительно согласно следующим стадиям способа: Реакция взаимодействия происходит согласно изобретению в пиридине в качестве растворителя или в смеси растворителей с долей пиридина по меньшей мере в 55 мас.%, предпочтительно в 80 мас.%. При смесях растворителей в качестве дополнительных растворителей пригодны смеси с пиридином, например спирты, такие как метанол или этанол, в частности, метанол; сложные эфиры, такие как этилацетат или бутиолацетат, в частности, сложный этиловый эфир уксусной кислоты или бутилацетат; амиды,такие, как например, N,N-диметилформамид или N,N-диметилацетамид или вода. Сначала берут соединение формулы II в пиридине или смеси раствора, содержащего пиридин в качестве раствора или суспензии. В заключение добавляют бромирующий агент в течение от 5 мин до 5 ч. Добавку бромирующего агента осуществляют или непосредственно, т.е. без растворителя или вместе с подходящим растворителем. В качестве бромирующего агента пригодны предпочтительно элементарный бром или смесь НВr и перекиси водорода. В случае брома добавку осуществляют вместе с подходящим растворителем, таким как пиридин с образованием пербромида пиридина. В этом случае достигают особенно высокой селективности соотношения монобромзамещенного соединения к дибромзамещенному соединению. В предпочтительной форме выполнения способа бромирующий агент и соединение формулы II применяют в молярном соотношении от 1:1 до 2:1. Предпочтительно бромирующий агент применяют в эквимолярном количестве или в небольшом избытке. Реакция взаимодействия осуществляется при температуре от 20 С до температуры кипения растворителя, предпочтительно в диапазоне от 60 и 85 С. При еще одной форме выполнения способа работают при температурах от 50 до 100 С, предпочтительно в диапазоне между 80 и 100 С. В частности, предпочитают температуру около 100 С.-3 006293 Время реакции составляет 1-24 ч, предпочтительно 2-12 ч, в частности, 5-8 ч. При еще одной форме выполнения способа время реакции составляет от 30 мин до 10 ч, предпочтительно от 30 мин до 5 ч. В том случае, если смесь НВr перекиси водорода применяется в качестве бромирующего агента,добавку бромирующего агента к раствору соединения формулы II осуществляют в промежуток времени предпочтительно от 10 мин и до 3 ч. Молярное соотношение HBr к соединению формулы II составляет предпочтительно от 1:1 до 1,5:1. Добавку производят при температуре от 0-50 С, предпочтительно между 20-40 С. После этого осуществляют добавку перекиси водорода. Молярное соотношение Н 2 О 2 к НВr составляет 1:1 до 1,5:1. Добавку проводят при температуре от 10 С до точки кипения растворителя,предпочтительно между 50 и 120 С, особенно предпочтительно, между 80 и 100 С, в частности, при прибл. 100 С; при другой форме выполнения способа добавку осуществляют предпочтительно между 60 и 85 С. После этого раствор перемешивают в течение от 10 мин до 36 ч, предпочтительно, от 10 мин до 8 ч. При еще одной форме выполнения способа раствор перемешивают в промежуток времени 1-36 ч,предпочтительно 2-8 ч. При другой форме выполнения раствор перемешивают в промежутке времени от 10 мин до 3 ч, предпочтительно от 10 мин до 2 ч. Затем проводят переработку и очистку продукта. Для этого раствор концентрируют. Сырой продукт растворяют в подходящем растворителе, предпочтительно, в пиридине или смеси, содержащей по меньшей мере 50% пиридина и смешивают с водой. После фильтрации и промывания остатка, соответственно, кристаллизации с применением подходящего растворителя (например, воды) получают продукт с хорошим выходом и высокой чистотой. Однако возможна загрузка сырого продукта в диметилсульфид и промывание водой и/или натровым щелоком. Органический раствор можно тогда применять в последующей реакции. При одной предпочтительной форме выполнения способа соединение формулы II подают в пиридине или в смеси пиридина с водой. В последнем случае соотношение пиридина к воде составляет от 80 до 98 мас.% к от 20 до 5 мас.%; предпочтительно в пределах от 90 до 95 мас.% к от 10 до 5 мас.%. Соотношение соединения формулы II к пиридину, соответственно пиридину/воде выбирают таким образом, что получается от 5 до 25%-ый раствор, предпочтительно от 10 до 15%-ый раствор. К результирующемуся раствору добавляют прибл. от 0,8 до 1,1 мол. эквивалентов, предпочтительно от 0,9 до 1,0 мол. эквивалента HBr. После удаления воды азеотропной отгонкой к оставшемуся раствору добавляют в промежуток времени от 1 до 3 ч, предпочтительно от 1,5 до 2,5 ч при 50 до 120 С, предпочтительно при 80 до 110 С, в частности, при прибл. 100 С перекись водорода. Перекись водорода обычно применяют в 20%-ом до 50%-го, предпочтительно в 30%-ом до 50%-ом водном растворе. После этого реакционную смесь перемешивают прибл. от 10 мин до 2 ч, предпочтительно от 30 мин до 1 ч. Затем следует переработка продукта. Для этого реакционный раствор охлаждают до комнатной температуры, в случае необходимости, промывают водным раствором сульфита натрия и концентрируют органическую фазу. Полученный таким образом продукт может применяться без дальнейшей очистки в последующих реакциях. Однако остаток можно загружать в диметилдисульфид, промывать полученный раствор водой или натровым щелоком и применять результирующуюся органическую фазу в последующих реакциях. При еще одной форме выполнения изобретения возможно то, что пиридин, который в случае необходимости содержит до 10% воды, смешивать с HBr и после этого воду удалять азеотропно. В реакционной смеси тогда растворяют соединение формулы II и прикапывают к ней перекись водорода. Как молярные соотношения примененных веществ, так и время реакции и температура реакции соответствуют вышеприведенным условиям. При еще одной форме выполнения имеется также возможность применять вместо пиридина и HBr пиридинийгидробромид. В том случае, если в качестве бромирующего агента применяется элементарный бром, добавку бромирующего агента к раствору соединения формулы II осуществляют по порциям или непрерывно в промежуток времени от прибл. 30 мин до 6 ч. Молекулярное соотношение брома к соединению формулыII предпочтительно составляет от 1:1 до 1,5:1. Добавка проводится при температуре 0-50 С, предпочтительно при комнатной температуре. После этого реакционную смесь перемешивают в течение промежутка времени 1-24 ч, предпочтительно 2-8 ч. Затем производят переработку и очистку продукта. Для этого раствор концентрируют. Сырой продукт растворяют в подходящем растворителе, например пиридине или смеси растворителя, содержащей по меньшей мере 50% пиридина, и смешивают с водой. После фильтрации и промывания остатка, соответственно, кристаллизации при применении пригодного растворителя, (например, воды), продукт получают с хорошим выходом и высокой чистотой. Продукт может быть также получен экстракцией из реакционного раствора. Для этого реакционный раствор сначала концентрируют и остаток загружают в подходящий растворитель или смесь растворителя, причем компоненты смеси выбирают, например, из группы, включающей воду, этилацетат и диметилдисульфид, в частности, воду, этилацетат, воду/этилацетат или воду/диметилдисульфид. Для экстракции пригодны несмешиваемые с водой растворители или соответствующие смеси, как например, этилацетат, бутилацетат, толуол или метил-трет-бутиловый эфир. После концентрации раствора получают продукт с хорошим выходом и высокой чистотой.-4 006293 Очистку сырого продукта осуществляют или промывкой полученного остатка или кристаллизацией. Для промывки пригодны, например, вода или водные растворители. Для перекристаллизации пригодны, например, толуол или бензол. В основном полученный продукт может без дальнейшей переработки реакционного раствора применяться для последующих стадий реакции в рамках дальнейшего превращения с получением действующих веществ. Реакционный раствор, содержащий соединение формулы I может для этого быть разбавлен другим растворителем и применяться таким образом в качестве сырого раствора для следующей стадии способа. Альтернативно к этому реакционный раствор может концентрироваться и полученный остаток может переводиться на следующую стадию непосредственно или в качестве расплава. Применяемые в качестве исходных веществ соединения формулы II известны из литературных источников. Так например, они могут быть получены известными способами, подробно описываемыми,как например, в публикациях WO 98/31681 или WO 99/58509. Нижеследующие примеры выполнения более подробно поясняют заявляемое изобретение. Пример 1. 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилин бромирующий агент: HBr/Н 2O2 Подают 100,5 г 2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина в 2000 г пиридина и прикапывают 98,2 г HBr при 20-35 С. При температуре 78-84 С прикапывают 64,6 г перекиси водорода в течение 0,5 ч. Реакционную смесь перемешивают затем в течение 12 ч при 25 С. После этого реакционную смесь концентрируют до получения масляного остатка. Сырой продукт растворяют в 100 мл пиридина при 50 С и смешивают с водой в количестве 1000 мл. После перемешивания в течение 1 ч при 0 С реакционную смесь отфильтровывают, два раза промывают в 200 мл воды и сушат. Получают 141 г (выход составляет 92%) желтого твердого вещества (ВСЖХ: 94,6% 4-бром-2-(4,5 дигидроизоксазол-3-ил)-3-метиланилина, 1,8% 6-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина,3,4% 4,6-дибром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина). Пример 2. 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилин бромирующий агент: бром Подают 100 г 2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина в 1000 г пиридина и в течение 3 ч прикапывают раствор из в общей сложности 96,19 г брома в 1000 г пиридина при 20 С в пять свежеполученных порций. Затем реакционную смесь перемешивают еще 12 ч. Пиридин отгоняют при 150 мбар и при температуре ванны 75 С остаток растворяют в 2 л воды и несколько раз экстрагируют с помощью 250 мл этилацетат. После концентрации получают 122,1 г продукта (выход составляет 81,6%; ГХ: 93,2% 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина, 2,7% 6-бром-2-(4,5-дигидроизоксазол-3-ил)-3 метиланилина, 4,1% 4,6-дибром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина). Пример 3. 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилин бромирующий агент: бром 5 г соединения 2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина подают в 50 г пиридина и при 20 С прикапывают в течение 5 ч раствор из 4,89 г брома в 50 г пиридина (смесь получают при 0 С). Затем перемешивают еще 12 ч при 25 С. Реакционную смесь выливают в 250 мл воды и три раза экстрагируют с помощью каждый раз по 100 мл метил-трет-бутилового эфира. Собранные органические фазы промывают два раза водой каждый раз в количестве 100 мл, сушат над сульфатом натрия и концентрируют. Получают 6,0 г продукта (выход 79,8%; 94,3% 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3 метиланилина, 1,8% 6-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина, 3,5% 4,6-дибром-2-(4,5 дигидроизоксазол-3-ил)-3-метиланилина). Пример 4. 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3-метиланилин бромирующий агент: HBr, Н 2O2 500,0 г 2-(4,5-дигидроизоксазол-3-ил)-3-метиланилина подают в 4500 г пиридина и прикапывают 467,4 г 47%-го HBr при 25-35 С. При температуре кипения с обратным холодильником воду азеотропно удаляют при нормальном давлении. После этого прикапывают при 100 С 199,2 г 50%-ой Н 2O2 в течение 2 ч. После перемешивания в течение 1 ч реакционную смесь охлаждают до комнатной температуры,промывают раствором сульфита натрия и растворитель отгоняют (Т 100 С). Остаток загружают в 3220 г диметилсульфида и при 60 С промывают с помощью 1500 г воды. Результирующийся раствор применяют в последующей реакции. Получают прибл. 83% целевого продукта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения производных 4-броманилина формулы I где заместители имеют следующее значение:R2 означает C1-С 6 алкил, C1-С 6 алкокси, С 3-С 8 циклоалкил, С 2-С 6 алкенил, циано или гетероциклический остаток,отличающийся тем, что соединение формулы II в котором R1 и R2 имеют вышеприведенное значение, подвергают взаимодействию с бромирующим агентом в пиридине в качестве растворителя или в смеси растворителей по меньшей мере с 55 мас.% пиридина. 2. Способ по п.1, отличающийся тем, что в качестве бромирующего агента применяют бром. 3. Способ по п.1, отличающийся тем, что в качестве бромирующего агента применяют бромид водорода. 4. Способ по пп.1-3, отличающийся тем, что в качестве растворителя применяют пиридин. 5. Способ по одному из пп.1-4, при котором R1 означает C1-C6 алкил. 6. Способ по п.5, при котором R1 означает метил или этил. 7. Способ по одному из пп.1-6, при котором R2 означает гетероциклическое кольцо. 8. Способ по п.7, при котором R2 означает изоксазоловое, изоксазолиновое или изоксазолидиновое кольцо. 9. Способ по п.8, при котором R2 означает 4,5-дигидроизоксазол-3-ил или 4,5-дигидроизоксазол-5 ил. 10. Способ по одному из пп.1-8 для получения 4-бром-2-(4,5-дигидроизоксазол-3-ил)-3 метиланилина.
МПК / Метки
МПК: C07C 251/48, C07D 261/04
Метки: получения, производных, способ, 4-броманилина
Код ссылки
<a href="https://eas.patents.su/7-6293-sposob-polucheniya-proizvodnyh-4-bromanilina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных 4-броманилина</a>
Предыдущий патент: Фунгицидная смесь
Следующий патент: Применение комбинации целекоксиба и гемцитабина в комбинированном способе лечебного воздействия при лечении рака поджелудочной железы
Случайный патент: Электрическая цепь электролизера и способ снижения электромагнитных полей вблизи электролизера











