Улучшенный способ получения промежуточного соединения для синтеза рилпивирина
Номер патента: 24409
Опубликовано: 30.09.2016
Авторы: Бадхе Сачин Аравинд, Гурджар Мукунд Кешав, Майкап Голакчандра Сударшан, Джоши Шашикант Гангарам, Мехта Самит Сатиш
Формула / Реферат
1. Способ получения гидрохлорида (Е)-4-(2-цианоэтенил)-2,6-диметилфениламина формулы (II)
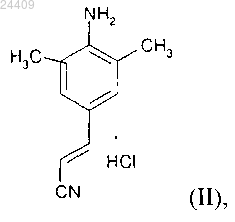
включающий взаимодействие 2,6-диметил-4-амино-1-карбоксибензилфениламина формулы (V)
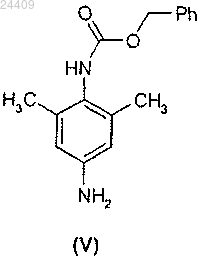
с нитритом натрия в соляной кислоте с последующей обработкой образующегося диазотизированного соединения тетрафторборатом щелочного металла, с получением соответствующей тетрафторборатной соли формулы (VI)
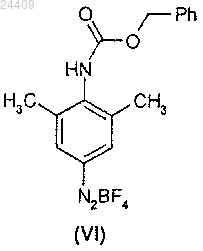
взаимодействие соединения формулы (VI) с акрилонитрилом в присутствии ацетата палладия и растворителя с образованием соединения формулы (VII)
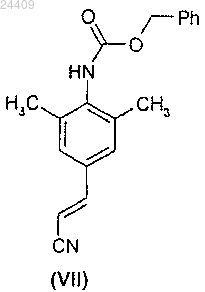
которое после удаления защитной группы с помощью органической кислоты и последующей обработки соляной кислотой дает соединение формулы (II), имеющее менее чем 0,5% Z-изомера.
2. Способ по п.1, в котором растворитель выбирают из группы, включающей метанол, этанол, изопропанол, диметилформамид, диметилацетамид и тетрагидрофуран.
3. Способ по п.1, в котором органическая кислота представляет собой трифторуксусную кислоту.
4. Способ по п.1, в котором тетрафторборат щелочного металла выбирают из группы, включающей тетрафторборат натрия и тетрафторборат калия.
5. Способ по п.1, в котором соединение формулы (V)
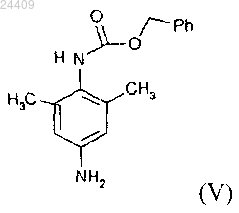
получают способом, включающим взаимодействие 2,6-диметил-4-нитроанилина формулы (III)
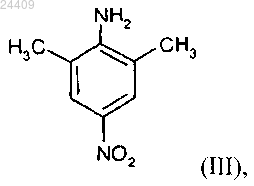
с бензилхлорформиатом с образованием соединения формулы (IV)
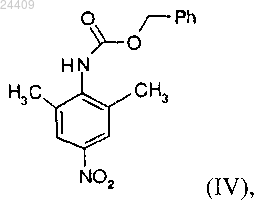
и последующим восстановлением соединения формулы (IV) хлоридом олова.
Текст
УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ ДЛЯ СИНТЕЗА РИЛПИВИРИНА Изобретение относится к получению ключевого промежуточного соединения для рилпивирина,а именно гидрохлорида (Е)-4-(2-цианоэтенил)-2,6-диметилфениламина (II), способом,включающим взаимодействие соли тетрафторбората иона диазония 2,6-диметил-4-амино-1 карбоксибензилфениламина (VI) с акрилонитрилом в присутствии ацетата палладия с последующей обработкой кислотой и его последующую конверсию в соль гидрохлорид (II), при этом нежелательного изомера Z имеется менее 0,5%, который дает гидрохлорид рилпивирина,имеющий менее 0,1% изомера Z. Гурджар Мукунд Кешав, Майкап Голакчандра Сударшан, Джоши Шашикант Гангарам, Бадхе Сачин Аравинд, Мехта Самит Сатиш (IN) Трошина Л.Ю. (RU)(71)(73) Заявитель и патентовладелец: ЭМКЬЮАР ФАРМАСЬЮТИКАЛЗ ЛИМИТЕД (IN) Область техники, к которой относится изобретение Настоящее изобретение относится к новому рентабельному и стереоселективному способу синтеза гидрохлорида рилпивирина. Типично изобретение относится к стереоселективному синтезу ключевого промежуточного для рилпивирина соединения, а именно гидрохлорида (Е)-4-(2-цианоэтенил)-2,6 диметилфениламина, при этом нужный изомер Е получают селективно с содержанием нежелательного изомера Z менее 0,5%, что способствует получению гидрохлорида рилпивирина с содержанием изомераZ менее 0,1%. Предшествующий уровень техники Рилпивирин, известный как соединение 4-[4-(4-[(1 Е)-2-цианоэтенил]-2,6-диметилфениламино)пиримидин-2-ил]аминобензонитрил, является ненуклеозидным ингибитором обратной транскриптазы(NNRTI) и обнаруживает ингибирующие свойства в отношении репликации вируса иммунодефицита человека (ВИЧ). Рилпивирин используют в виде его соли гидрохлорида в препаратах против ВИЧ: Обычно различные способы синтеза гидрохлорида рилпивирина (I) включают, как правило, получение ключевого промежуточного соединения гидрохлорида В WO 03/016306 впервые раскрывается синтез рилпивирина, включающий различные пути синтеза 4-(2-цианоэтенил)-2,6-диметилфениламина. Первый путь включает защиту аминогруппы 4-бром-2,6-диметилфениламина путем превращения в N,N-диметилметанимидамин с последующим формилированием с участием н-бутиллития и диметилформамида. Полученное формилсодержащее производное обрабатывают диэтил(цианометил)фосфонатом, получают цианоэтенильное соединение, из которого удаляют защитную группу с использованием хлорида пинка, и получают промежуточный цианоэтенилфениламин с нераскрытым соотношением E/Z. Такой путь включает тщательно разработанную последовательность синтеза, включающую защиту амина путем превращения его в имид, использование высоко влагочувствительного и пирофорного основания, такого как бутиллитий, и низкий выход реакции формилирования. Все указанные факторы делают способ совершенно нежизнеспособным для промышленного масштаба. На втором пути, раскрытом в WO 03/016306, используют 4-йод-2,6-диметилфениламин в качестве исходного материала для синтеза промежуточного цианоэтенилфениламина, который включает взаимодействие производного диметилфениламина с акрилонитрилом в течение по меньшей мере 12 ч при 130C в присутствии ацетата натрия и гетерогенного катализатора, такого как палладий на угле. Выделение нужного соединения включает обработку несколькими растворителями с последующим выпариванием. На таком пути также не приводятся какие-либо детали по соотношению E/Z ненасыщенного промежуточного продукта. Хотя на таком пути избегают использования фосфиновых лигандов, но длительное время реакции и проблема доступности чистых галогенфениламиновых производных в сочетании с умеренным выходом ставят под сомнение промышленную применимость такого пути. Третий путь,раскрытый вWO 03/016306,включает взаимодействие 4-бром-2,6-диметилфениламина с акриламидом в присутствии ацетата палладия,трис-(2-метилфенил)фосфина и N,N-диэтилэтанамина. Полученный амид дегидрируют с использованием фосфорилхлорида и получают 4-(2-цианоэтенил)-2,6-диметилфениламин с умеренным выходом 67% без упоминания о соотношении E/Z. Хотя соотношение изомеров E/Z для цианоэтенильного производного, полученного такими путями,в патенте конкретно не раскрывается, однако найдено, что сходимость результатов вышеуказанных реакций обеспечивает соотношение E/Z между 70/30 и 80/20. В литературе также сообщается о различных других способах введения цианоэтинильной группы в рилпивирин. В Journal of Medicinal Chemistry, (2005), 48, 2072-79 раскрывается реакция Виттига или Уодсворса-Эммонса соответствующего альдегида с хлоридом цианометилтрифенилфосфония с образованием продукта с соотношением изомеров E/Z 80/20. Альтернативный способ с реакцией Хека, включающий взаимодействие арилбромида с акрилонитрилом в присутствии три-о-толилфосфина и ацетата палладия, дает такое же соединение с более высоким соотношением изомеров E/Z 90/10. Способ требует дополнительной очистки ввиду присутствия значительной части изомера Z в ненасыщенном промежуточном соединении. Подобный способ раскрывается в Organic Process Research and Development, (2008), 12, 530-536. Однако найдено, что соотношение E/Z 4-(2-цианоэтенил)-2,6-диметилфениламина составляет 80/20, которое, как было найдено, улучшается до 98/2 (E/Z) после того, как соединение превращают в его соль гидрохлорид с использованием смеси этанола и изопропанола. Из вышеуказанного очевидно, что способы известного уровня техники ассоциируются с недостатками, указанными далее.a) Высокая доля изомера Z, что требует тщательной очистки с использованием методов колоночной хроматографии, кристаллизации или последовательной обработки несколькими растворителями, что снижает общий выход.b) Введение цианоэтенильной группы в формилированные производные бензоламина включает влагочувствительный реагент, подобный н-бутиллитию, что не является предпочтительным для промышленного масштаба. Кроме того, в способе используют эфиры цианометилфосфонаты и скрывается примерная доля изомера Z, и получают более высокий процент примесей, из-за чего требуется тщательная очистка, и в итоге снижается выход.c) Пути известного уровня техники включают использование фосфиновых лигандов, которые в случае операций в промышленном масштабе являются дорогостоящими и токсичными для окружающей среды.d) В способах известного уровня техники используют межфазные катализаторы, такие как бромид тетрабутиламмония, в стехиометрических количествах, и реакции осуществляют при весьма высоких температурах до 140-150C. Таким образом, существует потребность в разработке нового удобного и рентабельного способа получения гидрохлорида (Е)-4-(2-цианоэтенил)-2,6-диметилфениламина формулы (II), имеющего менее 0,5% изомера Z, не включающего какую-либо очистку и не включающего использование фосфинового реагента, который, по существу, дает гидрохлорид рилпивирина (I), соответствующий установленным условиям. Авторы настоящего изобретения разработали способ стереоселективного синтеза промежуточного соединения для рилпивирина гидрохлорида (Е)-4-(2-цианоэтенил)-2,6-диметилфениламина (II), включающий диазотирование 2,6-диметил-4-амино-1-карбоксибензилфениламина с последующей обработкой тетрафторборатом щелочного металла с образованием соли тетрафторбората иона диазония, за которой следует взаимодействие с акрилонитрилом в присутствии ацетата палладия(II) и последующее удаление защиты аминогруппы кислотой и затем обработка хлороводородной кислотой с образованием нужного изомера Е соединения (II), имеющего менее 0,5% изомера Z и с выходом 75-80%. Затем соединение (II) превращают в гидрохлорид рилпивирина (I) с содержанием изомера Z менее 0,1%. Цель изобретения Целью настоящего изобретения является получение гидрохлорида (Е)-4-(2-цианоэтенил)-2,6 диметилфениламина (II), имеющего менее 0,5% изомера Z, удобным рентабельным промышленно жизнеспособным способом, который не включает использование токсичных для окружающей среды фосфиновых реагентов. Другой целью изобретения является способ, который приемлем для синтеза в коммерческом масштабе и по которому изомер Е гидрохлорида (Е)-4-(2-цианоэтенил)-2,6-диметилфениламина (II) селективно синтезируют, используя реагенты, которые не являются вредными и влагочувствительными. Еще одной целью настоящего изобретения является эффективный и рентабельный способ получения гидрохлорида рилпивирина (I) с содержанием изомера Z менее 0,1% путем использования гидрохлорида (Е)-4-(2-цианоэтенил)-2,6-диметилфениламина формулы (II), имеющего менее 0,5% нежелательного изомера Z. Сущность изобретения Настоящее изобретение относится к новому способу синтеза гидрохлорида (Е)-4-(2-цианоэтенил)2,6-диметилфениламина формулы (II), имеющего нужную чистоту. Один аспект изобретения относится к новому и рентабельному способу получения гидрохлорида(Е)-4-(2-цианоэтенил)-2,6-диметилфениламина (II), имеющего менее 0,5% изомера Z, за счет процесса,включающего взаимодействие 2,6-диметил-4-амино-1-карбоксибензилфениламина (V) с нитритом натрия в хлороводородной кислоте с последующей обработкой диазотированного соединения тетрафторборатом натрия с образованием соответствующей соли тетрафторбората формулы (VI), которая при взаимодействии с акрилонитрилом в присутствии ацетата палладия и растворителя дает соединение(VII), которое после удаления защитной группы с помощью кислоты и последующей обработки хлороводородной кислотой дает соединение (II). Другой аспект изобретения относится к новому и рентабельному способу получения гидрохлорида рилпивирина (I), имеющего менее 0,1% изомера Z, включающему взаимодействие гидрохлорида(II) с 4-[(4-хлор-2 пиримидинил)амино]бензонитрилом формулы (XI) в ацетонитриле в качестве растворителя, выделение свободного основания рилпивирина при щелочном рН, необязательно, очистку ацетоном, растворение в диметилсульфоксиде, нагревание смеси до 50-55C и добавление соляной кислоты, а затем воды и выделение гидрохлорида рилпивирина, имеющего менее 0,1% изомера Z, при температуре 25-30C. Цели настоящего изобретения станут более явными из последующего подробного описания. Осуществление изобретения Авторы настоящего изобретения неожиданно обнаружили, что гидрохлорид (Е)-4-(2-цианоэтенил)2,6-диметилфениламина (II), имеющий менее 0,5% изомера Z, можно получить с выходом 75-80% катализируемым ацетатом палладия взаимодействием акрилонитрила с солью тетрафторборатом диазония 2,6-диметил-4-амино-1-карбоксибензилфениламина. Кроме того, обнаружено, что гидрохлорид рилпивирина, полученный из соединения (II), имеет менее 0,1% изомера Z (схема 1). Схема 1 Способ получения гидрохлорида рилпивирина (I), воплощенный в настоящем изобретении Соединение формулы (V) получают взаимодействием 2,6-диметил-4-нитроанилина (III) с бензилхлорформиатом с образованием 3,5-диметил-4-карбоксибензиламин-1-нитробензола (IV), который затем превращают в гидрохлорид 3,5-диметил-4-карбоксибензиламин-1-фениламина (Va) путем восстановления хлоридом олова в метаноле в качестве растворителя. В одном воплощении гидрохлорид 3,5-диметил-4-карбоксибензиламин-1-фениламина формулы(Va) обрабатывают нитритом натрия в присутствии соляной кислоты в водной среде при 0-25C и получают соединение диазония. По завершении реакции, которое контролируют ВЭЖХ, реакционную смесь обрабатывают водным раствором тетрафторбората и получают тетрафторборат 3,5-диметил-4 карбоксибензиламино-1-диазония (VI). Водный раствор тетрафторбората получают, растворяя в воде тетрафторборат щелочного металла,такой как тетрафторборат натрия или тетрафторборат калия, для получения 30-50% водного раствора. Соль тетрафторборат арендиазония формулы (VI), которая выделяется, отфильтровывают и сушат. К соединению формулы (V) добавляют органический растворитель. Органический растворитель выбирают из группы, включающей этанол, метанол, изопропанол, диметилформамид, диметилацетамид и тетрагидрофуран. К смеси постепенно добавляют акрилонитрил в присутствии ацетата палладия и перемешивают при температуре окружающей среды до завершения реакции. Реакционную массу фильтруют и концентрируют и получают остаток, содержащий 2,6-диметил-4-(2-цианоэтенил)-1-карбоксибензилфениламин(VII). Для удаления защитной группы из соединения (VII) используют органическую или неорганическую кислоту, но предпочтительно органическую кислоту. К остатку добавляют трифторуксусную кислоту и перемешивают при 40-60C до завершения реакции, которое контролируют ТСХ. Реакционную массу гасят водой и нейтрализуют жидким аммиаком. Смесь экстрагируют несмешивающимся с водой растворителем, подобным толуолу. Органический слой концентрируют и обрабатывают смесью спирта, подобного изопропанолу, и простого эфира, подобного диизопропиловому эфиру. Затем к смеси добавляют раствор хлороводорода в изопропаноле и выделяют гидрохлорид (Е)-4-(2-цианоэтенил)-2,6-диметилфениламина (II). Уместно отметить, что соединение (II) получают с выходом 75-80%, и обнаружено, что изомера Z имеется менее 0,5%, что легко снижается до уровня ниже 0,1% в гидрохлориде рилпивирина. Это является полной противоположностью методам известного уровня техники, в которых гидрохлорид (Е)-4-(2-цианоэтенил)-2,6-димегилфениламина (II) выделяют с более чем 2% изомера Z, и требуется дополнительная очистка для получения содержания изомера Z в гидрохлориде рилпивирина (I) ниже желательных пределов. Затем гидрохлорид (Е)-4-(2-цианоэтенил)-2,6-диметилфениламина (II) растворяют в ацетонитриле и после добавления 4-[(4-хлор-2-пиримидинил)амино]бензонитрила (XI) полученную смесь греют при 7090C до завершения реакции, которое контролируют ВЭЖХ. Затем реакционную смесь охлаждают до 40C, и, когда реакционную смесь подщелачивают водным раствором неорганического основания, подобного карбонату натрия, начинает выделяться рилпивирин-основание. Затем рилпивирин свободное основание очищают путем кипячения с обратным холодильником в органическом растворителе, подобном ацетону, и раствор после необязательной обработки углем частично концентрируют, охлаждают и фильтруют. Влажный остаток на фильтре с содержанием изомера Z0,6% сушат, растворяют в диметилсульфоксиде и после постепенного смешивания с соляной кислотой при 50-55C разбавляют водой при той же температуре. Конечный продукт, который извлекают, отфильтровывают при 25-30C, промывают водой и получают гидрохлорид рилпивирина, имеющий менее 0,1% изомера Z. Отмечают, что температура фильтрации является критичной для получения конечного продукта с содержанием изомера Z менее 0,1%. Авторы изобретения обнаружили, что дополнительная очистка не требуется, в силу чего появляется какая-то возможность избежать потери выхода. Соединение формулы (XI), требуемое для получения рилпивирина как свободного основания, получают так, как раскрывается на схеме 2. Схема 2 Получение 4-[(4-хлор-2-пиримидинил)амино]бензонитрила (XI)(X) обрабатывают оксихлоридом фосфора и получают 4-[(4-хлор-2-пиримидинил)амино]бензонитрил формулы (XI). Реакцию выполняют в температурном интервале 60-80C с использованием толуола в качестве растворителя. Приведенные далее примеры предназначены для пояснения настоящего изобретения. Указанные примеры являются примерами осуществления изобретения и не истолковываются как ограничивающие объем изобретения. Примеры Пример 1. Синтез тетрафторбората 3,5-диметил-4-карбоксибензиламинфенил-1-диазония (VI). Гидрохлорид 3,5-диметил-4-карбоксибензиламин-1-фениламина (150 г) добавляют к воде (1500 мл) и реакционную смесь охлаждают до 10-15C. К реакционной массе постепенно добавляют концентрированную соляную кислоту (150 мл), затем добавляют 50% водный раствор нитрита натрия (102 мл) и смесь перемешивают при той же температуре. По завершении реакции, которое контролируют ТСХ, к реакционной массе добавляют 50% водный раствор тетрафторбората натрия (323 мл) и перемешивают. Соль тетрафторбората, выделяющуюся из реакционной массы, отфильтровывают и сушат и получают тетрафторборат 3,5-диметил-4-карбоксибензиламинфенил-1-диазония. Выход = 165 г. Выход в %: 91%.(2000 мл) постепенно добавляют акрилонитрил (43,1 г). К реакционной массе при перемешивании при 25-30C добавляют ацетат палладия (5 г) и реакционную массу перемешивают до завершения реакции. По завершении реакции реакционную массу фильтруют и концентрируют и получают остаток, содержащий 2,6-диметил-4-(2-цианоэтенил)-1-карбоксибензилфениламин (VII), который используют в следующей реакции. Выход = 161 г. Пример 3. Синтез гидрохлорида 2,6-диметил-4-(2-цианоэтенил)фениламина (II). К остатку 2,6-диметил-4-(2-цианоэтенил)-1-карбоксибензилфениламина, полученному в примере 2(161 г), при 25-30C постепенно добавляют трифторуксусную кислоту (600 мл) и реакционную массу перемешивают при 45-60C до завершения реакции, которое контролируют ТСХ. По завершении реакции к реакционной массе добавляют воду (1800 мл), реакционную массу нейтрализуют водным аммиаком и экстрагируют толуолом. Органический слой отделяют и концентрируют и получают 2,6-диметил 4-(2-цианоэтенил)фениламин. Остаток смешивают со смесью 1:1 изопропанола и диизопропилового эфира (1000 мл) и обрабатывают HCl, растворенным в изопропаноле, и получают соль гидрохлорид 2,6-диметил-4-(2-цианоэтенил)фениламина (II), который охлаждают до 25-30C, отфильтровывают и сушат. Выход = 90 г. Выход в %: 80% (относительно соединения VI). Пример 4. Синтез 3,5-диметил-4-карбоксибензиламин-1-нитробензола (IV). К суспензии 2,6-диметил-4-нитроанилина (100 г) в толуоле (1000 мл) при 25-30C постепенно добавляют раствор бензилхлорформиата (1027 г, 50% раствор в толуоле). Смесь кипятят с обратным холодильником до завершения реакции. Реакционную смесь охлаждают до 10-15C, фильтруют, остаток на фильтре сушат и получают 3,5-диметил-4-карбоксибензиламин-1-нитробензол (IV). Выход 160 г. Выход в %: 88%. Пример 5. Синтез гидрохлорида 3,5-диметил-4-карбоксибензиламин-1-фениламина (Va). К смеси 3,5-диметил-4-карбоксибензиламин-1-нитробензола (150 г) и метанола (1500 мл) добавляют дигидрат хлорида олова (394 г). Реакционную массу греют при 60-65C и перемешивают до завершения реакции, которое контролируют ВЭЖХ. Реакционную смесь концентрируют и остаток разбавляют водой (750 мл). Постепенно при перемешивании при 15-20C добавляют 20% раствор гидроксида натрия(2000 мл). Смесь экстрагируют дихлорметаном и органический слой перемешивают с соляной кислотой при 10-15C для отделения соли гидрохлорида 3,5-диметил-4-карбоксибензиламин-1-фениламина (Va),который отфильтровывают и сушат. Выход = 145 г. Выход в %: 94%. Пример 6. Синтез 4-[(4-хлор-2-пиримидинил)амино]бензонитрила (XI). Смесь 4-гидрокси-2-тиометилпиримидина (VIII) (500 г) и 4-аминобензонитрила (IX; 1246,5 г) при перемешивании постепенно нагревают до 100-125C, затем нагревают далее до 180-185C и такой нагрев продолжают до завершения реакции, которое контролируют ВЭЖХ. Затем реакционную массу охлаждают до 100-110C и к ней добавляют толуол (2000 мл). Реакционную массу перемешивают при 100110C, охлаждают до температуры окружающей среды, фильтруют, сушат и получают 4-[(4-гидрокси-2 пиримидинил)амино]бензонитрил. К нему добавляют толуол (2500 мл) и к смеси при 50-70C постепенно добавляют оксихлорид фосфора (434,5 г). Реакционную массу перемешивают при 70-75C до завершения реакции и охлаждают до 10-20C, гасят водой и нейтрализуют, добавляя раствор карбоната натрия, фильтруют при 10-20C, сушат и получают 4-[(4-хлор-2-пиримидинил)амино]бензонитрил (XI). Выход = 450 г. Выход в %: 83%. Пример 7. Синтез гидрохлорида рилпивирина. 4-[(4-Хлор-2-пиримидинил)амино]бензонитрил (100 г) и гидрохлорид 2,6-диметил-4-(2 цианоэтенил)фениламина (90,65 г) смешивают с ацетонитрилом (800 мл) в инертной атмосфере и греют при 85-90C до завершения реакции, которое контролируют ВЭЖХ. Реакционную смесь охлаждают до 40C и рН реакционной массы доводят примерно до 10 20% раствором карбоната натрия. Реакционную массу фильтруют при 5-10C, сушат и получают рилпивирин (110 г). Полученный таким образом рилпивирин растворяют в ацетоне (3600 мл) и после необязательной обработки углем раствор концентрируют до 500 мл и фильтруют при 5-10C, сушат и получают рилпивирин (80 г), который затем добавляют к диметилсульфоксиду (338 мл) и нагревают до 70-75C. Смесь охлаждают до 50-55C и смешивают с соляной кислотой (25 мл) при постоянном перемешивании. К смеси при 40-45C добавляют воду (1350 мл) и смесь перемешивают и охлаждают далее. Реакционную массу фильтруют при 25-30C, влажный остаток на фильтре сушат и получают 90 г гидрохлорида рилпивирина,имеющий менее 0,1% изомера Z. с нитритом натрия в соляной кислоте с последующей обработкой образующегося диазотизированного соединения тетрафторборатом щелочного металла, с получением соответствующей тетрафторборатной соли формулы (VI) взаимодействие соединения формулы (VI) с акрилонитрилом в присутствии ацетата палладия и растворителя с образованием соединения формулы (VII) которое после удаления защитной группы с помощью органической кислоты и последующей обработки соляной кислотой дает соединение формулы (II), имеющее менее чем 0,5% Z-изомера. 2. Способ по п.1, в котором растворитель выбирают из группы, включающей метанол, этанол, изопропанол, диметилформамид, диметилацетамид и тетрагидрофуран. 3. Способ по п.1, в котором органическая кислота представляет собой трифторуксусную кислоту. 4. Способ по п.1, в котором тетрафторборат щелочного металла выбирают из группы, включающей тетрафторборат натрия и тетрафторборат калия. 5. Способ по п.1, в котором соединение формулы (V) с бензилхлорформиатом с образованием соединения формулы (IV) и последующим восстановлением соединения формулы (IV) хлоридом олова. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07D 239/04, C07C 253/30, C07C 255/34
Метки: получения, промежуточного, синтеза, соединения, способ, улучшенный, рилпивирина
Код ссылки
<a href="https://eas.patents.su/7-24409-uluchshennyjj-sposob-polucheniya-promezhutochnogo-soedineniya-dlya-sinteza-rilpivirina.html" rel="bookmark" title="База патентов Евразийского Союза">Улучшенный способ получения промежуточного соединения для синтеза рилпивирина</a>
Предыдущий патент: Способ синтеза 3-(2-бром-4,5-диметоксифенил)пропаннитрила и применение в синтезе ивабрадина и его фармацевтически приемлемых кислотно-аддитивных солей
Следующий патент: Распределительный коллектор
Случайный патент: Способ и устройство для улучшения боковой опоры, создаваемой ногами самоподъемной буровой установки











