Переносчик для доставки вещества в эукариотические клетки и способ его получения
Формула / Реферат
1. Способ получения переносчика для доставки в эукариотические клетки вещества, например, ДНК, РНК, белка, нуклеопротеида или фармацевтического средства, обладающего липофильными или липофобными свойствами, причем указанный переносчик содержит, по крайней мере, один вирусный капсомер, который получен таким образом, что он является пригодным для конструирования капсида или капсидоподобной структуры и на внутренней стороне имеет структуру, взаимодействующую с указанным веществом так, что указанное молекулярное вещество может связываться с капсомером или присоединяться к нему, включающий осуществление следующих стадий:
(а) синтез, очистка или выделение капсомера и
(б) обеспечение образования комплекса вещества с указанным капсомером.
2. Способ по п.1, отличающийся тем, что капсомер является капсомером вируса полиомы или происходит из него.
3. Способ по п.2, отличающийся тем, что капсомер является пентамером белка VP1 вируса полиомы или происходит из него.
4. Способ по п.1, отличающийся тем, что капсомер является капсомером безоболочечных вирусов, таких как ДНК-содержащие паповавирусы, в частности вирусы полиомы и папилломавирусы, а также иридовирусы, аденовирусы, парвовирусы или РНК-содержащие пикорнавирусы, в частности полиовирусы, а также калицивирусы, реовирусы и бирнавирусы или происходит из них.
5. Способ по п.1, отличающийся тем, что капсомер является капсомером внешней и/или внутренней оболочки вирусов, таких как ДНК-содержащие поксвирусы, герпесвирусы, гепаднавирусы или РНК-содержащие ретровирусы, парамиксовирусы, вирус Сендай, ортомиксовирусы, буньявирусы, аренавирусы, торовирусы, тогавирусы, флавивирусы, рабдовирусы и филовирусы или происходит из них.
6. Способ по любому из пп.1-5, отличающийся тем, что взаимодействия вещества и капсомера являются липофильными взаимодействиями и/или взаимодействиями, основанными на образовании ковалентных связей, ионных связей или водородных мостиков.
7. Способ по любому из пп.1-6, отличающийся тем, что структура, взаимодействующая с веществом, содержит бифункциональные, предпочтительно гетерологические бифункциональные группы.
8. Способ по п.7, отличающийся тем, что указанные бифункциональные группы являются группами соединений, включающих малеимидные производные, алкилгалогениды, арилгалогениды, изоцианаты, глутаральдегиды, акрилирующие реагенты и сложные имидоэфиры.
9. Способ по любому из пп.7 или 8, отличающийся тем, что указанные бифункциональные группы взаимодействуют с цистеиновыми остатками на капсомере.
10. Способ по любому из пп.1-9, отличающийся тем, что структура, взаимодействующая с веществом, содержит группы с повышенной аффинностью, такие как группы 4-иодоцетамидосалициловой кислоты и/или фенилдиазонийфторборат п-арсоновой кислоты и/или производных указанных соединений.
11. Способ по любому из пп.3-10, отличающийся тем, что структура, взаимодействующая с веществом, образована эпитопами пентамера VP1 вируса полиомы.
12. Способ по любому из пп.1-11, отличающийся тем, что для конструирования капсидоподобной структуры для доставки вещества в клетки определенного типа или в определенный участок внутриклеточного пространства используют, по крайней мере, один дополнительный капсомер.
13. Способ по любому из пп.1-12, отличающийся тем, что капсидоподобная структура содержит, по крайней мере, один белок VP-2 или VP-3 полиомавируса.
14. Способ по любому из пп.1-13, отличающийся тем, что образование комплекса вещества с капсомером обеспечивают за счет модификации цистеиновых остатков капсомера с помощью бифункциональных групп.
15. Способ по п.14, отличающийся тем, что указанные бифункциональные группы являются группами соединений, включающих малеимидные производные, алкилгалогениды, арилгалогениды, изоцианаты, глутаральдегиды, акрилирующие реагенты и сложные имидоэфиры.
16. Применение переносчика, полученного в соответствии со способом по любому из пп.1-15 формулы для доставки вещества, например ДНК, РНК, олигонуклеотидов, нуклеопротеидов, белков, пептидов, а также низкомолекулярных липофильных и липофобных реагентов, коллоидного золота и меченных золотом белков и пептидов.
Текст
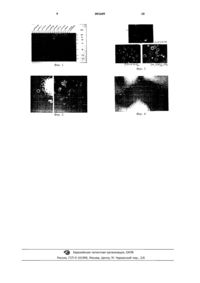
1 Настоящее изобретение относится к переносчику для транспорта в эукариотические клетки вещества, такого как ДНК, РНК, белок,нуклеопротеид (PNA), или фармацевтическое средство, обладающее липофильным и липофобным свойством. Кроме того настоящее изобретение относится к способу получения такого переносчика, к его использованию, и к композициям агентов, предназначенных для применения в настоящем изобретении и для его осуществления. При определенных условиях, эукариотические клетки абсорбируют ДНК, белки и другие молекулы. Однако скорость такой абсорбции обычно низка. Кроме того транспорт указанного вещества не был ранее определен с точки зрения клеток и клеточного компартмента, или области во внутриклеточном пространстве. Известно, что для того, чтобы улучшить абсорбцию, в частности, ДНК в эукариотические клетки, в качестве переносчиков для транспорта в клетки используют вирусные векторы. Использование вирусных векторов нежелательно из-за того, что в этом случае может происходить котрансфекция вирусных геномов. Кроме того в патенте США 4950599 был описан захват молекул, таких как ДНК в эукариотические клетки с использованием пустых вирусных капсидов, в частности, капсидов полиомавирусов. Однако даже в этом способе котрансфекция вирусных геномов не может быть исключена. Кроме того молекулы, размер которых превышает внутренний объем капсида полиомавируса, не могут быть упакованы в нем. И, наконец, получение синтетических капсидов полиомы, которое может быть предпринято, как один из возможных способов избежать котрансфекции, является чрезвычайно трудной и дорогостоящей задачей. Задачей настоящего изобретения является решение проблем, существующих в настоящее время в данной области, а более конкретно, задачей настоящего изобретения является показать, что для транспорта молекулярного вещества в эукариотические клетки может быть использован универсальный переносчик, и что этот переносчик может быть получен очень простым и недорогостоящим способом. Для этого используются вирусные капсомеры или капсомеры, происходящие из вирусов,причем капсид, состоящий не менее чем из одного капсомера, имеет на внутренней стороне структуру, взаимодействующую с веществом,образуя комплекс для доставки в молекулярной форме таких соединений как нуклеиновые кислоты, пептиды, липофильные и липофобные реагенты. Настоящее изобретение относится к переносчику, который содержит, по крайней мере,один капсомер, полученный или происходящий от вируса, где указанный капсомер на одной из своих сторон имеет структуру, взаимодейст 001609 2 вующую с молекулярным веществом, такую,что это молекулярное вещество может связываться или присоединяться к капсомеру. Переносчик настоящего изобретения имеет то преимущество, что он может быть получен синтетически относительно простым способом. Этот способ позволяет избежать котрансфекции вирусных геномов. Кроме того, благодаря взаимодействию структуры переносчика с указанным веществом, это вещество может связываться с клетками и внедряться в них. Для осуществления этого необязательно должна сохраняться типичная форма капсида. Для получения переносчиков настоящего изобретения, помимо капсомеров могут быть также использованы и другие виды защитных форм. Особенно значительным преимуществом настоящего изобретения является то, что в зависимости от формирования, по крайней мере, одного капсомера переносчик настоящего изобретения может быть использован для специфического транспорта вещества в определенные клетки и/или в предварительно определенные участки внутриклеточного пространства. Капсомер получают, предпочтительно так,чтобы он был пригоден для конструирования капсида или капсидподобной структуры. Особенно предпочтительно, чтобы этот капсомер спонтанно образовывал капсиды. В соответствии с другим предпочтительным вариантом настоящего изобретения этот капсомер происходит от полиомавируса, и может быть образован из пентамера VP1 пoлиомавируса. Альтернативно, капсомер может быть получен из не покрытых оболочкой вирусов,таких как ДНК-содержaщие паповавирусы (Раpovaviridae), в частности, полиомавирусы и папиломавирусы, иридовирусы (Iridoviridae), аденовирусы (Adenoviridae), парвовирусы (Parvoviridae); и РНК-содержащие пикорнавирусы, а в частности, полиовирусы, калицивирусы (Caliciviridae), реовирусы (Reoviridae), и бирнавирусы (Birnaviridae), либо на основе этих вирусов. В зависимости от типа транспортируемого вещества может также оказаться предпочтительным получать капсомер из внешней и/или внутренней оболочки обернутых оболочкой вирусов, таких как ДНК-содержащие поксвирусы (Poxviridae), герпесвирусы (Herpesviridae),гепаднавирусы (Hepadnaviridae); или РНКсодержащие ретровирусы, парамиксовирусы(Rhabdoviridae), и филовирусы (Filoviridae), или на основе этих вирусов. Вышеуказанные взаимодействия являются соответствующими липофильными взаимодействиями и/или взаимодействиями, которые ос 3 нованы на образовании ковалентных связей,ионных связей или водородных мостиков. Таким образом, можно гарантировать, что, при транспортировке в клетку указанное вещество остается безопасным благодаря связыванию или прикреплению к переносчику, но после транспортировки в клетку оно может освобождаться от носителя, либо оно может быть отделено клеточными системами. Структура переносчика может содержать бифункциональные, предпочтительно гетерологические, бифункциональные группы, причем,указанные бифункциональные группы могут быть выбраны из группы соединений, включающей малеимидные производные, алкилгалогениды, арилгалогениды, изоцианаты, глутаральдегиды, акрилирующие реагенты и сложные имидоэфиры. Таким способом достигается,в частности, высвобождение указанного вещества в лизосоме, в цитоплазматическом пространстве или в ядре. Было показано, что особенно предпочтительно, чтобы бифункциональные группы реагировали с цистеиновыми остатками на капсомере. И кроме того, предпочтительно, чтобы взаимодействующая структура содержала группы с повышенной аффинностью, такие как 4 иодоацетамидосалициновая кислота и/или фенилдиазонилфторборат п-арсоновой кислоты,и/или их производные. Такая структура может быть также образована эпитопами пентамераVP1. В другом своем предпочтительном варианте осуществления настоящее изобретение относится к получению переносчика, такого, чтобы с использованием, по крайней мере, одного дополнительного капсомера, можно было сконструировать капсидподобную структуру для транспорта указанного вещества в предварительно определенный тип клеток, или в предварительно определенную область внутриклеточного пространства. Таким дополнительным капсомером может быть капсомер настоящего изобретения. Однако указанная капсидподобная структура может быть также получена с использованием капсомеров, не относящихся к настоящему изобретению. Выбор типа капсомеров и их комбинации для получения капсидподобной структуры зависит от природы клетки или от предварительно определенной локализации этой структуры во внутриклеточном пространстве, в которую или к которой транспортируется указанное вещество. Практически, одна сторона капсомера является частью внутренней капсидподобной структуры, где эта капсидподобная структура происходит, предпочтительно, от полиомавируса. И наконец, капсидподобная структура может включать, по крайней мере, один белок VP-2 и/или белок VP-3. 4 Для получения переносчика настоящего изобретения предлагается способ, который включает следующие стадии:(ii) образование комплекса молекулярного вещества с использованием капсомера. Разработка этого способа предусматривает модификацию подходящих остатков капсомера,а в частности, его цистеиновых остатков, с использованием бифункциональных групп после стадии (i). Такая модификация может быть практически осуществлена с использованием одного или нескольких из следующих соединений: малеимидные производные, алкилгалогениды, арилгалогениды, изоцианаты, глутаральдегиды, акрилирующие реагенты и сложные имидоэфиры. Переносчики настоящего изобретения могут быть предпочтительно использованы в качестве фармацевтического носителя для введения в эукариотические клетки таких молекул, как ДНК, РНК, олигонуклеотиды, нуклеопротеиды(PNA), белки, пептиды, и низкомолекулярные липофильные и липофобные реагенты, коллоидное золото, меченные золотом белки и пептиды. Кроме того в соответствии с настоящим изобретением предусматривается использование комбинации переносчика настоящего изобретения с агентами, подходящими или необходимыми для введения, например, реагентами, растворителями и т.п. Для осуществления способа настоящего изобретения может быть также использована комбинация агентов. Такая комбинация может также включать соответствующее устройство, и т.п. Для более подробного описания настоящего изобретения приводятся нижеследующие примеры и иллюстрации. Фиг. 1 иллюстрирует детекцию слитых белков VP3, VP2 и VP1 с помощью гельэлектрофореза. Фиг. 2 (слева) иллюстрирует полученное на электронном микроскопе изображение пентамеров, образованных из белка VP1, и (справа) смоделированную на компьютере структуру пентамеров с симметрией 5-го порядка. Фиг. 3 иллюстрирует полученные пентамеры и образованные из них капсиды, и Фиг. 4 иллюстрирует полученное на электронном микроскопе изображение нагруженныхVP1-капсидов. В нижеследующих примерах описан один из возможных предпочтительных вариантов осуществления настоящего изобретения. 1) Экспрессия белка VP1 полиомавируса вE.coli. Был получен ген белка оболочки VP1 мышиного полиомавируса, который содержит некоторые признаки последовательностей штамма А 2 и штамма A3. Кодирующую последователь 5 ность, начинающуюся с ATG или с нижеследующей аминокислоты, клонировали непосредственно за сайтом расщепления фактора Ха в производном векторе, полученном от коммерчески доступного вектора pQE 10, поставляемогоQuiagen. Этот вектор несет сайт расщепления Ха слитого белка VP1 в N-(амино)-конце с гистидиновой последовательностью. Полученную таким образом гибридную конструкцию клонировали вовнутрь маркерного гена (lacZкомплементация) и индуировали с помощью промотора lacZ. Конечную конструкцию трансформировали в клетки E.coli, подходящие для экспрессии векторов pQE. Когда клетки после предварительного культивирования достигали логарифмической фазы роста, их индуцировали путем добавления соответствующего индуктора,например, IPTG. После этого они экспрессировали большие количества гибридного белка, содержащего белок VP1. Через 6 ч после индуцирования гибридный белок собирали. Этот белок присутствует в растворимой форме и может быть очищен на колонках с никелевым хелатным комплексом в соответствии со схемой очистки Quiagen, подвергнутой лишь небольшим изменениям. Путем инкубирования с фактором Ха, часть очищенного белка VP1 может быть снова удалена из колонки с никелевым хелатным комплексом. Полученный белок VP1 присутствовал в очень чистой форме и образовывал пентамеры сам с собой. Белки VP2 и VP3 могут быть получены аналогичным образом. На фиг. 1 показана детекция гибридных белков VP3, VP2 и VP1 с помощью гельэлекторофореза. На фиг. 2, слева, показано полученное на электронном микроскопе изображение пентамеров, образованных из белка VP1,а справа показана смоделированная на компьютере структура пентамеров с симметрией 5-го порядка. 2) Модификация цистеиновых остатков на одной стороне пентамеров перед их сборкой. Пентамеры VP1, полученные как описано в примере (1), имеют множественные структуры, которые могут быть трансформированы в бифункциональные группы с помощью реакции с соответствующими реагентами. Эти структуры были обнаружены на той стороне пентамеров, которые после сборки с образованием капсида соответствуют его внутренней части. Используемым реагентом является сложный эфир 3-малеимидобензоил-N-гидроксисукцинимид,диспергированный в смеси ацетон/метанол/вода, который на одной стороне реактивного центра в качестве реакционноспособных групп несет SH-группы, а на другой стороне,реакционноспособную сложноэфирную группу,а именно, сложный сукцинимидоэфир, имеющий группы, способные реагировать с аминогруппами. Дисперсию смешивают с растворенными белками VP1, так чтобы происходила количественная реакция. 6 В таблице 1 показаны структуры петель капсомеров полиомавирусов, которые присутствуют на одной стороне капсомеров, и которые,после сборки, находятся во внутренней части капсида или капсидподобной структуры: Таблица 1 Петля 1: Asp 38, Leu 39, Val 40, Thr 41, Gly 42, Pro 43,Asp 44, Ser 45 Петля 2: Asn 109, Glu 110, Asp 111, Leu 112, Thr 113,Lys114, Asp 115, Thr 116, Leu 117 Хвост: от N-конца аминокислотного остатка 1 до остатка 29 (по крайней мере, от аминокислоты 18 N-конца, локализация которого была точно определена в структурном анализе, и до остатка 29): Lys 18, Ala 19, Cys 20, Pro 21, Arg 22, Pro 23, Ala 24, Pro 25, Val 26, Pro 27, Lys 28, Leu 29 Петля 3: Туr 354, Asp 355, Gly 356, Thr 357, Gln 358,Pro 359, Val 360. 3) Сборка пентамеров VP1 с образованием капсидов VP1. Пентамеры VP1 находились в буферном растворе, который содержит EGTA для стабилизации пентамерного состояния в несобранном виде. Затем, для стабилизации рН, в буферный раствор добавляли ионы магния, ионы натрия и трис/HCl, рН 7,6. Раствор белка переносили в камеру для диализа и диализовали против 2 М раствора сульфата аммония. После нескольких замен диализного буфера, пентамеры VP1 образовывали капсиды. При исследовании на электронном микроскопе эти капсиды, по своему диаметру, или по своей стабильности, не отличались от пустых капсидов полиомавирусов,хотя у них отсутствовали белки внутренней оболочки VP2 и VP3. На фиг. 3 показаны полученные пентамеры и образованные из них капсиды. 4) Упаковка ДНК-олигонуклеотидов вVP1-капсидах полиомавируса. Обычные олигонуклеотиды, то есть, олигонуклеотиды с неизменной химической структурой могут быть упакованы в VP1-капсиды полиомавируса с высоким выходом в соответствии с нижеследующей схемой: капсидные структуры, такие как структуры, которые были получены в примере 3, забуферивали до рН 5,5. Затем их подвергали реакции в условиях осмотического шока с эквимолярным или избыточным молярным количеством, обычно, с двухкратным молярным избытком олигонуклеотидов. Для олигонуклеотидов, используемых в этом примере (20-меров), массовое отношение составляло около 1:6 по отношению к белкуVP1. При исследовании на электронном микроскопе, полученная таким образом форма VP1 капсидов, нагруженных олигонуклеотидами, не отличалась от ненагруженных VP1-капсидов. На фиг. 4 показан вид нагруженных VP1-капсидов,полученный на электронном микроскопе. 7 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения переносчика для доставки в эукариотические клетки вещества, например, ДНК, РНК, белка, нуклеопротеида или фармацевтического средства, обладающего липофильными или липофобными свойствами,причем указанный переносчик содержит, по крайней мере, один вирусный капсомер, который получен таким образом, что он является пригодным для конструирования капсида или капсидоподобной структуры и на внутренней стороне имеет структуру, взаимодействующую с указанным веществом так, что указанное молекулярное вещество может связываться с капсомером или присоединяться к нему, включающий осуществление следующих стадий:(а) синтез, очистка или выделение капсомера и(б) обеспечение образования комплекса вещества с указанным капсомером. 2. Способ по п.1, отличающийся тем, что капсомер является капсомером вируса полиомы или происходит из него. 3. Способ по п.2, отличающийся тем, что капсомер является пентамером белка VP1 вируса полиомы или происходит из него. 4. Способ по п.1, отличающийся тем, что капсомер является капсомером безоболочечных вирусов, таких как ДНК-содержащие паповавирусы, в частности вирусы полиомы и папилломавирусы, а также иридовирусы, аденовирусы,парвовирусы или РНК-содержащие пикорнавирусы, в частности полиовирусы, а также калицивирусы, реовирусы и бирнавирусы или происходит из них. 5. Способ по п.1, отличающийся тем, что капсомер является капсомером внешней и/или внутренней оболочки вирусов, таких как ДНКсодержащие поксвирусы, герпесвирусы, гепаднавирусы или РНК-содержащие ретровирусы,парамиксовирусы, вирус Сендай, ортомиксовирусы, буньявирусы, аренавирусы, торовирусы,тогавирусы, флавивирусы, рабдовирусы и филовирусы или происходит из них. 6. Способ по любому из пп.1-5, отличающийся тем, что взаимодействия вещества и капсомера являются липофильными взаимодействиями и/или взаимодействиями, основанными на образовании ковалентных связей, ионных связей или водородных мостиков. 7. Способ по любому из пп.1-6, отличающийся тем, что структура, взаимодействующая с веществом, содержит бифункциональные, пред 001609 8 почтительно гетерологические бифункциональные группы. 8. Способ по п.7, отличающийся тем, что указанные бифункциональные группы являются группами соединений, включающих малеимидные производные, алкилгалогениды, арилгалогениды, изоцианаты, глутаральдегиды, акрилирующие реагенты и сложные имидоэфиры. 9. Способ по любому из пп.7 или 8, отличающийся тем, что указанные бифункциональные группы взаимодействуют с цистеиновыми остатками на капсомере. 10. Способ по любому из пп.1-9, отличающийся тем, что структура, взаимодействующая с веществом, содержит группы с повышенной аффинностью, такие как группы 4-иодоцетамидосалициловой кислоты и/или фенилдиазонийфторборат п-арсоновой кислоты и/или производных указанных соединений. 11. Способ по любому из пп.3-10, отличающийся тем, что структура, взаимодействующая с веществом, образована эпитопами пентамера VP1 вируса полиомы. 12. Способ по любому из пп.1-11, отличающийся тем, что для конструирования капсидоподобной структуры для доставки вещества в клетки определенного типа или в определенный участок внутриклеточного пространства используют, по крайней мере, один дополнительный капсомер. 13. Способ по любому из пп.1-12, отличающийся тем, что капсидоподобная структура содержит, по крайней мере, один белок VP-2 или VP-3 полиомавируса. 14. Способ по любому из пп.1-13, отличающийся тем, что образование комплекса вещества с капсомером обеспечивают за счет модификации цистеиновых остатков капсомера с помощью бифункциональных групп. 15. Способ по п.14, отличающийся тем, что указанные бифункциональные группы являются группами соединений, включающих малеимидные производные, алкилгалогениды, арилгалогениды, изоцианаты, глутаральдегиды, акрилирующие реагенты и сложные имидоэфиры. 16. Применение переносчика, полученного в соответствии со способом по любому из пп.115 формулы для доставки вещества, например ДНК, РНК, олигонуклеотидов, нуклеопротеидов, белков, пептидов, а также низкомолекулярных липофильных и липофобных реагентов,коллоидного золота и меченных золотом белков и пептидов.
МПК / Метки
МПК: A61K 48/00, C12N 15/87
Метки: переносчик, вещества, эукариотические, доставки, получения, способ, клетки
Код ссылки
<a href="https://eas.patents.su/6-1609-perenoschik-dlya-dostavki-veshhestva-v-eukarioticheskie-kletki-i-sposob-ego-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Переносчик для доставки вещества в эукариотические клетки и способ его получения</a>
Предыдущий патент: Способы, в которых применяют индикаторные лиганды
Следующий патент: Препарат из покрытых частиц.
Случайный патент: Способ укладки искусственного газона