Способ получения 5-цианофталида
Формула / Реферат
1. Способ получения 5-цианофталида, включающий обработку соединения формулы IV
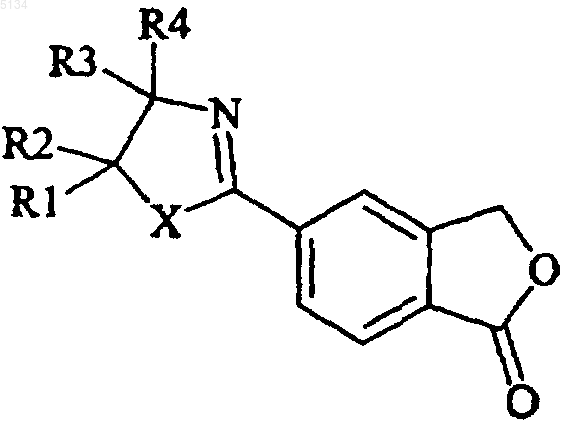 (IV)
(IV)
в которой X представляет собой O или S;
каждый из R1-R2, независимо друг от друга, выбирают из водорода и C1-6 алкила, или R1 и R2 совместно образуют C2-5 алкиленовую цепочку, образующую спирокольцо; R3 выбирают из водорода и C1-6 алкила, R4 выбирают из водорода, C1-6 алкила, карбоксигруппы, либо R3 и R4 совместно образуют C2-5 алкиленовую цепочку, образующую спирокольцо; дегидратирующим агентом, с образованием 5-цианофталида формулы
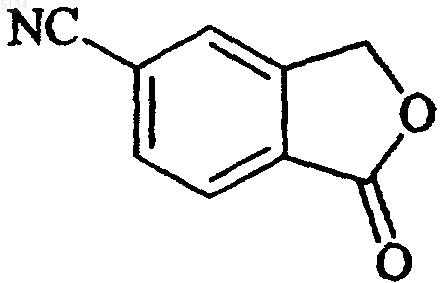 ( III)
( III)
2. Способ по п.1, отличающийся тем, что соединение формулы IV получают способом, включающим
a) взаимодействие функционального производного 5-карбоксифталида формулы V
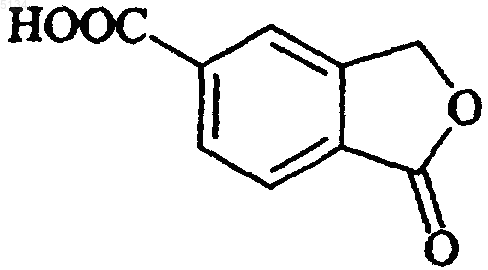 (V)
(V)
с 2-гидрокси- или 2-меркаптоэтанамином формулы VI
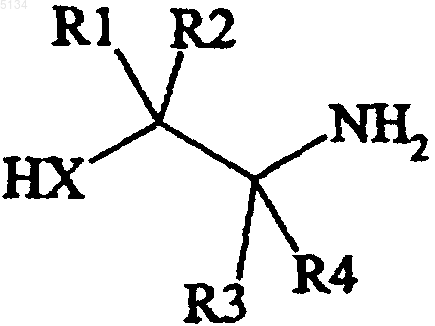 (VI)
(VI)
в которой X, R1-R4 имеют указанные выше значения,
(b) проведение дегидратации полученного таким образом амида формулы VII
 (VII)
(VII)
в которой X, R1-R4 имеют указанные выше значения, с замыканием цикла;
в результате чего получают 2-(1-оксо-1,3-дигидроизобензофуран-5-ил)оксазолин или -тиазолин формулы IV
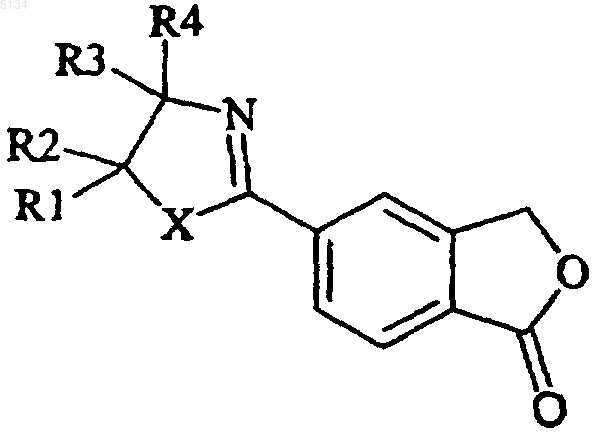 (IV)
(IV)
в которой X, R1-R4 имеют указанные выше значения.
3. Способ получения 5-цианофталида по любому из пп.1-2, отличающийся тем, что соединение формулы IV обрабатывают дегидратирующим агентом, выбранным из окситрихлорида фосфора, хлористого тионила, пятихлористого фосфора, PPA (полифосфорной кислоты) и P4O10 или реактива Вилсмайера, в комбинации с органическим основанием, предпочтительно пиридином или каталитическим количеством третичного амида.
4. Способ по п.3, отличающийся тем, что соединение формулы IV обрабатывают SOCl2 в качестве дегидратирующего агента и реакцию проводят в среде толуола, содержащего каталитическое количество N,N-диметилформамида.
5. Способ получения 5-цианофталида по любому из пп.1-2, отличающийся тем, что в нем термическое расщепление тиазолинового кольца соединения формулы IV, в которой X представляет собой S, проводят в присутствии кислорода или окисляющего агента.
6. Способ получения 5-цианофталида по любому из пп.1-2, отличающийся тем, что в нем на тиазолиновое кольцо соединения формулы IV, в которой X представляет собой S, а R4 представляет собой карбоксигруппу, воздействуют таким инициатором радикалов, как свет или пероксиды.
7. Способ по любому из пп.1-6, отличающийся тем, что R3 представляет собой метил или этил.
8. Способ по любому из пп.2-7, отличающийся тем, что дегидратирующий агент, используемый на стадии b), представляет собой SOCl2, POCl3 или PCl5, предпочтительно SOCl2.
9. Способ по любому из пп.2-8, отличающийся тем, что реакцию на стадии b) проводят в отсутствие растворителя или в присутствии такого подходящего растворителя, как толуол, сульфолан или ацетонитрил, предпочтительно в среде толуола.
10. Способ по любому из пп.8-9, отличающийся тем, что дегидратирующий агент, используемый на стадии b), представляет собой SOCl2, а реакцию проводят в среде толуола, содержащей каталитическое количество N,N-диметилформамида.
Текст
1 Настоящее изобретение относится к новому способу получения 5-цианофталида, являющегося промежуточным соединением, используемым в производстве хорошо известного антидепрессанта, циталопрама, 1-[3-(диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила. Циталопрам является хорошо известным антидепрессантом, который уже в течение ряда лет присутствует на рынке, имеющим следующую структуру: Формула I Это вещество является ингибитором повторного поглощения активного в отношении центральной нервной системы серотонина (5 гидрокситриптамина; 5-НТ) и, следовательно,обладает антидепрессантной активностью. Антидепрессантная активность рассматриваемого соединения описана в нескольких публикациях,например J. Hyttel, Prog. Neuro-Psychopharmacol.Biol. Psychiat., 1982, 6, 277-295 и A. Gravem,Acta Psychiatr. Scand., 1987, 75, 478-486. Циталопрам получают способом, описанным в US Patent4650884, согласно которому 5-цианофталид подвергают двум последовательным превращениям по реакции Гриньяра,например с участием галогенида 4-фторфенилмагния и галогенида N,N-диметиламинопропилмагния, соответственно, и полученное в результате соединениe формулы Формула II подвергают реакции замыкания цикла путем дегидратации под действием сильной серной кислоты. Энантиомеры циталопрама могут быть получены по способу, описанному в US Patent4943590, например путем разделения энантиомеров промежуточного соединения формулы II и осуществлением энантиоселективного замыкания кольца с целью получения желаемого энантиомера. Таким образом, 5-цианофталид является важным промежуточным соединением в получении циталопрама и важно получать указанный материал соответствующего качества с помощью удобного и экономичного способа. Способ получения 5-цианофталида был ранее описан в Bull. Soc. Sci. Bretagne, 1951, 26,35 и в статье Levy and Stephen, J. Chem. Soc.,1931, 867. В соответствии с этим способом 5 005134 2 аминофталид превращают в соответствующий 5-цианофталид путем диазотирования с последующей реакцией с CuCN. 5-Аминофталид получают из 4-аминофталимида двухстадийным восстановлением. Синтез некоторых алкил- и фенилнитрилов из хлорангидридов кислот описан в TetrahedronLetters, 1982, 23, 14, 1505-1508 и в Tetrahedron,1998, 54, 9281. Было установлено, что 5-цианофталид может быть получен с высоким выходом удобным и экономичным способом из 2-(1-оксо-1,3 дигидроизобензофуран-5-ил)оксазолиновых или-тиазолиновых промежуточных соединений формулы IV. Настоящее изобретение относится к способу получения 5-цианофталида, включающему обработку соединения формулы IV Формула IV в которой Х представляет собой О или S; каждый из R1-R2, независимо друг от друга, выбирают из водорода и C1-6 алкила, или R1 иR2 совместно образуют C2-5 алкиленовую цепочку, образующую спиро-кольцо; R3 выбирают из водорода и C1-6 алкила, R4 выбирают из водорода, C1-6 алкила, карбоксигруппы или ее предшественника, либо R3 и R4 совместно образуют C2-5 алкиленовую цепочку, которая образует спирокольцо; дегидратирующим агентом или, в альтернативном случае, когда Х представляет собой S, осуществляют термическое расщепление тиазолинового кольца или проводят обработку инициатором радикалов, таким как пероксид или свет, с образованием 5-цианофталида формулы Формула III В качестве дегидратирующего агента можно использовать фосфорокситрихлорид, хлористый тионил, пятихлористый фосфор, РРА (полифосфорную кислоту) и Р 4O10. Реакцию можно проводить в присутствии такого органического основания, как пиридин, или в присутствии каталитических количеств третичного амида. Предпочтительно, соединение формулы IV обрабатывают SOCl2, используемым в качестве дегидратирующего агента, и реакцию проводят в среде толуола, в присутствии каталитического количества N,N-диметилформамида. В альтернативном случае, в качестве дегидратирующего агента может использоваться реагент Vilsmeier, т.е. соединение, которое образуется посредством реакции хлорирующего агента, предпочтительно хлорангидрида кисло 3 ты, например фосгена, оксалилхлорида, хлористого тионила, оксихлорида фосфора, пятихлористого фосфора, трихлорметилхлорформиата,который сокращенно называют "дифосфгеном",или бис(трихлорметил)карбоната, который также, сокращенно, называют "трифосгеном", с таким третичным амидом, как N,N-диметилформамид или N,N-диалкилалканамид, например N,N-диметилацетамид. Классический реагент Vilsmeier представляет собой хлористый хлорметилендиметилиминий. Реагент Vilsmeier предпочтительно получают in situ добавлением хлорирующего агента к смеси, содержащей исходное производное оксазолина или тиазолина формулы IV и третичный амид. В том случае, когда Х представляет собойS, а превращение тиазолиновой группы в цианогруппу осуществляют термической трансформацией, термическое разложение соединения IV предпочтительно проводят в среде безводного органического растворителя, более предпочтительно в среде апротонного полярного растворителя, например в N,N-диметилформамиде,N,N-диметилацетамиде,диметилсульфоксиде или ацетонитриле. Температура термического разложения, при котором происходит превращение 2-тиазолильной группы в цианогруппу,составляет 60-140 С. Термическое разложение удобно проводить путем нагревания с обратным холодильником в среде подходящего растворителя, предпочтительно в среде ацетонитрила. Термическое расщепление может быть с успехом осуществлено в присутствии кислорода или окисляющего агента. Соединения формулы IV,в которой Х представляет собой S, a R4 представляет собой карбоксигруппу или ее предшественник, также могут быть превращены в циталопрам, путем обработки инициатором радикалов, как свет или пероксиды. В тексте описания и формулы изобретения термин C1-6 относится к разветвленной или неразветвленной алкильной группе, содержащей от 1 до 6 углеродных атомов, включительно,например к метилу, этилу, 1-пропилу, 2-пропилу, 1-бутилу, 2-метил-2-пропилу, 2,2-диметил-1 этилу и 2-метил-1-пропилу. В соответствии со способом настоящего изобретения 5-цианофталид может быть получен с высоким выходом, и предлагаемый способ значительно удобнее известного способа. Этот способ носит название усиленного (robust) способа. Применение CuCN исключается, вследствие чего уменьшается количество нежелательных побочных продуктов и реализуется процесс, совместимый с окружающей средой. Согласно другому аспекту настоящее изобретение относится к способу получения промежуточного соединения формулы IV, включающему а) взаимодействие функционального производного 5-карбоксифталида формулы V Формула VI в которой X, R1-R4 имеют указанные выше значения,(b) проведение дегидратации полученного таким образом амида формулы VII Формула VII в которой X, R1-R4 имеют указанные выше значения, с замыканием цикла; в результате чего получают 2-(1-оксо-1,3 дигидроизобензофуран-5-ил)оксазолин или -тиазолин формулы IV Формула IV Функциональное производное, используемое на стадии а), предпочтительно представляет собой сложный эфир, например сложный алкиловый эфир, сложный ариловый эфир, или алкиларилсложноэфирное производное 5-карбоксифталида, или хлорангидридное производное 5-карбоксифталида. Дегидратирующий агент, используемый на стадии b), предпочтительно представляет собойSOCl2. Реакцию на стадии b) проводят в отсутствие растворителя или в среде подходящего растворителя, например толуола, сульфолана или ацетонитрила. Кроме этого, при использовании растворителя может потребоваться присутствие каталитического количестваN,N-диметилформамида, особенно в том случае, когда дегидратирующий агент представляет собойSOCl2. В качестве растворителя предпочтительно использовать толуол, если необходимо, в присутствии каталитического количества N,Nдиметилформамида. Реакцию на стадии b) проводят при повышенной температуре, предпочтительно при температуре кипения растворителя. Время проведения реакции не имеет решающего значения и может быть легко установлено специалистом в данной области. 5 5-Карбоксифталид, используемый в качестве исходного материала, может быть получен способами, раскрытыми в US patent3607884 или German patent2630927, например по реакции концентрированного раствора терефталевой кислоты с формальдегидом в среде жидкогоSО 3 или в результате электрохимического гидрирования тримеллитовой кислоты. Согласно предпочтительному техническому решению способа настоящего изобретенияR3 представляет собой метил или этил. 5-Цианофталид может быть выделен традиционным способом, например в результате добавления воды, фильтрации и последующей промывки образовавшихся кристаллов. Если желательно, дополнительную очистку можно осуществлять методом перекристаллизации. В соответствии со сказанным выше согласно способу настоящего изобретения 5-цианофталид получают в результате нового применения 2-(1-оксо-1,3-дигидроизобензофуран-5-ил) оксазолинового или -тиазолинового промежуточного соединения формулы IV в качестве реагентов. В результате использования таких реагентов условия проведения реакции становятся значительно более удобными, чем описанные ранее в известном способе получения 5-цианофталида, особенно при использовании в качестве дегидратирующего агента SOCl2. Примеры Настоящее изобретение дополнительно иллюстрируется следующими примерами. Пример 1. Получение 2-(1-оксо-1,3-дигидроизобензофуран-5-ил)карбонил]амино]-2 метил-1-пропанола. 5-Карбоксифталид (267 г, 1,5 моля) добавляли к хлористому тионилу (950 мл) и затем прикапывали N,N-диметилформамид (12 мл). Полученную смесь нагревали с обратным холодильником в течение 1 ч и хлористый тионил отгоняли при пониженном давлении, после чего проводили двукратное выпаривание толуолом(2 х 50 мл) с образованием твердого остатка. Сырой хлорангидрид затем обрабатывали 1000 мл тетрагидрофурана. К раствору 2-амино-2-метил 1-пропанола (400,5 г, 4,5 моля) в тетрагидрофуране (500 мл), охлажденному до +5 С, прикапывали раствор хлорангидрида, поддерживая при этом температуру в интервале +5+10 С. После завершения добавления охлаждение прекращали и полученную смесь перемешивали в течение ночи при температуре окружающей среды. После этого смесь переливали в деионизированную воду (2000 мл) и органический растворитель отгоняли при 50 С и пониженном давлении. После охлаждения и перемешивания в течение 2 ч твердый продукт отфильтровывали и промывали деионизированной водой(2 х 100 мл). Полученный продукт сушили при 70 С в течение 36 ч при пониженном давлении. Выход: 285,3 г (76%) белого продукта с чистотой (ВЭЖХ, по площадям пиков)=90%. Спектр 1 Н ЯМР (ДМСО d-6, 500 МГц): 1,18 (3H, s), 1,32(3H, s), 3,55 (2H, s), 5,45 (2H, s), 7,88-7,98 (3H,m), 8,07 (1H, s). Пример 2. Получение 4,4-диметил-2-(1-оксо-1,3-дигидроизобензофуран-5-ил)оксазолина. К хлористому тионилу (130 мл), охлажденному до -10 С, при перемешивании прикапывали 2-(1-оксо-1,3-дигидроизобензофуран 5-ил)карбонил]амино]-2-метил-1-пропанол (85 г,0,34 моля). Температуру поддерживали в интервале -10-5 С в течение 1,5 ч, после чего охлаждение прекращали и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь охлаждали до 0 С и прикапывали тетрагидрофуран (860 мл), поддерживая температуру ниже +8 С. Полученную суспензию перемешивали в течение 2 ч при 5 С, после чего фильтровали и образовавшиеся кристаллы промывали тетрагидрофураном (150 мл). Влажное твердое вещество растворяли в деионизированной воде (400 мл) и значение рН устанавливали равным 9,1 в результате добавления 25% водного раствора аммиака. Твердое вещество отфильтровывали, промывали деионизированной водой и сушили в течение 14 ч при 50 С и пониженном давлении. Выход: 62,8 г (80%) белого продукта с чистотой (ВЭЖХ, по площадям пиков)=94%. Спектр 1H ЯМР (ДМСО d-6, 500 МГц): 1,31 (6H, s), 4,18 (2H, s), 5,44 (2H, s), 7, 9(1H, s). Пример 3. Получение 5-цианофталида. К суспензии 4,4-диметил-2-(1-оксо-1,3 дигидроизобензофуран-5-ил)оксазолина (23,1 г,0,1 моля) в хлористом тиониле (36 мл) медленно добавляли N,N-диметилформамид (5 мл). Полученный раствор нагревали с обратным холодильником в течение 1 ч и затем давали охлаждаться до комнатной температуры в течение 3 ч. Добавляли толуол (150 мл) и суспензию фильтровали и промывали толуолом (2 х 50 мл). Влажные кристаллы переносили в деионизированную воду (150 мл) и рН устанавливали равным 8,0 с помощью 25% водного раствора аммиака. Твердое вещество отфильтровывали и промывали деионизированной водой (2 х 50 мл) и затем сушили при 60 С при пониженном давлении. Выход: 11,9 г (75%) беловатого продукта с чистотой (ВЭЖХ, площади пиков)=92%. Аналитически чистый образец получали перекристаллизацией из уксусной кислоты или толуола. Спектр 1 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 5-цианофталида,включающий обработку соединения формулы IV Формула IV в которой Х представляет собой О или S; каждый из R1-R2, независимо друг от друга, выбирают из водорода и C1-6 алкила, или R1 иR2 совместно образуют С 2-5 алкиленовую цепочку, образующую спиро-кольцо; R3 выбирают из водорода и C1-6 алкила, R4 выбирают из водорода, С 1-6 алкила, карбоксигруппы, либо R3 и R4 совместно образуют С 2-5 алкиленовую цепочку,образующую спиро-кольцо; дегидратирующим агентом, с образованием 5-цианофталида формулы 2. Способ по п.1, отличающийся тем, что соединение формулы IV получают способом,включающим а) взаимодействие функционального производного 5-карбоксифталида формулы V в которой X, R1-R4 имеют указанные выше значения,(b) проведение дегидратации полученного таким образом амида формулы VII в которой X, R1-R4 имеют указанные выше значения, с замыканием цикла; в результате чего получают 2-(1-оксо-1,3 дигидроизобензофуран-5-ил)оксазолин или -тиазолин формулы IV в которой X, R1-R4 имеют указанные выше значения. 3. Способ получения 5-цианофталида по любому из пп.1-2, отличающийся тем, что соединение формулы IV обрабатывают дегидратирующим агентом, выбранным из окситрихлорида фосфора, хлористого тионила, пятихлористого фосфора, РРА (полифосфорной кислоты) и Р 4 О 10 или реактива Вилсмайера, в комбинации с органическим основанием, предпочтительно пиридином или каталитическим количеством третичного амида. 4. Способ по п.3, отличающийся тем, что соединение формулы IV обрабатывают SOCl2 в качестве дегидратирующего агента и реакцию проводят в среде толуола, содержащего каталитическое количество N,N-диметилформамида. 5. Способ получения 5-цианофталида по любому из пп.1-2, отличающийся тем, что в нем термическое расщепление тиазолинового кольца соединения формулы IV, в которой Х представляет собой S, проводят в присутствии кислорода или окисляющего агента. 6. Способ получения 5-цианофталида по любому из пп.1-2, отличающийся тем, что в нем на тиазолиновое кольцо соединения формулыIV, в которой Х представляет собой S, a R4 представляет собой карбоксигруппу, воздействуют таким инициатором радикалов, как свет или пероксиды. 7. Способ по любому из пп.1-6, отличающийся тем, что R3 представляет собой метил или этил. 8. Способ по любому из пп.2-7, отличающийся тем, что дегидратирующий агент, используемый на стадии b), представляет собойSOCl2, РОСl3 или РСl5, предпочтительно SOCl2. 9. Способ по любому из пп.2-8, отличающийся тем, что реакцию на стадии b) проводят в отсутствиe растворителя или в присутствии такого подходящего растворителя, как толуол,сульфолан или ацетонитрил, предпочтительно в среде толуола. 10. Способ по любому из пп.8-9, отличающийся тем, что дегидратирующий агент, используемый на стадии b), представляет собойSOCl2, а реакцию проводят в среде толуола, содержащей каталитическое количество N,Nдиметилформамида.
МПК / Метки
МПК: C07D 307/87
Метки: 5-цианофталида, получения, способ
Код ссылки
<a href="https://eas.patents.su/5-5134-sposob-polucheniya-5-cianoftalida.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 5-цианофталида</a>
Предыдущий патент: Полисахариды с антитромботической активноcтью, содержащие по меньшей мере одну ковалентную связь с биотином или производным биотина
Следующий патент: Новое применение таксоидных производных
Случайный патент: Седельно-сцепное устройство









