Полисахариды с антитромботической активноcтью, содержащие по меньшей мере одну ковалентную связь с биотином или производным биотина
Номер патента: 5133
Опубликовано: 30.12.2004
Авторы: Эрбер Жан-Марк, Дюшоссуа Филипп, Птиту Морис, Сави Пьер
Формула / Реферат
1. Синтетические полисахариды с антитромботической активностью и их фармацевтически приемлемые соли, отличающиеся тем, что они имеют по меньшей мере одну ковалентную связь с биотином или производным биотина.
2. Полисахариды по п.1 формулы
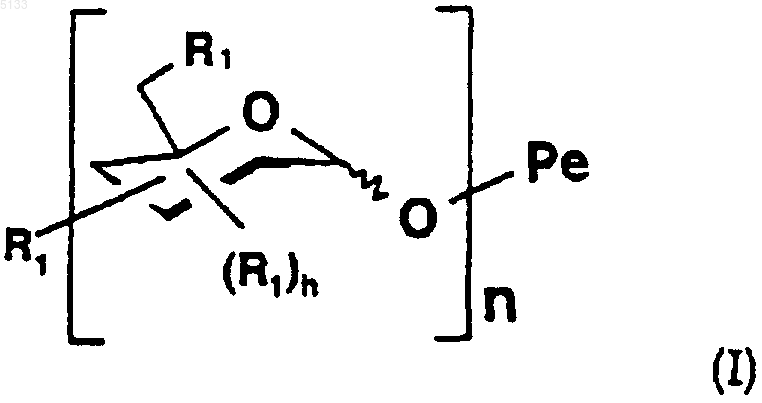
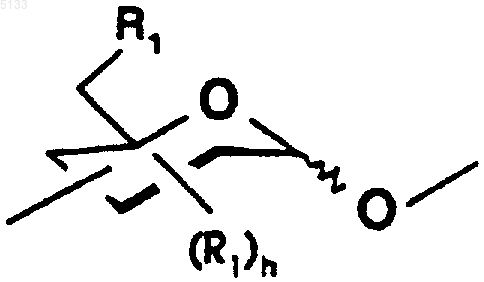
где волнистая линия обозначает связь, расположенную либо ниже, либо выше плоскости кольца пиранозы,

Po обозначает полисахарид, содержащий n одинаковых или разных моносахаридных единиц, связанных с Pe через свой аномерный углерод,
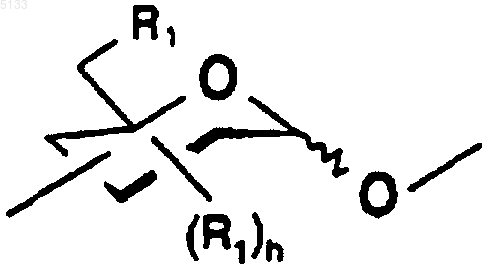
является схематическим представлением моносахаридной единицы с пиранозной структурой, выбранной из гексоз, пентоз и соответствующих дезоксисахаров, причем эта единица связана с другой моносахаридной единицей через свой аномерный углерод и гидроксильные группы этой единицы замещены одинаковыми или разными группами R1, причем R1 является таким, как определено ниже,
Pe представляет собой пентасахарид структуры
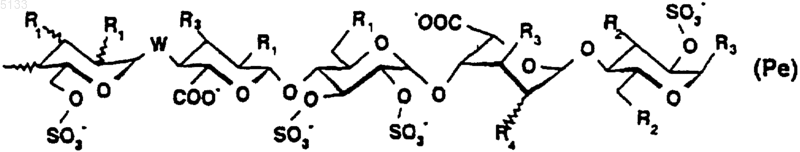
h равно 1 или 2,
n является целым числом и может принимать любое значение от 0 до 25,
R1 представляет собой связь -T-Biot, (C1-C6)алкоксигруппу или группу -OSO3-,
R2 представляет собой связь -T-Biot, (C1-C6)алкоксигруппу или группу -OSO3-,
R3 представляет собой связь -T-Biot или (C1-C6)алкоксигруппу,
R4 представляет собой связь -T-Biot, (C1-C6)алкоксигруппу или группу -OSO3- или же R4 является мостиком -O-CH2-, причем группа -CH2- связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце;
при этом подразумевается, что по меньшей мере один из заместителей R1, R2, R3 или R4 представляет собой группу -T-Biot,
W представляет собой атом кислорода или метиленовую группу,
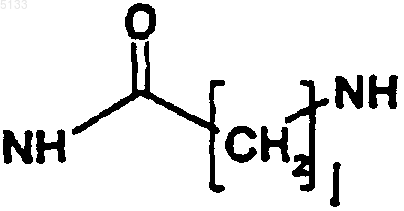
T представляет собой одну из связей, выбранную из NH,
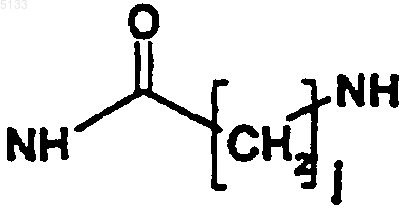
или
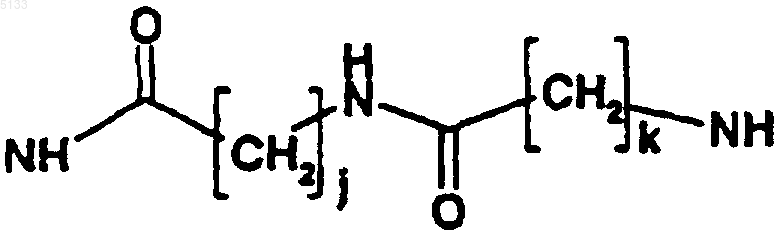
где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10;
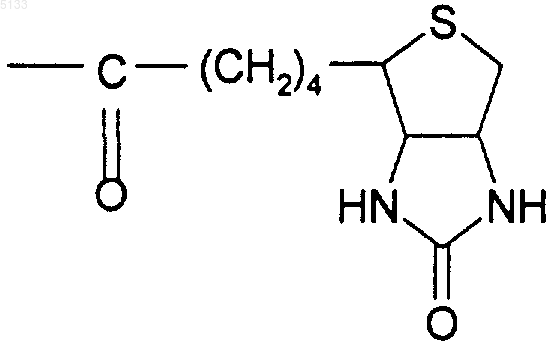
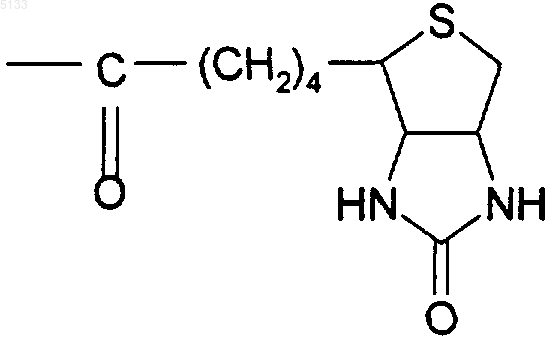
Biot представляет собой группу
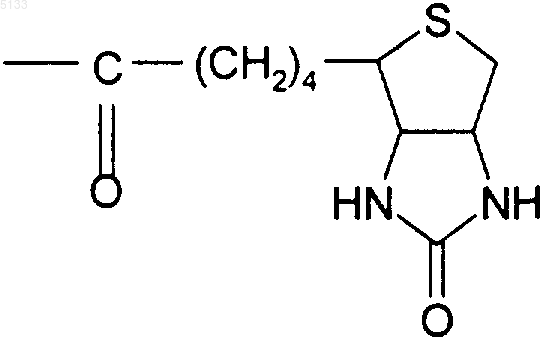
и их фармацевтически приемлемые соли.
3. Полисахариды по любому из пп.1 и 2 формулы (I.1)
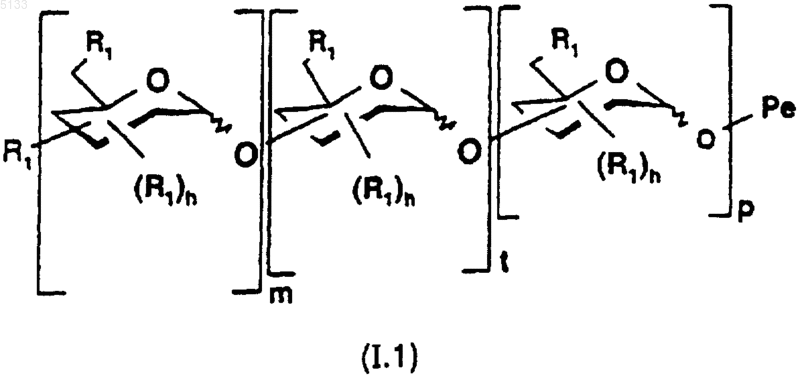
где
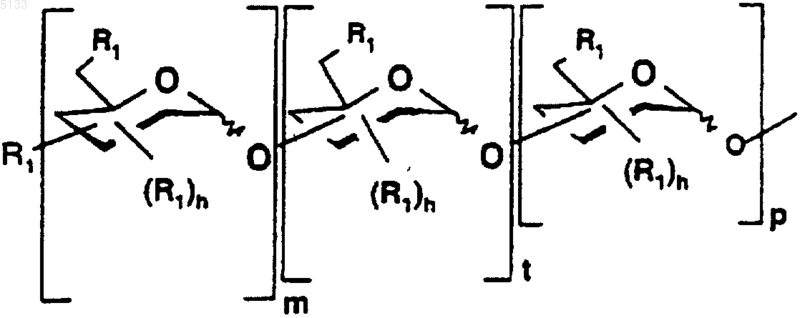
обозначает специфическое семейство полисахаридов Po, которые связаны с Pe через свой аномерный углерод, как определено для (I),
является таким, как определено для (I),
группы R1 являются такими, как определено для (I) и для одного и того же моносахарида, могут быть одинаковыми или разными;
моносахарид, присутствующий в [ ]m, повторяется m раз, моносахарид, присутствующий в [ ]t, повторяется t раз и моносахарид, присутствующий в [ ]p, повторяется p раз,
m является целым числом в пределах от 1 до 5, t является целым числом в пределах от 0 до 24 и p является целым числом в пределах от 0 до 24, причем подразумевается, что 1_ m+t+p_ 25,
и их фармацевтически приемлемые соли.
4. Полисахариды по п.3, отличающиеся тем, что только один из заместителей R1, R2, R3 или R4 представляет собой связь -T-Biot, где T и Biot являются такими, как определено для (I).
5. Гексадекасахариды по любому из пп.1-4 формулы (I.2)
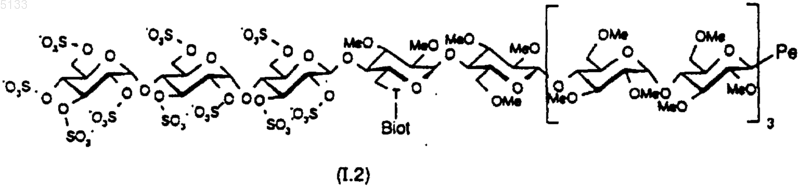
где T представляет собой одну из связей, выбранную из NH,

или
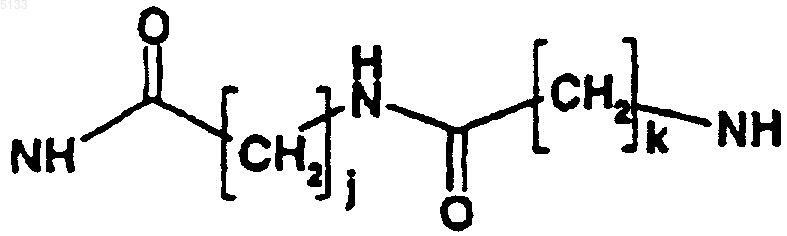
где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10;
Biot представляет собой группу
Pe представляет собой пентасахарид структуры
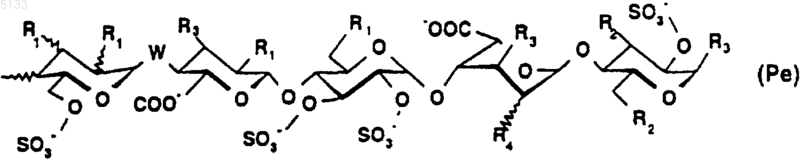
где R1 представляет собой (C1-C6)алкоксигруппу или группу -OSO3-,
R2 представляет собой (C1-C6)алкоксигруппу или группу -OSO3-,
R3 представляет собой (C1-C6)алкоксигруппу,
R4 представляет собой (C1-C6)алкоксигруппу или группу -OSO3- или же R4 является мостиком -O-CH2-, причем группа -CH2- связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце;
W представляет собой атом кислорода или метиленовую группу,
и их фармацевтически приемлемые соли.
6. Пентасахариды по любому из пп.1 и 2 формулы (I.3)
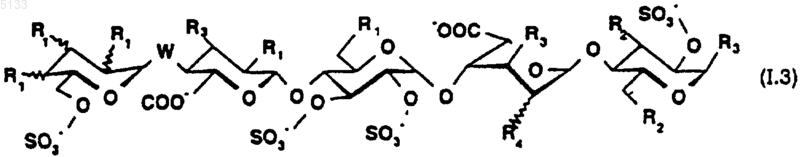
где R1, R2, R3, R4 и W являются такими, как определено для (I),
и их фармацевтически приемлемые соли.
7. Пентасахариды по п.6, отличающиеся тем, что только один из заместителей R1, R2, R3 или R4 представляет собой связь -T-Biot, где T и Biot являются такими, как определено для (I).
8. Пентасахариды по любому из пп.6 и 7 формулы (I.3) формулы (I.4)
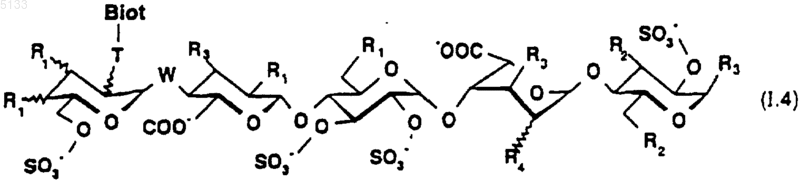
где T представляет собой одну из связей, выбранную из
NH,
или
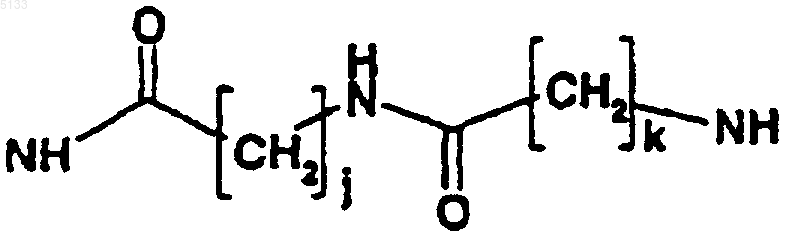
где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10;
Biot представляет собой группу
R1 представляет собой (C1-C6)алкоксигруппу или группу -OSO3-,
R2 представляет собой (C1-C6)алкоксигруппу или группу -OSO3-,
R3 представляет собой (C1-C6)алкоксигруппу,
R4 представляет собой (C1-C6)алкоксигруппу или группу -OSO3- или же R4 является мостиком -O-CH2-, причем -CH2- группа связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце,
W представляет собой атом кислорода или метиленовую группу,
и их фармацевтически приемлемые соли.
9. Полисахариды по любому из пп.1 и 2, выбранные из
метил-(2,3,4,6-тетра-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-сульфонато-b-D-глюкопиранозил)-(1R 4)-(6-биотинамидо-6-дезокси-2,3-ди-O-метил-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R 4)-[(2,3,6-три-O-метил-a-D-глюкопиранозил)-(1R 4)-O-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R 4)]3-(6-O-сульфонато-2,3-ди-O-метил-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-b-D-глюкопиранозилуроновая кислота)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-a-L-идопиранозилуроновая кислота)-(1R 4)-2,3,6-три-O-сульфонато-a-D-глюкопиранозид, натриевая соль,
метил-(2,3,4,6-тетра-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-сульфонато-b-D-глюкопиранозил)-(1R 4)-(6-[6-(биотинамидо)гексамидо]-6-дезокси-2,3-ди-O-метил-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R 4)-[(2,3,6-три-O-метил-a-D-глюкопиранозил)-(1R 4)-O-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R 4)]3-(6-O-сульфонато-2,3-ди-O-метил-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-b-D-глюкопиранозилуроновая кислота)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-a-L-идопиранозилуроновая кислота)-(1R 4)-2,3,6-три-O-сульфонато-a-D-глюкопиранозид, натриевая соль,
метил-(2,3,4,6-тетра-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-сульфонато-b-D-глюкопиранозил)-(1R 4)-(6-[6-(6-биотинамидогексамидо)гексамидо]-6-дезокси-2,3-ди-O-метил-a-D-глюкопиранозил)-(1R 4)-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R 4)-[(2,3,6-три-O-метил-a-D-глюкопиранозил)-(1R 4)-O-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R 4)]3-(6-O-сульфонато-2,3-ди-O-метил-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-b-D-глюкопиранозилуроновая кислота)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-a-L-идопиранозилуроновая кислота)-(1R 4)-2,3,6-три-O-сульфонато-a-D-глюкопиранозид, натриевая соль,
метил-(2-биотинамидо-2-дезокси-3,4-ди-O-метил-6-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-b-D-глюкопиранозилуроновая кислота)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-a-L-идопиранозилуроновая кислота)-2,3,6-(1R 4)-(три-O-сульфонато-a-D-глюкопиранозид, натриевая соль,
метил-(2-[6-(6-биотинамидогексамидо)гексамидо]-2-дезокси-3,4-ди-O-метил-6-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-b-D-глюкопиранозилуроновая кислота)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-a-L-идопиранозилуроновая кислота)-(1R 4)-2,3,6-три-O-сульфонато-a-D-глюкопиранозид, натриевая соль,
метил-(2-[6-(6-биотинамидогексамидо)гексамидо]-2-дезокси-3,4-ди-O-метил-6-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-b-D-глюкопиранозилуроновая кислота)-(1R 4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R 4)-(2,3-ди-O-метил-a-L-идопиранозилуроновая кислота)-(1R 4)-2,3,6-три-O-сульфонато-a-D-глюкопиранозид, натриевая соль.
10. Фармацевтические композиции, содержащие в качестве активного начала полисахарид по любому из пп.1-9, возможно, в комбинации с одним или более чем одним инертным и подходящим эксципиентом.
11. Применение фармацевтических композиций по п.10 при патологиях, являющихся результатом модификации гомеостаза системы коагуляции, проявляющейся при нарушениях сердечно-сосудистой и церебрально-васкулярной системы, таких как тромбоэмболические нарушения, связанные с атеросклерозом и диабетом, например нестабильная стенокардия, апоплексия, рестеноз после ангиопластики, эндартерэктомия или введение эндоваскулярных протезов, или тромбоэмболические нарушения, связанные с ретромбозом после тромболиза, с инфарктом, с деменцией ишемического происхождения, с периферическими артериальными заболеваниями, с гемодиализом или с предсердными фибрилляциями, во время использования сосудистых протезов для аортокоронарного шунтирования, при лечении или предупреждении тромбоэмболических патологий венозного происхождения, таких как легочные эмболии, для предупреждения или лечения тромботических осложнений, наблюдаемых после хирургических операций, роста опухолей или нарушений коагуляции, вызываемых бактериальными, вирусными или ферментными активаторами.
12. Применение полисахарида по любому из пп.1-9 для покрытия протезов.
13. Применение полисахарида по любому из пп.1-9 в качестве адъювантов во время эндартерэктомии, осуществляемой с использованием пористых баллонов.
14. Способ нейтрализации полисахаридов по любому из пп.1-9, включающий взаимодействие указанных полисахаридов с авидином или стрептавидином.
15. Применение авидина или стрептавидина в изготовлении лекарств, предназначенных для нейтрализации полисахаридов по любому из пп.1-9.
Текст
1 Настоящее изобретение относится к новым синтетическим олиго- и полисахаридам, имеющим по меньшей мере одну ковалентную связь с биотином или производным биотина и обладающим антикоагулянтной и антитромботической фармакологической активностью гепарина. Гепарин катализирует, в частности через антитромбин III (AT III), ингибирование двух ферментов, участвующих в каскаде коагуляции крови, а именно фактора Ха и фактора IIа (или тромбина). Препараты, содержащие низкомолекулярные гепарины (LMWHs), содержат цепи,образованные 4-30 моносахаридами, и обладают свойством действовать более селективно в отношении фактора Ха, чем в отношении тромбина. Известно, что ингибирование фактора Ха требует присоединения гепарина к AT III через антитромбинсвязывающий домен (Домен-А) и что ингибирование фактора IIа (тромбина) требует присоединения к AT III через Домен-А и к тромбину через менее хорошо охарактеризованный связывающий домен (Домен-Т). Известны синтетические олигосахариды,соответствующие домену Домен-А гепарина. Они раскрыты, например, в патентах ЕР 84999 и ЕР 529715, в патентной заявке, опубликованной под номером WO 99/36428, и в публикацииBioorg. Med. Chem., 1998, 6, 1509-1516. Эти синтетические олигосахариды обладают свойством селективного ингибирования, через антитромбин III, фактора Ха коагуляции без какоголибо действия в отношении тромбина. Они проявляют антитромботическую активность при венозном тромбозе. Синтетические олигосахариды, способные ингибировать тромбин или фактор Ха через активацию AT III, раскрыты в патентных заявках,опубликованных под номерами WO 98/03554 иWO 99/36443. В этих патентных заявках раскрыты новые биологически активные сульфатированные и алкилированные производные полисахаридов. Они являются, в частности, антикоагулянтами и антитромботическими средствами. В частности,было показано, что эти сульфатированные и алкилированные полисахариды могут быть мощными антитромботическими средствами и антикоагулянтами в зависимости от расположения алкильных групп и сульфатных групп, которые несет глюцидная основная цепь. Более обобщенно, было обнаружено, что путем получения полисахаридных последовательностей можно точно регулировать активности GAGs(глюкозаминоглюканового) типа с целью получения очень активных продуктов, проявляющих антикоагулянтные и антитромботические фармакологические свойства гепарина. По сравнению с гепарином их преимущество в том, что они имеют специфическую структуру и не взаимодействуют с тромбоцитарным фактором 4, фактором тромбоцитопенических эффектов гепарина. 2 Однако применение в терапевтическом лечении человека некоторых продуктов, раскрытых в патентных заявках, опубликованных под номерами WO 98/03554 и WO 99/36443, и в патенте ЕР 529715, может оказаться проблематичным, в частности, если эти продукты имеют большие периоды полувыведения. В случае предупреждения и лечения тромбоза указанными выше продуктами необходимо восстанавливать или поддерживать текучесть крови, одновременно предотвращая вызываемое ими кровотечение. Это необходимо, поскольку хорошо известно, что у пациента, находящегося на лечении, кровотечение может быть инициировано любой случайной причиной. Пациенту, находящемуся на антитромботическом лечении, может также потребоваться хирургическое вмешательство. Кроме того, во время некоторых хирургических операций могут применяться антикоагулянты в высоких дозах для предотвращения коагуляции крови, и в конце операции их необходимо нейтрализовать. Следовательно, полезно иметь антитромботические агенты, которые в любое время могут быть нейтрализованы в целях прекращения антикоагулянтного действия. В действительности, известные синтетические олигосахариды, описанные выше, не могут быть легко нейтрализованы известными антидотами для гепарина или LMWHs, включая протаминсульфат. Настоящее изобретение относится к новым синтетическим полисахаридам со структурой,аналогичной структуре соединений, раскрытых в патентных заявках, опубликованных под номерами WO 98/03554 и WO 99/36443, и в патенте ЕР 529715: структуры синтетических олигосахаридов, которые являются объектом данного изобретения, модифицированы таким образом,что они имеют ковалентную связь с биотином(гексагидро-2-оксо-1H-тиено[3,4-d]имидазол-4 пентановой кислотой) или с производным биотина. Оказывается, и это неожиданно, что введение биотина или производного биотина не модифицирует фармакологическую активность полисахаридов. Действительно, новые полисахариды, которые являются объектом данного изобретения, обладают антитромботической активностью, сравнимой с активностью олигосахаридов, известных из уровня техники. Однако они дополнительно имеют преимущество в том, что в критических ситуациях их можно быстро нейтрализовать специфическими антидотами. Этими специфическими антидотами являются авидин (The Merck Index, Twelfth edition, 1996, M. N. 920, страницы 151-152) или стрептавидин, два тетрамерных белка с относительными массами, равными приблизительно 66000 и 60000 Да, которые имеют очень высокое сродство к биотину. В общем, данное изобретение относится к синтетическим полисахаридам с антитромботической активностью, имеющим по меньшей ме 3 ре одну ковалентную связь с биотином или производным биотина. В качестве производного биотина можно упомянуть производные биотина, приведенные в каталоге Pierce, 1999-2000, страницы 62-81,например 6-биотинамидогексаноат 4 В частности, объектом настоящего изобретения являются полисахариды формулы (I) где волнистая линия обозначает связь, расположенную либо ниже, либо выше плоскости кольца пиранозы,или 6-(6-биотинамидогексанамидо)гексаноат Ро обозначает полисахарид, содержащий n одинаковых или разных моносахаридных единиц,связанных с Ре через свой аномерный углерод,или 2-биотинамидоэтантиол или соединения следующих формул: является схематическим представлением моносахаридной единицы с пиранозной структурой, выбранной из гексоз, пентоз и соответствующих дезоксисахаров, причем эта единица связана с другой моносахаридной единицей через свой аномерный углерод, и гидроксильные группы этой единицы замещены одинаковыми или разными группами R1, причем R1 является таким, как определено ниже,Ре представляет собой пентасахарид структурыh равно 1 или 2,n является целым числом и может принимать любое значение от 0 до 25,R1 представляет собой связь -T-Biot, (С 1 С 6)алкоксигруппу или группу -ОSО 3-,R2 представляет собой связь -T-Biot, (С 1 С 6)алкоксигруппу или группу -ОSО 3-,R3 представляет собой связь -T-Biot или(С 1-С 6)алкоксигруппу,R4 представляет собой связь -T-Biot, (С 1 С 6)алкоксигруппу или группу -ОSО 3- или же R4 является мостиком -O-CH2-, причем группа -СН 2 связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце; при этом подразумевается, что по меньшей мере один из заместителей R1, R2, R3 или R4 представляет собой группу -T-Biot,W представляет собой атом кислорода или метиленовую группу,Т представляет собой одну из связей, выбранную из NH, или где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10;Biot представляет собой группу где и их фармацевтически приемлемые соли. Как указано выше, следует отметить, что вообще в настоящем описании волнистая линия обозначает связь, расположенную либо ниже,либо выше плоскости кольца пиранозы. Моносахариды, присутствующие в Ро, могут быть одинаковыми или могут отличаться друг от друга, и межгликозидные связи могут бытьилитипа. Эти моносахариды выбирают предпочтительно из D или L гексоз: алозы, альтрозы, глюкозы, маннозы, галозы, идозы, галактозы или талозы (в этом случае h=2), или из D или L пентоз: рибозы, арабинозы, ксилозы или ликсозы (в этом случае h=2). Также можно использовать другие моносахариды, такие как, например, дезоксисахара (h=1 и/или -CH2R1=СН 3). Полисахаридная часть Ро может состоять из 0-25 алкилированных и ди- или трисульфатированных моносахаридных единиц. Полисахаридная часть Ро может также состоять из 0-25 алкилированных и моно- или дисульфатированных моносахаридных единиц. Полисахаридная часть Ро может состоять из 0-25 незаряженных, и/или частично заряженных, и/или полностью заряженных алкилированных моносахаридных единиц. Заряженные или незаряженные единицы могут быть рассредоточены вдоль цепи или, с другой стороны, они могут быть сгруппированы в заряженные или незаряженные сахаридные домены. Связи между единицами могут быть 1,2; 1,3; 1,4; 1,5; 1,6; иилитипа. В настоящем описании выбор сделан таким образом, чтобы представить 1C4 конформацию для L-идуроновой кислоты и 4 С 1 конформацию для D-глюкуроновой кислоты, однако,общеизвестно, что в общем случае в растворе конформация моносахаридных единиц меняется. Так, L-идуроновая кислота может иметь 1 С 4, 2S0 или 4C1 конформацию. Согласно одному из своих аспектов данное изобретение относится к полисахаридам формулы (I.1) обозначает специфическое семейство полисахаридов Ро, которые связаны с Ре через свой аномерный углерод, как определено для (I), является таким, как определено для (I),группы R1 являются такими, как определено для (I), и для одного и того же моносахарида могут быть одинаковыми или разными; моносахарид, присутствующий в [ ]m, повторяется m раз, моносахарид, присутствующий в [ ]t, повторяется t раз, и моносахарид, присутствующий в [ ]р, повторяется р раз,m является целым числом в пределах от 1 до 5, t является целым числом в пределах от 0 до 24 и р является целым числом в пределах от 0 до 24, причем подразумевается, что 1m+t+р 25,и их фармацевтически приемлемым солям. Среди этих полисахаридов формулы (I.1) полисахариды, в которых только один из заместителей R1, R2, R3 или R4 представляет собой связь T-Biot, где Т и Biot такие, как определено для (I), и их фармацевтически приемлемые соли составляют еще один аспект изобретения. Согласно конкретному аспекту данное изобретение относится к гексадекасахаридам формулы (I.2) где Т представляет собой одну из связей, выбранную из NH, или где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10; где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10;-O-СН 3-, причем группа -СН 2- связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце;W представляет собой атом кислорода или метиленовую группу,и их фармацевтически приемлемым солям. Согласно еще одному из своих аспектов данное изобретение относится к пентасахаридам формулы (I.3) где R1, R2, R3, R4 и W являются такими, как определено для (I), и к их фармацевтически приемлемым солям. Среди этих пентасахаридов формулы (I.3) пентасахариды, в которых только один из заместителей R1, R2, R3 или R4 представляет собой связь -T-Biot, где Т и Biot являются такими, как определено для (I), и их фармацевтически приемлемые соли составляют другой аспект данного изобретения. Среди этих пентасахаридов формулы (I.3) другим объектом данного изобретения является пентасахарид формулы (I.4) где Т представляет собой одну из связей, выбранную из NH, или-O-CH2-, причем -CH2- группа связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце,W представляет собой атом кислорода или метиленовую группу,и их фармацевтически приемлемые соли. Согласно другому аспекту данное изобретение относится к следующим полисахаридам: метил (2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонато-D-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(6-биотинамидо-6-дезокси-2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-[(2,3,6-три-O-метилD-глюкопиранозил)-(14)-O-(2,3,6-три-O-метилDглюкопиранозил)-(14)]3-(6-O-сульфонато-2,3 ди-O-метилD-глюкопиранозил)-(14)-(2,3 ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-OсульфонатоD-глюкопиранозид, натриевая соль,метил (2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонато-D-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(6-[6-(биотинамидо)гексамидо]-6-дезокси-2,3-ди-O-метил-D-глюкопиранозил)-(14)-(2,3,6-три-O-метил-D-глюкопиранозил)-(14)-[(2,3,6-три-O-метил-D-глюкопиранозил)-(14)-O-(2,3,6-три-O-метилD-глюкопиранозил)-(14)]3-(6-О-сульфонато)-2,3-ди-О-метилD-глюкопиранозил)-(14)(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-OсульфонатоD-глюкопиранозид, натриевая соль, 9 метил (2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонато-D-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(6-[6-(6-биотинамидогексамидо)гексамидо]-6-дезокси-2,3-диO-метилD-глюкопиранозил)-(14)-(2,3,6-триO-метилD-глюкопиранозил)-(14)-[(2,3,6-триO-метилD-глюкопиранозил)-(14)-O-(2,3,6 три-O-метилD-глюкопиранозил)-(14)]3-(6O-сульфонато-2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-OметилL-идопиранозилуроновая кислота)-(14)2,3,6-три-O-сульфонатоD-глюкопиранозид,натриевая соль,метил (2-биотинамидо-2-дезокси-3,4-ди-Oметил-6-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)2,3,6-три-O-сульфонатоD-глюкопиранозид,натриевая соль,метил (2-[N-(6-биотинамидогексаноил)]-2 дезокси-3,4-ди-O-метил-6-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-триO-сульфонатоD-глюкопиранозил)-(14)-(2,3 ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-O-сульфонатоD-глюкопиранозид, натриевая соль,метил (2-[6-(6-биотинамидогексамидо)гексамидо]-2-дезокси-3,4-ди-O-метил-6-O-сульфонато-D-глюкопиранозил)-(14)-(2,3-ди-O-метил-D-глюкопиранозилуроновая кислота)-(14)(2,3,6-три-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-O-сульфонато-D-глюкопиранозид, натриевая соль. Данное изобретение охватывает полисахариды в их кислотной форме или в форме любой из их фармацевтически приемлемых солей. В кислотной форме функциональные группы -СООи -SО 3- присутствуют соответственно в -СООН и -SО 3 Н форме. Подразумевается, что термин "фармацевтически приемлемая соль полисахаридов по изобретению" означает полисахарид, в котором одна или более чем одна из функциональных групп -СОО- и/или -SО 3- связана ионной связью с фармацевтически приемлемым катионом. Предпочтительными солями по изобретению являются те соли, для которых катион выбран из катионов щелочных металлов, и, еще более предпочтительно, те соли, катионом для которых является Na+ или K+. Соединения указанной выше формулы (I) также включают те соединения, в которых один или более чем один атом водорода или углерода 10 заменен его радиоактивным изотопом, например тритием или углеродом-14. Такие меченые соединения используют в научно-исследовательских, метаболических или фармакокинетических исследованиях и в биохимических анализах в качестве лигандов. В основе способа получения соединений по данному изобретению лежит использование основных ди- или олигосахаридных синтонов,полученных, как сообщается в вышеуказанной литературе. В частности, следует упомянуть патенты или патентные заявки ЕР 300099, ЕР 529715, ЕР 621282 и ЕР 649854 и документы С.Engl., 1993, 32, 1671-1690. Эти синтоны последовательно подвергают реакциям сочетания друг с другом, с тем чтобы получить полностью защищенный эквивалент полисахарида по данному изобретению. Этот защищенный эквивалент затем превращают в соединение по изобретению. Один из основных синтонов, упомянутых выше, содержит конкретную защищенную функциональную группу, что делает возможным последующее введение биотина или производного биотина, например латентную аминную функциональную группу в форме азидогруппы или защищенную в форме N-фталимидогруппы. В упомянутых выше реакциях сочетания"донорный" ди- или олигосахарид, активированный по его аномерному углероду, взаимодействует с "акцепторным" ди- или олигосахаридом, имеющим свободный гидроксил. Настоящее изобретение относится к способу получения соединений формулы (I), отличающемуся тем, что на первой стадии синтезируют полностью защищенный эквивалент целевого полисахарида (I), содержащий защищенный предшественник домена Ре, удлиненный по его невосстановительному концу защищенным предшественником сульфатированного полисахарида Ро, и один из этих предшественников содержит, в частности, соответственно защищенную аминную функциональную группу для последующего введения биотина или производного биотина; на второй стадии вводят и/или демаскируют отрицательно заряженные группы; на третьей стадии снимают защиту с аминной функциональной группы, а затем вводят биотин или производное биотина. Синтез Ре проводят по методикам, описанным, в частности, в патентных заявках, опубликованных под номерами WO 98/03554 и WO 99/36443, и в литературе (приведенной выше). Полисахаридную часть, которая является предшественником Ро, синтезируют по реакциям,хорошо известными специалистам в данной области техники, с использованием методов синтеза олигосахаридов (G.J. Boons, Tetrahedron, 1996,52, 1095-1121, WO 98/03554 и WO 99/36443) или олигосахарида, когда олигосахарид, который является донором гликозидной связи, подвергают реакции сочетания с олигосахаридом, который 11 является акцептором гликозидной связи, с получением в результате другого олигосахарида,размеры которого равны сумме размеров двух реагирующих веществ. Эту последовательность повторяют до тех пор, пока не получат целевое соединение формулы (I). Природа и параметры заряда конечного соединения определяют природу химических веществ, используемых на различных стадиях синтеза, в соответствии с правилами, общеизвестными для специалиста в данной области техники. В частности, можно сослаться,например, на С. van Boeckel, and M. Petitou,Angew Chem. Int. Ed. Engl., 1993, 32, 1671-1690 или на Н. Paulsen, "Advances in selective chemicalChem. Int. Ed. Engl., 21, 155-173 (1982). Соединения по изобретению получают из их полностью защищенных полисахаридных предшественников, используя следующую последовательность реакций: снимают защиту со спиртовых функциональных групп, которые потом должны быть превращены в O-сульфогруппу и карбоновые кислоты, путем удаления защитных групп, использованных в процессе получения основной цепи,после этого вводят сульфогруппы,снимают защиту с аминной функциональной группы, что делает возможным введение биотина или производного биотина,вводят биотин или производное биотина обычной реакцией сочетания амин/кислота. Соединения по изобретению легко могут быть получены с использованием различных стратегий синтеза олигосахаридов, известных специалистам в данной области техники. Способ, описанный выше, является предпочтительным способом по изобретению. Однако соединения формулы (I) могут быть получены другими способами, хорошо известными в химииcахаров, описанными, например, в Monosaccharides,their chemistry and their roles in natural products,P.M. Collins and R.J. Ferrier, J. WileySons, 1995,и в G.J. Boons, Tetrahedron, 1996, 52, 1095-1121. Пентасахариды Ре могут быть получены соответственно из дисахаридных синтонов способом, описанным в публикации С. van Boeckeland М. Petitou, Angew. Chem. Int. Ed. Engl., 1993,32, 1671-1690. Защитные группы, используемые в способе получения соединений (I), являются защитными группами, обычно используемыми в химии cахаров,например в Protective Groups in Organic Synthesis,Т.W. Greene, John WileySons, New York, 1981. Защитные группы предпочтительно выбирают из, например, ацетильной, галогенометильной, бензоильной, левулинильной, бензильной,замещенной бензильной, возможно, замещенной тритильной, тетрагидропиранильной, аллильной,пентенильной,трет-бутилдиметилсилильной(tBDMS) или триметилсилилэтильной групп. Активирующими группами являются группы,обычно используемые в химии сахаров в соот 005133 12 ветствии, например, c G.J. Boons, Tetrahedron, 1996,52, 1095-1121. Эти активирующие группы выбирают, например, из имидатов, тиогликозидов,пентенилгликозидов, ксантатов, фосфитов или галогенидов. Что касается способа, которым биотин связывают с олигосахаридом, и природы производного биотина, химическая литература предлагает другие возможности, которые могут быть реализованы при помощи ряда защитных групп,хорошо известных специалистам в данной области техники. Предпочтительным будет использование аминной функциональной группы,или тиольной функциональной группы, или карбоновокислотной функциональной группы,или альдегидной функциональной группы, которая будет взаимодействовать с производным биотина, содержащим реакционную группу типа активированной сложноэфирной, малеимидной, йодацетильной или типа первичного амина,причем взаимодействие протекает согласно условиям, описанным в литературе (сравни SavagePierce Chemical Company, 1992). Способ, описанный выше, дает возможность получать соединения по изобретению в форме солей. Чтобы получить соответствующие кислоты, соединения по изобретению в форме солей приводят в контакт с катионообменной смолой в кислотной форме. Соединения по изобретению в форме кислот потом можно нейтрализовать основанием с получением желательной соли. Для получения солей соединений формулы (I) можно использовать любое неорганическое или органическое основание, которое дает фармацевтически приемлемые соли с соединениями формулы (I). В качестве основания предпочтительно использовать гидроксид натрия, гидроксид калия, гидроксид кальция или гидроксид магния. Предпочтительными солями являются натриевая и калиевая соль соединений формулы (I). Были проведены биохимические и фармакологические исследования соединений по изобретению. Общую антитромботическую активность этих продуктов и их нейтрализацию исследовали на модели венозного тромбоза, предусматривающей инъекцию тканевого фактора с последующим стазом полой вены крыс, как описаноJ.-M. Herbert et al., Blood, 1998, 91, 4197-4205. В этой модели после внутривенной инъекции 0,130 ммоль/кг соединений достигается 60% ингибирование тромбоза. Инъекция авидина в молярном соотношении 1 к 1000 значительно снижает антитромботический эффект этих соединений, причем достигается снижение более чем на 50%. Таким же путем прогеморрагическая активность соединений нейтрализуется инъекцией авидина в указанных выше дозах. Так же действие олигосахаридов на кровообращение,измеренное по анти-Ха активности и/или анти-IIа активности, нейтрализуется инъекцией авидина. 13 Таким образом, другим объектом настоящего изобретения является способ использования авидина или стрептавидина, отличающийся тем,что он делает возможной нейтрализацию полисахаридов согласно изобретению. Авидин или стрептавидин можно использовать для изготовления лекарств, предназначенных для нейтрализации полисахаридов по настоящему изобретению. Благодаря своей биохимической и фармацевтической активности олигосахариды по настоящему изобретению представляют собой чрезвычайно полезные лекарства. Их токсичность полностью совместима с данным применением. Они также очень стабильны и, следовательно, особенно подходят для составления активного начала запатентованных фармацевтических продуктов. Их можно применять при различных патологиях, являющихся результатом модификации гомеостаза системы коагуляции, проявляющейся при нарушениях сердечно-сосудистой и церебрально-васкулярной системы, таких как тромбоэмболические нарушения, связанные с атеросклерозом и диабетом, например нестабильная стенокардия, апоплексия, рестеноз после ангиопластики,эндартерэктомия или введение эндоваскулярных протезов, или тромбоэмболические нарушения,связанные с ретромбозом после тромболиза, с инфарктом, с деменцией ишемического происхождения, с периферическими артериальными заболеваниями, с гемодиализом или с предсердными фибрилляциями, во время использования сосудистых протезов для аортокоронарного шунтирования. Кроме того, эти продукты можно применять для лечения или предупреждения тромбоэмболических патологий венозного происхождения, таких как легочные эмболии. Их можно применять для предупреждения или для лечения тромботических осложнений, наблюдаемых, например, после хирургических операций, роста опухолей или нарушений коагуляции, вызываемых бактериальными, вирусными или ферментными активаторами. В случае их применения во время введения протезов, соединениями по изобретению можно покрывать протезы и таким образом делать их гемосовместимыми. В частности, их можно присоединять к внутрисосудистым протезам (стентам). В этом случае, их можно химически модифицировать путем введения подходящего ответвления по невосстановительному или восстановительному концу, как раскрыто в ЕР 649854. Соединения по настоящему изобретению можно применять также в качестве адъювантов во время эндартерэктомии, осуществляемой с использованием пористых баллонов. Соединения по изобретению можно использовать в изготовлении лекарств, предназначенных для лечения вышеперечисленных заболеваний. Соответственно, согласно еще одному аспекту объектом настоящего изобретения является фармацевтическая композиция, содержащая в качестве активного начала синтетический полисахарид по изобретению или одну из его 14 фармацевтически приемлемых солей, возможно,в комбинации с одним или более чем одним инертным и подходящим эксципиентом. Указанные эксципиенты выбирают в соответствии с желательной фармацевтической формой и желательным способом введения: пероральным, подъязычным, подкожным, внутримышечным, внутривенным, чрескожным, через слизистые, местным или ректальным. Активное начало также может присутствовать в форме комплекса с циклодекстрином, например-, - или -циклодекстрином, 2-гидроксипропил-циклодекстрином или метилциклодекстрином. Активное начало также можно высвобождать при помощи содержащего его баллона или при помощи эндоваскулярного расширителя,вводимого в кровеносные сосуды. При этом исключается влияние на фармакологическую эффективность активного начала. В каждой стандартной дозе активное начало присутствует в количествах, соответствующих суточным дозам, предусмотренных для получения желаемого профилактического или терапевтического эффекта. Каждая стандартная доза может содержать от 0,1 до 100 мг активного начала, предпочтительно от 0,5 до 50 мг. Эти дозы антикоагулянтных соединений могут быть нейтрализованы дозами авидина или стрептавидина в пределах от 1 до 1000 мг посредством в.в.(внутривенной) инъекции, болюса или инфузии. Соединения по изобретению можно применять также в комбинации с одним или более чем одним другим активным началом, применяемым в требуемой терапии, таким как, например, антитромботические средства, антикоагулянты, ингибиторы агрегации тромбоцитов,такиe как, например, дипиридамол, аспирин,тиклопидин или клопидогрел, или антагонисты гликопротеинового IIб/IIIа комплекса. Приведенные ниже методики, подготовительные примеры и схемы иллюстрируют синтез различных промежуточных соединений, используемых при получении полисахаридов по данному изобретению. Использованы следующие сокращения: Вn: бензил;Z: бензилоксикарбонил. Также с целью иллюстрации подробно описаны примеры синтеза соединений по изобретению. Подготовительный пример 1. 2-(Триметилсилил)этил 4,6-O-бензилиден-2,3-ди-O-метил-D-глюкопиранозид (2). Гидрид натрия (18 г) добавляют порциями при 0 С к раствору соединения 1 (15,8 г, 42,8 ммоль) (полученного в соответствии с К. Jansson(350 мл). Реакционную смесь перемешивают в течение 4 ч при температуре окружающей среды. Избыток гидрида натрия ликвидируют метанолом и реакционную смесь вливают в ледяную воду (1,5 л). После экстракции этилацетатом органическую фазу промывают насыщенным раствором хлорида натрия и водой, сушат над сульфатом натрия и затем концентрируют под вакуумом. Остаток очищают хроматографией на колонке с силикагелем (15/1 (об./об.) циклогексан/ этилацетат) с получением 16,8 г соединения 2.[]D=-41 (с=0,69, дихлорметан). Подготовительный пример 2. 2-(Триметилсилил)этил 6-O-бензил-2,3-ди-O-метилD-глюкопиранозид (3). Порошок молекулярных сит 3(82 г), метилоранж (цветной индикатор), цианоборгидрид натрия (34 г, 526 ммоль) и затем, по каплям,насыщенный раствор соляной кислоты в диэтиловом эфире последовательно добавляют к раствору соединения 2 (16 г, 40,3 ммоль) в тетрагидрофуране (600 мл) до получения розовой окраски. После фильтрации и экстракции этилацетатом органическую фазу промывают насыщенным раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия и затем концентрируют под вакуумом. Хроматография на колонке с силикагелем (3/1 (об./об.) толуол/ этилацетат) делает возможным получение 12,5 г соединения 3. []D=-42 (с=1,2, дихлорметан). Подготовительный пример 3. 2-(Триметилсилил)этил (2,3-ди-O-бензоил-4,6-О-бензилиден-D-глюкопиранозил)-(14)-(2,3,6-три-O-бен 005133(полученного в соответствии с подготовительным примером 1 патентной заявки, опубликованной под номером WO 99/36443), соединения 3 (6,0 г, 15,05 ммоль) и порошка молекулярных сит 4(16,7 г) в толуоле (300 мл) перемешивают в атмосфере аргона в течение 1 ч. Смесь затем охлаждают до -20 С. Раствор N-йодсукцинимида (3,9 г, 17,4 ммоль) и трифторметансульфоновой кислоты (0,17 мл, 1,97 ммоль) в смеси 1/1 (об./об.) дихлорметан/диоксан (86 мл) по каплям добавляют к реакционной смеси. Через 10 мин реакционную смесь фильтруют, разбавляют дихлорметаном, чрезмерно промывают 1 М раствором тиосульфата, 10% раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия и затем концентрируют под вакуумом. Остаток очищают хроматографией на колонке с силикагелем (6/1 (об./об.) толуол/ этилацетат) с получением 18,8 г трисахарида 5.[]D=+34 (с=1,26, дихлорметан). Подготовительный пример 4. 2-(Триметилсилил)этил (4,6-O-бензилиденD-глюкопиранозил)-(14)-(-D-глюкопиранозил)-(14)-6-Oбензил-2,3-ди-O-метилD-глюкопиранозид (6). тpeт-Бутилат калия (3,15 г) добавляют к раствору соединения 5 (18,7 г, 14 ммоль) в смеси 1/1 (об./об.) метанол/диоксан (140 мл). Реакционную смесь перемешивают в течение 2 ч при температуре окружающей среды. Ее нейтрализуют смолой Dowex 50WX4 Н+, фильтруют и концентрируют под вакуумом. Остаток очищают хроматографией на колонке с силикагелем[]D=+29 (с=1,11, дихлорметан). Подготовительный пример 5. 2-(Триметилсилил)этил (4,6-O-бензилиден-2,3-ди-O-метил-D-глюкопиранозил)-(14)-(2,3,6-три-O-метил-D-глюкопиранозил)-(14)-6-O-бензил-2,3-диO-метилD-глюкопиранозид (7). Гидрид натрия (5,2 г, 216 ммоль) добавляют порциями в атмосфере аргона к охлажденной смеси (0 С) соединения 6 (9,93 г, 12,24 ммоль) и метилйодида (9,0 мл, 138 ммоль) в безводном тетрагидрофуране (100 мл). Эту смесь перемешивают в течение 20 ч при температуре окружающей среды. Избыток гидрида натрия ликвидируют метанолом и реакционную смесь вливают в ледяную воду (500 мл). После экстракции этилацетатом органическую фазу промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют под вакуумом с получением 11 г соединения 7, которое используют на следующей стадии без очистки. ТСХ: Rf=0,38, силикагель, 3/2 (об./об.) толуол/этилацетат. Подготовительный пример 6. 2-(Триметилсилил)этил (2,3-ди-О-метилD-глюкопирано 17 зил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-6-O-бензил-2,3-ди-O-метилDглюкопиранозид (8). Соединение 7 (11 г) растворяют в 60% уксусной кислоте (180 мл) и перемешивают в течение 1 ч 30 мин при 80 С. Смесь концентрируют и упаривают совместно с толуолом. Остаток очищают хроматографией на колонке с силикагелем (2/1 (об./об.) толуол/ацетон) с получением 8,46 г соединения 8. ТСХ: Rf=0,36, силикагель, 1/1 (об./об.) толуол/ацетон. Подготовительный пример 7. 2-(Триметилсилил)этил (6-О-бензоил-2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-6-O-бензил-2,3-ди-O-метил-D-глюкопиранозид (9). 1-Бензоилокси-1 Н-бензотриазол (5,36 г,22,4 ммоль) и триэтиламин (3,32 мл) добавляют к раствору соединения 8 (8,41 г, 10,6 ммоль) в дихлорметане (110 мл). Эту смесь перемешивают в течение 20 ч при температуре окружающей среды и затем разбавляют дихлорметаном, промывают насыщенным раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия и затем концентрируют под вакуумом. Остаток очищают хроматографией на колонке с силикагелем (5/0,5/0,25 (об./об./об.) циклогексан/этилацетат/этанол) с получением 8,40 г соединения 9. Подготовительный пример 13. 2-(Триметилсилил)этил (2,3-ди-O-бензоил-4,6-О-бензилиден-D-глюкопиранозил)-(14)-(2,3,6-три-O-бензоилD-глюкопиранозил)-(14)-(6-O-бензоил-2,3 ди-O-метилD-глюкопиранозил)-(14)-(2,3,6 три-O-метилD-глюкопиранозил)-(14)-(2,3,6 три-О-метилD-глюкопиранозил)-(14)-(2,3,6 три-O-метилD-глюкопиранозил)-(14)-6-Oбензил-2,3-ди-O-метилD-глюкопиранозид (15). Реакцию сочетания соединения 14 с дисахаридом 4 проводят по методике, описанной в подготовительном примере 3, с получением соединения 15. Подготовительный пример 18. 2-(Триметилсилил)этил (2,3-ди-O-бензоил-4,6-О-бензилиден-D-глюкопиранозил)-(14)-(2,3,6-три-O-бензо 21 илD-глюкопиранозил)-(14)-(6-O-бензоил-2,3 ди-O-метилD-глюкопиранозил)-(14)-(2,3,6 три-О-метилD-глюкопиранозил)-(14)-[(2,3,6 три-О-метилD-глюкопиранозил)-(14)-(2,3,6 три-O-метилD-глюкопиранозил)-(14)]2-6-Oбензил-2,3-ди-O-метилD-глюкопиранозид (20). Смесь тиогликозида 4 (5,2 г, 5,23 ммоль),гептасахарида 19 (4,72 г, 2,75 ммоль) и порошка молекулярных сит 4 в толуоле перемешивают в атмосфере аргона в течение 1 ч. Затем по каплям добавляют раствор N-йодсукцинимида (1,36 г,5,85 ммоль) и трифторметансульфоновой кислоты(0,140 мл, 1,56 ммоль) в смеси 1/1 (об./об.) дихлорметан/диоксан (32 мл) при 0 С. Через 15 мин реакционную смесь фильтруют, разбавляют дихлорметаном, промывают последовательно 1 М раствором тиосульфата натрия, 10% раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия и концентрируют под вакуумом. Остаток очищают хроматографией на колонке с силикагелем (3/0,5/0,5) (об./об./об.) циклогексан/этилацетат/этанол) с получением 7,13 г соединения 20. Подготовительный пример 22. 2-(Триметилсилил)этил (2,3-ди-O-метил-6-O-тозилD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-[(2,3,6-три-O-метилDглюкопиранозил)-(14)-(2,3,6-три-O-метил-D-глюкопиранозил)-(14)]3-6-O-бензил-2,3-диO-метилD-глюкопиранозид (24). Соединение 23 (1,09 г) растворяют в пиридине (10 мл) в атмосфере аргона и затем добавляют тозилхлорид (1,03 г). После перемешивания в течение 2 ч реакционную смесь разбавляют дихлорметаном (100 мл). Органическую фазу промывают последовательно 10% раствором гидросульфата калия и затем водой, сушат и упаривают до сухости. После хроматографии на колонке с силикагелем (2,3/2 (об./об.) толуол/ацетон) получают 1,77 г соединения 24. ТСХ: Rf=0,5, силикагель, 3/1/1 (об./об./об.) циклогексан/этилацетат/этанол. Подготовительный пример 23. 2-(Триметилсилил)этил (6-дезокси-2,3-ди-O-метил-6-фталимидоD-глюкопиранозил)-(14)-(2,3,6-три-OметилD-глюкопиранозил)-(14)-[(2,3,6-триO-метилD-глюкопиранозил)-(14)-(2,3,6-триO-метилD-глюкопиранозил)-(14)]3-6-O-бензил-2,3-ди-O-метилD-глюкопиранозид (25). Фталимид калия (225 мг, 1,38 ммоль) и затем 18-краун-6 краун-эфир (121,5 мг, 0,46 ммоль) добавляют к раствору соединения 24 (500 мг,0,23 ммоль) в безводном N,N-диметилформами 23 де (11 мл), содержащем порошок молекулярных сит 4 . Смесь перемешивают в течение 4 ч при 80 С. После охлаждения реакционную смесь разбавляют дихлорметаном, фильтруют через целит и концентрируют. Остаток очищают хроматографией на геле Sephadex LH20 (3 х 100 см)(1/1 (об./об.) дихлорметан/этанол), а затем хроматографией на колонке с силикагелем (11/2(полученного в соответствии с соединением 41,подготовительный пример 36 из WO 99/36443),акцептора 25 (840 мг, 0,391 ммоль) и порошка молекулярных сит 4(2,15 г) в толуоле (33 мл) перемешивают в атмосфере аргона в течение 1 ч. Реакционную смесь охлаждают до 0 С и в нее вводят раствор N-йодсукцинимида (387 мг) и трифторметансульфоновой кислоты (55,4 мкл) в смеси 1/1 (об./об.) дихлорметан/диоксан (7 мл). Через 10 мин смесь фильтруют, разбавляют толуолом, промывают последовательно 1 М раствором тиосульфата натрия, в 10% растворе гидрокарбоната натрия и в воде, сушат над сульфатом натрия и затем концентрируют под вакуумом. Остаток очищают хроматографией на геле Sephadex LH20 (1/1 (об./об.) дихлорметан/этанол), а затем хроматографией на колонке с силикагелем (5/4 (об./об.) толуол/ацетон) с получением 887 мг соединения 27.[]D=+70 (с=0,35, дихлорметан). Подготовительный пример 25. 2-(Триметилсилил)этил (2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-(14)-(2,3,6-три-O-ацетилD-глюкопиранозил)-(14)-(2,3,6-три-O-ацетилD-глюкопиранозил)-(14)-(6-дезокси-2,3-ди-O-метил 6-фталимидоD-глюкопиранозил)-(14)-(2,3,6 три-О-метилD-глюкопиранозил)-(14)-[(2,3,6 три-O-метилD-глюкопиранозил)-(14)-(2,3,6 три-O-метилD-глюкопиранозил)-(14)]3-2,3 ди-O-метилD-глюкопиранозид (28). Раствор соединения 27 (750 мг, 0,245 ммоль) в уксусной кислоте (37 мл) обрабатывают под давлением водорода (5 бар (500 кПа в присутствии 10% палладия на угле (750 мг) в течение 2 ч 30 мин. После фильтрации раствор концентрируют и остаток очищают хроматографией на 24 колонке с силикагелем (6/1 (об./об.) толуол/ этанол) с получением 728 мг соединения 28. ТСХ: Rf=0,32, силикагель, 6/1 (об./об.) толуол/этанол. Подготовительный пример 26. 2-(Триметилсилил)этил (2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-(14)-(2,3,6-три-O-ацетилD-глюкопиранозил)-(14)-(2,3,6-три-O-ацетилD-глюкопиранозил)-(14)-(6-дезокси-2,3-ди-O-метил 6-фталимидоD-глюкопиранозил)-(14)-(2,3,6 три-О-метилD-глюкопиранозил)-(14)-[(2,3,6 три-O-метилD-глюкопиранозил)-(14)-(2,3,6 три-O-метилD-глюкопиранозил)-(14)]3-6-Oацетил-2,3-ди-O-метилD-глюкопиранозид (29). Триэтиламин (51,1 мкл, 0,368 ммоль), уксусный ангидрид (32,5 мкл, 0,344 ммоль) и диметиламинопиридин (6,0 мг, 0,049 ммоль) добавляют к раствору соединения 28 (728 мг,0,245 ммоль) в дихлорметане (10 мл). После перемешивания в течение 1 ч реакционную смесь разбавляют дихлорметаном, промывают последовательно 10% раствором гидросульфата калия, водой, насыщенным раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия и концентрируют под вакуумом. Очистка остатка, осуществленная хроматографией на колонке с силикагелем, делает возможным получение 0,618 мг соединения 29. ТСХ: Rf=0,37, силикагель, 6/1 (об./об.) толуол/этанол. Схема 6 Синтез олигосахарида 31 Подготовительный пример 27. (2,3,4,6-тетраO-АцетилD-глюкопиранозил)-(14)-(2,3,6 три-O-ацетилD-глюкопиранозил)-(14)-(2,3,6 три-O-ацетилD-глюкопиранозил)-(14)-(6-дезокси-2,3-ди-O-метил-6-фталимидоD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-[(2,3,6-три-O-метилD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)]3-6-O-ацетил-2,3-ди-O-метил-Dглюкопираноза (30). Раствор соединения 29 (579 мг, 0,192 ммоль) в смеси 2/1 (об./об.) трифторуксусная кислота/ дихлорметан (11,5 мл) перемешивают в течение 1 ч. Реакционную смесь разбавляют смесью 2/1(об./об.) толуол/н-пропилацетат (69 мл), концентрируют и выпаривают совместно с толуолом. Остаток очищают хроматографией на ко 25 лонке с силикагелем (5/1 (об./об.) толуол/ этанол) с получением 523 мг соединения 30. ТСХ: Rf=0,31, силикагель, 5/1 (об./об.) толуол/этанол. Подготовительный пример 28. (2,3,4,6-тетраО-АцетилD-глюкопиранозил)-(14)-(2,3,6 три-О-ацетилD-глюкопиранозил)-(14)-(2,3,6 три-О-ацетилD-глюкопиранозил)-(14)-(6 дезокси-2,3-ди-O-метил-6-фталимидоD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-[(2,3,6-три-O-метилDглюкопиранозил)-(14)-(2,3,6-три-О-метилDглюкопиранозил)-(14)]3-6-O-ацетил-2,3-ди-Oметил-D-глюкопиранозы трихлорацетимидат (31). Трихлорацетонитрил (65,5 мкл, 0,85 ммоль) и карбонат цезия (88,4 мг, 0,27 ммоль) добавляют к раствору соединения 30 в дихлорметане (3 мл). После перемешивания в течение 2 ч смесь фильтруют и концентрируют. Остаток очищают хроматографией на колонке с силикагелем (6/1 26 добавления порошка молекулярных сит 4 смесь охлаждают до -20 С и добавляют 0,1 М раствор триметилсилилтрифторметансульфоната в дихлорметане (181,5 мкл). Через 25 мин смесь нейтрализуют добавлением твердого гидрокарбоната натрия. После фильтрации и концентрирования остаток очищают хроматографией на геле Sephadex LH20, а затем хроматографией на колонке с силикагелем (6/5 (об./об.) толуол/ацетон) с получением 302 мг соединения 33.[]D=+86 (с=1, дихлорметан). Подготовительный пример 30. Метил (2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-(14)(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)(6-дезокси-2,3-ди-O-метил-6-фталимидоD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-[(2,3,6-три-O-метилD-глюкопиранозил)-(14)-O-(2,3,6-три-О-метилDглюкопиранозил)-(14)]3-(6-O-ацетил-2,3-ди-OметилD-глюкопиранозил)-(14)-(2,3-ди-OметилD-глюкопиранозилуроновая кислота)(14)-(3,6-ди-O-ацетилD-глюкопиранозил)(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)D-глюкопиранозид (34). Раствор соединения 33 (104 мг, 0,024 ммоль) в уксусной кислоте (5 мл) обрабатывают под давлением водорода (4 бар (400 кПа в присутствии 10% палладия на угле (104 мг) в течение 4 ч. После фильтрации раствор лиофилизируют с получением соединения 34 (87 мг), которое используют на следующей стадии без очистки. Подготовительный пример 31. Метил (-Dглюкопиранозил)-(14)-(-D-глюкопиранозил)(14)-(-D-глюкопиранозил)-(14)-(6-дезокси-2,3 ди-O-метил-6-фталимидоD-глюкопиранозил)(14)-(2,3,6-три-O-метилD-глюкопиранозил)(14)-[(2,3,6-три-O-метилD-глюкопиранозил)(14)-O-(2,3,6-три-О-метилD-глюкопиранозил)(14)]3-(2,3-ди-O-метилD-глюкопиранозил)(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(-D-глюкопиранозил)(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)D-глюкопиранозид (35). Молярный раствор метилата натрия в метаноле (140 мкл) добавляют к раствору соединения 34 (80 мг, 0,021 ммоль) в безводном метаноле (6,9 мл) в присутствии порошка молекулярных сит 3(875 мг). После 20 ч при температуре окружающей среды реакционную смесь фильтруют и фильтрат нейтрализуют уксусной кислотой. Раствор концентрируют наполовину и наносят на колонку Sephadex G-25 Fine (3 х 92 см). После элюирования водой и лиофилизации получают соединение 35 (66 мг). Подготовительный пример 32. Метил (2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(6-дезокси-2,3-ди-O-метил 6-фталимидоD-глюкопиранозил)-(14)-(2,3,6 три-О-метилD-глюкопиранозил)-(14)-[(2,3,6 три-O-метилD-глюкопиранозил)-(14)-O-(2,3,6 три-O-метилD-глюкопиранозил)-(14)]3-(6O-сульфонато-2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-OметилL-идопиранозилуроновая кислота)-(14)2,3,6-три-О-сульфонатоD-глюкопиранозид,натриевая соль (36). Полиол 35 (66,4 мг, 0,021 ммоль) растворяют в N,N-диметилформамиде (1,8 мл). Добавляют комплекс триоксид серы-триэтиламин (320 мг,1,77 ммоль) и смесь перемешивают в течение 20 ч при 55 С. Этот раствор наносят на колонкуSephadex G-25 Fine (3 х 92 см), элюируемую 0,2 М хлоридом натрия. Фракции, содержащие продукт, концентрируют и обессоливают, используя такую же колонку, элюируемую водой. После лиофилизации получают 83 мг соединения 36. Масс-спектр: ESI метод, отрицательный режим: химическая масса=4968,92, экспериментальная масса=4966,520,16 а.е.м (атомных единиц массы). Подготовительный пример 33. Метил (2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(6-амино-6-дезокси-2,3-диO-метилD-глюкопиранозил)-(14)-(2,3,6-триО-метилD-глюкопиранозил)-(14)-[(2,3,6-триO-метилD-глюкопиранозил)-(14)-O-(2,3,6 три-O-метилD-глюкопиранозил)-(14)]3-(6O-сульфонато-2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-OметилL-идопиранозилуроновая кислота)-(14)2,3,6-три-О-сульфонатоD-глюкопиранозид,натриевая соль (37). 28 Соединение 36 (83 мг, 0,017 ммоль) растворяют в смеси 2/1 этанол/вода (1,67 мл). Добавляют гидразингидрат (81,2 мкл, 1,67 ммоль) и смесь доводят до кипения с обратным холодильником в течение 20 ч. Раствор наносят на колонку Sephadex G-25 Fine (3 х 92 см), элюируемую водой. После концентрирования фракций, содержащих продукт, остаток растворяют в смеси 2/1 (об./об.) этанол/вода (5,00 мл) и снова обрабатывают в предыдущих условиях гидразингидратом (81,2 мкл) с получением 71 мг соединения 37. Масса-спектр: ESI метод, отрицательный режим: химическая масса=4838,32; экспериментальная масса=4814,60,70 а.е.м. Схема 9 Синтез пентасахарида 39(584 мг, 0,420 ммоль) (полученное в соответствии с Р. Westerduin et al., Bioorg. Med. Chem.,1994, 2, 1267) растворяют в смеси 1/2 (об./об.) дихлорметан/диэтиловый эфир (28,5 мл). После добавления порошка молекулярных сит 4 смесь охлаждают до -20 С и добавляют 0,1 М раствор триметилсилилтрифторметансульфоната в дихлорметане (94,6 мкл). Через 10 мин снова добавляют имидат (53,8 мг), а затем 0,1 М раствор триметилсилилтрифторметансульфоната в дихлорметане (19,2 мкл). Через 10 мин смесь нейтрализуют добавлением твердого гидрокарбоната натрия. После фильтрации и концентрирования остаток очищают хроматографией на колонке с силикагелем (3/1 (об./об.) толуол/ этилацетат) с получением 499 мг соединения 39. Подготовительный пример 35. Метил (6-Oацетил-2-амино-2-дезокси-3,4-ди-O-метилDглюкопиранозил)-(14)-(2,3-ди-O-метилDглюкопиранозилуроновая кислота)-(14)-(3,6 ди-O-ацетилD-глюкопиранозил)-(14)-(2,3 ди-O-метилL-идопиранозилуроновая кислота)-(14)D-глюкопиранозид (40). Раствор соединения 39 (552,6 мг, 0,335 ммоль) в смеси 5/1 (об./об.) тpeт-бутанол/этилацетат (16 мл) обрабатывают под давлением водорода (10 бар (1000 кПа в присутствии 10% палладия на угле (1,10 г) и 1 М соляной кислоты(0,336 мл) в течение 4 ч 30 мин. После фильтрации раствор концентрируют с получением соединения 40, которое используют на следующей стадии без очистки. Подготовительный пример 36. Метил (2 амино-2-дезокси-3,4-ди-O-метилD-глюкопиранозил)-(14)-(2,3-ди-О-метилD-глюкопиранозилуроновая кислота)-(14)-(-D-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)D-глюкопиранозид (41). Соединение 40 (324 мг, 0,300 ммоль) растворяют в метаноле (8,8 мл). Добавляют 5 М раствор гидроксида натрия (2,2 мл) и реакционную смесь перемешивают при температуре окружающей среды в течение 16 ч. Ее нейтрализуют смолой Dowex 50 Н+ и фильтруют. Раствор пропускают через колонку Sephadex G-25 30 соединения 41. На этой стадии, что подтверждено ЯМР (ядерным магнитным резонансом),защитные группы (бензильная и ацетильная группы) были удалены. ТСХ: Rf=0,26, силикагель, 5/5/1/3 (об./об./ об./об.) этилацетат/пиридин/уксусная кислота/ вода. Подготовительный пример 37. Метил (2(бензилоксикарбонил)амино-2-дезокси-3,4-диO-метилD-глюкопиранозил)-(14)-(2,3-диO-метилD-глюкопиранозилуроновая кислота)(14)-(-D-глюкопиранозил)-(14)-(2,3-ди-OметилL-идопиранозилуроновая кислота)-(14)-D-глюкопиранозид (42). Соединение 41 (241,1 мг, 0,253 ммоль) растворяют в воде (12,4 мл) и добавляют гидрокарбонат натрия (63,7 мг), затем по каплям добавляют бензилхлорформиат (41 мкл). После перемешивания в течение 12 ч реакционную смесь пропускают через колонку Sephadex G-25Fine, элюируемую водой. Фракции, содержащие продукт, концентрируют. После очистки хроматографией на колонке с силикагелем (21/17/ 3,6/10 (об./об./об./об.) этилацетат/пиридин/ уксусная кислота/вода) получают 221 мг соединения 42. ТСХ: Rf=0,63, силикагель, 5/5/1/3 (об./об./ об./об.) этилацетат/пиридин/уксусная кислота/ вода. Подготовительный пример 38. Метил (2(бензилоксикарбонил)амино-2-дезокси-3,4-диO-метил-6-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонато-D-глюкопиранозил)-(14)-(2,3-ди-O-метил-L-идопиранозилуроновая кислота)-(14)-2,3,6 три-О-сульфонатоD-глюкопиранозид, натриевая соль (43). Полиол 42 (19,6 мг, 0,018 ммоль) растворяют в N,N-диметилформамиде (1,62 мл). Добавляют комплекс триоксид серы-триэтиламин(114 мг) и смесь перемешивают в течение 20 ч при 55 С без света. Этот раствор наносят на колонку Sephadex G-25 Fine, элюируемую 0,2 М хлоридом натрия. Фракции, содержащие продукт, концентрируют и обессоливают, используя такую же колонку, элюируемую водой. После лиофилизации получают 28,5 мг соединения 43. 31 обрабатывают под давлением водорода (5 бар(8,25 мг) в течение 16 ч. После фильтрации раствор концентрируют и остаток наносят на колонку Sephadex G-25 Fine (3 х 92 см). После элюирования водой и лиофилизации получают 23,7 мг соединения 44.Med. Chem., 1994, 2, 1267) в смеси этилацетат/ трет-бутанол (72 мл, 1/1, об./об.) обрабатывают под давлением водорода (4 бар (400 кПа в присутствии 10% палладия на угле (9,0 г) в течение 6 ч. После фильтрации и концентрирования полученное соединение 46 используют непосредственно на следующей стадии без очистки. ТСХ: Rf=0,54, 26/22/4,6/17 (об./об./об./об.) этилацетат/пиридин/уксусная кислота/вода. Подготовительный пример 41. Метил (метил-4-O-левулинил-2,3-ди-O-метилD-глюкопиранозилуронат)-(14)-(2,3,6-три-О-ацетил-D-глюкопиранозил)-(14)-(метил-2,3-ди-OметилL-идопиранозилуронат)-(14)-2,3,6 три-О-ацетилD-глюкопиранозид (47). Гидрокарбонат калия (2,71 г), а затем метилйодид (3,4 мл) добавляют при 0 С к раствору соединения 46 (2,57 г, 2,71 ммоль) в безводном 32 окружающей среды реакционную смесь охлаждают до 0 С. Затем последовательно добавляют диметиламинопиридин (132 мг) и уксусный ангидрид (1,5 мл). Смесь перемешивают в течение 16 ч. После нейтрализации избытка уксусного ангидрида смесь разбавляют этилацетатом. Органическую фазу промывают последовательно 10% раствором гидросульфата калия и водой, а затем насыщенным гидрокарбонатом натрия и водой, сушат над сульфатом натрия, фильтруют и затем упаривают до сухости. Остаток очищают хроматографией на колонке с силикагелем[9/5 циклогексан/(1/1 этилацетат/этанол)] с получением 2,51 г соединения 47. ТСХ: Rf=0,41, 2/1 (об./об.) толуол/ацетон. Подготовительный пример 42. Метил (метил-2,3-ди-O-метилD-глюкопиранозилуронат)(14)-(2,3,6-три-O-ацетилD-глюкопиранозил)(14)-(метил-2,3-ди-O-метилL-идопиранозилуронат)-(14)-2,3,6-три-О-ацетилD-глюкопиранозид (48). Соединение 47 (2,5 г, 2,56 ммоль) растворяют в смеси 1/1 (об./об.) толуол/этанол (500 мл). Добавляют гидразина ацетат (1,01 г). После перемешивания в течение 2 ч при температуре окружающей среды реакционную смесь концентрируют до сухости. Остаток растворяют в дихлорметане. Органическую фазу промывают последовательно 2% раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия,фильтруют и затем выпаривают до сухости. После хроматографии на колонке с силикагелем(об./об.) дихлорметан/диэтиловый эфир (126 мл). После добавления порошка молекулярных сит 4 смесь охлаждают до -20 С и добавляют 1 М раствор тpeт-бутилдиметилсилилтрифторметансульфоната в дихлорметане (421 мкл). Через 30 мин 33 добавляют дополнительное количество имидата(266 мг) и 1 М раствор трет-бутилдиметилсилилтрифторметансульфоната в дихлорметане (168 мкл). Через 10 мин смесь нейтрализуют добавлением твердого гидрокарбоната натрия и фильтруют. В раствор доливают дихлорметан,промывают последовательно 2% раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия и затем концентрируют под вакуумом. Полученный остаток очищают хроматографией на колонке с силикагелем (4/3, а затем 1/1 (об./об.) дихлорметан/этилацетат) с получением 1,814 г соединения 49. ТСХ: Rf=0,57, 3/1 (об./об.) толуол/этилацетат. Подготовительный пример 44. Метил (2 азидо-2-дезокси-3,4-ди-O-метилD-глюкопиранозил)-(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(-D-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)D-глюкопиранозид (50). 30% водный раствор перекиси водорода(42 мл) добавляют при -5 С к раствору соединения 49 (845,3 мг) в тетрагидрофуране (104 мл). После перемешивания в течение 5 мин по каплям добавляют 0,7 М водный раствор гидроксида лития (19,2 мл). Реакционную смесь перемешивают в течение 1 ч при -5 С, затем в течение 4 ч при 0 С и наконец в течение 16 ч при температуре окружающей среды. Ее нейтрализуют 1 М раствором соляной кислоты. Раствор наносят на колонку Sephadex G-25Fine (5 х 1000 см), элюируемую водой. Фракции,содержащие ожидаемое соединение, объединяют, концентрируют и наносят на колонку со смолой Dowex AG 50 WX4 H+ (50 мл). Соеди 005133 34 нение собирают при 0 С и концентрируют с получением 618 мг соединения 50. ТСХ: Rf=0,56, 26/22/4,6/17 (об./об./об./об.) этилацетат/пиридин/уксусная кислота/вода. Подготовительный пример 45. Метил (2 азидо-2-дезокси-3,4-ди-O-метил-6-O-сульфонато-D-глюкопиранозил)-(14)-(2,3-ди-O-метил-D-глюкопиранозилуронат)-(14)-(2,3,6-три-OсульфонатоD-глюкопиранозил)-(14)-(2,3 ди-O-метилL-идопиранозилуронат)-(14)2,3,6-три-O-сульфонатоD-глюкопиранозид,натриевая соль (51). Непосредственно перед использованием соединение 50 перегоняют совместно с N,N-диметилформамидом (3 х 29 мл). К раствору соединения 50 (612 мг, 0,624 ммоль) в N,N-диметилформамиде (58 мл) добавляют комплекс триоксид серы-триэтиламин (3,84 г). Смесь перемешивают в течение 16 ч при 55 С без света. Эту смесь, охлажденную до 0 С, по каплям добавляют к раствору гидрокарбоната натрия (5,33 г) в воде (200 мл). Смесь перемешивают в течение 16 ч при температуре окружающей среды и концентрируют до сухости. Остаток растворяют в воде и раствор наносят на колонку Sephadex G-25 Fine, элюируемую 0,2 М хлоридом натрия. Фракции, содержащие продукт, концентрируют и обессоливают, используя такую же колонку, элюируемую водой. После лиофилизации получают 1,06 г соединения 51. ТСХ: Rf=0,5, 3/5/1/3 (об./об./об./об.) этилацетат/пиридин/уксусная кислота/вода. Подготовительный пример 46. Метил (2 амино-2-дезокси-3,4-ди-O-метил-6-O-сульфонато-D-глюкопиранозил)-(14)-(2,3-ди-O-метил-D-глюкопиранозилуроновая нислота)-(14)(2,3,6-три-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-О-сульфонато-D-глюкопиранозид, натриевая соль (44). Данный гидрогенолиз выполняли дважды,и в каждом случае на 534,4 мг соединения 51. Раствор соединения 51 (534,4 мг) в смеси тpeт-бутанол (6,7 мл, 12,6 мл/г)/вода (10 мл, 19 мл/ г) обрабатывают под давлением водорода (5 бар) в присутствии 10% палладия на угле (160 мг) при 40 С в течение 4 ч. После фильтрации (фильтрMillipore LSWP 5 мкм) раствор концентрируют до сухости с получением 530 мг соединения 44. ТСХ: Rf=0,49, 3/5/1/3 (об./об./об./об.) этилацетат/пиридин/уксусная кислота/вода. Пример 1. Пример 1. Метил (2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-OсульфонатоD-глюкопиранозил)-(14)-(2,3,6 три-О-сульфонатоD-глюкопиранозил)-(14)(6-биотинамидо-6-дезокси-2,3-ди-O-метилDглюкопиранозил)-(14)-(2,3,6-три-O-метилDглюкопиранозил)-(14)-[(2,3,6-три-O-метил-D-глюкопиранозил)-(14)-O-(2,3,6-три-O-метил-D-глюкопиранозил)-(14)]3-(6-O-сульфонато 2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3 ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая нислота)-(14)-2,3,6-три-ОсульфонатоD-глюкопиранозид, натриевая соль. Сульфосукцинимид биотина (16,5 мг) добавляют к раствору соединения 37 (18 мг, 3,72 мкмоль) в 0,5% гидрокарбонате натрия (1,5 мл). После перемешивания в течение 16 ч при температуре окружающей среды реакционную смесь наносят на колонку Sephadex G-25,элюируемую хлоридом натрия. Фракции, содержащие продукт, концентрируют и обессоливают на такой же колонке,элюируемой водой. После лиофилизации получают 15,9 мг соединения примера 1. 36 натоD-глюкопиранозил)-(14)-(6-[6-(биотинамидо)гексамидо]-6-дезокси-2,3-ди-O-метилDглюкопиранозил)-(14)-(2,3,6-три-O-метилDглюкопиранозил)-(14)-[(2,3,6-три-О-метил-D-глюкопиранозил)-(14)-O-(2,3,6-три-О-метил-D-глюкопиранозил)-(14)]3-(6-O-сульфонато 2,3-ди-O-метилD-глюкопиранозил)-(14)(2,3-ди-О-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоDглюкопиранозил)-(14)-(2,3-ди-O-метилLидопиранозилуроновая кислота)-(14)-2,3,6-триO-сульфонатD-глюкопиранозид, натриевая соль. 6-(Биотинамидо)гексаноат (16,5 мг) добавляют к раствору соединения 37 (18 мг, 3,72 мкмоль) в 0,5% гидрокарбонате натрия (1,5 мл). После перемешивания в течение 16 ч при температуре окружающей среды реакционную смесь наносят на колонку Sephadex G-25 Fine,элюируемую хлоридом натрия. Фракции, содержащие продукт, концентрируют и обессоливают на такой же колонке,элюируемой водой. После лиофилизации получают 17,9 мг соединения примера 2.[]D=+60 (с=1,0, вода). Масс-спектр: ESI метод, отрицательный режим: химическая масса=5178,28; экспериментальная масса=5176,30,77 а.е.м. Пример 3. Метил (2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонато-D-глюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(6-[6-(6-биотинамидогексамидо)гексамидо]-6-дезокси-2,3-ди-OметилD-глюкопиранозил)-(14)-(2,3,6-три-OметилD-глюкопиранозил)-(14)-[(2,3,6-триO-метилD-глюкопиранозил)-(14)-O-(2,3,6 три-О-метилD-глюкопиранозил)-(14)]3-(6O-сульфонато-2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-OметилL-идопиранозилуроновая кислота)-(14)2,3,6-три-O-сульфонатоD-глюкопиранозид,натриевая соль. Сульфосукцинимидил 6-(6-биотинамидогексамидо)гексаноат (23,6 мг) добавляют к раствору соединения 37 (17 мг, 3,51 мкмоль) в 0,5% гидрокарбонате натрия (1,4 мл). После перемешивания в течение 16 ч при температуре окружающей среды реакционную смесь наносят на колонку Sephadex G-25 Fine,элюируемую хлоридом натрия. Фракции, содержащие продукт, концентрируют и обессоливают на такой же колонке, элюируемой водой. После лиофилизации получают 17,4 мг соединения примера 3.(42 мг) в N,N-диметилформамиде (750 мкл) добавляют к раствору соединения 44 (21,2 мг,0,012 ммоль) в 0,5% гидрокарбонате натрия (750 мкл). После перемешивания в течение 16 ч при температуре окружающей среды реакционную смесь наносят на колонку Sephadex G-25 Fine. После элюирования водой и лиофилизации получают 22,3 мг соединения примера 4.[]D=+38 (с=0,15, вода). Масс-спектр: ESI метод, отрицательный режим: химическая масса=1938,48; экспериментальная масса=1937,480,11 а.е.м. Пример 5. Метил (2-[N-(6-биотинамидогексаноил)]-2-дезокси-3,4-ди-O-метил-6-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-ОметилD-глюкопиранозилуроновая кислота)(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-О-сульфонатоD-глюкопиранозид, натриевая соль. Данную реакцию проводили дважды и в каждом случае на 494,5 мг соединения 44. Соединение 44 (494,5 мг, 0,289 ммоль) растворяют в 0,5% водном растворе гидрокарбоната натрия (116 мл). К нему по каплям добавляют раствор 6-биотинамидогексаноата сульфосукцинимида (1,46 г,2,63 ммоль) в 0,5% растворе гидрокарбоната натрия (12 мл). После перемешивания в течение 16 ч при температуре окружающей среды добавляют 1 М водный раствор гидроксида натрия и смесь перемешивают в течение 1 ч. Реакционную смесь наносят на колонку Sephadex G-25Fine (5 х 1000 см), элюируемую хлоридом натрия. Фракции, содержащие продукт и полученные в результате этих двух реакций, объединяют. После лиофилизации получают 999,2 мг соединения примера 5. ТСХ: Rf=0,42, 3/5/1/3 (об./об./об./об.) этилацетат/пиридин/уксусная кислота/вода. Масс-спектр: ESI метод, отрицательный режим: химическая масса=2051,64; экспериментальная масса=2051,600,43 а.е.м. Пример 6. Метил (2-[6-(6-биотинамидогексамидо)гексамидо]-2-дезокси-3,4-ди-O-метил 6-O-сульфонатоD-глюкопиранозил)-(14)(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идо 005133 38 пиранозилуроновая кислота)-(14)-2,3,6-три-OсульфонатоD-глюкопиранозид, натриевая соль. Соединение 44 (30,1 мг, 17,6 мкмоль) растворяют в 0,5% водном растворе гидрокарбоната натрия (7 мл). К нему по каплям добавляют раствор сульфосукцинимидил-6-(6-биотинамидогексамидо) (118 мг, 176 мкмоль) в 0,5% растворе гидрокарбоната натрия (1 мл). После перемешивания в течение 16 ч при температуре окружающей среды добавляют 1 М водный раствор гидроксида натрия и смесь перемешивают в течение 1 ч. Реакционную смесь наносят на колонку Sephadex G-25 Fine (2 х 85 см), элюируемую хлоридом натрия. Фракции, содержащие продукт, объединяют, концентрируют и обессоливают на колонкеSephadex G-25 Fine (2 х 85 см), элюируемой водой. После лиофилизации получают 26,5 мг соединения примера 6. ТСХ: Rf=0,42, 3/5/1/3 (об./об./об./об.) этилацетат/пиридин/уксусная кислота/вода. Масс-спектр: ESI метод, отрицательный режим: химическая масса=2164,48; экспериментальная масса=2164,290,38 а.е.м. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Синтетические полисахариды с антитромботической активностью и их фармацевтически приемлемые соли, отличающиеся тем, что они имеют по меньшей мере одну ковалентную связь с биотином или производным биотина. 2. Полисахариды по п.1 формулы где волнистая линия обозначает связь, расположенную либо ниже, либо выше плоскости кольца пиранозы, Ро обозначает полисахарид, содержащий n одинаковых или разных моносахаридных единиц, связанных с Ре через свой аномерный углерод, является схематическим представлением моносахаридной единицы с пиранозной структурой, выбранной из гексоз, пентоз и соответствующих дезоксисахаров, причем эта единица связана с другой моносахаридной единицей через свой аномерный углерод и гидроксильные группы этой единицы замещены одинаковыми или разными группами R1, причем R1 является таким, как определено ниже,Ре представляет собой пентасахарид структурыh равно 1 или 2,n является целым числом и может принимать любое значение от 0 до 25,R1 представляет собой связь -T-Biot, (С 1 С 6)алкоксигруппу или группу -ОSО 3-,R2 представляет собой связь -T-Biot, (С 1 С 6)алкоксигруппу или группу -ОSО 3-,R3 представляет собой связь -T-Biot или(С 1-С 6)алкоксигруппу,R4 представляет собой связь -T-Biot, (С 1 С 6)алкоксигруппу или группу -ОSО 3- или же R4 является мостиком -O-CH2-, причем группа-СН 2- связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце; при этом подразумевается, что по меньшей мере один из заместителей R1, R2, R3 или R4 представляет собой группу -T-Biot,W представляет собой атом кислорода или метиленовую группу,Т представляет собой одну из связей, выбранную из NH, обозначает специфическое семейство полисахаридов Ро, которые связаны с Ре через свой аномерный углерод, как определено для (I), является таким, как определено для (I),группы R1 являются такими, как определено для (I), и для одного и того же моносахарида,могут быть одинаковыми или разными; моносахарид, присутствующий в [ ]m, повторяется m раз, моносахарид, присутствующий в [ ]t, повторяется t раз и моносахарид, присутствующий в [ ]р, повторяется р раз,m является целым числом в пределах от 1 до 5, t является целым числом в пределах от 0 до 24 и р является целым числом в пределах от 0 до 24, причем подразумевается, что 1m+t+р 25,и их фармацевтически приемлемые соли. 4. Полисахариды по п.3, отличающиеся тем, что только один из заместителей R1, R2, R3 или R4 представляет собой связь -T-Biot, где Т иBiot являются такими, как определено для (I). 5. Гексадекасахариды по любому из пп.1-4 формулы (I.2) где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10; где Т представляет собой одну из связей, выбранную из NH, или и их фармацевтически приемлемые соли. 3. Полисахариды по любому из пп.1 и 2 формулы (I.1) где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10;-O-СН 2-, причем группа -СН 2- связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце;W представляет собой атом кислорода или метиленовую группу,и их фармацевтически приемлемые соли. 6. Пентасахариды по любому из пп.1 и 2 формулы (I.3) где R1, R2, R3, R4 и W являются такими, как определено для (I),и их фармацевтически приемлемые соли. 7. Пентасахариды по п.6, отличающиеся тем, что только один из заместителей R1, R2, R3 или R4 представляет собой связь -T-Biot, где Т иBiot являются такими, как определено для (I). 8. Пентасахариды по любому из пп.6 и 7 формулы (I.3) формулы (I.4) где Т представляет собой одну из связей, выбранную из NH, или где j и k, которые являются одинаковыми или разными, представляют собой целые числа, которые могут принимать любое значение от 1 до 10;-O-CH2-, причем -CH2- группа связана с атомом углерода, несущим карбоксильную функциональную группу на том же кольце,W представляет собой атом кислорода или метиленовую группу,и их фармацевтически приемлемые соли. 9. Полисахариды по любому из пп.1 и 2,выбранные из метил-(2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонато-D-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(6-биотинамидо-6-дезокси-2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-[(2,3,6-три-O-метилD-глюкопиранозил)-(14)-O-(2,3,6-три-O-метилD-глюкопиранозил)-(14)]3-(6-O-сульфонато-2,3-ди-OметилD-глюкопиранозил)-(14)-(2,3-ди-OметилD-глюкопиранозилуроновая кислота)(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-O-сульфонатоD-глюкопиранозид, натриевая соль,метил-(2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонато-D-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(6-[6-(биотинамидо)гексамидо]-6-дезокси-2,3-ди-O-метилDглюкопиранозил)-(14)-(2,3,6-три-O-метилDглюкопиранозил)-(14)-[(2,3,6-три-O-метил-D-глюкопиранозил)-(14)-O-(2,3,6-три-O-метил-D-глюкопиранозил)-(14)]3-(6-O-сульфонато 2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3 ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-OсульфонатоD-глюкопиранозид, натриевая соль,метил-(2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонато-D-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(6-[6-(6-биотинамидогексамидо)гексамидо]-6-дезокси-2,3-ди-OметилD-глюкопиранозил)-(14)-(2,3,6-три-OметилD-глюкопиранозил)-(14)-[(2,3,6-триO-метилD-глюкопиранозил)-(14)-O-(2,3,6 три-O-метилD-глюкопиранозил)-(14)]3-(6O-сульфонато-2,3-ди-O-метилD-глюкопиранозил)-(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-OметилL-идопиранозилуроновая кислота)(14)-2,3,6-три-O-сульфонатоD-глюкопиранозид, натриевая соль,метил-(2-биотинамидо-2-дезокси-3,4-ди-Oметил-6-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонато 43-D-глюкопиранозил)-(14)-(2,3-ди-O-метил-L-идопиранозилуроновая кислота)-2,3,6-(14)(три-O-сульфонатоD-глюкопиранозид, натриевая соль,метил-(2-[6-(6-биотинамидогексамидо)гексамидо]-2-дезокси-3,4-ди-O-метил-6-O-сульфонато-D-глюкопиранозил)-(14)-(2,3-ди-O-метил-D-глюкопиранозилуроновая кислота)-(14)(2,3,6-три-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-O-сульфонато-D-глюкопиранозид, натриевая соль,метил-(2-[6-(6-биотинамидогексамидо)гексамидо]-2-дезокси-3,4-ди-O-метил-6-O-сульфонато-D-глюкопиранозил)-(14)-(2,3-ди-O-метил-D-глюкопиранозилуроновая кислота)-(14)(2,3,6-три-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-O-сульфонато-D-глюкопиранозид, натриевая соль. 10. Фармацевтические композиции, содержащие в качестве активного начала полисахарид по любому из пп.1-9, возможно, в комбинации с одним или более чем одним инертным и подходящим эксципиентом. 11. Применение фармацевтических композиций по п.10 при патологиях, являющихся результатом модификации гомеостаза системы коагуляции, проявляющейся при нарушениях сердечно-сосудистой и церебрально-васкулярной системы, таких как тромбоэмболические нарушения, связанные с атеросклерозом и диа 44 бетом, например нестабильная стенокардия,апоплексия, рестеноз после ангиопластики, эндартерэктомия или введение эндоваскулярных протезов, или тромбоэмболические нарушения,связанные с ретромбозом после тромболиза, с инфарктом, с деменцией ишемического происхождения, с периферическими артериальными заболеваниями, с гемодиализом или с предсердными фибрилляциями, во время использования сосудистых протезов для аортокоронарного шунтирования, при лечении или предупреждении тромбоэмболических патологий венозного происхождения, таких как легочные эмболии,для предупреждения или лечения тромботических осложнений, наблюдаемых после хирургических операций, роста опухолей или нарушений коагуляции, вызываемых бактериальными,вирусными или ферментными активаторами. 12. Применение полисахарида по любому из пп.1-9 для покрытия протезов. 13. Применение полисахарида по любому из пп.1-9 в качестве адъювантов во время эндартерэктомии, осуществляемой с использованием пористых баллонов. 14. Способ нейтрализации полисахаридов по любому из пп.1-9, включающий взаимодействие указанных полисахаридов с авидином или стрептавидином. 15. Применение авидина или стрептавидина в изготовлении лекарств, предназначенных для нейтрализации полисахаридов по любому из пп.1-9.
МПК / Метки
МПК: A61P 7/02, C08B 37/00, A61K 31/715
Метки: производным, антитромботической, одну, активноcтью, биотином, содержащие, ковалентную, меньшей, мере, полисахариды, связь, биотина
Код ссылки
<a href="https://eas.patents.su/23-5133-polisaharidy-s-antitromboticheskojj-aktivnoctyu-soderzhashhie-po-menshejj-mere-odnu-kovalentnuyu-svyaz-s-biotinom-ili-proizvodnym-biotina.html" rel="bookmark" title="База патентов Евразийского Союза">Полисахариды с антитромботической активноcтью, содержащие по меньшей мере одну ковалентную связь с биотином или производным биотина</a>
Предыдущий патент: Лекарственный препарат
Следующий патент: Способ получения 5-цианофталида
Случайный патент: Конструирование устойчивости к выходу в стрелку у сахарной свеклы с помощью трансгенной экспрессии гомолога гена ft свеклы, контролирующего время цветения












