Соединения, модулирующие активность ppar, и способы их получения
Номер патента: 9518
Опубликовано: 28.02.2008
Авторы: Браттон Лэрри Дон, Триведи Бхарат Калидас, Ауэрбах Брюс Джеффри, Гейер Эндрю Джордж, Филзен Гари Фредерик, Аненгст Пол Чарльз
Формула / Реферат
1. Соединение, выбранное из
[4-(бифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси]уксусной кислоты;
[5-метокси-2-метил-4-(4'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты;
[4-(2',4'-дихлорбифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси]уксусной кислоты;
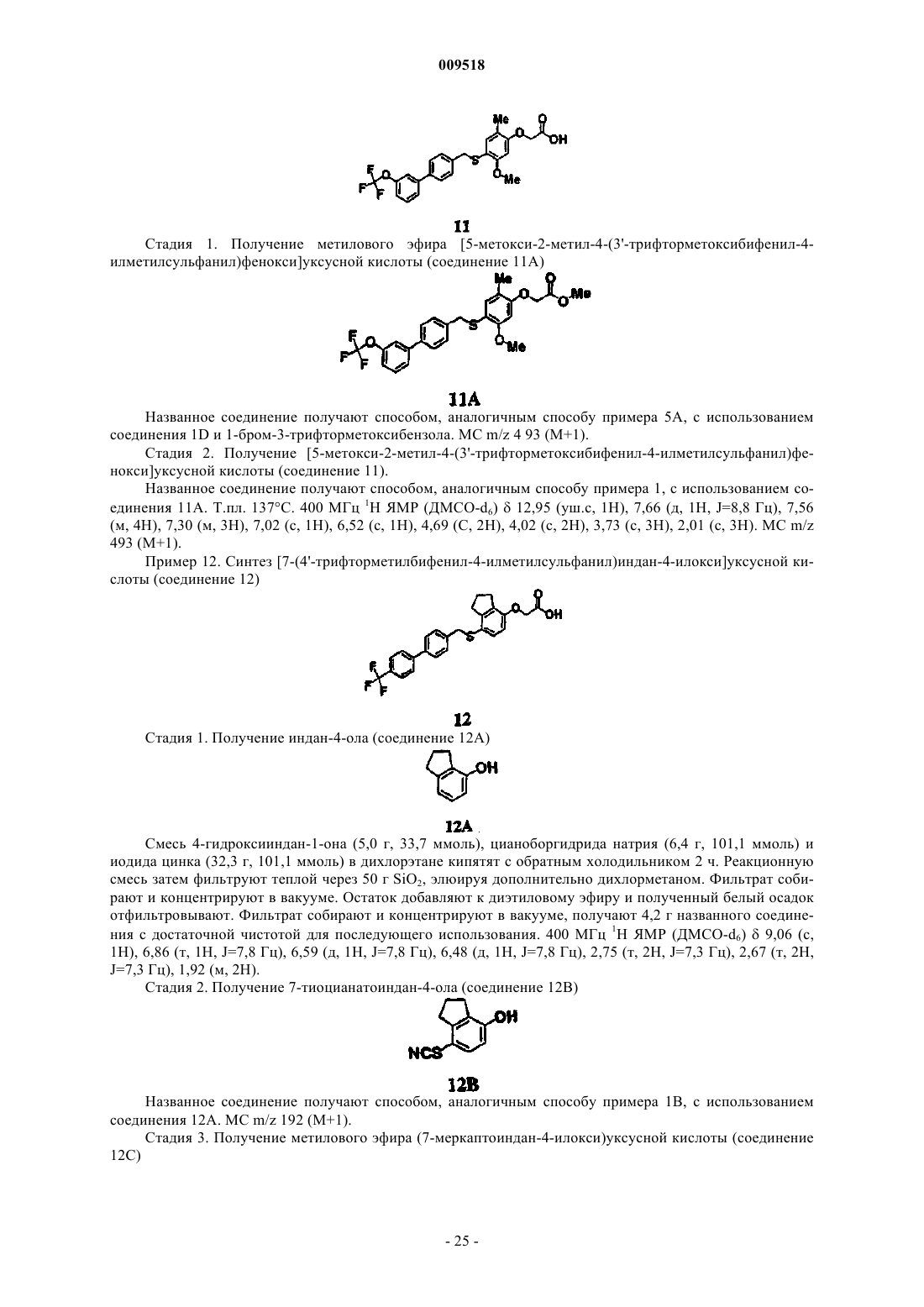
[5-метокси-2-метил-4-(3'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты;
[4-(4'-фторбифенил-4-илметилсульфанил-5-метокси-2-метилфенокси]уксусной кислоты;
[7-(4'-трифторметилбифенил-4-илметилсульфанил)индан-4-илокси]уксусной кислоты;
{5-метокси-2-метил-4-[4-(4-трифторметилбензилокси)бензилсульфанил]фенокси}уксусной кислоты;
[5-метокси-2-метил-4-(3'-трифторметоксибифенил-3-илметилсульфанил)фенокси]уксусной кислоты;
{5-метокси-2-метил-4-[4-(5-трифторметилпиридин-2-ил)бензилсульфанил]фенокси}уксусной кислоты;
{5-метокси-2-метил-4-[6-(4-трифторметилфенил)пиридин-3-илметилсульфанил]фенокси}уксусной кислоты;
[3-метокси-4-(4'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты;
{5-метокси-2-метил-4-[2-(4'-трифторметилбифенил-4-ил)этилсульфанил]фенокси}уксусной кислоты;
(4-{4-[2-(3-фторфенил)винил]бензилсульфанил}-5-метокси-2-метилфенокси)уксусной кислоты;
[5-метокси-2-метил-4-(3-метил-4'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты;
{4-[5-(4-хлорфенил)изоксазол-3-илметилсульфанил]-5-метокси-2-метилфенокси}уксусной кислоты;
{5-метокси-2-метил-4-[5-(4-трифторметилфенил)изоксазол-3-илметилсульфанил]фенокси}уксусной кислоты;
[5-метокси-2-метил-4-(4'-трифторметилбифенил-3-илметилсульфанил)фенокси]уксусной кислоты;
{7-[4-(4-трифторметилбензилокси)бензилсульфанил]индан-4-илокси}уксусной кислоты;
{5-метил-7-[4-(5-трифторметилпиридин-2-ил)бензилсульфанил]-2,3-дигидробензофуран-4-илокси} уксусной кислоты
и их фармацевтически приемлемых солей.
2. Фармацевтическая композиция для лечения или контроля дислипидемии или диабета, содержащая в качестве активного ингредиента соединение по п.1 в эффективном количестве, смешанное с носителем, разбавителем или наполнителем.
3. Способ лечения, профилактики или контроля инсулиннезависимого сахарного диабета у млекопитающего, включающий введение нуждающемуся млекопитающему терапевтически эффективного количества соединения по п.1.
4. Способ модулирования уровней лептина у млекопитающего, включающий введение нуждающемуся млекопитающему терапевтически эффективного количества соединения по п.1.
5. Способ лечения, профилактики или контроля дислипидемии у млекопитающего, включающий введение нуждающемуся млекопитающему терапевтически эффективного количества соединения по п.1.
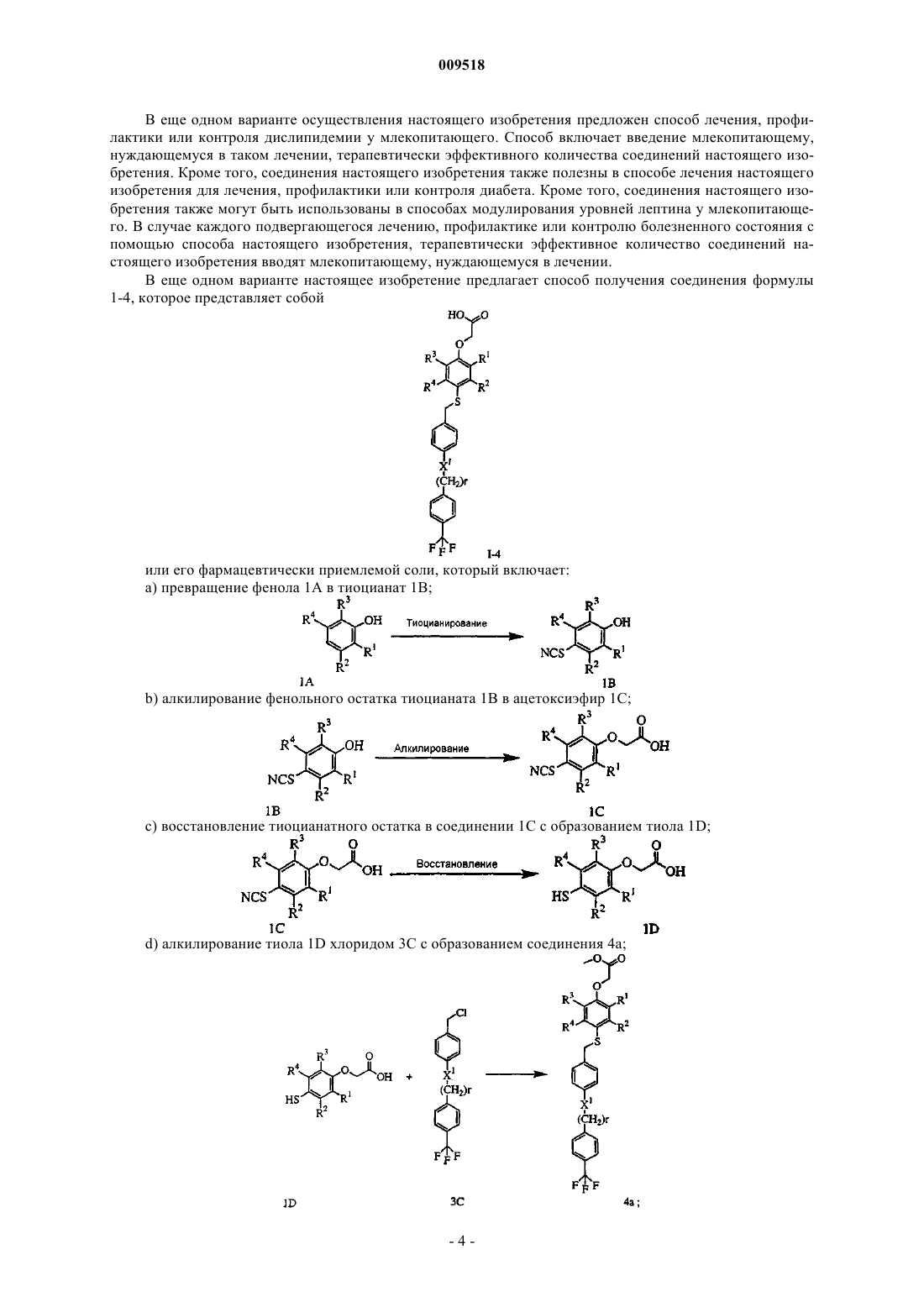
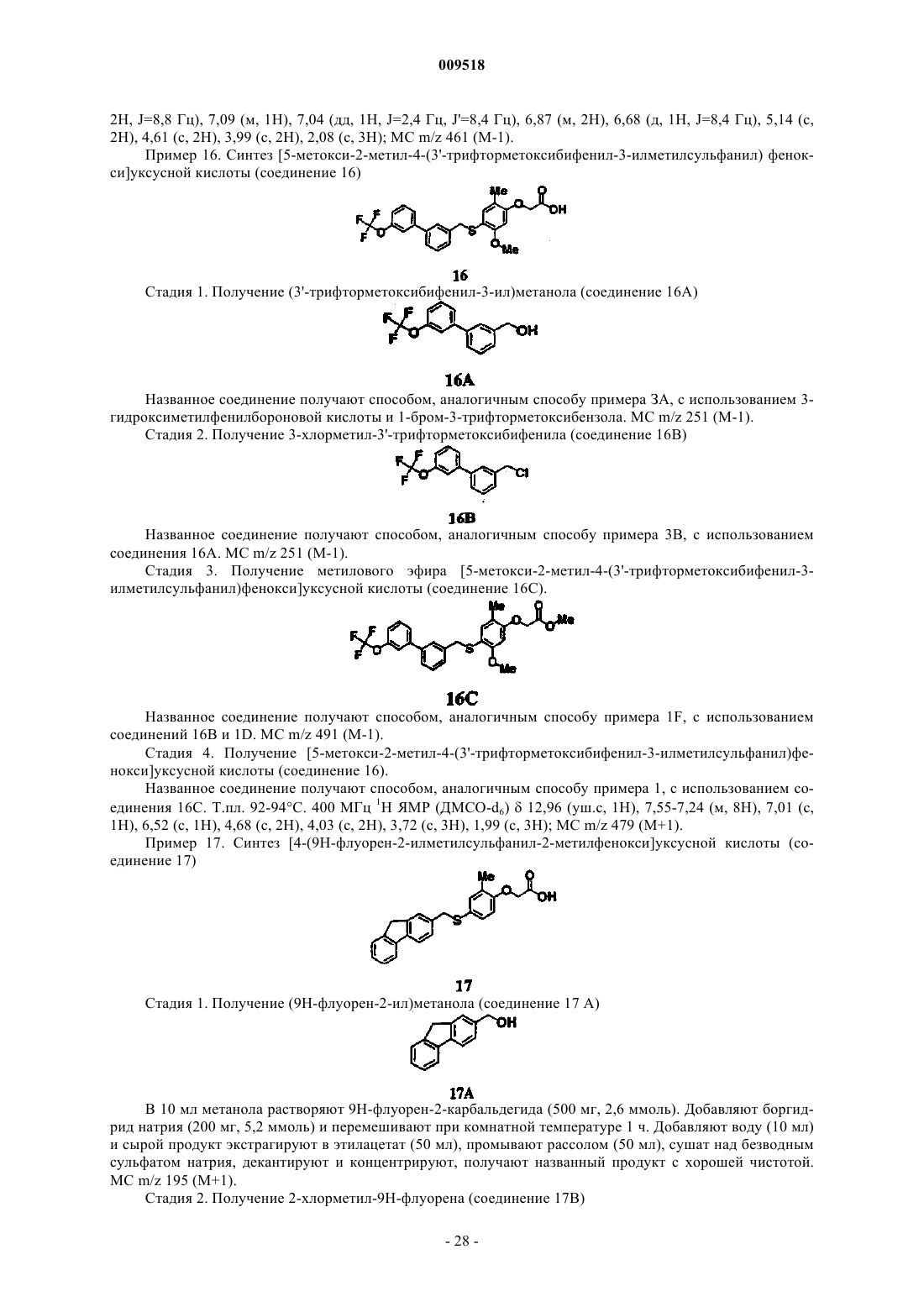
6. Способ получения соединения формулы I-4, которое представляет собой
включающий:
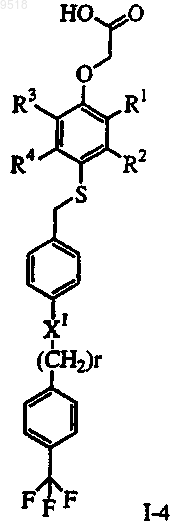
а) превращение фенола 1А в тиоцианат 1В
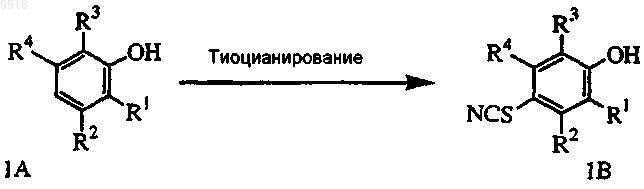
b) алкилирование фенольного остатка тиоцианата 1В до ацетоксиэфира 1С;
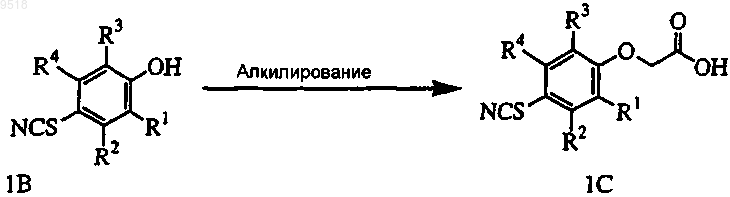
с) восстановление тиоцианатного остатка в 1С с образованием тиола 1D;

d) алкилирование тиола 1D хлоридом 3С с образованием соединения 4а;

и
е) омыление сложноэфирного остатка в соединении 4а с образованием I-4;
где R1 представляет собой атом водорода или вместе с R2 образует 5-членное карбоциклическое кольцо;
R2 представляет собой метоксигруппу или вместе с R1 образует 5-членное карбоциклическое кольцо;
R3 представляет собой атом водорода или метил;
R4 представляет собой атом водорода;
X1 отсутствует или представляет собой О и
r принимает значения 0 или 1.
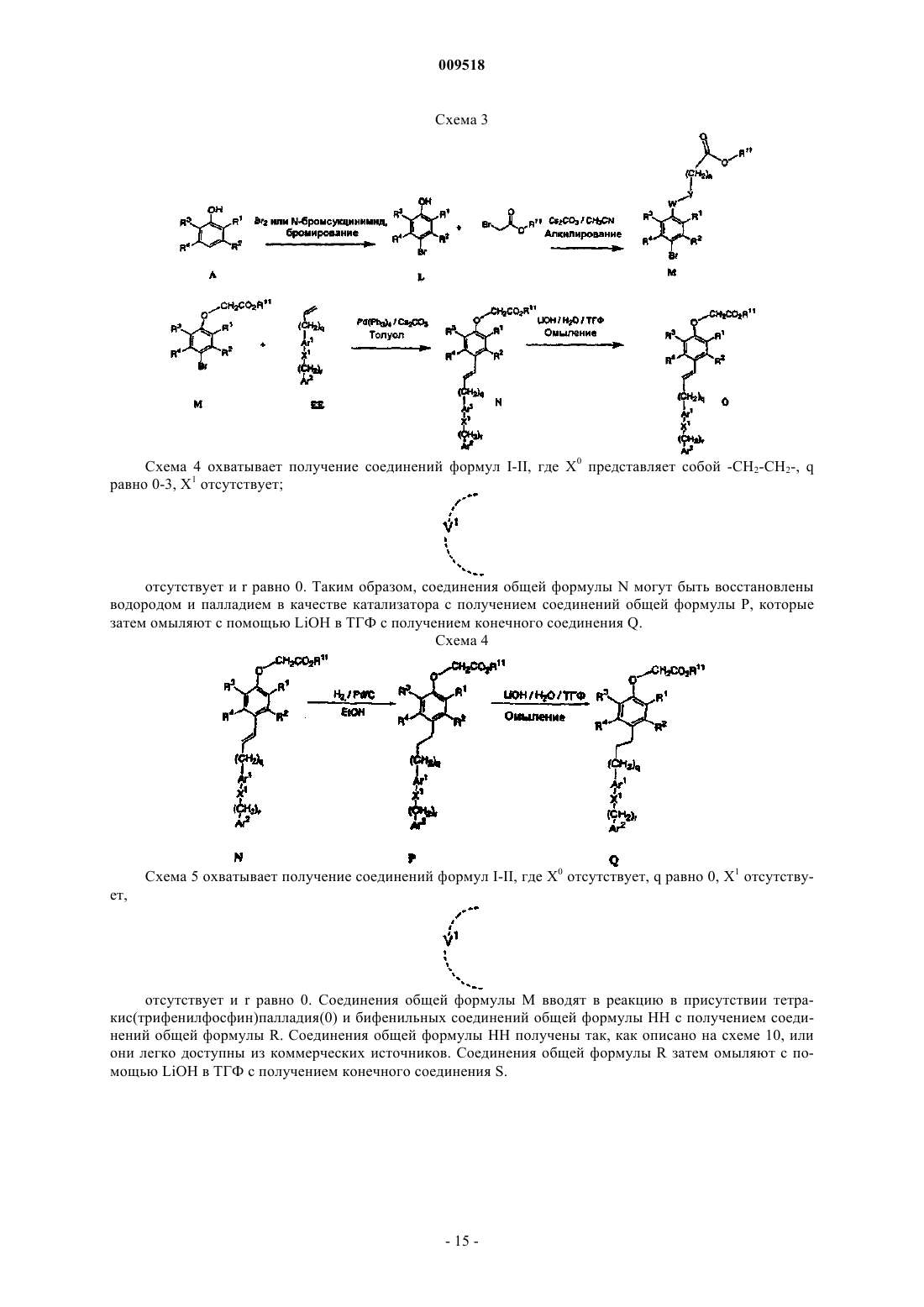
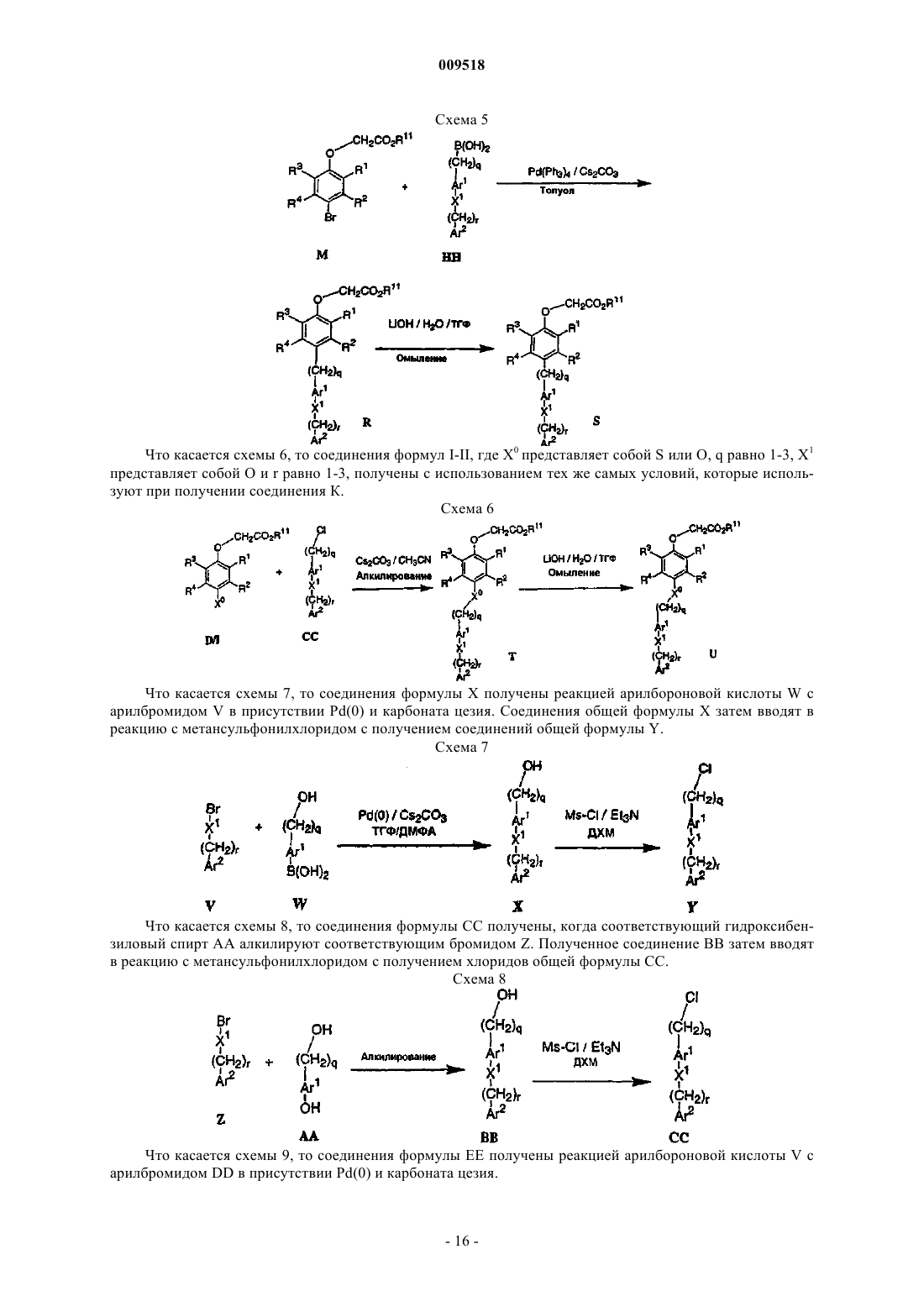
Текст
009518 Настоящий патент заявляет приоритет предварительных заявок на патент с регистрационными номерами:60/370508, направленный на рассмотрение 5 апреля 2002 г., и 60/386026, направленный на рассмотрение 5 июня 2002 г. Настоящее изобретение относится к соединениям и фармацевтическим препаратам, которые могут быть использованы для лечения состояний, опосредуемых рецепторами нуклеарных гормонов, более конкретно, к соединениям и фармацевтическим препаратам, которые модулируют активность рецептора активации пролифератора пероксисомы (PPAR). Гиперхолестеринемия, дислипидемия, диабет и ожирение являются хорошо известными факторами риска развития атеросклероза и ишемической болезни сердца. Эти заболевания характеризуются высоким уровнем холестерина и липидов в крови. Скопление холестерина в крови обычно зависит от пищевого усваивания холестерина из кишечника и от биосинтеза холестерина в теле, особенно в печени. Основная часть холестерина в плазме переносится на содержащих аполипопротеин-В липопротеинах, таких как липопротеины низкой плотности (LDL) и липопротеины очень низкой плотности (VLDL). Риск заболевания коронарной артерии у человека возрастает, когда повышаются уровни LDL и VLDL. Следовательно, высокие уровни холестерина, переносимые в липопротеинах высокой плотности (HDL), защищают от заболеваний сердечной артерии (Am. J. Med., 1977, 62:707-714). Статины, по-видимому, представляют собой наиболее важный класс понижающих уровень липидов лекарственных средств. Эти соединения ингибируют HMG-CoA-редуктазу, которая вовлечена в лимитирующую скорость стадию биосинтеза клеточного холестерина. Типичными примерами статинов являются аторвастатин, ловастатин, правастатин и симвастатин. Эффективность этих соединений зависит от регуляции рецептора LDL. Другими важными лекарственными средствами против липидемии являются фибраты, такие как гемфибрил и клофибрат, поглотители желчных кислот, такие как холестирамин и колестипол, пробукол и аналоги никотиновой кислоты. На сегодняшний день разработан целый ряд пероральных противодиабетических агентов. Наиболее часто используемыми гипогликемическими лекарственными средствами являются сульфонилмочевины. Сульфонилмочевины обычно используют для стимуляции инсулина. Бигуанидметформин обычно используют для улучшения чувствительности к инсулину и для снижения выработки печеночной глюкозы. Акарбозу используют для ограничения послеобеденной гипергликемии. Тиазолидин-2,4-дионы используют для усиления активности инсулина без повышения секреции инсулина. Ожирение представляет собой хроническое заболевание, которое сильно распространено в современном обществе и ассоциируется не только с общественным презрением, но также с пониженной продолжительностью жизни и множеством медицинских проблем, включая сахарный диабет, невосприимчивость к инсулину, гипертензию, гиперхолестеринемию, тромбоэмболическое заболевание и ишемическую болезнь сердца (Raisanen et al., British Medical Journal, 301:835-837 (1990. Лечение ожирения остается проблемой, и неясно, приводит ли диета к пониженному долговременному риску ранней смерти. Еще одним важным воздействием при ожирении является физическая активность. Однако физические упражнения, в целом, как установлено, могут быть только умеренно успешными для стимуляции снижения веса. Программа, объединяющая как диету, так и физические упражнения, а также поведенческая модификация, рассматривается как оптимальная методика снижения веса. Исследования показали, что сочетание как ограничения в пище, так и физических упражнений способствует значительной потере жира при сохранении мышечной ткани. Рецепторы активации пролифератора пероксисомы (PPAR) вовлечены в ряд биологических процессов и болезненных состояний, включая гиперхолестеринемию, дислипидемию и диабет. PPAR являются представителями подсемейства нуклеарных рецепторов факторов транскрипции, которые включают рецепторы стероида, тироида и витамина D. Они играют роль в контроле экспрессии белков, которые регулируют липидный метаболизм. Кроме того, PPAR активируются как жирными кислотами, так и метаболитами жирных кислот. Существует три подтипа PPAR-PPAR, PPAR (также называемые как PPAR) иPPAR. Каждый из рецепторов проявляет различную модель тканевой экспрессии и имеет отличия при активации структурно различными соединениями. Например, PPAR экспрессирует наиболее обильно в жировой ткани и в низких концентрациях в скелетной мышце, в сердце, печени, кишечнике, почке, сосудистом эндотелии и в клетках гладких мышц, а также макрофагах. Рецепторы PPAR связаны с регулированием инсулиновой чувствительности и уровнями глюкозы в крови, дифференциации макрофагов, воспалительной реакции и дифференциации клеток. Таким образом, PPAR связаны с ожирением, диабетом,карценогенезом, гиперплазией, атеросклерозом, дислипидемией и гиперхолестеринемией. Кроме того, PPAR является агонистом низших триглицеридов и холестерина LDL в плазме и, следовательно, может быть использован при лечении гипертриглицеридемии, дислипидемии и ожирения.PPAR ассоциируется с развитием инсулиннезависимого сахарного диабета (NIDDM), гипертензии и сердечно-сосудистого заболевания, дислипидемии и некоторых злокачественных новообразований. И,наконец, активация PPAR, как показано, повышает уровни HDL (Leibowitz, WO 97/28149, август 1997). Как установлено совсем недавно, селективные агонисты PPAR проявляют зависимое от дозы повышение сывороточного HDL-C и понижение LDL-C и VLDL-TG у невосприимчивых к инсулину макак резус-1 009518 среднего возраста (W.R. Oliver et al., PNAS, Vol. 98, p. 5306-5311, 2001). Противолипидемические, противодиабетические средства и средства против ожирения, как считают, все еще проявляют непостоянную эффективность. Эффективность противодиабетических и противолипидемических терапевтических средств имеет ограничения, в частности, из-за плохого соблюдения режима больными вследствие неприемлемых побочных эффектов. Такими побочными эффектами являются диарея и дискомфорт в желудочно-кишечном тракте, а в случае противодиабетических средств отек, гипогликемия и гепатотоксичность. Более того, каждый тип лекарства действует не одинаково хорошо у всех больных. По причинам, приведенным выше, существует необходимость в новых противолипидемических и противодиабетических средствах и средствах против ожирения, которые могут быть использованы отдельно или в комбинации. Кроме того, множество PPAR, например PPAR отдельно или в комбинации с одновременной активацией PPAR и/или PPAR, может быть желательно при создании препарата для лечения дислипидемии, при которой уровень HDL растет, а уровень LDL понижается. Настоящее изобретение предлагает соединения, способные модулировать активность PPAR. Соединения настоящего изобретения описываются формулой I и их фармацевтически приемлемыми солями, где Х 0 и X1 независимо друг от друга отсутствуют, представляют собой О, S, -CH2-, -CH2-CH2-,-CH=CH-, -CHCH-, -S(O)2- или -S(O)-;Ar1 и Ar2 каждый независимо друг от друга представляет собой незамещенный или замещенный арил или гетероарил, при условии, что Ar1 не является тиазолилом или оксазолилом; отсутствует; или, если присутствует, представляет собой насыщенную или ненасыщенную углеводородную цепь, которая является замещенной или незамещенной, где указанная цепь содержит от 1 до 4 атомов, так чтоR1 и R2 выбраны из атома водорода, низшего алкила, низшей алкоксигруппы, галогеналкила, -О(СН 2)mCF3, атома галогена, нитро-, цианогруппы, -ОН, -SH, -CF3, -S(О)ралкила, -S(О)рарила, -(CH2)mOR5,- (CH2)mNR6R7, -COR5, -CO2R5 или -NR6R7, или вместе с атомами, к которым они присоединены, образуют пяти-восьмичленное кольцо;R3 и R4 выбраны из атома водорода, низшего алкила, низшей алкоксигруппы, галогеналкила, -О(СН 2)mCF3, атома галогена, нитро-, циано-группы, -ОН, -SH, -CF3, -S(О)ралкила, -S(O)рарила, -(CH2)mOR5,- (CH2)mNR6R7, -COR5, -CO2H, -CO2R5 или -NR6R7; при условии, что по меньшей мере один из заместителей R1-R4 представляет собой Н, низший алкил, низшую алкоксигруппу, галогеналкил, -О-(СН 2)mCF3, атом галогена, нитро-, цианогруппу, -ОН, -SH,-CF3, -S(O)pалкил, -S(O)pарил, -(CH2)mOR5, -(CH2)mNR6R7 или -NR6R7;R5 представляет собой атом водорода, алкил, алкенил, алкинил или арил;R6 и R7 каждый независимо друг от друга представляет собой атом водорода, алкил, алкенил, алкинил, -СО-алкил, -СО-арил, циклоалкил, -СО 2-алкил, -СО 2-арил, или R6 и R7 вместе с атомами, к которым они присоединены, образуют 4-7-членное кольцо, содержащее от 1 до 3 гетероатомов;m принимает значения от 0 до 5; р принимает значения 0, 1 или 2;q принимает значения от 0 до 6; иr принимает значения от 0 до 6. Настоящее изобретение также предлагает соединение формулы (II): и его фармацевтически приемлемые соли, где Х 0 и X1 независимо друг от друга отсутствуют, представляют собой О, S, -СН 2-, -СН 2-СН 2-,-СН=СН-, СНСН-, -S(O)2- или -S(O)-;Ar1 и Ar2 каждый независимо друг от друга представляет собой незамещенный или замещенный арил или гетероарил, при условии, что Ar1 не является тиазолилом или оксазолилом; отсутствует; или, если присутствует, представляет собой насыщенную или ненасыщенную углеводородную цепь, которая является замещенной или незамещенной, где указанная цепь содержит от 1 до 4 атомов, так чтоR3 и R4 выбраны из атома водорода, низшего алкила, низшей алкокси-группы, галогеналкила,-О-(СН 2)mCF3, атома галогена, нитро-, цианогруппы, -ОН, -SH, -CF3, -S(О)ралкила, -S(О)рарила,-(CH2)mOR5, -(CH2)mNR6R7, -COR5, -CO2H, -CO2R5 или -NR6R7;R5 представляет собой атом водорода, алкил, алкенил, алкинил или арил;R6 и R7 каждый независимо друг от друга представляет собой атом водорода, алкил, алкенил, алкинил, -СО-алкил, -СО-арил, циклоалкил, -СО 2-алкил, -СО 2-арил, -SO2-алкил, -SO2-арил, или R6 и R7 вместе с атомами, к которым они присоединены, образуют 4-7-членное кольцо, содержащее от 1 до 3 гетероатомов; представляет собой насыщенную или ненасыщенную,замещенную или незамещенную углеводородную цепь или углеводородную цепь с гетероатомами,содержащую от 3 до 6 атомов, где атом углерода во 2 положении присоединен к атому углерода в 3 положении с образованием 5-8-членного кольца;m принимает значения от 0 до 5; р принимает значения от 0 до 2;q принимает значения от 0 до 6; иr принимает значения от 0 до 6.-3 009518 В еще одном варианте осуществления настоящего изобретения предложен способ лечения, профилактики или контроля дислипидемии у млекопитающего. Способ включает введение млекопитающему,нуждающемуся в таком лечении, терапевтически эффективного количества соединений настоящего изобретения. Кроме того, соединения настоящего изобретения также полезны в способе лечения настоящего изобретения для лечения, профилактики или контроля диабета. Кроме того, соединения настоящего изобретения также могут быть использованы в способах модулирования уровней лептина у млекопитающего. В случае каждого подвергающегося лечению, профилактике или контролю болезненного состояния с помощью способа настоящего изобретения, терапевтически эффективное количество соединений настоящего изобретения вводят млекопитающему, нуждающемуся в лечении. В еще одном варианте настоящее изобретение предлагает способ получения соединения формулы 1-4, которое представляет собой или его фармацевтически приемлемой соли, который включает: а) превращение фенола 1 А в тиоцианат 1 В;b) алкилирование фенольного остатка тиоцианата 1 В в ацетоксиэфир 1 С; с) восстановление тиоцианатного остатка в соединении 1 С с образованием тиола 1D;-4 009518 и е) омыление сложноэфирного остатка в соединении 4 а с образованием 1-4; гдеR1 представляет собой атом водорода или вместе с R2 образует 5-членное карбоциклическое кольцо;R2 представляет собой метоксигруппу или вместе с R1 образует 5-членное карбоциклическое кольцо;R3 представляет собой атом водорода или метил;R4 представляет собой атом водорода;X1 отсутствует или представляет собой О; иr принимает значения 0 или 1. Если не оговорено особо, используются следующие определения. Галоген представляет собой атом фтора, хлора, брома или йода. Алкил, алкоксигруппа, алкенил, алкинил и т.д. означают как линейные,так и разветвленные группы; но в случае индивидуального радикала, такого как пропил, определение охватывает только линейный радикал, причем разветвленный изомер, такой как изопропил, определяется конкретно. Определение алкил, используемое в данном случае, относится к линейному или разветвленному углеводороду, содержащему от 1 до 11 атомов углерода, и включает, например, метил, этил, н-пропил,изопропил, н-бутил, втор-бутил, изобутил, трет.-бутил, н-пентил, н-гексил и т.д. Алкильная группа также может быть замещена одним или несколькими заместителями, выбираемыми из низшей алкоксигруппы,низшей тиоалкоксигруппы, -О(СН 2)1-5CF3, атома галогена, нитро-, цианогруппы, =O, =S, -ОН, -SH, -CF3, OCF3, -CO2H, -СО 2 С 1-С 6-алкила, NH2, -NHC1-С 6-алкила, -CONR'R" или -N (C1-С 6-алкила)2, где R' и R" независимо друг от друга представляют собой алкил, алкенил, алкинил, арил или, соединенные вместе,образуют 4-7-членное кольцо. Предпочтительные алкильные группы содержат от 1 до 6 атомов углерода(C1-С 6-алкил). Определение низший алкил, используемое в данном случае, относится к подряду алкила, который означает линейный или разветвленный углеводородный радикал, содержащий от 1 до 6 атомов углерода,и включает, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет.-бутил, нпентил, н-гексил и т.д. Необязательно в данном случае определение низший алкил называется C1-С 6 алкилом. Определение галогеналкил, используемое в данном случае, относится к низшему алкильному радикалу, который определен выше, содержащему по меньшей мере один галогеновый заместитель, например хлорметил, фторэтил, трифторметил или 1,1,1-трифторэтил и т.д. Галогеналкил также может включать перфторалкил, где все атомы водорода низшей алкильной группы замещены атомами фтора. Определение алкенил означает линейный или разветвленный ненасыщенный углеводородный радикал, содержащий от 2 до 12 атомов углерода, и включает, например, этенил, 1-пропенил, 2 пропенил, 1-бутенил, 2-бутенил, 1-пентенил, 2-пентенил, 3-метил-3-бутенил, 1-гексенил, 2-гексенил, 3 гексенил, 3-гептенил, 1-октенил, 1-ноненил, 1-деценил, 1-ундеценил, 1-додеценил и т.д. Определение алкинил означает линейный или разветвленный углеводородный радикал, содержащий от 2 до 12 атомов углерода по меньшей мере с одной тройной связью, и включает, например, 1 пропинил, 1-бутинил, 3-бутинил, 1-пентинил, 3-пентинил, 3-метил-3-бутинил, 1-гексинил, 3-гексинил, 3 гептинил, 1-октинил, 1-нонинил, 1-децинил, 1-ундецинил, 1-додецинил и т.д. Определение алкилен, используемое в данном случае, относится к двухвалентной группе, полученной из линейной или разветвленной насыщенной углеводородной цепочки, содержащей от 1 до 10 атомов углерода, путем удаления двух атомов водорода, и включает, например, метилен, 1,2-этилен, 1,1 этилен, 1,3-пропилен, 2,2-диметилпропилен и т.д. Алкиленовые группы этого изобретения необязательно могут быть замещены. Алкиленовая группа также может быть замещена одним или несколькими заместителями, выбираемыми из низшего алкила, низшей алкокси-группы, низшей тиоалкокси-группы, -О(СН 2)1-5CF3, атома галогена, нитро-, циано-группы, =O, =S, -ОН, -SH, -CF3, -CO2H, -CO2C1-C6-алкила,-NH2, -NHC1-С 6-алкила, -CONR'R" или -N (C1-С 6-алкила)2, где R' и R" независимо друг от друга представляют собой алкил, алкенил, алкинил, арил или, соединенные вместе, образуют 4-7-членное кольцо. Предпочтительные алкиленовые группы содержат от 1 до 6 атомов углерода (C1-С 6-алкил). Определение циклоалкил означает углеводородное кольцо, содержащее от 3 до 12 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, декалинил, норпинанил и адамантил. Когда это возможно, циклоалкильная группа может содержать двойные связи, например 3-циклогексен-1-ил. Циклоалкильное кольцо может быть не замещено или замещено 1-3 заместителями, выбираемыми из алкила, алкокси-, тиоалкокси-, гидроксигруппы, тиола, нитрогруппы,атома галогена, аминогруппы, алкила и диалкиламиногруппы, формила, карбоксила, CN, -NH-CO-R',-CO-NHR'-, -CO2R', -COR', арила или гетероарила, где алкил, арил и гетероарил имеют значения, определенные выше. Примерами замещенных циклоалкильных групп являются фторциклопропил, 1-иодциклобутил, 2,3-диметилциклопентил, 2,2-диметоксициклогексил и 3-фенилциклопентил. Определение гетероатом, используемое в данном случае, означает атом кислорода, атом азота или серы (О, N или S), а также сульфоксил или сульфонил (SO или SO2), если не оговорено особо. Определение гетероциклоалкил означает моноциклическую, конденсированную, мостиковую или-5 009518 спиро-бициклическую гетероциклическую систему. Моноциклические гетероциклические кольца содержат приблизительно от 3 до 12 атомов, причем от 1 до 5 гетероатомов, выбираемых из О, N и S, и предпочтительно содержат от 3 до 7 атомов в кольце. Бициклические гетероциклы содержат в кольце от 7 до 17 атомов, предпочтительно от 7 до 12 атомов. Бициклические гетероциклы содержат приблизительно от 7 до 17 кольцевых атомов, предпочтительно от 7 до 12 кольцевых атомов. Бициклические гетероциклы могут быть конденсированными, спиро- или мостиковыми кольцевыми системами. Примерами гетероциклических групп являются циклические простые эфиры (оксираны), такие как этиленоксид, тетрагидрофуран, диоксан, и замещенные циклические простые эфиры, где заместители представляют собой заместители, описанные выше для алкильных и циклоалкильных групп. Типичными замещенными циклическими простыми эфирами являются пропиленоксид, фенилоксиран (стиролоксид), цис-2-бутеноксид(2,3-диметилоксиран), 3-хлортетрагидрофуран, 2,6-диметил-1,4-диоксан и др. Гетероциклы, содержащие атом азота, представляют собой такие группы, как пирролидин, пиперидин, пиперазин, тетрагидротриазин, тетрагидропиразол, и замещенные группы, такие как 3-аминопирролидин, 4-метилпиперазин-1-ил и др. Типичными содержащими атом серы гетероциклами являются тетрагидротиофен, дигидро-1,3 дитиол-2-ил и гексагидротиепин-4-ил. Другие обычно используемые гетероциклы представляют собой дигидрооксатиол-4-ил, тетрагидрооксазолил, тетрагидрооксадиазолил, тетрагидродиоксазолил, тетрагидрооксатиазолил, гексагидротриазинил, тетрагидрооксазинил, морфолинил, тиоморфолинил, тетрагидропиримидинил, диоксолинил, октагидробензофуранил, октагидробензимидазолил и октагидробензотиазолил. В число гетероциклов, содержащих атом серы, также включены окисленные по атому серы гетероциклы, содержащие группы SO или SO2. Примерами являются сульфоксидная и сульфоновая формы тетрагидротиофена. Определение углеводородная цепь, используемое в данном случае, относится к линейному углеводороду, содержащему от 2 до 6 атомов углерода. Углеводородная цепь необязательно замещена одним или несколькими заместителями, выбираемыми из низшего алкила, низшей алкокси-группы, низшей тиоалкокси-группы, -О (СН 2)0-2CF3, атома галогена, нитро-, цианогруппы, =O, =S, -ОН, -SH, -CF3,-СО 2 Н, -СО 2 С 1-С 6-алкила, -NH2, -NHC1-С 6-алкила, -CONR'R" или -N (C1-C6-алкила)2, где R' и R" независимо друг от друга представляют собой алкил, алкенил, алкинил, арил или, соединенные вместе, образуют 4-7-членное кольцо. Определение арил означает циклическое или полициклическое ароматическое кольцо, содержащее от 5 до 12 атомов углерода, и является незамещенным или замещенным в количестве до 4-х групп,выбираемых из C1-С 6-алкила, циклоалкила, гетероарила, диалкиламиноалкоксигруппы или групп, которые перечислены выше в качестве заместителей в случае алкила. Определение арил включает как одновалентные образцы, например, где Ar2 представляет собой арил, и двухвалентные образцы, например, гдеAr1 представляет собой арил. Примерами арильных групп являются, но не ограничиваются только ими,фенил, бифенил, нафтил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-метилфенил, 3-метилфенил, 4 метилфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-хлор-3-метилфенил, 2-хлор-4 метилфенил, 2-хлор-5-метилфенил, 3-хлор-2-метилфенил, 3-хлор-4-метилфенил, 4-хлор-2-метилфенил,4-хлор-3-метилфенил, 5-хлор-2-метилфенил, 2,3-дихлорфенил, 2,5-дихлорфенил, 3,4-дихлорфенил, 2,3 диметилфенил, 3,4-диметилфенил, 4-трифторметил и т.д. Определение гетероарил означает ароматическое моно-, би- или полициклическое кольцо, включающее один или несколько (например, 1-4) гетероатомов, выбираемых из N, О и S. Определение гетероарил включает как одновалентные образцы, например, где Ar2 представляет собой гетероарил, и двухвалентные образцы, например, где Ar1 представляет собой гетероарил. Следует понимать, что гетероцикл необязательно замещен заместителями в количестве до 4 групп, выбираемых из C1-С 6-алкила, циклоалкила, гетероарила, диалкиламиноалкоксигруппы или групп, которые перечислены выше в качестве заместителей в случае алкила. Примерами подходящих моноциклических гетероарилов являются, но не ограничиваются только ими, замещенный или незамещенный тиенил, фуранил, пирролил, имидазолил,пиразолил, изотиазолил, изоксазолил, триазолил, тетразолил, пиридинил, пиразинил, пиримидинил, пиперидинил, пирролидинил, пиперазинил, азетидинил, азиридинил, морфолинил, тиетанил, оксетарил. Предпочтительными моноциклическими дигетероциклами являются, но не ограничиваются только ими,1-, 2-, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 3-, 4- или 5-изотиазолил, 3-, 4- или 5-изоксазолил,1-, 3- или 5-триазолил, 1-, 2- или 3-тетразолил, 2-пиразинил, 2-, 4- или 5-пиримидинил, 1- или 2 пиперазинил, 2-, 3- или 4-морфолинил. Примерами подходящих бициклических и полициклических гетероарильных групп являются, но не ограничиваются только ими, 1-, 2-, 3-, 5-, 6-, 7- или 8-индолизинил, 1-,3-, 4-, 5-, 6- или 7-изоиндолил, 2-, 3-, 4-, 5-, 6- или 7-индолил, 2-, 3-, 4-, 5-, 6- или 7-индазолил, 2-, 4-, 5-,6-, 7- или 8-пуринил, 1-, 2-, 3-, 4-, 6-, 7-, 8- или 9-хинолизинил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолиил, 1-, 3-,4-, 5-, 6-, 7- или 8-изохинолиил, 1-, 4-, 5-, 6-, 7- или 8-фталазинил, 2-, 3-, 4-, 5- или 6-нафтиридинил, 2-, 3-,5-, 6-, 7- или 8-хиназолинил, 3-, 4-, 5-, 6-, 7- или 8-циннолинил, 2-, 4-, 6- или 7-птеридинил, 1-, 2-, 3-, 4-,5-, 6-, 7- или 8-4 аН-карбазолил, 1-, 2-, 3-, 4-, 5-, 6-, 7- или 8-карбазолил, 1-, 3-, 4-, 5-, 6-, 7-, 8- или 9 карболинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-фенантридинил, 1-, 2-, 3-, 4-, 6-, 7-, 8- или 9-акридинил, 1-,2-, 4-, 5-, 6-, 7-, 8- или 9-перимидинил, 2-, 3-, 4-, 5-, 6-, 8-, 9- или 10-фенатролинил, 1-, 2-, 3-, 4-, 6-, 7-, 8 или 9-феназинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-фенотиазинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-6 009518 феноксазинил, 2-, 3-, 4-, 5-, 6- или 1-, 3-, 4-, 5-, 6-, 7-, 8-, 9- или 10-бензизохинолинил, 2-, 3-, 4- или тиено[2,3-b]фуранил, 2-, 3-, 5-, 6-, 7-, 8-, 9-, 10- или 11-7 Н-пиразино[2,3-c]карбазолил, 2-, 3-, 5-, 6- или 7-2 Нфуро[3,2-b]пиранил, 2-, 3-, 4-, 5-, 7- или 8-5 Н-пиридо [2,3-d]-о-оксазинил, 1-, 3- или 5-1 Н-пиразоло[4,3d]оксазолил, 2-, 4- или 5-4 Н-имидазо[4,5-d]тиазолил, 3-, 5- или 8-пиразино[2,3-d]пиридазинил, 2-, 3-, 5 или 6-имидазо[2,1-b]тиазолил, 1-, 3-, 6-, 7-, 8- или 9-фуро [3,4-с] циннолинил, 1-, 2-, 3-, 4-, 5-, 6-, 8-, 9-,10- или 11-4 Н-пиридо [2,3-c] карбазолил, 2-, 3-, 6- или 7-имидазо[1,2-b][1,2,4]триазинил, 7-бензо[b]тиенил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 2-, 4-, 5-, 6- или 7-бензимидазолил, 2-, 4-, 5-, 6- или 7 бензотиазолил, 1-, 2-, 4-, 5-, 6-, 7-, 8-или 9-бензоксапинил, 2-, 4-, 5-, 6-, 7- или 8-бензоксазинил, 1-, 2-, 3-,5-, 6-, 7-, 8-, 9-, 10- или 11-1 Н-пирроно [1,2-b][2]бензазапинил. Типичными конденсированными гетероароматическими группами являются, но не ограничиваются только ими, 2-, 3-, 4-, 5-, 6-, 7- или 8 хинолинил, 1-, 2-, 4-, 5-, 6-, 7- или 8-изохинолинил, 2-, 3-, 4-, 5-, 6- или 7-индолил, 2-, 3-, 4-, 5-, 6- или 7 бензо[b] тиенил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 2-, 4-, 5-, 6- или 7-бензимидазолил, 2-, 4-, 5-, 6- или 7 бензотиазолил. Определение углеводородная цепь с гетероатомами, используемое в данном случае, относится к углеводородной цепи, где один или несколько атомов углерода замещены гетероатомами. Углеводородная цепь с гетероатомами необязательно замещена одним или несколькими заместителями, выбираемыми из низшего алкила, низшей алкокси-группы, низшей тиоалкокси-группы, -О(СН 2)0-2CF3, атома галогена, нитро-, цианогруппы, =O, =S, -ОН, -SH, -CF3, -СО 2 Н, -СО 2 С 1-С 6-алкила, -NH2, -NHC1-C6-алкила,-CONR'R" или -N (C1-С 6-алкила)2, где R' и R" независимо друг от друга представляют собой алкил, алкенил, алкинил, арил или, соединенные вместе, образуют 4-7-членное кольцо. Определение гетероалкилен, используемое в данном случае, относится к алкиленовому радикалу,который определен выше, который содержит один или несколько гетероатомов, таких как атомы кислорода, серы или азота (с валентностью, завершенной атомом водорода или кислорода) в углеродной цепи или завершающими углеродную цепь. Определения низшая алкоксигруппа и низшая тиоалкоксигруппа, используемые в данном случае, относятся к О-алкилу или S-алкилу из 1-6 атомов углерода, который определен выше как низший алкил. Определение циклоалкенил означает циклоалкильную группу, содержащую от одного до нескольких двойных связей углерод-углерод. Примерами являются циклобутен, циклопентен, циклогексен,циклогептен, циклобутадиен, циклопентадиен и др. Символ означает связь к группе, когда образуется 4-8-членное кольцо. Обычно этот символ будет появляться в парах. Когда связь представлена линией, такой какэто подразумевает, что связь может отсутствовать или присутствовать, при условии, что конечное соединение является стабильным и имеет достаточную валентность. Определение больной означает всех млекопитающих, включая человека. Примеры больных включают людей, коров, собак, кошек, коз, овец, свиней и кроликов. Терапевтически эффективное количество представляет собой количество соединения настоящего изобретения, которое при введении больному ослабляет симптомы дислипидемии, инсулиннезависимого сахарного диабета, ожирения, гипергликемии, гиперхолестеринемии, гиперлипидемии,атеросклероза, гипертриглицеридемии, гиперинсулинемии, глюкозных нарушений, связанных с циркуляцией глюкокортикоидов, гормонов роста, катехоламинов, глюкагона или паратиреоидного гормона. Кроме того, терапевтически эффективное количество представляет собой количество соединения настоящего изобретения, которое при введении больному ослабляет симптомы нарушения потребления пищи, подавляет аппетит или модулирует уровни лептина. Определение фармацевтически приемлемая соль относитсятся к сравнительно нетоксичным, неорганическим и органическим основно- или кислотно-аддитивным солям соединений настоящего изобретения. Такие соли могут быть получены in situ во время конечного выделения и очистки соединений или путем отдельного взаимодействия очищенного соединения в его свободной форме с подходящими органическими или неорганическими основанием или кислотой и выделения образующейся в результате соли. Типичными солями являются соли гидробромид, гидрохлорид, сульфат, бусульфат, нитрат, ацетат,оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафталинмезилат, глюкогептонат, лактобионат и лаурилсульфонат и т.д. Соли также включают катионы на основе щелочных и щелочноземельных металлов, таких как натрий,литий, калий, кальций, магний и т.д., а также нетоксичные аммонийные, четвертичные аммонийные и аминные катионы, включая, но без ограничения, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.д. (См., например, публикацию BergeS.M., et al., "Pharmaceutical Salts", J. Pharm. Sci., 1977; 66:1-19, которая включена в описание в качестве ссылки). Форма свободного основания может быть регенерирована при введении соли в контакт с основанием. Хотя свободное основание может отличаться от солевой формы по своим физическим свойствам, таким как растворимость, соли эквивалентны их соответствующим свободным основаниям с точки зрения целей настоящего изобретения.-7 009518 Соединения настоящего изобретения описываются формулой I и их фармацевтически приемлемыми солями, гдеX0 и X1 независимо друг от друга отсутствуют, представляют собой О, S, -СН 2-, -СН 2-СН 2-,-СН=СН-, СНСН-, -S(O)2- или -S(O)-;Ar1 и Ar2 каждый независимо друг от друга представляет собой незамещенный или замещенный арил или гетероарил, при условии, что Ar1 не является тиазолилом или оксазолилом; отсутствует; или, если присутствует, представляет собой насыщенную или ненасыщенную углеводородную цепь, которая является замещенной или незамещенной, где указанная цепь содержит от 1 до 4 атомов, так чтоR1 и R2 выбраны из атома водорода, низшего алкила, низшей алкоксигруппы, галогеналкила, -О(СН 2)mCF3, атома галогена, нитро-, циано-группы, -ОН, -SH, -CF3, -S (О)ралкила, -S(O)pарила,-(CH2)mOR5, - (CH2)mNR6R7, -COR5, -CO2R5 или -NR6R7, или вместе с атомами, к которым они присоединены, образуют пяти-восьмичленное кольцо;R3 и R4 выбраны из атома водорода, низшего алкила, низшей алкоксигруппы, галогеналкила, -О(СН 2)mCF3, атома галогена, нитро-, цианогруппы, -ОН, -SH, -CF3, -S(О)ралкила, -S(О)рарила, -(CH2)mOR5,- (CH2)mNR6R7, -COR5, -CO2H, -CO2R5 или -NR6R7; при условии, что по меньшей мере один из заместителей R1-R4 представляет собой Н, низший алкил, низшую алкоксигруппу, галогеналкил, -О-(СН 2)mCF3, атом галогена, нитро-, цианогруппу, -ОН, -SH,-CF3, -S(О)ралкил, -S(O)рарил, -(CH2)mOR5, - (СН 2)mNR6R7 или -NR6R7;R5 представляет собой атом водорода, алкил, алкенил, алкинил или арил;R6 и R7 каждый независимо друг от друга представляет собой атом водорода, алкил, алкенил, алкинил, -СО-алкил, -СО-арил, циклоалкил, -СО 2-алкил, -СО 2-арил, или R6 и R7 вместе с атомами, к которым они присоединены, образуют 4-7-членное кольцо, содержащее от 1 до 3 гетероатомов;m принимает значения от 0 до 5; р принимает значения 0, 1 или 2;q принимает значения от 0 до 6; иr принимает значения от 0 до 6. В соединениях формулы I заместители R1, R2, R3 и R4 предпочтительно выбирают из атома водорода, алкила или алкоксигруппы. Более предпочтительно заместители R2 и R3 представляют собой атом водорода; и заместители R1 и R4 представляют собой алкил или алкоксигруппу. В особенно предпочтительном варианте формулы I заместители R2 и R3 представляют собой атом водорода; R1 представляет собой алкил и R4 представляет собой алкоксигруппу. Предпочтительными алкоксигруппами являются метокси-, этокси-, изопропокси-, н-пропокси-, трет.-бутокси-, н-бутокси- или изобутоксигруппы. Аналогично, предпочтительными алкильными группами являются метил, этил, изопропил, н-пропил, трет.бутил, н-бутил или изобутил. В наиболее предпочтительном варианте формулы I q равно 1, Ar1 представ-8 009518 ляет собой фенил, X1 отсутствует, r равно О, V1 отсутствует и Ar2 представляет собой 4 трифторметилфенил. В соединениях формулы I предпочтительно представляет собой (CH2)t, где t принимает значения от 1 до 4. Кроме того, необязательно замещен по меньшей мере одним заместителем, где заместитель представляет собой,но без ограничения, низший алкил, низшую алкоксигруппу, низшую тиоалкоксигруппу, -О(СН 2)0-2CF3,атом галогена, нитро-, цианогруппу, =O, =S, -ОН, -SH, -CF3, -OCF3, -CO2H, -СО 2 С 1-С 6-алкил, -NH2,-NHC1-C6-алкил, -CONR'R" или -N (C1-С 6-алкил)2, где R' и R" независимо друг от друга представляют собой алкил, алкенил, алкинил, арил или, соединенные вместе, образуют 4-7-членное кольцо. В предпочтительном варианте формулы I, заместители R1 и R2 соединены вместе с образованием пяти-восьмичленного кольца, имеющего формулу II. Такими кольцами являются, например, циклоалкильные, арильные, гетероциклоалкильные или гетероарильные кольца, где каждое из таких колец необязательно замещено, как описано выше, и его фармацевтически приемлемые соли, гдеX0 и X1 независимо друг от друга отсутствуют, представляют собой О, S, -СН 2-, -СН 2-СН 2-,-СН=СН-, СНСН-, -S(O)2- или -S(O)-;Ar2 и Ar2 каждый независимо друг от друга представляет собой незамещенный или замещенный арил или гетероарил, при условии, что Ar1 не является тиазолилом или оксазолилом; отсутствует; или, если присутствует, представляет собой насыщенную или ненасыщенную углеводородную цепь, которая является замещенной или незамещенной, где указанная цепь содержит от 1 до 4 атомов, так чтоR3 и R4 выбраны из атома водорода, низшего алкила, низшей алкоксигруппы, галогеналкила,-О-(СН 2)mCF3, атома галогена, нитро-, цианогруппы, -ОН, -SH, -CF3, -S(О)р-алкила, -S(O)p-арила,-(CH2)mOR5, - (СН 2) mNR6R7, -COR5, -CO2H, -CO2R5 или -NR6R7;R5 представляет собой атом водорода, алкил, алкенил, алкинил или арил;R6 и R7 каждый независимо друг от друга представляет собой атом водорода, алкил, алкенил, алкинил, -СО-алкил, -СО-арил, циклоалкил, -СО 2-алкил, -СО 2-арил, -SO2-алкил, -SO2-арил, или R6 и R7 вместе с атомами, к которым они присоединены, образуют 4-7-членное кольцо, содержащее от 1 до 3 гетероато-9 009518 мов; представляет собой насыщенную или ненасыщенную, замещенную или незамещенную углеводородную цепь или углеводородную цепь с гетероатомами, содержащую от 3 до 6 атомов, где атом углерода во 2 положении присоединен к атому углерода в 3 положении с образованием пяти-восьмичленного кольца;m принимает значения от 0 до 5; р принимает значения от 0 до 2;q принимает значения от 0 до 6; иr принимает значения от 0 до 6. Предпочтительно представляет собой -СН 2-СН 2-СО-О-,-CН 2-СН 2-O-CO-, -CH2-CH2-CH2-CH2-, -HC=CH-HC=CH-, -N=CH-HC=CH-, -HC=N-HC=CH-,-HC=CH-N=CH-, -HC=CH-HC=N-, -CH2-CH2-CH2-, -CH2-СН 2-О-СН 2-, -СН 2-О-СН 2-СН 2-, -СН 2-НС=СНСН 2-, -СН 2-НС=СН-, -СН 2-CH2-NR4-CH2-, -COCH=CH-O-, -O-CH=CH-CO-, -CH=CH-NR4-, -NR4-СН=СН-,-СН=СН-СН 2-, -CH2-CH2-NR4, -NR4-CH2-CH2-, -O-CH2-CH2-, -СН 2-СН 2-О-, -СН 2-СН 2-СО-, -СН 2-СО-СН 2-,-СО-СН 2-СН 2-, -СН 2-СН 2-СН 2-СО-, -СО-СН 2-СН 2-СН 2-, -СН 2-СО-СН 2-СН 2-, -СН 2-СН 2-СО-СН 2-,-СН 2CH2-CH2-NR4-, -NR4-CH2-CH2-CH2-, -О-СН 2-СН 2-СН 2-, -СН 2-СН 2-СН 2-О-, -CO-NR4-CH2-CH2-, -NR4-COCH2-CH2-, -CH2-CH2-NR4-CO- или -СН 2-СН 2-CO-NR4-. Следует понимать, что самый левый атом этих групп присоединен к атому, помеченному 3 в формуле I, а самый правый атом этих групп присоединен к атому с меткой 2 в формуле I. В данном варианте осуществления необязательно замещен одним или несколькими заместителями, выбираемыми из низшего алкила,низшей алкокси-группы, низшей тиоалкоксигруппы,-О(СН 2)1-5CF3, атома галогена, нитро-, цианогруппы, =O, =S, -ОН, -SH, -CF3, -СО 2 Н, -СО 2 С 1-С 6 алкила, -NH2, -NHC1-С 6-алкила, -ОСН 2 О-и -N (С 1-С 6-алкила)2. В соединениях формулы II заместители R3 и R4 предпочтительно выбраны из атома водорода, алкила или алкоксигруппы. Более предпочтительно заместители R3 и R4 представляют собой атом водорода; а представляет собой насыщенную или ненасыщенную, незамещенную углеводородную цепь, содержащую от 3 до 6 атомов, где атом углерода в положении 2 соединен с атомом углерода в положении 3 с образованием пяти-восьмичленного кольца, такого как циклопентильное или циклогексильное кольцо. В наиболее предпочтительном варианте формулы II q равно 1, Ar1 представляет собой фенил, X1 представляет собой О, r представляет собой 1, V1 отсутствует и Ar2 представляет собой 4-трифторметилфенил. Также в этом варианте осуществления изобретения предпочтительно представляет собой (CH2)t, где t принимает значения от 1 до 4. Кроме того, необязательно замещен по меньшей мере одним заместителем, где заместитель включает, но без ограничения, низший алкил, низшую алкоксигруппу, низшую тиоалкоксигруппу, -О(СН 2)0-2CF3, атом галогена, нитро-, цианогруппу, =O, =S, -ОН, -SH, -CF3, -OCF3, -CO2H, -СО 2 С 1-С 6-алкил, -NH2, -NHC1-С 6 алкил, -CONR'R" или -N(C1-C6-алкил)2, где R' и R" независимо друг от друга представляют собой алкил,алкенил, алкинил, арил или, соединенные вместе, образуют 4-7-членное кольцо. Подгруппу типичных соединений формулы I и II составляют:(4-4-[2-(3-фторфенил)винил]бензилсульфанил-5-метокси-2-метилфенокси)уксусная кислота; 5-метокси-2-метил-4-(3-метил-4'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусная кислота; 4-[5-(4-хлорфенил)изоксазол-3-илметилсульфанил]-5-метокси-2-метилфеноксиуксусная кислота; 5-метокси-2-метил-4-[5-(4-трифторметилфенил)изоксазол-3-илметилсульфанил]феноксиуксусная кислота; 5-метокси-2-метил-4-[3-(4-трифторметилфенил)изоксазол-5-илметилсульфанил]феноксиуксусная кислота; 5-метокси-2-метил-4-(4'-трифторметилбифенил-3-илметилсульфанил)фенокси]уксусная кислота; 7-[4-(4-трифторметилбензилокси)бензилсульфанил]индан-4-илоксиуксусная кислота; 5-метил-7-[4-(5-трифторметилпиридин-2-ил)бензилсульфанил]-2,3-дигидробензофуран-4 илоксиуксусная кислота; и их фармацевтически приемлемые соли. Соединения настоящего изобретения подходят для введения больному при лечении, контроле или профилактике дислипидемии, ожирения. Соединения настоящего изобретения также приемлемы для введения больному для модулирования лептина. Таким образом, соединения могут быть введены больному отдельно или как часть композиции, которая содержит другие компоненты, такие как наполнители,разбавители и носители, которые все хорошо известны в данной области. Композиции могут быть введены людям и/или животным или перорально, ректально, парентерально (внутривенно, внутримышечно или подкожно), интрацистерно, внутривагинально, внутрибрюшинно, внутрипузырно, локально (порошки, мази или капли) или в виде ротового или назального спрея. Композиции, подходящие для парентеральной инъекции, могут содержать физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для восстановления в стерильные инъецируемые растворы или дисперсии. Примерами подходящих водных и неводных носителей, разбавителей, растворителей и наполнителей являются вода, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и др.), их подходящие смеси, растительные масла (такие как оливковое масло) и инъецируемые органические сложные эфиры, такие как этилолеат. Соответствующая текучесть может быть сохранена, например, за счет использования покрытия,такого как лецитин, путем удерживания требуемого размера частиц в случае дисперсий и за счет использования поверхностно-активных веществ. Такие композиции также могут содержать вспомогательные вещества, такие как консерванты, смачивающие, эмульгирующие и диспергирующие агенты. Предотвращение действия микроорганизмов могут обеспечивать различные противобактериальные и противогрибковые агенты, например парабены,хлорбутанол, фенол, сорбиновая кислота и др. Также может быть желательно включение изотонических агентов, например сахаров, хлорида натрия и др. Пролонгированная абсорбция инъецируемой фармацевтической формы может быть вызвана за счет использования агентов, задерживающих абсорбцию, например моностеарата алюминия и желатина. Твердые дозированные лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных лекарственных формах активное соединение смешано по меньшей мере с одним инертным наполнителем (или носителем), таким как цитрат натрия или дикальцийфосфат, или (а) наполнителями или сухими разбавителями, такими как, например, крахмалы, лактоза, сахароза, глюкоза, маннит и салициловая кислота; (б) связующими веществами,такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь; (в) увлажнители, такие как, например, глицерин; (г) диспергирующие агенты, такие как, например, агар, карбонат кальция, картофельный крахмал и крахмал тапиоки, альгиновая кислота,некоторые комплексные силикаты и карбонат натрия; (д) замедлители растворения, такие как, например,парафин; (е) ускорители поглощения, такие как, например, четвертичные аммонийные соединения; (ж) смачивающие агенты, такие как, например, цетиловый спирт и моностеарат глицерина; (з) адсорбенты,такие как, например, каолин и бентонит; и (и) смазывающие вещества, такие как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия или их смеси. В случае- 11009518 капсул, таблеток или пилюль, дозированные лекарственные формы могут также включать буферные агенты. Твердые композиции аналогичного типа также могут быть использованы в качестве наполнителей в мягкие и твердые наполненные желатиновые капсулы с использованием таких наполнителей как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и т.д. Твердые дозированные лекарственные формы, такие как таблетки, капсулы, пилюли и гранулы, могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие хорошо известные в данной области покрытия. Они могут содержать затеняющие агенты и также могут представлять собой такие композиции, которые могут высвобождать активное соединение или соединения в определенной части желудочно-кишечного тракта замедленным образом. Примерами композиций с заделанным соединением, которые могут быть использованы, являются полимерные вещества и воски. Активные соединения также могут быть в микрокапсулированой форме, если это приемлемо, с одним или несколькими упомянутыми выше наполнителями. Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как, например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла, в особенности хлопковое масло, арахисовое масло, масло кукурузных завязей, оливковое масло, касторовое масло и кунжутное масло, глицерин, тетра-гидрофурфуриловый спирт, полиэтиленгликоли и сорбитановые сложные эфиры жирных кислот, или смеси таких веществ и др. Помимо таких инертных разбавителей композиции также могут включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подслащивающие вещества, корригирующие вещества и ароматизирующие агенты. Суспензии помимо активных соединений могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сорбитановые эфиры, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант или смеси таких веществ и т.д. Композиции для ректального введения предпочтительно представляют собой свечи, которые могут быть получены путем смешения соединений настоящего изобретения с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для свечей, которые являются твердыми при обычных температурах, но жидкими при температуре тела, и, следовательно, плавятся в ректальной или вагинальной полости и высвобождают активный компонент. Дозированные лекарственные формы для локального применения соединения настоящего изобретения включают мази, порошки, спреи и ингаляторы. Активные компоненты смешивают в стерильных условиях с физиологически приемлемым наполнителем и любым консервантом, буферным агентом или пролеллантом, как это может быть необходимо. Глазные препараты, глазные мази, порошки и растворы также рассматриваются как подпадающие под объем настоящего изобретения. Соединения настоящего изобретения могут быть введены больному при уровне доз в интервале приблизительно от 0,1 до 2 000 мг в день. Для нормального взрослого человека, имеющего вес тела приблизительно 70 кг, предпочтительной является доза в интервале приблизительно от 0,01 до 10 мг на кг веса тела. Однако конкретные дозы могут меняться. Например, доза может зависеть от ряда факторов,включая потребность больного, сложность состояния, подвергающегося лечению, и фармакологическая активность используемого соединения. Определение оптимальных дозировок в случае конкретного больного хорошо известно квалифицированным в данной области специалистам. Настоящее изобретение включает соединения, которые могут быть синтезированы рядом способов,аналогичных способам, известным специалистам в органическом синтезе. Перечисленные в документе соединения могут быть синтезированы в соответствии со способами, описанными ниже, наряду со способами, обычно используемыми химиками-синтетиками, и комбинациями или вариациями этих способов, которые в целом известны специалистам в области химического синтеза. Синтетические схемы для соединений в настоящем изобретении не ограничены способами, описанными ниже. Предполагается, что специалист в данной области сможет использовать схемы, описанные ниже, чтобы синтезировать соединения, заявленные в изобретении. Отдельные соединения могут требовать изменения условий, чтобы закрыть различные функциональные группы. Может потребоваться ряд защитных групп, в целом известных квалифицированным специалистам. Если необходимо, может быть проведена очистка на колонке с силикагелем при элюировании подходящей системой органических растворителей. Кроме того, может быть использована ВЭЖХ с обращенной фазой или перекристаллизация. Большое число соединений формул I и II предпочтительно получают при взаимодействии соединения: в растворителе в присутствии основания, такого как карбонат цезия, с арилгалогенидом:n, R1, R2, R3, R4, Х 0, X1, V1, Ar1 и Ar2 принимают те же значения, которые определены выше для формулы I;R11 представляет собой низший алкил; иX представляет собой атом галогена. Полученный сложный эфир затем предпочтительно гидролизуют с образованием соединений формул I и II. То есть соединения формул I и II могут быть получены с использованием метода синтеза,представленного на схемах 1-6. Схема 1 охватывает получение соединений формул I и II, где Х 0 представляет собой S, q равно 0-3, отсутствует, X1 отсутствует и r равно 0. Соединения общей формулы А подвергают тиоцианированию смесью брома и тиоцианата натрия с получением соединений общей формулы В. Соединения общей формулы В затем алкилируют алкилгалогенкарбоксилатом с получением соединения общей формулы С. Предпочтительным алкилгалогенкарбоксилатом является метилбромацетат. Альтернативные способы получения соединения С будут легко понятны для специалиста в области органического синтеза. Соединения общей формулы D затем получают восстановлением соединения С дитиотреитом в метаноле. Соединения общей формулы D затем алкилируют соединениями общей формулы Y так же, как и в случает соединения В, с получением соединения Е. Соединения общей формулы Y получают так, как представлено на схеме 7 (см. ниже), или эти соединения легко доступны из коммерческих источников. Затем соединения общей формулы Е омыляют с помощью LiOH в ТГФ с получением конечного соединения F. Схема 1- 13009518 Схема 2 охватывает получение соединений формул I и II, где Х 0 представляет собой О, q равно 0-3, X1 отсутствует, отсутствует и r равно 0. Соединения общей формулы А алкилируют алкилгалогенкарбоксилатом с получением соединения общей формулы G. Предпочтительным алкилгалогенкарбоксилатом является метилбромацетат. Альтернативные способы получения соединений G, когда Y представляет собой О,будут вполне очевидны для специалиста в области органического синтеза. Соединения общей формулыG затем ацилируют с использованием условий ацилирования по Фриделю-Крафтцу с получением соединений общей формулы Н, которые затем окисляют м-хлорнадбензойной кислотой, после чего следует гидролиз с получением фенольных соединений общей формулы I. Соединения общей формулы I затем вводят в реакцию способом, аналогичным описанному в случае соединения D, с получением после омыления с помощью LiOH в ТГФ соединений общей формулы K. Схема 2 Схема 3 охватывает получение соединений формул I и II, где Х 0 представляет собой -СН 2-СН 2-,-С=С-, q равно 0-3, X1 отсутствует, отсутствует и r равно 0. Соединения общей формулы А бромируют бромом с использованием уксусной кислоты в качестве растворителя, получают соединение L. С другой стороны, можно использовать N-бромсукцинимид вместо брома и дихлорметан вместо уксусной кислоты в качестве растворителя. Соединения общей формулы L затем алкилируют алкилгалогенкарбоксилатом с получением соединений общей формулы М. Предпочтительным алкилгалогенкарбоксилатом является метилбромацетат. Альтернативные способы получения соединений формулы М будут легко понятны для специалиста в области органического синтеза. Затем соединения общей формулы М вводят в реакцию в присутствии тетракис(трифенилфосфин)палладия(0) с бифенильными соединениями общей формулы ЕЕ с получением соединений общей формулы N. Соединения общей формулы ЕЕ получены так, как описано на схеме 9, или они легко доступны из коммерческих источников. Соединения общей формулы N затем омыляют с помощью LiOH в ТГФ с получением конечного соединения О. Схема 4 охватывает получение соединений формул I-II, где Х 0 представляет собой -СН 2-СН 2-, q равно 0-3, X1 отсутствует; отсутствует и r равно 0. Таким образом, соединения общей формулы N могут быть восстановлены водородом и палладием в качестве катализатора с получением соединений общей формулы Р, которые затем омыляют с помощью LiOH в ТГФ с получением конечного соединения Q. Схема 4 Схема 5 охватывает получение соединений формул I-II, где Х 0 отсутствует, q равно 0, X1 отсутствует, отсутствует и r равно 0. Соединения общей формулы М вводят в реакцию в присутствии тетракис(трифенилфосфин)палладия(0) и бифенильных соединений общей формулы НН с получением соединений общей формулы R. Соединения общей формулы НН получены так, как описано на схеме 10, или они легко доступны из коммерческих источников. Соединения общей формулы R затем омыляют с помощью LiOH в ТГФ с получением конечного соединения S. Что касается схемы 6, то соединения формул I-II, где Х 0 представляет собой S или О, q равно 1-3, X1 представляет собой О и r равно 1-3, получены с использованием тех же самых условий, которые используют при получении соединения К. Схема 6 Что касается схемы 7, то соединения формулы X получены реакцией арилбороновой кислоты W с арилбромидом V в присутствии Pd(0) и карбоната цезия. Соединения общей формулы X затем вводят в реакцию с метансульфонилхлоридом с получением соединений общей формулы Y. Схема 7 Что касается схемы 8, то соединения формулы СС получены, когда соответствующий гидроксибензиловый спирт АА алкилируют соответствующим бромидом Z. Полученное соединение ВВ затем вводят в реакцию с метансульфонилхлоридом с получением хлоридов общей формулы СС. Схема 8 Что касается схемы 9, то соединения формулы ЕЕ получены реакцией арилбороновой кислоты V с арилбромидом DD в присутствии Pd(0) и карбоната цезия. Что касается схемы 10, то соединения формулы НН получены реакцией арилбромида V с бороновой кислотой FF с получением соединения GG. Соединения общей формулы GG затем вводят в реакцию с алкиллитиевым реагентом и затем гасят боратом, который гидролизуется, давая соединения общей формулы НН. Схема 10 Что касается схемы 11, то соединения формул I-II, где Х 0 представляет собой S или О, q равно 1-3,X отсутствует, r равно 0 и V1 представляет собой насыщенную или ненасыщенную углеводородную цепь, которая является замещенной или незамещенной, получены с использованием тех же самых условий, которые используют при получении соединения К. Соединения общей формулы NN получены так,как представлено на схеме 12, или являются легко доступными из коммерческих источников. Схема 11 1 Что касается схемы 12, то соединения формулы NN могут быть получены при взаимодействии соответствующим образом замещенного ариламина LL в условиях реакции Зандмейера, после чего следует нагревание с получением промежуточного соединения ММ. Полученное промежуточное соединение ММ затем вводят в реакцию с метансульфонилхлоридом с получением хлоридов общей формулы NN. Схема 12 Не все соединения формул I и II, попадающие в рассматриваемый класс, могут быть совместимы с некоторыми описанными условиями реакций. Такие ограничения вполне очевидны для специалиста в области органического синтеза, и могут быть использованы альтернативные способы. Следующие не ограничивающие описания также иллюстрируют методы синтеза соединений формул I и II. Пример 1. Синтез [4-(бифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси]уксусной кислоты 2-Гидрокси-4-метоксибензальдегид (3 г, 19,7 ммоль), формиат аммония (6,2 г, 99 ммоль) и палладий/уголь (900 мг, при 10%) добавляют к 26 мл ледяной уксусной кислоты и нагревают при 110 С в течение 1 ч. Реакционную массу охлаждают, фильтруют и разбавляют водой (100 мл). Сырой продукт экстрагируют хлороформом (350 мл), промывают водой, рассолом и сушат над безводным сульфатом натрия. Полученный раствор концентрируют и используют на следующей стадии без дополнительной очистки. МС m/z 139 (М+1). Стадия 2. Получение 5-метокси-2-метил-4-тиоцианатофенола (соединение 1 В) Продукт примера 1 А (3,5 г, 25 ммоль), тиоцианат натрия (6,48 г, 80 ммоль) и бромид натрия (2,6 г,25 ммоль) растворяют в 30 мл безводного метанола. По каплям в течение 15 мин добавляют бром (4,4 г,28 ммоль) и перемешивают при комнатной температуре 1 ч. Добавляют рассол (50 мл) и сырой продукт экстрагируют этилацетатом (3100 мл). Объединенные органические экстракты промывают рассолом,сушат над безводным сульфатом натрия, декантируют и концентрируют, получают названный продукт с хорошей чистотой. 400 МГц 1 Н ЯМР (ДMCO-d6) 10,13 (с, 1 Н), 7,25 (с, 1 Н), 6,54 (с, 1H), 3,77 (с, 3 Н), 2,0(с, 3 Н) ; МС m/z 196 (М+1). Стадия 3. Получение метилового эфира (5-метокси-2-метил-4-тиоцианатофенокси)уксусной кислоты (соединение 1 С) Продукт примера 1B (620 мг, 3,2 ммоль), метилбромацетат (854 мг, 3,5 ммоль) и карбонат цезия (3,1 г, 9,6 ммоль) перемешивают в 10 мл безводного ацетонитрила при комнатной температуре в течение 1 ч. Реакционную смесь фильтруют через Celite, концентрируют и очищают хроматографией с нормальной фазой. 400 МГц 1H ЯМР (ДМСО-d6) 7,33 (с, 1 Н), 6,72 (с, 1 Н), 4,93 (с, 2 Н), 3,84 (с, 3 Н), 3,66 (с, 3 Н), 2,09(с,2 Н); МС m/z 268 (М+1). Стадия 4. Получение метилового эфира (4-меркапто-5-метокси-2-метилфенокси)уксусной кислоты Бифенил-4-илметанол (500 мг, 2,72 ммоль), трибромид фосфора (809 мг, 2,99 ммоль) и бромид лития (260 мг, 2,99 ммоль) растворяют в 10 мл ДМФА и перемешивают при комнатной температуре 1 ч. Добавляют воду (10 мл) и сырой продукт экстрагируют в дихлорметан, сушат над безводным сульфатом натрия, фильтруют через силикагель и концентрируют. МС m/z 167 (M+1-Br). Стадия 6. Получение метилового эфира [4-(бифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси]уксусной кислоты (соединение 1F)(250 мг, 0,76 ммоль) добавляют к 5 мл ацетонитрила и перемешивают при комнатной температуре 4 ч. Реакционную массу фильтруют через Celite, концентрируют и очищают хроматографией с нормальной фазой. МС m/z 409 (М+1). Стадия 7. Получение [4-(бифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси]уксусной кислоты (соединение 1). Продукт примера 1F (101 мг) растворяют в 10 мл раствора ТГФ/вода (10:1). Добавляют моногидрат гидроксида лития (300 мг) и перемешивают 30 мин. Добавляют 2 н. водную HCl до рН 5, и затем промывают этилацетатом. Органический экстракт сушат над безводным сульфатом натрия, декантируют и концентрируют. Названный продукт перекристаллизовывают из смеси хлороформ/гексаны. Т.пл. 60-62 С. 400 МГц 1 Н ЯМР (ДМСО-d6) 12,94 (уш.с, 1H), 7,58 (д, 2 Н, J=8 Гц), 7,52 (д, 2 Н, J=8 Гц), 7,39 (т, 2 Н, J=7,2 Гц), 7,30 (м, 3 Н), 7,02 (с, 1 Н), 6,52 (с, 1 Н), 4,69 (с, 2 Н), 4,01 (с, 2 Н), 3,73 (с, 3 Н), 2,01 (с, 3 Н). МС m/z 393 Названное соединение получают способом, аналогичным способу примера 1 В, из 2-метилфенола. 400 МГц 1H ЯМР (ДМСО-d6) 10,09 (с, 1 Н), 7,36 (с, 1 Н), 7,30 (д, 1 Н, J=8,1 Гц), 6,83 (д, 1 Н, 7=8,1 Гц), 2,08(с, 3 Н); МС m/z 166 (М+1). Стадия 2. Получение метилового эфира (2-метил-4-тиоцианатофенокси)уксусной кислоты (соединение 2 В) Названное соединение получают из соединения 2 примера 2 А способом, аналогичным способу примера 1 С. 400 МГц 1 Н ЯМР (ДМСО-d6)7,46 (С, 1 Н), 6,95 (д, 1 Н, J=8,5 Гц), 6,80 (д, 1 Н, J=8,5 Гц), 4,86(с, 2 Н), 3,65 (с, 3 Н), 2,17 (с, 3 Н); МС m/z 238 (М+1). Стадия 3. Получение метилового эфира (4-меркапто-2-метилфенокси)уксусной кислоты (соединение 2 С)- 19009518 Названное соединение получают из соединения метилового эфира (2-метил-4-тиоцианатофенокси) уксусной кислоты способом, аналогичным способу примера 1D. 400 МГц 1 Н ЯМР (ДМСО-d6)7,05 (с,1 Н), 7,00 (д, 1 Н, J=10,3 Гц), 6,70 (д, 1 Н, J=10,3 Гц), 5,00 (с, 1 Н), 4,73 (с, 1 Н), 3,63 (с, 3 Н), 2,09 (с, 3 Н); МСm/z 213 (М+1). Стадия 4. Получение метилового эфира [4-(бифенил-4-илметилсульфанил)-2-метилфенокси] уксусной кислоты (соединение 2D) Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 2 С и 1E. MC m/z 379(М+1). Стадия 5. Получение [4-(бифенил-4-илметилсульфанил)-2-метилфенокси]уксусной кислоты (соединение 2). Названное соединение получают способом, аналогичным способу примера 1. Т.пл. 138 С. 400 МГц 1 Н ЯМР (ДМСО-d6)7,59 (д, 2 Н, J=9,5 Гц); 7,53 (д, 2 Н, J=9,5 Гц), 7,40 (м, 2 Н), 7,31(м, 3 Н), 7,14 (д, 1 Н,J=l,7 Гц), 7,09 (д, 1 Н, J=10,7 Гц), 6,70 (д, 1 Н, J=10,7 Гц), 4,62 (с, 2 Н), 4,11 (с, 2 Н), 2,09 (с, 3 Н); МС m/z 363 1-Бром-4-трифторметилбензол (814 г, 3,62 ммоль), 4-гидроксиметилфенилбороновую кислоту (600 мг, 3,98 ммоль), карбонат цезия (2,36 г, 7,24 ммоль) и PdCl2 (dppf) (132 мг, 0,181 ммоль) добавляют к 10 мл раствора ДМФА/ТГФ, 1:1. Реакционную массу продувают азотом и нагревают при 90 С в течение 1 ч. Реакционную массу охлаждают, выливают в диэтиловый эфир и промывают водой (250 мл), рассолом (1 50 мл) и сушат над безводным сульфатом натрия. Сырой продукт фильтруют через силикагель, элюируют диэтиловым эфиром и концентрируют, получают названное соединение. МС m/z 251 (М-1). Стадия 2. Получение 4-хлорметил-4'-трифторметилбифенила (соединение 3 В) Продукт примера 3 А растворяют в 10 мл метиленхлорида. Затем добавляют триэтиламин (468 мг,4,62 моль) и метансульфонилхлорид (422 мг, 3,68 ммоль) и перемешивают 18 ч. Реакционную массу выливают в воду и экстрагируют метиленхлоридом. Органический раствор сушат над безводным сульфатом натрия, декантируют и концентрируют, получают названное соединение, которое используют без дополнительной очистки. МС m/z 235 (М-Cl+1). Стадия 3. Получение метилового эфира [2-метил-4-(4'-трифторметилбифенил-4-илметилсульфанил) фенокси]уксусной кислоты (соединение 3 С)- 20009518 Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 3 В и 2 С. МС m/z 447 (М+1). Стадия 4. Получение [2-метил-4-(4'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты (соединение 3). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 3 С. Т.пл. 140-141 С. 400 МГц 1H ЯМР (ДМСО-d6)12,95 (уш.(с), 1 Н), 7,82 (д, 2 Н, 7=8,4 Гц),7,74 (д, 2 Н, J=8,4 Гц), 7,61 (д, 2 Н, J=8,4 Гц), 7,35 (д, 2 Н, 7 = 8,4 Гц), 7,10 (м, 2 Н), 6,70 (д, 1 Н, J=8,4 Гц),4,62 (с, 2 Н), 4,13 (с, 2 Н), 2,08 (с, 3 Н); МС m/z 431 (М-1). Анализ. Рассчитано для C23H19F3O3S0,7 Н 2 О С 62,07; Н 4,62; найдено: С 61,98; Н 4,22. Пример 4. Синтез [5-метокси-2-метил-4-(4'-трифторметилбифенил-4-илметилсульфанил)фенокси] уксусной кислоты (соединение 4) Стадия 1. Получение метилового эфира [5-метокси-2-метил-4-(4'-трифторметилбифенил-4 илметилсульфанил)фенокси]уксусной кислоты (соединение 4 А) Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 1D и 3 В. МС m/z 477 (M+1). Стадия 2. Получение [5-метокси-2-метил-4-(4'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты (соединение 4). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 4 А. Т.пл. 170-171 С. 400 МГц 1 Н ЯМР (ДМСО-d6)7,81 (д, 2 Н, J=8 Гц), 7,60 (д, 2 Н, J=8,4 Гц),7,32 (д, 2 Н, J=8,4 Гц), 7,02 (с, 1 Н) , 6,52 (с, 1 Н), 4,70 (с, 2 Н), 4,03 (с, 2 Н), 3,73 (с, 3 Н), 2,00 (с, 3 Н). МС m/z 463 (М+1). Анализ. Рассчитано для C24H21F3NO4S0,1 Н 2 О С 62,09; Н 4,6 0; найдено: С 62,00; Н 4,36. Пример 5. Синтез [5-метокси-2-метил-4-(2',4',6'-триметилбифенил-4-илметилсульфанил)фенокси] уксусной кислоты (соединение 5) Стадия 1. Получение метилового эфира [5-метокси-2-метил-4-(2',4',6'-триметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты (соединение 5 А) 2-Бром-1,3,5-триметилбензол (396 мг, 2 ммоль), 4-гидроксиметилфенилбороновую кислоту (334 мг,2,2 ммоль), карбонат цезия (1,3 г, 4 ммоль) и PdCl2 (dppf) (82 мг, 0,1 ммоль) добавляют к 5 мл раствора ДМФА/ТГФ, 1:1. Реакционную массу продувают азотом и нагревают при 90 С в течение 1 ч. Реакционную массу охлаждают, выливают в диэтиловый эфир и промывают водой (210 мл), рассолом (110 мл) и сушат над безводным сульфатом натрия. Органический раствор фильтруют через силикагель, элюируют диэтиловым эфиром и концентрируют. Сырой продукт растворяют в 10 мл дихлорметана. К полученно- 21009518 му раствору добавляют триэтиламин (202 мг, 2 ммоль), затем метансульфонилхлорид (184 мг, 1,6 ммоль) и перемешивают при комнатной температуре 18 ч. Реакционную смесь выливают в воду и экстрагируют метиленхлоридом. Органический раствор сушат над безводным сульфатом натрия, декантируют и концентрируют, получают сырой алкилхлорид. Продукт примера 1D (387 мг, 1,6 ммоль), сырой 4'хлорметил-2,4,6-триметилбифенил и карбонат цезия (1 г, 3,06 ммоль) перемешивают в 10 мл ацетонитрила 3 ч, фильтруют, концентрируют и очищают хроматографией с нормальной фазой, получают названный продукт. МС m/z 451 (М+1). Стадия 2. Получение [5-метокси-2-метил-4-(2',4',6'-триметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты. Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 5 А. Т.пл. 141 С. 400 МГц 1 Н ЯМР (ДМСО-d6)12,81 (уш.с, 1 Н) , 7,04 (д, 2 Н, J=8,4 Гц), 6,77 (м,3 Н), 6,69 (с, 2 Н), 6,36 (с, 1 Н), 4,43 (с, 2 Н), 3,82 (с, 2 Н), 3,58 (с, 3 Н), 2,03 (с, 3 Н), 1,82 (с, 3 Н), 1,67 (с, 6 Н). МС m/z 437 (М+1). Пример 6. Синтез [4-(4'-хлор-3'-трифторметилбифенил-4-илметилсульфанил)-2-метилфенокси]уксусной кислоты (соединение 6) Названное соединение получают способом, аналогичным способу примера 3 А, с использованием 4 бром-1-хлор-2-трифторметилбензола. МС m/z 288 (М+1). Стадия 2. Получение 4-хлор-4'-хлорметил-3-трифторметилбифенила (соединение 6 В) Названное соединение получают способом, аналогичным способу примера 3 В, с использованием соединения 6 А. МС m/z 305 (М) . Стадия 3. Получение метилового эфира [4-(4'-хлор-3'-трифторметилбифенил-4-илметилсульфанил)2-метилфенокси]уксусной кислоты (соединение 6 С) Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 2 С и 6 В. МС m/z 481 (М+1). Стадия 4. Получение [4-(4'-хлор-3'-трифторметилбифенил-4-илметилсульфанил)-2-метилфенокси] уксусной кислоты (соединение 6). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 6 С. 400 МГц 1 Н ЯМР (ДМСО-d6)7,97 (с, 1 Н), 7,92 (д, 1 Н, J=10,5 Гц), 7,74 (д, 1 Н, J=10,5 Гц),7,64 (д, 2 Н, J=8,9 Гц), 7,34 (д, 2 Н, J=8,9 Гц), 7,14 (с, 1 Н), 7,08 (д, 1 Н, J=11,0 Гц), 6,70 (д, 1 Н, J=11,0 Гц),- 22009518 4,62 (с, 2 Н), 4,12 (с, 2 Н), 2,08 (с, 3 Н); МС m/z 465 (М-1). Пример 7. Синтез [4-(2',4'-дихлорбифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси]уксусной кислоты (соединение 7) Стадия 1. Получение метилового эфира [4-(2',4'-дихлорбифенил-4-илметилсульфанил)-5-метокси-2 метилфенокси]уксусной кислоты (соединение 7 А) Названное соединение получают способом, аналогичным способу примера 5 А, с использованием соединения 1D и 1-бром-2,4-дихлорбензола. МС m/z 479 (М+2). Стадия 2. Получение [4-(2',4'-дихлорбифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси] уксусной кислоты (соединение 7). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 7 А. 400 МГц 1 Н ЯМР (ДМСО-d6)12,95 (уш.с, 1 Н), 7,67 (дд, 1 Н, J=2 Гц, J=8,4 Гц), 7,43 (д, 1 Н,J=2,4 Гц), 7,37 (с, 1 Н), 7,28 (с, 4 Н), 7,02 (с, 1 Н), 6,52 (с, 1 Н), 4,70 (с, 2 Н) , 4,02 (с, 2 Н), 3,72 (с, 3 Н), 2,01 (с,3 Н); МС m/z 465 (М+2). Пример 8. Синтез [4-(3',4'-дихлорбифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси]уксусной кислоты (соединение 8) Стадия 1. Получение метилового эфира [4-(3',4'-дихлорбифенил-4-илметилсульфанил)-5-метокси-2 метилфенокси]уксусной кислоты (соединение 8 А) Названное соединение получают способом, аналогичным способу примера 5 А, с использованием соединения 1D и 4-бром-2,4-дихлорбензола. МС m/z 479 (М+2). Стадия 2. Получение [4-(3',4'-дихлорбифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси] уксусной кислоты (соединение 8). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 8 А. Т.пл. 161-162 С. 400 МГц 1 Н ЯМР (ДМСО-d6)7,87 (д, 1 Н, J=2 Гц), 7,57-7,66 (м, 4 Н), 7,29- 23009518 Стадия 1. Получение метилового эфира [5-метокси-2-метил-4-(3'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты (соединение 9 А) Названное соединение получают способом, аналогичным способу примера 5 А, с использованием соединения 1D и 1-бром-3-трифторметилбензола. МС m/z 477 (М+1). Стадия 2. Получение [5-метокси-2-метил-4-(3'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты (соединение 9). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 9 А. Т.пл. 138-139 С. 400 МГц 1 Н ЯМР (ДМСО-d6)12,95 (уш.с, 1 Н), 7,91 (м, 2 Н), 7,63 (м, 4 Н),7,32 (д, 2 Н, J=8,4 Гц), 7,02 (с, 1 Н), 6,52 (с, 1 Н), 4,69 (с, 2 Н), 4,03 (С, 2 Н), 3,73 (с, 3 Н), 2,06 (с, 3 Н); МС m/z 463 (М+1). Пример 10. Синтез [4-(4'-фторбифенил-4-илметилсульфанил)-5-метокси-2-метилфенокси]уксусной кислоты (соединение 10) Названное соединение получают способом, аналогичным способу примера 3 А, с использованием 1 бром-4-фторбензола. МС m/z 185 (М-Н 2 О). Стадия 2. Получение 4-хлорметил-4'-фторбифенила (соединение 10 В) Названное соединение получают способом, аналогичным способу примера 3 В, с использованием соединения 10 А. МС m/z 222 (М+2). Стадия 3. Получение метилового эфира [4-(4'-фторбифенил-4-илметилсульфанил)-5-метокси-2 метилфенокси]уксусной кислоты (соединение 10 С) Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 10 В и 1D. MC m/z 427 (М+1). Стадия 4. Получение [4-(4'-фторбифенил-4 -илметилсульфанил)-5-метокси-2-метилфенокси] уксусной кислоты. Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 10 С. 400 МГц 1 Н ЯМР (ДМСО-d6)12,93 (уш.с, 1 Н), 7,62 (м, 2 Н), 7,49 (д, 2 Н, J=8,4 Гц), 7,27 (д,2 Н, J=8,4 Гц), 7,22 (м, 2 Н), 7,02 (с, 1 Н), 6,52 (с, 1 Н), 4,69 (с, 2 Н), 4,01 (с, 2 Н), 3,73 (с, 3 Н), 2,01 (с, 3 Н). MC Стадия 1. Получение метилового эфира [5-метокси-2-метил-4-(3'-трифторметоксибифенил-4 илметилсульфанил)фенокси]уксусной кислоты (соединение 11 А) Названное соединение получают способом, аналогичным способу примера 5 А, с использованием соединения 1D и 1-бром-3-трифторметоксибензола. МС m/z 4 93 (М+1). Стадия 2. Получение [5-метокси-2-метил-4-(3'-трифторметоксибифенил-4-илметилсульфанил)фенокси]уксусной кислоты (соединение 11). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 11 А. Т.пл. 137 С. 400 МГц 1H ЯМР (ДМСО-d6)12,95 (уш.с, 1 Н), 7,66 (д, 1 Н, J=8,8 Гц), 7,56 Смесь 4-гидроксииндан-1-она (5,0 г, 33,7 ммоль), цианоборгидрида натрия (6,4 г, 101,1 ммоль) и иодида цинка (32,3 г, 101,1 ммоль) в дихлорэтане кипятят с обратным холодильником 2 ч. Реакционную смесь затем фильтруют теплой через 50 г SiO2, элюируя дополнительно дихлорметаном. Фильтрат собирают и концентрируют в вакууме. Остаток добавляют к диэтиловому эфиру и полученный белый осадок отфильтровывают. Фильтрат собирают и концентрируют в вакууме, получают 4,2 г названного соединения с достаточной чистотой для последующего использования. 400 МГц 1 Н ЯМР (ДМСО-d6)9,06 (с,1 Н), 6,86 (т, 1 Н, J=7,8 Гц), 6,59 (д, 1 Н, J=7,8 Гц), 6,48 (д, 1 Н, J=7,8 Гц), 2,75 (т, 2 Н, J=7,3 Гц), 2,67 (т, 2 Н,J=7,3 Гц), 1,92 (м, 2 Н). Стадия 2. Получение 7-тиоцианатоиндан-4-ола (соединение 12 В) Названное соединение получают способом, аналогичным способу примера 1 В, с использованием соединения 12 А. МС m/z 192 (М+1). Стадия 3. Получение метилового эфира (7-меркаптоиндан-4-илокси)уксусной кислоты (соединение 12 С) 7-Тиоцианатоиндан-4-ол (пример 12 В) (1,47 г, 7,7 ммоль), карбонат цезия (3,77 г, 11,6 ммоль) и метилбромацетата (1,24 г, 8,08 ммоль) перемешивают в 20 мл ацетонитрила при комнатной температуре в течение 4 ч. Реакционную смесь фильтруют и концентрируют. Сырой продукт обрабатывают в условиях примера 1D с получением названного продукта. МС m/z 239 (М+1). Стадия 4. Получение метилового эфира [7-(4'-трифторметилбифекил-4-илметилсульфанил)индан-4 илокси]уксусной кислоты (соединение 12D) Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 12 С и 3 В. МС m/z 473 (М+1). Стадия 5. Получение [7-(4'-трифторметилбифенил-4-илметилсульфанил)индан-4-илокси]уксусной кислоты (соединение 12). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 12D. Т.пл. 158-159 С. 400 МГц 1 Н ЯМР (ДМСО-d6) 12,94 (уш.с, 1 Н), 7,82 (д, 2 Н, 7 = 8 Гц), 7,74 Стадия 1. Получение метилового эфира [4-(4-бензилоксибензилсульфанил)-2-метилфенокси]уксусной кислоты (соединение 13 А) Названное соединение получают способом, аналогичным способу примера 1F, с использованием 1 хлорметил-4-бензилоксибензола и соединения 2 С. МС m/z 409 (М+1). Стадия 2. [4-(4-Бензилоксибензилсульфанил)-2-метилфенокси]уксусной кислоты (соединение 13). Названное соединение получают способом, аналогичным способу примера 1 и 13 А. Т.пл. 120121 С. 400 МГц 1 Н ЯМР (ДМСО-d6)7,39-7,25 (м, 5 Н), 7,15-7,03 (м, 4Н), 6,85 (д, 2 Н, J=8,5 Гц), 6,68 (д,1 Н, J=8,4 Гц), 5,00 (с, 2 Н), 4,62 (с, 2 Н), 4,00 (с, 2 Н), 2,08 (с, 3 Н); МС m/z 395 (М+1). Пример 14. Синтез 5-метокси-2-метил-4-[4-(4-трифторметилбензилокси)бензилсульфанил]фенокси уксусной кислоты (соединение 14) Названное соединение получают способом, аналогичным способу примера ЗВ, с использованием соединения 14 А. МС m/z 265 (М-Cl+1). Стадия 3. Получение метилового эфира 5-метокси-2-метил-4-[4-(4-трифторметилбензилокси) бензилсульфанил]феноксиуксусной кислоты (соединение 14 С) Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 14 В и 1D. MC m/z 507 (М+1). Стадия 4. Получение 5-метокси-2-метил-4-[4-(4-трифторметилбензилокси)бензилсульфанил] феноксиуксусной кислоты (соединение 14). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 14 С. Т.пл. 145 С. 400 МГц 1 Н ЯМР (ДМСО-d6)12,94 (уш.с, 1 Н), 7,70 (д, 2 Н, J=8 Гц), 7,76 (д,2 Н, J=8 Гц), 7,14 (д, 2 Н, J=8,8 Гц), 6,97 (с, 1 Н), 6,87 (м, 2 Н), 6,50 (С, 1 Н), 5,14 (с, 2 Н), 4,68 (с, 2 Н), 3,91 (с,2 Н), 3,71 (с, 3 Н), 2,00 (с, 3 Н); MC m/z 491 (M-1). Пример 15. Синтез 2-метил-4-[4-(4-трифторметилбензилокси)бензилсульфанил]феноксиуксусной кислоты (соединение 15) Стадия 1. Получение метилового эфира 2-метил-4-[4-(4-трифторметилбензилокси)бензилсульфанил]феноксиуксусной кислоты (соединение 15 А) Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 2 С и 14 В. МС m/z 477 (М+1). Стадия 2. Получение 2-метил-4-[4-(4-трифторметилбензилокси)бензилсульфанил]феноксиуксусной кислоты (соединение 15). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 15 А. Т.пл. 133 С. 400 МГц 1 Н ЯМР (ДМСО-d6) 7,70 (д, 2 Н, J=8 Гц), 7,76 (д, 2 Н, J=8 Гц), 7,14 (д,- 27009518 2 Н, J=8,8 Гц), 7,09 (м, 1 Н), 7,04 (дд, 1 Н, J=2,4 Гц, J'=8,4 Гц), 6,87 (м, 2 Н), 6,68 (д, 1 Н, J=8,4 Гц), 5,14 (с,2 Н), 4,61 (с, 2 Н), 3,99 (с, 2 Н), 2,08 (с, 3H); МС m/z 461 (M-1). Пример 16. Синтез [5-метокси-2-метил-4-(3'-трифторметоксибифенил-3-илметилсульфанил) фенокси]уксусной кислоты (соединение 16) Названное соединение получают способом, аналогичным способу примера ЗА, с использованием 3 гидроксиметилфенилбороновой кислоты и 1-бром-3-трифторметоксибензола. МС m/z 251 (М-1). Стадия 2. Получение 3-хлорметил-3'-трифторметоксибифенила (соединение 16 В) Названное соединение получают способом, аналогичным способу примера 3 В, с использованием соединения 16 А. МС m/z 251 (М-1). Стадия 3. Получение метилового эфира [5-метокси-2-метил-4-(3'-трифторметоксибифенил-3 илметилсульфанил)фенокси]уксусной кислоты (соединение 16 С). Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 16 В и 1D. MC m/z 491 (М-1). Стадия 4. Получение [5-метокси-2-метил-4-(3'-трифторметоксибифенил-3-илметилсульфанил)фенокси]уксусной кислоты (соединение 16). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 16 С. Т.пл. 92-94 С. 400 МГц 1 Н ЯМР (ДМСО-d6)12,96 (уш.с, 1 Н), 7,55-7,24 (м, 8 Н), 7,01 (с,1 Н), 6,52 (с, 1 Н), 4,68 (с, 2 Н), 4,03 (с, 2 Н), 3,72 (с, 3 Н), 1,99 (с, 3 Н); MC m/z 479 (М+1). Пример 17. Синтез [4-(9 Н-флуорен-2-илметилсульфанил-2-метилфенокси]уксусной кислоты (соединение 17) В 10 мл метанола растворяют 9 Н-флуорен-2-карбальдегида (500 мг, 2,6 ммоль). Добавляют боргидрид натрия (200 мг, 5,2 ммоль) и перемешивают при комнатной температуре 1 ч. Добавляют воду (10 мл) и сырой продукт экстрагируют в этилацетат (50 мл), промывают рассолом (50 мл), сушат над безводным сульфатом натрия, декантируют и концентрируют, получают названный продукт с хорошей чистотой. МС m/z 195 (М+1). Стадия 2. Получение 2-хлорметил-9 Н-флуорена (соединение 17 В) Названное соединение получают способом, аналогичным способу примера ЗВ, с использованием соединения 17 А. МС m/z 17 9 (М-С 1+1). Стадия 3. Получение метилового эфира [4-(9 Н-флуорен-2-илметилсульфанил-2-метилфенокси]уксусной кислоты (соединение 17 С) Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 17 В и 2 С. МС m/z 422 (М+1). Стадия 4. Получение [4-(9 Н-флуорен-2-илметилсульфанил-2-метилфенокси]уксусной кислоты (соединение 17). Названное соединение получают способом, аналогичным способу примера 1, с использованием соединения 17 С. 400 МГц 1 Н ЯМР (ДМСО-d6)12,93 (уш.с, 1 Н), 7,80 (д, 1 Н, J=7,6 Гц), 7,23 (д, 1 Н, J=8 Гц),7,5 (д, 1 Н, J=7,6 Гц), 7,43 (с, 1 Н), 7,31 (т, 1 Н, J=6,4 Гц), 7,24 (м, 2 Н), 7,15 (м, 1 Н), 7,08 (дд, 1 Н, J=2,4 Гц,J'=8,4 Гц), 6,7 (д, 1 Н, ,7=8,8 Гц), 4,62 (с, 2 Н), 4,13 (с, 2 Н), 3,82 (с, 2 Н), 2,09 (с, 3 Н). МС m/z 375 (М-1). Анализ. Рассчитано для C23H20O3S0,3 Н 2 О С 72,34; Н 5,44; найдено: С 72,46; Н 5,20. Пример 18. Синтез 5-метокси-2-метил-4-[4-(5-трифторметилпиридин-2-ил)бензилсульфанил]феноксиуксусной кислоты (соединение 18) Названное соединение получают из 2-хлор-5-трифторметилпиридина и 4-(гидроксиметил)бороновой кислоты с катализатором PdCl2 (dppb) способом, аналогичным способу примера3 А. 400 МГц 1 Н ЯМР (ДMCO-d6)8,98 (с, 1 Н), 8,2 (дд, 1 Н, J=2,4 Гц, J'=8,4 Гц), 8,09 (м, 3 Н), 7,42 (д, 2 Н, J=8,54 Гц), 5,23 Названное соединение получают способом, аналогичным способу примера 3 В, с использованием соединения 18 А. МС m/z 272 (М+1). Стадия 3. Получение метилового эфира 5-метокси-2-метил-4-[4-(5-трифторметилпиридин-2-ил) бензилсульфанил]феноксиуксусной кислоты (соединение 18 С)- 29009518 Названное соединение получают способом, аналогичным способу примера 1F, с использованием соединений 1D и 18 В. МС m/z 478 (М+1). Стадия 4. Получение 5-метокси-2-метил-4-[4-(5-трифторметилпиридин-2-ил)бензилсульфанил] феноксиуксусной кислоты (соединение 18). Названное соединение получают из продукта примера 18 С способом, аналогичным способу примера 1. Т.пл. 225 С (разл.). 400 МГц 1 Н ЯМР (ДМСО-d6)8,97 (с, 1 Н), 8,2 (дд, 1 Н, J=2,4 Гц, J'=8,4 Гц), 8,13 Названное соединение получают из 2-хлор-5-хлорметилпиридина и соединения 1D способом, аналогичным способу примера 1F. МС m/z 370 (М+2). Стадия 2. Получение метилового эфира 5-метокси-2-метил-4-[6-(4-трифторметилфенил)пиридин 3-илметилсульфанил]феноксиуксусной кислоты (соединение 19 В) Названное соединение получают из продукта примера 19 А и 1-бром-4-трифторметилбензола способом, аналогичным способу примера 3 А. МС m/z 478 (М+1). Стадия 3. Получение 5-метокси-2-метил-4-[6-(4-трифторметилфенил)пиридин-3-илметилсульфанил]феноксиуксусной кислоты (соединение 19). Названное соединение получают из продукта примера 19 В способом, аналогичным способу примера 1. Т.пл. 203 С (разл.). 400 МГц 1 Н ЯМР (ДМСО-d6)8,34 (д, 1 Н, J=l,6 Гц), 8,21 (д, 2 Н, J=8 Гц), 7,92 (д,1 Н, J=8,4 Гц), 7,77 (д, 2 Н, J=8,4 Гц), 7,65 (дд, 1 Н, J=2,4 Гц, J'=8,4 Гц), 6,93 (с, 1 Н), 6,39 (с, 1 Н), 4,15 (с,2 Н), 4,00 (с, 2 Н), 3,66 (с, 3 Н), 1,95 (с, 3 Н). МС m/z 464 (М+1). Пример 20. Синтез [5-хлор-2-метил-4-(4'-трифторметилбифенил-4-илметилсульфанил)фенокси]уксусной кислоты (соединение 20) Названное соединение получают способом, аналогичным способу примера 1 В, из 5-хлор-2- 30
МПК / Метки
МПК: C07D 311/58, C07D 405/12, C07D 413/12, C07D 213/32, C07D 209/10, C07D 213/20, A61K 31/19, C07C 317/22, C07D 261/08, C07C 59/70, C07C 323/19
Метки: способы, получения, ppar, модулирующие, активность, соединения
Код ссылки
<a href="https://eas.patents.su/30-9518-soedineniya-moduliruyushhie-aktivnost-ppar-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, модулирующие активность ppar, и способы их получения</a>
Предыдущий патент: Пиразолопиримидины
Случайный патент: Теплообменник и способ и устройство для его изготовления