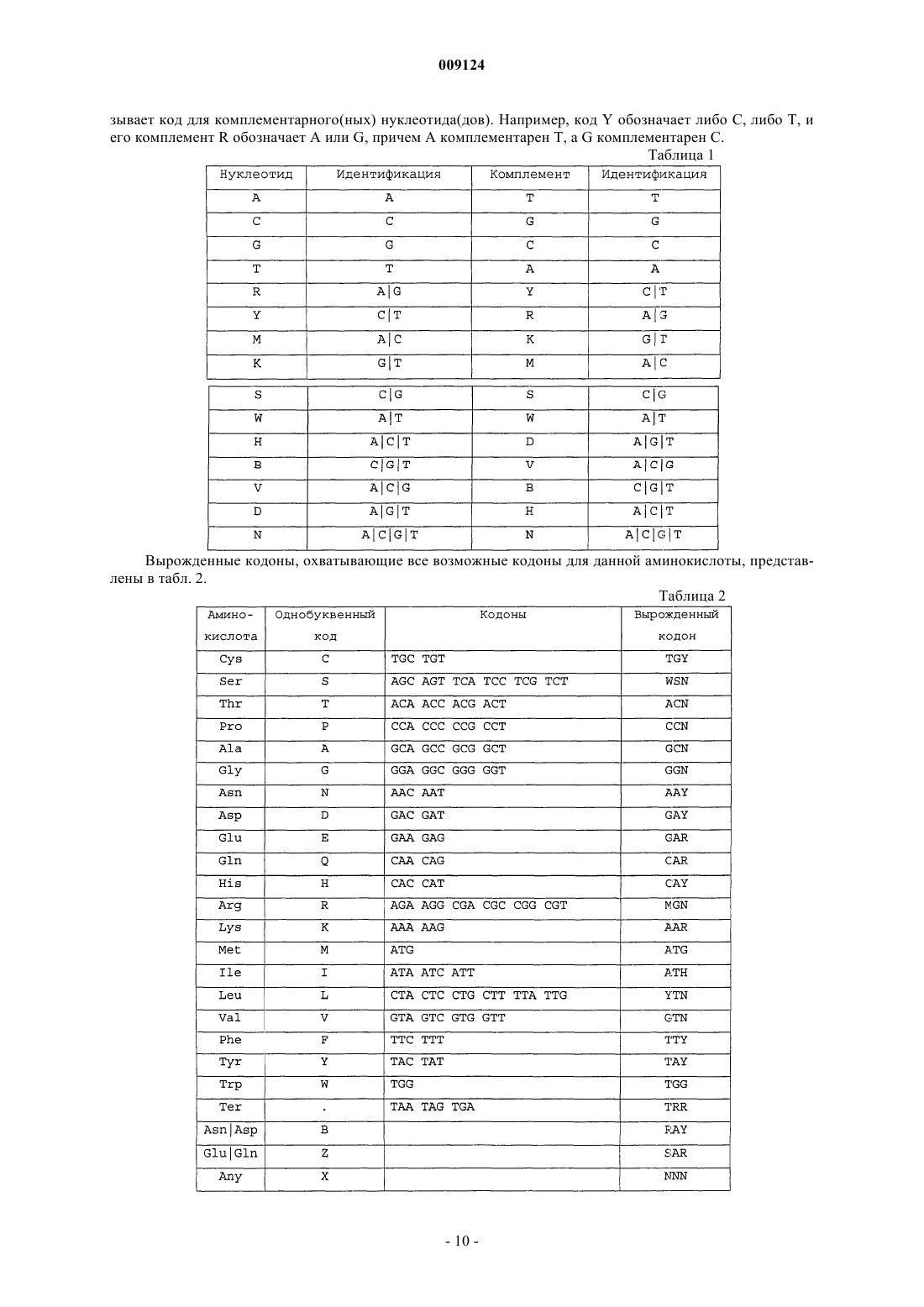
Антитела против il-20 и связывающие партнеры, а также способы их применения при воспалении
Номер патента: 9124
Опубликовано: 26.10.2007
Авторы: Киндсвогель Уэйн, Чандрасекер Ясмин А., Мур Маргарет Д., Сивакумар Паллавур В., Диллон Стейси Р., Сюй Вэньфэн, Ленер Джойс М., Сиадак Энтони У.
Формула / Реферат
1. Способ получения антител против полипептида, в котором предусмотрена инокуляция животному полипептида, выбранным из группы, состоящей из:
a) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 102 (Asp) SEQ ID NO:8;
b) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 60 (Ile) SEQ ID NO:8;
c) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 69 (Glu) SEQ ID NO:8;
d) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 81 (Cys) SEQ ID NO:8;
e) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 96 (Lys) SEQ ID NO:8;
f) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 102 (Asp) SEQ ID NO:8;
g) полипептида, состоящего из аминокислотных остатков с 60 (Ile) по 69 (Glu) SEQ ID NO:8;
h) полипептида, состоящего из аминокислотных остатков с 60 (Ile) по 81 (Cys) SEQ ID NO:8;
i) полипептида, состоящего из аминокислотных остатков с 60 (Ile) по 96 (Lys) SEQ ID NO:8;
j) полипептида, состоящего из аминокислотных остатков с 60 (Ile) по 102 (Asp) SEQ ID NO:8;
k) полипептида, состоящего из аминокислотных остатков с 69 (Glu) по 81 (Cys) SEQ ID NO:8;
1) полипептида, состоящего из аминокислотных остатков с 69 (Glu) по 96 (Lys) SEQ ID NO:8;
m) полипептида, состоящего из аминокислотных остатков с 69 (Glu) по 102 (Asp) SEQ ID NO:8;
n) полипептида, состоящего из аминокислотных остатков с 81 (Cys) по 96 (Lys) SEQ ID NO:8;
о) полипептида, состоящего из аминокислотных остатков с 81 (Cys) по 102 (Asp) SEQ ID NO:8 и
р) полипептида, состоящего из аминокислотных остатков с 96 (Lys) по 102 (Asp) SEQ ID NO:8,
где полипептид вызывает иммунный ответ у животного с продукцией антител; и выделение антител у животного; и где антитела специфически связываются с полипептидом IL-20 (SEQ ID NO: 8).
2. Способ по п.1, где антитело снижает провоспалительную активность IL-20 (SEQ ID NO:8).
3. Способ по п.1, где антитело, полученное способом, нейтрализует взаимодействие IL-20 (SEQ ID NO:8) с IL-22RA (SEQ ID NO:2).
4. Способ по п.3, где нейтрализацию антителом измеряют по нейтрализации IL-20 (SEQ ID NO:8) в in vitro клеточном тесте по нейтрализации.
5. Способ по п.1, где антитело снижает провоспалительную активность как IL-20 (SEQ ID NO:8), так и IL-22 (SEQ ID NO:6).
6. Антитело, полученное способом по п.1, где антитело связывается с полипептидом SEQ ID NO:8 и где антитело дополнительно содержит водорастворимый полимер.
7. Антитело по п.2, где антитело представляет собой (а) поликлональное антитело, (b) моноклональное антитело мыши, (с) гуманизированное антитело, полученное из (b), (d) фрагмент антитела, или (е) моноклональное антитело человека.
8. Антитело по п.2, где антитело дополнительно содержит радионуклид, фермент, субстрат, кофактор, флуоресцентный маркер, хемилюминесцентный маркер, пептидную метку, магнитную частицу или токсин.
9. Антитело по п.7, где антитело дополнительно содержит полиэтиленгликоль.
10. Антитело или фрагмент антитела, которые связываются с полипептидом, содержащим аминокислотную последовательность SEQ ID NO:8, и снижают провоспалительную активность IL-20 (SEQ ID NO:8), где антитело дополнительно содержит водоростворимый полимер.
11. Антитело или фрагмент антитела по п.10, где антитело или фрагмент антитела снижает провоспалительную активность либо IL-20 (SEQ ID NO:8), либо IL-22 (SEQ ID NO:6).
12. Антитело или фрагмент антитела по п.10, где антитело или фрагмент антитела представляет собой (а) поликлональное антитело, (b) моноклональное антитело мыши, (с) гуманизированное антитело, полученное из (b), (d) фрагмент антитела или (е) моноклональное антитело человека.
13. Антитело или фрагмент антитела по п.10, где антитело или фрагменты антитела дополнительно содержит радионуклид, фермент, субстрат, кофактор, флуоресцентный маркер, хемилюминесцентный маркер, пептидную метку, магнитную частицу, лекарство или токсин.
14. Антитело по п.10, где антитело или фрагменты антитела содержит полиэтиленгликоль.
15. Способ снижения или ингибирования индуцируемой IL-20 пролиферации или дифференциации гематопоетических клеток и предшественников гематопоетических клеток, в котором предусмотрено культивирование клеток костного мозга или периферической крови с композицией, содержащей количество антитела по п.3, достаточное для снижения пролиферации или дифференциации гематопоетических клеток в костном мозге или клеток периферической крови по сравнению с клетками костного мозга или периферической крови, культивируемыми в отсутствие антитела.
16. Способ по п.15, где гематопоетические клетки и предшественники гематопоэтических клеток представляют собой лимфоидные клетки.
17. Способ по п.16, где лимфоидные клетки представляют собой макрофаги или Т-клетки.
18. Способ снижения индуцируемого IL-20 воспаления у млекопитающего, в котором предусмотрено введение млекопитающему количества композиции, содержащей антитело по п.3, при котором происходит снижение воспаления.
19. Способ снижения индуцируемого IL-20 воспаления у млекопитающего, в котором предусмотрено введение млекопитающему количества композиции, содержащей антитело или фрагмента антитела по п.10, при котором происходит снижение воспаления.
20. Способ подавления воспалительного ответа у млекопитающего с воспалением, в котором предусмотрено:
(1) определение уровня амилоидного белка А в сыворотке;
(2) введение композиции, содержащей антитело по п.3 в приемлемом фармацевтическом носителе;
(3) определение уровня амилоидного белка А в сыворотке после введения;
(4) сравнение уровня амилоидного белка А в сыворотке, определенного на стадии (1), с уровнем амилоидного белка А в сыворотке, определенного на стадии (3),
где отсутствие увеличения или снижение уровня амилоидного белка А в сыворотке является показателем подавления воспалительного ответа.
21. Способ подавления воспалительного ответа у млекопитающего с воспалением, в котором предусмотрено:
(1) определение уровня амилоидного белка А в сыворотке;
(2) введение композиции, содержащей антитело по п.5 в приемлемом фармацевтическом носителе;
(3) определение уровня амилоидного белка А в сыворотке после введения;
(4) сравнение уровня амилоидного белка А в сыворотке, определенного на стадии (1) с уровнем амилоидного белка А в сыворотке, определенного на стадии (3),
где отсутствие увеличения или снижение уровня амилоидного белка А в сыворотке является показателем подавления воспалительного ответа.
22. Способ подавления воспалительного ответа у млекопитающего с воспалением, в котором предусмотрено:
(1) определение уровня амилоидного белка А в сыворотке;
(2) введение композиции, содержащей антитело по п.16 в приемлемом фармацевтическом носителе;
(3) определение уровня амилоидного белка А в сыворотке после введения;
(4) сравнение уровня амилоидного белка А в сыворотке, определенного на стадии (1), с уровнем амилоидного белка А в сыворотке, определенного на стадии (3),
где отсутствие увеличения или снижение уровня сывороточного амилоидного белка А является показателем подавления воспалительного ответа.
23. Способ лечения млекопитающего, страдающего воспалительным заболеванием, в котором играет роль IL-20, в котором предусмотрено
введение антагониста млекопитающему,
где антагонист содержит антитело, фрагмент антитела или связывающий полипептид, который специфически связывается с полипептидом или фрагментом полипептида IL-22RA (SEQ ID NO:3) или представляет собой полипептид или фрагмент полипептида IL-22RA (SEQ ID NO:3); и где воспалительная активность IL-20 (SEQ ID NO:8) снижается.
24. Способ по п.23, где заболевание представляет собой хроническое воспалительное заболевание.
25. Способ по п.24, где хроническое воспалительное заболевание включает воспалительное заболевание кишечника, язвенный колит, болезнь Крона, артрит, атопический дерматит или псориаз.
26. Способ по п.23, где болезнь представляет сосющ острое воспалительное заболевание.
27. Способ по п.26, где острое воспалительное заболевание включает эндотоксемию, сепсис, синдром токсического шока или инфекционное заболевание.
28. Способ по п.23, где антитело дополнительно содержит радионуклид, фермент, субстрат, кофактор, флуоресцентный маркер, хемилюминесцентный маркер, пептидную метку, магнитную частицу, лекарство или токсин.
29. Антитело, содержащее моноклональное антитело, которое связывается с антигенным эпитопом IL-20 человека (SEQ ID NO:8), выбранным из группы, состоящей из:
a) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 102 (Asp) SEQ ID NO:8;
b) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 60 (Ile) SEQ ID NO:8;
c) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 69 (Glu) SEQ ID NO:8;
d) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 81 (Cys) SEQ ID NO:8;
e) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 96 (Lys) SEQ ID NO:8;
f) полипептида, состоящего из аминокислотных остатков с 42 (Ile) по 102 (Asp) SEQ ID NO:8;
g) полипептида, состоящего из аминокислотных остатков с 60 (Ile) по 69 (Glu) SEQ ID NO:8;
h) полипептида, состоящего из аминокислотных остатков с 60 (Ile) по 81 (Cys) SEQ ID NO:8;
i) полипептида, состоящего из аминокислотных остатков с 60 (Ile) по 96 (Lys) SEQ ID NO:8;
j) полипептида, состоящего из аминокислотных остатков с 60 (Ile) по 102 (Asp) SEQ ID NO:8;
k) полипептида, состоящего из аминокислотных остатков с 69 (Glu) по 81 (Cys) SEQ ID NO:8;
1) полипептида, состоящего из аминокислотных остатков с 69 (Glu) по 96 (Lys) SEQ ID NO:8;
m) полипептида, состоящего из аминокислотных остатков с 69 (Glu) по 102 (Asp) SEQ ID NO:8;
n) полипептида, состоящего из аминокислотных остатков с 81 (Cys) по 96 (Lys) SEQ ID NO:8;
о) полипептида, состоящего из аминокислотных остатков с 81 (Cys) по 102 (Asp) SEQ ID NO:8 и
р) полипептида, состоящего из аминокислотных остатков с 96 (Lys) по 102 (Asp) SEQ ID NO:8,
где антитело снижает или нейтрализует активность IL-20 человека (SEQ ID NO:8).
30. Антитело по п.29, где антитело снижает или нейтрализует активность IL-20 человека (SEQ ID NO:8).
31. Антитело по п.29, где антитело выбрано из группы, состоящей из (а) моноклонального антитела мыши, (b) гуманизированного антитела, полученного из (а), (с) фрагмента антитела и (d) моноклонального антитела человека.
32. Антитело по п.30, где антитело дополнительно содержит полиэтиленгликоль.
33. Антитело по п.30, где антитело выбрано из группы, состоящей из (а) моноклонального антитела мыши, (b) гуманизированного антитела, полученного из (а), (с) фрагмента антитела и (d) моноклонального антитела человека.
34. Антитело по п.33, где антитело дополнительно содержит полиэтиленгликоль.
35. Способ лечения патологического состояния у индивидуума, связанного с активностью IL-20, в котором предусмотрено введение эффективного количества антитела по п.29, которое оказывает лечебное воздействие на указанное патологическое состояние.
36. Способ по п.35, где указанное патологическое состояние представляет собой хроническое воспалительное состояние.
37. Способ по п.36, где указанное хроническое воспалительное состояние включает воспалительное заболевание кишечника, язвенный колит, болезнь Крона, артрит, атопический дерматит или псориаз.
38. Способ по п.36, где указанное патологическое состояние представляет собой острое воспалительное состояние.
39. Способ по п.38, где указанное острое воспалительное состояние включает эндотоксемию, сепсис, синдром токсического шока или инфекционное заболевание.
Текст
009124 Уровень техники, к которому относится изобретение Цитокины представляют собой растворимые небольшие белки, которые опосредуют разнообразные биологические эффекты, включая регуляцию роста и дифференцировку многих типов клеток (см., например, Arai et al., Annu. Rev. Biochem. 59:783 (1990); Mosmann, Curr. Opin. Immunol. 3:311 (1991); Pauland Seder, Cell 76:241 (1994. Белки, которые составляют группу цитокинов, включают интерлейкины,интерфероны, колоние-стимулирующие факторы, факторы некроза опухолей и другие регуляторные молекулы. Например, интерлейкин-17 человека представляет собой цитокин, который стимулирует экспрессию интерлейкина-6, внутриклеточной молекулы адгезии 1, интерлейкина-8, гранулоцит-макрофагколоние-стимулирующего фактора и экспрессию простагландина Е 2, и играет роль в предпочтительном созревании CD34+ гематопоэтических предшественников в нейтрофилы (Yao et al., J. Immunol. 155:5483(1995); Fossiez et al., J. Exp. Med. 183:2593 (1996. Рецепторы, которые связывают цитокины, обычно состоят из одного или нескольких интегративных белков мембран, которые связывают цитокин с высоким сродством и передают сигнал связывания в клетку посредством цитоплазматических частей определенных субъединиц рецептора. Рецепторы цитокинов сгруппированы в несколько классов на основе сходства их внеклеточных лиганд-связывающих доменов. Например, рецепторные цепи, ответственные за связывание и/или передачу сигнала интерферонов, являются членами класса II семейства рецепторов цитокинов на основе характерных 200 остатков внеклеточного домена. Продемонстрированная активность цитокинов и их рецепторов in vivo иллюстрирует их клинические возможности и потребность в других цитокинах, рецепторах цитокинов, агонистах цитокинов и антагонистах цитокинов. Например, продемонстрированная in vivo активность семейства провоспалительных цитокинов иллюстрирует их огромные клинические возможности и потребность в антагонистах провоспалительных молекул. Настоящее изобретение направлено на данные потребности посредством предложения антагонистов провоспалительных цитокинов IL-20 и IL-22. Такие антагонисты настоящего изобретения, которые могут блокировать, ингибировать, снижать, действовать антагонистически или нейтрализовать активность IL-22, IL-20 или как IL-20, так и IL-22, включают растворимые рецепторы IL22RA и нейтрализующие антитела против IL-22RA. В изобретении дополнительно предлагается их применение при воспалительном заболевании, а также относящиеся к ним композиции и способы. Подробное описание изобретения 1. Обзор. По сравнению с другими изобретениями в настоящем изобретении предлагается новое применение растворимого рецептора, обозначаемого "Zcytor11" или "IL-22RA", и нейтрализующих антител против цитокиновых рецепторов IL22-RA. В настоящем изобретении предлагаются также растворимые полипептидные фрагменты IL-22RA и гибридные белки для применения при воспалительных и аутоиммунных заболеваниях человека. Антитела против IL-22RA и растворимые рецепторы IL-22RA настоящего изобретения, включая нейтрализующие антитела против IL-22RA настоящего изобретения, могут быть применены для блокирования, ингибирования, снижения, антагонистического действия или нейтрализации активности либо IL-22 или IL-20, или как IL-20, так и IL-22 при лечении конкретных заболеваний человека, таких как псориаз, псориатический артрит, артрит, эндотоксемия, воспалительное заболевание кишечника (IBD), колит и другие раскрытые здесь воспалительные состояния. Иллюстративная нуклеотидная последовательность, которая кодирует Zcytor11 (IL-22RA), предлагается в SEQ ID NO:1; кодирующий пептид представлен в SEQ ID NO:2. IL-22RA представляет собой рецепторную субъединицу как для IL-20, так и для IL-22. Zcytor11 (IL-22RA) раскрыт в обычно принадлежащем США патенте 5965704, в обычно принадлежащей WIPO публикации WO 02/12345 и обычно принадлежащей WIPO публикации WO 02/072607. Анализ клона кДНК человека, кодирующей IL-22RA(SEQ ID NO:1), выявил открытую рамку считывания, кодирующую 574 аминокислоты (SEQ ID NO:2),включающую внеклеточный лиганд-связывающий домен из приблизительно 211 аминокислотных остатков (остатки 18-228 SEQ ID NO:2; SEQ ID NO:3), трансмембранный домен из приблизительно 23 аминокислотных остатков (остатки 229-251 SEQ ID NO:2) и внутриклеточный домен из приблизительно 313 аминокислотных остатков (остатки с 252 до 574 SEQ ID NO:2). Данные молекулы настоящего изобретения включают полипептиды, которые включают цитокин-связывающий домен, включающий аминокислотные остатки 18-228 SEQ ID NO:2; SEQ ID NO:3. В одном осуществлении растворимый рецептор настоящего изобретения, растворимый IL-22R присоединен к константной области тяжелой цепи (пример представлен в SEQ ID NO:4). Специалисту в данной области должно быть понятно, что границы доменов являются приблизительными. Возможна делеция остатков концов доменов. Как описано ниже, в настоящем изобретении предлагаются выделенные полипептиды, включающие аминокислотную последовательность, которая по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90% или более чем на 95%, например на 96, 97, 98 или более чем на 99% или более,идентична референтной аминокислотной последовательности 18-228 SEQ ID NO:2, которая также представлена как SEQ ID NO:3, где выделенный пептид специфически связывается с антителом, которое специфически связывается с полипептидом, включающим аминокислотную последовательность SEQ IDNO:3. Примеры полипептидов включают полипептиды, включающие либо аминокислотные остатки SEQID NO:3, либо аминокислотные остатки SEQ ID NO:3. Более того, в настоящем изобретении предлагаются также выделенные полипептиды, как раскрыто выше, которые связывают IL-22 (например, полипептидная последовательность IL-22 человека, как показано в SEQ ID NO:6). Полинуклеотидная последовательность IL-22 человека представлена в SEQ ID NO:5. Полинуклеотидная последовательность IL-22 мыши представлена в SEQ ID NO:10 и соответствующий полипептид представлен в SEQ ID NO:11. В настоящем изобретении предлагаются также выделенные полипептиды, как раскрыто выше, которые связывают IL-20 (например, полипептидная последовательность IL-20 человека, как показано в SEQ IDNO:8; публикация WIPO No. WO 99/27103). Полинуклеотидная последовательность IL-20 человека представлена в SEQ ID NO:7. В настоящем изобретении предлагаются также выделенные полипептиды и эпитопы, включающие по меньшей мере 15 соседних аминокислотных остатков аминокислотной последовательности SEQ IDNO:3. Примеры пептидов включают полипептиды, которые либо включают, либо состоят из SEQ IDNO:3, ее антигенных эпитопов или ее связывающих фрагментов для функциональных IL-20 или IL-22. Более того, в настоящем изобретении предлагаются также выделенные пептиды, как раскрыто выше,которые связываются, блокируют, ингибируют, снижают, проявляют антагонистическое действие или нейтрализуют активность IL-22 или IL-20. Настоящее изобретение включает также варианты полипептидов IL-22RA, где аминокислотная последовательность варианта полипептида имеет идентичность с аминокислотными остатками SEQ IDNO:3, выбранную из группы, состоящей по меньшей мере из 70% идентичности, по меньшей мере 80% идентичности, по меньшей мере 90% идентичности, по меньшей мере 95% идентичности или выше, чем 95% идентичность, такая как 96, 97, 98% или выше чем 99% или более идентичность, и где любое различие между аминокислотной последовательностью варианта полипептида и соответствующей аминокислотной последовательностью SEQ ID NO:3 обусловлено одной или более консервативными аминокислотными заменами. Здесь описаны такие консервативные аминокислотные замены. Более того, в настоящем изобретении предлагаются также выделенные полипептиды, как раскрыто выше, которые связываются, блокируют, ингибируют, снижают, проявляют антагонистическое действие или нейтрализуют активность IL-22 или IL-20. В настоящем изобретении дополнительно предлагаются антитела и фрагменты антител, которые специфически связываются с такими полипептидами. Примеры антител включают нейтрализующие антитела, поликлональные антитела, мышиные моноклональные гуманизированные антитела, антитела,происходящие из мышиных моноклональных антител, и человеческие моноклональные антитела. Примеры фрагментов антител включают F(ab')2, F(ab)2, Fab', Fab, Fv, scFv и минимальные узнающие единицы. Нейтрализующие антитела предпочтительно связывают IL-22RA и таким образом блокируют, ингибируют, снижают, вызывают антагонистическое действие или нейтрализуют взаимодействие IL-20 и IL22 с IL-22RA настоящего изобретения. Это означает, что нейтрализующие антитела против IL-22RA настоящего изобретения могут либо связывать, блокировать, ингибировать, снижать, проявлять антагонистическое действие или нейтрализовать каждый из IL-20 или IL-22 по одиночке, либо связывать, блокировать, ингибировать, снижать, проявлять антагонистическое действие или нейтрализовать IL-20 и IL-22 вместе. Настоящее изобретение дополнительно включает композиции, включающие носитель и описанные здесь пептид, полипептид или антитело. Кроме того, в настоящем изобретении предлагаются фармацевтические композиции, включающие фармацевтически приемлемый носитель и по меньшей мере один из таких экспрессионных векторов или рекомбинантных вирусов, включающих такие экспрессионные векторы. Настоящее изобретение дополнительно включает фармацевтические композиции, включающие фармацевтически приемлемый носитель и описанные здесь полипептид или антитело. Настоящее изобретение охватывает также антиидиотипические антитела или фрагменты антиидиотипических антител, которые специфически связывают антитело или фрагмент антитела, которые специфически связывают полипептид, включающий аминокислотную последовательность SEQ ID NO:3 или ее фрагмент. Характерное антиидиотипическое антитело связывается с антителом, которое специфически связывает полипептид, состоящие из SEQ ID NO:3. В настоящем изобретении предлагаются также гибридные белки, включающие полипептид IL-22RA и иммуноглобулиновую часть. В таких гибридных белках иммуноглобулиновая часть может представлять собой константную область тяжелой цепи иммуноглобулина, такую как Fc фрагмент человека. Настоящее изобретение дополнительно включает молекулы нуклеиновых кислот, которые кодируют такие гибридные белки. В настоящем изобретении предлагаются также поликлональные и моноклональные антитела, которые связываются с полипептидами, включающими внеклеточный домен IL-22RA, такими как мономерные, гомодимерные, гетеродимерные и мультимерные рецепторы, включая растворимые рецепторы. Более того, такие антитела могут быть использованы как антагонисты связывания лигандов IL-22RA, IL-22(SEQ ID NO:6) и IL-20 (SEQ ID NO:8), раздельно или совместно, с рецептором IL-22RA. Более того, гиперэкспрессия или позитивная регуляция IL-22 и IL-20 была показана при псориатических поражениях человека и в образцах кожи с атрофическим дерматитом человека, что предполагает,-2 009124 что IL-22 подобно IL-20 также вовлечен в псориаз человека, атрофический дерматит или другие воспалительные заболевания кожи и эпителиальных тканей. Более того, как здесь описано, при гиперэкспрессии IL-20 или IL-22 у трансгенных мышей проявлялось эпидермальное утолщение и вовлечение иммунных клеток, что указывает на фенотип псориаза; и, кроме того, при введении IL-22 нормальным мышам проявлялось эпидермальное утолщение и вовлечение иммунных клеток, что указывает на фенотип псориаза, который исчезал под действием антагониста растворимого рецептора IL-22RA2 (zcytor16; публикация WIPO No. WO 01/40467). Такие данные in vivo дополнительно предполагают, что провоспалительный IL-22 вовлечен в псориаз, атрофический дерматит или другие воспалительные заболевания кожи и эпителиальных тканей. Как таковые, антагонисты активности IL-22 и IL-20, такие как растворимые рецепторы IL-22RA и антитела к ним, включая моноклональные и нейтрализующие антитела против IL22RA человека настоящего изобретения, пригодны для терапевтического лечения воспалительных заболеваний, особенно в качестве антагонистов как IL-22, так и IL-20, по одиночке и вместе, при лечении псориаза. Более того, антагонисты активности IL-22, такие как растворимые рецепторы IL-22RA и антитела к ним, включая моноклональные и нейтрализующие антитела против IL-22RA человека настоящего изобретения, пригодны для терапевтического лечения других воспалительных заболеваний, например,для связывания, блокирования, ингибирования, снижения, антагонистического действия или нейтрализации IL-22 и IL-20 (по одиночке и вместе) при лечении атрофического дерматита, IBD, колита, эндотоксемии, артрита, ревматоидного артрита и псориазного артрита, респираторного заболевания взрослых(ARD), септического шока, множественной органной недостаточности, воспалительного повреждения легких, таких как астма или бронхит, бактериальной пневмонии, псориаза, экземы, атрофического и контактного дерматита и воспалительного заболевания кишечника, такого как язвенный колит и болезнь Крона. Данные и другие аспекты изобретения станут очевидными при ссылке на последующее подробное описание. Кроме того, ниже идентифицированы различные ссылки и они включены в качестве ссылки во всей своей полноте. 2. Определения. В следующем описании часто применяется ряд терминов. Предлагается ряд определений для облегчения понимания изобретения. Применяемые здесь "нуклеиновая кислота" и "молекула нуклеиновой кислоты" относятся к полинуклеотидам, таким как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК),олигонуклеотидам, фрагментам, получаемым с помощью полимеразной цепной реакции (ПЦР) и фрагментам, образуемым с помощью любого из лигирования, вырезания, действия эндонуклеазы и действия экзонуклеазы. Молекулы нуклеиновой кислоты могут состоять из мономеров, которые представляют собой естественно существующие нуклеотиды (такие как ДНК и РНК), или аналоги существующих в природе нуклеотидов (например, -энантиомерные формы существующих в природе нуклеотидов), или сочетание обоих. Модифицированные нуклеотиды могут содержать изменения в сахарных частях и/или в частях пиримидиновых или пуриновых оснований. Модификации сахара включают, например, замену одной или более гидроксильных групп галогенами, алкильными группами, аминами и азидогруппами,или сахара могут быть функционализированы в виде простых или сложных эфиров. Более того, полная сахарная часть может быть заменена стерически и электронно сходными структурами, такими как азасахара и карбоциклические аналоги сахаров. Примеры модификаций в части основания включают алкилированные пурины и пиримидины, ацилированные пурины или пиримидины или другие хорошо известные гетероциклические заместители. Мономеры нуклеиновой кислоты могут быть соединены с помощью фосфодиэфирных связей или аналогов таких связей. Аналоги фосфодиэфирных связей включают фосфоротиоат, фосфородитиоат, фосфороселеноат, фосфородиселеноат, фосфороанилотиоат, фосфоранилидат, фосфорамидат и тому подобное. Термин "молекула нуклеиновой кислоты" также включает так называемые "пептиднуклеиновые кислоты", которые включают природные или модифицированные основания нуклеиновой кислоты, присоединенные к полиамидной основе. Нуклеиновые кислоты могут быть либо односпиральными, либо двуспиральными. Термин "комплемент молекулы нуклеиновой кислоты" относится к молекуле нуклеиновой кислоты,имеющей комплементарную нуклеотидную последовательность и обратную ориентацию по сравнению с референтной нуклеотидной последовательностью. Например, последовательность 5' ATGCACGGG 3' комплементарна 5'CCCGTGCAT 3'. Термин "вырожденная нуклеотидная последовательность" обозначает последовательность нуклеотидов, которая включает один или несколько вырожденных кодонов по сравнению с молекулой референтной нуклеиновой кислоты, которая кодирует полипептид. Вырожденные кодоны содержат различные триплеты нуклеотидов, но кодируют тот же самый аминокислотный остаток (т.е. каждый из триплетов GAU и GAC кодирует Asp). Термин "структурный ген" относится к молекуле нуклеиновой кислоты, которая транскрибируется в матричную РНК (мРНК), которая затем транслируется в последовательность аминокислот, характерную для конкретного полипептида."Выделенная молекула нуклеиновой кислоты" представляет собой молекулу нуклеиновой кислоты,которая не интегрирована в геномную ДНК организма. Например, молекула ДНК, которая кодирует фактор роста, которая была выделена из геномной ДНК клетки, представляет собой выделенную молекулу ДНК. Другим примером выделенной молекулы нуклеиновой кислоты является химически синтезированная молекула нуклеиновой кислоты, которая не интегрирована в геном организма. Молекула нуклеиновой кислоты, которая была выделена из конкретного вида, является меньшей по сравнению с полной молекулой ДНК хромосомы кз того же вида."Конструкт молекулы нуклеиновой кислоты" представляет собой молекулу нуклеиновой кислоты,односпиральной или двуспиральной, которая была модифицирована посредством вмешательства человека для включения сегментов нуклеиновой кислоты, объединенных и взаимно расположенных в порядке,не существующем в природе."Линейная ДНК" обозначает незамкнутые в круг молекулы ДНК, содержащие свободные 5' - и 3'концы. Линейная ДНК может быть получена из замкнутых в круг молекул ДНК, таких как плазмиды,путем ферментативного гидролиза или физического разрушения."Комплементарная ДНК (кДНК)" представляет собой односпиральную молекулу ДНК, которая образуется из матрицы мРНК с помощью фермента обратной транскриптазы. Обычно для инициации обратной транскрипции применяют праймер, комплементарный частям мРНК. Специалисты в данной области также применяют термин "кДНК" для обозначения двуспиральной молекулы ДНК, состоящей из такой односпиральной молекулы ДНК и комплементарной ей цепи ДНК. Термин "кДНК" также относится к клону молекулы кДНК, синтезированной на матрице РНК."Промотор" представляет собой нуклеотидную последовательность, которая управляет транскрипцией структурного гена. Обычно промотор располагается в 5'-некодирующей области гена, проксимальной к сайту старта транскрипции структурного гена. Элементы последовательности в промоторах, которые принимают участие в инициации транскрипции, часто характеризуют с помощью консенсусных нуклеотидных последовательностей. Данные промоторные элементы включают сайты связывания РНКполимеразы, последовательности ТАТА, последовательности СААТ, специфичные для дифференцировки элементы (DSEs; McGehee et al., Mol. Endocrinol. 7:551 (1993, чувствительные к циклическому АМФ элементы (CRE), чувствительные к сыворотке элементы (SREs; Treisman, Seminars in Cancer Biol. 1:47(1990, глюкокортикоид-чувствительные элементы (GRE) и сайты связывания для других транскрипционных факторов, такие как CRE/ATF (O'Reilly et al., J. Biol. Chem. 267:19938 (1992, АР 2 (Ye et al., J.the Gene, 4th ed. (The Benjamin/Cummings Publishing Company, Inc. 1987), и Lemaigre and Rousseau, Biochem. J. 303:1 (1994. Если промотор является индуцируемым промотором, то скорость транскрипции возрастает в ответ на индуцирующий агент. Напротив, скорость транскрипции не регулируется индуцирующим агентом, если промотор является конститутивным промотором. Известны также репрессируемые промоторы."Базовый промотор" содержит необходимые нуклеотидные последовательности для промоторной функции, включая блок ТАТА и старт транскрипции. При таком определении базовый промотор может иметь или может не иметь определяемой активности в отсутствие специфических последовательностей,которые могут увеличивать активность или придавать тканевую специфичность активности."Регуляторный элемент" представляет собой нуклеотидную последовательность, которая модулирует активность базового промотора. Например, регуляторный элемент может содержать нуклеотидную последовательность, которая связывается с клеточными факторами, обеспечивающими транскрипцию исключительно или предпочтительно в конкретных клетках, тканях и органеллах. Данные типы регуляторных элементов обычно ассоциированы с генами, которые экспрессируются "специфичным для клетки", "специфичным для ткани" или "специфичным для органеллы" образом."Энхансер" представляет собой тип регуляторного элемента, который может увеличивать эффективность транскрипции независимо от расстояния или ориентации энхансера по отношению к сайту старта транскрипции."Гетерологичная ДНК" обозначает молекулу ДНК или популяцию молекул ДНК, которые не существуют в естественных условиях в данной клетке-хозяине. Молекулы ДНК, гетерологичные по отношению к конкретной клетке-хозяину, могут содержать ДНК, происходящую из вида клетки-хозяина (т.е. эндогенной ДНК), когда ДНК хозяина соединена с ДНК не хозяина (т.е. экзогенной ДНК). Например,молекула ДНК, содержащая нехозяйский сегмент ДНК, кодирующий полипептид, оперативно связанный с хозяйским сегментом ДНК, включающим промотор транскрипции, рассматривается как гетерологичная молекула ДНК. Наоборот, гетерологичная молекула ДНК может включать эндогенный ген, оперативно связанный с экзогенным промотором. В качестве другой иллюстрации молекула ДНК, включающая ген,происходящий от клетки дикого типа, рассматривается в качестве гетерологичной ДНК, если данная молекула ДНК введена в мутантную клетку, которая не содержит ген дикого типа."Полипептид" представляет собой полимер из аминокислотных остатков, соединенных с помощью пептидных связей, продуцируемый естественным путем или полученный синтетически. Полипептиды из менее чем приблизительно 10 аминокислотных остатков обычно обозначают как "пептиды"."Белок" представляет собой макромолекулу, включающую одну или более полипептидных цепей. Белок также может включать не пептидные компоненты, такие как углеводные группы. Углеводы и другие непептидные заместители могут быть присоединены к белку клеткой, в которой белок продуцируется, и могут варьироваться в зависимости от типа клетки. Белки определяются здесь в соответствии с их аминокислотными базовыми структурами; заместители, такие как углеводные группы, обычно не описываются, но тем не менее могут присутствовать. Пептид или полипептид, кодируемый нехозяйской молекулой ДНК, представляет собой "гетерологичный" пептид или полипептид."Клонирующий вектор" представляет собой молекулу нуклеиновой кислоты, такую как плазмида,космида или бактериофаг, которая обладает способностью к автономной репликации в клетке-хозяине. Клонирующие векторы обычно содержат один или небольшое количество сайтов рестрикции, узнаваемых эндонуклеазами, что обеспечивает вставку молекулы нуклеиновой кислоты определенным образом без утраты необходимой биологической функции вектора, а также нуклеотидных последовательностей,кодирующих маркерный ген, который является пригодным для применения для идентификации и отбора клеток, трансформированных клонирующим вектором. Маркерные гены обычно включают гены, которые обеспечивают устойчивость к тетрациклину или устойчивость к ампициллину."Экспрессионный вектор" представляет собой молекулу нуклеиновой кислоты, кодирующую ген,который экспрессируется в клетке-хозяине. Обычно экспрессионный вектор включает промотор транскрипции, ген и терминатор транскрипции. Экспрессию гена обычно ставят под контроль промотора, и такой ген называют "оперативно связанным с" промотором. Сходным образом регуляторный элемент и базовый промотор являются оперативно связанными, если регуляторный элемент модулирует активность базового промотора."Рекомбинантный хозяин" представляет собой клетку, которая содержит гетерологичную молекулу нуклеиновой кислоты, такую как клонирующий вектор или экспрессионный вектор. В данном контексте примером рекомбинантного хозяина является клетка, которая продуцирует IL-22RA с экспрессионного вектора. Напротив, IL-22RA может быть продуцирован клеткой, которая является "естественным источником" IL-22RA и не содержит экспрессионного вектора."Интегрированные трансформанты" являются рекомбинантными клетками-хозяевами, в которых гетерологичная ДНК была интегрирована в геномную ДНК клеток."Гибридный белок" представляет собой гибридный белок, экспрессируемый молекулой нуклеиновой кислоты, включающей нуклеотидные последовательности по меньшей мере двух генов. Например,гибридный белок может включать по меньшей мере часть полипептида IL-22RA, соединенную с полипептидом, который связывается с аффинным матриксом. Такой гибридный белок служит средством для выделения больших количеств IL-22RA с помощью аффинной хроматографии. Термин "рецептор" обозначает ассоциированный с клеткой белок, который связывается с биологически активной молекулой, называемой "лигандом". Данное взаимодействие опосредует действие лиганда на клетку. Рецепторы могут быть связанными с мембраной, цитозольными или ядерными; мономерными (например, рецептор тиреотропина, бета-адренергический рецептор) или мультимерными (например, рецептор PDGF, рецептор гормона роста, рецептор IL-3, рецептор GM-CSF, рецептор G-CSF, рецептор эритропоэтина и рецептор IL-6). Связанные с мембраной рецепторы отличаются мультидоменной структурой, включающей внеклеточный лиганд-связывающий домен, и внутриклеточный эффекторный домен, который обычно участвует в проведении сигнала. В некоторых связанных с мембраной рецепторах внеклеточный лиганд-связывающий домен и внутриклеточный эффекторный домен расположены в разных полипептидах, которые составляют полный функциональный рецептор. В целом связывание лиганда с рецептором приводит к конформационному изменению рецептора,которое вызывает взаимодействие между эффекторным доменом и другой молекулой (молекулами) в клетке, что в свою очередь ведет к изменению в метаболизме клетки. Метаболические события, которые часто связаны с лиганд-рецепторными взаимодействиями, включают транскрипцию генов, фосфорилирование, дефосфорилирование, увеличение образования циклического АМФ, мобилизацию клеточного кальция, мобилизацию мембранных липидов, клеточную адгезию, гидролиз инозитоловых липидов и гидролиз фосфолипидов."Растворимый рецептор" представляет собой рецепторный полипептид, который не связан с клеточной мембраной. Растворимые рецепторы наиболее часто являются лиганд-связывающими рецепторными полипептидами, у которых отсутствует трансмембранный и цитоплазматический домены и другая связь с клеточной мембраной, такая как через гликофосфоинозитол (gpi). Растворимые рецепторы могут включать дополнительные аминокислотные остатки, такие как аффинные метки, которыми снабжают для очистки полипептида или для обеспечения сайтами для присоединения полипептида к субстрату или к последовательностям константных областей иммуноглобулинов. Многие рецепторы клеточной поверхности имеют существующие в природе растворимые копии, которые получаются путем гидролиза-5 009124 или транслируются с мРНК после альтернативного сплайсинга. Растворимые рецепторы могут быть мономерными, гомодимерными, гетеродимерными или мультимерными, причем мультимерные рецепторы обычно не включают больше 9 субъединиц, предпочтительно не включают больше 6 субъединиц и наиболее предпочтительно не включают больше 3 субъединиц. Говорят, что рецепторные полипептиды являются, по существу, свободными от трансмембранного и внутриклеточного полипептидных сегментов,когда у них отсутствуют существенные части данных сегментов, обеспечивающих заякоревание на мембране или передачу сигнала, соответственно. Растворимые рецепторы рецепторов цитокинов класса I и класса II обычно включают внеклеточный цитокин-связывающий домен, свободный от трансмембранного домена и внутриклеточного домена. Например, представители растворимых рецепторов включают растворимые рецепторы для CRF2-4 (также известные как IL-10RB) (Genbank, N поступления Z17227),как показано в SEQ ID NO:44 и SEQ ID NO:45; растворимый рецептор для IL-10RA (Genbank, N поступления U00672 и NM 001553), как показано в SEQ ID NO:46; растворимый рецептор для pDIRS1 (также известный как IL-20RB) (Genbank, N поступления AY358305), как показано в SEQ ID NO:47; и растворимый рецептор для IL-22RA (патент США No. 5965704), как показано в SEQ ID NO:3. Специалист в данной области может хорошо изобразить, какие последовательности из известных последовательностей цитокинов класса I и класса II включают внеклеточный цитокин-связывающий домен, свободный от трансмембранного домена и внутриклеточного домена. Более того, специалист в данной области, применяя генетический код, может легко определить полинуклеотиды, которые кодируют такие растворимые рецепторные полипептиды. Термин секреторная сигнальная последовательность обозначает последовательность ДНК, которая кодирует пептид (секреторный пептид), который в качестве компонента более крупного полипептида направляет более крупный полипептид по секреторному пути клетки, в которой он синтезируется. Более крупный полипептид обычно расщепляется с удалением секреторного пептида при прохождении по секреторному пути. Выделенный полипептид представляет собой полипептид, который по существу свободен от примеси клеточных компонентов, таких как углеводные, липидные или другие белковые загрязнения,связанные с полипептидом в природе. Обычно препарат выделенного полипептида содержит полипептид в высоко очищенной форме, т.е. по меньшей мере приблизительно 80% чистоты, по меньшей мере приблизительно 90% чистоты, по меньшей мере приблизительно 95% чистоты, более чем 95% чистоты, такой как чистый на 96, 97 или 98% или более, или чистый на более чем 99%. Одним способом показать,что конкретный препарат белка содержит выделенный полипептид, является появление единственной полосы после электрофореза препарата белка в полиакриламидном геле с додецилсульфатом натрия(ДДС-Na) и окраска геля кумасси ярко синим. Однако термин выделенный не исключает присутствия того же пептида в альтернативных физических формах, таких как димеры или альтернативно гликозилированные или дериватизированные формы. Термины "аминоконцевой" и "карбоксиконцевой" применяются здесь для обозначения положений внутри полипептидов. Когда позволяет контекст, данные термины применяются со ссылкой на конкретную последовательность или часть полипептида для обозначения близости или относительного положения. Например, определенная последовательность, расположенная карбокситерминально по отношению к референтной последовательности в полипептиде, локализована проксимально по отношению к карбоксильному концу референтной последовательности, но не обязательно на карбоксильном конце полного полипептида. Термин "экспрессия" относится к биосинтезу продукта гена. Например, в случае структурного гена экспрессия включает транскрипцию структурного гена в мРНК и трансляцию мРНК в один или более полипептидов. Термин "сплайсинговый вариант" применяется здесь для обозначения альтернативных форм РНК,транскрибируемых с гена. Варианты сплайсинга появляются естественным образом благодаря использованию альтернативных сайтов сплайсинга в транскрибированной молекуле РНК или, что менее обычно,между раздельно транскрибированными молекулами РНК, и могут приводить к нескольким мРНК,транскрибированным с одного и того же гена. Сплайсинговые варианты могут кодировать полипептиды,содержащие измененную аминокислотную последовательность. Термин сплайсинговый вариант также применяется здесь для обозначения полипептида, кодируемого сплайсинговым вариантом мРНК, транскрибированной с гена. Применяемый здесь термин "иммуномодулятор" включает цитокины, факторы роста стволовых клеток, лимфотоксины, костимулирующие молекулы, гематопоэтические факторы и тому подобное и синтетические аналоги данных молекул. Термин "пара комплемент/антикомплемент" обозначает не идентичные части, которые образуют нековалентно ассоциированную, стабильную пару при подходящих условиях. Например, биотин и авидин (или стрептавидин) являются прототипными членами пары комплемент/антикомплемент. Другие иллюстративные пары комплемент/антикомплемент включают пары рецептор/лиганд, пары антитело/антиген (или гаптен или эпитоп), пары смысловой/антисмысловой полинуклеотид и тому подобное.-6 009124 Когда желательна последующая диссоциация пары комплемент/антикомплемент, пара комплемент/антикомплемент предпочтительно имеет сродство связывания менее 109 М-1."Антиидиотипическое антитело" представляет собой антитело, которое связывается с доменом вариабельной области иммуноглобулина. В настоящем контексте антиидиотипическое антитело связывается с вариабельной областью антитела против IL-22RA и таким образом антиидиотипическое антитело имитирует эпитоп IL-22RA."Фрагмент антитела" представляет собой часть антитела, такую как F(ab')2, F(ab)2, Fab', Fab и тому подобное. Независимо от структуры фрагмент антитела связывается с тем же антигеном, который узнается интактным антителом. Например, фрагмент моноклонального антитела против IL-22RA связывается с эпитопом IL-22RA. Термин "фрагмент антитела" также включает синтетический или сконструированный генетически полипептид, который связывается с конкретным антигеном, таким как полипептиды, которые состоят из вариабельной области легкой цепи, "Fv" фрагментов, состоящих из вариабельных областей тяжелой и легкой цепей, рекомбинантных одноцепочечных полипептидных молекул, в которых вариабельные области легкой и тяжелой цепей соединены пептидным линкером ("scFv белки"), и единиц минимального распознавания, состоящих из аминокислотных остатков, которые имитируют гипервариабельную область."Гибридное антитело" представляет собой рекомбинантный белок, который содержит вариабельные домены и области, определяющие комплементарность, происходящие от антитела грызуна, тогда как остальная часть молекулы антитела происходит от антитела человека."Гуманизированные антитела" представляют собой рекомбинантные белки, в которых мышиные области, определяющие комплементарность моноклонального антитела, были перенесены из тяжелой и легкой вариабельных цепей иммуноглобулина мыши в вариабельный домен человека. Конструирование гуманизированных антител для терапевтического применения у человека, происходящих от антител мыши, таких как те, которые связываются с белком человека или нейтрализуют его, находится в компетенции специалистов в данной области. Как применяется здесь, "терапевтический агент" представляет собой молекулу или атом, которые конъюгированы с частью антитела для получения конъюгата, который пригоден для терапии. Примеры терапевтических агентов включают лекарства, токсины, иммуномодуляторы, хелатирующие агенты, соединения бора, фотоактивные агенты или красители и радиоизотопы."Выявляемая метка" представляет собой молекулу или атом, которые могут быть конъюгированы с частью антитела для получения молекулы, пригодной для диагностики. Примеры выявляемых меток включают хелатирующие агенты, фотоактивные агенты, радиоизотопы, флуоресцентные агенты, парамагнитные ионы и другие маркерные части. Термин "аффинная метка" применяется здесь для обозначения полипептидного сегмента, который может быть присоединен ко второму полипептиду для обеспечения очистки или выявления второго полипептида или обеспечения сайтов для присоединения второго полипептида к субстрату. В принципе, в качестве аффинной метки может быть применен любой пептид или белок, для которого имеется антитело или другой специфический связывающий агент. Аффинные метки включают полигистидиновый тракт,протеин A (Nilsson et al., EMBO J. 4:1075 (1985); Nilsson et al., Methods Enzymol. 198:3 (1991, глутатионS-трансферазу (Smith and Johnson, Gene 67:31 (1988, Glu-Glu аффинную метку (Grussenmeyer et al., Proc.Natl. Acad. Sci. USA 82:7952 (1985, вещество Р, пептид FLAG (Hopp et al., Biotechnology 6:1204 (1988,стрептавидин-связывающий пептид или другой антигенный эпитоп или связывающий домен. См. в целом Ford et al., Protein Expression and Purifcation 2:95 (1991). Молекулы ДНК, кодирующие аффинные метки, имеются в продаже из коммерческих источников, например, Pharmacia Biotech, Piscataway, NJ)."Голое антитело" представляет собой цельное антитело, в отличие от фрагмента антитела, которое не конъюгировано с терапевтическим агентом. Голые антитела включают и поликлональные, и моноклональные антитела, а также некоторые рекомбинантные антитела, такие как гибридные и гуманизированные. Применяемый здесь термин "компонент антитела" включает и цельное антитело, и фрагмент антитела."Иммуноконъюгат" представляет собой конъюгат компонента антитела с терапевтическим агентом или выявляемой меткой. Применяемый здесь термин "гибридный белок антитела" относится к рекомбинантной молекуле,которая включает компонент антитела и компонент полипептида IL-22RA. Примеры гибридного белка антитела включают белок, который включает внеклеточный домен IL-22RA и либо домен Fc, либо антигенсвязывающую область."Полипептид-мишень" или "пептид-мишень" представляет собой аминокислотную последовательность, которая включает по меньшей мере один эпитоп и которая экспрессируется на клетке-мишени,такой как опухолевая клетка или клетка, которая является носителем антигена инфекционного агента. Тклетки распознают пептидные эпитопы, презентируемые молекулой главного комплекса гистосовмести-7 009124 мости полипептиду-мишени или пептиду-мишени, и обычно лизируют клетку-мишень или рекрутируют другие иммунные клетки к клетке-мишени, тем самым убивая клетку-мишень."Антигенный пептид" представляет собой пептид, который обычно связывается молекулой главного комплекса гистосовместимости с образованием комплекса МНС-пептид, который узнается Т-клеткой,тем самым вызывая индукцию ответа цитотоксического лимфоцита после презентации Т-клетке. Таким образом, антигенные пептиды способны связываться с подходящей молекулой главного комплекса гистосовместимости и индуцировать ответ цитотоксических Т-клеток, а также лизис клеток или выделение конкретного цитокина против клетки-мишени, которая связывает или экспрессирует антиген. Антигенный пептид может быть связан в зависимости от ситуации молекулой главного комплекса гистосовместимости класса I или класса II на антиген-презентирующей клетке или на клетке-мишени. У эукариот РНК-полимераза II катализирует транскрипцию структурного гена с получением мРНК. Молекула нуклеиновой кислоты может быть сконструирована так, чтобы она содержала матрицу РНКполимеразы II, в которой транскрипт РНК имеет последовательность, которая комплементарна таковой конкретной мРНК. Транскрипт РНК называют "антисмысловой РНК" и молекулу нуклеиновой кислоты,которая кодирует антисмысловую РНК, называют "антисмысловым геном". Молекулы антисмысловой РНК способны связываться с молекулами мРНК, что приводит к ингибированию трансляции мРНК."Антисмысловой олигонуклеотид, специфичный для IL-22RA", или "IL-22RA антисмысловой олигонуклеотид" представляет собой олигонуклеотид, имеющий последовательность, (а) способную образовывать стабильный триплекс с частью гена IL-22RA, или (b) способную образовывать стабильный дуплекс с частью транскрипта мРНК гена IL-22RA."Рибозим" представляет собой молекулу нуклеиновой кислоты, которая содержит каталитический центр. Термин включает ферменты на основе РНК, самосплайсируемые РНК, саморасщепляющиеся РНК и молекулы нуклеиновой кислоты, которые осуществляют данные каталитические функции. Молекулу нуклеиновой кислоты, которая кодирует рибозим, называют "геном рибозима"."Внешняя направляющая последовательность" представляет собой молекулу нуклеиновой кислоты,которая направляет эндогенный рибозим, RNase P, к конкретным видам внутриклеточной мРНК, вызывая расщепление мРНК под действием RNase Р. Молекулу нуклеиновой кислоты, которая кодирует внешнюю направляющую последовательность, называют "геном внешней направляющей последовательности". Термин вариант гена IL-22RA относится к молекулам нуклеиновой кислоты, которые кодируют полипептид, имеющий аминокислотную последовательность, которая представляет собой модификациюSEQ ID NO:3. Такие варианты включают существующие в природе полиморфизмы генов IL-22RA, а также синтетические гены, которые содержат консервативные замены аминокислот в аминокислотной последовательности SEQ ID NO:3. Дополнительные варианты форм генов IL-22RA представляют собой молекулы нуклеиновой кислоты, которые содержат вставки или делеции в описанных здесь нуклеотидных последовательностях. Вариант гена IL-22RA может быть идентифицирован, например, путем определения, будет ли ген гибридизоваться с молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность SEQ ID NO:l, или с ее комплементом в жестких условиях. Альтернативно, варианты генов IL-22RA могут быть идентифицированы путем сравнения последовательностей. Две аминокислотные последовательности имеют 100% идентичность аминокислотных последовательностей, если аминокислотные остатки двух аминокислотных последовательностей являются теми же самыми при выравнивании на максимальное соответствие. Сходно две нуклеотидные последовательности имеют 100% идентичность нуклеотидных последовательностей, если нуклеотидные остатки двух нуклеотидных последовательностей являются теми же самыми при выравнивании на максимальное соответствие. Сравнения последовательностей могут быть выполнены с применением стандартных компьютерных программ, таких как включенные в компьютерный комплект по биоинформатикеLASERGENE, который производится DNASTAR (Madison, Wisconsin). Другие способы сравнения нуклеотидных или аминокислотных последовательностей с помощью определения оптимального выравнивания хорошо известны специалистам в данной области (см. например, Peruski and Peruski, The InternetEdition (Academic Press, Inc. 1998. Конкретные способы определения идентичности последовательностей описываются ниже. Независимо от конкретного способа, применяемого для идентификации варианта гена IL-22RA или варианта полипептида IL-22RA, вариант гена или полипептида, кодируемого вариантом гена, может быть функционально охарактеризован по его способности специфически связываться с антителом противIL-22RA. Вариант гена IL-22RA или вариант полипептида IL-22RA может быть также функционально охарактеризован по его способности связываться со своим лигандом, IL-22, с применением описанного здесь биологического или биохимического теста. Термин аллельный вариант применяется здесь для обозначения любого из двух или более альтернативных форм гена, находящихся в том же самом локусе хромосомы. Аллельные варианты возникают-8 009124 естественным путем из-за мутации и могут быть результатом фенотипического полиморфизма в популяциях. Мутации генов могут быть молчащими (без изменений в кодируемом пептиде) или мутантные гены могут кодировать пептиды, имеющие измененную аминокислотную последовательность. Термин аллельный вариант используется здесь также для обозначения белка, кодируемого аллельным вариантом гена. Термин ортолог обозначает полипептид или белок, полученный из вида, который является функциональной копией полипептида или белка другого вида. Различия последовательностей между ортологами являются результатом формирования вида. Паралоги являются различными, но структурно сходными белками, продуцируемыми организмом. Паралоги, как считается, происходят путем дупликации генов. Например, -глобин, -глобин и миоглобин являются паралогами друг друга. Настоящее изобретение включает функциональные фрагменты генов IL-22RA. В контексте данного изобретения функциональный фрагмент гена IL-22RA относится к молекуле нуклеиновой кислоты,которая кодирует часть полипептида IL-22RA, которая является описанным здесь доменом или, по меньшей мере, специфически связывается с антителом против IL-22RA. Из-за неточности стандартных аналитических методов молекулярные массы и длины полимеров понимаются как приблизительные величины. Когда такая величина выражается как примерно Х или приблизительно X, представленная величина Х должна рассматриваться с точностью 10%. 3. Получение полинуклеотидов или генов IL-22RA. Молекулы нуклеиновой кислоты, кодирующие ген IL-22RA человека, могут быть получены путем скрининга кДНК человека или геномной библиотеки с применением полинуклеотидных зондов на основе SEQ ID NO:1. Данные способы являются стандартными и хорошо установленными и могут осуществляться с применением наборов для клонирования, доступных из коммерческих источников. См., например, Ausubel et al. (eds.), Short Protocols in Molecular Biology, 3rd Edition, John WileySons 1995; Wu et(1972); Huynh et al., "Constructing and Screening cDNA Libraries in gt10 and gt11" in DNA Cloning: A Protocol Approach Vol. I, Glover (ed.), page 49 (IRL Press, 1985); Wu (1997) at pages 47-52. Молекулы нуклеиновой кислоты, кодирующие ген IL-22RA человека, могут быть также получены с применением полимеразной цепной реакции (ПЦР) с праймерами олигонуклеотидов, имеющими нуклеотидные последовательности, которые основываются на нуклеотидных последовательностях гена или кДНК IL-22RA. Общие способы скрининга библиотек с помощью ПЦР предлагаются, например, Yu etal., "Use of the Polymerase Chain Reaction to Screen Phage Libraries", in Methods in Molecular Biology, Vol. 15: PCR Protocols: Current Methods and Applications, White (ed.), Humana Press, Inc., 1993. Более того, способы применения ПЦР для выделения родственных генов описываются, например, Preston, "Use of Degenerate Oligonucleotide Primers and the Polymerase Chain Reaction to Clone Gene Family Members", inMethods in Molecular Biology, Vol. 15: PCR Protocols: Current Methods and Applications, White (ed.), Humana Press, Inc., 1993. В качестве альтернативы, ген IL-22RA может быть получен путем синтеза молекул нуклеиновой кислоты с применением взаимного прайминга длинных олигонуклеотидов и описанных здесь нуклеотидных последовательностей (см., например, Ausubel (1995. Созданные способы с применением полимеразной цепной реакции обеспечивают способностью синтезировать молекулы ДНК длиной по меньшей мере две тысячи пар нуклеотидов (Adang et al., Plant Molec. Biol. 21:1131 (1993), BambotMethods Appl. 4:299 (1995. Для обзора синтеза полинуклеотидов см., например, Glick and Pasternak, Molecular Biotechnology, Principles and Applications of Recombinant DNA (ASM Press 1994), Itakura et al.,Annu. Rev. Biochem. 53:323 (1984) и Climie et al., Proc. Nat'l Acad. Sci. USA 87:633 (1990). 4. Получение вариантов генов IL-22RA. В настоящем изобретении предлагается множество молекул нуклеиновой кислоты, включая молекулы ДНК и РНК, которые кодируют раскрытые здесь полипептиды IL-22RA. Специалисты в данной области должны легко признавать, что, учитывая вырожденность генетического кода, среди данных молекул полинуклеотидов возможны рассматриваемые вариации последовательностей. Более того, в настоящем изобретении также предлагаются выделенные, растворимые мономерные, гомодимерные, гетеродимерные и мультимерные рецепторные полипептиды, которые включают по меньшей мере одну субъединицу рецептора IL-22RA, которая является, по существу, гомологичной рецепторному полипептиду с SEQ ID NO:3. Таким образом, в настоящем изобретении рассматриваются молекулы нуклеиновой кислоты, кодирующие полипептид IL-22RA, включая вырожденные нуклеотиды SEQ ID NO:1 и их РНК эквиваленты. В табл. 1 представлены однобуквенные коды для обозначения положений вырожденных нуклеотидов. Идентификации представляют собой нуклеотиды, обозначенные буквой кода. Комплемент ука-9 009124 зывает код для комплементарного(ных) нуклеотида(дов). Например, код Y обозначает либо С, либо Т, и его комплемент R обозначает А или G, причем А комплементарен Т, а G комплементарен С. Таблица 1 Вырожденные кодоны, охватывающие все возможные кодоны для данной аминокислоты, представлены в табл. 2. Таблица 2- 10009124 Специалист в данной области должен понимать, что некоторая двусмысленность заложена в определение вырожденного кодона, представителя всех возможных кодонов, кодирующих аминокислоту. Например, вырожденный кодон для серина (WSN) может в некоторых условиях кодировать аргинин(AGR) и вырожденный кодон для аргинина (MGN) может в некоторых условиях кодировать серин(AGY). Сходные взаимоотношения существуют между кодонами, кодирующими фенилаланин и лейцин. Таким образом, некоторые полинуклеотиды, охватываемые вырожденной последовательностью, могут кодировать варианты аминокислотных последовательностей, но специалист в данной области может легко идентифицировать такие варианты последовательностей, справляясь с аминокислотными последовательностями SEQ ID NO:3. Варианты последовательностей могут быть легко протестированы на их функции, как здесь описано. Различные виды могут выказывать предпочтительное использование кодонов. В целом см.Mol. Biol. 158:573 (1982), Sharp and Matassi, Curr. Opin. Genet. Dev. 4:851 (1994), Kane, Curr. Opin. Biotechnol. 6:494 (1995), и Makrides, Microbiol. Rev. 60:512 (1996). Применяемый здесь термин предпочтительное использование кодонов или предпочтительные кодоны представляет собой термин уровня техники, относящегося к трансляции кодонов в белок, наиболее часто используемой в клетках определенного вида, таким образом, благоприятствуя одному или нескольким представителям возможных кодонов, кодирующих каждую аминокислоту (см. табл. 2). Например, аминокислота треонин (Thr) может кодироваться АСА, АСС, ACG или ACT, но в клетках млекопитающих наиболее обычным используемым кодоном является АСС; у других видов, например, в клетках насекомых, дрожжей, вирусов или бактерий предпочтительными могут быть различные кодоны Thr. Предпочтительные кодоны для конкретного вида могут быть введены в полинуклеотиды настоящего изобретения с помощью различных способов,известных в данной области. Введение последовательностей предпочтительных кодонов в рекомбинантную ДНК может, например, увеличивать продукцию белка, делая трансляцию белка более эффективной в конкретном типе клеток или у конкретного вида. Следовательно, раскрытые здесь последовательности вырожденных кодонов служат в качестве матрицы для оптимизации экспрессии полинуклеотидов в различных типах клеток и видов, обычно применяемых в данной области техники и раскрытых здесь. Последовательности, содержащие предпочтительные кодоны, могут быть протестированы и оптимизированы для экспрессии у различных видов и протестированы на их функцию, как здесь описано. кДНК, кодирующая IL-22RA, может быть выделена с помощью различных способов, таких как зондирование с полной или частичной кДНК человека или с одним или более наборами вырожденных зондов на основе раскрытых последовательностей. кДНК может быть также клонирована с применением полимеразной цепной реакции с праймерами, созданными из раскрытых здесь представителей последовательностей IL-22RA человека. Кроме того, библиотека кДНК может быть использована для трансформации или трансфекции клеток-хозяев и экспрессия интересующей кДНК может быть определена с помощью антитела к полипептиду IL-22RA. Специалисты в данной области должны знать, что последовательность, раскрытая в SEQ ID NO:1,представляет собой единичный аллель IL-22RA человека и что предполагается существование аллельных вариантов и альтернативного сплайсинга. Аллельные варианты данной последовательности могут быть клонированы с помощью зондирования кДНК или геномных библиотек от различных индивидуумов в соответствии со стандартными процедурами. Раскрытые здесь аллельные варианты нуклеотидных последовательностей, включая те, которые содержат молчащие мутации и те, в которых мутации ведут к изменениям аминокислотной последовательности, входят в объем настоящего изобретения, также как и белки, которые представляют собой аллельные варианты раскрытых здесь аминокислотных последовательностей. Молекулы кДНК, полученные от мРНК после альтернативного сплайсинга, которые сохраняют свойства полипептида IL-22RA, включаются в объем настоящего изобретения, также как и полипептиды, кодируемые такими кДНК и мРНК. Аллельные варианты и варианты сплайсинга данных последовательностей могут быть клонированы путем зондирования кДНК или геномных библиотек от различных индивидуумов или тканей в соответствии со стандартными процедурами, известными в данной области. Применяя обсуждаемые выше способы, специалист в данной области может получить множество полипептидов, которые включают растворимую рецепторную субъединицу IL-22RA, которая по существу гомологична SEQ ID NO:1, или которая кодирует аминокислоты SEQ ID NO:3, или ее аллельные варианты, и сохраняют лиганд-связывающие свойства рецептора IL-22RA дикого типа. Такие полипептиды могут также включать дополнительные полипептидные сегменты, как обычно раскрывается здесь. В определенных осуществлениях изобретения выделенные молекулы нуклеиновой кислоты могут гибридизоваться в жестких условиях с молекулами нуклеиновой кислоты, включающими раскрытые здесь нуклеотидные последовательности. Например, такие молекулы нуклеиновой кислоты могут гибридизоваться в жестких условиях с молекулами нуклеиновой кислоты, включающими нуклеотидную последовательность SEQ ID NO:1, или с молекулами нуклеиновой кислоты, включающими нуклеотидную последовательность, комплементарную SEQ ID NO:1, или ее фрагментами.- 11009124 В целом, жесткие условия выбирают так, чтобы температура была приблизительно 5 С, ниже чем температура точки плавления (Tm) для конкретной последовательности при определенной ионной силе и рН. Tm представляет собой температуру (при определенной ионной силе и рН), при которой 50% последовательности-мишени полностью гибридизуется с подходящим зондом. После гибридизации молекулы нуклеиновой кислоты могут быть промыты для удаления непрогибридизованных молекул нуклеиновой кислоты в жестких условиях или в очень жестких условиях. См., например, Sambrook et al., Molecular(1990. Компьютерная программа для анализа последовательности, такая как OLIGO 6.00 (LSR; LongLake, MN) и Primer Premier 4.0 (Premier Biosoft International; Palo Alto, CA), а также сайты в Интернете являются доступными средствами анализа данной последовательности и расчета Tm на основе определенных для пользователей критериев. Также в возможностях специалиста в данной области адаптация гибридизации и условий промывания для применения с конкретным полинуклеотидным гибридом. В настоящем изобретении также предлагаются выделенные полипептиды IL-22RA, которые имеют по существу сходную идентичность последовательностей с полипептидами SEQ ID NO:3 или с другими ортологами. Термин по существу сходная идентичность последовательностей применяется здесь для обозначения полипептидов, имеющих по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или выше чем 95%, такую как 96, 97, 98 или 99% идентичность последовательности с последовательностями, представленными в SEQ ID NO:3, или с их ортологами. Например,вариант и ортологичный рецептор IL-22RA могут быть использованы для индукции иммунного ответа и выработки антител с перекрестной реакцией с IL-22RA человека. Такие антитела могут быть гуманизированы и модифицированы, как здесь описано, и применяться терапевтически для лечения псориаза,псориазного артрита, IBD, колита, эндотоксемии, а также других описанных здесь терапевтических применений. Настоящее изобретение также охватывает варианты молекул нуклеиновой кислоты, которые могут быть идентифицированы с помощью двух критериев: определения сходства между кодируемым полипептидом и аминокислотной последовательностью SEQ ID NO:3, и гибридизационным тестом. Такие варианты IL-22RA включают молекулы нуклеиновой кислоты, (1) которые остаются гибридизованными с молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность SEQ ID NO:1 (или с ее комплементом) при жестких условиях промывки, при которых жесткость промывки эквивалентна 0,5 х 2 х SSC с 0,1% ДДС-Na при 55-65 С и (2) которые кодируют полипептид, имеющий по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или выше чем 95%, такую как 96, 97, 98 или 99% идентичность последовательности с аминокислотной последовательностью SEQ IDNO:3. Альтернативно, варианты IL-22RA могут быть охарактеризованы как молекулы нуклеиновой кислоты, (1) которые остаются гибридизованными с молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность SEQ ID NO:1 (или с ее комплементом) при очень жестких условиях промывки, при которых жесткость промывки эквивалентна 0,1 х-0,2 х SSC с 0,1% ДДС-Na при 50-65 С и (2) которые кодируют полипептид, имеющий по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или выше чем 95%, такую как 96, 97, 98 или 99% или выше идентичность последовательности с аминокислотной последовательностью SEQ ID NO:3. Процент идентичности последовательностей определяют общепринятыми способами. См., например, Altschul et al., Bull. Math. Bio. 48:603 (1986), и Henikoff and Henikoff, Proc. Natl. Acad. Sci. USA 89:10915 (1992). Вкратце, две аминокислотные последовательности выравниваются для оптимизации баллов выравнивания с применением штрафа 10 на внесение делеции в выравнивание, штрафа 1 на продолжение делеции и матрицы баллов Henikoff and Henikoff (там же) как представлено в табл. 3 (аминокислоты указываются стандартным однобуквенным кодом). Затем рассчитывают процент идентичности как: ([общее число идентичных пар]/[длина более длинной последовательности плюс число пробелов,введенных в более длинную последовательность для того, чтобы выровнять две последовательности])(100). Специалисты в данной области понимают, что существует много принятых алгоритмов для выравнивания двух аминокислотных последовательностей. Алгоритм поиска сходства "FASTA" Pearson иLipman является подходящим способом выравнивания белков для анализа степени идентичности родственной аминокислотной последовательности, раскрытой здесь, и аминокислотной последовательности предполагаемого варианта IL-22RA. Алгоритм FASTA описан Pearson and Lipman, Proc. Nat'l Acad. Sci.USA 85:2444 (1988), и Pearson, Meth. Enzymol. 183:63 (1990). Вкратце, FASTA сначала характеризует сходство последовательностей путем идентификации областей, родственных запрашиваемой последовательности (например, SEQ ID NO:2 или SEQ ID NO:3) и тестируемой последовательности, которые имеют либо наивысшую степень идентичности (если переменная ktup равна 1) или пары идентичности (еслиktup равна 2) без рассмотрения консервативных аминокислотных замен, вставок или делеций. Десять областей с наивысшей степенью идентичности затем переоценивают путем сравнения сходства всех парных аминокислот с применением матрицы замен аминокислот, и концы областей отстригают для включения только тех остатков, которые вносят вклад в наивысший балл. Если существует несколько областей с баллами, более высокими, чем величина отсекания (рассчитанная с помощью предварительно определенной формулы, основанной на длине последовательности и величины ktup), затем отстриженные исходные области проверяют для определения того, могут ли области соединяться с образованием приближенного выравнивания с пробелами. Наконец, области двух аминокислотных последовательностей с наивысшими баллами выравнивают с применением модификации алгоритма NeedlemanWunsch-Sellers (Needleman and Wunsch, J. Mol. Biol. 48:444 (1970); Sellers, SIAM J. Appl. Math. 26:787(1974, что разрешает вставки и делеции аминокислот. Иллюстративными параметрами для анализаFASTA являются: ktup=1, штраф=10 за открытие пробела, штраф=1 за увеличение пробела и матрица замен=BLOSUM62. Данные параметры могут быть введены в программу FASTA путем модификации файла матрицы баллов ("SMATRIX"), как объяснено в приложении 2 Pearson, Meth. Enzymol. 183:63FASTA можно также использовать для определения идентичности последовательностей молекул нуклеиновой кислоты с применением отношения, как раскрыто выше. Для сравнения нуклеотидных последовательностей величина ktup может варьировать между одним и шестью, предпочтительно от трех до шести, наиболее предпочтительно равна трем, с другими параметрами, указанными, как описано выше. Настоящее изобретение включает молекулы нуклеиновой кислоты, которые кодируют полипептид,имеющий консервативные замены аминокислот по сравнению с раскрытой здесь аминокислотной последовательностью. Например, могут быть получены варианты, которые содержат одну или более замен аминокислот в SEQ ID NO:3, в которых алкиламинокислота заменена на алкиламинокислоту в аминокислотной последовательности IL-22RA, ароматическая аминокислота заменена на ароматическую аминокислоту в аминокислотной последовательности IL-22RA, содержащая серу аминокислота заменена на содержащую серу аминокислоту в аминокислотной последовательности IL-22RA, содержащая гидроксил аминокислота заменена на содержащую гидроксил аминокислоту в аминокислотной последовательностиIL-22RA, кислая аминокислота заменена на кислую аминокислоту в аминокислотной последовательности IL-22RA, основная аминокислота заменена на основную аминокислоту в аминокислотной последова- 13009124 тельности IL-22RA или двухосновная монокарбоксильная аминокислота заменена на двухосновную монокарбоксильную аминокислоту в аминокислотной последовательности IL-22RA. Среди обычных аминокислот, например, консервативная замена аминокислот иллюстрируется заменой аминокислот внутри каждой из последующих групп: (1) глицин, аланин, валин, лейцин и изолейцин, (2) фенилаланин, тирозин и триптофан, (3) серин и треонин, (4) аспартат и глутамат, (5) глутамин и аспарагин и (6) лизин,аргинин и гистидин. Таблица BLOSUM62 представляет собой матрицу замен аминокислот, полученную из приблизительно 2000 локальных множественных выравнивании сегментов последовательностей белков, представляющих высоко консервативные области более чем 500 групп родственных белковBLOSUM62 может быть использована для определения консервативных аминокислотных замен, которые могут быть введены в аминокислотные последовательности настоящего изобретения. Хотя возможно создать аминокислотные замены на основе только химических свойств (как обсуждалось выше), выражение консервативная замена аминокислот предпочтительно относится к замене, представленной величиной BLOSUM62 более высокой, чем -1. Например, аминокислотная замена является консервативной, если замена характеризуется величиной BLOSUM62 0, 1, 2 или 3. В соответствии с данной системой предпочтительные консервативные аминокислотные замены характеризуются величиной BLOSUM62 по меньшей мере 1 (например, 1, 2 или 3), в то время как более предпочтительные консервативные аминокислотные замены характеризуются величиной BLOSUM62 по меньшей мере 2 (например, 2 или 3). Конкретные варианты IL-22RA характеризуются как имеющие по меньшей мере 70%, по меньшей мере 80%,по меньшей мере 90%, по меньшей мере 95% или выше чем 95%, такую как 96, 97, 98 или 99% или более высокую идентичность последовательности с аминокислотной последовательностью (например, SEQ IDNO:3), где вариация в аминокислотной последовательности обусловлена одной или более консервативными аминокислотными заменами. Консервативные замены аминокислот могут быть введены в ген IL-22RA, например, путем замены нуклеотидов на нуклеотиды, представленные в SEQ ID NO:1. Такие консервативные аминокислотные варианты могут быть получены с помощью олигонуклеотид-направленного мутагенеза, линкерсканирующего мутагенеза, мутагенеза, использующего полимеразную цепную реакцию и тому подобное(см., Ausubel (1995); and McPherson (ed.), Directed Mutagenesis: A Practical Approach (IRL Press 1991. Вариант полипептида IL-22RA может быть идентифицирован по способности специфически связываться с антителами против IL-22RA. Белки настоящего изобретения могут также включать аминокислотные остатки, не существующие в природе. Аминокислоты, не существующие в природе, включают, не ограничиваясь этим, транс-3 метилпролин, 2,4-метанопролин, цис-4-гидроксипролин, транс-4-гидроксипролин, N-метилглицин, аллотреонин, метилтреонин, гидроксиэтилцистеин, гидроксиэтилгомоцистеин, нитроглутамин, гомоглутамин, пипеколовую кислоту, тиазолидинкарбоновую кислоту, дегидропролин, 3- и 4-метилпролин, 3,3 диметилпролин, трет-лейцин, норвалин, 2-азафенилаланин, 3-азафенилаланин, 4-азафенилаланин и 4 фторфенилаланин. В данной области известно несколько способов введения не существующих в природе аминокислотных остатков в белки. Например, может быть применена система in vitro, в которой бессмысленные мутации подавляются применением химически аминоацилированного супрессора тРНК. Способы синтеза аминокислот и аминоацилированных тРНК известны в данной области техники. Транскрипция и трансляция плазмид, содержащих бессмысленные мутации обычно осуществляется в бесклеточной системе, включающей экстракт Е. coli S30 и имеющиеся в продаже ферменты, а также другие реактивы. Белки очищают хроматографией. См., например, Robertson et al., J. Am. Chem. Soc. 113:2722(1991), Ellman et al., Methods Enzymol. 202:301 (1991), Chung et al., Science 259:806 (1993) и Chung et al.,Proc. Nat'l Acad. Sci. USA 90:10145 (1993). Во втором способе трансляцию осуществляют в ооцитах Xenopus путем микроинъекции мутантной мРНК и химически аминоацилированного супрессора тРНК (Turcatti et al., J. Biol. Chem. 271:19991(1996. В третьем способе клетки Е. coli культивируют в отсутствие той природной аминокислоты, которая будет заменяться (например, фенилаланина) и в присутствии желаемой не существующей(их) в природе аминокислоты(от) (например, 2-азафенилаланина, 3-азафенилаланина, 4-азафенилаланина или 4 фторфенилаланина). Не существующая в природе аминокислота вводится в белок на место ее природной пары. См., Koide et al., Biochem. 33:7470 (1994). Существующие в природе аминокислотные остатки могут быть превращены в несуществующие в природе виды с помощью химической модификации in vitro. Химическая модификация может сочетаться с сайт-направленным мутагенезом для дополнительного расширения диапазона замен (Wynn and Richards, Protein Sci. 2:395 (1993. Ограниченное число неконсервативных аминокислот, аминокислот, которые не кодируются генетическим кодом, несуществующих в природе аминокислот и неприродных аминокислот может быть заместителями аминокислотных остатков IL-22RA. Незаменимые аминокислоты в полипептидах настоящего изобретения могут быть идентифицированы в соответствии с процедурами, известными в данной области, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез (Cunningham and Wells, Science 244:1081 (1989), Bass et al.,Proc. Nat'l Acad. Sci. USA 88:4498 (1991), Coombs and Corey, "Site-Directed Mutagenesis and Protein Engi- 14009124neering," in Proteins: Analysis and Design, Angeletti (ed.), pages 259-311 (Academic Press, Inc. 1998. В последнем способе единичные мутации аланина вводятся в каждый остаток в молекуле и полученные мутантные молекулы тестируются на биологическую активность для идентификации аминокислотных остатков, которые являются критическими для активности молекулы. См. также Hilton et al., J. Biol. Chem. 271:4699 (1996). Хотя может быть выполнен анализ последовательностей для дополнительного определения лигандсвязывающей области IL-22RA, аминокислоты, которые играют роль в связывающей активности IL22RA (такой как связывание IL-22RA с лигандом IL-22 или с антителом против IL-22RA), могут быть также определены с помощью физического анализа структуры, что определяется с помощью таких способов, как ядерный магнитный резонанс, кристаллография, дифракция электронов или фотоаффинное промечивание, в сочетании с мутацией предполагаемого контактного сайта аминокислот. См., например,de Vos et al., Science 255:306 (1992), Smith et al., J. Mol. Biol. 224:899 (1992) и Wlodaver et al., FEBS Lett. 309:59 (1992). Множественные замены аминокислот могут быть сделаны и протестированы с применением известных способов мутагенеза и скрининга, таких как раскрытые Reidhaar-Olson and Sauer (Science 241:53(1988 или Bowie and Sauer (Proc. Nat'l Acad. Sci. USA 86:2152 (1989. Кратко, данные авторы раскрывают способы одновременного рандомизирования двух или более положений в полипептиде, отбора на функционирующий полипептид, и затем секвенирования подвергнутых мутагенезу полипептидов для определения спектра позволяемых замен в каждом положении. Другие способы, которые могут быть использованы, включают Фаговый дисплей (например, Lowman et al., Biochem. 30:10832 (1991), Ladner etal., патент США 5223409, Huse, международная публикацияWO 92/06204 и область-направленный мутагенез (Derbyshire et al., Gene 46:145 (1986), и Ner et al., DNA 7:127, (1988. Более того, IL-22RA, меченный биотином или ФИТЦ, может быть применен для экспрессионного клонирования лигандов IL22RA. Варианты раскрытых нуклеотидных и полипептидных последовательностей IL-22RA могут быть также созданы с помощью перестановки ДНК, как раскрыто Stemmer, Nature 370:389 (1994), Stemmer,Proc. Nat'l Acad. Sci. USA 91:10747 (1994) и в международной публикацииWO 97/20078. Кратко, варианты молекул ДНК создают с помощью гомологичной рекомбинации in vitro путем рандомизированной фрагментации родительской ДНК с последующей повторной сборкой с применением ПЦР, что ведет к рандомизированному введению точечных мутаций. Данный способ может быть модифицирован с помощью применения семейства родительских молекул ДНК, таких как аллельные варианты или молекулы ДНК от различных видов, для введения в процесс дополнительной вариабельности. Отбор или скрининг на желаемую активность с последующими дополнительными повторениями мутагенеза и тестирование дает быструю эволюцию последовательностей путем отбора желаемых мутаций при одновременном отборе против вредных изменений. Раскрытые здесь способы мутагенеза могут сочетаться с высоко производительными, автоматизированными методами скрининга для определения активности клонированных, подвергнутых мутагенезу полипептидов в клетках-хозяевах. Подвергнутые мутагенезу молекулы ДНК, которые кодируют биологически активные полипептиды или полипептиды, которые связываются с антителами против IL-22RA,могут быть выделены из клеток-хозяев и быстро секвенированы с применением современного оборудования. Данные способы позволяют быстро определить важность индивидуальных аминокислотных остатков в интересующем пептиде и могут быть применены к полипептидами неизвестной структуры. Настоящее изобретение также включает функциональные фрагменты полипептидов IL-22RA и молекул нуклеиновой кислоты, кодирующих такие функциональные фрагменты. Обычный анализ делеций молекул нуклеиновой кислоты может быть выполнен для получения функциональных фрагментов молекулы нуклеиновой кислоты, которая кодирует полипептид IL-22RA. В качестве иллюстрации, молекулы ДНК, имеющие нуклеотидную последовательность SEQ ID NO:1, могут быть гидролизованы нуклеазой Bal31 для получения серий гнездовых делеций. Фрагменты затем вставляют в экспрессионные векторы в подходящую рамку считывания и экспрессируемые полипептиды выделяют и тестируют на способность связываться с антителами против IL-22RA. Одной альтернативой экзонуклеазному гидролизу является применение олигонуклеотид-направленного мутагенеза для введения делеций или стопкодонов для специфической продукции желаемого фрагмента. Альтернативно, конкретные фрагменты гена IL-22RA могут быть синтезированы с применением полимеразной цепной реакции. Примером данного подхода являются исследования усечения одного или обоих концов интерферонов, суммированные Horisberger and Di Marco, Pharmac. Ther. 66:507 (1995). Более того, стандартные способы функционального анализа белков описаны, например, Treuter et al., Molec. Gen. Genet. 240:113- 15009124 Анализ раскрытых здесь конкретных последовательностей дает набор иллюстративных функциональных фрагментов, представленных в табл. 4. Нуклеотиды, кодирующие дополнительные функциональные варианты описанных здесь доменов IL22-RA человека не показаны в табл. 4 и могут быть определены при ссылке на SEQ ID NO:1. Такие функциональные фрагменты включают, например, следующие нуклеотидные последовательности SEQ ID NO:1: нуклеотиды 85-381, 206-717 и 85-717 SEQ ID NO:1 и соответствующие кодируемые ими аминокислотные последовательности, как показано в SEQ ID NO: 2 и SEQ ID NO:3, соответственно. Таблица 4 Настоящее изобретение также охватывает функциональные фрагменты гена IL-22RA, которые имеют аминокислотные замены по сравнению с раскрытой здесь аминокислотной последовательностью. Вариант гена IL-22RA может быть идентифицирован на основе структуры путем определения степени идентичности с раскрытыми нуклеотидной и аминокислотной последовательностями, как обсуждалось выше. Альтернативным подходом к идентификации варианта гена на основе структуры является определение того, способна ли молекула нуклеиновой кислоты, кодирующая потенциальный вариант гена IL22RA, гибридизоваться с молекулой нуклеиновой кислоты, включающей нуклеотидную последовательность, такую как SEQ ID NO:1. Настоящее изобретение также включает применение функциональных фрагментов IL-22RA в виде полипептидов, антигенных эпитопов, несущих эпитоп частей полипептидов IL-22RA и молекул нуклеиновой кислоты, которые кодируют такие функциональные фрагменты, антигенные эпитопы, несущие эпитоп части полипептидов IL-22RA. Такие фрагменты применяют для создания полипептидов для применения в выработке антител и связывающих партнеров, которые связывают, блокируют, ингибируют,снижают, проявляют антагонистическое действие или нейтрализуют активность IL-22 или как IL-20, так и IL-22. Функциональный полипептид IL-22RA или его фрагмент, как здесь определено, характеризуется по его способности блокировать, ингибировать, снижать, проявлять антагонистическое действие или нейтрализовать воспалительную, пролиферативную или дифференцировочную активность IL-20 или IL22, благодаря его способности индуцировать или ингибировать специализированные клеточные функции или из-за его способности специфически связываться с антителом против IL-22RA, клеткой, IL-20 илиIL-22. Как описывалось ранее, IL-22RA по структуре и доменам относится к классу II рецепторов цитокинов, как здесь описано. Таким образом, настоящее изобретение дополнительно рассматривает применение гибридных белков, охватывающих (а) полипептидные молекулы, включающие один или более доменов, описанных выше; и (b) функциональные фрагменты, включающие один или более таких доменов. Другая часть полипептида гибридного белка может быть определена другим рецептором цитокинов класса II, таким как IL-10R, IL-13R, IL-20RA, IL-20RB, IL-10RB (CRF2-4), IL-22RA2, или к ненативному и/или к не относящемуся к ним секреторному сигнальному пептиду, который ускоряет секрецию гибридного белка. В настоящем изобретении также предлагаются полипептидные фрагменты или пептиды, включающие несущую эпитоп часть описанного здесь полипептида IL-22RA. Такие фрагменты или пептиды могут включать иммуногенный эпитоп, который представляет собой часть белка, которая вызывает ответ антитела при применении в качестве иммуногена полного белка. Иммуногенные несущие эпитоп пептиды могут быть идентифицированы с применением стандартных способов (см., например, Geysen et al.,Proc. Nat'l Acad. Sci. USA 81:3998 (1983. Наоборот, полипептидные фрагменты или пептиды могут включать антигенный эпитоп, который представляет собой область белковой молекулы, с которой может специфически связываться антитело. Определенные эпитопы состоят из линейных или прилегающих участков аминокислот и антигенность такого эпитопа не разрушается денатурирующими агентами. В данной области известно, что относительно короткие синтетические пептиды, которые могут имитировать эпитопы белка, могут быть использованы для стимуляции продукции антител против белка (смотри, например, Sutcliffe et al., Science 219:660 (1983. Соответственно, антигенные несущие эпитоп пептиды, антигенные пептиды, эпитопы и полипептиды настоящего изобретения пригодны для выработки антител, которые связываются с описанными здесь полипептидами, а также для идентификации и скрининга моноклональных антител противIL-22RA, которые являются нейтрализующими и которые могут связывать, блокировать, ингибировать,снижать, проявлять антагонистическое действие или нейтрализовать активность IL-22 и IL-20 (раздельно или совместно). Такие нейтрализующие моноклональные антитела настоящего изобретения могут связываться с антигенным эпитопом IL-22RA. Hopp/Woods профили гидрофильности могут быть использованы для определения областей, которые имеют наибольший антигенный потенциал в SEQ ID NO:3 (HoppEngineering 11:153-169, 1998). Профиль основывается на скользящем окне в шесть остатков. Скрытые остатки G, S и Т и экспонированные остатки Н, Y и W игнорировали. В IL-22RA данные области могут быть определены специалистом в данной области. Более того, антигенные эпитопы IL-22RA в SEQ IDNO:3, как предсказывается графиком Jameson-Wolf, например, с применением программы DNASTARProtean (DNASTAR, Inc., Madison, WI), служат в качестве предпочтительных антигенных эпитопов и могут быть определены специалистом в данной области. Такие антигенные эпитопы включают (1) аминокислотные остатки с 1 (Pro) по 6 (Asp) SEQ ID NO 3; (2) аминокислотные остатки с 26 (Ser) no 32 (Pro)(Thr) по 108 (Asp) SEQ ID NO:3; (8) аминокислотные остатки с 130 (Arg) no 135 (His) SEQ ID NO:3; (9) аминокислотные остатки с 164 (Gly) no 166 (Lys) SEQ ID NO:3; (10) аминокислотные остатки с 175 (Tyr) по 179 (Glu) SEQ ID NO:3; (11) аминокислотные остатки с 193 (Lys) по 196 (Ala) SEQ ID NO:3; (12) аминокислотные остатки с 203 (Lys) по 209 (Thr) SEQ ID NO:3. Дополнительные эпитопы включают следующие пептиды и потенциально создаются из нередуцированного полноразмерного IL22-RA человека,расщепляемого CnBr: пептид 6 (SEQ ID NO:56), пептид 7 (SEQ ID NO:57); пептид 8 (SEQ ID NO: 58); пептид 9 (SEQ ID NO: 59); пептид 10 (SEQ ID NO: 60) и пептид 11 (SEQ ID NO:61). Цистеины образуют дисульфидные мостики, что ведет к возможной связи между пептидами 7 (SEQ ID NO:57) и 10 (SEQ IDNO:60). Конкретно, SEQ ID NO:56 соответствует аминокислотным остаткам с 1 (Pro) по 92 (Met) SEQ IDNO:3; SEQ ID NO:57 соответствует аминокислотным остаткам с 93 (Thr) по 120 (Met) SEQ ID NO:3, SEQID NO: 58 соответствует аминокислотным остаткам с 121 (Ile) по 160 (Met) SEQ ID NO:3, SEQ ID NO:59 соответствует аминокислотным остаткам с 161 (His) по 185 (Met) SEQ ID NO:3, SEQ ID NO:60 соответствует аминокислотным остаткам с 186 (Ile) по 199 (Met) SEQ ID NO:3 и SEQ ID NO:61 соответствует аминокислотным остаткам с 200 (Cys) по 211 (Thr) SEQ ID NO:3. Кроме того, остатки SEQ ID NO:2 (и соответствующие остатки SEQ ID NO:3), которые важны для связывания лиганда с рецептором, включают Tyr-60, и Phe-164, Tyr-93, Arg-112, Lys-210 и Glu-211 SEQ ID NO:2 (и соответствующие остатки SEQID NO:3). Более того, первичные остатки SEQ ID NO:2 (и соответствующие остатки SEQ ID NO:3), которые важны для прямого связывания лиганда с рецептором, включают Tyr-60 и Phe-164 SEQ ID NO:2 (и соответствующие остатки SEQ ID NO:3), и вторичные остатки включают остатки Tyr-93, Arg-112, Lys210, и Glu-211 SEQ ID NO:2 (и соответствующие остатки SEQ ID NO:3). В предпочтительных осуществлениях антигенные эпитопы, с которыми связываются антитела настоящего изобретения, должны содержать остатки SEQ ID NO:2 (и соответствующие остатки SEQ ID NO:3), которые важны для связывания лиганда с рецептором, например, с IL-22RA и IL-20 или IL-22 (раздельно или совместно). Антигенные несущие эпитоп пептиды и полипептиды могут содержать по меньшей мере от четырех до десяти аминокислот, по меньшей мере от десяти до пятнадцати аминокислот или от приблизительно 15 до приблизительно 30 аминокислот раскрытой здесь аминокислотной последовательности. Такие несущие эпитоп пептиды и полипептиды могут быть получены путем фрагментации полипептида IL-22RA или с помощью химического пептидного синтеза, как здесь описано. Более того, эпитопы могут быть отобраны с помощью фагового дисплея рандомизированных пептидных библиотек (см., например., Laneand Stephen, Curr. Opin. Immunol. 5:268 (1993), и Cortese et al., Curr. Opin. Biotechnol. 7:616 (1996. Стандартные способы идентификации эпитопов и получения антител из небольших пептидов, которые включают эпитоп, описаны, например, Mole, "Epitope Mapping," in Methods in Molecular Biology, Vol. 10, Manson (ed.), pages 105-116 (The Humana Press, Inc. 1992), Price, "Production and Characterization of SyntheticPeptide-Derived Antibodies," in Monoclonal Antibodies: Production, Engineering, and Clinical Application,Ritter and Ladyman (eds.), pages 60-84 (Cambridge University Press 1995), и Coligan et al. (eds.). Current Protocols in Immunology, pages 9.3.1-9.3.5 and pages 9.4.1-9.4.11 (John WileySons 1997). Для любого полипептида IL-22RA, включая варианты и гибридные белки, специалист в данной области может легко создать полностью вырожденную полинуклеотидную последовательность, кодирующую данный вариант, применяя информацию, представленную в табл. 1 и 2 выше. Более того, специалист в данной области может применять стандартную компьютерную программу для создания вариантовIL-22RA на основе описанных здесь нуклеотидных и аминокислотных последовательностей. 5. Получение полипептидов IL-22RA. Полипептиды настоящего изобретения, включая полноразмерные полипептиды; растворимые мономерные, гомодимерные, гетеродимерные и мультимерные рецепторы; полноразмерные рецепторы; фрагменты рецепторов (например, лиганд-связывающие фрагменты и антигенные эпитопы), функциональные фрагменты и гибридные белки, могут быть получены в рекомбинантных клетках-хозяевах следуя общепринятым способам. Для экспрессии гена IL-22RA молекула нуклеиновой кислоты, кодирующая полипептид, должна быть оперативно связана с регуляторными последовательностями, которые контролируют транскрипционную экспрессию в экспрессионном векторе, и затем введена в клеткухозяина. Кроме транскрипционных регуляторных последовательностей, таких как промоторы и энхансе- 17009124 ры, экспрессионные векторы могут включать трансляционные регуляторные последовательности и маркерный ген, который подходит для отбора клеток, которые несут экспрессионный вектор. Экспрессионные векторы, которые подходят для получения чужеродных белков в эукариотических клетках, обычно содержат: (1) элементы прокариотной ДНК, кодирующие бактериальный сайт начала репликации и маркер устойчивости к антибиотику для обеспечения роста и отбора экспрессионного вектора в бактериальном хозяине; (2) элементы эукариотной ДНК, которые кодируют инициацию транскрипции, такие как промотор; и (3) элементы ДНК, которые контролируют процессинг транскриптов,такие как последовательность терминации транскрипции/полиаденилирования. Как обсуждалось выше,экспрессионные векторы могут также включать нуклеотидные последовательности, кодирующие секреторную последовательность, которая направляет гетерологичный полипептид по секреторному пути клетки-хозяина. Например, экспрессионный вектор IL-22RA может включать ген IL-22RA и секреторную последовательность гена любого секретируемого белка. Белки IL-22RA настоящего изобретения могут быть экспрессированы в клетках млекопитающих. Примеры подходящих клеток-хозяев млекопитающих включают клетки почек африканской зеленой мартышки (Vero; ATCC CRL 1587), клетки почек эмбриона человека (293-НЕК; ATCC CRL 1573), клетки почек детенышей хомячка (ВНК-21, ВНК-570; ATCC CRL 8544, ATCC CRL 10314), клетки почек собаки(MDCK; ATCC CCL 34), клетки яичников китайского хомячка (СНО-К 1; ATCC CCL61; СНО DG44(Chasin et al., Som. Cell. Molec. Genet. 12:555, 1986), клетки гипофиза крыс (GH1; ATCC CCL82), клеткиHeLa S3 (ATCC CCL2.2), клетки гепатомы крыс (H-4-II-E; ATCC CRL 1548), трансформированные SV40 клетки почек обезьян (COS-1; ATCC CRL 1650) и клетки эмбрионов мышей (NIH-3T3; ATCC CRL 1658). У хозяев-млекопитающих транскрипционный и трансляционный регуляторные сигналы могут происходить от вирусных источников млекопитающих, например, аденовируса, вируса папилломы быков,вируса обезьян или тому подобное, в которых регуляторные сигналы связаны с конкретным геном, который имеет высокий уровень экспрессии. Подходящие транскрипционные и трансляционные регуляторные последовательности можно также получать от генов млекопитающих, например, генов актина, коллагена, миозина и металлотионеина. Последовательности, регулирующие транскрипцию, включают промоторную область, достаточную для управления инициацией синтеза ДНК. Подходящие эукариотные промоторы включают промотор гена металлотионеина мыши (Hamer et al., J. Molec. Appl. Genet. 1:273 (1982, TK промотор вируса герпеса (McKnight, Cell 31:355 (1982, ранний промотор SV40 (Benoist et al., Nature 290:304 (1981, промотор вируса саркомы Рауса (Gorman et al., Proc. Nat'l Acad. Sci. USA 79:6777 (1982, цитомегаловирусный промотор (Foecking et al., Gene 45:101 (1980, и вирусный промотор опухоли молочной железы мыши(см. обычно Etcheverry, Expression of Engineered Proteins in Mammalian Cell Culture, in Protein Engineering: Principles and Practice, Cleland et al. (eds.), pages 163-181 (John WileySons, Inc. 1996. Альтернативно, для контроля экспрессии гена IL-22RA в клетках млекопитающих может быть использован прокариотный промотор, такой как промотор РНК-полимеразы бактериофага T3, если прокариотный промотор регулируется эукариотным промотором (Zhou et al., Mol. Cell. Biol. 10:4529 (1990), иKaufman et al., Nucl. Acids Res. 19:4485 (1991. В определенных осуществлениях последовательность ДНК, кодирующая растворимый рецепторный полипептид IL-22RA, или фрагмент полипептида IL-22RA оперативно связаны с другими генетическими элементами, требуемыми для их экспрессии, обычно включающими промотор и терминатор транскрипции в экспрессионном векторе. Вектор должен также обычно содержать один или более селектируемых маркеров и один или более сайтов старта репликации, хотя специалист в данной области должен знать, что в определенных системах селектируемые маркеры могут предлагаться в отдельных векторах и репликация экзогенной ДНК может обеспечиваться ее интеграцией в геном клетки-хозяина. Выбор промоторов, терминаторов, селектируемых маркеров, векторов и других элементов является рутинным делом для специалистов в данной области. Много таких элементов описано в литературе и доступно из коммерческих источников. Множественные компоненты комплекса растворимого рецептора могут быть котрансфицированы в индивидуальных экспрессионных векторах или могут содержаться в одном экспрессионном векторе. Такие способы экспрессии многокомпонентных комплексов белков хорошо известны в данной области. Экспрессионный вектор может быть введен в клетки-хозяева с применением различных стандартных способов, включая трансфекцию с помощью фосфата кальция, опосредуемую липосомами трансфекцию, доставку, опосредуемую микроснарядом, электропорацию и тому подобное. Трансфицированные клетки могут быть отобраны и размножены для обеспечения рекомбинантными клетками-хозяевами,которые включают экспрессионный вектор, стабильно интегрированный в геном клетки-хозяина. Способы введения векторов в клетки эукариот и способы отбора таких стабильных трансформантов с применением доминантного селектируемого маркера описаны, например, Ausubel (1995) и Murray (ed.), GeneTransfer and Expression Protocols (Humana Press 1991). Например, один подходящий селектируемый маркер представляет собой ген, который обеспечивает устойчивость к антибиотику неомицину. В данном случае селекция осуществляется в присутствии лекарства неомицинового типа, такого как G-418 или тому подобного. Системы селекции могут также ис- 18009124 пользоваться для увеличения уровня экспрессии интересующего гена, процесса, обозначаемого как амплификация. Амплификация осуществляется путем культивирования трансфектантов в присутствии низкого уровня селектирующего агента и последующего увеличения количества селектирующего агента для отбора клеток, которые продуцируют высокие уровни продуктов введенных генов. Подходящим селектируемым маркером амплификации является дигидрофолатредуктаза (DHFR), которая придает устойчивость к метотрексату. Могут применяться также другие гены устойчивости к лекарствам (например, устойчивости к гигромицину, множественной лекарственной устойчивости, пуромицинацетилтрансферазы). Альтернативно, маркеры, которые вводят измененный фенотип, такие как зеленый флуоресцентный белок или белки клеточной поверхности, такие как CD4, CD8, класс I MHC, щелочная фосфатаза плаценты, могут применяться для отделения трансфицированных клеток от нетрансфицированных клеток с помощью таких средств, как сортировка FACS или технология разделения с помощью магнитных шариков. Полипептиды IL-22RA могут быть также получены с помощью культивирования клеток млекопитающих с применением вирусных систем доставки. Примеры вирусов для данной цели включают аденовирус, ретровирусы, вирус герпеса, вирус коровьей оспы и вирусы, связанные с аденовирусами (AAV). Аденовирус, вирус с двуспиральной ДНК, является в настоящее время наиболее изученным вектором для переноса генов для доставки гетерологичной нуклеиновой кислоты (в качестве обзора см. Becker et al.,Meth. Cell Biol. 43:161 (1994), и Douglas and Curiel, ScienceMedicine 4:44 (1997. Преимущества аденовирусной системы включают аккомодацию относительно больших вставок ДНК, способность расти с высоким титром, способность инфицировать широкий диапазон клеточных типов млекопитающих и гибкость, которая позволяет применять ее с большим количеством доступных векторов, содержащих разные промоторы. С помощью делеции части генома аденовируса могут быть аккомодированы относительно большие вставки гетерологичной ДНК (до 7 т.п.о.). Данные вставки могут быть включены в вирусную ДНК с помощью прямого лигирования или путем гомологичной рекомбинации с котрансфицированной плазмидой. Есть возможность делеции существенного гена Е 1 из вирусного вектора, что ведет к отсутствию способности к репликации до тех пор, пока ген Е 1 не будет предоставлен клеткой-хозяином. Инфицированные аденовирусным вектором клетки 293 человека (АТСС No. CRL-1573, 45504, 45505), например,можно выращивать в виде прикрепленных клеток или в суспензионной культуре при относительно высокой плотности клеток с получением значительных количеств белка (смотри Garnier et al., Cytotechnol. 15:145 (1994.IL-22RA может быть также экспрессирован в других высших эукариотических клетках, таких как клетки птиц, грибов, насекомых, дрожжей или растений. Бакуловирусная система является эффективным средством для введения клонированных генов IL-22RA в клетки насекомых. Подходящие экспрессионные векторы основываются на вирусе Autographa californica множественного ядерного полиэдроза(AcMNPV) и содержат хорошо известные промоторы, такие как промотор белка теплового шока (hsp) 70 дрозофилы, промотор немедленного-раннего гена вируса Autographa californica ядерного полиэдроза (ie1) и отставленный ранний промотор 39K, бакуловирусный промотор р 10 и промотор металлотионеина дрозофилы. При втором способе получения рекомбинантного бакуловируса применяют систему на основе транспозона, описанную Luckow (Luckow, et al., J. Virol. 67:4566 (1993. Данную систему, в которой применяются векторы для переноса, продают в виде набора BAC-to-BAC (Life Technologies, Rockville,MD). В данной системе применяется вектор для переноса, PFASTBAC (Life Technologies), содержащий транспозон Tn7 для переноса ДНК, кодирующей полипептид IL-22RA, в бакуловирусный геном, поддерживаемый в Е. coli в виде большой плазмиды, называемой бакмидой. Смотри, Hill-Perkins andRapoport, J. Biol. Chem. 270:1543 (1995). Кроме того, векторы для переноса могут включать в рамке считывания соединение с ДНК, кодирующей эпитоп метки на С- или N-конце экспрессируемого полипептида IL-22RA, например, эпитоп метки Glu-Glu (Grussenmeyer et al., Proc.Nat'l Acad. Sci. 82:7952 (1985. Применяя способ, известный в данной области техники, вектор для переноса, содержащий ген IL-22RA,трансформируют в Е. coli и проводят скрининг бакмид на содержание прерванного гена lacZ, указывающего на рекомбинантный бакуловирус. ДНК бакмиды, содержащую геном рекомбинантного бакуловируса, затем выделяют с применением обычных способов. Иллюстративный вектор PFASTBAC может быть модифицирован в значительной степени. Например, полиэдриновый промотор может быть удален и заменен на промотор основного белка бакуловируса(также известный как Proc, р 6.9 или промотор МР), который экспрессируется при бакуловирусной инфекции раньше и, как показано, является выгодным для экспрессии секретируемых белков (см., например, Hill-Perkins and Possee, J. Gen. Virol. 71:971 (1990), Bonning, et al., J. Gen. Virol. 75:1551 (1994), иChazenbalk and Rapoport, J. Biol. Chem. 270:1543 (1995). В таких конструктах векторов для переноса может быть использован короткий или длинный вариант промотора основного белка. Более того, могут быть созданы векторы для переноса, которые заменяют природные секреторные сигнальные последовательности IL-22RA на секреторные сигнальные последовательности, происходящие от белков насекомых. Например, секреторная сигнальная последовательность от экдистероидглюкозилтрансферазы (EGT)San Diego, CA) может быть использована в конструктах для замены природной секреторной сигнальной последовательности IL-22RA. Для трансфекции клеток-хозяев применяют рекомбинантный вирус или бакмиду. Подходящие клетки-хозяева насекомых включают клеточные линии, происходящие от IPLB-Sf-21, клеточную линию яичников куколок Spodoptera frugiperda, такую как Sf9 (ATCC CRL 1711), Sf21AE, и Sf21 (Invitrogen Corporation; San Diego, CA), а также клетки Schneider-2 дрозофилы и клеточную линию HIGH FIVEO (Invitrogen), происходящую от Trichoplusia ni (патент США N 5300435). Для выращивания и поддержания клеток могут быть использованы имеющиеся в продаже бессывороточные среды. Подходящими средами являются Sf900 II (Life Technologies) или ESF921 (Expression Systems) для клеток Sf9; и Excell0405 (JRH Biosciences, Lenexa, KS) или Express FiveO (Life Technologies) для клеток Т. ni. Когда применяют рекомбинантный вирус, клетки обычно выращивают от плотности при инокуляции приблизительно 2-5 х 105 клеток до плотности 1-2 х 106 клеток, во время которой добавляют маточный раствор рекомбинантного вируса при множественности заражения (MOI) от 0,1 до 10, более обычно приблизительно 3. Принятые способы получения рекомбинантных белков в бакуловирусных системах предлагаютсяExpression Protocols (The Humana Press, Inc. 1995), и Lucknow, Insect Cell Expression Technology, in Protein Engineering: Principles and Practice, Cleland et al. (eds.), pages 183-218 (John WileySons, Inc. 1996). Клетки грибов, включая клетки дрожжей, также могут быть использованы для экспрессии описанных здесь генов. Конкретные интересующие в данном отношении штаммы дрожжей включают Saccharomyces cerevisiae, Pichia pastoris и Pichia methanolica. Подходящие промоторы для экспрессии в дрожжах включают промоторы от GAL1 (галактозы), PGK (фосфоглицераткиназы), ADH (алкогольдегидрогеназы), АОХ 1 (алкогольоксидазы), HIS4 (гистидинолдегидрогеназы) и тому подобное. Создано и легко доступно много клонирующих векторов дрожжей. Данные векторы включают векторы на основеYIp, такие как векторы YIp5, YRp векторы, такие как векторы YRp17, YEp, такие как векторил YEp13 иYCp, такой как YCp19. Способы трансформации клеток S. cerevisiae экзогенной ДНК и получения из них рекомбинантных пептидов раскрыты, например, в Kawasaki, патент США 4599311, Kawasaki et al.,патент США 4931373, Brake, патент США 4870008, Welch et al., патент США 5037743 и Murrayet al., патент США 4845075. Трансформированные клетки отбирают по фенотипу, определяемому по селектируемому маркеру, обычно устойчивости к лекарству или способности расти в отсутствие определенного компонента питательной среды (например, лейцина). Подходящей векторной системой для применения в Saccharomyces cerevisiae является векторная система РОТ 1, раскрытая Kawasaki et al. (патент США 4931373), которая дает возможность отбирать трансформированные клетки по росту в средах,содержащих глюкозу. Дополнительные подходящие промоторы и терминаторы для применения в дрожжах включают происходящие от генов гликолитических ферментов (смотри, например, Kawasaki, патент США 4599311, Kingsman et al., патент США 4615974 и Bitter, патент США 4977092) и гены алкогольдегидрогеназы. См. также патенты США 4990446, 5063154, 5139936 и 4661454. Системы трансформации для других дрожжей, включая Hansenula polymorpha, SchizosaccharomycesMicrobiol. 132:3459 (1986), и Cregg, патент США 4882279. Могут быть также использованы клеткиAspergillus в соответствии со способами McKnight et al., патент США 4935349. Способы трансформации Acremonium chrysogenum раскрыты Sumino et al., патент США 5162228. Способы трансформацииNeurospora раскрыты Lambowitz, патент США 4486533. Например, применение в качестве хозяина Pichia methanolica для продукции рекомбинантных белков раскрыто Raymond, патент США 5716808, Raymond, патент США 5736383, Raymond et al.,Yeast 14:11-23 (1998), и в международных публикацияхWO 97/17450, WO 97/17451, WO 98/02536 иWO 98/02565. Молекулы ДНК для применения при трансформации Р. methanolica обычно должны быть получены в виде двуспиральных, круговых плазмид, которые предпочтительно линеаризуют перед трансформацией. Для получения полипептидов в Р. methanolica промотор и терминатор в плазмиде могут быть таковыми от гена Р. methanolica, такого как ген утилизации спирта Р. methanolica (AUG1 илиAUG2). Другие пригодные промоторы включают таковые от генов дигидроксиацетонсинтазы (DHAS),формиатдегидрогеназы (FMD) и каталазы (CAT). Для облегчения интеграции ДНК в хромосому хозяина предпочтительно иметь полный экспрессионный сегмент плазмиды с примыкающими с обоих концов последовательностями ДНК хозяина. Подходящий селектируемый маркер для применения у Pichiamethanolica представляет собой ген ADE2 Р. methanolica, который кодирует фосфорибозил-5 аминоимидазолкарбоксилазу (AIRC; ЕС 4.1.1.21), и который позволяет клеткам-хозяевам ade2 расти в отсутствие аденина. Для широкомасштабных промышленных процессов, когда желательно свести к ми- 20009124 нимуму применение метанола, могут применяться клетки-хозяева с делецией обоих генов утилизации метанола (AUG1 и AUG2). Для продукции секретируемых белков клетки-хозяева могут быть дефицитными по генам протеаз вакуолей (РЕР 4 и PRB1). Электропорацию применяют для облегчения введения плазмиды, содержащей ДНК, кодирующей интересующий полипептид в клетках Р. methanolica. Клетки Р. methanolica могут быть трансформированы с помощью электропорации с применением экспоненциально угасающего, пульсирующего электрического поля, имеющего силу поля от 2,5 до 4,5 кВ/см, предпочтительно 3,75 кВ/см, и константу времени (t) от 1 до 40 мс, наиболее предпочтительно приблизительно 20 мс. Экспрессионные векторы могут быть также введены в протопласты растений, интактные ткани растений или выделенные клетки растений. Способы введения экспрессионных векторов в ткань растения включают прямое инфицирование или сокультивирование ткани растения с Agrobacterium tumefaciens,доставку, опосредуемую микроснарядом, инъекцию ДНК, электропорацию и тому подобное. См., например, Horsch et al., Science 227:1229 (1985), Klein et al., Biotechnology 10:268 (1992), и Miki et. al., Procedures for Introducing Foreign DNA into Plants, in Methods in Plant Molecular Biology and Biotechnology,Glick et al. (eds.), pages 67-88 (CRC Press, 1993). Альтернативно, гены IL-22RA могут быть экспрессированы в прокариотических клетках-хозяевах. Подходящие промоторы, которые могут использоваться для экспрессии полипептидов IL-22RA в прокариотических хозяевах хорошо известны специалистам в данной области и включают промоторы, способные узнавать полимеразы Т 4, Т 3, Sp6 и Т 7, промоторы PR и PL бактериофага лямбда, trp, recА, теплового шока, lacUV5, tac, Ipp-lacSpr, phoA, и lacZ промоторы Е. coli, промоторы В. subtilis, промоторы бактериофагов Bacillus, промоторы Streptomyces, int промотор бактериофага лямбда, bla промотор pBR322 иGlick, J. Ind. Microbiol. 1:277 (1987), Watson et al., Molecular Biology of the Gene, 4th Ed. (Benjamin Cummins 1987) и Ausubel et al. (1995). Подходящие прокариотные хозяева включают Е. coli и Bacillus subtilus. Подходящие штаммы Е. coli включают BL21(DE3), BL21(DE3)pLysS, BL21(DE3)pLysE, DH1, DH4I, DH5, DH5I, DH5IF', DH5IMCR,DH10B, DH10B/р 3, DH11S, C600, HB101, JM101, JM105, JM109, JM110, K38, RR1, Y1088, Y1089,CSH18, ER1451 и ER1647 (см., например. Brown (ed.). Molecular Biology Labfax (Academic Press 1991. Подходящие штаммы Bacillus subtilus включают BR151, YB886, MI119, MI120 и В 170 (см., напримерHardy, Bacillus Cloning Methods, in DNA Cloning: A Practical Approach, Glover (ed.) (IRL Press 1985. Когда экспрессируют полипептид IL-22RA в бактериях, таких как Е. coli, полипептид может оставаться в цитоплазме, обычно в виде нерастворимых гранул, или может быть направлен в периплазматическое пространство с помощью бактериальной последовательности для секреции. В первом случае клетки лизируют и гранулы получают и денатурируют с применением, например, гуанидинизотиоцианата или мочевины. Денатурированный полипептид может быть затем заново уложен и димеризован с помощью разведения денатурирующего раствора, такого как с помощью диализа против раствора мочевины и сочетания восстановленного и окисленного глутатиона с последующим диализом против забуференного солевого раствора. В последнем случае полипептид может быть получен из периплазматического пространства в растворимой и функционирующей форме с помощью разрушения клеток (например, с помощью сонификации или осмотического шока) для высвобождения компонентов периплазматического пространства и получения белка, тем самым избегая необходимости денатурации и повторной укладки. Способы экспрессии белков в прокариотических хозяевах хорошо известны специалистам в данной области (см., например, Williams et al., Expression of foreign proteins in E. coli using plasmid vectors andal. (eds.), page 15 (Oxford University Press 1995), Ward et al., Genetic Manipulation and Expression of Antibodies, in Monoclonal Antibodies: Principles and Applications, page 137 (Wiley-Liss, Inc. 1995), и Georgiou,Expression of Proteins in Bacteria, in Protein Engineering: Principles and Practice, Cleland et al. (eds.), page 101 (John WileySons, Inc. 1996. Стандартные способы введения экспрессионных векторов в клетки бактерий, дрожжей, насекомых и растений предлагаются, например, Ausubel (1995). Обычные способы экспрессии и получения чужеродных белков, продуцируемых клеточной системой млекопитающих предлагаются, например, Etcheverry, Expression of Engineered Proteins in Mammalian Cell Culture, in Protein Engineering: Principles and Practice, Cleland et al. (eds.), pages 163 (Wiley-Liss,Inc. 1996). Стандартные способы получения белка, продуцируемого бактериальной системой, предлагаются, например, Grisshammer et al., Purification of over-produced proteins from E. coli cells, in DNA Cloning 2: Expression Systems, 2nd Edition, Glover et al. (eds.), pages 59-92 (Oxford University Press 1995) . Установленные способы для выделения рекомбинантных белков из бакуловирусной системы описаныRichardson (ed.), Baculovirus Expression Protocols (The Humana Press, Inc. 1995). В качестве альтернативы, полипептиды настоящего изобретения могут быть синтезированы с помощью способов исключительно твердофазного синтеза, частичного твердофазного синтеза, конденсации фрагментов или классического синтеза в растворе. Данные способы синтеза хорошо известны специалистам в данной области (см., например, Merrifield, J. Am. Chem. Soc. 85:2149 (1963), Stewart et al.,- 21009124Lloyd-Williams et al., Chemical Approaches to the Synthesis of Peptides and Proteins (CRC Press, Inc. 1997. Варианты в стратегиях общего химического синтеза, такие как природное химическое лигирование и лигирование экспрессируемого белка также являются стандартными (смотри, например, Dawson et al.,Science 266:776 (1994), Hackeng et al., Proc. Nat'l Acad. Sci. USA 94:7845 (1997), Dawson, MethodsChem. 273:16205 (1998. Пептиды и полипептиды настоящего изобретения включают по меньшей мере шесть, по меньшей мере семь или по меньшей мере 15 смежных аминокислотных остатков SEQ ID NO:3. В качестве иллюстрации, полипептиды могут включать по меньшей мере шесть, по меньшей мере девять или по меньшей мере 15 смежных аминокислотных остатков SEQ ID NO:3. В определенных осуществлениях изобретения полипептиды включают 20, 30, 40, 50, 100 или более смежных остатков данных аминокислотных последовательностей. Молекулы нуклеиновой кислоты, кодирующие такие пептиды и полипептиды, пригодны для полимеразной цепной реакции в качестве праймеров и зондов. Более того, полипептиды IL-22RA и их фрагменты могут быть экспрессированы в виде мономеров,гомодимеров, гетеродимеров или мультимеров в клетках высших эукариот. Такие клетки могут быть использованы для получения мономерных, гомодимерных, гетеродимерных и мультимерных рецепторных полипептидов IL-22RA, которые включают по меньшей мере один полипептид IL-22RA (рецепторы, включающие IL-22RA или рецепторные полипептиды, включающие IL-22RA), или они могут быть применены в качестве тестирующих клеток в системах для скрининга. В одном аспекте настоящего изобретения полипептид настоящего изобретения, включающий внеклеточный домен IL-22RA, получают путем культивирования клетки и клетку используют для скрининга лигандов для рецептора, включая природный лиганд, IL-22, а также агонисты и антагонисты природного лиганда. Суммируя данный подход, кДНК или ген, кодирующий рецептор, соединяют с другими генетическими элементами, требуемыми для их экспрессии (например, промотором транскрипции), и полученный экспрессионный вектор вводят в клетку-хозяина. Клетки, которые экспрессируют ДНК и продуцируют функциональный рецептор, отбирают и применяют для множества систем скрининга. Каждый компонент мономерного, гомодимерного, гетеродимерного и мультимерного рецепторного комплекса может быть экспрессирован в одной и той же клетке. Более того, компоненты мономерного, гомодимерного, гетеродимерного и мультимерного рецепторного комплекса могут быть также гибридизованы с трансмембранным доменом или другой мембранной гибридной частью, чтобы позволить комплексу собраться и для возможности скрининга трансфектантов, как описано выше. Для тестирования антагонистов полипептидов IL-20 и IL-22 и антител настоящего изобретения клетки млекопитающих, подходящие для использования для экспрессии рецепторов, включающих IL22RA, или других рецепторов, известных как связывающие IL-20 или IL-22 (например, клетки экспрессирующие IL-22RA/CRF2-4; и IL-20RA, IL-20RB, IL-22RA/IL-20RB, или IL-20RA/IL-20RB) и передающие опосредованный рецепторами сигнал, включают клетки, которые экспрессируют другие рецепторные субъединицы, которые могут формировать функциональный комплекс с IL-22RA (или IL-20RA). Данные субъединицы могут включать таковые семейства рецепторов интерферона или других рецепторов цитокинов класса II или класса I, например, CRF2-4 (Genbank, No. регистрации Z17227), IL-10R(Genbank, No. регистрации U00672 и NM001558), IL-22RA (обычно принадлежащие патенту США 5965704), zcytor7 (IL-20RA) (обычно принадлежащие патенту США 594551L), IL-20RA/IL-20RB(WIPO,публикации WO 01/46232) и IL-9R. Предпочтительно также применять клетку от тех же видов, что и рецептор, предназначенный для экспрессии. В предпочтительном осуществлении клетка зависит от экзогенно добавляемого гематопоэтического ростового фактора для своей пролиферации. Предпочтительные клеточные линии данного типа представляют собой клеточную линию TF-1 человека (номер АТСС CRL-2003) и клеточную линиюAML-193 (номер АТСС CRL-9589), которые являются зависимыми от GM-CSF клеточными линиями лейкоза человека и BaF3 (Palacios and Steinmetz, Cell 41:727-734, (1985, которая является зависимой отIL-3 клеточной линией пре-В мыши. Другие клеточные линии включают клетки BHK, COS-1 и СНО. Подходящие клетки-хозяева могут быть сконструированы для получения необходимых рецепторных субъединиц или другого клеточного компонента, необходимого для желаемого клеточного ответа, Данный подход является выгодным, потому что клеточные линии для экспрессии рецепторных субъединиц могут быть сконструированы от любых видов, обходя тем самым потенциальные ограничения, происходящие из-за видовой специфичности. Ортологи видов кДНК рецептора человека могут быть клонированы и использованы в клеточных линиях от тех же видов, такие как кДНК мыши в клеточной линии BaF3. Клеточные линии, которые зависят от гематопоэтического фактора роста, такого как GM-CSF или IL-3,могут быть сконструированы таким образом, что становятся зависимыми от другого цитокина, который действует через рецептор IL-22RA, такого как IL-22.- 22009124 Клетки, экспрессирующие функциональный рецептор, применяют в тестах скрининга. Разнообразные подходящие тесты известны в данной области. Данные тесты основываются на определении биологического ответа в клетке-мишени. Одним таким тестом является тест на клеточную пролиферацию. Клетки культивируют в присутствии или в отсутствие тестируемого соединения и пролиферацию клеток определяют с помощью, например, измерения включения меченного тритием тимидина или с помощью колориметрического теста, основанного на метаболическом разрушении бромида 3-(4,5-диметилтиазол 2-ил)-2,5-дифенилтетразолия (МТТ) (Mosman, J Immunol. Meth. 65: 55-63, (1983. В альтернативном формате теста применяют клетки с дополнительной конструкцией для экспрессии репортерного гена. Репортерный ген присоединяют к промоторному элементу, который отвечает за путь, опосредованный рецептором, и в тесте определяют активацию транскрипции репортерного гена. Предпочтительным промоторным элементом в данном отношении является чувствительный элемент сыворотки или SRE. См.,например, Shaw et al., Cell 56:563-572, (1989). Таким предпочтительным репортерным геном является ген люциферазы (de Wet et al., Mol. Cell. Biol. 7:725, (1987. Экспрессию гена люциферазы определяют по люминесценции с применением способов, известных в данной области (например, Baumgartner et al., J.Biol. Chem. 269:29094-29101, (1994); Schenborn and Goiffin, PromegaNotes 41:11, 1993). Наборы для определения активности люциферазы имеются в продаже у, например, Promega Corp., Madison, WI. Линии клеток-мишеней данного типа могут быть применены для скрининга библиотек химических соединений,кондиционных для клеток культуральных сред, грибковых бульонов, образцов почвы, образцов воды и тому подобное. Например, образцы банка кондиционных для клеток культуральных сред могут быть протестированы на клетках-мишенях для идентификации клеток, которые продуцируют лиганд. Позитивные клетки затем применяют для получения библиотеки кДНК в экспрессионном векторе млекопитающих, которую разделяют на пулы, трансфицируют в клетки-хозяева и экспрессируют. Образцы сред от трансфицированных клеток затем тестируют с последующим разделением на пулы, повторной трансфекцией, субкультивированием и повторным тестированием позитивных клеток для выделения клонированной кДНК, кодирующей лиганд. Несколько клеточных линий, отвечающих на IL-20, известно в данной области или может быть создано, например, клеточная линия Baf3/DIRS1/cytoR11 (WIPO,публикации WO 02/072607). Более того,известно несколько клеточных линий, отвечающих на IL-22 (Dumoutier et al., J. Immunol. 164:1814-1819,2000; Dumoutier, L. et al., Proc. Nat'l. Acad. Sci. 97:10144-10149, 2000; Xie M.H. et al., J. Biol. Chem. 275: 31335-31339, 2000; Kotenko SV et al., J. Biol. Chem. 276:2725-2732, 2001), а также такие, которые экспрессируют IL-22 рецепторную субъединицу IL-22RA. Например, следующие клетки отвечают на IL-22: ТК 10 (Xie М.Н. et al., выше) (карцинома почки человека); SW480 (АТССCCL-228) (аденокарцинома ободочной кишки человека); HepG2 (АТССНВ-8065) (гепатома человека); РС 12 (АТСС No. CRL-1721)(клеточная модель нейронов мыши; феохромоцитома крысы); и MES13 (АТССCRL-1927) (линия мезангиальных клеток почек мыши). Кроме того, несколько клеточных линий, экспрессирующих IL-22RA(рецептор IL-22), также являются кандидатами на клеточные линии, отвечающие на IL-22: A549 (АТССCCL-185) (карцинома легких человека); G-361 (АТСС No. CRL-1424) (меланома человека); и Caki-1(АТССHTB-46) (карцинома почки человека). Кроме того, клеточные линии, отвечающие на IL-22,могут быть созданы, например, описанная здесь клеточная линия Baf3/cytoR11/CRF2-4 (WIPO, No. публикации WO 02/12345). Данные клетки могут быть использованы в тестах для оценки функционированияIL-22RA в качестве антагониста IL-20 или IL-22 или противовоспалительного фактора. Дополнительный подход к скринингу, обеспечиваемый настоящим изобретением, включает применение гибридных рецепторных полипептидов. Данные гибридные полипептиды входят в два общих класса. В первом классе внутриклеточный домен IL-22RA соединен со связывающим лиганд доменом второго рецептора. Второй класс гибридных рецепторных полипептидов включает внеклеточный (связывающий лиганд) домен IL-22RA (SEQ ID NO:3) с внутриклеточным доменом второго рецептора, предпочтительно рецептора гематопоэтических цитокинов, и трансмембранный домен. Гибридные IL-22RA мономеры, гомодимеры, гетеродимеры и мультимеры рецепторов настоящего изобретения данного второго класса экспрессируются в клетках, известных как способные отвечать на сигналы, передаваемые вторым рецептором. Совместно эти два класса гибридных рецепторов дают возможность идентифицировать отвечающий клеточный тип для разработки теста для определения IL-22 или IL-20. Более того, такие клетки могут быть использованы в присутствии IL-22 или IL-20 для тестирования растворимых рецепторных антагонистов настоящего изобретения в конкурентном типе анализа. В таком анализе снижение пролиферации или активности в отношении передачи сигнала IL-22 или IL-20 в присутствии растворимого рецептора настоящего изобретения является демонстрацией антагонистической активности. Более того, анализы связывания растворимого рецептора IL-22RA, тесты на основе клеток могут быть также применены для оценки того, будет ли растворимый рецептор связывать, блокировать, ингибировать,снижать, проявлять антагонистическое действие или нейтрализовать активность IL-22 или IL-20. 6. Получение гибридных белков и конъюгатов IL-22RA. Одним общим классом аналогов IL-22RA являются варианты, имеющие аминокислотную последовательность, которая является мутантным вариантом раскрытой здесь аминокислотной последовательности. Другой общий класс аналогов IL-22RA предлагается в виде антиидиотипических антител и их фраг- 23009124 ментов, как описано ниже. Более того, в качестве аналогов могут быть применены рекомбинантные антитела, включающие антиидиотипические вариабельные домены (см., например, Monfardini et al., Proc.Assoc. Am. Physicians 108:420 (1996. Так как вариабельные домены антиидиотипических антител против IL-22RA имитируют IL-22RA, данные домены могут обеспечить связывающую активность в отношении IL-22RA. Способы получения антиидиотипических каталитических антител известны специалистам в данной области (см., например, Joron et al., Ann. N Y Acad. Sci. 672:216 (1992), Friboulet et al.,Appl. Biochem. Biotechnol. 47:229 (1994), и Avalle et al., Ann. N Y Acad. Sci. 864:118 (1998. Другой подход к идентификации аналогов IL-22RA обеспечивается применением комбинаторных библиотек. Способы конструкции и скрининга фагового дисплея и других комбинаторных библиотек предлагаются, например, Kay et al., Phage Display of Peptides and Proteins (Academic Press 1996), Verdine,патент США 5783384, Kay et al., патент США 5747334, и Kauffman et al., патент США 5723323. Полипептиды IL-22RA имеют применение как in vivo, так и in vitro. В качестве иллюстрации, растворимая форма IL-22RA может быть добавлена к клеточной культуральной среде для ингибирования эффектов лиганда IL-22RA, продуцируемого культивируемыми клетками. Гибридные белки IL-22RA можно применять для экспрессии IL-22RA в рекомбинантном хозяине и для выделения продуцируемого IL-22RA. Как описано ниже, конкретные гибридные белки IL-22RA также находят применение в диагностике и терапии. Один тип гибридного белка включает пептид, который управляет полипептидом IL-22RA из рекомбинантной клетки-хозяина. Для направления полипептида IL22RA по секреторному пути эукариотной клетки-хозяина в экспрессионном векторе IL-22RA предлагается секреторная сигнальная последовательность (также известная как сигнальный пептид, лидирующая последовательность, препро-последовательность или пре-последовательность). Тогда как секреторная сигнальная последовательность может происходить от IL-22RA, подходящая сигнальная последовательность может также происходить от другого секретируемого белка или синтезироваться de novo. Секреторную сигнальную последовательность оперативно связывают с последовательностью, кодирующей IL22RA, так что две последовательности объединяются в правильной рамке считывания и располагаются для направления вновь синтезированного полипептида по секреторному пути клетки-хозяина. Секреторные сигнальные последовательности обычно располагаются на 5'-конце нуклеотидной последовательности, кодирующей интересующий полипептид, хотя секреторные сигнальные последовательности могут располагаться где угодно в интересующей нуклеотидной последовательности (см., например, Welch etal., патент США 5037743; Holland et al., патент США 5143830). Хотя секреторная сигнальная последовательность I1-22RA или другого белка, продуцируемого клетками млекопитающих (например, сигнальная последовательность активатора плазминогена тканевого типа, как описано, например, в патенте США 5641655), пригодна для экспрессии IL-22RA в рекомбинантных хозяевах-млекопитающих, сигнальная последовательность дрожжей является предпочтительной для экспрессии в клетках дрожжей. Примерами подходящих сигнальных последовательностей дрожжей являются те, которые происходят от -фактора феромона спаривания дрожжей (кодируемого геномMF1), инвертазы (кодируемой геном SUC2) или кислой фосфатазы (кодируемой геном PHO5). См., например, Romanos et al., Expression of Cloned Genes in Yeast, in DNA Cloning 2: A Practical Approach, 2ndEdition, Glover and Hames (eds.), pages 123-167 (Oxford University Press 1995). Растворимые рецепторные полипептиды IL-22RA могут быть получены с помощью экспрессии укороченной ДНК, кодирующей внеклеточный домен, например, полипептида, который содержит SEQID NO:3, или соответствующую область рецептора не от человека. Предпочтительно, чтобы внеклеточные домены полипептидов получали в форме, по существу, свободной от трансмембранного и внутриклеточного полипептидных сегментов. Для направления рецепторного домена на экспорт из клеткихозяина рецепторную ДНК соединяют со втором сегментом ДНК, кодирующим секреторный пептид,такой как t-PA секреторный пептид. Для облегчения очистки секретируемого рецепторного домена Сконцевое расширение, такое как полигистидиновая метка, вещество Р, пептид Flag (Hopp et al., Biotechnology 6:1204-1210, (1988); поставляемый Eastman Kodak Co., New Haven, CT) или другой полипептид или белок, для которых доступны антитело или другой специфический связывающий агент, может быть соединено с рецепторным полипептидом. Более того, антигенные эпитопы IL-22RA из внеклеточных связывающих цитокины доменов также получают как описано выше. В другом альтернативном подходе внеклеточный рецепторный домен IL-22RA или другого рецепторного компонента класса I или II цитокинов может быть экспрессирован как гибрид с константными областями тяжелых цепей иммуноглобулина, обычно с Fc фрагментом, который содержит два домена константной области и шарнирную область, но не имеет вариабельной области (см. Sledziewski, AZ et al.,патенты США N 6018026 и 5750375). Растворимые полипептиды IL-22RA настоящего изобретения включают такие гибриды. Один такой гибрид показан в SEQ ID NO:4. Такие гибриды обычно секретируются в виде мультимерных молекул, где части Fc связаны друг с другом через дисульфидный мостик и два рецепторных полипептида расположены в тесном соседстве друг с другом. Гибриды данного типа могут быть использованы для аффинной очистки родственного лиганда из раствора, в качестве средства тестирования in vitro, для блокирования, ингибирования или снижения сигналов in vitro с помощью спе- 24009124 цифического титрования лиганда и в качестве антагонистов in vivo путем введения их парентерально для связывания циркулирующего лиганда и удаления его из циркуляции. Для очистки лиганда химерный IL22RA-Ig добавляют к образцу, содержащему лиганд (например, к кондиционным для клеток культуральным средам или тканевым экстрактам), в условиях, которые облегчают рецептор-лигандное взаимодействие (обычно при приблизительно физиологических температуре, рН и ионной силе). Комплекс химералиганд затем разделяют с помощью смеси с применением протеина А, который иммобилизован на твердом носителе (например, нерастворимых шариках смолы). Лиганд затем элюируют с применением общепринятых химических способов, таких как градиент соли или рН. В альтернативном случае химера сама может быть связана с твердым носителем со связыванием и элюированием, выполняемыми как указано выше. Химеры могут быть использованы in vivo для регуляции воспалительных ответов, включая ответы острой фазы, такие как амилоид А сыворотки (SAA), С-реактивный протеин (CRP) и тому подобное. Химеры с высоким связывающим сродством вводят парентерально (например, с помощью внутримышечной, подкожной или внутривенной инъекции). Циркулирующие молекулы связывают лиганд и исчезают из циркуляции с помощью нормальных физиологических процессов. Для применения в тестах химеры связывают с носителем через Fc область и применяют в формате ИФА. Для содействия в выделении антитела против IL-22RA и связывающих партнеров настоящего изобретения может быть выгодно применена тестирующая система, которая использует связывающий лиганд рецептор (или антитело, один член пары комплемент/антикомплемент) или его связывающий фрагмент и имеющийся в продаже биосенсорный прибор (BIAcore, Pharmacia Biosensor, Piscataway, NJ). Такие рецептор, антитело, член пары комплемент/антикомплемент или фрагмент иммобилизуют на поверхности рецепторного чипа. Применение данного приспособления раскрыто Karlsson, J. Immunol.Methods 145:229-40, 1991 и Cunningham and Wells, J. Mol. Biol. 234:554-63, 1993. Рецептор, антитело,член или фрагмент ковалентно присоединяют, применяя аминные или сульфгидрильные химические группы, к декстрановым волокнам, которые присоединены к золотой пленке в проточной кювете. Тестируемый образец пропускают через кювету. Если лиганд, эпитоп или противоположный член пары комплемент/антикомплемент присутствует в образце, он должен связаться с иммобилизованным рецептором, антителом или членом, соответственно, вызывая изменение в показателе преломления среды, который определяют как изменение поверхностного плазменного резонанса золотой пленки. Данная система позволяет определить верхние и нижние границы, на основании которых может быть рассчитано связывающее сродство, и оценить стехиометрию связывания. Альтернативно, лиганд/рецепторное связывание может быть проанализировано с применением способа SELDI(ТМ) (Ciphergen, Inc., Palo Alto, CA). Более того, способ BIACORE, описанный выше, может быть применен в экспериментах по конкуренции для определения, связываются ли различные моноклональные антитела с одними и теми же или различными эпитопами на полипептиде IL-22RA, и могут ли в таком случае применяться с целью картирования эпитопов нейтрализующих антител настоящего изобретения, которые связывают, блокируют, снижают, проявляют антагонистическое действие или нейтрализуют IL-22 или как IL-20, так и IL-22. Связывающие лиганд рецепторные полипептиды могут также применяться в других системах тестирования, известных в данной области. Такие системы включают скетчардовский анализ для определения связывающего сродства (см., Scatchard, Ann. NY Acad. Sci. 51: 660-72, 1949) и калориметрические тесты (Cunningham et al., Science 253:545-48, 1991; Cunningham et al., Science 245:821-25, 1991). В настоящем изобретении дополнительно предлагается множество других гибридных полипептидов и относящихся к ним мультимерных белков, включающих один или более гибридных полипептидов. Например, растворимый рецептор IL-22RA может быть получен в виде гибрида с димеризующимся белком, как раскрыто в патентах США 5155027 и 5567584. Предпочтительные димеризующиеся белки в данном отношении включают домены константных областей иммуноглобулинов, например, IgG1, и легкая цепьчеловека. Гибриды иммуноглобулин-растворимый IL-22RA могут быть экспрессированы в клетках с генетическими конструктами для получения множества мультимерных аналогов рецептора IL22RA. С растворимым рецептором IL-22RA могут быть соединены вспомогательные домены для направления его к конкретным клеткам, тканям или макромолекулам (например, коллагену или клеткам, экспрессирующим лиганды IL-22RA, IL-22 или IL-20). Полипептид IL-22RA может быть гибридизован с двумя или более частями, такими как аффинная метка для очистки и направляющий домен. Гибридные полипептиды могут также включать один или более сайтов расщепления, особенно между доменами. См., Tuan et al., Connective Tissue Research 34:1-9,1996. В бактериальных клетках часто желательно экспрессировать гетерологичный белок в виде гибридного белка для снижения токсичности, увеличения стабильности и повышения открываемости экспрессируемого белка. Например, IL-22RA может быть экспрессирован в виде гибридного белка, включающего полипептид глутатион-S-трансферазу. Гибридные белки с глутатион-S-трансферазой обычно растворимы и легко очищаются из лизатов Е. coli на колонках иммобилизованного глутатиона. В сходных подходах гибридный белок IL-22RA, включающий полипептид белка, связывающего мальтозу, может быть выделен на колонках смолы с иммобилизованной амилозой, в то время как гибридный белок, включающий С-конец укороченного гена протеина А, может быть очищен с применением IgG-Сефарозы. Уста- 25009124 новленные способы экспрессии гетерологичного полипептида в виде гибридного белка в бактериальной клетке описываются, например, Williams et al., Expression of Foreign Proteins in E. coli Using Plasmid Vectors and Purification of Specific Polyclonal Antibodies, in DNA Cloning 2: A Practical Approach, 2nd Edition,Glover and Hames (Eds.), pages 15-58 (Oxford University Press 1995). Кроме того, доступны имеющиеся в продаже экспрессионные системы. Например, в системе очистки белка PINPOINT Xa (Promega Corporation; Madison, WI) предлагается способ выделения гибридного белка, включающего полипептид, который становится биотинилированным при экспрессии, с помощью смолы, которая включает авидин. Пептидные метки, которые являются пригодными для выделения гетерологичных полипептидов,экспрессируемых либо прокариотными, либо эукариотическими клетками, включают полигистидиновые метки (которые обладают сродством к хелатирующей никель смоле), метки с-myc, кальмодулинсвязывающий белок (выделяемый с помощью аффинной хроматографии с иммобилизованным кальмодулином), вещество Р, метка RYIRS (которая связывается с антителами против RYIRS), метка Glu-Glu и метка FLAG (которая связывается с антителами против FLAG). См., например, Luo et al., Arch. Biochem.(1997). Молекулы нуклеиновой кислоты, кодирующие такие пептидные метки, имеются в продаже, например, у Sigma-Aldrich Corporation (St. Louis, МО). Другая форма гибридного белка включает полипептид IL-22RA и константную область тяжелой цепи иммуноглобулина, обычно Fc фрагмент, который содержит два или три домена константной области и шарнирную область, но лишен вариабельной области. В качестве иллюстрации Chang et al., патент США 5723125, описывают гибридный белок, включающий интерферон человека и Fc фрагмент иммуноглобулина человека. С-конец интерферона соединен с N-концом Fc фрагмента с помощью пептидной линкерной части. Примером пептидного линкера является пептид, включающий в первую очередь инертную в отношении Т-клеток последовательность, которая иммунологически инертна. Иллюстративный пептидный линкер имеет аминокислотную последовательность: GGSGG SGGGG SGGGG S (SEQ IDNO:9). В данном гибридном белке иллюстративной частью Fc является 4 цепь человека, которая является стабильной в растворе и не обладает или обладает низкой активностью в отношении активации комплемента. Соответственно, настоящее изобретение охватывает гибридный белок IL-22RA, который включает часть IL-22RA и Fc фрагмент человека, где С-конец части IL-22RA присоединен к N-концу Fc фрагмента через пептидный линкер, такой как пептид, включающий аминокислотную последовательность SEQ ID NO:4. Частью IL-22RA может быть молекула IL-22RA или ее фрагмент. Например, гибридный белок может включать аминокислоту SEQ ID NO:3 и Fc фрагмент (например, Fc фрагмент человека) (SEQ ID NO: 4). В другом варианте гибридный белок IL-22RA включает последовательность IgG, часть IL-22RA,ковалентно связанную с аминоконцом последовательности IgG, и сигнальный пептид, который ковалентно присоединен к аминоконцу части IL-22RA, где последовательность IgG состоит из следующих элементов в следующем порядке: шарнирная область, домен СН 2 и домен СН 3. Соответственно, последовательность IgG лишена домена CH1. Часть IL-22RA проявляет активность IL-22RA, как здесь описано,такую как способность связываться с лигандом IL-22RA. Данный общий подход для получения гибридных белков, которые включают части как антитела, так и не антитела, описан LaRochelle et al., европейский патент ЕР 742830 (WO 95/21258). Гибридные белки, включающие часть IL-22RA и часть Fc, могут быть использованы, например, как средство тестирования in vitro. Например, присутствие лиганда IL-22RA в биологическом образце может быть определено с применением гибридного белка IL-22RA-иммуноглобулин, в котором часть IL-22RA применяют для связывания лиганда, а макромолекулу, такую как протеин А или антитело против Fc,применяют для связывания гибридного белка с твердым носителем. Такие системы могут применяться для идентификации агонистов и антагонистов, которые мешают связыванию лигандов IL-22RA, например, IL-22 или как IL-20, так и IL-22, со своим рецептором. Другие примеры белков гибридов с антителами включают полипептиды, которые включают антиген-связывающий домен и фрагмент IL-22RA, который содержит внеклеточный домен IL-22RA. Такие молекулы могут применяться для направленной доставки к конкретным тканям для улучшения связывающей активности IL-22RA. В настоящем изобретении дополнительно предлагается множество других гибридных полипептидов. Например, часть или все домен(ы), представляющий(ие) биологическую функцию, могут быть обменены с IL-22RA настоящего изобретения функционально эквивалентным(ыми) доменом(ами) от другого члена семейства рецепторов цитокинов. Гибридные полипептиды могут быть экспрессированы в рекомбинантных клетках-хозяевах для продукции множества гибридных аналогов IL-22RA. ПолипептидIL-22RA может быть соединен с двумя или более частями или доменами, такими как аффинная метка,для очистки и направленной доставки домена. Гибридные полипептиды могут также включать одно или более сайтов расщепления, особенно между доменами. См., например, Tuan et al., Connective Tissue Research 34:1 (1996). Гибридные белки могут быть получены с помощью способов, известных специалистам в данной области, путем получения каждого компонента гибридного белка и их химической конъюгации. Альтер- 26009124 нативно, полинуклеотид, кодирующий гибридный белок в подходящей рамке считывания, может быть создан с применением известных способов и экспрессирован с помощью описанных здесь способов. Обычные способы для ферментативного и химического расщепления гибридных белков описаны, например, Ausubel (1995) стр. с 16-19 по 16-25. Домены, связывающие IL-22RA, могут быть дополнительно охарактеризованы с помощью физического анализа структуры, что определяется такими методами, как ядерный магнитный резонанс, кристаллография, дифракция электронов или фотоаффинное промечивание, в сочетании с мутацией аминокислот предполагаемого сайта контакта агонистов лиганда IL-22RA. См., например, de Vos et al., Science 255:306 (1992), Smith et al., J. Mol. Biol. 224:899 (1992), и Wlodaver et al., FEBS Lett. 309:59 (1992). Настоящее изобретение охватывает также химически модифицированные композиции IL-22RA, в которых полипептид IL-22RA соединен с полимером. Примерами полипептидов IL-22RA являются растворимые полипептиды, которые лишены функционального трансмембранного домена, так что полипептид состоит из аминокислотных остатков SEQ ID NO:3. Обычно полимер является водорастворимым, так что конъюгат IL-22RA не осаждается в водной среде, такой как физиологическая среда. Примером подходящего полимера является такой, который модифицирован так, чтобы иметь одну реакционноспособную группу, такую как активный сложный эфир для ацилирования или альдегид для алкилирования. Таким способом может контролироваться степень полимеризации. Примером реакционноспособного альдегида является пропионовый альдегид полиэтиленгликоля или его моно-(С 1-С 10)-алкокси или арилоксипроизводные (см., например, Harris, et al., патент США 5252714). Полимер может быть разветвленным или не разветвленным. Более того, для получения конъюгатов IL-22RA может быть применена смесь полимеров. Конъюгаты IL-22RA, применяемые в терапии, могут включать фармацевтически приемлемые водорастворимые полимерные части. Подходящие водорастворимые полимеры включают полиэтиленгликоль(ПЭГ), монометокси-ПЭГ, моно-(С 1-С 10)-алкокси-ПЭГ, арилокси-ПЭГ, поли-(N-винилпирролидон)ПЭГ, трезилмонометокси-ПЭГ, пропиональдегид-ПЭГ, бис-сукцинимидилкарбонат-ПЭГ, гомополимеры пропиленгликоля, полипропиленоксид/этиленоксид сополимер, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт, декстран, целлюлозу или другие полимеры на основе углеводородов. Подходящий ПЭГ может иметь молекулярную массу от приблизительно 600 до приблизительно 60000, включая, например, 5000, 12000, 20000 и 25000. Конъюгат IL-22RA может также включать смесь таких водорастворимых полимеров. Один пример конъюгата IL-22RA включает часть IL-22RA и полиалкилоксидную часть, присоединенную к N-концу части IL-22RA. ПЭГ является одним из подходящих полиалкилоксидов. В качестве иллюстрации, IL-22RA может быть модифицирован ПЭГ, процесс, известный как ПЭГилирование. ПЭГилирование IL-22RA может быть осуществлено с помощью любой из реакций ПЭГилирования, известных в данной области техники (см., например, европейский патент ЕР 0154316, Delgado et al., Critical(1994), и Francis et al., Int J Hematol 68:1 (1998. Например, ПЭГилирование может быть осуществлено с помощью реакции ацилирования или с помощью реакции алкилирования с реакционноспособной молекулой полиэтиленгликоля. При альтернативном подходе конъюгаты IL-22RA образуются путем конденсации активированного ПЭГ, в котором концевая гидрокси- или аминогруппа ПЭГ замещена активированным линкером (см., например, Karasiewicz et al., патент США 5382657). ПЭГилирование с помощью ацилирования обычно требует взаимодействия активного эфирного производного ПЭГ с полипептидом IL-22RA. Примером активированного эфира ПЭГ является ПЭГ, эстерифицированный до N-гидроксисукцинимида. Применяемый здесь термин ацилирование включает следующие типы связей между IL-22RA и растворимым в воде полимером: амидные, карбаматные, уретановые и тому подобное. Способы получения ПЭГилированного IL-22RA с помощью ацилирования должны обычно включать стадии (а) взаимодействия полипептида IL-22RA с ПЭГ (таким как реакционноспособный сложный эфир альдегидного производного ПЭГ) в условиях, при которых одна или более групп ПЭГ присоединяется к IL-22RA, и (b) получения продукта(ов) реакции. Обычно оптимальные условия реакции для реакций ацилирования должны определяться на основе известных параметров и желаемых результатов. Например, чем выше отношение ПЭГ:IL-22RA, тем больше процент полиПЭГилированного продукта IL-22RA. Продуктом ПЭГилирования с помощью ацилирования обычно является полиПЭГилированный продукт IL-22RA, где -аминогруппы лизина ПЭГилированы через ацильную линкерную группу. Примером соединяющего линкера является амид. Обычно полученный в результате IL-22RA должен быть, по меньшей мере, на 95% моно-, ди- или трипэгилирован, хотя в зависимости от условий реакции могут образовываться некоторые виды с более высокими степенями ПЭГилирования. ПЭГилированные виды могут быть отделены от неконъюгированных полипептидов IL-22RA при применении стандартных способов очистки, таких как диализ, ультрафильтрация, ионообменная хроматография, аффинная хроматография и тому подобное.- 27009124 ПЭГилирование с помощью алкилирования обычно включает взаимодействие концевого альдегидного производного ПЭГ с IL-22RA в присутствии восстанавливающего агента. Группы ПЭГ могут быть присоединены к полипептиду через -CH2-NH-группу. Более того, антитела против IL-22RA или фрагменты антител настоящего изобретения могут быть ПЭГилированы с применением известных в данной области и описанных здесь способов. Создание производных через восстановительное алкилирование для получения моноПЭГилированного продукта имеет преимущества в отношении различной реактивности различных типов первичных аминогрупп, доступных для дериватизации. Обычно реакцию проводят при рН, который позволяет иметь преимущество в различиях pKa между -аминогруппами остатков лизина и -аминогруппой N-концевого остатка белка. С помощью такой избирательной дериватизации контролируется присоединение растворимого в воде полимера, который содержит реакционноспособную группу, такую как альдегид, к белку. Конъюгация с полимером осуществляется преимущественно на N-конце белка без существенной модификации других реакционноспособным групп, таких как аминогруппы боковой цепи лизина. В настоящем изобретении предлагается по существу гомогенный препарат монополимерных конъюгатов IL22RA. Восстановительное алкилирование для получения по существу гомогенной популяции молекул монополимерных конъюгатов IL-22RA может включать стадии: (а) взаимодействия полипептида IL-22RA с реакционноспособньм ПЭГ в условиях восстановительного алкилирования при рН, который дает возможность избирательной модификации -аминогруппы на аминоконце IL-22RA, и (b) получения продукта(ов) реакции. Восстанавливающий агент, применяемый для восстановительного алкилирования,должен быть стабильным в водном растворе и способным восстанавливать только основание Шиффа,образуемое в начале процесса восстановительного алкилирования. Примеры восстанавливающих агентов включают боргидрид натрия, цианоборгидрид натрия, диметиламинборан, триметиламинборан и пиридинборан. Для по существу гомогенной популяции монополимерных конъюгатов IL-22RA условия реакции восстановительного алкилирования являются таковыми, что дают возможность избирательного присоединения водорастворимой полимерной части к N-концу IL-22RA. Такие условия реакции обычно предусматривают различия в pKa между аминогруппами лизина и -аминогруппой на N-конце. рН также влияет на планируемое соотношение полимера к белку. В целом, если рН является более низким, больший избыток полимера по отношению к белку должен быть желательным из-за менее реакционноспособной N-концевой -группы, больше полимера необходимо для достижения оптимальных условий. Если рН является более высоким, соотношение полимер:IL-22RA может не быть таким высоким, потому что доступны более реакционноспособные группы. Обычно рН должен находиться в диапазоне от 3 до 9 или от 3 до 6. Данный способ может быть применен для создания включающих IL-22RA гомодимерных,гетеродимерных или мультимерных конъюгатов растворимого рецептора. Другим рассматриваемым фактором является молекулярная масса водорастворимого полимера. Обычно чем выше молекулярная масса полимера, тем меньше количество молекул полимера, которое может быть присоединено к белку. Для реакций ПЭГилирования обычная молекулярная масса составляет от приблизительно 2 кДа до приблизительно 100 кДа, от приблизительно 5 кДа до приблизительно 50 кДа или от приблизительно 12 кДа до приблизительно 25 кДа. Молярное отношение водорастворимого полимера к IL-22RA обычно должно находиться в диапазоне от 1:1 до 100:1. Обычно молярное отношение водорастворимого полимера к IL-22RA должно составлять от 1:1 до 20:1 для ПЭГилирования и от 1:1 до 5:1 для моноПЭГилирования. Общие способы получения конъюгатов, включающих части полипептида и водорастворимого полимера, известны в данной области. См., например, Karasiewicz et al., патент США 5382657, GreenwaldBiochem. 247:434 (1997. Данный способ может применяться для создания включающих IL-22RA гомодимерных, гетеродимерных или мультимерных конъюгатов растворимого рецептора. Настоящее изобретение охватывает композиции, включающие пептид или полипептид, такие как описанные здесь растворимый рецептор или антитело. Такие композиции могут дополнительно включать носитель. Носитель может быть традиционным органическим или неорганическим носителем. Примеры носителей включают воду, буферный раствор, спирт, пропиленгликоль, макроголь, кунжутное масло,кукурузное масло и тому подобное. 7. Выделение полипептидов IL-22RA. Полипептиды настоящего изобретения могут быть очищены, по меньшей мере, приблизительно до 80% чистоты, по меньшей мере, приблизительно до 90% чистоты, по меньшей мере, приблизительно до 95% чистоты или выше чем 95%, такой как 96, 97, 98% или выше чем 99% чистоты по отношению к загрязняющим макромолекулам, особенно другим белкам и нуклеиновым кислотам, и свободны от инфекционных и пирогенных агентов. Полипептиды настоящего изобретения могут также быть очищены до фармацевтически чистого состояния, которое составляет больше, чем 99,9% чистоты. В определенных- 28009124 препаратах очищенный полипептид является, по существу, свободным от других полипептидов, особенно от других полипептидов животного происхождения. Фракционирование и/или другие общепринятые способы очистки могут быть использованы для получения препаратов очищенного IL-22RA из природных источников (например, тканевых источников человека), синтетических полипептидов IL-22RA и рекомбинантных полипептидов IL-22RA, а также гибридных полипептидов IL-22RA, очищенных из рекомбинантных клеток-хозяев. В целом для фракционирования образцов может быть использовано осаждение сульфатом аммония и кислая или хаотропная экстракция. Примеры стадий очистки могут включать гидроксиапатит, исключение по размеру, FPLC и высокоэффективную жидкостную хроматографию с обращенной фазой. Подходящие хроматографические среды включают дериватизированные декстраны, агарозу, целлюлозу, полиакриламид, специальные кремнеземы и тому подобное. Подходят производные PEI, DEAE, QAE и Q. Примеры хроматографических сред включают те среды, которые дериватизированы фенильными, бутильными или октильными группами, такие как Phenyl-Sepharose FF (Pharmacia), Toyopearl butyl 650 (Toso Haas, Montgomeryville,PA), Octyl-Sepharose (Pharmacia) и тому подобное; или полиакриловые смолы, такие как Amberchrom CG 71 (Toso Haas) и тому подобное. Подходящие твердые носители включают стеклянные шарики, смолы на основе кремнезема, целлюлозные смолы, агарозные шарики, шарики поперечно сшитой агарозы, полистироловые шарики, поперечно сшитые полиакриламидные смолы и тому подобное, которые нерастворимы в тех условиях, в которых они применяются. Данные носители могут быть модифицированы реакционноспособными группами, которые позволяют присоединение белков с помощью аминогрупп, карбоксильных групп, сульфгидрильных групп, гидроксильных групп и/или углеводных частей. Примеры химических способов присоединения включают активацию цианогенбромидом, активацию N-гидроксисукцинимидом, активацию эпоксидом, сульфгидрильную активацию, гидразидную активацию и карбоксильные и аминопроизводные для химических способов присоединения с помощью карбодиимида. Данные и другие твердые среды хорошо известны и широко используются в данной области и доступны из коммерческих источников. Выбор конкретного способа выделения и очистки полипептида является делом обычной техники и определяется частично свойствами выбранного носителя. См., например. Affinity Chromatography: PrinciplesMethods (Pharmacia LKB Biotechnology 1988), и Doonan,Protein Purification Protocols (The Humana Press 1996). Специалистами в данной области могут быть разработаны дополнительные варианты выделения и очистки IL-22RA. Например, антитела против IL-22RA, полученные как описано ниже, могут быть использованы для выделения больших количеств белка с помощью иммуноаффинной очистки. Полипептиды настоящего изобретения могут быть также выделены с использованием их конкретных свойств. Например, хроматография с адсорбцией иммобилизованных ионов металла (IMAC) может быть применена для очистки белков, обогащенных гистидином, включая те, которые включают полигистидиновые метки. Кратко, гель сначала нагружают двухвалентными ионами металла для образования хелатов (Sulkowski, Trends in Biochem. 3:1 (1985. Белки, обогащенные гистидином будут адсорбироваться данным матриксом с различным сродством в зависимости от применяемого иона металла, и будут элюироваться путем конкурентной элюции, понижения рН или применения сильных хелатирующих агентов. Другие способы очистки включают очистку гликозилированных белков с помощью аффинной хроматографии с иммобилизованным лектином и ионообменной хроматографии (М. Deutscher, (ed.),Meth. Enzymol. 182:529 (1990. В дополнительных осуществлениях изобретения может быть сконструирован гибрид интересующего полипептида и аффинной метки (например, связывающего мальтозу белка,домена иммуноглобулина) для облегчения очистки. Более того, лиганд-связывающие свойства внеклеточного домена IL-22RA могут быть использованы для очистки, например, содержащих IL-22RA растворимых рецепторов; например, с помощью применения аффинной хроматографии, при которой лиганд IL22 связан с колонкой и содержащий IL-22RA рецептор связан и затем элюируется с применением стандартных хроматографических способов. Полипептиды IL-22RA или их фрагменты могут быть также получены с помощью химического синтеза, как описано выше. Полипептиды IL-22RA могут быть мономерами или мультимерами; гликозилированными или не гликозилированными; ПЭГилированными или не ПЭГилированными; и могут включать или не включать инициирующий остаток аминокислоты метионина. 8. Получение антител против белков IL-22RA. Антитела против IL-22RA могут быть получены, например, с применением в качестве антигена продукта IL-22RA экспрессионного вектора, или IL-22RA, выделенного из природного источника. Особенно пригодные антитела против IL-22RA связываются специфически с IL-22RA. Антитела рассматриваются как специфически связывающиеся, если антитела проявляют по меньшей мере одно из следующих двух свойств: (1) антитела связываются с IL-22RA с пороговым уровнем связывающей активности, и (2) антитела не имеют существенных перекрестных реакций с полипептидами, относящимися к IL22RA. В отношении первой характеристики, антитела специфически связываются, если они связываются с полипептидом, пептидом или эпитопом IL-22RA со связывающим сродством (Ka) 106 М-1 или более,предпочтительно 107 М-1 или более, более предпочтительно 108 М-1 или более и наиболее предпочтитель- 29009124 но 109 М-1 или более. Связывающее сродство антитела может быть легко определено специалистом в данной области, например, с помощью скетчардовского анализа (Scatchard, Ann. NY Acad. Sci. 51:660(1949. В отношении второй характеристики, антитела не имеют существенных перекрестных реакций с родственными полипептидными молекулами, например, если они определяют IL-22RA, но не известные в настоящее время полипептиды при применении стандартного анализа путем Вестерн-блоттинга. Примеры известных родственных полипептидов включают известные рецепторы цитокинов. Антитела против IL-22RA могут быть получены с применением антигенных пептидов или полипептидов, несущих эпитоп IL-22RA. Антигенные несущие эпитоп пептиды или полипептиды настоящего изобретения содержат последовательность по меньшей мере из девяти или между 15 и приблизительно 30 аминокислотами, содержащимися в SEQ ID NO:3 или другой раскрытой здесь аминокислотной последовательности. Однако пептиды или полипептиды, включающие более крупную часть аминокислотной последовательности изобретения, содержащие от 30 до 50 аминокислот, или любой длины до и включая полную аминокислотную последовательность полипептида изобретения, также пригодны для индукции антител, которые связываются с IL-22RA. Желательно, чтобы аминокислотная последовательность несущего эпитоп пептида выбиралась с обеспечением существенной растворимости в водных растворителях (т.е. последовательность включала относительно гидрофильные остатки, в то время как гидрофобных остатков обычно избегали). Более того, аминокислотные последовательности, содержащие остатки пролина, также могут быть желательными для выработки антител. В качестве иллюстрации потенциальные антигенные сайты в IL-22RA были идентифицированы с применением способа Jameson-Wolf, Jameson and Wolf, CABIOS 4:181, (1988), выполняемого с помощью программы PROTEAN (версия 3.14) LASERGENE (DNASTAR; Madison, WI). В данном анализе применяли параметры по умолчанию. Способ Jameson-Wolf предсказывает потенциальные антигенные детерминанты с помощью объединения шести главных подпрограмм для предсказания структуры белка. Кратко, сначала был применен способ Hopp-Woods, Hopp et al., Ргос. Nat'l Acad. Sci. USA 78:3824 (1981), для идентификации аминокислотных последовательностей, представляющих области наибольшей локальной гидрофильности (параметр: в среднем семь остатков). На второй стадии был применен способ Emini, Emini et al., J. Virology 55:836 (1985), для расчета вероятностей поверхностей (параметр: порог выбора поверхностей (0,6) = 1). На третьей стадии был применен способ Karplus-Schultz, Karplus and Schultz, Naturwissenschaften 72:212(1985), для предсказания гибкости каркаса цепи (параметр: порог гибкости (0,2) = 1). На четвертой и пятой стадиях анализа предсказания вторичной структуры применяли к данным, используя способы ChouFasman, Chou, Prediction of Protein Structural Classes from Amino Acid Composition, in Prediction of Protein Structure and the Principles of Protein Conformation, Fasman (ed.), pages 549-586 (Plenum Press 1990),and Garnier-Robson, Garnier et al., J. Mol. Biol. 120:97 (1978) (параметры Chou-Fasman: таблица конформаций = 64 белка; порогобласти=103; порогобласти = 105; параметры Garnier-Robson: константы выбора = 0). В шестой подпрограмме параметры гибкости и факторы гидрофобности/доступности растворителю объединяли для определения величины контура поверхности, обозначаемой как антигенный индекс. Наконец, к антигенному индексу применяли функцию расширения пика, которая расширяет главные пики поверхности путем добавления 20, 40, 60 или 80% от величины соответствующего пика для расчета дополнительной свободной энергии, возникающей из-за подвижности областей поверхности по отношению к внутренним областям. Данный расчет, однако, не применялся к любому главному пику,расположенному в области спирали, так как области спирали имеют тенденцию к меньшей гибкости. Результаты данного анализа показали, что следующие аминокислотные последовательности SEQ IDNO:3 должны дать подходящие антигенные пептиды: профили гидрофильности Hopp/Woods могут быть использованы для определения областей, которые имеют наибольший антигенный потенциал в SEQ IDet al., Protein Engineering 11:153-169, 1998). Профиль основывается на скользящем окне в шесть остатков. Внутренние остатки G, S и Т и экспонируемые остатки Н, Y и W игнорировались. Более того, антигенные эпитопы IL-22RA в SEQ ID NO:3, как предсказано графиком Jameson-Wolf, например, с применением программы DNASTAR Protean (DNASTAR, Inc., Madison, WT), служат в качестве предпочтительных антигенных эпитопов и могут быть определены специалистом в данной области. Такие антигенные эпитопы включают (1) аминокислотные остатки с 1 (Pro) по 6 (Asp) SEQ ID NO 3; (2) аминокислотные остатки с 26 (Ser) по 32 (Pro) SEQ ID NO 3; (3) аминокислотные остатки с 41 (Lys) по 47 (Asp) SEQ ID NO 3; (4) аминокислотные остатки с 49 (Val) по 62 (Cys) SEQ ID NO 3; (5) аминокислотные остатки с 41(Ala) SEQ ID NO:3; (12) аминокислотные остатки с 203 (Lys) по 209 (Thr) SEQ ID NO:3. Настоящее изобретение относится к применению любого антигенного пептида с 1 до 12 для получения антител противIL-22RA или в качестве набора для скрининга или идентификации нейтрализации моноклональных антител настоящего изобретения. Настоящее изобретение охватывает также полипептиды, включающие по
МПК / Метки
МПК: A61P 37/00, C07K 16/24
Метки: связывающие, применения, воспалении, антитела, способы, также, против, партнеры, il-20
Код ссылки
<a href="https://eas.patents.su/30-9124-antitela-protiv-il-20-i-svyazyvayushhie-partnery-a-takzhe-sposoby-ih-primeneniya-pri-vospalenii.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела против il-20 и связывающие партнеры, а также способы их применения при воспалении</a>
Предыдущий патент: Парентеральные композиции пептидов для лечения системной красной волчанки
Следующий патент: Применение ингибиторов il-18 для лечения и/или предупреждения заболеваний, характерных для синдрома системной воспалительной реакции
Случайный патент: Устройство и способ переработки неорганического и органического мусора и получения формовочной пасты для различных приложений