Способ профилактики рака молочной железы
Номер патента: 6083
Опубликовано: 25.08.2005
Авторы: Экерт Роберт С., Скотт Тери Дж., Никелсен Николаус Т., Кохен Фредрик Дж., Глусман Джоан Е., Никербокер Рональд К.
Формула / Реферат
1. Способ профилактики (предотвращения) рака молочной железы у человека, который включает введение упомянутому человеку в течение периода, составляющего по меньшей мере шесть месяцев, соединения формулы
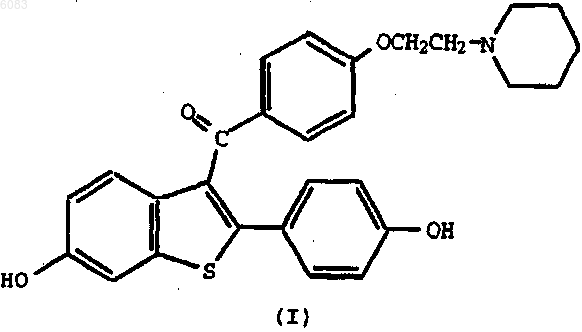
(ралоксифена) или его фармацевтически приемлемой соли или сольвата в эффективной дозе, составляющей от 60 до 120 мг/день.
2. Способ по п.1 для снижения вероятности возникновения рака молочной железы у человека.
3. Способ по п.1 для снижения вероятности развития рака молочной железы у человека.
4. Способ по пп.1-3, где упомянутая эффективная доза составляет около 60 мг/день.
5. Способ по п.4, где упомянутый период времени составляет по меньшей мере два года.
6. Способ по п.4, где упомянутый период времени составляет постоянное введение.
7. Способ по пп.1-6, где упомянутое соединение представляет его хлористо-водородную соль.
8. Способ по пп.1-7, где упомянутым человеком является женщина в постклимактерическом периоде.
9. Способ по пп.1-8, где у упомянутой женщины в постклимактерическом периоде нет особого риска развития рака молочной железы.
10. Способ по пп.1-9, где упомянутый рак молочной железы является de novo.
Текст
006083 Предпосылки создания изобретения Карцинома молочной железы или рак груди является основной медицинской проблемой для женщин, которая начинается с третьего десятилетия жизни и существует на протяжении всего периода физиологического старения. В настоящее время установлено, что в Соединенных Штатах женщины имеют один из восьми шансов развития упомянутого заболевания в течение их времени жизни (к возрасту восьмидесяти лет), тогда как одна из двадцати восьми женщин имеет риск в течение жизни умереть от рака молочной железы (Harris et al., Ed. Diseases of the Breast, 1996: pp. 159-168). Карцинома молочной железы занимает третье место из числа наиболее обычных раковых заболеваний и самым частым видом рака у женщин. Она является основной причиной смертности у женщин, а также причиной потери трудоспособности, психической травмы и экономического урона. Карцинома молочной железы является второй наиболее обычной причиной смерти от рака женщин в Соединенных Штагах и главной причиной связанной с раком смерти для женщин возраста между 15 и 54 годами (Forbes, Seminars in Oncology, vol. 24(1), Suppl 1, 1997; pp. S1-20-S1-35). Непрямое действие этой болезни также вносит вклад в смертность от рака молочной железы, включая последствия запущенного заболевания, такие как метастазы в кости или головной мозг. Осложнения, возникающие из-за подавления костного мозга, лучевого фиброза и сепсиса, связанного с нейтропенией, коллатериальные эффекты из-за терапевтических вмешательств,таких как хирургия, облучение, химиотерапия или трансплантация костного мозга, также вносят вклад в распространенность этой болезни и связанную с ней смертность. Эпидемиология этой болезни, хотя она и является предметом интенсивного исследования, до сих пор недостаточно понятна. По-видимому, имеется важный генетический компонент, который придает некоторым женщинам предрасположение к появлению данной болезни. Однако не ясно, является ли этот генетический компонент причинным или разрешающим для этой болезни или только предопределяет ход развития болезни. Хотя в течение длительного времени было известно, что карцинома молочной железы имеет тенденцию более часто встречаться в некоторых семьях, такой анализ не всегда предсказывает появление болезни у других членов семьи и имеет небольшое значение для предсказания ее распространения у населения в целом. В настоящее время установлено, что только 5% всех раковых болезней молочной железы является результатом генетического предрасположения (Harris et al., Ed. Disease of theBreast, 1996: pp. 159-168). С целью попытки объяснения связи между гормоном эстрогеном и причиной и ходом развития карциномы молочной железы было проведено экстенсивное клиническое и фармакологическое исследование. Факторы риска для данной болезни относятся главным образом к продолжительности кумулятивного воздействия эстрогена женщины и включают возраст (менархе) начала менструаций, число родов в анамнезе, возраст во время первой доношенной беременности и менопаузу. Несмотря на то, что известно много о связи эстрогена в ходе развития указанной болезни и важности эстрогенной зависимости для эндокринного лечения данной болезни, существуют весьма различные мнения о роли эстрогена в патогенезе этой болезни, т.е. по вопросу является ли эстроген причинным агентом (инициатором) или обязательным кофактором (активатором) и процессе карциногенеза. Эстроген, который включает 17 эстрадиол, эстрон и другие активные метаболиты, является основным половым гормоном в организме женщины, но дополнительно, по-видимому, он является важным гемостатическим гормоном как у мужчин, так и у женщин на всем протяжении их взрослой жизни. Все люди имеют некоторый уровень эндогенного эстрогена. Однако у огромного большинства населения не обнаруживается карцинома молочной железы, этот факт подкрепляет предположение, что эстроген, сам по себе, не является инициатором карциногенеза, как, например, в случае с химическим карциногеном или карциногеном из окружающей среды. Кроме того, у женщин, когда у них наступает менопауза с последующей потерей выработки эндогенного овариального эстрогена, не наблюдается пропорционального снижения риска заболевания этой болезнью. Фактически, независимо от личного анамнеза рака молочной железы возраст является единственным, наиболее сильным фактором риска для развития этой болезни. Рак молочной железы бывает редко у женщин моложе 20 лет, но этот риск быстро увеличивается с возрастом. По сравнению с риском развития рака молочной железы у 20-летних женщин риск у женщины в возрасте от 40 до 49 лет повышается в 40 раз, у женщины в возрасте от 50 до 59 лет риск повышается в 60 раз и женщины в возрасте свыше 60 лет имеют риск, в 90 раз превышающий риск у более молодых женщин (Forbes, Seminars in Oncology, vol. 24(1), Suppl 1, 1997: pp. S1-20-S1-35). Гормональную заместительную терапию (ГЗТ) часто рекомендуют женщинам в постклимактерическом и околоклимактерическом периоде для облегчения менопаузных симптомов и снижения риска сердечно-сосудистой болезни, остеопороза и других серьезных последствий длительного дефицита эстрогена. Однако из-за достаточно признанных данных по прямому влиянию кумулятивного воздействия эстрогена в течение жизни и риску рака молочной железы существуют серьезные споры по потенциалу гормональной заместительной терапии в повышении риска развития у женщины карциномы молочной железы. В то время как кратковременная ГЗТ (менее 5 лет) связывается с минимальным риском или с отсутствием повышения риска, эпидемиологические исследования и мета-анализы использования длительного ГЗТ (между пятью и семью годами) показывают повышение риска развития рака молочной железы-1 006083 от 35 до 75% (Grady et al., Hormone Therapy to Prevent Disease and Prolong Life in Postmenopausal Women.,Ann. Intern Med, 117: pp. 1016-1037, 1992). Теории и доказательство, относящиеся к роли эстрогена в патогенезе этой болезни, сложны. Экспериментальные модели карциномы молочной железы на крысах требуют введения карциногена для вызывания опухоли (онкогенез), тогда как эстроген ведет себя как активатор (а не инициатор) этого процесса. Овариэктомия у этих животных-моделей будет мешать этому процессу химически индуцированного онкогенеза. У людей, однако, хронометраж карциногенного события неизвестен. Известно, что женщины,которые испытывают раннюю менопаузу или медицинскую или хирургическую овариэктомию до возраста 40 лет, будут иметь приблизительно 50% снижение риска рака молочной железы по сравнению с женщинами, имеющими нормальную менопаузу в возрасте 50 лет (Harris, et al., Ed Diseases of the Breast,1996: pp. 159-168). Логично, следовательно, что подходы к профилактике рака молочной железы должны быть нацелены на снижение периода воздействия эстрогена в течение жизни. Это можно достичь фармакологически индуцированной депривацией эстрогена через введение средства, которое будет блокировать продуцирование и/или действие эстрогена везде по системе гипоталамус - гипофиз - половые железы. Тем не менее, проблематично экстраполирование вероятного успеха профилактики карциномы молочной железы de novo или иначе средствами этой природы. В противоположность сложной роли эстрогена в патогенезе этой болезни и несмотря на постоянно увеличивающуюся массу данных по проблеме значительные успехи были достигнуты в нашем понимании влияния эстрогена в регулировании установленной карциномы молочной железы. Эстроген является фактором роста для большинства клеток карциномы молочной железы на ранних стадиях данной болезни. Быстро делящиеся клетки чувствительны к его действию через рецепторы эстрогена. Было также установлено, хотя это не вполне понятно, что в некоторой точке в процессе этой болезни перерожденные(раковые) клетки часто теряют свою чувствительность к активирующему действию эстрогена. В конце концов, основная часть клеток карциномы становится независимой от эстрогена в отношении роста и теряет свою восприимчивость к терапии на основе гормона, которая широко включает агонисты ГНВГ(GNRH, гонадотропинвысвобождающий гормон) "антиэстрогены", прогестины и андрогены. Огромные успехи в лечении рака молочной железы были достигнуты с появлением и широко распространенным использованием терапевтического вмешательства на гормональной основе. Наиболее экстенсивно в эндокринной терапии используют тамоксифен. При помощи этой терапии существенно повышен пятилетний срок выживаемости для женщин с карциномой молочной железы, однако, никакой дополнительной пользы или преимущества по выживаемости не достигают путем непрерывной терапии в течение более чем пяти лет. Действительно, данные показывают понижение выживания без болезни, а также общего выживания при использовании тамоксифена в течение более чем пяти лет (NSABP B-14Negative Lymph Nodes and Estrogen Receptor Positiv Tumors, J. Natl Cane Inst, vol. 88(21): pp. 1529-1542,1996). К сожалению, тамоксифен ассоциируется также с существенными отрицательными воздействиями, такими как: существенно повышенная частота венозной тромбоэмболии, значительно повышенная частота симптомов сужения сосудов или приступообразного ощущения жара (приливы) (в диапазоне 1667%), образование катаракты и образование ДНК-аддукта, который, несмотря на то, что клинически это не подтверждено, все же вызывает беспокойство в отношении его потенциала для гепатоклеточной карциномы (наблюдаемой экспериментально на моделях-животных). Однако наиболее серьезным фактом является эстрогенное действие тамоксифена в матке, которое вызывает внутриматочную гиперплазию и существенное повышение числа случаев внутриматочных карцином (риск повышается в три-четыре раза после пятилетнего введения тамоксифена) (Goldhirsch et.al., Endocrine Therapies of Breast Cancer, Sem inOne, vol. 23(4), pp. 494-505, 1996). По этой причине и из-за отсутствия улучшения в выживаемости при долговременном использовании тамоксифена терапия с тамоксифеном в течение более чем пяти лет теперь противопоказана. Данные свидетельствуют, что при долговременном воздействии тамоксифена опухолевые клетки молочной железы испытывают изменения, которые вызывают у них развитие устойчивости к его антиэстрогенному действию, и наоборот, восприимчивость к его эстрогенным свойствам (Santen, Editorial:Long Term Tamoxifen Therapy: Can an Antagonist become an Agonist, J. Clin. Endo and Metab, vol. 81 (6),pp. 2027-2029, 1996). Изменения в любой стадии пути сигнала рецептора эстрогена могут быть ответственны за механизм развития устойчивости к терапии тамоксифеном, некоторые из них не вызывают перекрестную устойчивость к другим гормональным терапиям и некоторые из них действительно приводят к полной толерантности к эндокринной терапии любого вида. Один механизм устойчивости к тамоксифену относят к постепенной эволюции клеток карциномы из эстрогензависимых в эстрогеннезависимые(эстроген-рецептор положительные клетки становятся клетками эстроген-рецептор отрицательными). Таким образом, даже в случае наиболее успешных доступных комбинаций способов лечения (хирургия,облучение и/или химиотерапия) долговременный прогноз для пациентов плохой, в особенности, когда имеется метастазирующая опухоль. Ясно, что имеется огромная потребность в улучшенных способах терапии и, возможно, наиболее важно критическая потребность в профилактике болезни в самом начале-2 006083 Несмотря на то, что тамоксифен был экстенсивно исследован и оказался эффективным в регулировании установленной болезни, не проводились законченные, широкомасштабные клинические исследования с использованием плацебо в качестве контроля, направленные на потенциальное использование этого соединения для первичной профилактики рака молочной железы. Действительно существуют исследования, показывающие, что женщины, имеющие историю болезни с карциномой в одной молочной железе и прошедшие лечение тамоксифеном, имеют уменьшенное число случаев опухолей в контралатеральной молочной железе. Хотя это могло быть интерпретировано как тип профилактики этой болезни,неясно, является ли это антиметастатическим эффектом или ингибированием de novo данной болезни. Понимание такого различия в биологическом механизме очень важно для попытки профилактики инициации болезни de novo у здоровых женщин без конкретной истории болезни с карциномой молочной железы или без фактора риска карциномы молочной железы. В течение последнего десятилетия было доказано, что "антиэстрогенная" терапия, особенно с использованием тамоксифена, должна быть исследована для определения ее потенциала для профилактики карциномы молочной железы de novo. Однако частично вследствие отсутствия доказательства пользы и известной и потенциальной токсичности тамоксифена никакие исследования по ожидаемой профилактике здоровых женщин не проводили. Недавно были предложены два таких исследования по профилактике, и каждое исследование было предметом значительной дискуссии. В результате этой дискуссии пришли к выводу, что исследование, которое должно было быть проведено и Великобритании, имеет неблагоприятное отношение риск-к-пользе, и оно не было предпринято. Аналогично этому, в Италии из-за заботы о безопасности, относящейся к случаю внутриматочных раковых болезней, исследования по профилактике с использованием тамоксифена предписывали проводить только на женщинах, которые подвергались гистерэктомии. Однако в Соединенных Штатах Америки такое исследование было предпринято при содействии Национального Института рака. На основе понимания спорного анализа таких исследований и необходимости, в противном случае, огромного количества проб, исследование в США ограничивали только женщинами, у которых имелся высокий риск развития этой болезни и включали в исследование женщин как в пред-, так и в постклимактерическом периоде (молодые женщины для права быть выбранными для исследования должны были иметь оценку риска, эквивалентную оценке риска 60 летней женщины). Результаты этого исследования не будут доступными в течение по меньшей мере трех лет. (Для дальнейшей информации, относящейся к дискуссии по потенциальному использованию тамоксифена в качестве химиопрофилактического средства при карциноме молочной железы, клиническим схемам и определению потенциала высокого риска см.: "Breast Cancer Prevention Study: Are Healthyand Intergovernmental Relations Subcommittee of the Committee on Governmental Operations, House of Representatives of the One Hundred Second Congress, Second Session, October 22, 1992 [ISBN 0-16-044316-4] и цитированные в этой публикации ссылки и свидетельства). Вследствие того, что целью профилактики болезни является защита женщины от карциногенного события (или случая предраковых патологических изменений) и последующей активации или развития инвазивной болезни (рака), необходимо пролонгированное использование профилактического терапевтического средства (Kelloff et al. Approaches to the Development and Marketing Approval of Drugs that Prevent Cancer, Cancer Epidemiology, Biomarkers and Prevention, vol. 4, pp. 1-10, 1995). Поэтому необходимо,чтобы терапия была крайне высокотолерантной, с профилем исключительной безопасности и минимальным побочным действием. Действие ралоксифена исследовали более чем на 12000 субъектах. Экстенсивные интегрированные данные из клинических исследований фазы III с использованием ралоксифена для профилактики или лечения остеопороза у женщин в постклимактерическом периоде анализировали на безопасность. Когда все дозы ралоксифена объединили, это исследование включило более чем 12850 человеко-лет воздействия ралоксифена. Было доказано, что ралоксифен крайне высокотолерантен, имеет широкий терапевтический индекс и имеет минимальное свидетельство острой или хронической токсичности, эти показатели основаны почти на 3-летнем клиническом опыте. По сравнению с этим, отрицательное действие, связанное с долговременным использованием тамоксифена, вызывает значительное беспокойство в плане его приемлемости для использования в качестве химиопрофилактического средства (Grainger et al. Tamoxifen: Teaching an Old Drug New Tricks, Nat Med, vol. 2 (4), pp. 381-385, 1996). К настоящему времени не имеется продемонстрированной, эффективной профилактической терапии для de nova карциномы молочной железы. Кроме того, нет исследований по совершенствованию или изучению профилактики карциномы молочной железы у женщин в общем населении, которые не имеют определенного повышенного риска развития рака молочной железы. Ясно, что существует большая потребность в профилактической терапии рака молочной железы, пригодной для всего населения, включая индивидуумы с высоким риском, а также индивидуумы без определенного повышенного риска и включая как мужчин, так и женщин. Настоящее изобретение предлагает способы профилактики рака молочной железы, включая рак молочной железы de novo.-3 006083 Краткое изложение сущности изобретения Это изобретение относится к способу профилактики рака молочной железы у человека, который заключается в введении этому человеку в течение достаточного периода времени эффективной дозы соединения формулы или его фармацевтически приемлемой соли или сольвата. Кроме того, изобретение относится к изделиям, которые содержат упаковочный материал и фармацевтическое средство, содержащееся в этом упаковочном материале, где упаковочный материал включает этикетку, которая указывают, что это фармацевтическое средство можно вводить для профилактики рака молочной железы, где фармацевтическим средством является соединение формулы I или его фармацевтически приемлемая соль или сольват. Краткое описание чертежа Чертеж изображает число случаев (в процентах) возникновения рака молочной железы у пациентов,которых лечили плацебо и гидрохлоридом ралоксифена, в исследованиях, контролируемых плацебо. Подробное описание изобретения Настоящее изобретение относится к открытию того факта, что соединения формулы I можно использовать для профилактики рака молочной железы. Способы, предложенные этим изобретением, применяют на практике введением человеку, нуждающемуся в этом, в течение достаточного периода времени дозы ралоксифена или его фармацевтически приемлемой соли или сольвата, которая эффективна для профилактики рака молочной железы. Термин "профилактика", когда его используют в сочетании с раком молочной железы, включает снижение вероятности того, что человек будет подвержен раку молочной железы или у него будет развиваться рак молочной железы. Термин не включает лечение пациента с диагностированным раком молочной железы. Термин "de novo", используемый в настоящем изобретении, означает изначальное отсутствие перерождения или метаморфозы нормальных клеток молочной железы в раковые или злокачественные клетки. Такое перерождение может протекать по стадиям в тех же или дочерних клетках посредством эволюционного процесса или может иметь место в виде одного основного события. Этот процесс de novo является процессом, отличным от процесса метастаза, деления и образования колоний опухолевыми клетками, занесенными в другой орган, или распространения уже перерожденных или злокачественных клеток из первичного участка опухоли в новые локализации. Термин "de novo" связывают с первичной профилактикой. Данное изобретение относится также к введению соединения формулы I пациенту, который имеет повышенный риск развития рака молочной железы, de novo или иначе. Человек, который не имеет особого риска развития рака молочной железы, является человеком, у которого может развиться рак молочной железы do novo, который не имеет доказательства или подозрения в потенциальном риске данной болезни, выше нормального, и у которого никогда не диагностировали эту болезнь. Фактор наибольшего риска, вносящий вклад в развитие карциномы молочной железы, имеется у человека с историей болезни с раком молочной железы, даже когда не имеется доказательства остаточной болезни, у человека, у которого прошло 5 лет или более после лечения такой болезни и который считается "оставшимся в живых после рака молочной железы". Другим, вполне признаваемым фактором риска является история болезни с раковым заболеванием в семье. Показано, что ралоксифен, который является хлористо-водородной солью соединения формулы I,связывается с ремонтером эстрогена, и первоначально считали, что он является молекулой, функцией и фармакологией которой была функция и фармакология "антиэстрогена". Фактически, ралоксифен действительно блокирует действие эстрогена в некоторых тканях; однако, в других ралоксифен активирует те же гены, что и эстроген, проявляет подобную фармакологию и ведет себя как агонист эстрогена, например, в скелете и на липидах сыворотки крови. Теперь считают, что необычный профиль, который проявляет ралоксифен и который отличается от профиля эстрогена и других "антиэстрогенов", является результатом необычной активации и/или подавления различных функций генов комплексом ралоксифенрецептор эстрогена в противоположность активации и/или подавления генов комплексом эстрогенрецептор эстрогена. Следовательно, несмотря на то, что ралоксифен и эстроген используют один и тот-4 006083 же рецептор и конкурируют за него, фармакологический результат генной регуляции этих двух агентов предсказать нелегко, и он уникален для каждого из них. Обычно это соединение превращают в готовую препаративную форму с обычными наполнителями,разбавителями или носителями и прессуют в таблетки или превращают в готовые препаративные формы в виде эликсиров или растворов для обычного перорального введения или вводят внутримышечными или внутривенными способами. Соединения можно вводить чрескожно или интравагинально, их можно изготовить в виде лекарственных форм с пролонгированным действием, парентеральных форм, депо-форм и тому подобное. Соединения, используемые в способах настоящего изобретения, можно получить в соответствии с принятыми способами, такими как способы, подробно описанные в патентах США 4133814,4418068, 4380635, 5629425, заявке на патент Великобритании GB 2293602, опубликованной 3 марта 1966 г., и заявке на Европейский патент 95301291, зарегистрированной 28 февраля 1995 г., опубликованной 6 сентября 1995 г., и международной заявке PCT/US 97/04259, имеющей международную дату регистрации 20 марта 1997 г. и дату публикации 26 сентября 1997 г., все эти патенты и заявки включены здесь в качестве ссылок. Обычно способ синтеза начинают с бензо[b]тиофена, имеющего 6-гидроксильную группу и 2-(4-гидроксифенильную) группу. Гидроксильные группы исходного соединения защищают, положение 3 ацилируют и продукт освобождают от защитных групп с образованием соединений формулы I. Примеры получения таких соединений представлены в патентах США и заявке на патент Великобритании, обсуждаемых выше. Соединения, используемые в способах данного изобретения, образуют фармацевтически приемлемые кислотно- и основно-аддитивные соли с большим числом органических и неорганических кислот и оснований и включают физиологически приемлемые соли, которые часто используют в фармацевтической химии. Такие соли также являются частью данного изобретения. Типичные неорганические кислоты, используемые для образования таких солей, включают хлористо-водородную, бромисто-водородную,йодисто-водородную, азотную, серную, фосфорную, гипофосфорную и тому подобное. Можно также использовать соли, образованные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые и гидроксиалкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты. Такие фармацевтически приемлемые соли, таким образом, включают ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, -гидроксибутират, бутин-1,4 диоат, гексин-1,4-диоат, капрат, каприлат, хлорид, циннамат, цитрат, формиат, фумарат, гликолат, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат, фосфат, вторичный кислый фосфат, первичный кислый фосфат, метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, салицилат, себацат, сукцинат,суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, пбромбензолсульфонат, хлорбензолсульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и тому подобное. Предпочтительной солью является хлористо-водородная соль. Фармацевтически приемлемые кислотно-аддитивные соли обычно получают реакцией соединения формулы I с эквимолярным или избыточным количеством кислоты. Реагенты обычно смешивают в общем для них растворителе, таком как диэтиловый простой эфир или бензол. Соль обычно осаждается из раствора в пределах времени от около 1 ч до 10 дней, ее можно выделить фильтрованием или растворитель можно отогнать обычным способом. Основания, обычно используемые для образования солей, включают гидроксид аммония и гидроксиды, карбонаты щелочных и щелочно-земельных металлов, а также алифатические и первичные, вторичные и третичные амины, алифатические диамины. Основания, в особенности пригодные для получения аддитивных солей, включают гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия, метиламин, диэтиламин, этилендиамин и циклогексиламин. Фармацевтически приемлемые соли обычно имеют повышенные характеристики растворимости по сравнению с соединением, из которого их получают, и, таким образом, часто более пригодны для приготовления готовой препаративной формы в виде жидкостей или эмульсий. Фармацевтические готовые препаративные формы можно получить способами, известными в данной области. Например, соединения можно превратить в готовые препаративные формы с обычными наполнителями, разбавителями или носителями и формовать в таблетки, капсулы, суспензии, порошки и тому подобное. Примеры наполнителей, разбавителей и носителей, которые подходят для таких готовых препаративных форм, включают следующие наполнители и разбавители, такие как крахмал, сахара, маннит и кремниевые производные; связывающие средства, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажняющие средства, такие как глицерин; дезинтегрирующие средства, такие как карбонат кальция и бикарбонат натрия; средства для замедления растворения, такие как парафин; ускорители всасывания, такие как соединения четвертичного аммония; поверхностно-активные вещества, такие как цетиловый спирт, моностеарат глицерина;-5 006083 адсорбирующие носители, такие как каолин и бентонит; и смазывающие средства, такие как тальк, стеарат кальция и магния и твердые полиэтиленгликоли. Соединения можно также изготовить в виде эликсиров или растворов для обычного перорального введения или в виде растворов, подходящих для парентерального введения, например, внутримышечными, подкожными или внутривенными способами. Кроме того, эти соединения хорошо пригодны для приготовления готовых препаративных форм в виде лекарственных форм с пролонгированным действием и тому подобное. Готовые препаративные формы можно составлять таким образом, чтобы они высвобождали активный ингредиент только или предпочтительно и определенной части кишечного тракта, возможно в течение некоторого периода времени. Покрытия, оболочки и защитные матрицы можно изготовить, например, из полимерных веществ или восков. Конкретная эффективная и достаточная продолжительность приема и доза соединения формулы I,требуемые для профилактики рака молочной железы в соответствии с данным изобретением, будут зависеть от физических характеристик пациента, пути введения и относящихся к ним факторов, которые могут быть оценены лечащим врачом. Предпочтительная продолжительность введения составляет по меньшей мере шесть месяцев, более предпочтительно по меньшей мере один год и очень предпочтительно по меньшей мере два года или постоянно. Обычно приемлемые и эффективные суточные дозы будут от около 0,1 до около 1000 мг/день, предпочтительно от около 30 до около 200 мг/день и более предпочтительно от около 50 до около 150 мг/день. Наиболее предпочтительный диапазон доз находится между около 60 и около 120 мг/день с особенно предпочтительной дозой 60 мг/день. Описанные диапазоны доз не предназначены для ограничения изобретения. Скорее эти диапазоны доз разъясняют данное изобретение, и изобретение включает в себя те диапазоны, которые функционально эквивалентны, обеспечивая обнаруженные химиопрофилактические характеристики данного соединения. Следовательно, хотя некоторые способы введения могут применять во внимание буквально другой диапазон доз соединения формулы I, который эффективно используют в данном изобретении,такой буквально другой диапазон доз, поскольку он функционально эквивалентен указанным диапазонам, охватывается данным изобретением. Кроме того, описанные диапазоны доз основываются на хлористо-водородной соли соединения формулы I. Поэтому доза 60 мг эквивалентна 55,71 мг свободного основания. Средний специалист данной области будет способен вычислить эквивалент свободного основания любой соли соединения формулы I, которая фармацевтически приемлема. Например, доза "около 60 мг" будет содержать от 55 до 65 мг гидрохлорида ралоксифена при содержании в ней от 51,73 до 60,35 мг свободного основания. Выгодно также вводить соединение пероральным путем. Для таких целей пригодны следующие пероральные лекарственные формы. Готовые препаративные формы Готовая препаративная форма 1. Желатиновые капсулы. Твердые желатиновые капсулы получают с использованием следующих ингредиентов: Ингредиент Количество, мг/капсула Ралоксифен HCl 30-200 Крахмал, NF 0-650 Текучий порошок крахмала 0-650 Силиконовая жидкость, 350 сантистокс 0-15 Ингредиенты смешивают, пропуская через сито 45 меш по шкале США, и заполняют ими твердые желатиновые капсулы. Примеры готовых препаративных форм в виде капсул включают формы, показанные ниже. Готовая препаративная форма 2. Капсула ралоксифена. Ингредиент Количество, мг/капсула Ралоксифен HCl 30-200 Крахмал, NF 112 Текучий порошок крахмала 225,3 Силиконовая жидкость, 350 сантистокс 1,7 Готовая препаративная форма 3. Капсула ралоксифена. Ингредиент Ралоксифен HCl Крахмал, NF Текучий порошок крахмала Силиконовая жидкость, 350 сантистокс 006083 Готовая препаративная форма 4. Капсула ралоксифена. Ингредиент Ралоксифен HCl Крахмал, NF Текучий порошок крахмала Силиконовая жидкость, 350 сантистокс Готовая препаративная форма 5. Капсула ралоксифена. Ингредиент Ралоксифен HCl Крахмал, NF Текучий порошок крахмала Силиконовая жидкость, 350 сантистокс Приведенные выше конкретные готовые препаративные формы можно изменить в соответствии с предложенными приемлемыми вариантами.NF - национальная фармакопея США. Таблетированную готовую препаративную форму получают, используя указанные ниже ингредиенты. Готовая препаративная форма 6. Таблетки. Ингредиент Количество, мг/таблетка Ралоксифен HCl 30-200 Целлюлоза, микрокристаллическая 0-650 Диоксид кремния, коллоидный 0-650 Стеариновая кислота 0-15 Компоненты смешивают и прессуют для образования таблеток. В соответствии с другим вариантом таблетки, каждая из которых содержит 0,1-1000 мг активного ингредиента, изготавливают следующим образом. Готовая препаративная форма 7. Таблетки. Ингредиент Количество, мг/таблетка Ралоксифен HCl 30-200 Крахмал 45 Целлюлоза, микрокристаллическая 35 Поливинилпирролидон (в виде 10% раствора в воде) 4 Натрийкарбоксиметилцеллюлоза 4,5 Стеарат магния 0,5 Тальк 1 Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш по шкале США и тщательно перемешивают. Раствор поливинилпирролидона смешивают с получаемым порошком, который затем пропускают через сито 14 меш по шкале США. Таким образом, полученные гранулы сушат при 50-60 С и пропускают через сито 18 меш по шкале США. Натрийкарбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито 60 меш по шкале США, затем добавляют к гранулам, которые после перемешивания прессуют на таблеточной машине, получая таблетки. Суспензии, каждая из которых содержит 0,1-1000 мг лекарственного средства на 5 мл дозу, изготовляют следующим образом. Готовая препаративная форма 8. Суспензии. Ингредиент Количество, мг/5 мл Ралоксифен HCl 30-200 Натрийкарбоксиметилцеллюлоза 50 мг Сироп 1,2 5 мг Раствор бензойной кислоты 0,10 мл Отдушка Сколько угодно Краситель Сколько угодно Очищенная вода до 5 мл Лекарственное средство пропускают через сито 45 меш по шкале США и смешивают с натрийкарбоксиметилцеллюлозой и сиропом для образования гладкой пасты. Раствор бензойной кислоты, от-7 006083 душку и краситель разбавляют некоторым количеством воды и добавляют при перемешивании. Затем добавляют достаточное количество воды для получения требуемого объема суспензии. Предпочтительные таблетированные готовые препаративные формы включают следующие две формы. Готовая препаративная форма 9. Ингредиент Количество, мг Функция Ралоксифен HCl 60,0 Активный Высушенная распылительной сушкой 30,0 Растворимый разбавитель лактоза Безводная лактоза 12,0 Растворимый разбавитель Повидон 12,0 Связывающее средство Полисорбат 80 2,4 Смачивающее средство Кросповидон 14,4 Дезинтегрирующее средство Стеарат магния 1,2 Смазывающее средство(Масса сердцевины таблетки 240,0) Пленочное покрытие Краситель белый смесевой 12,0 Краситель Полирующее вспомогательное Тальк Следы средство Полирующее вспомогательное Карнаубский воск средство Готовая препаративная форма 10. Ингредиент Ралоксифен HCl Высушенная распылительной сушкой лактоза Безводная лактоза Повидон Полисорбат 80 Кросповидон Стеарат магния(Масса сердцевины таблетки Пленочное покрытие Краситель белый смесевой Растворимый разбавитель Связывающее средство Смачивающее средство Дезинтегрирующее средство Смазывающее средство Краситель Полирующее вспомогательное средство Полирующее вспомогательное средство Методика испытания В качестве подтверждения полезности данного изобретения ниже представлены результаты временной безопасности, полученные в клинических исследованиях фазы III с использованием ралоксифена. Большинство случаев карциномы молочной железы имело место в большом, продолжительном исследовании по лечению остеопороза у 7704 женщин в постклимактерическом периоде с установленным остеопорозом. Однако дополнительно сообщалось о меньших исследованиях женщин в постклимактерическом периоде с риском остеопороза. В указанных здесь исследованиях использовали двойной "слепой" способ контроля и плацебо в качестве контроля; большинство исследований имели продолжительность приблизительно три года и были предназначены для определения эффективности ралоксифена для профилактики или лечения остеопороза у женщин в постклимактерическом периоде. Кроме того, исследования представляют информацию по состоянию здоровья в отношении сердечно-сосудистой системы и других основных медицинских состояний (включая случаи заболеваемости карциномой молочной железы). Пациентов приписывали произвольно к разным группам для получения либо плацебо, либо 30, 60,120 или 150 мг лекарственного средства в день перорально. Для исследования назначения исследуемого лекарственного средства всех пациентов и исследователей распределяли слепым методом (двойной слепой отбор). Все пациенты во всех группах получали ежедневно приблизительно 500 мг/день добавок кальция. Кроме того, пациенты в обширном исследовании по лечению 7704 пациентов получали добавки с витамином D, 400-600 (МЕ/день).-8 006083 Субъектами, выбранными для этих исследований, были женщины в постклимактерическом периоде(по меньшей мере 2 года со времени последнего менструального цикла) с диапазоном возраста приблизительно от сорока пяти до восьмидесяти лет. Типичные критерии исключения из участия в этих исследованиях включали 1) наличие серьезного системного заболевания, 2) острую или хроническую болезнь печени, 3) существенно ослабленную функцию почек, 4) субъекты, которые, по мнению исследователей, имели плохие для включения в клиническое исследование факторы медицинского или психического риска, например злоупотребление лекарственными средствами или алкоголизм и т.д., 5) субъекты, имеющие любую историю болезни с раковым заболеванием в течение 5 лет до внесения в списки для исследования, за исключением неглубоких поражений, например базально-клеточной карциномы кожи, 6) наличие аномального маточного кровотечения. Наиболее важным критерием исключения было исключение женщин, имеющих историю болезни с раком молочной железы или другой эстрогензависимой неоплазией в данное время или в прошлом. Эти критерии исключения создавали популяцию субъектов, которая отражала общее население в отношении риска развития карциномы молочной железы, или, другими словами, эти субъекты не имели особенного повышенного риска развития рака молочной железы. Потенциальных субъектов отбирали до регистрации в участии в исследовании. Требовалось, чтобы субъекты представили их истории болезни и сообщили о настоящем медицинском состоянии. Требовалось, чтобы все потенциальные пациенты либо имели фоновую маммограмму или ультразвуковую оценку молочной железы, либо подвергались одному из этих анализов в течение 12-месячного периода,предшествующего внесению в списки для исследования. В большинстве исследований требовалось получение маммограммы через два года, однако, рекомендовались ежегодные маммограммы. Все субъекты с диагностированными и описанными карциномами молочной железы должны были немедленно прекратить участие в исследовании и были направлены участковым исследователем для соответствующей онкологической экспертизы и наблюдения. Во всех контролируемых плацебо исследованиях продолжительностью по меньшей мере 6 месяцев и среди всех субъектов, получающих более чем в течение 1 месяца лечение изучаемыми лекарственными средствами, было установлено всего 42 случая рака молочной железы: 24 случая наблюдали в группе плацебо по сравнению с 18 случаями в группах лечения ралоксифеном. Общее отношение назначений лечения для рандомизированных пациентов (группы ралоксифена к группе плацебо) было приблизительно 2:1. Результаты, показанные в табл. 1-4, относятся к субъектам с гистопатологическими диагнозами карциномы молочной железы. Эти данные включают результаты пациентов с произвольно сделанными маммограммами в течение одного года, а также обязательной фоновой маммограммой и последующими маммограммами в течение следующих двух лет. После того, как был установлен диагноз рака молочной железы, субъекты исключались из участия в исследовании и их статус раскрывали, чтобы выявить терапию, которая им назначалась (т.е. какое из изучаемых лекарственных средств они получали). Для исследований, указанных в данном изобретении, число пациентов, произвольно отнесенных к группе, получающей плацебо, было приблизительно 3195. Число пациентов, произвольно отнесенных к группам, получающим ралоксифен (объединены группы со всеми дозами), было приблизительно 6681.(В широкомасштабном исследовании по лечению 7704 пациентов пациентам, которые остались внесенными в исследование, шифр терапии не раскрывали. Поэтому число пациентов, отнесенных в каждой группе терапии, является оценкой). Результаты, показанные ниже, представлены для пациентов, которые были диагностированы, как имеющие карциному молочной железы в любой момент времени в процессе исследования, но по меньшей мере через один месяц после произвольного отнесения к группе исследования лекарственной терапии (плацебо или ралоксифен). В табл. 1 представлены результаты всех контролируемых плацебо исследований с данными для всех объединенных доз ралоксифена. В табл. 2 представлена подгруппа случаев,представленных в табл. 1, конкретно пациентов, зарегистрированных в широкомасштабном исследовании по лечению 7704 пациентов, в котором имело место наибольшее число случаев рака молочной железы. Двумя дозами ралоксифена в этом исследовании лечения были 60 и 120 мг/день. Поскольку число случаев рака молочной железы повышалось с возрастом, предполагалось, что исследование лечения будет иметь более высокое число случаев рака молочной железы [средний возраст пациента 67 лет в начале исследования]. В таблицах представлено число случаев рака молочной железы (n) для каждой группы лечения, общее число пациентов, которым назначено такое лечение (N), оценка относительного риска развития рака молочной железы и 95% доверительный интервал для относительного риска развития рака молочной железы. Следует принять но внимание, что, если верхний предел 95% доверительного интервала меньше 1,0, то имеется статистически значимое доказательство (на уровне 5%) того, что число случаев рака молочной железы при лечении ралоксифеном меньше числа случае рака молочной железы в группе плацебо.-9 006083 Таблица 1 Анализ относительного риска возникновения рака молочной железы во всех объединенных исследованиях, контролируемых плацебо 95% доверительВремя от назначения Случаи с Относительный риск Случаи с плацебо ный интервал для лечения до ралоксифеномn/N, % плацебо) риска По меньшей мере 24/3195 18/6681 0,36(0,20, 0,64) 1 месяц По меньшей мере 21/3195 10/6681 0,23(0,11, 0,45) 12 месяцев Таблица 2 Анализ относительного риска рака молочной железы в широкомасштабном (7704 пациентов) исследовании лечения женщин в постклимактерическом периоде с установленным остеопорозом 95% доверительВремя от назначения Случаи с Относительный риск Случаи с плацебо ный интервал для лечения до момента ралоксифеномn/N, % плацебо) риска По меньшей мере 21/2659 12/5317 0,29(0,15, 0,55) 1 месяц По меньшей мере 18/2659 5/5317 0,14(0,06, 0,32) 12 месяцев В этих контролируемых плацебо исследованиях данные ясно указывают, что пациенты, произвольно назначенные в группу ралоксифена, имеют уменьшенное число случаев рака молочной железы по сравнению с пациентами, произвольно назначенными в группу плацебо. Приблизительная оценка относительного риска для всех пациентов, диагностированных по меньшей мере через один месяц после произвольного назначения приема изучаемого лекарственного средства, дает величину 0,36 с 95% доверительным интервалом (0,20, 0,64), показывающую 64% снижение числа случаев рака молочной железы. Когда рассматривается только широкомасштабное исследование по лечению отдельно, приблизительная оценка относительного риска дает величину 0,29 с 95% доверительным интервалом (0,15, 0,55), показывающую 71% снижение числа случаев рака молочной железы. Эти результаты высоко статистически значимы. Вследствие того, что раковые болезни, диагностированные по меньшей мере через 1 год после рандомизации, очень вероятно, представляют раковые болезни, которые клинически ранее не существовали,мы также анализировали эти данные, рассматривая только случаи, которые имели место по меньшой мере через 12 месяцев после рандомизации для изучения лекарственного средства. Для всех контролируемых плацебо объединенных исследований приблизительная оценка относительного риска дает величину 0,23 с 95% доверительным интервалом (0,11, 0,45), соответствующую 77% снижению числа случаев рака молочной железы. Для широкомасштабного исследования лечения приблизительная оценка относительного риска дает величину 0,14 с 95% доверительным интервалом (0,06, 0,32), соответствующую 86% снижению числа случаев карциномы молочной железы. Для дальнейшего анализа появления опухолей в зависимости от продолжительности времени в исследовании в табл. 3 и 4 представлены данные относительного риска, которые разделены на три временных периода 1) случаи, диагностированные по фоновым маммограммам, т.е. все случаи, диагностированные в срок между 1 и 6 месяцами после назначения на исследование лекарственного средства; 2) случаи, диагностированные по маммограммам через 1 год, т.е. все случаи, диагностированные в срок между 6 и 18 месяцами после назначения на исследование лекарственного средства, и 3) случаи, диагностированные по маммограммам через два года, т.е. все случаи, диагностированные в срок между 18 и 30 месяцами после назначения на исследование лекарственного средства. В табл. 3 представлен относительный риск рака молочной железы для каждого периода времени для всех объединенных, контролируемых плацебо исследований. В табл. 4 представлена информация для подгруппы пациентов, указанных в табл. 3, а именно, пациентов в широкомасштабном исследовании лечения 7704 пациентов. Из обеих таблиц очевидно, что относительный риск развития карциномы молочной железы снижается с каждым последующим периодом времени. Относительный риск для обеих групп достигает статистической значимости во временной точке после двух последующих лет.- 10006083 Таблица 3 Ежегодный относительный риск возникновения рака молочной железы всех контролируемых плацебо объединенных исследованийa Относительный 95% доверительМаммограммьгb Случаи плацебо Случаи ралоксифена риск ный интервал Фоновая (1-6 меся 2 5 1,20(0,23, 6,15) цев) В течение последующего года (6-18 6 7 0,56 Рандомизация - отношение ралоксифен:плацебо составляет 2,1:1. Один пациент, который имел карциному молочной железы диагностированную через 30 месяцев, исключен из этого анализа из-за временной категории. Таблица 4 Ежегодный относительный риск возникновения рака молочной железы при широкомасштабном (7704 пациента) исследовании лечения женщин в постклимактерическом периоде с установленным остепороэома Случаи раОтносительный риск 95% доверительМаммограммы Случаи плацебо локсифена ный интервал Фоновая (1-6 меся 2 5 1,25 В качестве резюме, фиг. 1 графически представляет число возникновения случаев рака молочной железы во всех контролируемых плацебо исследованиях. (Один пациент, который имел рак молочной железы, диагностированный через 30 месяцев, исключен из этого графика, так что график представляет приблизительно тот же самый последующий период в обеих группах лечения). Две кривые (для плацебо и ралоксифена) почти неразличимы до временной точки 1 год, после которой они расходятся, причем число случаев рака молочной железы в группе плацебо повышается с большей скоростью, чем в группе ралоксифена. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ профилактики (предотвращения) рака молочной железы у человека, который включает введение упомянутому человеку в течение периода, составляющего по меньшей мере шесть месяцев,соединения формулы(ралоксифена) или его фармацевтически приемлемой соли или сольвата в эффективной дозе, составляющей от 60 до 120 мг/день. 2. Способ по п.1 для снижения вероятности возникновения рака молочной железы у человека. 3. Способ по п.1 для снижения вероятности развития рака молочной железы у человека. 4. Способ по пп.1-3, где упомянутая эффективная доза составляет около 60 мг/день. 5. Способ по п.4, где упомянутый период времени составляет по меньшей мере два года. 6. Способ по п.4, где упомянутый период времени составляет постоянное введение.- 11006083 7. Способ по пп.1-6, где упомянутое соединение представляет его хлористо-водородную соль. 8. Способ по пп.1-7, где упомянутым человеком является женщина в постклимактерическом периоде. 9. Способ по пп.1-8, где у упомянутой женщины в постклимактерическом периоде нет особого риска развития рака молочной железы. 10. Способ по пп.1-9, где упомянутый рак молочной железы является de novo.
МПК / Метки
МПК: A61K 31/4535, A61K 31/381, A61P 35/00
Метки: способ, молочной, профилактики, рака, железы
Код ссылки
<a href="https://eas.patents.su/13-6083-sposob-profilaktiki-raka-molochnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Способ профилактики рака молочной железы</a>
Предыдущий патент: Производные 3, 4-дигидро-1н-изохинолин-2-ила
Следующий патент: Система дозированной выдачи сжатого природного газа
Случайный патент: Насадка для поточного цитометра с высокоэффективной сортировкой клеток












