Способ получения замещенных 4-фенил-4-цианоциклогексановых кислот
Формула / Реферат
1. Способ получения замещённых 4-фенил-4-цианоциклогексановых кислот формулы I

в которой R1 представляет группу -(CR4R5)rR6, в которой алкильные фрагменты могут быть необязательно замещены одним или более галогенами;
r = 0-6;
R4 и R5 независимо выбраны из водорода или C1-2алкила;
R6 представляет C3-6циклоалкил или C4-6циклоалкил, содержащий одну или две ненасыщенные связи, причём циклоалкильные фрагменты могут быть необязательно замещены 1-3 метильными группами или одной этильной группой;
X представляет YR2, галоген, нитро, NH2 или формиламин;
X2 представляет O или NR8;
Y представляет O или S(O)m';
m' представляет 0, 1 или 2;
R2 независимо выбран из -CH3 или -CH2CH3, необязательно замещенных 1 или более галогенами;
R3 представляет водород, галоген, C1-4алкил, CH2NHC(O)C(O)NH2, галогензамещенный C1-4алкил, -CH-CR8'R8', циклопропил, необязательно замещенный R8'; CN, OR8, CH2OR8, NR8R10, CH2NR8R10, C(Z')H, C(O)OR8, C(O)NR8R10, или Cу CR8';
R8 представляет водород или C1-4алкил, необязательно замещенный одним-тремя фторами;
R8' представляет R8 или фтор;
R10 представляет OR8 или R11;
R11 представляет водород или C1-4алкил, необязательно замещенный одним-тремя фторами;
Z' представляет O, NR9, NOR8, NCN, C(-CN)2, CR8CN, CR8NO2, CR8C(O)OR8, CR8C(O)NR8R8, C(-CN)NO2, C(-CN)C(O)OR9, или C(-CN)C(O)NR8R8;
R' и R" независимо представляют водород или -C(O)OT, в котором T представляет водород или Li;
который включает
a) сочетание галогенида металла группы I(a) или группы II(a) с апротонным биполярным растворителем на основе амида и воды и соединением формулы II(a) или II(b),
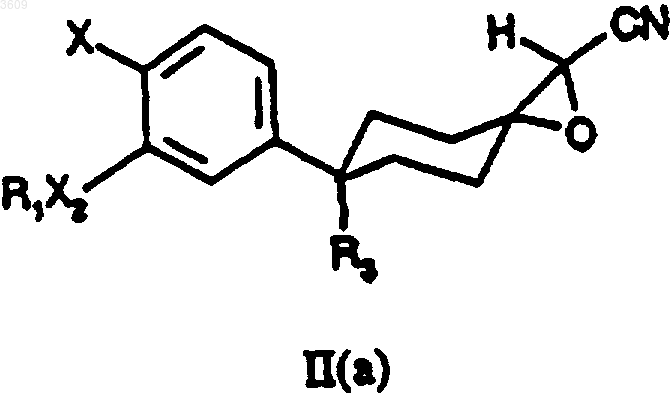

где R1, R3, X2 и X имеют те же значения, что и для формулы (I);
b) нагревание указанного сочетания до температуры, по крайней мере, около 60ш в течение нескольких часов, необязательно в инертной атмосфере;
отличающийся тем, что осуществляют
c) осаждение соединения формулы (I) добавлением достаточного количества LiOH к указанному сочетанию для образования соединения формулы (I), в которой T в группе -C(O)OT представляет Li;
d) удаление растворителя на основе амида и воды из указанного осадка и необязательно
i) дальнейшую очистку Li соли или
ii) подкисление Li соли с получением свободной кислоты.
2. Способ по п.1, в котором продукт представляет соединение, в котором R1 представляет -CH2-циклопропил, циклопентил, 3-гидроксициклопентил, метил или CF2H; X представляет YR2; Y представляет кислород; X2 представляет кислород; R2 представляет CF2H или метил и R3 представляет CN.
3. Способ по п.1 или 2, в котором галогенидом металла группы I(a) или II(a) является галогенид лития или магния.
4. Способ по любому из пп.1-3, в котором галогенидом металла I(a) или II(a) группы является бромид лития или бромид магния.
5. Способ по любому из пп.1-4, в котором апротонным биполярным растворителем на основе амида является диметилформамид, диметилацетамид или N-метилпирролидинон.
6. Способ по любому пп.1-5, в котором галогенидом металла I(a) или II(a) группы является бромид лития, а растворителем на основе амида - диметилформамид.
7. Способ по любому из пп.1-6, в котором вода присутствует в количестве, превышающем 0,1 % по вес/вес содержимого реакционного сосуда.
8. Способ по любому из пп.1-7, в котором соединением формулы II(a) или II(b) является цис-6-[3-(циклопентилокси)-4-метоксифенил]-1-оксаспиро[2.5]октан-2,6-дикарбонитрил.
9. Продукт способа по любому из пп.1-8, который представляет цис-литий-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоксилат.
10. Соединение, которое представляет цис-литий-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоксилат.
11. Композиция, включающая, по существу, чистый цис-литий-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоксилат.
Текст
1 Объем изобретения Данное изобретение охватывает промежуточные соединения и синтетические пути получения 4-циано-4-(3-циклопентилокси-4-метоксифенил)циклогексановой кислоты и ее аналогов. Данная кислота и ее аналоги селективно ингибируют каталитический сайт (участок) изофермента фосфодиэстеразы IV (далее ФДЭIV) и, являясь такими, эти кислоты полезны при лечении множества заболеваний, которые могут быть смягчены путем воздействия на фермент ФДЭ IV и его подтипы. Область изобретения Бронхиальная астма представляет собой сложное, многофакторное заболевание, характеризующееся обратимым сужением дыхательных путей и повышенной реактивностью дыхательных путей по отношению к внешним раздражителям. Идентификация новых терапевтических агентов для астмы затруднена тем, что за развитие заболевания отвечает множество медиаторов. Поэтому, маловероятно, что исключение влияния одного медиатора приведет к существенному воздействию на все основные компоненты хронической астмы. Альтернативой медиаторного подхода является регуляция активности клеток, ответственных за патофизиологию данного заболевания. Одним из таких путей является повышение уровня цАМФ (циклического аденозин 3',5'монофосфата). Было показано, что циклический ДМФ является вторичным посредником, медиирующим биологические ответные реакции на широкий диапазон гормонов, нейромедиаторов и лекарств; т.е. являющимся промежуточным звеном между первым и вторым [Krebs Endocrinology Proceeding of 4th International CongressExcerpta Medica, 17-29, 1973]. Когда подходящий агонист связывается со специфическими рецепторами клеточной поверхности, активируется аденилатциклаза, которая с повышенной скоростью превращает Мg+2-АТФ в цАМФ. Циклический АМФ влияет на активность большинства, если не всех, клеток, которые вносят вклад в патофизиологию внешней (аллергической) астмы. Как таковое, увеличение цАМФ оказывает благоприятное воздействие,включая: 1) расслабление гладкой мускулатуры дыхательных путей, 2) ингибирование высвобождения медиатора тучных клеток, 3) подавление дегрануляции нейтрофилов, 4) ингибирование дегрануляции базофилов, и 5) ингибирование активации моноцитов и макрофагов. Следовательно, соединения, которые активируют аденилатциклазу или ингибируют фосфодиэстеразу должны быть эффективными при подавлении нежелательной активации гладкой мускулатуры дыхательных путей и широкого диапазона воспалительных клеток. Основной клеточный механизм инактивации цАМФ представляет гидролиз 3'-фосфодиэфирной связи с 2 одним или более семействами изоферментов,относимых к циклическим нуклеотидным фосфодиэстеразам (ФДЭ). В настоящее время показано, что определенный циклический нуклеотидфосфодиэстеразный фермент ФДЭ IV, ответственен за разрушение цАМФ в гладкой мускулатуре дыхательных путей и воспалительных клетках [Torphy, "Phosphodiesterase Isozymes: Potential Targets for Novel Anti-asthmatic Agents" in NewServices Ltd., 1989]. Исследования показывают,что ингибирование данного фермента приводит не только к расслаблению гладкой мускулатуры дыхательных путей, но также подавляет дегрануляцию тучных клеток, базофилов и нейтрофилов, наряду с ингибированием активации моноцитов и нейтрофилов. Более того, благоприятное воздействие ингибиторов ФДЭ IV явно усиливается при увеличении аденилатциклазной активности клеток-мишеней под действием соответствующих гормонов или автокоидов, как это имеет место in vivo. Таким образом, ингибиторы ФДЭ IV эффективны в астматических легких, где повышаются уровни простагландина Е 2 и простациклина (активаторов аценилатциклазы). Такие соединения предлагают уникальный подход к фармакотерапии бронхиальной астмы и обладают важными терапевтическими преимуществами по сравнению с агентами, имеющимися в настоящее время в продаже. Способ и промежуточные соединения по данному изобретению предоставляют средства получения определенных 4-замещенных-4-(3,4 дизамещенных фенил)циклогексановых кислот,которые полезны при лечении астмы и других заболеваний, которые могут быть смягчены действием на ФДЭ IV фермент и его подтипы. Конечные продукты представляющие особый интерес, полностью описаны в патенте США 552483, выданном 3 сентября 1996 г. Информация и иллюстрации, представленные здесь, постольку, поскольку данная информация и иллюстрации необходимы для понимания данного изобретения и его реализации на практике,включены здесь для сведения. Краткое изложение сущности изобретения Данное изобретение относится к способу получения соединения формулы I(CR4R5)nC(O)O(CR4R5)mR6, в которых алкильные фрагменты могут быть необязательно замещены одним или более галогенами;R4 и R5 независимо выбраны из водорода или C1-2 алкила;R6 представляет С 3-6 циклоалкил или С 4-6 циклоалкил, содержащий одну или две ненасыщенные связи, в которых циклоалкильные и гетероциклические фрагменты могут быть необязательно замещены 1-3 метильными группами или одной этильной группой; Х представляет YR2, галоген, нитро, NH2 или формиламин; Х 2 представляет O или NR8;R2 независимо выбран из -СН 3 илиR3 представляет водород, галоген, C1-4 алкил, CH2NHC(O)C(O)NH2, галогензамещенный C1-4 алкил, -СН=СR8'R8', циклопропил, необязательно замещенный группой R8', CN, OR8,CH2OR8, NR8R10, CH2NR8R10, C(Z')H, C(O)OR8,C(O)NR8R10, или CCR8';R8 представляет водород или C1-4 алкил,необязательно замещенный одним-тремя фторами;R11 представляет водород или C1-4 алкил,необязательно замещенный одним-тремя фторами;R' и R" независимо представляют водород или -С(O)ОТ, в котором Т представляет водород или Li; способ включает: а) сочетание галогенида металла группыI(а) или группы II(а) с апротонным биполярным растворителем на основе амида и воды и соединением формулы А или В где R1, R3, Х 2 и Х имеют те же значения, что и для формулы (I); б) нагревание указанного сочетания до температуры, по крайней мере, около 60C в течение нескольких часов, необязательно, в инертной атмосфере; отличающийся тем, что осуществляют в) осаждение соединения формулы (I) путем добавления достаточного количества LiOH к указанному сочетанию для образования соединения формулы (I), в которой Т в группе С(О)ОТ представляет Li; г) удаление растворителя на основе амида и воды из указанного осадка и необязательно 1) дальнейшую очистку или Li соли с получением свободной кислоты; или 4 2) подкисление Li соли с получением свободной кислоты. Конкретные варианты воплощения изобретения Данный способ включает синтез некоторых 4-замещенных-4(3,4-дизамещенных фенил)циклогексановых кислот. Он позволяет превращать цианоэпоксид в его соответствующую гомологизированную кислоту с помощью использования промежуточной соли металла группы I(а) или II(b). Соединения, которые получают по данному способу, являются ФДЭ IV ингибиторами. Они полезны для лечения ряда заболеваний,описанных в патенте США 5552438, выданном 3 сентября 1996 г. Предпочтительные соединения,которые могут быть получены по данному способу являются следующими. Предпочтительные R1 заместители для соединений всех указанных формул представляют СН 2-циклопропил, СН 2-С 5-6 циклоалкил, (3- или 4-циклопентенил), бензил, или C1-2 алкил, незамещенный или замещенный одним или несколькими фторами. Предпочтительные Х группы для формулы(I) или (II) являются такими, в которых Х представляет YR2 и Y представляет кислород. Предпочтительной Х 2 группой для формулы (I) является группа, в которой Х 2 представляет кислород. Атомами галогена являются предпочтительно фтор и хлор, более предпочтительно фтор. Более предпочтительные R2 группы представляют такие, в которых R2 представляет метил или фторзамещенные алкилы, в частности,C1-2 алкил, такой как -СF3, -CHF2 или -CH2CHF2 фрагмент. Наиболее предпочтительными являются -CHF2 и -СН 3 фрагменты. Наиболее предпочтительны те соединения,в которых R1 представляет -СН 2-циклопропил,циклопентил, метил или CF2H; Х представляетRS представляет CN. Соли лития этих соединений представляют подгруппу предпочтительных соединений. В частности, предпочтительной является литиевая соль 4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоновой кислоты, т.е. литий-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоксилат. Более конкретно, наиболее предпочтительно соединение цис-литий-4-циано-4-(3-циклопентилокси-4 метоксифенил)-r-1-циклогексанкарбоксилат. Карбоксилаты получают раскрытием эпоксида галогенидом металла I(а) или II(а) группы с получением ацилнитрила, который гидролизуется в кислоту в присутствии воды. Проблема при получении кислоты из ацилнитрила состоит в том, что когда карбоксилат образуется из ацилнитрила,генерируется циановодород(HCN). Проблема последнего состоит в удале 5 нии этого HCN наиболее эффективным с точки зрения стоимости способом. Характерным признаком данного изобретения является средство для более эффективного удаления HCN. Было обнаружено, что если реакция протекает в апротонном биполярном растворителе на основе амида, содержащем воду, то при добавлении сильного основания образуется цианидная соль и остается в растворе, а карбоксилатная соль,которая образуется в то же самое время, осаждается из раствора. Это позволяет собрать осадок и удалить растворитель и с помощью этого удалить наибольшую часть или, по существу,всю цианидную соль из осадка соли алкановой кислоты. Это позволяет избежать проведения стадии дополнительной стадии очистки, такой как окисление HCN. Галогенидами металла группы I(а) илиII(а), используемыми в данном изобретении,являются любые галогениды щелочных металлов и щелочно-земельных металлов, т.е. лития,натрия, калия, рубидия, цезия или франция и бериллия, магния, кальция, стронция, бария или радия. Предпочтительными металлами являются литий и магний. Галогениды включают фторид,хлорид, бромид и иодид. Предпочтительным галогенидом является бромид. Галогениды лития и магния предпочтительны. Бромид лития и бромид магния наиболее предпочтительны. Бромид лития особенно предпочтителен. Что касается растворителей на основе амида, иллюстративными примерами их могут быть диметилформамид (ДМФ), диметилацетамид иN-метилпирролидон и аналогичные ДМФ является наиболее предпочтительным. Может использоваться еще один органический растворитель дополнительно к растворителю на основе амида. Например ацетонитрил успешно использовался в реакции, иллюстрируемой ниже. Обычно в реакционную емкость добавляют воду, поскольку она гидролизует ацилнитрил insitu, давая алкановую кислоту. Следовательно,более предпочтительным воплощением данного изобретения является использование апротонного биполярного растворителя, который смешивается с водой. ДМФ, диметилацетамид и Nметилпирролидон удовлетворяют данному требованию. Хотя необходимо иметь воду в реакционной среде, количество воды может изменяться в широком интервале. Реакция протекает даже, когда присутствует незначительное количество воды. Предпочтительно иметь в реакционном сосуде, по крайней мере и, 1% вес./вес.,вычисленных в расчете как на жидкости, так и на твердые вещества, если какие-либо присутствуют в сосуде. Более предпочтительным количеством воды является, по крайней мере, примерно 1 % вес./вес. и наиболее предпочтительно примерно 1-5% воды по вес./вес. Хотя были испытаны все возможные комбинации систем воды с растворителем на основе амида, известно, что реакция будет протекать с 20% воды(вес./вес.). Исходя из этого, считается, что может использоваться даже более высокий процент воды. Оптимизация соотношений органического растворителя и воды может достигаться специалистами в данной области. Считается,что объемом данного изобретения охватывается использование любого количества воды в сочетании с растворителем на основе амида. Реакция может протекать при любой температуре выше примерно 60 С. Поскольку могут использоваться многочисленные сочетания растворителя на основе амида и воды, не целесообразно устанавливать точный верхний предел температуры, поскольку она будет меняться в зависимости от выбора растворителя и соотношения выбранных растворителей. Галогениды металла I(а) или II(а) групп раскрывают эпоксиды, давая ацилнитрил. Он гидролизуется в кислоту в присутствии воды. Но вместо того, чтобы выделять свободную кислоту, образуют нерастворимую соль карбоксилата путем добавления примерно 2 или более эквивалентов сильного основания в реакционный сосуд. Данное основание образует две соли,соль циклогексановой кислоты и соль HCN, который выделяется при гидролизе ацилнитрильной группы. Цианид метала растворим в растворителе, а соль алкановой кислоты осаждается из раствора. Это позволяет отделить соль алкановой кислоты от цианидной соли с помощью простого удаления растворителя. Изобретение может осуществляться на практике при использовании менее чем 2 экв. основания, но это может привести к нежелательной с экономической точки зрения потере алкановой кислоты, поскольку она не осаждается из раствора. А непрореагировавший HCN может загрязнять алкановую кислоту, которая выпала в осадок из раствора. Следовательно, предпочтительно использовать 2 или более эквивалентов основания. Сильным основанием для целей данного изобретения является гидроксид лития, поскольку соль цианида лития является хорошо растворимой в водном апротонном биполярном растворителе на основе амида, и, таким образом, воздействует более эффективно и более полно удаляет цианидный ион из соли кислоты при удалении растворителя на основе амида. Цианид лития лучше растворим в ДМФ по сравнению с цианидом натрия или цианидом калия. Поэтому более выгодно образовывать катион лития в сильном основании на стадии образования соли данного способа. Предпочтительным осуществлением данного изобретения на практике является такое, при котором растворитель(и) загружают в реакционный сосуд, добавляют бромид лития и затем эпоксид. Когда реакция по существу завершается, добавляют два или более эквивалента водного раствора, гидроксида лития,соль циклогексановой кислоты осаждают из раствора и отфильтровывают, растворитель отбрасывают. Литиевая соль циклогексановой 7 кислоты может дополнительно при необходимости очищаться для удаления остаточных: примесей, таких как цианидные соли или превращаться в кислоту при помощи растворения или суспендирования соли в растворителе и подкисления данного материала для получения свободной кислоты. Схематическое изображение данного способа представлено на схемах I и II. На этих графических изображениях использованы конкретные примеры для иллюстрации общей методики, используемой в данном изобретении. Схема I Схема II иллюстрирует еще один очень похожий перечень условий, которые могут быть использованы в данном изобретении. Эта схема следует по тому же пути, что и на схеме I; но некоторые условия на некоторых стадиях изменены. Химические реакции, представленные на схеме I, описаны в заявке США, находящейся одновременно на рассмотрении,60/061613(поданной 12 февраля 1997 г.), а также в поданной заявке РСТ/US 98/02749, указывающей наряду с другими странами США, опубликованной как WO 98/34584. Данная заявка включена для сведения, особенно что касается химических реакций на стадиях 1-7. Химические реакции в схеме II представлены в РСТ заявке под номером РСТ/ЕР 98/05504, поданной 26 августа 1998 г., также указывающей США в качестве выбранного государства. Полное раскрытие данной заявки включено для сведения. Дополнительно детали данного второго набора химических реакций представлены ниже. Общее описание химических реакций на схемах I и II заключается в следующем. Смесь циклопентилхлорида, изованилина и карбоната калия в диметилформамиде перемешивают при примерно 125 С до тех пор, пока образование циклопентилокси продукта не будет считаться завершенным (приблизительно 2 9 ч). Смесь охлаждают до 20-25 С, твердое вещество (хлорид калия и бикарбонат калия) удаляют путем центрифугирования и промывают метанолом перед отбрасыванием. Диметилформамидные жидкости и промывочный метанол объединяют для использования на следующей стадии. Раствор циклопентилокси соединения в диметилформамиде и метаноле охлаждают до примерно 0 С и обрабатывают боргидридом натрия (примерно 1,5 ч). Температуру поддерживают ниже 5 С. После этого смесь перемешивают при 0-10 С в течение 30 мин и при 2530 С до тех пор, пока реакция восстановления не будет считаться завершенной (примерно 1 ч). Добавляют 50% уксусную кислоту для разрушения избытка боргидрида, диметилформамид и метанол удаляют перегонкой в вакууме. После охлаждения до 20-25 С смесь распределяют между водой и толуолом. Толуольную фазу,содержащую спирт, промывают деминерализованной водой, пропускают через фильтр для использования на следующей стадии. Раствор спирта в толуоле обрабатывают концентрированной соляной кислотой (мин. 36%) при 15-25 С. Органическую фазу, содержащую соединение хлора, отделяют и обрабатывают бикарбонатом натрия для нейтрализации следов НСl. Твердое вещество (хлорид натрия, бикарбонат натрия) удаляют фильтрованием. Раствор соединения хлора концентрируют перегонкой в вакууме. После охлаждения до примерно 20 С, добавляют деминерализованную воду, бромид тетрабутиламмония и цианид натрия. После этого смесь нагревают до 80 С и перемешивают при этой температуре, до тех пор, пока реакция цианидирования не будет считаться завершенной (примерно 2 ч). После охлаждения до 60 С смесь распределяют между водой и толуолом. Толуольную фазу, содержащую цианосоединение промывают деминерализованной водой при 30-25 С,перегоняют в вакууме до минимального объема и добавляют ацетонитрил. Раствор продукта в ацетонитриле непосредственно используют на следующей стадии. Готовят растворы метилакрилата в ацетонитриле и Triton В и ацетонитрила. Примерно 16,6% раствора метилакрилата добавляют к раствору цианосоединения при 25 С. Добавляют,примерно 12,5% раствор Triton В, смесь перемешивают в течение нескольких минут и затем вновь осаждают до 25 С. Добавление в этом порядке повторяют еще три раза, затем добавляют двумя порциями конечные 33% раствора метилакрилата и 50% раствора Triton В. Реакционную смесь перемешивают при 20-25 С до тех пор, пока реакция не будет завершена (приблизительно 2-3 ч). Ацетонитрил удаляют перегонкой в вакууме до минимального объема. Смесь распределяют между циклогексан/толуолом и 10 водой при 50 С. Циклогексан/толуольные фазы,содержащие пимелат, выдерживают в течение примерно 1 ч примерно при 0 С. Продукт отделяют центрифугированием и промывают холодным(0 С) циклогексан/толуолом. Влажный осадок на фильтре сушат в вакууме при максимально 50 С, получая пимелат в виде порошка бежевого цвета. 29% раствор метоксида натрия в метаноле добавляют одной порцией к раствору пимелата в диоксане. Смесь нагревают примерно до 75 С(при кипячении с обратным холодильником) и поддерживают при этой температуре до тех пор,пока образование 2-карбометоксициклогексан 1-она не будет полностью завершенным (приблизительно 1 ч). Большую часть метанола отгоняют и заменяют диоксаном. К смеси, нагретой до кипения с обратным холодильником(примерно 85-88 С), добавляют бикарбонат натрия и деминерализованную воду и поддерживают при данной температуре до тех пор, пока образование циклогексан-1-она не будет полностью завершено (примерно 10 ч). После этого смесь охлаждают до 60 С и добавляют концентрированный раствор соляной кислоты для снижения рН от 10 до 7,5. Большую часть метанола и диоксана удаляют перегонкой в вакууме. После этого смесь распределяют между смесью циклогексан/толуол и водой примерно при 70 С. Органическую фазу, содержащую кетон, дважды промывают деминерализованной водой примерно при 70 С. Раствор продукта охлаждают до 10 С и выдерживают в течение 1 ч при 9-11 С. Продукт отделяют фильтрацией и промывают холодным(10 С) циклогексан/толуолом. Влажный осадок на фильтре сушат в вакууме при максимально 50 С, получая кетон в виде не совсем белого порошка. Дикарбонитрил получают из кетона обработкой кетона хлорацетонитрилом в присутствии неорганического основания и каталитических количеств бензилтриэтиламмонийхлорида(БТЭАХ). Кетон и небольшой избыток хлорацетонитрила в подходящем растворителе, таком как ТГФ, добавляют в смесь сильного основания (водный гидроксид калия) и БТЭАХ и растворителя, смешиваемого с водой, такого как тетрагидрофуран, при пониженной температуре примерно 0 С или около этого. Реакцию поддерживают примерно при данной температуре в течение ее протекания, обычно около 1 ч. Продукт может быть выделен или использован в виде неочищенного масла. Дикарбонитрил превращают в циклогексанкарбоновую кислоту при использовании галогенида металла I(а) или II(а) группы. Данную реакцию проводят путем загрузки в сосуд растворителей; в данном случае в качестве примера которых является ДМФ, ацетонитрил и вода, и галогенида металла I(а) или II(а) группы (пред 11 почтительно примерно 1,5 экв.), представленного LiBr; заполнения сосуда инертным газом; добавления дикарбонитрила А или В или смеси А и В; и нагревания сосуда и его содержимого примерно до 100 С в течение нескольких часов,например 8 ч. Реакционную смесь разбавляют ДМФ и, необязательно, водой. ДобавляютLiOH, растворенный в воде, (предпочтительно примерно 50% молярный избыток). Образуется суспензия. Ее перемешивают при слегка повышенной температуре (40-80 С) в течение часа или примерно часа. Соль лития выделяют с помощью обычных способов. Кислоту получают, например, суспендированием соли лития в органическом растворителе, таком как этилацетат, и обработкой суспензии водной минеральной кислотой. Органический растворитель затем выделяют, осуществляют промывку и концентрирование. Продукт выделяют обычными способами. Следующие примеры приведены для иллюстрации конкретных воплощений данного изобретения, но не ограничения его. То, что сохраняется за изобретателями, представлено в формуле изобретения, прилагаемой к описанию. Конкретные примеры Пример 1. Получение 3-циклопентилокси 4-метоксибензальдегида. Смесь циклопентил/хлорида (8,48 г, 0,08 моль), изованилина (6,12 г, 0,04 моль) и карбоната калия (1,1 г, 0,08 моль) в диметилформамиде (4,04 г) перемешивали в реакторе (100 мл) при 120-125 С в течение 1,5 ч. Отбирали образец для проверки превращения загрузки. Результат (ГХ(газовая хроматография: 0,5% площади изованилина (цель: 1,0% площади). Смесь охлаждали до 20 С и фильтровали для удаления твердого вещества (бикарбоната калия, хлорида калия). Влажный осадок на фильтре промывали метанолом. Пример 2. Получение 3-циклопентилокси 4-метоксибензилового спирта. Диметилформамидные жидкости и промывочный метанол из примера 1 объединяли и переносили в чистый реактор. Добавляли дополнительное количество метанола (8,52 г) и смесь охлаждали до 0 С. Добавляли борогидрид натрия (0,49 г, 0,0129 моль) небольшими порциями в течение 1 ч и 10 мин, поддерживая температуру между 4 и 9 С. Загрузку перемешивали при 7,2-10 С в течение 30 мин и затем нагревали до 25 С. Образец отбирали после 110 мин перемешивания при 25-31 С и анализировали(ГХ), и реакция считалась завершенной. Уксусную кислоту 50% (1,80 г) загружали в реактор для тушения оставшегося боргидрида натрия. В течение данной загрузки поддерживали температуру смеси 24-25 С. Диметилформамид и метанол удаляли перегонкой в вакууме (в конце перегонки: 58 С, 6 мбар (600 Па. После охлаждения до 20-25 С смесь распределяли между водой (3,13 г) и толуолом (28,07 г). Толуольную 12 фазу (содержащую заданное соединение) промывали деминерализованной водой (2,65 г). Пример 3. Получение 4-хлорметил-2 циклопентилокси-1-метоксибензола. Толуольный раствор из примера 2 охлаждали до 20 С и добавляли концентрированную соляную кислоту (37,5%; 9,80 г), поддерживая температуру между 20 и 22,7 С. Образец отбирали через 40 мин после завершения добавления и анализировали (ГХ), и реакция считалась завершенной. Фазы оставляли для разделения и нижнюю, водную фазу отбрасывали. Бикарбонат натрия (1,20 г) загружали в реактор для нейтрализации оставшейся хлористо-водородной кислоты. После перемешивания в течение 15 мин смесь охлаждали до 23 С и фильтровали для удаления твердого вещества (бикарбоната натрия, хлорида натрия). Часть толуола (17,07 г) удаляли перегонкой в вакууме (в конце перегонки: 28 С, 7 мбар (700 Па. Пример 4. Получение 4-цианометил-2 циклопентилокси-1-метоксибензола. После охлаждения раствора из примера 3 до 25 С добавляли хлорид тетрабутиламмония(2,775 г) и цианид натрия (1,976 г, 0,039 моль),смесь нагревали до 80 С и затем перемешивали при 78,1-80,4 С в течение 1 ч и 50 мин. Образец отбирали для проверки превращения загрузки. Добавляли толуол (5,841 г) и деминерализованную воду (8,76 г), фазы оставляли разделяться (примерно при 54 С) и нижнюю, водную фазу отбрасывали. Толуольную фазу (содержащую продукт) промывали деминерализованной водой (13,32 г). Толуол удаляли перегонкой в вакууме (в конце перегонки: 55 С, 1 мбар (100 Па. Пример 5. Получение диметил-4-циано-4(3-циклопентилокси-4-метоксифенил)пимелата. Цианометильное соединение, полученное в примере 4 (9,05 г при 85,4%; 7,73 г при 100%; 0,0334 моль), загружали в реактор (0,5 л) при комнатной температуре. Загружали в реактор ацетонитрил (2856 г) и деминерализованную воду (0,07 г). Приготавливали растворы метилакрилата (6,88 г, 0,029 моль) в ацетонитриле(4,02 г) и метанольного Triton В (40,2% 0,94 г,2,2269 Ммоль Triton В) в ацетонитриле (4,06 г). Первую порцию, примерно 16,6% раствора метилакрилата (1,81 г) добавляли при 20 С. Затем добавляли первую порцию, примерно 12,5% раствора Triton В (0,63 кг). Температура загрузки после добавления составляла 31 С. Затем добавляли при 28 С вторую порцию, примерно 16,6% раствора метилакрилата (1,82 г). Затем добавляли вторую порцию, примерно 12,5% раствора Triton В (0,63 г). Температура загрузки после добавления составляла 36 С. При 35 С добавляли третью порцию, примерно 16,6% раствора метилакрилата (1,81 г). Затем добавляли третью порцию примерно 12,5% раствора Triton В (0,62 г). Температура загрузки после добавле 13 ния составляла 32 С. Добавляли четвертую порцию, примерно 16,6% раствора метилакрилата(1,81 г) при 32 С. Затем добавляли четвертую порцию примерно 12,5% раствора Triton В (0,63 г). Температура загрузки после добавления составляла 36 С. Добавляли при 34 С пятую порцию, примерно 33,2% раствора метилакрилата(3,64 г). Затем добавляли пятую порцию примерно 25% раствора Triton В (1,25 г). Температура загрузки после добавления составляла 38 С. Затем добавляли последнюю порцию примерно 25% раствора Triton В (1,25 г). Температура загрузки после добавления составляла 36 С. Реакционную смесь перемешивали в течение 1,5 ч при 20-25 С. Ацетонитрил удаляли перегонкой в вакууме (в конце перегонки: 59 С,20 мбар (2 кПа. Смесь распределяли примерно при 50 С между смесью циклогексан/толуол(1145,9/254,6 г) и водой (559,8 г). Циклогексан/толуольную фазу (содержащую продукт) промывали деминерализованной водой (559,8 г) при 50-52 С. Для кристаллизации заданного продукта, смесь охлаждали в течение 50 мин до 0 С. Затем в смесь в качестве затравки добавляли пимелат и выдерживали в течение 1 ч при(-1) - 1 С. Пимелат отфильтровывали и промывали циклогексан/толуолом (6,51 г/1,44 г) и выделяли с помощью обычных средств. Пример 6. Получение 4-циано-4-(3 циклопентилокси-4-метоксифенил)циклогексан 1-она. Пимелат, полученный в примере 5 (76,52 г,1,8112 моль), нагружали в реактор (100 мл). Добавляли диоксан (2214 г) и 29,1% метанольный метоксид натрия (0,44 г, 24 ммоль). Смесь нагревали до кипения с обратным холодильником(77 С) и перемешивали при этой температуре в течение 1 ч. Для проверки конверсии загрузки отбирали образец. Метанол удаляли перегонкой(16,82 г дистиллята) при донной температуре 97 С. Потерю диоксана в ходе перегонки компенсировали добавлением свежего диоксана(121,6 г). Добавляли бикарбонат натрия (22,2 г,26 ммоль) и деминерализованную воду (2,47 г). Смесь нагревали до кипения с обратным холодильником (87 С) и перемешивали примерно при 87 С в течение 10 ч. Для проверки конверсии загрузки отбирали образец. Содержимое реактора охлаждали до 78 С. Для моделирования струи жидкости добавляли диоксан (0,13 г) и деминерализованную воду (0,12 г). После охлаждения до 60 С добавляли концентрированную соляную кислоту (37%, 0,265 г) для доведения рН до 7,5. Диоксан, метанол и часть воды(27,73 г дистиллята) удаляли перегонкой в вакууме (в конце перегонки: 66 С, 305 мбар (30,5 кПа. При перемешивании в реактор загружали циклогексан (180,0 г) и толуол (65,5 г). Смесь нагревали до 70 С и фазы оставляли разделяться при 70 С и нижнюю, водную фазу отбрасывали. Органическую фазу, содержащую заданный 14 кетон, промывали двумя порциями деминерализованной воды (169,4 г всего) примерно при 70 С. Для моделирования струи жидкости в реактор добавляли циклогексан (165,0 г). Для кристаллизации продукта, загрузку охлаждали в течение 1 ч до 10 С. Затем ее выдерживали в течение 6 ч при 9-11 С для завершения кристаллизации. Продукт отфильтровывали и 1 ч промывали циклогексан/толуолом(81,5 г/27,2 г). Пример 7. Получение цис-6-[3-(циклопентилокси)-4-метоксифенил)]-1-оксаспиро[2.5] октан-2,6-дикарбонитрила. 500 мл круглодонную колбу, оснащенную воздушной мешалкой, внутренним термометром и вводом азота, заполняли азотом. В колбу загружали 50% гидроксид калия в воде (22,0 г) и тетрагидрофуран (55,0 мл). При перемешивании при комнатной температуре добавляли бензилтриэтиламмонийхлорид (0,81 г, 35 ммоль, 0,05 экв.). Раствор охлаждали до 0 С. Через воронку с уравновешиванием давления загружали раствор, содержащий тетрагидрофуран (55,0 мл), 4 циано-4-(3-циклопентилокси-4-метоксифенил) циклогексан-1-он (23,0 г, 73 ммоль, 1,0 экв.) и хлороацетонитрил (5,9 г, 78 ммоль, 1,07 экв.) при комнатной температуре. При перемешивании содержимого колбы при 0 С раствор в воронке добавляли в течение 15 мин. Температуру поддерживали между 0 и 5 С и перемешивали в течение одного часа. Реакционную смесь подогревали до 25 С, разбавляли водой (90,0 мл) и этилацетатом (90,0 мл). Раствор перемешивали и оставляли отстаиваться в течение 30 мин. Слои разделялись, органический слой отделяли и концентрировали перегонкой в вакууме до остатка. Добавляли метилциклогексан/ТГФ (5:1)(54,0 мл) и раствор нагревали до 60 С, затем охлаждали до 20 С в течение 90 мин; продукт начинал кристаллизоваться примерно при 40 С. Суспензию затем охлаждали до 0 С и выдерживали при от - 0 до 5 С в течение 2 ч. Продукт отфильтровывали и промывали смесью метанола (46,0 мл) при 0 С. Продукт сушился, давая заданный продукт в виде белого кристаллического твердого вещества. Пример 8. Получение цис-литий-4-циано 4-(3-циклопентилокси-4-метоксифенил)-r-1 циклогексанкарбоксилата, 2. В 1,0 л 3-горлую круглодонную колбу, оснащенную воздушной мешалкой, внутренним термометром и дефлегматором, соединенным с каустическим скруббером, загружали диметилформамид (200 мл), ацетонитрил (200 мл), бромид лития (32,4 г, 0,37 моль) и воду (5,6 г, 0,31 моль). Суспензию перемешивали до тех пор,пока раствор не становился прозрачным, с по 15 следующим добавлением цис-6-[3-(циклопентилокси)-4-метоксифенил)]-1-оксаспиро[2.5] октан-2,6-дикарбонитрила, 1, (90,0 г, 0,25 моль). Содержимое колбы нагревали при температуре между 90 и 95 С в течение 8-12 ч. Реакционную смесь охлаждали до 60 С и разбавляли диметилформамидом (270 мл). К раствору янтарного цвета (60 С) быстро добавляли водный раствор гидроксида лития (21,65 г, 0,51 моль моногидрат гидроксида лития, растворенный в 112,5 мл воды). Суспензию перемешивали при 60 С в течение 1 ч, охлаждали до 5 С и оставляли при 5 С на 1 ч. Суспензию фильтровали, промывали этилацетатом (100 мл) и сушили на воздухе,получая 2 с соответствующим выходом 79,5%. Пример 9. Получение цис-4-циано-4-(3 циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоксилата, 3. В 1,0 л 3-горлую круглодонную колбу, оснащенную воздушной мешалкой и внутренним термометром, добавляли цис-литий-4-циано-4(3-циклопентилокси-4-метоксифенил)-r-1 циклогексанкарбоксилат, 2 (58,5 г, 0,167 моль) и этилацетат (500 мл). Светлую суспензию перемешивали при комнатной температуре с последующим добавлением 3N водной НСl (70 мл,0,21 моль). Реакционную смесь перемешивали в течение 10 мин и переносили в делительную воронку. Органический слой выделяли и промывали один раз водой (1000 мл). Органический слой отделяли и фильтровали в чистую 1,0 л 3 горлую круглодонную колбу, оснащенную дистилляционной насадкой и воздушной мешалкой. Реакционную смесь концентрировали отгонкой этилацетата (200 мл). Содержимое колбы охлаждали до 60 С с последующим добавлением гептана (275 мл). Суспензию охлаждали до 5 С,выдерживали при 5 С в течение 2 ч, фильтровали и промывали холодным (5 С) гептаном (50 мл). Продукт сушили в вакуумной печи до постоянного веса, получая 50,0 г (85%) соединения 3.R4 и R5 независимо выбраны из водорода или C1-2 алкила;R6 представляет С 3-6 циклоалкил или С 4-6 циклоалкил, содержащий одну или две ненасыщенные связи, причм циклоалкильные фрагменты могут быть необязательно замещены 1-3 метильными группами или одной этильной группой; Х представляет YR2, галоген, нитро, NH2 или формиламин; Х 2 представляет О или NR8;R2 независимо выбран из -СН 3 илиR8 представляет водород или С 1-4 алкил,необязательно замещенный одним-тремя фторами;R11 представляет водород или С 1-4 алкил,необязательно замещенный одним-тремя фторами;R' и R" независимо представляют водород или -С(O)ОТ, в котором Т представляет водород или Li; который включает а) сочетание галогенида металла группыI(а) или группы II(а) с апротонным биполярным растворителем на основе амида и воды и соединением формулы II(а) или II(b) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения замещнных 4-фенил 4-цианоциклогексановых кислот формулы I в которой R1 представляет группу -(CR4R5)rR6, в которой алкильные фрагменты могут быть необязательно замещены одним или более галогенами; где R1, R3, Х 2 и Х имеют те же значения, что и для формулы (I);b) нагревание указанного сочетания до температуры, по крайней мере, около 60 в течение нескольких часов, необязательно в инертной атмосфере; отличающийся тем, что осуществляютc) осаждение соединения формулы (I) добавлением достаточного количества LiOH к ука 17 занному сочетанию для образования соединения формулы (I), в которой Т в группе -С(О)ОТ представляет Li;d) удаление растворителя на основе амида и воды из указанного осадка и необязательноii) подкисление Li соли с получением свободной кислоты. 2. Способ по п.1, в котором продукт представляет соединение, в котором R1 представляетYR2; Y представляет кислород; Х 2 представляет кислород; R2 представляет СF2 Н или метил и R3 представляет CN. 3. Способ по п.1 или 2, в котором галогенидом металла группы I(а) или II(а) является галогенид лития или магния. 4. Способ по любому из пп.1-3, в котором галогенидом металла I(а) или II(а) группы является бромид лития или бромид магния. 5. Способ по любому из пп.1-4, в котором апротонным биполярным растворителем на основе амида является диметилформамид, диметилацетамид или N-метилпирролидинон. 18 6. Способ по любому пп.1-5, в котором галогенидом металла I(а) или II(а) группы является бромид лития, а растворителем на основе амида - диметилформамид. 7. Способ по любому из пп.1-6, в котором вода присутствует в количестве, превышающем 0,1% вес./вес. содержимого реакционного сосуда. 8. Способ по любому из пп.1-7, в котором соединением формулы II(a) или II(b) является цис-6-[3-(циклопентилокси)-4-метоксифенил]-1 оксаспиро[2.5]октан-2,6-дикарбонитрил. 9. Продукт способа по любому из пп.1-8,который представляет цис-литий-4-циано-4-(3 циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоксилат. 10. Соединение, которое представляет цислитий-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоксилат. 11. Композиция, включающая, по существу,чистый цис-литий-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-1-циклогексанкарбоксилат.
МПК / Метки
МПК: C07C 51/08, C07D 303/46
Метки: способ, кислот, замещенных, 4-фенил-4-цианоциклогексановых, получения
Код ссылки
<a href="https://eas.patents.su/10-3609-sposob-polucheniya-zameshhennyh-4-fenil-4-cianociklogeksanovyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения замещенных 4-фенил-4-цианоциклогексановых кислот</a>
Предыдущий патент: 4-(аминометил)пиперидинбензамиды для лечения желудочно-кишечных расстройств
Следующий патент: Гербицидная смесь, содержащая замещенное 3-гетероциклилом производное бензоила, азотосодержащее удобрение и вспомогательный агент
Случайный патент: Охлаждающее устройство для сыпучего материала, имеющее уплотнительное устройство между соседними транспортирующими планками