Бензамиды 4-(аминометил) пиперидина как 5нт4-антагонисты
Номер патента: 8504
Опубликовано: 29.06.2007
Авторы: Босман Жан-Поль Рене Мари Андре, Мевеллек Лоранс Анн, Гейсен Хенрикус Якобус Мария
Формула / Реферат
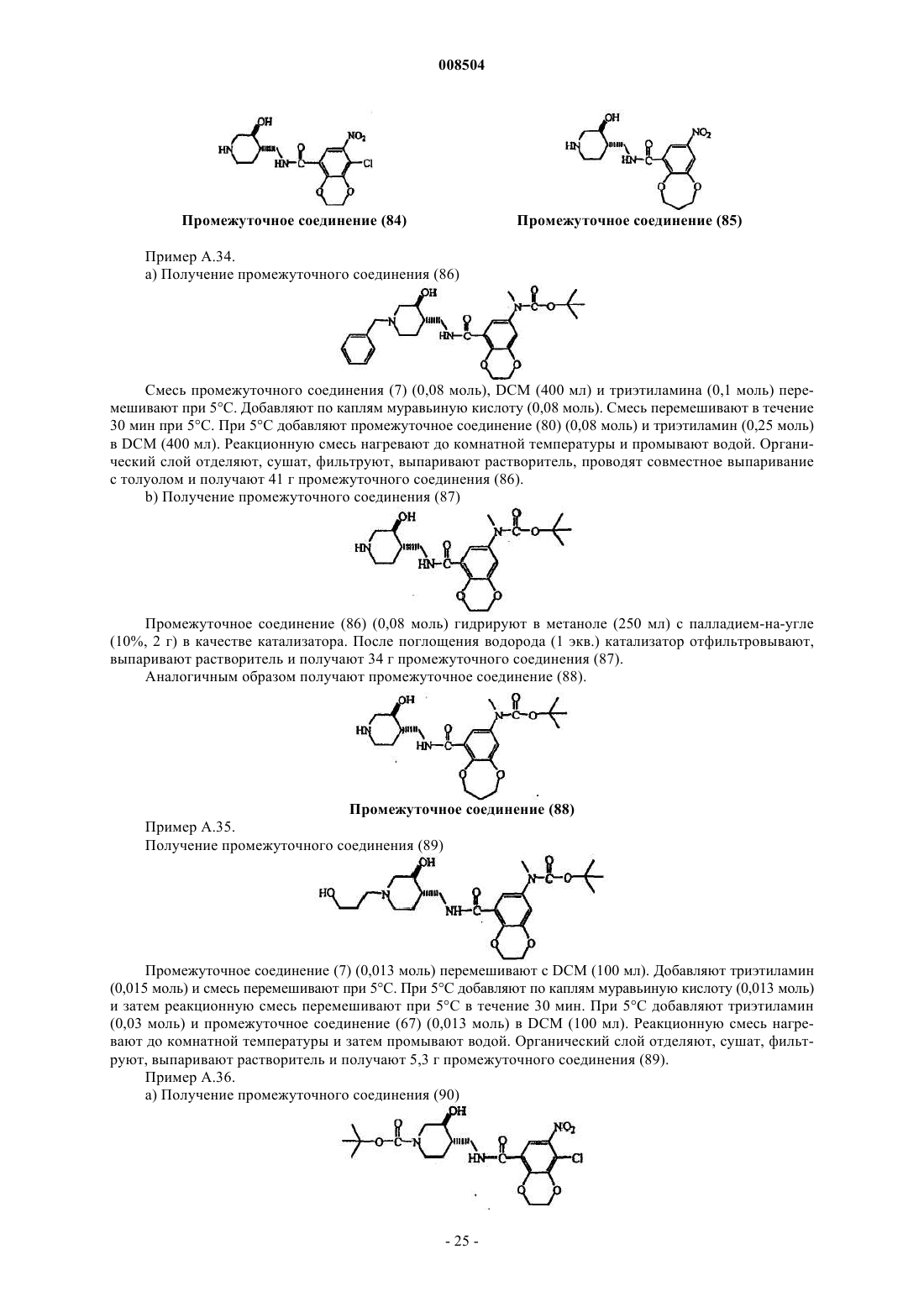
1. Соединение формулы (I)
его стереохимически изомерная форма, его N-оксидная форма или его фармацевтически приемлемая соль присоединения кислоты или основания, где
-R1-R2- представляет собой двухвалентный радикал формулы
| -О-СН2-О- | (а-1), |
| -О-СН2-СН2- | (а-2), |
| -О-СН2-СН2-О- | (а-3), |
| -О-СН2-СН2-СН2- | (а-4), |
| -О-СН2-СН2-СН2-О- | (а-5), |
| -О-СН2-СН2-СН2-СН2- | (а-6), |
| -О-СН2-СН2-СН2-СН2-О- | (а-7), |
| -О-СН2-СН2-СН2-СН2-СН2- | (а-8), |
где в указанных двухвалентных радикалах, необязательно, 1 или 2 атома водорода у одного и того же или разных атомов углерода могут быть заменены C1-6-алкилом или гидрокси;
R3 представляет собой водород, галоген, С1-4-алкил;
R4 представляет собой C1-6-алкил; C1-6-алкил, замещенный циано или C1-6-алкилокси; C1-6-алкилокси; циано; амино или моно- или ди(C1-6-алкил)амино;
R5 представляет собой водород или C1-6-алкил и радикал -OR5 располагается в положении 3 или 4 пиперидиновой группы;
L представляет собой водород или L представляет собой радикал формулы
| -Alk-R6 | (b-1), |
| -Alk-X-R7 | (b-2), |
| -Alk-Y-C(=O)-R9 | (b-3) |
или
| -Alk-Z-C(=O)-NR11R12 | (b-4), |
где каждый Alk представляет собой C1-12-алкандиил; и
R6 представляет собой водород; гидрокси; циано; С3-6-циклоалкил; C1-6-алкилсульфониламино; арил или Het;
R7 представляет собой C1-6-алкил; C1-6-алкил, замещенный гидрокси; С3-6-циклоалкил; арил или Het;
X представляет собой О, S, SO2 или NR8, причем указанный R8 представляет собой водород или C1-6-алкил;
R9 представляет собой водород, C1-6-алкил, С3-6-циклоалкил, гидрокси или арил;
Y представляет собой непосредственную связь или NR10, где R10 представляет собой водород или C1-6-алкил;
Z представляет собой непосредственную связь, О, S или NR10, где R10 представляет собой водород или C1-6-алкил;
R11 и R12 представляют собой, каждый независимо, водород, C1-6-алкил, С3-6-циклоалкил или R11 и R12, объединенные с атомом азота, к которому R11 и R12 присоединены, могут образовывать пирролидинильный, пиперидинильный, пиперазинильный или 4-морфолинильный цикл, причем оба, необязательно, замещены C1-6-алкилом;
арил представляет незамещенный фенил или фенил, замещенный одним, двумя или тремя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси, C1-6-алкила, C1-6-алкилокси, C1-6-алкилкарбонила, нитро, трифторметила, амино, аминокарбонила и аминосульфонила; и
Het представляет собой фуранил; фуранил, замещенный C1-6-алкилом или галогеном; тетрагидрофуранил; тетрагидрофуранил, замещенный C1-6-алкилом; диоксоланил; диоксоланил, замещенный C1-6-алкилом; диоксанил; диоксанил, замещенный C1-6-алкилом; тетрагидропиранил; тетрагидропиранил, замещенный C1-6-алкилом; 2,3-дигидро-2-оксо-1Н-имидазолил; 2,3-дигидро-2-оксо-1Н-имидазолил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена или C1-6-алкила; пирролидинил; пирролидинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси или C1-6-алкила; пиридинил; пиридинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси или C1-6-алкила; пиримидинил; пиримидинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси или C1-6-алкила; пиридазинил; пиридазинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа гидрокси, C1-6-алкилокси, C1-6-алкила или галогена; пиразинил; пиразинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа гидрокси, C1-6-алкилокси, C1-6-алкила или галогена.
2. Соединение по п.1, где
-R1-R2- представляет собой двухвалентный радикал формулы
| -О-СН2-СН2-О- | (а-3), |
| -О-СН2-СН2-СН2-О- | (а-5), |
R3 представляет собой водород, галоген, C1-4-алкил;
R4 представляет собой C1-6-алкил; C1-6-алкил, замещенный циано или C1-6-алкилокси; C1-6-алкилокси; циано; амино или моно- или ди(C1-6-алкил)амино;
R5 представляет собой водород или C1-6-алкил и радикал -OR5 располагается в положении 3 или 4 пиперидиновой группы;
L представляет собой водород или L представляет собой радикал формулы
| -Alk-R6 | (b-1), |
| -Alk-X-R7 | (b-2), |
| -Alk-Y-C(=O)-R9 | (b-3) |
или
| -Alk-Z-C(=O)-NR11R12 | (b-4), |
где каждый Alk представляет собой C1-12-алкандиил; и
R6 представляет собой водород; гидрокси; циано; С3-6-циклоалкил; С1-6-алкилсульфониламино; арил или Het;
R7 представляет собой C1-6-алкил; C1-6-алкил, замещенный гидрокси; С3-6-циклоалкил; арил или Het;
X представляет собой О, S, SО2 или NR8; причем указанный R8 представляет собой водород или C1-6-алкил;
R9 представляет собой C1-6-алкил или гидрокси;
Y представляет собой непосредственную свячь;
Z представляет собой непосредственную связь или О,
R11 и R12 представляют собой, каждый независимо, водород или C1-6-алкил или R11 и R12, объединенные с атомом азота, к которому присоединены R11 и R12, могут образовывать пирролидинил или пиперазинил, замещенный C1-6-алкилом;
арил представляет незамещенный фенил или фенил, замещенный одним, двумя или тремя заместителями, выбраными, каждый независимо, из числа галогена, гидрокси, С1-6-алкила, C1-6-алкилокси и аминосульфонила; и
Het представляет собой тетрагидрофуранил; тетрагидрофуранил, замещенный C1-6-алкилом; диоксоланил; диоксоланил, замещенный C1-6-алкилом; пиридинил; пиридинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси, C1-6-алкила; пиримидинил; пиримидинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси или C1-6-алкила; пиридазинил; пиридазинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа гидрокси, C1-6-алкилокси, C1-6-алкила или галогена; пиразинил; пиразинил, замещенный одним или двумя заместителями, выбиранными, каждый независимо, из числа гидрокси, C1-6-алкилокси, C1-6-алкила или галогена.
3. Соединение по п.1 или 2, где радикал -OR5 располагается в положении 3 пиперидиновой группы, имеющей транс-конфигурацию.
4. Соединение по п.3, где абсолютной конфигурацией указанной пиперидиновой группы является (3S,4S)-конфигурация.
5. Соединение по любому из предшествующих пунктов, где -R1-R2- представляет собой радикал формулы (а-5); R3 представляет собой водород; R4 представляет собой метил; и R5 представляет собой водород.
6. Соединение по п.5, где L представляет собой радикал формулы (b-2), где X представляет собой О; Alk представляет собой C1-4-алкандиил; и R7 представляет собой C1-6-алкил.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-6.
8. Способ получения фармацевтической композиции по п.7, где терапевтически эффективное количество соединения по любому из пп.1-6 тщательно смешивают с фармацевтически приемлемым носителем.
9. Применение соединения по любому из пп.1-6 в качестве лекарственного средства.
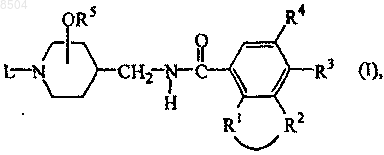
10. Способ получения соединения формулы (I), где промежуточное соединение формулы (II) вводят во взаимодействие с производным карбоновой кислоты формулы (III) или ее реакционноспособным функциональным производным
где на приведенной выше схеме реакции радикалы -R1-R2-, R3, R4, R5 и L имеют значения, указанные в п.1;
и, в случае необходимости, соединения формулы (I) превращают одно в другое известными в данной области техники последующими реакциями преобразований; или, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты, или, напротив, соль присоединения кислоты соединения формулы (I) превращают обработкой щелочью в форму свободного основания; и причем, если желательно, получают его стереохимически изомерную форму.
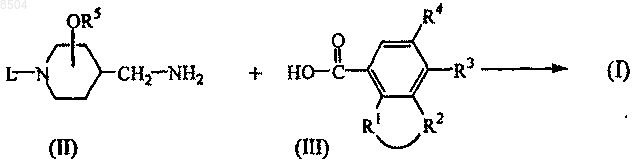
11. Способ получения соединения формулы (I), где
промежуточное соединение формулы (IV) N-алкилируют соединением формулы (I-а), определяемым как соединение формулы (I), где L представляет водород, в растворителе, инертном для реакции, и, необязательно, в присутствии подходящего основания, причем таким образом получают соединения формулы (I-b), определяемые как соединения формулы (I), где L иной, чем водород,

где на приведенной выше схеме реакции радикалы -R1-R2-, R3, R4, R5 и L имеют значения, указанные в п.1, и W представляет собой подходящую удаляемую группу;
и, в случае необходимости, соединения формулы (I) превращают одно в другое известными в данной области техники последующими реакциями преобразований; или, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты, или, напротив, соль присоединения кислоты соединения формулы (I) превращают обработкой щелочью в форму свободного основания; и причем, если желательно, получают его стереохимически изомерную форму.
12. Способ получения соединения формулы (I), где
соответствующий промежуточный кетон или альдегид формулы L'=O (V), причем указанный L'=O представляет собой соединение формулы L-H, где 2 геминальных атома водорода в C1-12-алкандиильной группе заменены =O, вводят во взаимодействие с соединением формулы (I-а), причем таким образом получают соединения формулы (I-b)
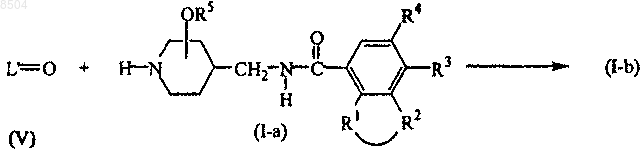
где на приведенной выше схеме реакции радикалы -R1-R2-, R3, R4, R5 и L имеют значения, указанные в п.1;
и, в случае необходимости, соединения формулы (I) превращают одно в другое известными в данной области техники последующими реакциями преобразований; или, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты, или, напротив, соль присоединения кислоты соединения формулы (I) превращают обработкой щелочью в форму свободного основания; и причем, если желательно, получают его стереохимически изомерную форму.
Текст
008504 Настоящее изобретение относится к новым соединениям формулы (I), обладающим свойствами 5 НТ 4-антагонистов. Изобретение также относится к способам получения таких новых соединений, фармацевтическим композициям, содержащим указанные новые соединения, а также к применению указанных соединений в качестве лекарственного средства. В WO-00/37461 раскрываются бициклические бензамиды 3- или 4-замещенных производных 4-(аминометил)пиперидина, обладающие свойствами 5 НТ 4-антагонистов. Соединения настоящего изобретения отличаются от названных известных в технике соединений структурно наличием функциональной группы в положении 4 бензамидной группы, которая иная, чем водород или галогеногруппа. Что неожиданно, соединения формулы (I) настоящего изобретения обладают свойствами метаболической устойчивости, улучшенными по сравнению с соединениями, раскрываемыми в WO-00/37461. Настоящее изобретение относится к соединениям формулы (I) их стереохимически изомерным формам, их N-оксидным формам или их фармацевтически приемлемым солям присоединения кислот или оснований, где -R1-R2- представляет собой двухвалентный радикал формулы-О-СН 2-О(а-1),-О-СН 2-СН 2(а-2),-О-СН 2-СН 2-О(а-3),-О-СН 2-СН 2-СН 2(а-4),-О-СН 2-СН 2-СН 2-О(а-5),-О-СН 2-СН 2-СН 2-СН 2(a-6),-О-СН 2-СН 2-СН 2-СН 2-О(а-7),-О-СН 2-СН 2-СН 2-СН 2-СН 2(а-8),где в указанных двухвалентных радикалах, необязательно, 1 или 2 атома водорода у одного и того же или разных атомов углерода могут быть заменены C1-6-алкилом или гидрокси,R3 представляет собой водород, галоген, C1-4-алкил;R4 представляет собой C1-6-алкил; C1-6-алкил, замещенный циано или C1-6-алкилокси; С 1-6-алкилокси; циано; амино или моно- или ди(C1-6-алкил)амино;R5 представляет собой водород или C1-6-алкил и радикал -OR5 располагается в положении 3 или 4 пиперидиновой группы;L представляет собой водород или L представляет собой радикал формулыX представляет собой О, S, SO2 или NR8, причем указанный R8 представляет собой водород или С 1-6-алкил;Y представляет собой непосредственную связь или NR10, где R10 представляет собой водород илиZ представляет собой непосредственную связь, О, S или NR10, где R10 представляет собой водород или C1-6-алкил;R , объединенные с атомом азота, к которому R11 и R12 присоединены, могут образовывать пирролидинильный, пиперидинильный, пиперазинильный или 4-морфолинильный цикл, причем оба, необязательно, замещены C1-6-алкилом; арил представляет незамещенный фенил или фенил, замещенный одним, двумя или тремя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси, C1-6-алкила, C1-6-алкилокси, C1-6 алкилкарбонила, нитро, трифторметила, амино, аминокарбонила и аминосульфонила; иHet представляет собой фуранил; фуранил, замещенный C1-6-алкилом или галогеном; тетрагидрофуранил; тетрагидрофуранил, замещенный C1-6-алкилом; диоксоланил; диоксоланил, замещенный C1-6-алкилом; диоксанил; диоксанил, замещенный C1-6-алкилом; тетрагидропиранил; тетрагидропиранил, заме-1 008504 щенный C1-6-алкилом; 2,3-дигидро-2-оксо-1 Н-имидазолил; 2,3-дигидро-2-оксо-1 Н-имидазолил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена или C1-6-алкила; пирролидинил; пирролидинил, замещенный 1 или 2 заместителями, выбранными, каждый независимо, из числа галогена, гидрокси или C1-6-алкила; пиридинил; пиридинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси или C1-6-алкила; пиримидинил; пиримидинил, замещенный одним или двумя заместителями, выбранными, каждый независимо,из числа галогена, гидрокси или C1-6-алкила; пиридазинил; пиридазинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа гидрокси, C1-6-алкилокси, C1-6-алкила или галогена; пиразинил; пиразинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа гидрокси, C1-6-алкилокси, C1-6-алкила или галогена. Используемый в приведенных выше определениях термин "галоген" является общим обозначением фтора, хлора, брома и иода; C1-4-алкил обозначает линейные и разветвленные насыщенные углеводородные радикалы с 1-4 атомами углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2 метилпропил и т.п.; C1-6-алкил является обозначением, включающим C1-4-алкил и его высшие гомологи с 5-6 атомами углерода, такие как, например, 2-метилбутил, пентил, гексил и т.п.; С 3-6-циклоалкил является общим обозначением циклопропила, циклобутила, циклопентила и циклогексила; C1-12-алкандиил обозначает двухвалентные линейные или разветвленные углеводородные радикалы, содержащие от 1 до 12 атомов углерода, такие как, например, метандиил, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил, 1,7-гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10-декандиил, 1,11-ундекандиил, 1,12-додекандиил и их разветвленные изомеры. C1-4-Алкандиил обозначает двухвалентные линейные или разветвленные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, такие как, например, метандиил, 1,2-этандиил, 1,3-пропандиил и 1,4-бутандиил. Термин "стереохимически изомерные формы", используемый в данном описании, определяет все возможные изомерные формы, которыми могут обладать соединения формулы (I). Если не упоминается или не указывается иное, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители в двухвалентных циклических (частично) насыщенных радикалах могут иметь или цис-, или транс-конфигурацию. Соединения, содержащие двойные связи, могут иметь Е- или Z-стереохимию при указанной двойной связи. Безусловно, имеется в виду, что стереохимически изомерные формы соединений формулы (I) охватываются объемом данного изобретения. Подразумевается, что фармацевтически приемлемые соли присоединения кислот и оснований, упоминаемые в данном описании выше, включают формы терапевтически активных нетоксичных солей присоединения кислот и оснований, которые могут образовывать соединения формулы (I). Фармацевтически приемлемые соли присоединения кислот обычно можно получить обработкой формы основания такой подходящей кислотой. К подходящим кислотам относятся, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная,азотная, фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная,пропановая, гликолевая, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная(т.е. бутандиовая), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. И, наоборот, указанные солевые формы можно превратить в форму свободного основания обработкой подходящим основанием. Соединения формулы (I), содержащие кислотный протон, также можно превратить в формы их нетоксичных солей металлов или присоединения аминов обработкой подходящими органическими и неорганическими основаниями. Подходящими формами солей оснований являются, например, соли аммония,соли щелочных и щелочно-земельных металлов, например натриевые, калиевые, магниевые, кальциевые соли и т.п., соли с органическими основаниями, например соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли, образованные с аминокислотами, например аргинином, лизином и т.п. Термин "соль присоединения", используемый в данном описании выше, также включает сольваты,которые могут образовывать соединения формулы (I), а также их соли. Такими сольватами являются,например, гидраты, алкоголяты и т.п. Некоторые соединения формулы (I) также могут существовать в своей таутомерной форме. Подразумевается, что такие формы, хотя они не указываются особо в приведенной выше формуле, входят в объем настоящего изобретения. Например, когда ароматическое гетероциклическое ядро замещено гидрокси, распространенным таутомером может являться, главным образом, кетоформа. Подразумевается, что N-оксидные формы соединений формулы (I), которые можно получить способами, известными в технике, включают такие соединения формулы (I), в которых 1 или несколько атомов азота окислены до N-оксида. В частности, предполагаются такие N-оксиды, где N-окисленным является азот пиперидина. Группа соединений, представляющих интерес, состоит из таких соединений формулы (I), к которым-2 008504 применимо одно или несколько из следующих ограничений:a) -R1-R2- представляет собой радикал формулы (а-3); и/илиb) -R1-R2- представляет собой радикал формулы (а-5); и/илиc) R3 представляет собой водород или галоген; и/илиe) R5 представляет собой водород или метил и радикал -OR5 располагается в положении 3 или 4 пиперидинового цикла; и/илиf) R5 представляет собой водород и радикал -OR5 располагается в положении 3 пиперидинового цикла; и/илиg) R5 представляет собой водород и радикал -OR5 располагается в положении 4 пиперидинового цикла; и/илиi) радикал -OR5 располагается в положении 3 пиперидинового цикла и находится в транс-положении относительно метилена в положении 4 пиперидиновой группы и абсолютной конфигурацией указанной пиперидиновой группы является (3S,4S); и/илиk) L представляет собой радикал формулы (b-1), (b-2), (b-3) или (b-4); илиl) L представляет собой радикал формулы (b-1), где Alk представляет собой С 1-4-алкандиил и R6 представляет собой водород, гидрокси, циано, С 3-6-циклоалкил, C1-6-алкилсульфониламино, арил, представляющий фенил, замещенный галогеном или гидрокси; или Het, представляющий тетрагидрофуранил,диоксоланил, диоксоланил, замещенный C1-4-алкилом, или пиридинил; илиL представляет собой радикал (b-2), где Alk представляет собой C1-4-алкандиил, X представляет О иL представляет собой радикал (b-2), где Alk представляет собой C1-4-алкандиил, X представляетNR8, где R8 представляет собой водород, и R7 представляет собой C1-6-алкил или Het, представляющий пиримидинил или пиразинил, замещенный C1-6-алкилом; илиL представляет собой радикал (b-2), где Alk представляет собой C1-4-алкандиил, X представляет SO2 и R7 представляет собой C1-6-алкил; илиL представляет собой радикал (b-3), где Alk представляет собой C1-4-алкандиил, Y представляет непосредственную связь и R9 представляет собой C1-6-алкил или гидрокси; илиL представляет собой радикал формулы (b-4), где Alk представляет собой C1-4-алкандиил, Z представляет непосредственную связь и R11 и R12, оба представляют собой водород или R11 и R12, объединенные с атомом азота, к которому присоединены R11 и R12, образуют пирролидинил или пиперазинил, замещенный C1-6-алкилом; илиL представляет собой радикал формулы (b-4), где Alk представляет собой C1-4-алкандиил, Z представляет собой О и R11 и R12, объединенные с атомом азота, к которому присоединены R11 и R12, образуют пирролидинил. Другими соединениями, представляющими интерес, являются такие соединения формулы (I), в которых-R1-R2- представляет собой двухвалентный радикал формулыR4 представляет собой C1-6-алкил; C1-6-алкил, замещенный циано или C1-6-алкилокси; C1-6-алкилокси; циано; амино или моно- или ди(C1-6-алкил)амино;R5 представляет собой водород или С 1-6-алкил и радикал -OR5 располагается в положении 3 или 4 пиперидиновой группы;L представляет собой водород или L представляет собой радикал формулыX представляет собой О, S, SO2 или NR8; причем указанный R8 представляет собой водород илиY представляет собой непосредственную связь;Z представляет собой непосредственную связь или О;R11 и R12 представляют собой, каждый независимо, водород или C1-6-алкил или R11 и R12, объединенные с атомом азота, к которому присоединены R11 и R12, могут образовывать пирролидинил или пиперазинил, замещенный C1-6-алкилом; арил представляет незамещенный фенил или фенил, замещенный одним, двумя или тремя заместителями, выбраными, каждый независимо, из числа галогена, гидрокси, C1-6-алкила, C1-6-алкилокси и аминосульфонила; иHet представляет собой тетрагидрофуранил; тетрагидрофуранил, замещенный C1-6-алкилом; диоксоланил; диоксоланил, замещенный C1-6-алкилом; пиридинил; пиридинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси, C1-6-алкила; пиримидинил; пиримидинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа галогена, гидрокси или C1-6-алкила; пиридазинил; пиридазинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа гидрокси, C1-6-алкилокси, C1-6-алкила или галогена; пиразинил; пиразинил, замещенный одним или двумя заместителями, выбранными, каждый независимо, из числа гидрокси, C1-6-алкилокси, C1-6-алкила или галогена. Особыми соединениями являются такие соединения формулы (I), в которых радикал -OR5, представляющий предпочтительно гидрокси или метокси, располагается в положении 3 пиперидиновой группы, имеющей транс-конфигурацию, т.е. радикал -OR5 находится в транс-положении относительно метилена в пиперидиновой группе. Соединениями, заслуживающими большего внимания, являются такие соединения формулы (I), в которых двухвалентный радикал формулы -R1-R2- представляет собой радикал формулы (а-3) или (а-5),радикал -OR5 представляет гидрокси и располагается в положении 3 пиперидиновой группы, имеющей(3S-транс)-конфигурацию, соответствующую абсолютной (3S,4S)-конфигурации указанной пиперидиновой группы. Предпочтительными соединениями являются такие заслуживающие большего внимания соединения, в которых -R1-R2- представляет собой радикал формулы (а-5); R3 представляет собой водород; R4 представляет собой метил; и R5 представляет собой водород. Более предпочтительными соединениями являются такие предпочтительные соединения, в которыхL представляет собой радикал формулы (b-2), где X представляет собой О, Alk представляет собой C1-4 алкандиил и R7 представляет собой C1-6-алкил, предпочтительно метил. Наиболее предпочтительными соединениями являются соединения (87), (125), (158), (159), (162),(163), (165), (168), (177), (183), (184), (185), (186), (187), (200), (202), (211), (225), (228), (229), (246) и (247). Соединения формулы (I) можно получить взаимодействием промежуточного соединения формулы(II) с производным карбоновой кислоты формулы (III) или, необязательно, ее реакционноспособным функциональным производным, таким как, например, карбонилимидазольные производные, галоидангидриды или смешанные ангидриды. Указанное образование амидной связи можно осуществить перемешиванием реагентов в подходящем растворителе, необязательно, в присутствии основания, такого как триэтиламин. Соединения формулы (I-b), определяемые как соединения формулы (I), в которых L иной, чем водород, как правило, можно получить N-алкилированием промежуточного соединения формулы (I-а) промежуточным соединением формулы (IV), где W представляет собой подходящую удаляемую группу,такую как, например, галоген, например фтор, хлор, бром, иод, или в некоторых случаях W может представлять собой сульфонилоксигруппу, например метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси, и подобную реакционноспособную удаляемую группу. Соединения формулы (I-а) определяются как соединения формулы (I), где L представляет водород. Взаимодействие можно осуществить в растворителе, инертном для реакции, таком как, например, ацетонитрил, 2-пентанол, изобутанол, диметилацетамид или ДМФА, и, необязательно, в присутствии подходящего основания, такого как,например, карбонат натрия, карбонат калия, N-метилпирролидон или триэтиламин. Перемешивание может повысить скорость реакции. Взаимодействие обычно можно осуществить при температуре в интервале от комнатной до температуры кипения реакционной смеси.-4 008504 С другой стороны, соединения формулы (I-b) также можно получить восстановительным N-алкилированием соединения формулы (I-а) промежуточным соединением формулы L'=O (V), где L'=O представляет производное формулы L-H, где 2 геминальных атома водорода заменены кислородом, следуя процедурам восстановительного N-алкилирования, известным в технике. Указанное восстановительное N-алкилирование можно осуществить в инертном для реакции растворителе, таком как, например, дихлорметан, этанол, толуол или их смесь, и в присутствии восстановителя, такого как, например, борогидрид, например борогидрид натрия, цианоборогидрид натрия или триацетоксиборогидрид. Также может быть удобным использование водорода в качестве восстановителя в сочетании с подходящим катализатором, таким как, например, палладий-на-угле или платина-на-угле. В случае, когда в качестве восстановителя используют водород, может быть выгодно добавлять к реакционной смеси дегидратирующий агент, такой как, например, трет-бутоксид алюминия. Для того, чтобы предотвратить нежелательное гидрирование некоторых функциональных групп в реагентах и продуктах реакции, также может быть выгодно добавлять в реакционную смесь подходящий каталитический яд,например тиофен или хинолинсеру. Для того, чтобы повысить скорость реакции, можно повысить температуру в интервале от комнатной температуры до температуры кипения реакционной смеси и, необязательно, можно увеличить давление газообразного водорода. Соединения формулы (I-а) можно получить взаимодействием промежуточного соединения формулы (VI), где PG представляет подходящую известную в данной области техники защитную группу, такую как, например, трет-бутоксикарбонильная или бензильная группа, или группу, удаляемую под действием света, с кислотой формулы (III) или ее соответствующим реакционноспособным функциональным производным, таким как, например, карбонилимидазольные производные, и последующим удалением защитной группы из полученного таким образом промежуточного соединения, т.е. удалением PG, известными в технике способами. Соединения формулы (I-c), определяемые как соединения формулы (I), где R3 представляет собой водород и R4 представляет собой амино, можно, как правило, получить N-алкилированием промежуточного соединения формулы (II) производным карбоновой кислоты формулы (III-а). Указанную реакциюN-алкилирования можно осуществить, перемешивая реагенты в подходящем растворителе, необязательно, в присутствии основания, такого как карбонат калия или триэтиламин. Затем за реакцией N-алкилирования следуют процедуры гидрирования с использованием подходящего катализатора, такого как палладий-на-угле. Соединения формулы (I-d), определяемые как соединения формулы (I), где R4 представляет собой метиламино, можно, как правило, получить N-алкилированием промежуточного соединения формулы(II) производным карбоновой кислоты формулы (III-b), где PG представляет собой защитную группу,которую можно удалить в кислой среде, такую как, например, трет-бутилоксикарбонил. Указанную реакцию N-алкилирования можно осуществить, перемешивая реагенты в подходящем растворителе, необязательно, в присутствии основания, такого как карбонат калия или триэтиламин. Затем за реакцией N-алкилирования следует реакция гидролиза в кислой среде для того, чтобы удалить защитную группу PG. Соединения формулы (I) также можно получить превращением соединений формулы (I) одно в другое известными в данной области техники реакциями преобразований. Исходные вещества и некоторые промежуточные соединения являются известными соединениями и доступны коммерчески, или их можно получить согласно обычным способам, как правило, известным в данной области техники. Например, промежуточные соединения формулы (II) можно получить согласно методологиям, описанным в WO-99/02156 или WO-00/37461. Промежуточные соединения формулы (VI) можно получить согласно методам, описанным в WO99/02156 или WO-00/37461 для описанных в них промежуточных соединений формулы (VIII). Соединения формулы (I) при получении способами, описанными выше в данном описании, можно синтезировать в форме рацемических смесей энантиомеров, которые можно отделить один от другого,следуя известным в данной области техники процедурам распределения. Рацемические соединения формулы (I) можно превратить в формы соответствующих солей диастереомеров взаимодействием с подходящей хиральной кислотой. Указанные формы солей диастереомеров затем разделяют, например, селективной или фракционированной кристаллизацией и высвобождают из них энантиомеры с помощью щелочей. Другой способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы также можно получить из соответствующих стереохимически чистых изомерных форм соответствующих исходных веществ, при условии, что взаимодействие происходит стереоспецифически. Предпочтительно, если нужен определенный стереоизомер, указанное соединение следует синтезировать стереоспецифическими способами получения. В таких способах будет выгодно использовать энантиомерно чистые исходные вещества. Соединения формулы (I), их N-оксидные формы, их формы солей присоединения кислот или оснований и их стереоизомерные формы обладают антагонистическими свойствами в отношении 5 НТ 4, как описано в примере С.1. Кроме того, соединения формулы (I) показывают улучшенную метаболическую устойчивость по сравнению со структурно родственными соединениями из WO-00/37461, как описано в примере С.2. Такие выгодные свойства метаболической устойчивости проявляются в пониженной опасности взаимодействия лекарственных средств на уровне ферментов цитохромов Р 450, таких как, например, CYP1A2,CYP3A4, CYP2D6, CYP2C9 и CYP2C19, и, следовательно, соединения настоящего изобретения имеют улучшенный профиль безопасности лекарственного средства. Кроме того, такие выгодные свойства метаболической устойчивости могут создать возможность однократного ежесуточного введения соединений формулы (I) вместо обычного введения активного ингредиента в режиме приема от 2 до 4 раз в сутки, причем посредством этого создается большее удобство для пациента. С учетом 5 НТ 4-антагонистических свойств соединений настоящего изобретения, обсуждаемые соединения, как правило, можно применять при лечении или профилактике желудочно-кишечных состояний,таких как гипермотильность, синдром раздраженного кишечника (IBS), IBS с преобладающей констипацией или диареей, IBS с преобладанием боли или без боли, повышенная чувствительность кишечника, и уменьшении боли, связанной с повышенной желудочно-кишечной чувствительностью и/или активностью. Также предполагается, что соединения формулы (I) применимы при предупреждении или профилактике нарушенной, задержанной или ослабленной желудочной аккомодации, такой как диспепсия. Диспептическими синдромами являются, например, эпигастральное давление, потеря аппетита, ощущение сытости, раннее насыщение, тошнота, рвота, метеоризм и отрыжка воздухом. Соединения формулы (I) также можно применять при лечении других расстройств, связанных с 5 НТ 4, таких как булимия и гиперфагия. Из полезности соединений формулы (I) следует, что настоящее изобретение также относится к способу лечения теплокровных животных, включая людей (как правило, называемых в данном описании пациентами), страдающих от желудочно-кишечных состояний, таких как синдром раздраженного кишечника (IBS). Следовательно, предлагаются способ оказания помощи пациентам, страдающим от таких состояний, как гипермотильность, синдром раздраженного кишечника (IBS), IBS с преобладающей кон-6 008504 стипацией или диареей, IBS с преобладанием боли или без боли, повышенная чувствительность кишечника, и способ уменьшения боли, связанной с повышенной желудочно-кишечной чувствительностью и/или активностью. Соединения формулы (I) также возможно применять при других желудочно-кишечных расстройствах, таких как расстройства, связанные с подвижностью верхнего отдела кишечника. В частности, их потенциально можно применять при лечении желудочных симптомов гастроэзофагеальной рефлюксной болезни, таких как изжога (в том числе эпизодическая изжога, ночная изжога и изжога, вызванная пищей). Кроме того, соединения-антагонисты 5 НТ 4 формулы (I) также могут найти возможное применение при лечении или профилактике повышенной чувствительности мочевого пузыря, сверхактивности мочевого пузыря, симптомов в нижнем отделе мочевого тракта, доброкачественной гипертрофии предстательной железы (ВРН), простатита, гиперрефлексии сжимателя, обструкции выходного отверстия, частого мочеиспускания, никтурии, острого позыва к мочеиспусканию, повышенной чувствительности в тазовой области, неудержания, уретрита, простатодинии, цистита, идиопатической повышенной чувствительности мочевого пузыря, недержания мочи или недержания мочи, связанного с синдромом раздраженного кишечника. В таком случае может быть выгодным комбинирование соединений-антагонистов 5 НТ 4 формулы (I) с альфа-адренорецепторным антагонистом, таким как альфузозин, индорамин, тамсулозин, доксазозин, теразозин, абанохил или празозин, для того, чтобы получить фармацевтические композиции,содержащие такой альфа-адренорецепторный антагонист и антагонист рецептора 5 НТ 4 формулы (I). Следовательно, настоящее изобретение относится к соединениям формулы (I) для применения в качестве лекарственного средства, и в частности к применению соединений формулы (I) для получения лекарственного средства для лечения желудочно-кишечных состояний, таких как гипермотильность, IBS,IBS с преобладающей констипацией или диареей, IBS с преобладанием боли или без боли, повышенная чувствительность кишечника, и уменьшения боли, связанной с повышенной желудочно-кишечной чувствительностью и/или активностью. Предусматриваются как профилактика, так и лечение. Ввиду 5 НТ 4-антагонистических свойств соединений настоящего изобретения такие соединения также можно применять при лечении или предупреждении у людей расстройств ЦНС, связанных с 5 НТ 4. В частности, соединения формулы (I) можно использовать для лечения различных расстройств ЦНС, в том числе лекарственной зависимости, когнитивных расстройств, таких как болезнь Альцгеймера и сенильная деменция; поведенческих расстройств, таких как шизофрения, мания, обсессивно-компульсивное расстройство и расстройства при применении психотропных веществ; расстройств настроения, таких как депрессия, биполярное аффективное расстройство, тревога и паническое расстройство; расстройств регуляции автономной функции, таких как гипертензия и расстройства сна; обсессивно-компульсивных расстройств, включая анорексию и булимию; и психоневрологических расстройств, таких как синдром Жилля де ла Туретта; болезни Гентингтона и других расстройств ЦНС. Для того, чтобы получить фармацевтические композиции данного изобретения, эффективное количество определенного соединения в форме основания или соли присоединения кислоты как активного ингредиента объединяют при тщательном перемешивании с фармацевтически приемлемым носителем,который может принимать самые разные формы, в зависимости от формы препарата, нужного для введения. Такие фармацевтические композиции, желательно, находятся в подходящей единичной дозированной форме, предпочтительно для введения перорально, или ректально, или парентеральной инъекцией. Например, при получении композиций в пероральной дозированной форме можно использовать любую обычную фармацевтическую среду, такую как, например, вода, гликоли, масла, спирты и т.п., в случае жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы, или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие вещества, дезинтегранты и т.п., в случае порошков,пилюль, капсул и таблеток. Из-за легкости введения таблетки и капсулы представляют наиболее благоприятные единичные дозированные формы, и в таком случае используют, очевидно, твердые фармацевтические носители. Для парентеральных композиций носитель, как правило, будет содержать стерильную воду, по меньшей мере, в большой части, хотя могут быть включены другие ингредиенты, например,способствующие растворению. Например, можно получить растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получить суспензии для инъекций, в таком случае можно использовать соответствующие жидкие носители, суспендирующие вещества и подобные вещества. В композициях, подходящих для чрескожного введения, носитель содержит, необязательно, вещество, усиливающее проникновение,и/или подходящее смачивающее вещество, необязательно, в сочетании с подходящими добавками любой природы в малом количестве, которые не вызывают существенного вредного действия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезны при получении нужных композиций. Такие композиции можно вводить различными путями, например в виде трансдермального пластыря,наклейки, в виде мази. Соли присоединения кислот (I) из-за их повышенной водорастворимости по сравнению с формой основания, очевидно, являются более подходящими при получении водных композиций. Получать вышеуказанные фармацевтические композиции в виде единичной дозированной формы особенно выгодно для облегчения введения и равномерности дозировки. Термин "единичная дозированная форма", используемый в данном описании и в формуле изобретения, относится к физически дис-7 008504 кретным единицам, подходящим в качестве единичных дозировок, причем каждая единица содержит предварительно установленное количество активного ингредиента, рассчитанное на получение нужного лечебного действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (в том числе таблетки с насечкой и покрытием), капсулы,пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций, наполненные чайные ложки, наполненные столовые ложки и подобные формы и их отдельные сочетания. Для перорального введения фармацевтические композиции могут принимать формы твердых дозированных форм, например таблеток (как форм, которые можно только глотать, так и форм, которые можно жевать), капсул или желатиновых капсул, полученных обычными способами с фармацевтически приемлемыми эксципиентами, такими как связующие вещества (например, кукурузный крахмал, набухающий в холодной воде, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); лубриканты (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или натрийкрахмалгликолят); или смачивающие вещества (например, лаурилсульфат натрия). На таблетки можно нанести покрытие способами, хорошо известными в технике. Жидкие препараты для перорального введения могут принимать формы, например, растворов, сиропов или суспензий, или они могут присутствовать в виде сухого порошка для восстановления перед применением добавлением воды или другого подходящего носителя. Такие жидкие препараты можно получить обычными способами, необязательно, с фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сорбитный сироп, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрированные съедобные жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, эфиры жирных кислот или этиловый спирт) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подслащивающие вещества включают предпочтительно по меньшей мере одно выраженное подслащивающее вещество, такое как сахарин, натрий- или кальцийсахарин, аспартам, ацесульфамкалий, цикламат натрия, алитам, дигидрохальконовые подслащивающие вещества,монеллин, стевиозид или сукралоза (4,1',6'-трихлор-4,1',6'-тридезоксигалоктосахароза), предпочтительно сахарин, натрий- или кальцийсахарин, и, необязательно, основное подслащивающее вещество, такое как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, сироп гидрированной глюкозы, ксилит,жженый сахар или мед. Выраженные подслащивающие вещества обычно используют в низких концентрациях. Например, в случае натрийсахарина концентарция может колебаться от 0,04 до 0,1% (мас./об.) относительно общего объема конечной композиции и предпочтительно составляет примерно 0,06% в композициях с малой дозировкой и примерно 0,08% в композициях с высокой дозировкой. Основное подслащивающее вещество можно эффективно использовать в больших количествах, колеблющихся от примерно 10 до примерно 35%, предпочтительно от примерно 10 до примерно 15% (мас./об.). Фармацевтически приемлемые флаворанты, которые могут маскировать горький вкус ингредиентов, в композициях с малой дозировкой представляют собой предпочтительно фруктовые ароматизаторы, такие как вишневый, малиновый, черносмородиновый или земляничный ароматизатор. Сочетание двух или нескольких флаворантов может дать очень хорошие результаты. В композициях с высокой дозировкой могут потребоваться более сильные ароматизаторы, такие как жженый сахар-шоколад, ароматизатор мятная свежесть, фантазийный ароматизатор и подобные фармацевтически приемлемые сильные флаворанты. Каждый флаворант может присутствовать в конечной композиции в концентрации, колеблющейся от 0,05 до 1% (мас./об.). Выгодно использовать сочетания указанных сильных флаворантов. Предпочтительно используют флаворант, который не претерпевает каких-либо изменений или потерь вкуса и цвета в кислой среде композиции. Композиции настоящего изобретения могут включать, необязательно, ветрогонное средство, такое как симетикон, альфа-D-галактозидаза и т.п. Соединения изобретения также можно ввести в состав препаратов-депо. Такие длительно действующие композиции можно вводить имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, соединения можно ввести в композицию с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами или в виде плохорастворимых производных, например в виде плохорастворимых солей. Соединения изобретения можно ввести в композиции для парентерального введения инъекцией,обычно внутривенной, внутримышечной или подкожной инъекцией, например инъекцией ударной дозы лекарственного средства или продолжительной внутривенной инфузией. Композиции для инъекций могут находиться в виде единичной дозированной формы, например в виде ампул, или в упаковке с множеством доз, с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать вещества, составляющие композиции, такие как придающие изотоничность, суспендирующие вещества, стабилизаторы и/или диспергирующие вещества. С другой стороны, активный ингредиент может находиться в форме порошка для восстановления подходящим носителем, например апирогенной водой, перед примнением. Соединения изобретения также можно ввести в состав ректальных композиций, таких как суппози-8 008504 тории или удерживающие клизмы, например, содержащих обычные основы для суппозиториев, такие как масло какао или другие глицериды. Для интраназального введения соединения изобретения можно использовать, например, в виде жидкого спрея, в виде порошка или в форме капель. Вообще, предполагается, что терапевтически эффективное количество может составлять от примерно 0,0001 до примерно 1 мг/кг массы тела, предпочтительно от примерно 0,001 до примерно 0,5 мг/кг массы тела. Экспериментальная часть В процедурах, описанных далее, используются следующие аббревиатуры: "ACN" обозначает ацетонитрил, "ТГФ" обозначает тетрагидрофуран, "DCM" обозначает дихлорметан, "DIPE" обозначает диизопропиловый эфир, "EtOAc" обозначает этилацетат, "NH4OAc" обозначает ацетат аммония, "НОАс" обозначает уксусную кислоту, "MIK" обозначает метилизобутилкетон, "ДМФА" обозначает диметилформамид,и "DMA" обозначает диметилацетамид. Для некоторых химикалиев используются формулы, например, NaOH для гидроксида натрия,Na2CO3 для карбоната натрия, К 2 СО 3 для карбоната калия, Н 2 для газа водорода, N2 для газа азота, СН 2 Сl2 для дихлорметана, СН 3 ОН для метанола, NH3 для аммиака, НСl для хлористо-водородной кислоты, NaH для гидрида натрия, СаСО 3 для карбоната кальция и КОН для гидроксида калия. А. Получение промежуточных соединений. Пример А.1. а) Получение промежуточного соединения (1)(1100 мл) перемешивают и кипятят с обратным холодильником в течение 24 ч. Реакционную смесь оставляют на ночь при комнатной температуре. Затем смесь концентрируют и остаток обрабатывают DCM и водой. Водный слой отделяют, промывают DCM и отдельные органические слои собирают, сушат,фильтруют и концентрируют. Продукт реакции сушат и получают 120 г промежуточного соединения (1).b) Получение промежуточного соединения (2) Смесь промежуточного соединения (1) (0,35 моль), К 2 СО 3 (0,77 моль) и бромида тетрабутиламмония (5 г) в 1,2-дибромэтане (42 мл), DMA (680 мл) и 2-пропаноне (1000 мл) перемешивают и кипятят с обратным холодильником (70 С) в течение 20 ч. Добавляют еще DMA (250 мл), и бромид тетрабутиламмония (5 г), и 1-бром-2-хлорэтан (29 мл). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 44 ч. Затем реакционную смесь оставляют охлаждаться до комнатной температуры в течение уикенда. Суспензию фильтруют и фильтрат концентрируют. Концентрат распределяют между водой и толуолом. Отделенный водный слой промывают несколько раз DCM. Отделенные органические слои объединяют, сушат, фильтруют и концентрируют. Остаток кристаллизуют из DIPE и ACN и получают 26 г промежуточного соединения (2) (т.пл. 140 С). с) Получение промежуточного соединения (3) Смесь промежуточного соединения (2) (0,063 моль) и 1 н. раствора NaOH (100 мл) перемешивают и кипятят с обратным холодильником в течение 4 ч. Реакционную смесь охлаждают на ледяной бане. К образовавшемуся осадку добавляют 1 н. соляную кислоту (100 мл). Полученную реакционную смесь нагревают до комнатной температуры, образовавшийся осадок отфильтровывают и сушат и получают 14,5 г промежуточного соединения (3) (т.пл. 234 С). Пример А.2. а) Получение промежуточного соединения (4) Смесь промежуточного соединения (2) (0,089 моль) и метанола (500 мл) гидрируют при 50 С с палладием-на-угле (10%, 3 г) в качестве катализатора в присутствии раствора тиофена (1 мл). После погло-9 008504 щения водорода (3 экв.) катализатор отфильтровывают на декалите, фильтрат упаривают и получают 20,9 г промежуточного соединения (4).b) Получение промежуточного соединения (5) К смеси промежуточного соединения (4) (0,1 моль) и трихлорметана (130 мл) добавляют ангидрид трифторуксусной кислоты (0,11 моль). Реакционную смесь перемешивают в течение 1 ч и смесь концентрируют. Остаток очищают на стеклянном фильтре на силикагеле (элюент СН 2 Сl2/СН 3 ОН, 90/10). Собирают фракции, содержащие продукт, и фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/CH3OH, 98/2). Чистые фракции собирают, выпаривают растворитель и получают 11,0 г промежуточного соединения (5). с) Получение промежуточного соединения (6) Промежуточное соединение (5) (0,036 моль) перемешивают в ДМФА (100 мл) при комнатной температуре в токе азота. В токе азота добавляют по частям гидрид натрия, 60% в парафине (0,0432 моль). Полученную реакционную смесь нагревают до 50 С. Затем в токе азота при 50 С добавляют по каплям иодметан (0,0432 моль). Полученную реакционную смесь перемешивают при 50 С в течение ночи, затем смесь охлаждают до комнатной температуры, выливают в воду (680 мл) и затем экстрагируют толуолом. Органический слой отделяют, сушат, фильтруют и концентрируют и получают 10,8 г промежуточного соединения (6).d) Получение промежуточного соединения (7) Смесь промежуточного соединения (6) (0,0338 моль), 1 н. раствора NaOH (0,07 моль) и воды (60 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, затем добавляют трет-бутилдикарбонат (0,041 моль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем добавляют 1 н. НСl (0,07 моль) и остаток экстрагируют DCM. Органический слой отделяют, сушат, фильтруют и концентрируют и получают 10,0 г промежуточного соединения (7). Пример А.3. а) Получение промежуточного соединения (8) Метиловый эфир 8-хлор-2,3-дигидро-1,4-бензодиоксин-5-карбоновой кислоты (0,44 моль) растворяют в серной кислоте (850 мл). Полученный раствор охлаждают до температуры ниже 0 С. Добавляют по каплям в течение 2 ч азотную кислоту (дымящую, 0,44 моль) в серной кислоте (200 мл). Реакционную смесь перемешивают в течение 45 мин при -10 С и затем выливают в смесь воды со льдом. Экстрагирование DCM дает промежуточное соединение (8).b) Получение промежуточного соединения (9) Смесь промежуточного соединения (8) (0,20 моль) в ТГФ (1000 мл) и NaOH (2 н. раствор, 1000 мл) перемешивают при комнатной температуре в течение 5 ч. ТГФ (700 мл) удаляют выпариванием при 35 С. Водный слой экстрагируют этилацетатом (2 х 750 мл). Водный слой отделяют, охлаждают на ледяной бане и подкисляют концентрированной НСl. Выпавшее в осадок вещество отфильтровывают, промывают водой и сушат и получают 52 г промежуточного соединения (9).- 10008504 Пример А.4. а) Получение промежуточного соединения (10) Смесь промежуточного соединения (8) (0,095 моль) и ТГФ (250 мл) гидрируют при 50 С с платиной-на-угле (5%, 3 г) в качестве катализатора в присутствии раствора тиофена (2 мл). После поглощения водорода (3 экв.) реакционную смесь фильтруют через целит, фильтрат упаривают и получают промежуточное соединение (10).b) Получение промежуточного соединения (11) Раствор промежуточного соединения (10) (0,095 моль) в хлороформе (200 мл) охлаждают на водяной бане, затем добавляют по каплям в течение 20-30 мин ангидрид трифторуксусной кислоты (0,125 г) и реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Растворитель выпаривают,добавляют толуол (150 мл), смесь концентрируют до приблизительно 100 мл и затем добавляют DIPE(300 мл). Полученное выпавшее в осадок вещество отфильтровывают, промывают DIPE и сушат и получают 28,8 г промежуточного соединения (11). с) Получение промежуточного соединения (12) К раствору промежуточного соединения (11) (0,084 моль) в N,N-диметилформамиде (150 мл) при температуре ниже 25 С добавляют по частям NaH (0,09 моль) и реакционную смесь перемешивают в течение 90 мин при комнатной температуре. Добавляют по каплям иодометан (0,09 моль) и смесь перемешивают при комнатной температуре в течение 20 мин. Реакционную смесь выливают в НСl (400 мл,5% водный раствор, охлажденная) и смесь экстрагируют DCM (2 раза по 350 мл). Органический слой отделяют, промывают водой, сушат и выпаривают растворитель. Остаток растворяют в NaOH (200 мл,2 н.) и ТГФ (150 мл) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение 90 мин. Органический растворитель выпаривают, водный щелочной концентрат охлаждают на льду и подкисляют концентрированной НСl. Выпавшее в осадок вещество отфильтровывают и сушат и получают 19,75 г промежуточного соединения (12). Пример А.5. а) Получение промежуточного соединения (13) Смесь метилового эфира 8-амино-2,3-дигидро-1,4-бензодиоксин-5-карбоновой кислоты (0,1 моль) и воды (100 мл) перемешивают при комнатной температуре. При комнатной температуре добавляют по каплям серную кислоту (96%, 11 мл). При комнатной температуре добавляют по каплям смесь NaNO2(0,1 моль) и воды (100 мл). Смесь перемешивают при комнатной температуре в течение 30 мин и получают смесь 1. Смесь Cu(I)Br (0,15 моль), водного раствора НВr (48%, 100 мл) и воды (300 мл) перемешивают при комнатной температуре. При комнатной температуре добавляют по каплям смесь 1. Смесь перемешивают при комнатной температуре в течение 30 мин и затем разбавляют водой (300 мл). Выпавшее в осадок вещество отфильтровывают, промывают водой и разбавляют смесью СН 2 Сl2/СН 3 ОН/Н 2 О (300 мл/100 мл/300 мл). Раствор фильтруют через декалит. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток суспендируют в смеси DIPE/петролейный эфир. Выпавшее в осадок вещество отфильтровывают и сушат и получают 23,2 г метил-8-бром-2,3-дигидро-1,4-бензодиоксин-5-карбоксилатаb) Получение промежуточного соединения (14) Раствор промежуточного соединения (13) (0,12 моль) в серной кислоте (175 мл) охлаждают до 0 С.- 11008504 Добавляют по каплям раствор азотной кислоты (0,12 моль) в серной кислоте (175 мл). Смесь перемешивают при -10 С в течение 10 мин и выливают в смесь воды со льдом. Выпавшее в осадок вещество отфильтровывают, промывают водой и растворяют в DCM. Добавляют воду. Смесь экстрагируют DCM. Органический слой промывают водой, сушат, фильтруют, и выпаривают растворитель, и получают 36 г промежуточного соединения (14). с) Получение промежуточного соединения (15) Смесь промежуточного соединения (14) (0,055 моль), NaOH (300 мл) и ТГФ (300 мл) перемешивают при комнатной температуре в течение ночи. ТГФ выпаривают. Добавляют этилацетат. Смесь экстрагируют этилацетатом. Смесь подкисляют НСl. Выпавшее в осадок вещество перемешивают, затем отфильтровывают, промывают водой (минимальным количеством) и сушат и получают 14,3 г промежуточного соединения (15). Пример А.6. а) Получение промежуточного соединения (16)(0,4 моль) и ацетоне (1000 мл) перемешивают и кипятят с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают, фильтруют и выпаривают растворитель. Остаток растворяют в DCM и раствор промывают водой и водным 2 н. раствором NaOH. Органический слой сушат, фильтруют, и выпаривают растворитель, и получают 30,5 г промежуточного соединения (16).b) Получение промежуточного соединения (17) Раствор промежуточного соединения (16) (0,146 моль) в растворе NaOH (2 н., 400 мл) и ТГФ (400 мл) перемешивают и кипятят с обратным холодильником в течение 18 ч. Реакционную смесь охлаждают и ТГФ удаляют выпариванием. Остаток подкисляют концентрированной НСl. Полученное твердое вещество отфильтровывают, промывают и сушат и получают 26,5 г промежуточного соединения (17). Пример А.7. а) Получение промежуточного соединения (18) Раствор NaNO2 (0,1314 моль) в Н 2 О (29,3 мл) при 0 С добавляют по каплям к смеси промежуточного соединения (4) (0,1195 моль) и 1,5 н. НСl (190 мл). Смесь перемешивают при 10 С в течение 15 мин и при 5 С добавляют по каплям к смеси CuCN (0,1673 моль) и KCN (0,2749 моль) в Н 2 О (293 мл). Смесь перемешивают при 5 С в течение 1 ч, затем 1,5 ч при 60 С, затем охлаждают и фильтруют. Фильтрат экстрагируют диэтиловым эфиром. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель досуха. Остаток растворяют в смеси CH2Cl2/CH3OH, раствор сушат, фильтруют и выпаривают растворитель досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/этилацетат, 98/2). Чистые фракции собирают, выпаривают растворитель досуха и получают 10,4 г промежуточного соединения (18).b) Получение промежуточного соединения (19) Смесь промежуточного соединения (18) (0,0446 моль) и моногидрата гидроксида лития (0,0891 моль) в ТГФ (300 мл) и воде (300 мл) перемешивают при комнатной температуре в течение 20 ч. ТГФ частично выпаривают. Смесь подкисляют 3 н. НСl и экстрагируют этилацетатом. Органический слой отделяют,сушат, фильтруют, и выпаривают растворитель досуха, и получают 9,4 г промежуточного соединения- 12008504 Пример А.8. Получение промежуточного соединения (21) Смесь промежуточного соединения (22) (0,12 моль) и 1 н. раствора NaOH (200 мл) перемешивают и кипятят с обратным холодильником в течение 4 ч. Реакционную смесь оставляют на ночь при комнатной температуре, затем охлаждают на ледяной бане и добавляют 1 н. соляную кислоту (200 мл). Смеси дают нагреться до комнатной температуры, образовавшийся осадок отфильтровывают и получают 26,7 г промежуточного соединения (21). Пример А.9. а) Получение промежуточного соединения (22) Смесь метилового эфира 5-нитро-2,3-дигидроксибензойной кислоты (0,3 моль), карбоната калия(0,66 моль), 1,3-дибромпропана (0,42 моль) и бромида тетра-н-бутиламмония (4,5 г) в 2-пропаноне (900 мл) и DMA (600 мл) перемешивают и кипятят с обратным холодильником в течение 30 ч. Реакционную смесь перемешивают в течение 2 суток при комнатной температуре и затем фильтруют. Растворитель выпаривают и остаток обрабатывают водой и DCM. Органический слой отделяют, сушат, фильтруют и концентрируют. Остаток суспендируют в DIPE, отфильтровывают, сушат и очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/СН 3 ОН, 98/2) и получают 33,5 г промежуточного соединенияb) Получение промежуточного соединения (23) Смесь промежуточного соединения (22) (0,11 моль) и ТГФ гидрируют с палладием-на-угле (10%, 3 г) в качестве катализатора в присутствии раствора тиофена (1 мл). После поглощения водорода (3 экв.) катализатор отфильтровывают на декалите, фильтрат концентрируют и получают 24,7 г промежуточного соединения (23). с) Получение промежуточного соединения (24) Промежуточное соединение (23) (0,11 моль) растворяют в трихлорметане (500 мл) и смесь охлаждают на ледяной бане до температуры ниже 10 С. Добавляют по каплям при той же температуре ангидрид трифторуксусной кислоты (0,14 моль), затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре и затем концентрируют. Остаток кристаллизуют из DIPE при комнатной температуре в течение ночи и получают 5,8 г промежуточного соединения (24).d) Получение промежуточного соединения (25) К смеси промежуточного соединения (24) (0,131 моль) в ДМФА (140 мл) в токе азота добавляютNaH (60%, 0,046 моль). Смесь перемешивают при комнатной температуре в течение 1 ч, добавляют по каплям иодметан (0,046 моль). Смесь перемешивают при температуре 50 С в течение ночи, затем охлаждают до комнатной температуры, выливают в смесь воды со льдом и экстрагируют толуолом. Органический слой промывают водой, сушат, фильтруют и выпаривают растворитель. Добавляют петролейный эфир, декантируют, остаток греют в петролейном эфире и раствор снова декантируют. Остаток концентрируют и получают 12,8 г промежуточного соединения (25).e) Получение промежуточного соединения (26) Смесь промежуточного соединения (25) (0,0294 моль), раствора NaOH (1M, 0,059 моль) и воды (60 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают на ледяной бане до комнатной температуры. Затем добавляют трет-бутилдикарбонат (0,036 моль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Добавляют НСl (1 н., 0,0059 моль) и продукт реакции экстрагируют DCM. Органический слой отделяют, сушат, фильтруют и концентрируют и получают 10,8 г промежуточного соединения (26). Пример А.10. а) Получение промежуточного соединения (27) К смеси промежуточного соединения (24) (0,131 моль) и ДМФА (450 мл) при комнатной температуре в токе азота добавляют по частям NaH (60%, 0,171 моль). Смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют по каплям иодэтан (0,171 моль). Смесь перемешивают при температуре 50-60 С в течение 2 суток, затем охлаждают до комнатной температуры, выливают в смесь воды со льдом и экстрагируют этилацетатом. Органический слой промывают водой, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент толуол/этилацетат, 90/10) и получают 26,5 г промежуточного соединения (27).b) Получение промежуточного соединения (28) К смеси промежуточного соединения (27) (0,063 моль) и воды (150 мл) при комнатной температуре добавляют по частям моногидрат гидроксида лития (0,264 моль). Смесь перемешивают при комнатной температуре в течение 18 ч. Удаляют воду (150 мл) выпариванием. Смесь подкисляют 3 н. НСl до получения рН 4 и затем экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают 14 г промежуточного соединения (28). Пример А.11. Получение промежуточного соединения (29)NaH (60%, 0,061 моль). Смесь перемешивают в течение 90 мин при комнатной температуре. Добавляют 1 иодпропан (0,061 моль) и реакционную смесь перемешивают при 50-60 С в течение 45 ч и затем охлаждают. Смесь выливают в холодную НСl (1 н., 300 мл) и экстрагируют DCM (2x200 мл). Объединенные органические слои промывают водой, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент гексан/EtAOc, 70/30). Нужные фракции собирают и выпаривают растворитель. Остаток растворяют в ТГФ (100 мл). Добавляют водный раствор NaOH (2 н., 125 мл). Смесь перемешивают в течение ночи. Органический растворитель выпаривают. Водный слой промывают DCM и насыщенным раствором хлорида натрия, охлаждают на ледяной бане и подкисляют концентрированной НСl до рН 3-4. Затем смесь экстрагируют диэтиловым эфиром (4x100 мл). Объединенные органические слои сушат, фильтруют, и выпаривают растворитель, и получают 6,5 г промежуточного соединения (29). Пример А.12. а) Получение промежуточного соединения (30)- 14008504 Смесь промежуточного соединения (24) (0,166 моль) и ДМФА (350 мл) перемешивают при комнатной температуре. Добавляют по частям NaH (60%, 0,2 моль). Смесь перемешивают при комнатной температуре в течение 1,5 ч и затем нагревают до 50 С. Добавляют 1-иодбутан (0,2 моль). Реакционную смесь перемешивают при 50 С в течение уикенда и затем охлаждают. Добавляют воду и смесь экстрагируют толуолом. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают на силикагеле на стеклянном фильтре (элюент CH2Cl2/CH3OH, 99/1). Нужные фракции собирают, выпаривают растворитель и получают 34 г промежуточного соединения (30).b) Получение промежуточного соединения (31) Промежуточное соединение (30) (0,09 моль), NaOH (10%) (400 мл) и ТГФ (100 мл) перемешивают при комнатной температуре в течение 28 ч. Органический растворитель выпаривают. Водную смесь промывают DCM, затем подкисляют концентрированной НСl (рН 3-4) и экстрагируют DCM. Объединенные органические слои сушат, фильтруют, и выпаривают растворитель, и получают 22 г промежуточного соединения (31). Пример А.13. а) Получение промежуточного соединения (32) Смесь промежуточного соединения (23) (0,2688 моль), 2-бромпропана (0,537 моль) и триэтиламина(0,403 моль) в ДМФА (600 мл) перемешивают при 130 С в течение ночи и затем приводят к комнатной температуре. ДМФА выпаривают. Остаток растворяют в этилацетате, раствор выливают в смесь воды со льдом и экстрагируют этилацетатом. Органический слой промывают водой, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент циклогексан/EtOAc, 80/20). Чистые фракции собирают, выпаривают растворитель и получают 25 г промежуточного соединения (32) (т.пл. 145 С).b) Получение промежуточного соединения (33) Смесь промежуточного соединения (32) (0,0942 моль), раствора NaOH (200 мл, 2 н.) и ТГФ (200 мл) перемешивают при комнатной температуре в течение 72 ч. Растворитель выпаривают. Добавляют этилацетат. Смесь экстрагируют этилацетатом. Водный слой подкисляют НСl до получения рН 2. Смесь перемешивают. Выпавшее в осадок вещество отфильтровывают, промывают минимальным количеством воды и сушат и получают 22 г промежуточного соединения (33) (т.пл. 203 С). Пример А.14. а) Получение промежуточного соединения (34) Серную кислоту (97%, 80 мл) осторожно добавляют к смеси метил-9-(ацетиламино)-3,4-дигидро 2 Н-1,5-бензодиоксепин-6-карбоксилата (0,51 моль) и метанола (1000 мл). Смесь перемешивают при 60 С в течение 1 ч и затем охлаждают. Растворитель выпаривают. Остаток растворяют в DCM. Смесь промывают раствором КНСО 3. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток суспендируют в DIPE и небольшом количестве ACN. Выпавшее в осадок вещество отфильтровывают, промывают и сушат и получают 105 г промежуточного соединения (34).b) Получение промежуточного соединения (35) Смесь промежуточного соединения (34) (0,24 моль) и воды (240 мл) перемешивают при 0 С. При- 15008504 0 С добавляют по каплям НСl (120 мл). Смесь перемешивают в течение 15 мин. При 0 С добавляют по каплям смесь нитрита натрия (0,24 моль) и воды (120 мл). Смесь перемешивают при 0 С в течение 30 мин и получают смесь (А). Перемешивают при комнатной температуре смесь хлорида меди (0,24 моль) и НСl(120 мл). Добавляют по каплям смесь (А). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Выпавшее в осадок вещество отфильтровывают, промывают и сушат и получают 55,8 г промежуточного соединения (35). с) Получение промежуточного соединения (36) Смесь промежуточного соединения (35) (0,22 моль), КОН (2,2 моль) и воды (1000 мл) перемешивают и кипятят с обратным холодильником в течение 30 мин и затем охлаждают. Смесь подкисляют концентрированной НСl. Выпавшее в осадок вещество отфильтровывают, промывают и сушат и получают 48 г промежуточного соединения (36).d) Получение промежуточного соединения (37) Смесь промежуточного соединения (36) (0,01 моль) и серной кислоты (20 мл) охлаждают до -30 С,затем при -30 С добавляют по каплям смесь азотной кислоты (0,01 моль) и серной кислоты (20 мл) и реакционную смесь перемешивают в течение 5 мин. Смесь выливают в смесь воды со льдом, полученное выпавшее в осадок вещество отфильтровывают и промывают водой и получают промежуточное соединение (37). Пример А.15. а) Получение промежуточного соединения (38) Смесь промежуточного соединения (34) (0,27 моль) и воды (270 мл) перемешивают при комнатной температуре. При комнатной температуре добавляют по каплям серную кислоту (97%, 30 мл). Смесь перемешивают в течение 15 мин. При комнатной температуре добавляют по каплям смесь нитрита натрия(0,27 моль) и воды (270 мл). Смесь перемешивают при комнатной температуре в течение 30 мин и получают смесь (А). Перемешивают при комнатной температуре смесь бромида меди(I) (0,4 моль), воды (540 мл) и бромисто-водородной кислоты (270 мл). Добавляют по каплям при комнатной температуре смесь (А). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Выпавшее в осадок вещество отфильтровывают, промывают разбавленной серной кислотой и водой и сушат при пониженном давлении в течение ночи. Остаток растворяют в DCM. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Твердое вещество сушат при пониженном давлении и получают 71,5 г промежуточного соединения (38).b) Получение промежуточного соединения (39) Раствор азотной кислоты (0,135 моль) в серной кислоте (70 мл) добавляют по каплям при температуре 0-5 С к смеси промежуточного соединения (38) (0,123 моль) и серной кислоты (280 мл). Реакционную смесь перемешивают при 0 С в течение 10 мин, выливают в смесь воды со льдом и экстрагируютDCM. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают промежуточное соединение (39). с) Получение промежуточного соединения (40) При комнатной температуре к смеси промежуточного соединения (39) (0,1205 моль) и ТГФ (700 мл) добавляют 2 н. раствор NaOH (700 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. ТГФ выпаривают. Добавляют этилацетат. Водный слой подкисляют концентрированной НСl. Выпавшее- 16008504 в осадок вещество отфильтровывают, промывают минимальным количеством воды и сушат и получают промежуточное соединение (40) (36,5 г). Пример А.16. а) Получение промежуточного соединения (41) Смесь метил-2,3-дигидрокси-5-метилбензоата (0,198 моль), 1,3-дибромпропана (0,198 моль) и К 2 СО 3 (0,396 моль) в 2-пропаноне (360 мл) перемешивают и кипятят с обратным холодильником в течение 6 ч, затем охлаждают и выпаривают растворитель. Смесь выливают в смесь воды со льдом и фильтруют. Фильтрат экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент циклогексан/этилацетат, от 80/20 до 70/30) и получают промежуточное соединение (41).b) Получение промежуточного соединения (42) Смесь промежуточного соединения (41) (0,1129 моль), 2 н. раствора NaOH (370 мл) и ТГФ (370 мл) перемешивают при комнатной температуре в течение 15 ч. ТГФ выпаривают и смесь подкисляют 12 н. НСl. Выпавшее в осадок вещество отфильтровывают, промывают водой и сушат и получают 21,9 г промежуточного соединения (42) (т.пл. 74 С). Пример А.17. а) Получение промежуточного соединения (45) Смесь метилового эфира 5-бром-2,3-дигидроксибензойной кислоты (0,397 моль) и К 2 СО 3 (0,87 моль) в 1,3-дибромпропане (49 мл) и 2-пропаноне (1000 мл) перемешивают и кипятят с обратным холодильником в течение 22 ч, затем реакционную смесь охлаждают, фильтруют через декалит и выпаривают растворитель. Остаток обрабатывают раствором NаНСО 3 (5%, водн.) и DCM. Органический слой отделяют,сушат, фильтруют через декалит, и выпаривают растворитель, и получают 112 г промежуточного соединения (45).b) Получение промежуточного соединения (46) Смесь промежуточного соединения (45) (0,14 моль), ТГФ (200 мл) и 2 н. раствора NaOH (300 мл) перемешивают при 30-60 С в течение 4 ч, затем органический растворитель выпаривают и водный концентрат охлаждают на льду и экстрагируют DCM. Водный слой дополнительно охлаждают на льду, подкисляют до рН 1, твердое вещество отфильтровывают и сушат и получают 33 г промежуточного соединения (46). с) Получение промежуточного соединения (47) Смесь промежуточного соединения (46) (0,33 моль) и цианида меди(I) (2,7 моль) в DMA (800 мл) перемешивают при 140 С в течение 20 ч, затем реакционную смесь охлаждают и добавляют FeCl36H2O(130 г), НСl (33 мл) и воду (200 мл). Смесь перемешивают при 60 С в течение 20 ч, охлаждают и выливают в воду. Добавляют этилацетат и слои фильтруют для удаления нерастворимых солей. Органический слой отделяют, промывают водой, сушат, фильтруют и выпаривают растворитель. Остаток растворяют в воде, добавляют 5% раствор NaOH, затем смесь экстрагируют DIPE, подкисляют НСl и экстрагируют этилацетатом. Органический слой отделяют, сушат и выпаривают растворитель. Остаток очищают колоночной хроматографией на коротких колонках (элюент CH2Cl2/CH3OH, 95/5, + 2 мл уксусной кислоты) и- 17008504 получают 7 г промежуточного соединения (47). Пример А.18. а) Получение промежуточного соединения (48) Смесь промежуточного соединения (16) (0,126 моль), NBS (0,151 моль) и [1,1'-бифенил]-2,2'-дикарбоновой кислоты (0,0126 моль) в тетрахлорметане (500 мл) перемешивают и кипятят с обратным холодильником в течение 5 ч, выливают в 10% раствор К 2 СО 3 и экстрагируют DCM. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/циклогексан, от 80/20 до 100/0) и получают 16,5 г промежуточного соединения (48).b) Получение промежуточного соединения (49) Смесь промежуточного соединения (48) (0,048 моль) и NaCN (0,1096 моль) в ДМСО (330 мл) перемешивают при комнатной температуре в течение 15 ч. Добавляют К 2 СО 3 (10% раствор). Смесь экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент циклогексан/этилацетат, 70/30) и получают 10,8 г промежуточного соединения (49). с) Получение промежуточного соединения (50) Смесь промежуточного соединения (49) (0,0419 моль) и моногидрата гидроксида лития (0,0837 моль) в ТГФ (100 мл) и воде (100 мл) перемешивают при комнатной температуре в течение 5 ч. ТГФ выпаривают. Смесь подкисляют концентрированной НСl и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель досуха, и получают 9,8 г промежуточного соединения (50). Пример А.19. а) Получение промежуточного соединения (51) Промежуточное соединение (23) (0,0895 моль) при комнатной температуре добавляют по частям к смеси концентрированной серной кислоты (28 мл) и воды (42 мл). Добавляют лед (70 г). Смесь энергично перемешивают и затем охлаждают до 0 С. При температуре от 0 до 7 С добавляют раствор NaNO2(0,0967 моль) в воде (15 мл). Смесь перемешивают в течение 15 мин и затем с температурой от 0 до 7 С добавляют в токе азота к горячему (85 С) раствору CuSO45H2O (0,358 моль) в воде (250 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 30 мин, затем охлаждают, выливают в смесь воды со льдом и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент толуол/этилацетат, 80/20). Собирают две фракции, выпаривают растворитель и получают 2,7 г промежуточного соединения (51).b) Получение промежуточного соединения (52) Смесь промежуточного соединения (51) (0,012 моль), (CH3)2SO4 (0,012 моль) и К 2 СО 3 (0,0144 моль) в 2-пропаноне (30 мл) перемешивают и кипятят с обратным холодильником в течение 4 ч, затем охлаждают до комнатной температуры и выпаривают растворитель досуха. Остаток растворяют в смеси DCM и воды. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают 2,7 г- 18008504 промежуточного соединения (52). с) Получение промежуточного соединения (53) При комнатной температуре к смеси промежуточного соединения (52) (0,013 моль) и ТГФ (20 мл) добавляют 2 н. раствор NaOH (20 мл). Смесь перемешивают при комнатной температуре в течение 18 ч. Выпаривают ТГФ при 30 С. Водный слой дважды экстрагируют этилацетатом, подкисляют 6 н. НСl и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают 2,5 г промежуточного соединения (53). Пример А.20. а) Получение промежуточного соединения (54) Смесь промежуточного соединения (48) (0,11 моль) и СН 3ONа/СН 3 ОН (30%, 0,44 моль) в метанолеb) Получение промежуточного соединения (55) Дигидрат гидроксида лития (0,182 моль) при комнатной температуре добавляют по частям к смеси промежуточного соединения (54) (0,091 моль), ТГФ (20 мл) и воды (200 мл). Смесь перемешивают при комнатной температуре в течение ночи. ТГФ выпаривают. Добавляют этилацетат. Смесь экстрагируют этилацетатом. Водный слой подкисляют концентрированной НСl. Добавляют DCM. Смесь экстрагируютDCM. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают 21,5 г промежуточного соединения (55). Пример А.21. Получение промежуточного соединения (56) Смесь 1,1-диметилэтил-(транс)-3-гидрокси-4-(фенилметил)амино]метил]-1-пиперидинкарбоксилата (описанного в WO-00/37461 как промежуточное соединение (1-d (0,023 моль) и метанола (100 мл) гидрируют с палладием-на-угле (10%, 1 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток отверждают в DIPE+ACN, отфильтровывают и сушат и получают 4 г 1,1-диметилэтил-(транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилата (промежуточное соединение 56, т.пл. 178 С). Аналогичным способом, но исходя из цис-3-гидрокси-4-пиперидинметанола (описанного в J. Org. Промежуточное соединение (57) Пример А.22. а) Получение промежуточного соединения (58) 1,1-Диметилэтил-(транс)-3-гидрокси-4-(фенилметил)амино]метил]-1-пиперидинкарбоксилат (опи- 19008504 санный в WO-00/37461 как промежуточное соединение (1-d (2,73 моль) отделяют и очищают хиральной колоночной хроматографией на Chiracel AD (элюент гексан/этанол, 80/20). Нужные фракции собирают и выпаривают растворитель. Добавляют толуол, осуществляют азеотропную отгонку на роторном испарителе и получают 377 г 1,1-диметилэтил-(3S-транс)-3-гидрокси-4-(фенилметил)амино]метил]-1-пиперидинкарбоксилата (промежуточное соединение 58).b) Получение промежуточного соединения (59) Смесь промежуточного соединения (58) (0,028 моль) и метанола (100 мл) гидрируют с палладиемна-угле (10%, 2 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывают, и фильтрат упаривают, и получают 4,7 г 1,1-диметилэтил-(3S-транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилата (промежуточное соединение 59; []20,D=+4,37 (с=24,03 мг/5 мл в СН 3 ОН. Пример А.23. а) Получение промежуточного соединения (60) Смесь 1,1-диметилэтил-(3R-транс)-3-гидрокси-4-(4-метилфенил)сульфонил]оксиметил]-1-пиперидинкарбоксилата (описанного в WO-00/37461 как промежуточное соединение (1-c-I (0,03 моль) и бензиламина (0,1 моль) в ТГФ (250 мл) перемешивают в течение 16 ч при 125 С (автоклав). Реакционную смесь охлаждают и выпаривают растворитель. Остаток обрабатывают DCM и водным раствором К 2 СО 3. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток кристаллизуют изb) Получение промежуточного соединения (61) Смесь промежуточного соединения (60) (0,016 моль) и метанола (150 мл) гидрируют с палладиемна-угле (10%, 2 г) в качестве катализатора при температуре 50 С. После поглощения водорода (1 экв.) катализатор отфильтровывают, и фильтрат упаривают, и получают 1,1-диметилэтил-(3R-транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилат (промежуточное соединение 61). Пример А.24. а) Получение промежуточного соединения (62)(описанного в WO-00/37461 как промежуточное соединение (1-с (0,27 моль) в ТГФ (1300 мл). Смесь перемешивают в течение 30 мин. Добавляют метилиодид (0,54 моль) и полученную реакционную смесь перемешивают в течение 90 мин. Добавляют небольшое количество воды. Растворитель выпаривают и остаток обрабатывают водой и DCM. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают 1,1-диметилэтил-(транс)-4-(4-метилфенил)сульфонил]окси]метил]-3-метокси-1-пиперидинкарбоксилат (промежуточное соединение 62).b) Получение промежуточного соединения (63) Смесь промежуточного соединения (62) (0,065 моль) и ТГФ (250 мл) обрабатывают жидким NН 3 в автоклаве при 125 С в течение 16 ч. Реакционную смесь фильтруют и фильтрат упаривают. Остаток обрабатывают 5% водным раствром NaOH и DCM. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают 16 г 1,1-диметилэтил-(транс)-4-аминометил)-3-метокси-1-пиперидинкарбоксилата (промежуточное соединение 63).- 20008504 Пример А.25. а) Получение промежуточного соединения (64)(200 мл) перемешивают при 10 С. При 10 С добавляют по каплям метанолат натрия (0,11 моль). Реакционную смесь перемешивают в течение 20 ч при комнатной температуре. Растворитель выпаривают. Остаток растворяют в воде, затем нейтрализуют уксусной кислотой и затем дважды экстрагируют DCM. Органический слой отделяют, промывают водой, сушат, фильтруют и выпаривают растворитель. Остаток суспендируют в DIPE, отфильтровывают, промывают и сушат и получают 17,2 г промежуточного соединения (64) (т.пл. 160 С).b) Получение промежуточного соединения (65) Смесь промежуточного соединения (64) (0,058 моль) и уксусной кислоты (12 мл) в метаноле (250 мл) гидрируют при 14 С с палладием-на-угле (10%, 1 г) в качестве катализатора. После поглощения водорода(3 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток растворяют в смеси лед/вода, затем подщелачивают гидроксидом калия и высаливают К 2 СО 3. Полученную смесь дважды экстрагируютDCM. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток суспендируют в DIPE, отфильтровывают, промывают и сушат и получают 7,5 г промежуточного соединения (65). Пример А.26. а) Получение промежуточного соединения (66) Смесь (транс)-4-(фенилметил)амино]метил]-3-пиперидинола (полученного в WO-00/37461 как промежуточное соединение (6 (0,04 моль), 3-бром-1-пропанола (0,04 моль) и Na2CO3 (0,08 моль) в метилизобутилкетоне (400 мл) перемешивают и кипятят с обратным холодильником в течение 18 ч. Растворитель выпаривают. Остаток обрабатывают водой и DCM. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/(CH3OH/NH3), 93/7). Нужные фракции собирают и выпаривают растворитель. Добавляют толуол,растворитель снова выпаривают и получают 7,2 г промежуточного соединения (66).b) Получение промежуточного соединения (67) Смесь промежуточного соединения (66) (0,026 моль) и метанола (150 мл) гидрируют с палладиемна-угле (10%, 2 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывают, и фильтрат упаривают, и получают 4,4 г промежуточного соединения (67). Пример А.27. а) Получение промежуточного соединения (68) Смесь (транс)-4-(фенилметил)амино]метил]-3-пиперидинола (полученного в WO-00/37461 как промежуточное соединение (6 (0,04 моль), 1-хлор-3-метоксипропана (0,04 моль) и Na2 СО 3 (0,08 моль) в метилизобутилкетоне (300 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч, затем охлаждают и выпаривают растворитель. Остаток растворяют в DCM, затем раствор промывают водой, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/(CH3OH/NH3), 97/3). Чистые фракции собирают, выпаривают растворитель и получают 5 г промежуточного соединения (68).b) Получение промежуточного соединения (69).- 21008504 Смесь промежуточного соединения (68) (0,016 моль) и метанола (150 мл) гидрируют с палладиемна-угле (10%, 1 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывают, и фильтрат упаривают, и получают 3,3 г промежуточного соединения (69). Пример А.28. а) Получение промежуточного соединения (70)(промежуточное соединение (1-d) в WO-99/02156) (0,426 моль), бензальдегида (0,5 моль) и палладия-наугле (10%, 5 г) в растворе тиофена (5 мл) и метаноле (1000 мл) перемешивают при 70-80 С в течение ночи. Растворитель выпаривают. Остаток обрабатывают DCM (150 мл) и 5% водным раствором NaOH (150 мл). Смесь разделяют на слои. Водный слой экстрагируют DCM. Объединенные органические слои сушат,фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле(элюент CH2Cl2/(CH3OH/NH3), 90/10). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из DIPE с каплей ACN. Выпавшее в осадок вещество отфильтровывают и сушат и получают 2,35 г 1,1-диметилэтил-(транс)-4-бис(фенилметил)амино]метил]-3-гидрокси-1-пиперидинкарбоксилата (промежуточное соединение 70), т.пл. 133 С).b) Получение промежуточного соединения (71) Смесь промежуточного соединения (70) (0,284 моль) в 2-пропаноле (1000 мл) и раствора 6 н. НСl в 2-пропаноле (250 мл) перемешивают и кипятят с обратным холодильником в течение 15 мин и затем охлаждают. Растворитель выпаривают. Добавляют 5% водный раствор NaOH (750 мл). Смесь дважды экстрагируют DCM. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают 88,95 г (транс)-4-бис(фенилметил)амино]метил]-3-пиперидинола (промежуточное соединение 71). с) Получение промежуточного соединения (72) Смесь промежуточного соединения (71) (0,083 моль) и бутилальдегида (7 г) в метаноле (300 мл) гидрируют с палладием-на-угле (10%, 2 г) в качестве катализатора в присутствии раствора тиофена (3 мл). После поглощения водорода (1 экв.) катализатор отфильтровывают на целите и фильтрат упаривают. Остаток растворяют в 2 н. соляной кислоте (500 мл). Смесь промывают толуолом и затем разделяют на слои. Водный слой подщелачивают 50% водным раствором NaOH и затем 3 раза экстрагируют толуолом. Объединенные органические слои сушат, фильтруют, и выпаривают растворитель, и получают 29 гd) Получение промежуточного соединения (73) Смесь промежуточного соединения (72) (0,079 моль) и метанола (250 мл) гидрируют с палладиемна-угле (10%, 2 г) в качестве катализатора. После поглощения водорода (2 экв.) катализатор отфильтровывают на целите, фильтрат упаривают и получают 13,8 г (транс)-4-(аминометил)-1-бутил-3-пиперидинола (промежуточное соединение 73). Пример А.29. а) Получение промежуточного соединения (74) Промежуточное соединение (71) (0,0387 моль) растворяют в 2-метилпропаноле (200 мл). Добавляют тетрагидрофурфурилметансульфонат (0,05 моль) и Na2 СО 3 (0,0774 моль). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 24 ч и затем охлаждают. Выпавшее в осадок вещество отфильтровывают. Растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/CH3OH, 97/3). Нужные фракции собирают, и выпаривают растворитель, и получают 11,1 г промежуточного соединения (74).b) Получение промежуточного соединения (75)(10%, 2 г) в качестве катализатора. После поглощения водорода (2 экв.) катализатор отфильтровывают на декалите, выпаривают растворитель и получают 5,74 г промежуточного соединения (75). Пример А.30. а) Получение промежуточного соединения (76) 1,1-Диметилэтил-(транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилат (полученный в WO00/37461 как промежуточное соединение (1-е (0,06 моль), 2-пропанол, насыщенный НСl (60 мл) и 2 пропанол (400 мл) перемешивают и кипятят с обратным холодильником в течение 30 мин и затем охлаждают. Выпаривают растворитель и проводят совместное выпаривание с толуолом. Остаток сушат и получают 12 г промежуточного соединения (76).b) Получение промежуточного соединения (77)(0,24 моль) в ACN (600 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч и затем охлаждают и фильтруют. Растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/(CH3OH/NH3), 85/15). Нужные фракции собирают, выпаривают растворитель и получают 4,5 г промежуточного соединения (77). Пример А.31. а) Получение промежуточного соединения (78) Смесь трифторуксусной кислоты (1,15 моль) и воды (2000 мл) перемешивают при комнатной температуре. К смеси добавляют по каплям 1,2,3,6-тетрагидро-1-(фенилметил)пиридин (1,15 моль) и смесь перемешивают при комнатной температуре в течение 15 мин. Добавляют по частям N-бромсукцинимид(1,4 моль) и смесь греют при 30-35 С в течение 1 ч. Реакционную смесь перемешивают в течение 30 мин. Снова добавляют по частям N-бромсукцинимид (0,085 моль) и смесь нагревают до 35 С. Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем декантируют и добавляют по каплям 20% раствор NaOH (2000 мл). Смесь перемешивают в течение ночи при комнатной температуре. Продукт реакции экстрагируют DCM (3 х). Органический слой отделяют, сушат, фильтруют и концентрируют и получают 193 г промежуточного соединения (78).b) Получение промежуточного соединения (79)- 23008504 Смесь гидрида лития (0,66 моль) и ТГФ (600 мл, чда) реагирует при комнатной температуре в атмосфере азота, затем добавляют по каплям смесь 2-гидрокси-2-метилпропаннитрила (0,66 моль) и ТГФ (150 мл),реакционную смесь перемешивают в течение 2 ч при комнатной температуре и получают смесь (А). Смесь промежуточного соединения (78) (0,6 моль) и ТГФ (250 мл) добавляют по каплям к смеси (А) и по завершении добавления реакционную смесь перемешивают и кипятят с обратным холодильником в течение 4 ч и затем перемешивают в течение ночи при комнатной температуре. Добавляют DCM и воду,органический слой отделяют, сушат, фильтруют, выпаривают растворитель и получают 128 г промежуточного соединения (79). с) Получение промежуточного соединения (80) Промежуточное соединение (79) (0,6 моль) гидрируют при 14 С в CH3OH/NH3 (1,5 л) с никелем Ренея в качестве катализатора. После поглощения водорода (2 экв.) катализатор отфильтровывают и выпаривают растворитель. Остаток растворяют в ACN и обработкой этандиовой кислотой (0,6 мл) превращают в соль этандиовой кислоты (1:1). Растворитель декантируют. Остаток суспендируют в 2-пропаноле. Выпавшее в осадок вещество отфильтровывают и растворяют в метаноле, смесь кипятят и охлаждают. Выпавшее в осадок вещество отфильтровывают, промывают и сушат и получают 107 г промежуточного соединения (80). Пример А.32. Получение промежуточного соединения (81)(0,02 моль), промежуточного соединения (76) (0,02 моль) и Nа 2 СО 3 (0,08 моль) в ACN (100 мл) перемешивают и кипятят с обратным холодильником в течение 48 ч, охлаждают, фильтруют и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/(СН 3 ОН/NH3), 80/20) и получают 2,4 г промежуточного соединения (81). Пример А.33. а) Получение промежуточного соединения (82)(0,146 моль). Реакционную смесь охлаждают до температуры ниже 10 С. При указанной температуре добавляют по каплям муравьиную кислоту (0,146 моль) и реакционную смесь перемешивают при указанной температуре в течение 1 ч (=смесь А). Промежуточное соединение (56) (0,146 моль) перемешивают в DCM (400 мл) при комнатной температуре в течение 1 ч и затем добавляют к смеси (А). Реакционную смесь перемешивают в течение 90 мин при комнатной температуре. Добавляют воду. Органический слой отделяют, сушат, фильтруют, выпаривают растворитель и получают 81 г промежуточного соединения (82).b) Получение промежуточного соединения (83)(1200 мл) перемешивают и кипятят с обратным холодильником в течение 2 ч. Реакционную смесь оставляют охлаждаться до комнатной температуры на ночь. Полученное выпавшее в осадок вещество отфильтровывают и сушат и получают 54,5 г промежуточного соединения (83) (т.пл. 150 С). Аналогичным образом получают промежуточные соединения (84) и (85). Пример А.34. а) Получение промежуточного соединения (86) Смесь промежуточного соединения (7) (0,08 моль), DCM (400 мл) и триэтиламина (0,1 моль) перемешивают при 5 С. Добавляют по каплям муравьиную кислоту (0,08 моль). Смесь перемешивают в течение 30 мин при 5 С. При 5 С добавляют промежуточное соединение (80) (0,08 моль) и триэтиламин (0,25 моль) в DCM (400 мл). Реакционную смесь нагревают до комнатной температуры и промывают водой. Органический слой отделяют, сушат, фильтруют, выпаривают растворитель, проводят совместное выпаривание с толуолом и получают 41 г промежуточного соединения (86).b) Получение промежуточного соединения (87)(10%, 2 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывают,выпаривают растворитель и получают 34 г промежуточного соединения (87). Аналогичным образом получают промежуточное соединение (88). Промежуточное соединение (88) Пример А.35. Получение промежуточного соединения (89)(0,015 моль) и смесь перемешивают при 5 С. При 5 С добавляют по каплям муравьиную кислоту (0,013 моль) и затем реакционную смесь перемешивают при 5 С в течение 30 мин. При 5 С добавляют триэтиламин(0,03 моль) и промежуточное соединение (67) (0,013 моль) в DCM (100 мл). Реакционную смесь нагревают до комнатной температуры и затем промывают водой. Органический слой отделяют, сушат, фильтруют, выпаривают растворитель и получают 5,3 г промежуточного соединения (89). Пример А.36. а) Получение промежуточного соединения (90)(8,4 мл) и смесь охлаждают до -5 С. В течение 5 мин добавляют по каплям муравьиную кислоту (0,06 моль). Реакционную смесь перемешивают в течение 40 мин при температуре в интервале от -5 до -10 С. Сразу добавляют промежуточное соединение (56) (0,06 моль) в DCM (50 мл) и триэтиламин (8,4 мл). Ледяную баню убирают и смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют DCM (200 мл). Смесь промывают в последовательности вода/NаОН(5% водн.)/вода/холодная НСl (5% соляная кислота)/вода. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток перетирают со смесью DIPE/ACN. Выпавшее в осадок вещество отфильтровывают и сушат и получают 23,2 г промежуточного соединения (90).b) Получение промежуточного соединения (91) Промежуточное соединение (90) (0,0478 моль) гидрируют в метаноле (250 мл) при 50 С с платинойна-угле (5%, 3 г) в качестве катализатора в присутствии раствора тиофена (3 мл). После поглощения водорода (3 экв.) катализатор отфильтровывают на декалите и выпаривают растворитель. Остаток перетирают с DIPE. Выпавшее в осадок вещество отфильтровывают и сушат и получают 19,7 г промежуточного соединения (91) (т.пл. 161 С). Аналогичным образом получают промежуточные соединения (92), (93) и 94). Промежуточное соединение (94) Пример А.37. Получение промежуточного соединения (95) Смесь промежуточного соединения (42) (0,336 моль) и триэтиламина (0,4 моль) в DCM (1000 мл) перемешивают при 5 С, затем добавляют по каплям этилхлорформиат (0,35 моль) и реакционную смесь перемешивают в течение 30 мин. К полученной смеси при 5 С добавляют раствор промежуточного соединения (59) (83 г) в DCM (1000 мл), затем реакционную смесь оставляют до достижения комнатной температуры и промывают водой. Органический слой отделяют, сушат, фильтруют, выпаривают растворитель и получают 150 г промежуточного соединения (95). Промежуточные соединения (96)-(114) получают согласно той же процедуре, что в примере А.38.- 27008504 Пример А.38. Получение промежуточного соединения (115) 4-Метокси-1-бутанол (0,9 моль) перемешивают в DCM (1500 мл), и добавляют триэтиламин (1,35 моль),затем добавляют по каплям метилсульфонилхлорид (1,1 моль) (температура поднимается до 40 С) и реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Смесь промывают водой. Органический слой отделяют, сушат, выпаривают растворитель, затем проводят совместное выпаривание с толуолом и получают 167 г промежуточного соединения (115). Пример А.39. Получение промежуточного соединения (116)(0,11 моль), затем добавляют по каплям метилсульфонилхлорид (0,07 моль) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Смесь промывают водным раствором Na2CO3 и водой. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/CH3OH, 99/1). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель, затем проводят совместное выпаривание с толуолом и получают 8,6 г промежуточного соединения (116). Пример А.40. а) Получение промежуточного соединения (117) Смесь 4-феноксибутилхлорида (0,135 моль) и DCM (50 мл) перемешивают и охлаждают до 0 С. Добавляют по каплям в течение 45 мин хлорсульфоновую кислоту (0,149 моль). Ледяную баню убирают и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Затем добавляют по каплям этандиоилдихлорид (0,176 моль), а затем ДМФА (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 20 ч. Затем смесь выливают на лед, экстрагируют DCM, экстракт сушат, выпаривают растворитель и получают промежуточное соединение (117).b) Получение промежуточного соединения (118) Раствор промежуточного соединения (117) (0,135 моль) в ТГФ (500 мл) перемешивают и охлаждают до 0 С и затем через раствор барботируют аммиак (газ). Реакционную смесь фильтруют и выпаривают растворитель. К остатку добавляют DCM (600 мл) и смесь промывают НСl (600 мл, 1 н.). Водный слой отделяют и экстрагируют DCM (2 раза по 300 мл). Объединенные органические слои промывают рассолом, сушат и выпаривают растворитель. Остаток кристаллизуют из СН 3 ОН/DIPE, отфильтровывают и сушат и получают 18,5 г промежуточного соединения (118). Аналогичным образом, но исходя из 4-феноксипропилхлорида или 4-феноксиэтилхлорида, получают промежуточные соединения (119) и (120). Промежуточное соединение (120) Пример А.41. Получение промежуточного соединения (121) 1-Пирролидинкарбонилхлорид (0,037 моль) растворяют в тетрахлорметане (12 мл). Добавляют по каплям 3-бром-1-пропанол (0,036 моль) и реакционную смесь перемешивают при комнатной температуре в течение 7 суток. Смесь охлаждают на льду и добавляют СН 3 ОН/(NН 3) (2 мл). Затем добавляют DCM(100 мл), смесь промывают водой, сушат и выпаривают растворитель. Остаток очищают на селикагеле на- 28008504 стеклянном фильтре (элюент DCM). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель и получают 4 г промежуточного соединения (121). Пример А.42. а) Получение промежуточного соединения (122) Смесь промежуточного соединения (87) (0,0154 моль), метилового эфира 4-бромбутановой кислоты(0,02 моль) и триэтиламина (0,02 моль) в ДМФА (150 мл) перемешивают в течение ночи при 70 С. Реакционную смесь охлаждают и выпаривают растворитель. Остаток растворяют в DCM и промывают водой. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель, и получают 8 г промежуточного соединения (122).b) Получение промежуточного соединения (123)(100 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают. Растворитель выпаривают. Остаток растворяют в DCM и промывают H2O/NH3. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/(CH3OH/NH3), 97/3). Нужные фракции собирают, выпаривают растворитель и получают 1,75 г промежуточного соединения (123). Аналогичным образом получают промежуточные соединения (124)-(129). Промежуточное соединение (129) Для получения конечных соединений также используют промежуточные соединения, известные в технике, такие как, например, 3-цианопропилбромид, тетрагидрофуранилметансульфонат, 3-гидроксипропилбромид, 2-метоксиэтилбромид, 3-метоксипропилхлорид, (транс)-4-(аминометил)-1-[2-(1,3-диоксолан-2-ил)этил]-3-пиперидинол (описанный в WO-00/37461 как промежуточное соединение 8), 1-хлор-3(1-метилэтокси)пропан, 2-(3-хлорпропил)-2-метил-1,3-диоксолан, 2-(2-бромэтил)-1,3-диоксолан, метил 4-бромбутаноат, 2-хлорацетонитрил, 2-(2-хлорэтокси)этанол, N-(2-хлорэтил)метансульфонамид и N-[3[(метилсульфонил)окси]пропил]метансульфонамид. В. Получение конечных соединений. Пример В.1. Смесь промежуточного соединения (95) (0,336 моль) в НСl/2-пропаноле (160 мл) и 2-пропанола(1400 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель выпаривают и остаток растворяют в смеси DCM и небольшого количества метанола. Смесь промывают водным раствором аммиака, органический слой отделяют, сушат, фильтруют и упаривают и получают 71 г соединения (255). Пример В.2. а) Получение промежуточного соединения (20) Смесь промежуточного соединения (85) (0,01 моль), промежуточного соединения (115) (0,014 моль) и карбоната натрия (0,02 моль) в изобутаноле (100 мл) перемешивают и кипятят с обратным холодильником в течение 40 ч, затем охлаждают и фильтруют. Из фильтрата выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/(CH3OH/NH3), 97/3). Нужные фракции собирают, выпаривают растворитель и получают 2,6 г промежуточного соединения (20).b) Промежуточное соединение (20) (0,006 моль) гидрируют в метаноле с палладием-на-угле (10%, 1 г) в качестве катализатора в присутствии раствора тиофена (0,5 мл). После поглощения водорода (3 экв.) катализатор отфильтровывают и выпаривают растворитель. Остаток очищают на силикагеле на стеклянном фильтре (элюент СН 2 Сl2/(CH3OH/NH3), 96/4). Нужные фракции собирают, фильтруют и выпаривают растворитель. Остаток растворяют в 2-пропаноле и обработкой (Е)-2-бутандиовой кислотой превращают в соль (Е)-2-бутандиовой кислоты (1:1). Выпавшее в осадок вещество отфильтровывают, промывают и сушат и получают 1,8 г соединения (1) (т.пл. 174 С). Пример В.3. а) Получение промежуточного соединения (43)(0,012 моль) и реакционную смесь охлаждают до температуры ниже 10 С. Осторожно добавляют муравьиную кислоту (0,012 моль), реакционную смесь перемешивают в течение 45 мин при температуре ниже 10 С и получают смесь (А). Промежуточное соединение (67) (0,011 моль) перемешивают в DCM(60 мл). Добавляют триэтиламин (0,029 моль), реакционную смесь перемешивают в течение 45 мин при комнатной температуре и получают смесь (В). Смесь (А) добавляют к смеси (В) и полученную реакционную смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь промывают 5% раствором NaOH и затем водой. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/СН 3 ОН, 95/5). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель и получают 3,5 г промежуточного соединения (43).b) Смесь промежуточного соединения (43) (0,007 моль), 6 н. НСl/2-пропанола (7 мл) и 2-пропанола(70 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель выпаривают. Остаток обрабатывают водой и DCM. Добавляют карбонат натрия. Органический слой отделяют, сушат,- 30
МПК / Метки
МПК: A61K 31/453, C07D 405/14, C07D 405/12, A61P 1/04
Метки: 4-(аминометил, бензамиды, пиперидина, 5нт4-антагонисты
Код ссылки
<a href="https://eas.patents.su/30-8504-benzamidy-4-aminometil-piperidina-kak-5nt4-antagonisty.html" rel="bookmark" title="База патентов Евразийского Союза">Бензамиды 4-(аминометил) пиперидина как 5нт4-антагонисты</a>
Предыдущий патент: Препараты, содержащие цефалоспориновое соединение, и их применение в лечении бактериальных инфекций у кошек и собак
Следующий патент: Конъюгаты химически модифицированного гормона роста человека
Случайный патент: Производное дитиокарбамата 2-((4-(4-метилпиперазин-1-ил)фенил)амино)-2-оксоетил4-этилпиперазин-1-карбодитиоат, обладающее антифунгальной активностью