Замещенные сульфонамиды, способ их получения и их применение в качестве лечебного средства для лечения расстройств цнс, ожирения и диабета типа ii
Номер патента: 8476
Опубликовано: 29.06.2007
Авторы: Кальдирола Патриция, Мотт Эндрю, Теденборг Ларс, Бремберг Ульф, Байерляйн Катарина, Йоханссон Гари, Тор Маркус, Йенмальм Йенсен Анника
Формула / Реферат
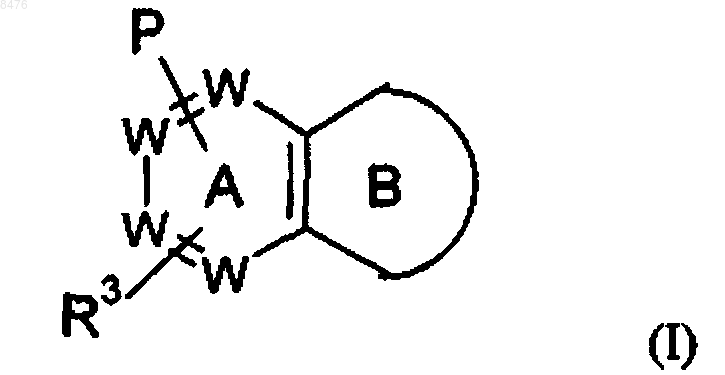
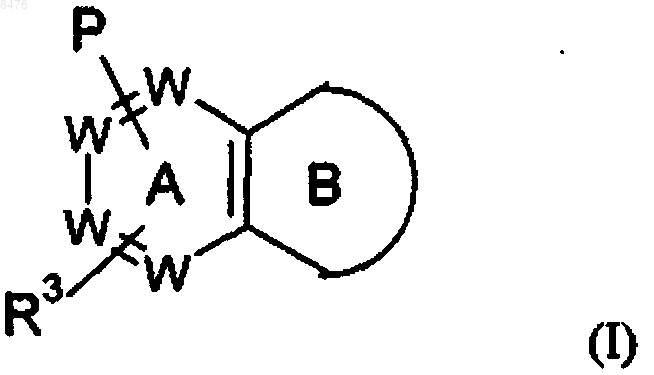
1. Соединение формулы (I)
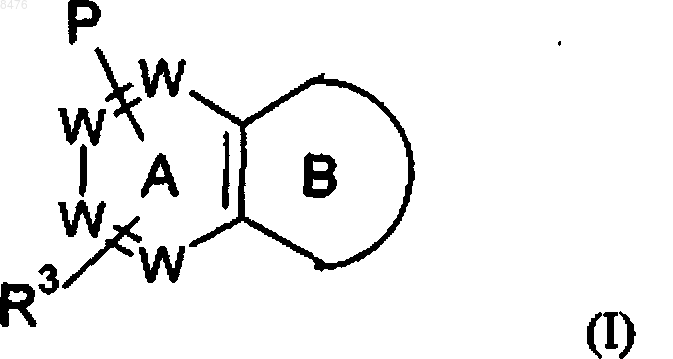
или его фармацевтически приемлемая соль, где в указанной формуле
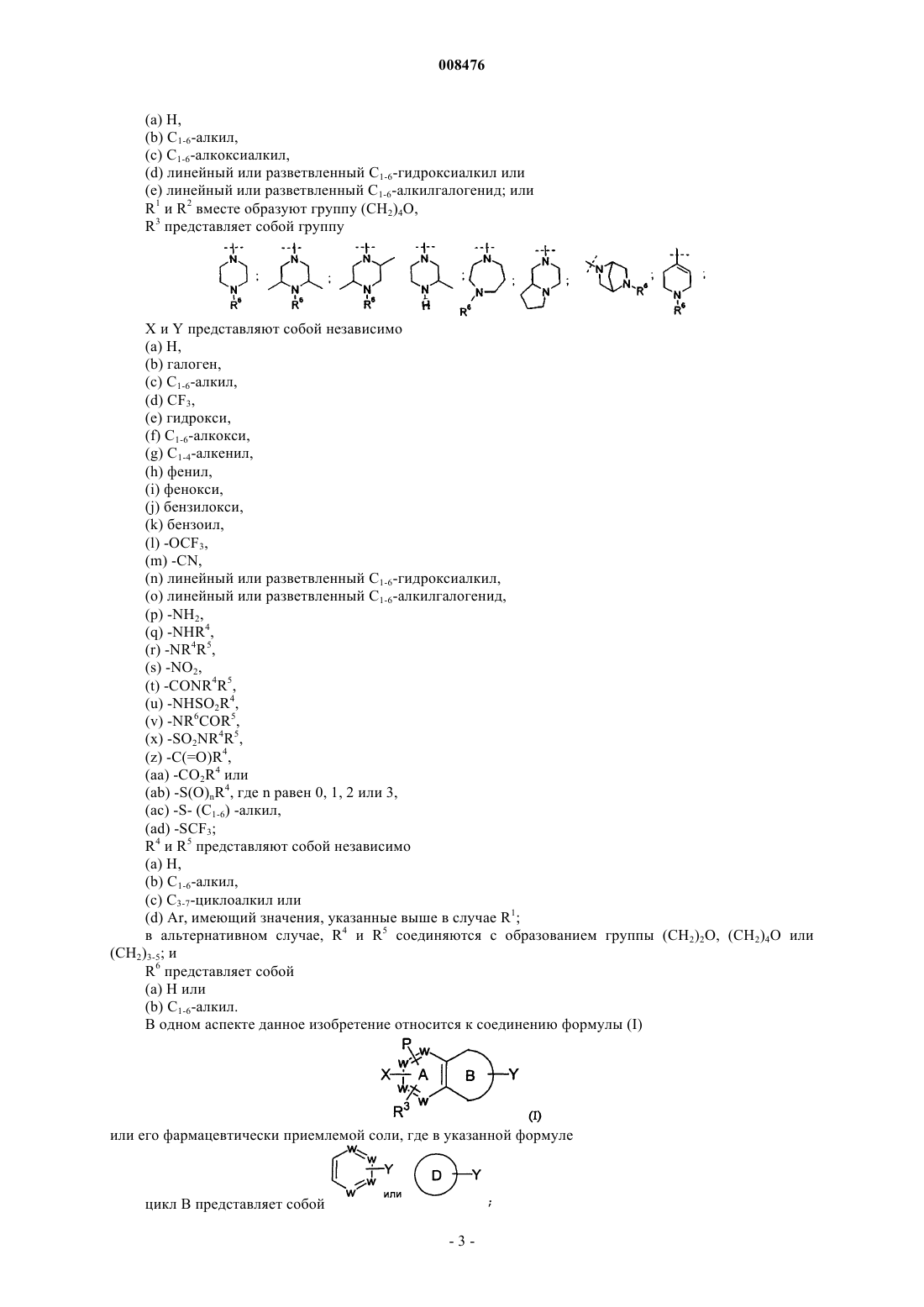
цикл В представляет собой 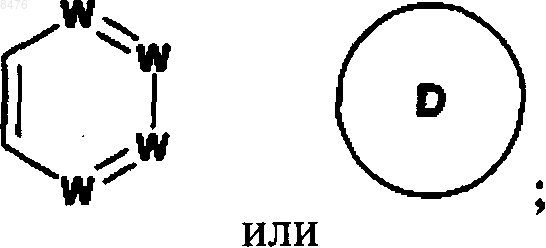
где D представляет фуран;
W представляет собой N или -(СН)-, при условии, что не более двух групп W представляют собой N в обоих циклах А и В вместе и кольцо А и кольцо В оба независимо выбирают из бензола и пиридина;
Р представляет собой
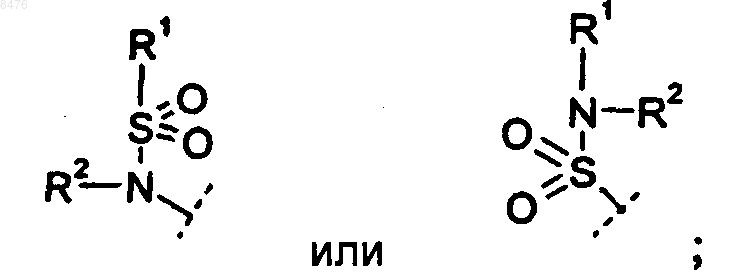
Р и R3 связаны с одним и тем же циклом и располагаются в мета- или пара-положении относительно друг друга;
R1 представляет собой
(a) C1-6-алкил,
(b) группу Ar;
Ar представляет собой
(a) фенил,
(b) 1-нафтил,
(c) 2-нафтил,
(d) бензил,
(e) циннамоил,
(f) 5-7-членный, необязательно ароматический, частично насыщенный или полностью насыщенный гетероцикл, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота и серы, или
(g) бициклическую систему, содержащую по меньшей мере один гетероцикл согласно (f),
где группа Ar замещена в одной или нескольких позициях
(a) Н, X или Y или
(b) 5-7-членным, необязательно ароматическим, частично насыщенным или полностью насыщенным гетероциклом, содержащим 1-4 гетероатома, выбранных из атомов кислорода, азота или серы;
R2 представляет собой
(a) Н, или
(b) C1-6-алкил,
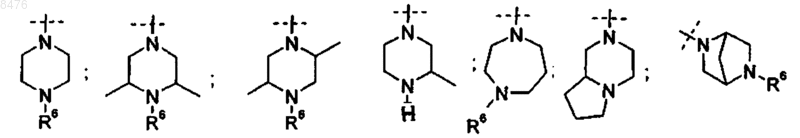
один из R3 представляет собой группу

X и Y представляют собой независимо
(a) Н,
(b) галоген,
(c) C1-6-алкил,
(d) -CF3,
(f) C1-6-алкокси,
(h) фенил,
(i) фенокси,
(j) бензилокси,
(k) бензоил,
(l) -OCF3,
(m) -CN,
(n) линейный или разветвленный C1-6-гидроксиалкил,
(о) линейный или разветвленный C1-6-алкилгалогенид,
(p) -NH2,
(s) -NO2,
(v) -NR4COR5,
(z) -C(=O)R4,
(ab) -S(O)nR4, где n равен 0, 1, 2 или 3;
(ad) -SCF3; R4 и R5 представляют собой независимо
(a) H,
(b) C1-6-алкил,
(c) C3-7-циклоалкил или
(d) Ar, имеющий значения, указанные выше в случае R1;
в альтернативном случае, R4 и R5 соединяются с образованием группы (СН2)2O, (СН2)4O или
(СН2)3-5; и
R6 представляет собой
(a) Н или
(b) линейный или разветвленный C1-6-алкил; за исключением
3-бензолсульфонамид-1-(4-этилпиперазин-1-ил)изохинолина и 1-(4-этилпиперазин-1-ил)-3-(4-метоксибензолсульфонамид)изохинолина.
2. Соединение по п.1 общей формулы (II)
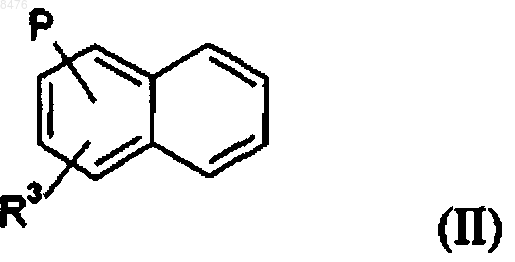
где R3 и Р имеют значения, указанные в случае формулы (I).
3. Соединение по п.1 общей формулы (III)
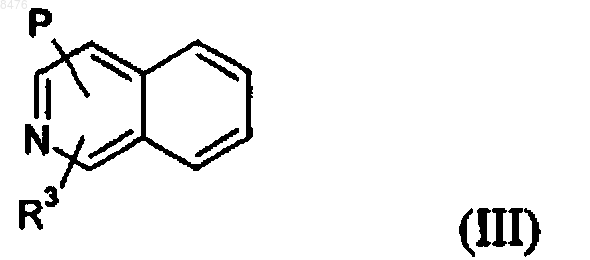
где R3 и Р имеют значения, указанные в случае формулы (I).
4. Соединение по п.1 общей формулы (IV)
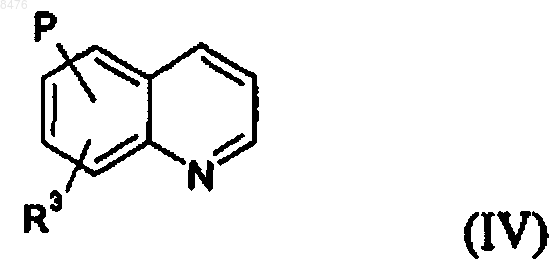
где R3 и Р имеют значения, указанные в случае формулы (I).
5. Соединение по п.1 общей формулы (V)
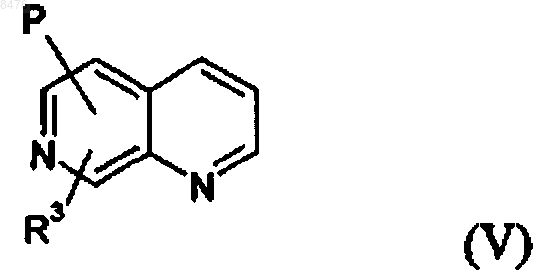
где R3 и Р имеют значения, указанные в случае формулы (I).
6. Соединение по п.1 общей формулы (VI)
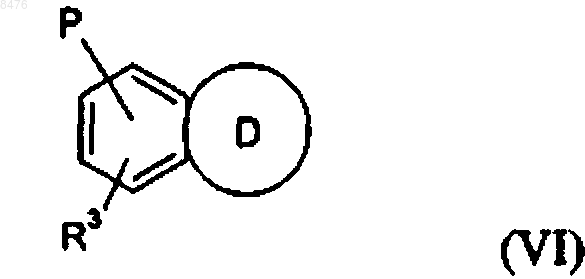
где R3 и Р имеют значения, указанные в случае формулы (I) и где D представляет фуран.
7. Соединение по п.1, где R1 представляет собой
(а) C1-6-алкил или
(e) группу Ar;
Ar представляет собой
(a) фенил,
(b) 1-нафтил,
(c) 2-нафтил или
(f) 5-7-членный, необязательно ароматический, частично или полностью насыщенный гетероцикл, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота и серы;
где группа Ar замещена в одном или нескольких положениях X или Y; где X или Y представляет собой
(a) Н,
(b) галоген,
(c) C1-6-алкил,
(d) -CF3,
(f) C1-6-алкокси,
(g) C1-4-алкенил,
(l) -OCF3, или
(n) линейный или разветвленный C1-6-гидроксиалкил,
R2 представляет собой
(a) Н или
(b) C1-3-алкил, в частности метил;
R3 представляет собой
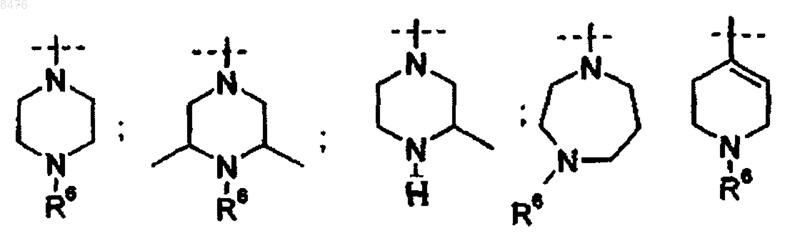
где R6 представляет собой
(a) Н или
(b) метил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и линейный или разветвленный пентил или гексил, в частности, метил;
и/или
D представляет фуранил.
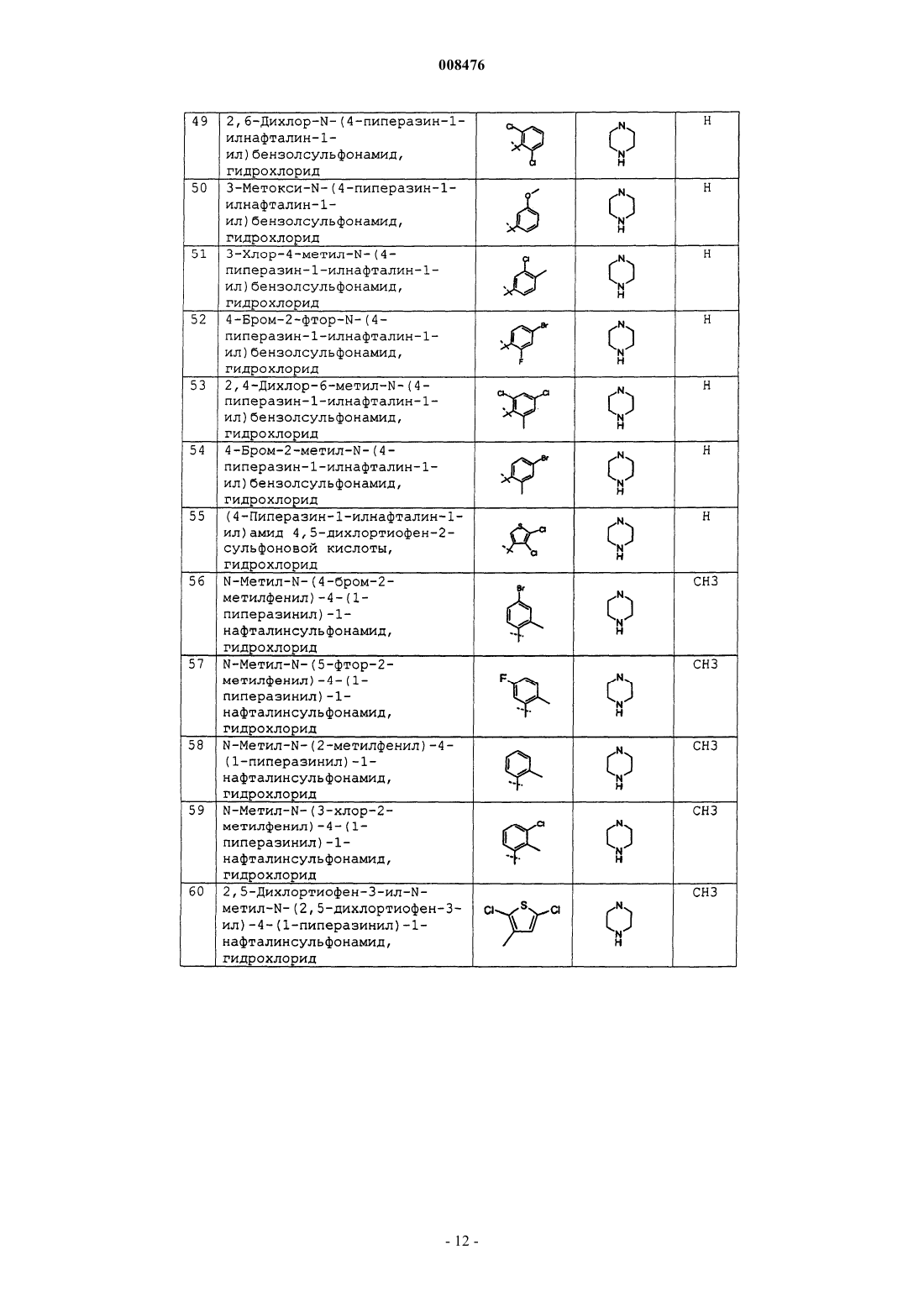
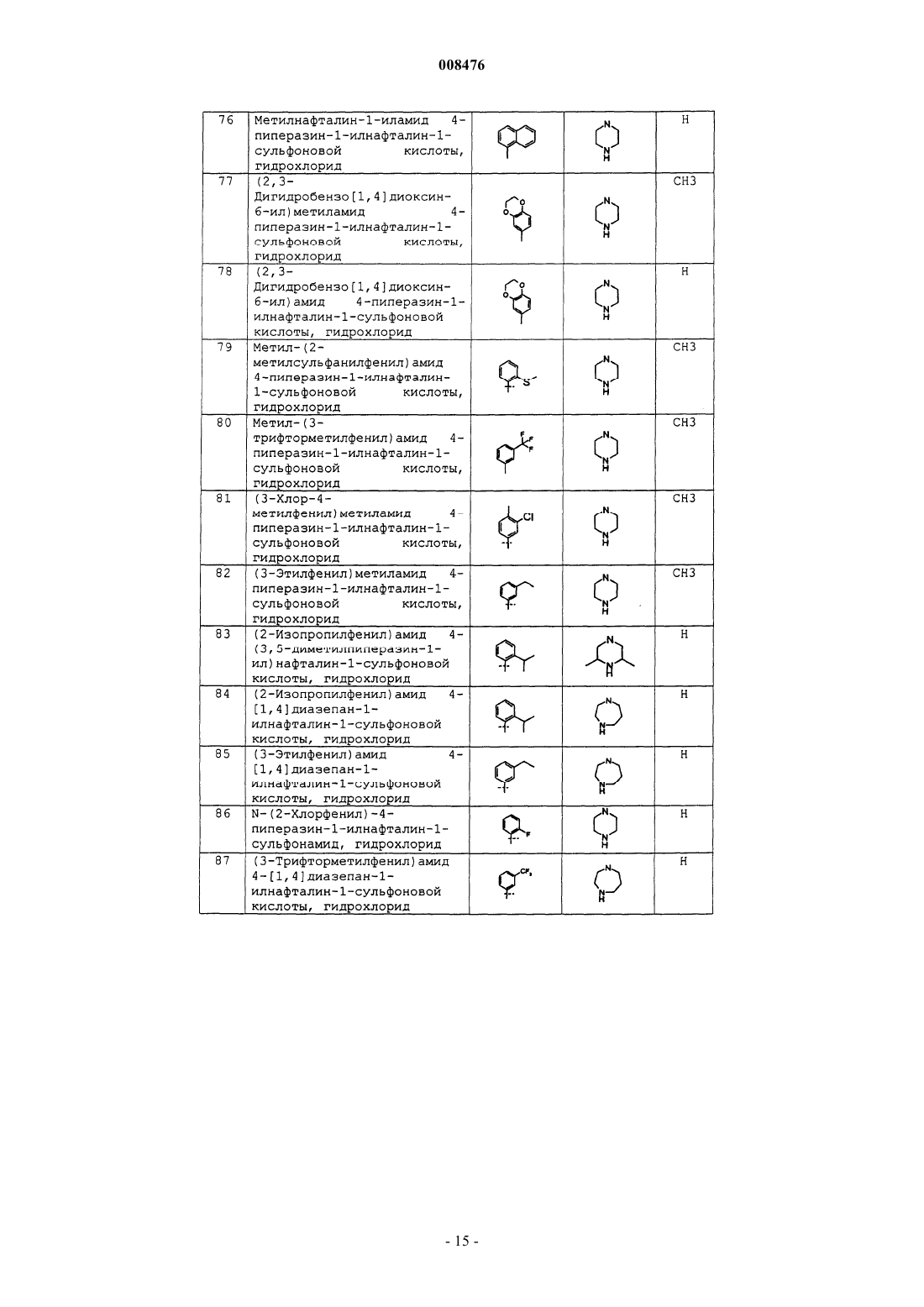
8. Соединение по п.2 или 7, представляющее собой
N-(4-метилфенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид,
N-(2,4-диметоксифенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-(3,4-дифторфенил)-4-(4-метил-1,4-диазепан-1-ил)-1-нафталинсульфонамид, гидрохлорид;
N-(3-фторфенил)-4-(4-метил-1,4-диазепан-1-ил)-1-нафталинсульфонамид, гидрохлорид;
4-(4-этил-1-пиперазинил)-N-фенил-1-нафталинсульфонамид, гидрохлорид;
4-гексагидропирроло[1,2-а]пиразин-2(1Н)-ил-N-(4-метилфенил)-1-нафталинсульфонамид, гидрохлорид;
N-(3,4-диметоксифенил)-4-гексагидропирроло[1,2-а]пиразин-2(1Н)-ил-1-нафталинсульфонамид, гидрохлорид;
4-(4-этил-1-пиперазинил)-N-(4-метилфенил)-1-нафталинсульфонамид, гидрохлорид;
N-(3,4-диметоксифенил)-4-(3-метил-1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-(4-метилфенил)-4-(4-метил-1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-[4-(2,5-диазабицикло[2,2,1]гепт-2-ил)-1-нафтил]-4-метилбензолсульфонамид, гидрохлорид;
N-(4-метилфенил)-4-(3-метил-1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-(2-нафтил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-метил-N-(4-метилфенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
4-(1,4-диазепан-1-ил)-N-(4-метилфенил)-1-нафталинсульфонамид, гидрохлорид;
4-(1,4-диазепан-1-ил)-N-(2-метокси-4-метилфенил)-1-нафталинсульфонамид, гидрохлорид;
N-(2-метокси-4-метилфенил)-4-(3,5-триметил-1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
4-(4-изопропил-1-пиперазинил)-N-(4-метилфенил)-1-нафталинсульфонамид, гидрохлорид;
4-бром-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2,5-дихлор-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид;
2-хлор-4-фтор-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид;
2,3-дихлор-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид;
2,4-дихлор-5-метил-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид;
3-трифторметил-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид;
2-трифторметил-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид;
4-бром-N-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
(4-пиперазин-1-илнафталин-1-ил)амид нафталин-1-сульфоновой кислоты, гидрохлорид;
(4-пиперазин-1-илнафталин-1-ил)амид 2,5-дихлортиофен-3-сульфоновой кислоты, гидрохлорид;
4-метокси-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
4-хлор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2-хлор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
N-(4-пиперазин-1-илнафталин-1-ил)-4-трифторметилбензолсульфонамид, гидрохлорид;
4-фтор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
5-фтор-2-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
4-фенокси-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2-бром-4-йод-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
(4-пиперазин-1-илнафталин-1-ил)амид тиофен-2-сульфоновой кислоты, гидрохлорид;
(4-пиперазин-1-илнафталин-1-ил)амид 5-хлортиофен-2-сульфоновой кислоты, гидрохлорид;
3-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
4-бутил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2,4,6-триметил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2,4,5-трихлор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
4-йод-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
3,4-дихлор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
5-бром-2-метокси-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2-бром-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
3-хлор-2-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2,6-дихлор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
3-метокси-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
3-хлор-4-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
4-бром-2-фтор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
2,4-дихлор-6-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
4-бром-2-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид;
(4-пиперазин-1-илнафталин-1-ил)амид 4,5-дихлортиофен-2-сульфоновой кислоты, гидрохлорид;
N-метил-N-(4-бром-2-метилфенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-метил-N-(5-фтор-2-метилфенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-мeтил-N-(2-метилфенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-метил-N-(3-хлор-2-метилфенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
2,5-диxлopтиoфeн-3-ил-N-мeтил-N-(2,5-дихлортиофен-3-ил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-метил-N-(2-нафтил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-мeтил-N-(1-нафтил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-метил-N-(4-хлорфенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
N-метил-N-(4-метоксифенил)-4-(1-пиперазинил)-1-нафталинсульфонамид, гидрохлорид;
5-фтор-2-метил-N-{4-[(2R,5S)-2,5-диметил-1]-пиперазин-1-ил-1-нафтил}бензолсульфонамид, гидрохлорид;
5-фтор-2-метил-N-[4-(1,2,3,6-тетрагидропиридин-4-ил)-1-нафтил]бензолсульфонамид, гидрохлорид;
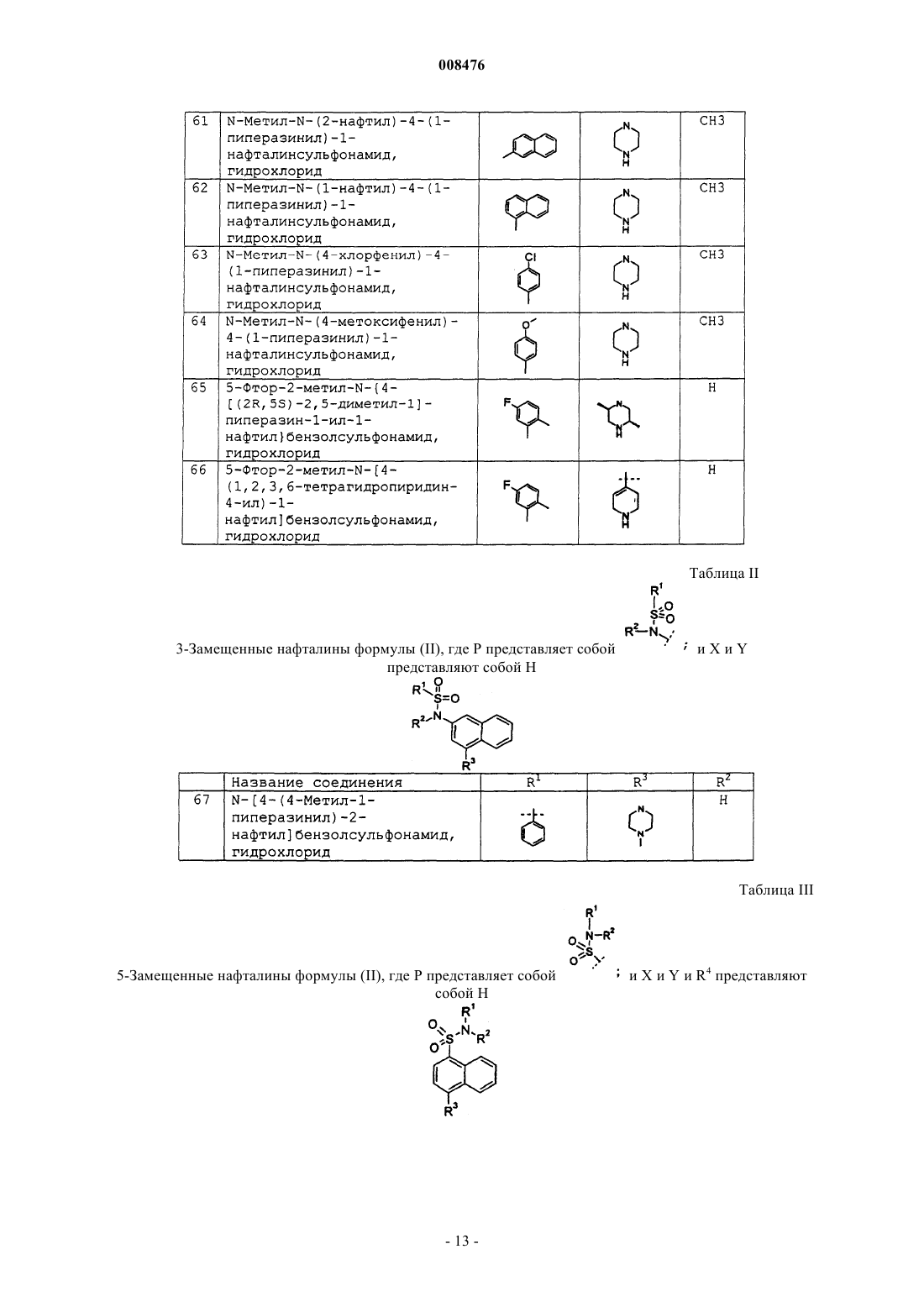
N-[4-(4-метил-1-пиперазинил)-2-нафтил]бензолсульфонамид, гидрохлорид;
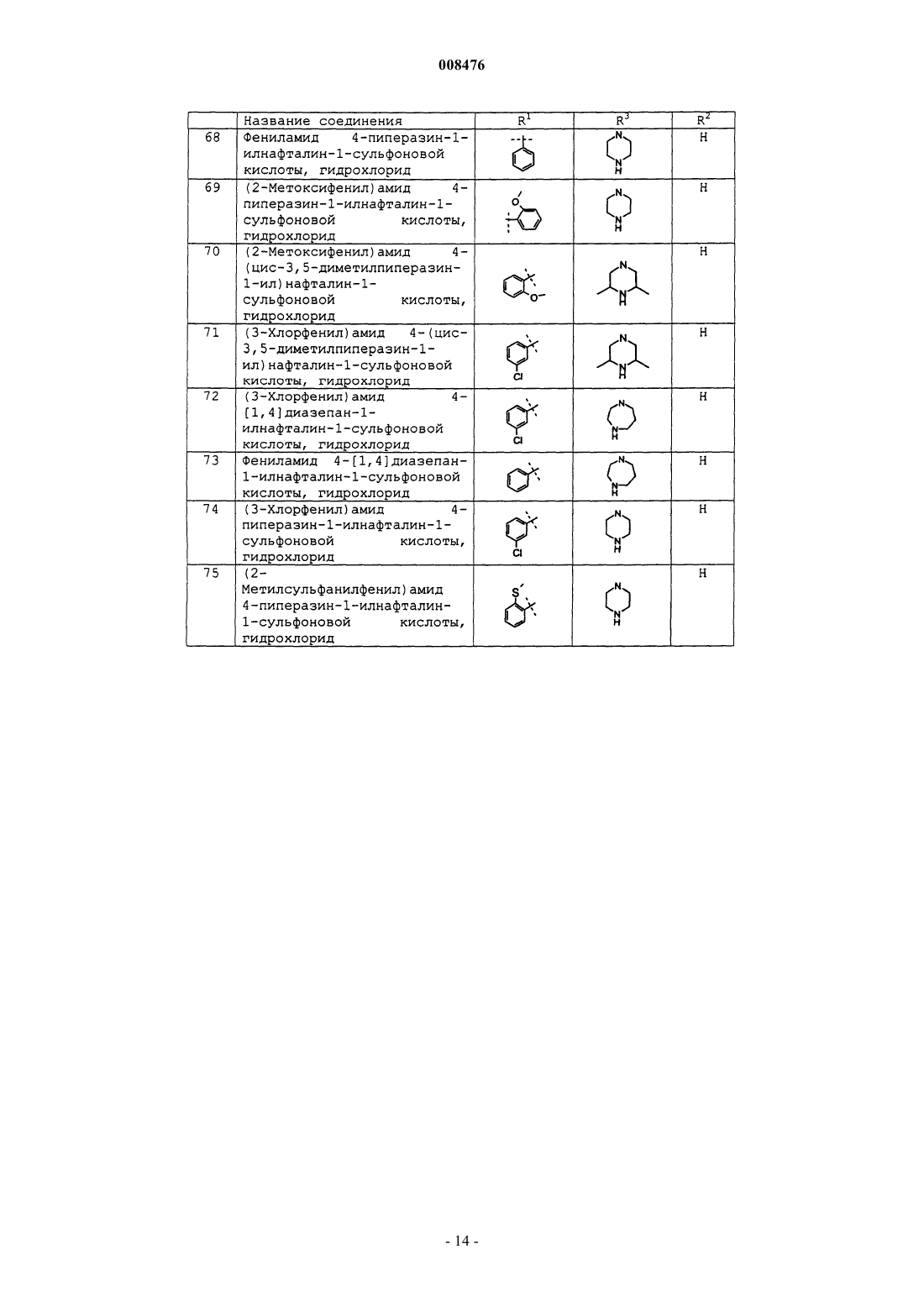
фениламид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2-метоксифенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2-метоксифенил)амид 4-(цис-3,5-диметилпиперазин-1-ил)нафталин-1-сульфоновой кислоты, гидрохлорид;
(3-хлорфенил)амид 4-(цис-3,5-диметилпиперазин-1-ил)нафталин-1-сульфоновой кислоты, гидрохлорид;
(3-хлорфенил)амид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
фениламид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-хлорфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2-метилсульфанилфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
метилнафталин-1-иламид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2,3-дигидробензо[1,4]диоксин-6-ил)метиламид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2,3-дигидробензо[1,4]диоксин-6-ил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
метил-(2-метилсульфанилфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
метил-(3-трифторметилфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-хлор-4-метилфенил)метиламид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-этилфенил)метиламид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2-изопропилфенил)амид 4-(3,5-диметилпиперазин-1-ил)нафталин-1-сульфоновой кислоты, гидрохлорид;
(2-изопропилфенил)амид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-этилфенил)амид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
N-(2-хлорфенил)-4-пиперазин-1-илнафталин-1-сульфонамид, гидрохлорид;
(3-трифторметилфенил)амид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
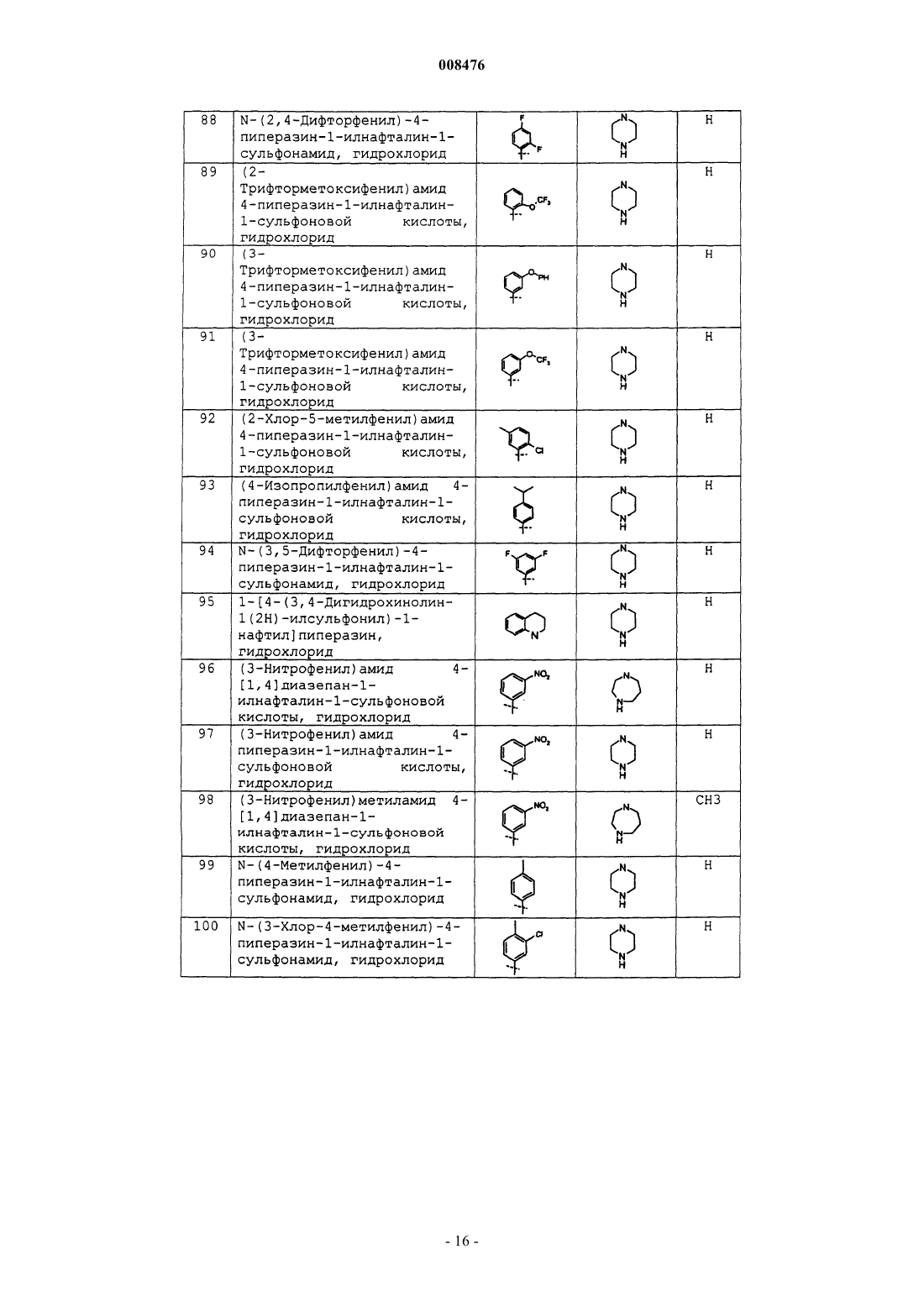
N-(2,4-дифторфенил)-4-пиперазин-1-илнафталин-1-сульфонамид, гидрохлорид;
(2-трифторметоксифенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-феноксифенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-трифторметоксифенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2-хлор-5-метилфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(4-изопропилфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
N-(3,5-дифторфенил)-4-пиперазин-1-илнафталин-1-сульфонамид, гидрохлорид;
1-[4-(3,4-дигидрохинолин-1(2Н)-илсульфонил)-1-нафтил]пиперазин, гидрохлорид;
(3-нитрофенил)амид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-нитрофенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-нитрофенил)метиламид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
N-(4-метилфенил)-4-пиперазин-1-илнафталин-1-сульфонамид, гидрохлорид;
N-(3-хлор-4-метилфенил)-4-пиперазин-1-илнафталин-1-сульфонамид, гидрохлорид;
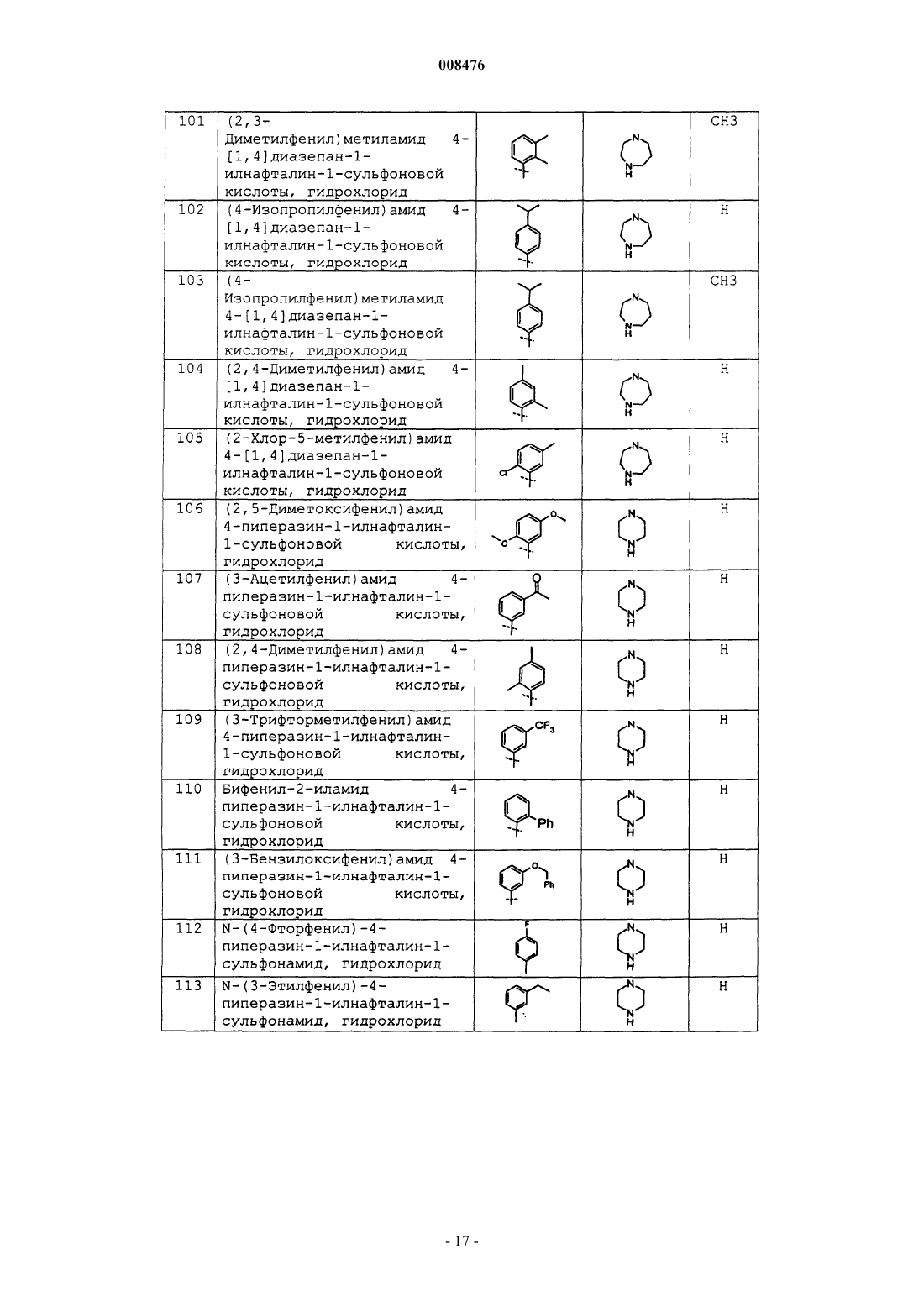
(2,3-диметилфенил)метиламид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(4-изопропилфенил)амид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(4-изопропилфенил)метиламид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2,4-диметилфенил)амид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2-хлор-5-метилфенил)амид 4-[1,4]диазепан-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2,5-диметоксифенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-ацетилфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(2,4-диметилфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-трифторметилфенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
бифенил-2-иламид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
(3-бензилоксифенил)амид 4-пиперазин-1-илнафталин-1-сульфоновой кислоты, гидрохлорид;
N-(4-фторфенил)-4-пиперазин-1-илнафталин-1-сульфонамид, гидрохлорид;
N-(3-этилфенил)-4-пиперазин-1-илнафталин-1-сульфонамид, гидрохлорид;
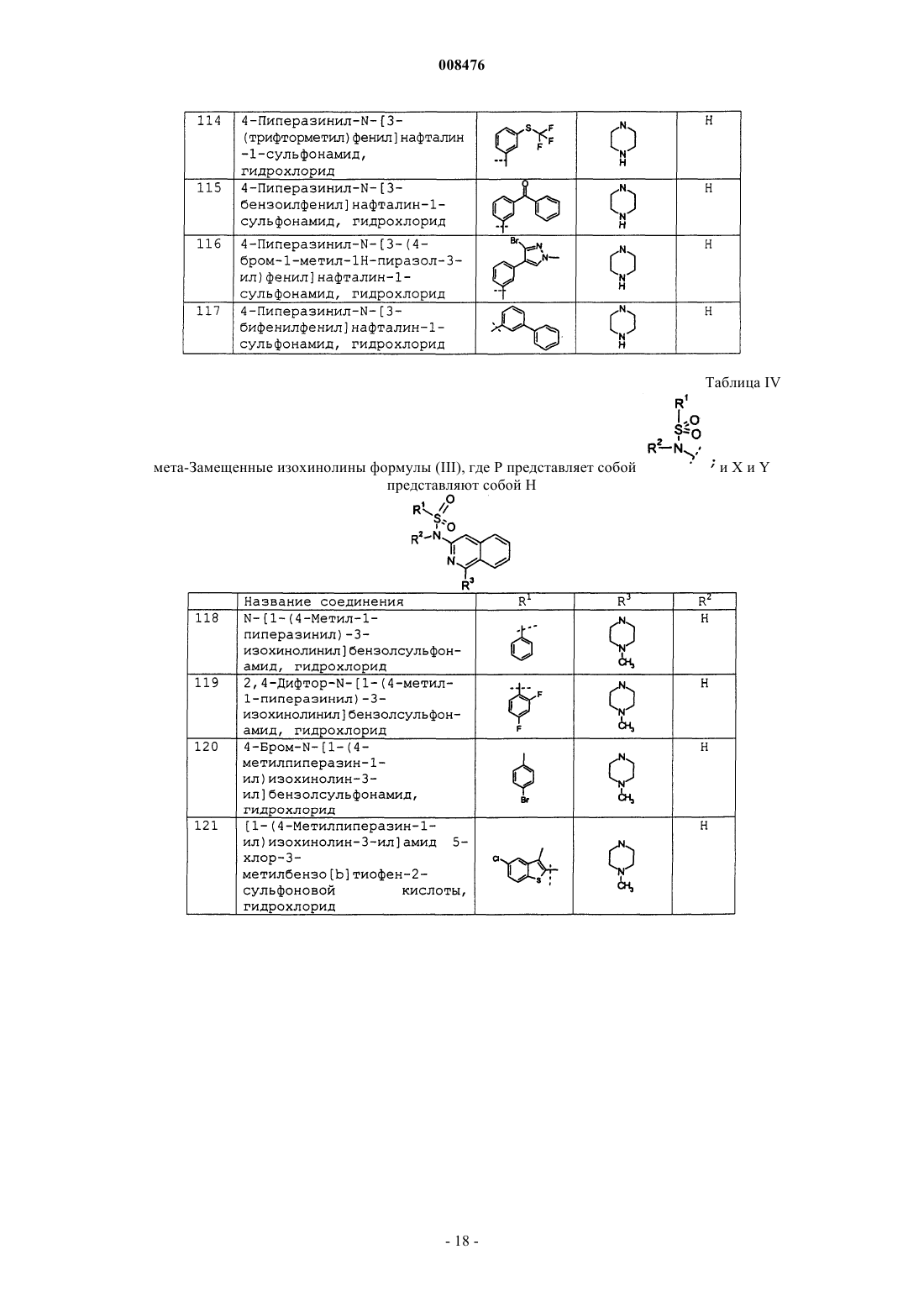
4-пиперазинил-N-[3-(трифторметил)фенил]нафталин-1-сульфонамид, гидрохлорид;
4-пиперазинил-N-[3-бензоилфенил]нафталин-1-сульфонамид, гидрохлорид;
4-пиперазинил-N-[3-(4-бром-1-метил-1Н-пиразол-3-ил)фенил]нафталин-1-сульфонамид, гидрохлорид;
4-пиперазинил-N-[3-бифенилфенил]нафталин-1-сульфонамид, гидрохлорид;
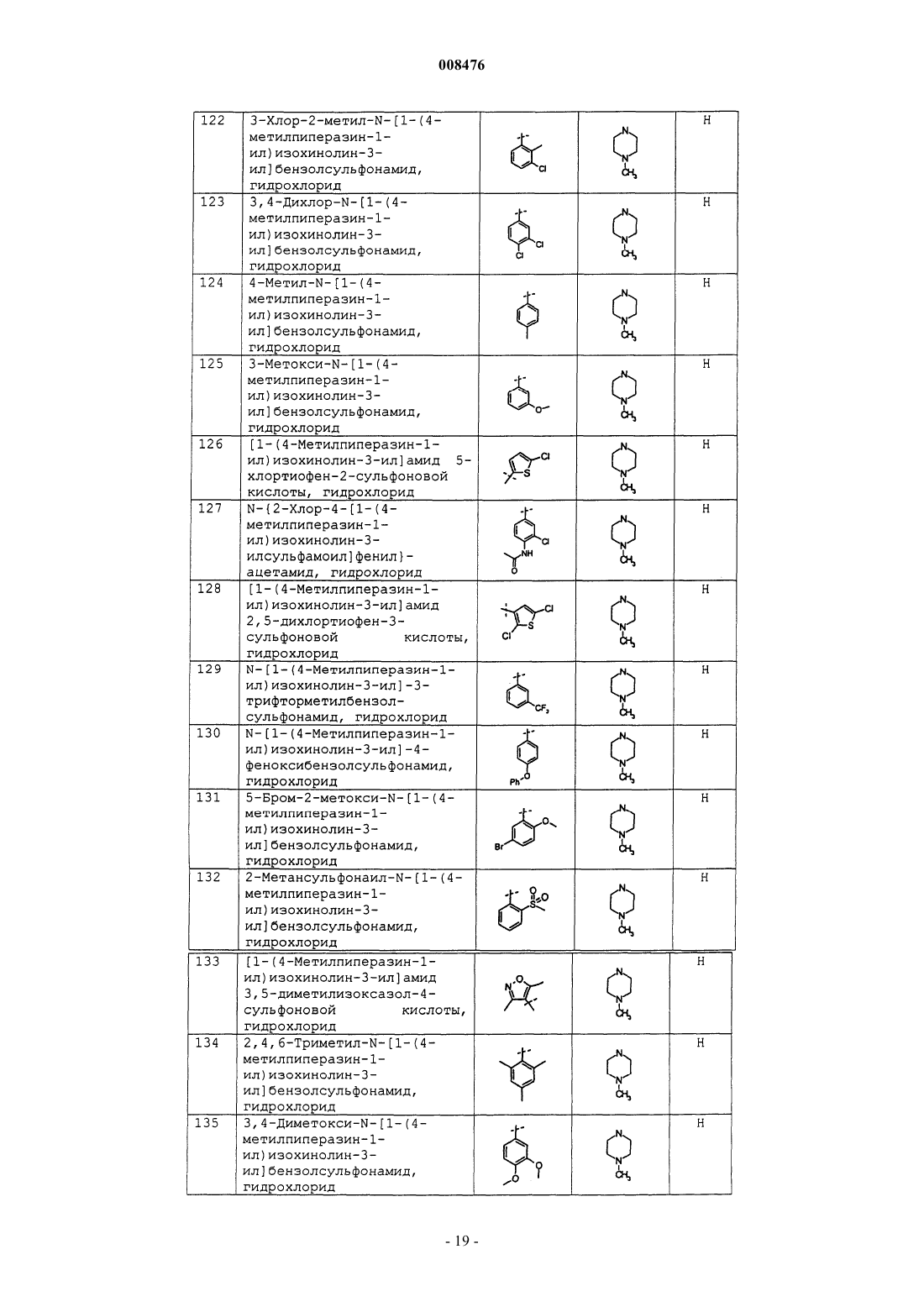
N-[1-(4-метил-1-пиперазинил)-3-изохинолинил]бензолсульфонамид, гидрохлорид;
2,4-дифтор-N-[1-(4-метил-1-пиперазинил)-3-изохинолинил]бензолсульфонамид, гидрохлорид;
4-бром-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфоновой кислоты, гидрохлорид;
3-хлор-2-метил-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
3,4-дихлор-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
4-метил-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
3-метокси-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]амид 5-хлортиофен-2-сульфоновой кислоты, гидрохлорид;
N-{2-хлор-4-[1-(4-метилпиперазин-1-ил)изохинолин-3-илсульфамоил]фенил}ацетамид, гидрохлорид;
[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]амид 2,5-дихлортиофен-3-сульфоновой кислоты, гидрохлорид;
N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]-3-трифторметилбензолсульфонамид, гидрохлорид;
N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]-4-феноксибензолсульфонамид, гидрохлорид;
5-бром-2-метокси-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
2-метансульфонаил-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]амид 3,5-диметилизоксазол-4-сульфоновой кислоты, гидрохлорид;
2,4,6-триметил-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
3,4-диметокси-N-[1-(4-метилпиперазин-1-ил)изохинолин-3-ил]бензолсульфонамид, гидрохлорид;
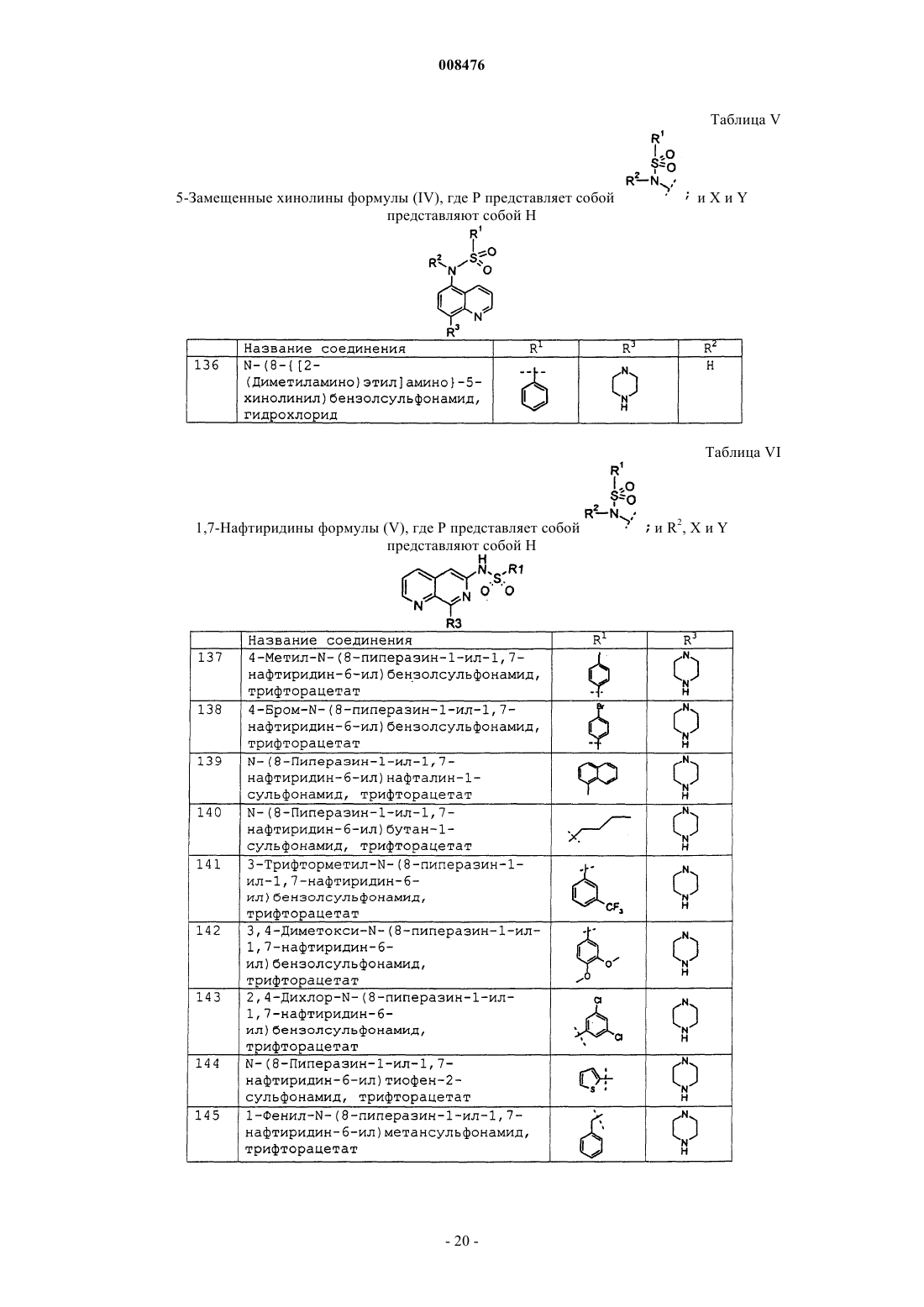
N-(8-{[2-(диметиламино)этил]амино}-5-хинолинил)бензолсульфонамид, гидрохлорид;
4-метил-N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил)бензолсульфонамид, трифторацетат;
4-бpoм-N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил)бензолсульфонамид, трифторацетат;
N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил)нафталин-1-сульфонамид, трифторацетат;
N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил)бутан-1-сульфонамид, трифторацетат;
3-трифторметил-N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил) бензолсульфонамид, трифторацетат;
3,4-диметокси-N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил) бензолсульфонамид, трифторацетат;
2,4-дихлор-N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил)бензолсульфонамид, трифторацетат;
N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил)тиофен-2-сульфонамид, трифторацетат;
1-фенил-N-(8-пиперазин-1-ил-1,7-нафтиридин-6-ил)метансульфонамид, трифторацетат;
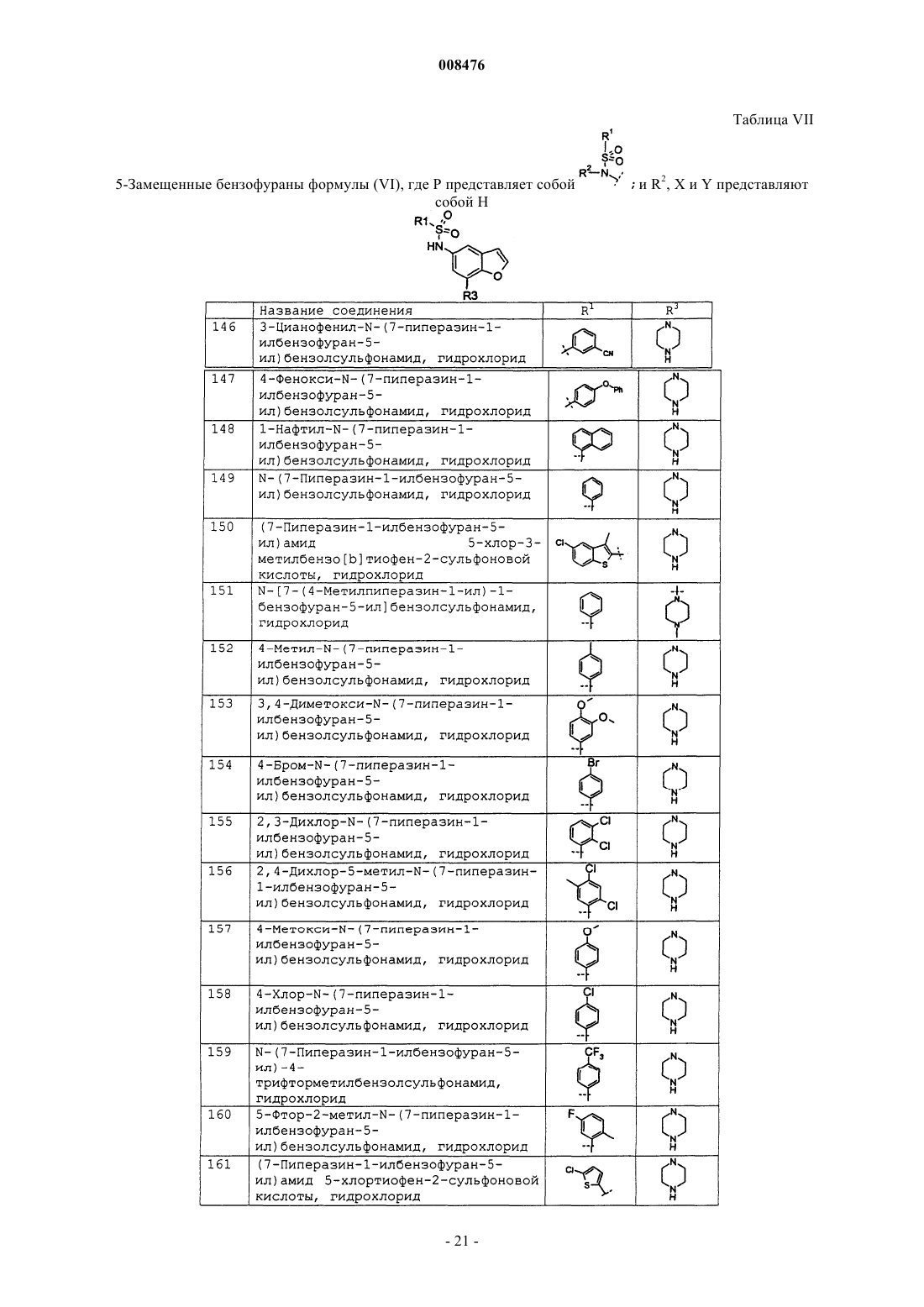
3-цианофенил-N-(7-пиперазин-1-илбензофуран-5-ил)бензолсульфонамид, гидрохлорид;
4-фенокси-N-(7-пиперазин-1-илбензофуран-5-ил)бензолсульфонамид, гидрохлорид;
1-нафтил-N-(7-пиперазин-1-илбензофуран-5-ил)бензолсульфонамид, гидрохлорид;
N-(7-пиперазин-1-илбензофуран-5-ил)бензолсульфонамид, гидрохлорид;
(7-пиперазин-1-илбензофуран-5-ил)амид 5-хлор-3-метилбензо[b]тиофен-2-сульфоновой кислоты, гидрохлорид;
N-[7-(4-метилпиперазин-1-ил)-1-бензофуран-5-ил]бензолсульфонамид, гидрохлорид.
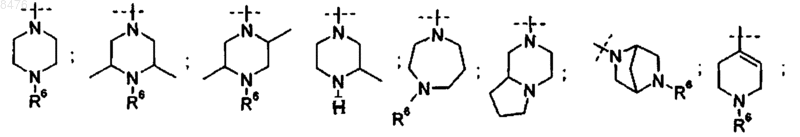
9. Способ получения соединения по п.2, где Р представляет собой 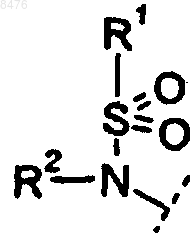 и R3 представляет диамин, выбранный из группы
и R3 представляет диамин, выбранный из группы

включающий стадии
(а) нуклеофильного замещения в ароматическом ядре атома галогена в 1-хлор-3-нитронафталине или 1-хлор-4-нитронафталине диаминами, выбранными из R3;
(b) восстановления нитрогруппы в 1-диамин-3-нитронафталине или 1-диамин-4-нитронафталине, полученном на стадии (а), с образованием 1-диамин-3-NH2-нафталина или 1-диамин-4-NH2-нафталина, соответственно; и
(c) взаимодействия 1-диамин-3-NH2-нафталина или 1-диамин-4-NH2-нафталина, полученного на стадии (b), с подходящим сульфонилхлоридом, с получением сульфонамида.
10. Способ по п.9, где стадия (а) представляет собой нуклеофильное замещение, катализируемое палладием.
11. Способ получения соединения по п.4, где Р представляет собой 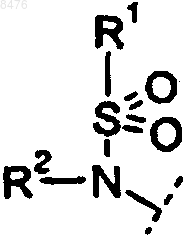 и R3 представляет диамин, выбранный из группы
и R3 представляет диамин, выбранный из группы
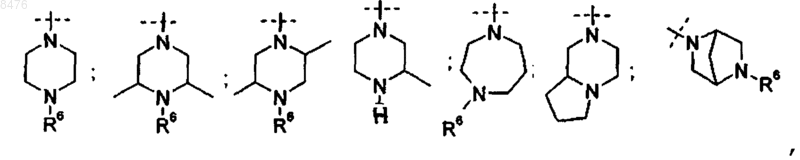
включающий стадии
(а) нуклеофильного замещения в ароматическом ядре трифторметансульфонатной группы в 2-трифторметансульфонат-5-нитрохинолине с диаминами, выбранными из R3;
(b) восстановления нитрогруппы в 2-диамин-5-нитрохинолине, полученном на стадии (а), с образованием 2-диамин-5-NH2-хинолина; и
(с) взаимодействия 2-диамин-5-NH2-хинолина, полученного на стадии (b), с подходящим сульфонилхлоридом с получением сульфонамида.
12. Способ получения соединения по п.2, где Р представляет собой 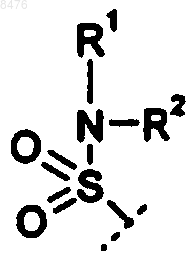 и R3 представляет диамин, выбранный из группы
и R3 представляет диамин, выбранный из группы
включающий стадии
(a) взаимодействия фторнафталина и хлорсульфоновой кислоты в кислой среде с целью введения сульфонилхлоридной группы в пара-положение относительно углерода с присоединенным атомом фтора;
(b) взаимодействия продукта реакции со стадии (а) с алифатическим или ароматическим первичным амином с образованием сульфонамида; и
(c) взаимодействия продукта реакции со стадии (b) с диамином, выбранным из R3.
13. Способ лечения или профилактики ожирения, диабета типа II и/или других расстройств, связанных с принятием пищи, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы (I), обладающего активностью антагониста рецептора
5-HT6, или его фармацевтически приемлемой соли, причем в соединении формулы (I)
цикл В представляет собой 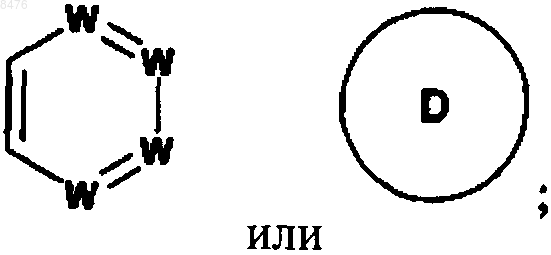
где D представляет фуран;
W представляет собой N или -(СН)-, при условии, что не более двух групп W представляют собой N в обоих циклах А и В вместе и кольцо А и кольцо В оба независимо выбирают из бензола и пиридина;
Р представляет собой
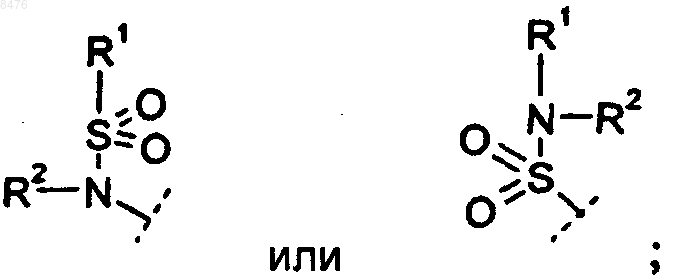
Р и R3 связаны с одним и тем же циклом и располагаются в мета- или пара-положении относительно друг друга;
R1 представляет собой
(a) C1-6-алкил,
(b) группу Ar;
Ar представляет собой
(а) фенил,
(b) 1-нафтил,
(c) 2-нафтил,
(d) бензил,
(e) циннамоил,
(f) 5-7-членный, необязательно ароматический, частично насыщенный или полностью насыщенный гетероцикл, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота и серы, или
(g) бициклическую систему, содержащую по меньшей мере один гетероцикл согласно (f),
где группа Ar замещена в одной или нескольких позициях
(a) Н, X или Y или
(b) 5-7-членным, необязательно ароматическим, частично насыщенным или полностью насыщенным гетероциклом, содержащим 1-4 гетероатома, выбранных из атомов кислорода, азота или серы;
R2 представляет собой
(a) Н, или
(b) C1-6-алкил,
один из R3 представляет собой группу
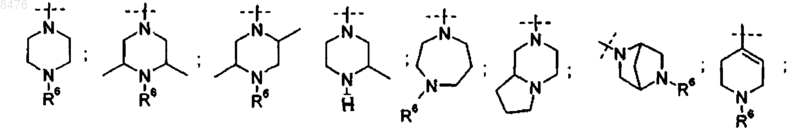
X и Y представляют собой независимо
(a) Н,
(b) галоген,
(c) C1-6-алкил,
(d) -CF3,
(f) C1-6-алкокси,
(h) фенил,
(i) фенокси,
(j) бензилокси,
(k) бензоил,
(l) -OCF3,
(m) -CN,
(n) линейный или разветвленный C1-6-гидроксиалкил,
(о) линейный или разветвленный C1-6-алкилгалогенид,
(p) -NH2,
(s) -NO2,
(v) -NR4COR5,
(z) -C(=O)R4,
(ab) -S(O)nR4, где n равен 0, 1, 2 или 3;
(ad) -SCF3;
R4 и R5 представляют собой независимо
(a) H,
(b) C1-6-алкил,
(c) C3-7-циклоалкил или
(d) Ar, имеющий значения, указанные выше в случае R1;
в альтернативном случае, R4 и R5 соединяются с образованием группы (СН2)2O, (СН2)4O или
(СН2)3-5; и
R6 представляет собой
(a) Н или
(b) линейный или разветвленный C1-6-алкил.
14. Способ модуляции активности рецептора 5-НТ6 для лечения или профилактики ожирения, диабета типа II и/или других расстройств, связанных с принятием пищи, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I)
или его фармацевтически приемлемой соли, где в указанной формуле
цикл В представляет собой 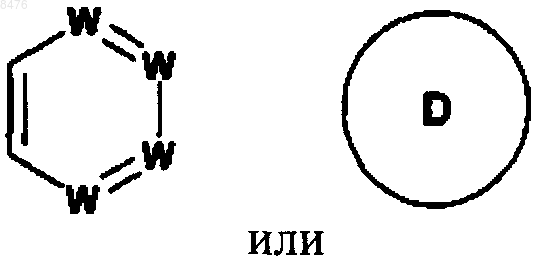
где D представляет фуран;
W представляет собой N или -(СН)-, при условии, что не более двух групп W представляют собой N в обоих циклах А и В вместе и кольцо А и кольцо В оба независимо выбирают из бензола и пиридина;
Р представляет собой

Р и R3 связаны с одним и тем же циклом и располагаются в мета- или пара-положении относительно друг друга;
R1 представляет собой
(a) C1-6-алкил,
(b) группу Ar;
Ar представляет собой
(a) фенил,
(b) 1-нафтил,
(c) 2-нафтил,
(d) бензил,
(e) циннамоил,
(f) 5-7-членный, необязательно ароматический, частично насыщенный или полностью насыщенный гетероцикл, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота и серы, или
(g) бициклическую систему, содержащую по меньшей мере один гетероцикл согласно (f),
где группа Ar замещена в одной или нескольких позициях
(a) Н, X или Y или
(b) 5-7-членным, необязательно ароматическим, частично насыщенным или полностью насыщенным гетероциклом, содержащим 1-4 гетероатома, выбранных из атомов кислорода, азота или серы;
R2 представляет собой
(a) Н, или
(b) C1-6-алкил,
один из R3 представляет собой группу
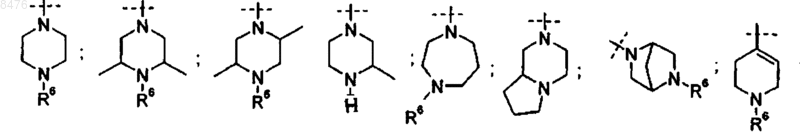
X и Y представляют собой независимо
(a) Н,
(b) галоген,
(c) C1-6-алкил,
(d) -CF3,
(f) C1-6-алкокси,
(h) фенил,
(i) фенокси,
(j) бензилокси,
(k) бензоил,
(l) -OCF3,
(m) -CN,
(n) линейный или разветвленный C1-6-гидроксиалкил,
(о) линейный или разветвленный C1-6-алкилгалогенид,
(p) -NH2,
(s) -NO2,
(v) -NR4COR5,
(z) -C(=O)R4,
(ab) -S(O)nR4, где n равен 0, 1, 2 или 3;
(ad) -SCF3;
R4 и R5 представляют собой независимо
(a) H,
(b) C1-6-алкил,
(c) C3-7-циклоалкил или
(d) Ar, имеющий значения, указанные выше в случае R1;
в альтернативном случае, R4 и R5 соединяются с образованием группы (СН2)2O, (СН2)4O или
(СН2)3-5; и
R6 представляет собой
(a) Н или
(b) линейный или разветвленный C1-6-алкил.
15. Применение соединения формулы (I), обладающего активностью антагониста рецептора 5-HT6, для получения лечебного средства для применения при лечении или профилактике ожирения, диабета типа II и/или других расстройств, связанных с принятием пищи,
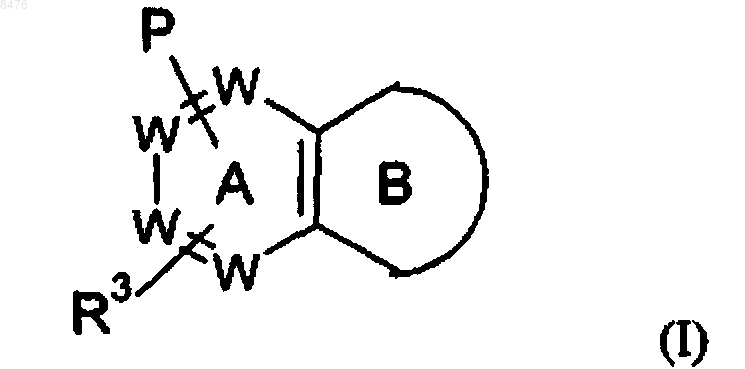
или его фармацевтически приемлемой соли, где в указанной формуле
цикл В представляет собой 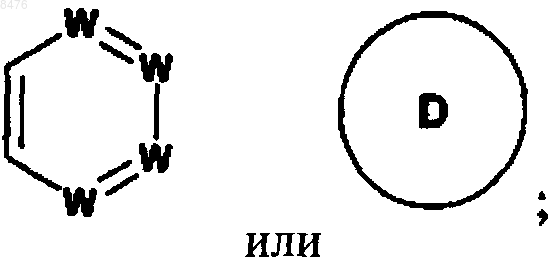
где D представляет фуран;
W представляет собой N или -(СН)-, при условии, что не более двух групп W представляют собой N в обоих циклах А и В вместе и кольцо А и кольцо В оба независимо выбирают из бензола и пиридина;
Р представляет собой

Р и R3 связаны с одним и тем же циклом и располагаются в мета- или пара-положении относительно друг друга;
R1 представляет собой
(a) C1-6-алкил,
(b) группу Ar;
Ar представляет собой
(a) фенил,
(b) 1-нафтил,
(c) 2-нафтил,
(d) бензил,
(e) циннамоил,
(f) 5-7-членный, необязательно ароматический, частично насыщенный или полностью насыщенный гетероцикл, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота и серы, или
(g) бициклическую систему, содержащую по меньшей мере один гетероцикл согласно (f),
где группа Ar замещена в одной или нескольких позициях
(a) Н, X или Y или
(b) 5-7-членным, необязательно ароматическим, частично насыщенным или полностью насыщенным гетероциклом, содержащим 1-4 гетероатома, выбранных из атомов кислорода, азота или серы;
R2 представляет собой
(a) Н, или
(b) C1-6-алкил,
один из R3 представляет собой группу
X и Y представляют собой независимо
(a) Н,
(b) галоген,
(c) C1-6-алкил,
(d) -CF3,
(f) C1-6-алкокси,
(h) фенил,
(i) фенокси,
(j) бензилокси,
(k) бензоил,
(l) -OCF3,
(m) -CN,
(n) линейный или разветвленный C1-6-гидроксиалкил,
(о) линейный или разветвленный C1-6-алкилгалогенид,
(p) -NH2,
(s) -NO2,
(v) -NR4COR5,
(z) -C(=O)R4,
(ab) -S(O)nR4, где n равен 0, 1, 2 или 3;
(ad) -SCF3; R4 и R5 представляют собой независимо
(a) H,
(b) C1-6-алкил,
(c) C3-7-циклоалкил или
(d) Ar, имеющий значения, указанные выше в случае R1;
в альтернативном случае, R4 и R5 соединяются с образованием группы (СН2)2O, (СН2)4O или
(СН2)3-5; и
R6 представляет собой
(a) Н или
(b) линейный или разветвленный C1-6-алкил.
16. Фармацевтическая композиция, пригодная для лечения или профилактики заболеваний, связанных с ингибированием рецептора 5-HT6, выбранных из группы, включающей ожирение, диабет типа II и/или другие расстройства, связанные с принятием пищи, где активным ингредиентом является соединение формулы (I), обладающее активностью антагониста рецептора 5-HT6
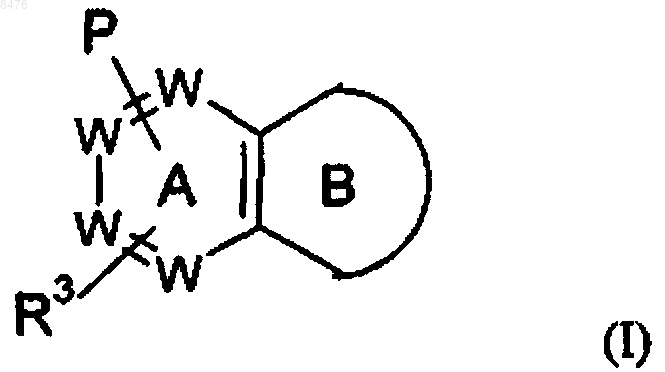
или его фармацевтически приемлемая соль, где в указанной формуле
цикл В представляет собой 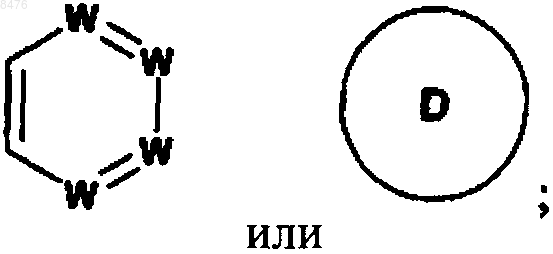
где D представляет фуран;
W представляет собой N или -(СН)-, при условии, что не более двух групп W представляют собой N в обоих циклах А и В вместе и кольцо А и кольцо В оба независимо выбирают из бензола и пиридина;
Р представляет собой

Р и R3 связаны с одним и тем же циклом и располагаются в мета- или пара-положении относительно друг друга;
R1 представляет собой
(a) C1-6-алкил,
(b) группу Ar;
Ar представляет собой
(a) фенил,
(b) 1-нафтил,
(c) 2-нафтил,
(d) бензил,
(e) циннамоил,
(f) 5-7-членный, необязательно ароматический, частично насыщенный или полностью насыщенэыщ гетероцикл, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота и серы, или
(g) бициклическую систему, содержащую по меньшей мере один гетероцикл согласно (f),
где группа Ar замещена в одной или нескольких позициях
(a) Н, X или Y или
(b) 5-7-членным, необязательно ароматическим, частично насыщенным или полностью насыщенным гетероциклом, содержащим 1-4 гетероатома, выбранных из атомов кислорода, азота или серы;
R2 представляет собой
(a) Н или
(b) C1-6-алкил,
один из R3 представляет собой группу
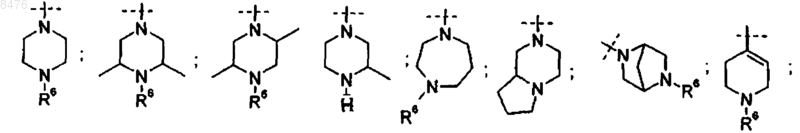
X и Y представляют собой независимо
(a) Н,
(b) галоген,
(c) C1-6-алкил,
(d) -CF3,
(f) C1-6-алкокси,
(h) фенил,
(i) фенокси,
(j) бензилокси,
(k) бензоил,
(l) -OCF3,
(m) -CN,
(n) линейный или разветвленный C1-6-гидроксиалкил,
(о) линейный или разветвленный C1-6-алкилгалогенид,
(p) -NH2,
(s) -NO2,
(v) -NR4COR5,
(z) -C(=O)R4,
(ab) -S(O)nR, где n равен 0, 1, 2 или 3;
(ad) -SCF3;
R4 и R5 представляют собой независимо
(a) H,
(b) C1-6-алкил,
(c) C3-7-циклоалкил или
(d) Ar, имеющий значения, указанные выше в случае R1;
в альтернативном случае, R4 и R5 соединяются с образованием группы (СН2)2O, (СН2)4O или
(СН2)3-5; и
R6 представляет собой
(a) H или
(b) линейный или разветвленный C1-6-алкил.
Текст
008476 Настоящее изобретение относится к замещенным сульфонамидам, к фармацевтическим композициям, содержащим такие соединения, и к применению указанных соединений для профилактики и лечения болезней, относящихся к ожирению, диабету типа II и расстройствам ЦНС. Ожирение является состоянием, характеризующимся повышением содержания жировой ткани в организме, приводящим к избыточной массе тела, превышающей признанные нормы. Ожирение является наиболее важным нарушением питания в западном мире и представляет наибольшую проблему, связанную со здоровьем, во всех промышленно развитых странах. Такое расстройство приводит к повышенной смертности из-за возросшей частоты заболевания такими болезнями, как сердечно-сосудистые заболевания, болезни пищеварительного тракта, респираторные заболевания, рак и диабет типа II. Поиск соединений, снижающих массу тела, ведется в течение многих десятилетий. Одним из направлений исследований является активация серотонинергических систем или путем прямого активирования подтипов серотониновых рецепторов, или путем подавления обратного поглощения серотонина. Однако точные характеристики подтипов рецепторов неизвестны. Серотонин (5-гидрокситриптамин или 5-НТ) - ключевой трансмиттер периферической и центральной нервной системы модулирует широкий ряд физиологических и патологических функций, в том числе страх, регуляцию сна, агрессию, питание и депрессию. Идентифицированы и клонированы несколько подтипов серотониновых рецепторов. Один из них рецептор 5-НТ 6 клонирован рядом исследователей в 1993 г. (Ruat M. et al. (1993), Biochem. Biophys. Res. Commun., 193:268-276; Sebben M. et al. (1994), NeuroReport, 5:2553-2557). Данный рецептор положительно соединяется с аденилилциклазой и отражает аффинность к антидепрессантам, таким как клозапин. Недавно появились сообщения о влиянии антагониста 5-HT6 и антисмысловых олигонуклеотидов 5-HT6 на снижение потребления корма крысами (BentleyJ.С. et al. (1999), Br. J. Pharmac. Suppl., 126, P66; Bentley J.C. et al. (1997), J. Psychopharmacol. Suppl., A64,255). Соединения с усиленной аффинностью и селективностью в отношении рецептора 5-HT6 идентифицированы, например, в WO 00/34242 и работе Isaac M. et al. (2000), 6-Bicyclopiperazinyl-1arylsulfonylindoles and 6-Bicyclopiperazinyl-1-arylsulfonylindoles derivatives as novel, potent and selective 5HT6 receptor antagonists. BioorganicMedicinal Chemistry Letters, 10:1719-1721 (2000). В J. Med. Chem., 1970, 13 (4), 592-598, описываются N-(4-[2-(диэтиламино)этил]амино-1 нафтил)амиды; N-5,6,7,8-тетрагидро-4-[(3-пиперидинопропил)амино]-1-нафтиламиды и родственные амиды и производные мочевины как шистосомицидные средства. В WO 99/42465 описываются производные сульфонамидов, связывающиеся с рецептором 5-HT6,которые можно использовать для лечения расстройств ЦНС, таких как страх, депрессия, эпилепсия, обсессивно-компульсивные расстройства, расстройства познавательной способности, ADHD, анорексия и булимия, шизофрения, злоупотребление лекарственными средствами. В WO 01/32646 А 1 описываются соединения, связывающиеся с рецептором 5-HT6, которые используют для лечения расстройств ЦНС и которые, среди прочего, можно использовать для лечения расстройств, связанных с питанием. В WO 99/37623 А 2 описываются соединения, связывающиеся с рецептором 5-НТ 6, которые используют для лечения расстройств ЦНС и которые, среди прочего, можно использовать для лечения расстройств, связанных с питанием. В WO 99/42465 A3 описываются соединения, связывающиеся с рецептором 5-HT6, которые используют для лечения расстройств ЦНС и которые, среди прочего, можно использовать для лечения расстройств, связанных с питанием. В ЕР 0815861 А 1 описываются соединения, связывающиеся с рецептором 5-HT6, которые используют для лечения расстройств ЦНС. В WO 99/02502 А 2 описываются соединения, связывающиеся с рецептором 5-НТ 6, которые используют для лечения расстройств ЦНС и которые, среди прочего, можно использовать для лечения расстройств, связанных с питанием. В WO 98/27081 А 1 описываются соединения, связывающиеся с рецептором 5-HT6, которые используют для лечения расстройств ЦНС и которые, среди прочего, можно использовать для лечения расстройств, связанных с питанием. Неожиданно обнаружено, что соединения формулы (I) показывают аффинность к рецептору 5-HT6 как антагонисты в низком наномолярном интервале. Соединения по изобретению и их фармацевтически приемлемые соли обладают антагонистической активностью в отношении рецептора 5-HT6 и, как предполагается, потенциально применимы при лечении или профилактике ожирения и диабета типа II, а также при лечении или профилактике расстройств центральной нервной системы, таких как страх, депрессия, приступы паники, расстройства памяти, расстройства сна, мигрень, анорексия, булимия, расстройства, связанные с излишним употреблением спиртных напитков, обсессивно-компульсивные расстройства, психозы, болезнь Альцгеймера, болезнь Паркинсона, хорея Гентингтона и/или шизофрения, связанный с гиперактивностью дефицит внимания (ADHD), злоупотребление лекарственными средствами.-1 008476 Определения Если не установлено или не указано иное, термин "C1-6-алкил" относится к линейной или разветвленной алкильной группе с 1-6 атомами углерода. Примерами указанной низшей алкильной группы являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и пентил и гексил с линейной или разветвленной цепью. Если не установлено или не указано иное, термин "C1-6-алкокси" относится к линейной или разветвленной алкоксигруппе с 1-6 атомами углерода. Примерами указанной низшей алкоксигруппы являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси и пентокси и гексокси с линейной или разветвленной цепью. Если не установлено или не указано иное, термин "галоген" будет обозначать фтор, хлор, бром или йод. Термин "C3-7-циклоалкил" обозначает циклическую алкильную группу, содержащую 3-7 атомов углерода. Примерами указанного циклоалкила являются циклопропил, циклобутил, циклопентил, циклогексил, метилциклогексил и циклогептил. Термин "гетероциклический" относится к углеводородной циклической системе с 4-8 членами в цикле, содержащей в качестве части цикла по меньшей мере один гетероатом (например, S, N или О). Он включает насыщенные, ненасыщенные, ароматические и неароматические гетероциклы. Подходящими гетероциклическими группами являются тиенильная, фурильная, пиридильная, пирролидинильная, имидазолильная, пиразолильная, пиперидильная, азепинильная, морфолинильная, пиранильная, диоксанильная, пиридазинильная, пиримидинильная и пиперазинильная группы. Термин "гетероарил" относится к углеводородной циклической системе по меньшей мере с одним ароматическим циклом, содержащей по меньшей мере один гетероатом, такой как О, N или S. Примерами гетероарильных групп являются фурильная, пирролильная, тиенильная, оксазолильная, имидазолильная, тиазолильная, пиридинильная, пиримидинильная, хиназолинильная и индолильная группы. Соединения формулы (I). В первом аспекте настоящее изобретение относится к соединению общей формулы (I) или его фармацевтически приемлемой соли, гдеW представляет собой N или -(СН)-, при условии, что не более трех групп W представляют собой N; Р представляет собой при условии, что Р и R3 могут находиться только в мета- или пара-положении друг к другу;(a) C1-6-алкил,(b) C1-6-алкоксиалкил,(c) линейный или разветвленный C1-6-гидроксиалкил,(d) линейный или разветвленный C1-6-алкилгалогенид или(a) фенил,(b) 1-нафтил,(c) 2-нафтил,(d) бензил,(e) циннамоил,(f) 5-7-членный, необязательно ароматический, частично насыщенный или полностью насыщенный гетероцикл, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота и серы, или(g) бициклическую систему, содержащую по меньшей мере один гетероцикл согласно (f),где группа Ar замещена в одной или нескольких позициях(b) 5-7-членным, необязательно ароматическим, частично насыщенным или полностью насыщенным моно- или бициклическим гетероциклом, причем каждый цикл содержит 1-4 гетероатома, выбранных из атомов кислорода, азота или серы;(а) Н,(b) C1-6-алкил,(c) C1-6-алкоксиалкил,(d) линейный или разветвленный C1-6-гидроксиалкил или(e) линейный или разветвленный C1-6-алкилгалогенид; илиR1 и R2 вместе образуют группу (CH2)4O,R3 представляет собой группу(a) Н,(b) галоген,(c) C1-6-алкил,(d) CF3,(e) гидрокси,(f) C1-6-алкокси,(g) C1-4-алкенил,(h) фенил,(i) фенокси,(j) бензилокси,(k) бензоил,(l) -OCF3,(m) -CN,(n) линейный или разветвленный C1-6-гидроксиалкил,(о) линейный или разветвленный C1-6-алкилгалогенид,(р) -NH2,(q) -NHR4,(r) -NR4R5,(s) -NO2,(t) -CONR4R5,(u) -NHSO2R4,(v) -NR6COR5,(x) -SO2NR4R5,(z) -C(=O)R4,(aa) -CO2R4 или(b) C1-6-алкил. В одном аспекте данное изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где в указанной формуле-3 008476 где D представляет собой 5-членный гетероциклический или гетероарильный цикл, причем указанный цикл содержит один или два атома, выбранных из группы, состоящей из атомов азота, серы и кислорода, при условии, что когда D содержит атом кислорода, он представляет собой гетероарил;W представляет собой N или -(СН)-, при условии, что не более трех групп W представляют собой N в обоих циклах А и В вместе; Р представляет собой Р и R3 связаны с одним и тем же циклом и располагаются в мета- или пара-положении относительно друг друга;(a) C1-6-алкил,(b) C1-6-алкоксиалкил,(c) линейный или разветвленный C1-6-гидроксиалкил,(d) линейный или разветвленный C1-6-алкилгалогенид или(a) фенил,(b) 1-нафтил,(c) 2-нафтил,(d) бензил,(e) циннамоил,(f) 5-7-членный, необязательно ароматический, частично насыщенный или полностью насыщенный гетероцикл, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота или серы, или(g) бициклическую систему, содержащую по меньшей мере один гетероцикл согласно (f),где группа Ar замещена в одной или нескольких позициях(b) 5-7-членным гетероциклом, необязательно, ароматическим, частично насыщенным или полностью насыщенным, содержащим 1-4 гетероатома, выбранных из атомов кислорода, азота или серы;(a) Н,(b) C1-6-алкил,(c) C1-6-алкокси,(d) линейный или разветвленный C1-6-гидроксиалкил или(e) линейный или разветвленный C1-6-алкилгалогенид; или(f) C1-6-алкокси,(g) C1-4-алкенил,(h) фенил,(i) фенокси,(j) бензилокси,(k) бензоил,(l) -OCF3,(m) -CN,(n) линейный или разветвленный C1-6-гидроксиалкил,(о) линейный или разветвленный C1-6-алкилгалогенид,(p) -NH2,(q) -NHR4,(r) -NR4R5,(s) -NO2,(t) -CONR4R5,(u) -NHSO2R4,(v) -NR4COR5,(x) -SO2NR4R5,(z) -C(=O)R4,(aa) -CO2R4 или(b) линейный или разветвленный C1-6-алкил. Предпочтительно изобретение относится к нафталинам формулы (II), изохинолинам формулы (III),хинолинам формулы (IV), 1,7-нафтиридинам формулы (V) и бензофуранам, бензотиофенам или индолам формулы (VI) где R3, P, X и Y имеют значения, указанные в случае формулы (I); и где D в формуле (VI) представляет собой 5-членный гетероциклический или гетероарильный цикл, причем указанный цикл содержит один или два атома, выбранных из группы, состоящей из атомов азота, серы и кислорода, при условии, что,когда D содержит атом кислорода, он представляет собой гетероарил. Группа Y может присоединяться к любому незамещенному атому углерода в D. Когда гетероарильный цикл содержит один или два атома азота, группа R6 может присоединяться к вторичному азоту. Предпочтительными соединениями общих формул (I), (II), (III) и (IV), (V), (VI) являются соединения, в которых R1 представляет собой(f) 5-7-членный частично или полностью насыщенный моно- или бициклический гетероцикл, причем каждый цикл содержит 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; где группа Ar замещена в одном или нескольких положениях X или Y; где X или Y представляет собой(m) линейный или разветвленный C1-6-гидроксиалкил,(n) фенилокси,(о) бензилокси,(ab) -S(O)nR4, где n равен 0, 1, 2 или 3,(ac) -S-(C1-6)-алкил,(ad) -SCF3,(v) -NR4COR5,(х) -SO2NR4R5,(z) -C(=O)R4;D представляет собой фуранил. Предпочительными соединениями формулы (II) являются пара-замещенные нафталины, в которых Р представляет собой где R1 и R2 имеют значения, указанные в случае формулы (I); и X и Y представляют собой Н, атомы галогена, метил, метокси (см. табл. I). Особенно предпочтительными из таких соединений являются соединения, в которых R1 представляет собой фенил, метилфенил, метоксифенил, диметоксифенил, 1-нафтил, 2-нафтил, фторметилфенил, хлорфенил, дихлорфенил, фторхлорфе-6 008476 нил, дихлортиенил, хлортиенил, трифторметилфенил или метоксиметилфенил; R2 представляет собой Н или метил; и R3 представляет собой пиперазинил или гомопиперазинил, 3,5-диметилпиперазинил, 4 пиперидин, 4-(4,3)-дигидропиридин, 4-(1,2,3,6)-тетрагидропиридин; R6 представляет собой Н, метил,этил, изопропил. Другими предпочтительными соединениями формулы (II) являются соединения, в которых группа Р и группа R3 находятся в пара-положении. Другими предпочтительными соединениями формулы (II) являются соединения, в которых группа где R1 и R2 имеют Р и группа R3 находятся в пара-положении, где группа Р представляет собой значения, указанные в случае формулы (I) (см. табл. III); и X или Y представляют собой Н, метил, этил,изопропил, метокси, тиометил, 1-нафтил, фенилокси, трифторметокси, трифтортиенил (см. табл. II). Особенно предпочтительными из таких соединений являются соединения, где R1 представляет собой фенил, 1-нафтил, фенилоксифенил, диметоксифенил, диметилфенил, метилхлорфенил, изопропилфенил,фторфенил, 1(2 Н)-3,4-дигидрохинолин, R2 представляет собой Н или метил, R3 представляет собой пиперазинил, и R6 представляет собой Н. Предпочтительными соединениями формулы (III) являются изохинолины, где Р представляет собой и находится в положении 3 цикла, где R1 и R2 имеют значения, указанные в случае формулы (I),и X или Y представляют собой Н, метил, бром, метокси, ацетиламино (см. табл. IV). Особенно предпочтительными из таких соединений являются соединения, где R1 представляет собой фенил, бромфенил,метилхлорфенил, метилфенил, метоксифенил, триметилфенил, диметоксифенил, бромметоксифенил; R2 представляет собой Н или метил; и R3 представляет собой метилпиперазинил. Предпочтительными соединениями формулы (IV) являются хинолины, где Р представляет собой и находится в положении 5 цикла, где R1 и R2 имеют значения, указанные в случае формулы (I); и X и Y представляют собой Н (см. табл. V). Особенно предпочтительными из таких соединений являются соединения, где R1 представляет собой фенил; R2 представляет собой Н или метил; и R3 представляет собой пиперидинил. Предпочтительными соединениями формулы V являются 1,7-нафтиридины, где Р представляет со бой и находится в положении 8 цикла, где R1 и R2 имеют значения, указанные в случае формулы(I); и X и Y представляют собой галоген, метокси (см. табл. V). Особенно предпочтительными из таких соединений являются соединения, где R1 представляет собой фенил, диметоксифенил, 1-нафтил; R2 представляет собой Н или метил; и R3 представляет собой пиперидинил. Предпочтительными соединениями формулы (VI) являются бензофураны, где Р представляет собой(I), и где D в формуле (VI) представляет собой 5-членный гетероциклический или гетероарильный цикл,причем указанный цикл содержит один или два атома, выбранных из группы, состоящей из атомов азота,серы и кислорода, при условии, что когда D содержит атом кислорода, он представляет собой гетероарил. Группа Y может быть присоединена к любому незамещенному атому углерода в D. Когда гетероарильный цикл содержит один или два атома азота, группа R6 может присоединяться к вторичному азоту; и X и Y представляют собой галоген, метокси (см. табл. V). Особенно предпочтительными из таких соединений являются соединения, где R1 представляет собой фенил, дихлорфенил, бромфенил, дихлорметилфенил, 1-нафтил, фенил, метилфенил, фторфенил, тиофенил, хлортиофенил; R2 представляет собой Н или метил; и R3 представляет собой пиперидинил или N-метилпиперидинил. Пара-замещенные нафталины формулы (II), где Р представляет собой собой Н 3-Замещенные нафталины формулы (II), где Р представляет собой представляют собой Н 5-Замещенные нафталины формулы (II), где Р представляет собой собой Н мета-Замещенные изохинолины формулы (III), где Р представляет собой представляют собой Н 5-Замещенные хинолины формулы (IV), где Р представляет собой представляют собой Н 1,7-Нафтиридины формулы (V), где Р представляет собой представляют собой Н 5-Замещенные бензофураны формулы (VI), где Р представляет собой собой Н 008476 Способы получения Соединения по изобретению (табл. I, II, IV, V, VI) можно получить, исходя из галогеннитрозамещенных бициклических ароматических соединений, путем катализируемого основанием (карбонат калия) нуклеофильного замещения в ароматическом ядре галогена в нужной позиции центрального двухъядерного цикла выбранным диамином (R3). Восстановление нитрогруппы, подходящим образом размещенной на центральном двухъядерном цикле, при взаимодействии, катализированном Ni Ренея, приводит к анилину, который затем замещают путем сульфонилирования выбранным алкил- или арилсульфонилхлоридом (R1-SO2-Cl) (схема 1 и схема 3). Соединения по изобретению (табл. III) можно получить, исходя из фторзамещенных бициклических ароматических соединений, в которые сульфонилхлоридная функциональная группа введена сульфонилированием, катализированным кислотой. Затем сульфонильную группу вводят во взаимодействие с выбранными анилинами (R1-NH2). Диаминную группу (R3) вводят путем катализируемого основанием нуклеофильного замещения в ароматическом ядре (схема 2). Соединения по изобретению (табл. VII) можно получить, исходя из йодзамещенных бициклических ароматических соединений. Диаминную группу (R3) вводят путем катализируемого палладием нуклеофильного замещения. Восстановление нитрогруппы, подходящим образом размещенной на центральном двухъядерном цикле, при взаимодействии, катализированном Ni Ренея, приводит к анилину, который затем замещают путем сульфонилирования выбранным алкил- или арилсульфонилхлоридом (R1-SO2-Cl)(схема 4). Химикаты, используемые в вышеописанных способах синтеза, могут включать, например, растворители, реагенты, катализаторы, реагенты для введения и удаления защитных групп. Способы, описанные выше, также могут дополнительно включать стадии, осуществляемые или до, или после стадий, конкретно описанных в данном случае, с целью присоединения или удаления подходящих защитных групп,для того, чтобы в конечном счете осуществить синтез соединений формулы (I). Кроме того, для получения целевых соединений различные стадии синтеза можно осуществлять в другой последовательности или другом порядке. Химические превращения и методики с применением защитных групп (введение и удаление защитных групп), полезные при синтезе соответствующих соединений, известны в уровне техники и включают, например, превращения и методики, описанные в R. Larock, Comprehensive OrganicWiley and Sons (1995), и их последующих изданиях. В зависимости от условий процесса конечные продукты формулы (I) получают или в нейтральной форме, или в виде соли. Как свободные основания, так и соли таких конечных продуктов входят в объем изобретения. Аддитивные соли кислот новых соединений можно способом, самим по себе известным, превратить в свободное основание с использованием веществ основного характера, таких как щелочи, или путем ионного обмена. Полученное свободное основание также может образовывать соли с органическими или неорганическими кислотами. При получении аддитивных солей кислот, предпочтительно, используют такие кислоты, которые образуют терапевтически приемлемые подходящие соли. Примерами таких кислот являются галогеноводородные кислоты, серная кислота, фосфорная кислота, азотная кислота, алифатические, алициклические, ароматические или гетероциклические карбоновые или сульфоновые кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, гликолевая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, аскорбиновая кислота, малеиновая кислота, оксималеиновая кислота, пировиноградная кислота, п-оксибензойная кислота, эмбоновая кислота,метансульфоновая кислота, этансульфоновая кислота, оксиэтансульфоновая кислота, галогенбензолсульфоновая кислота, толуолсульфоновая кислота, миндальная кислота или нафталинсульфоновая кислота. В описании и прилагаемой формуле изобретения приведенная химическая формула или название будет охватывать все стерео- и оптические изомеры и их рацематы, когда такие изомеры существуют. Все возможные диастереоизомерные формы (чистые энантиомеры, таутомеры, рацемические смеси и смеси двух энантиомеров в неравных пропорциях) входят в объем изобретения. Такие соединения также могут встречаться в виде цис- или транс-, Е- или Z-изомерных форм относительно двойной связи. Рассматриваются все изомерные формы. Фармацевтические композиции получают, как правило, смешивая активное вещество или его фармацевтически приемлемую соль с обычными фармацевтическими эксципиентами. Композиции также можно получить известными способами, такими как гранулирование, прессование, микроинкапсулирование, разбрызгивание и т.п. Данное изобретение относится к способу лечения или профилактики ожирения, диабета типа II и/или расстройств центральной нервной системы. Способ включает введение субъекту (например, млекопитающему - человеку, лошади, собаке или кошке), нуждающемуся в этом, эффективного количества- 22008476 одного или нескольких соединений формулы (I), описанных выше. Данное изобретение также относится к способу снижения массы тела (например, лечению нарушений массы тела). Способ включает введение субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I). Используемый в данном описании термин "нарушения массы тела" относится к расстройствам, вызванным дисбалансом между поглощаемой энергией и расходуемой энергией, что приводит к аномальной (например, избыточной) массе тела. К таким нарушениям массы тела относится ожирение. В объем данного изобретения также входит способ модуляции (например, ингибирования) активности рецепторов 5-HT6. Способ включает введение субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I). Способы, описанные в данном описании, также могут включать стадию идентификации того, что субъект нуждается в лечении от ожирения, диабета типа II или расстройств центральной нервной системы или нуждается в снижении массы тела."Эффективное количество" означает количество соединения, которое оказывает лечебное действие на субъекта, которого лечат. Лечебное действие может быть объективным (т.е. поддающимся измерению с помощью какого-либо теста или маркера) или субъективным (т.е. субъект говорит о признаках или ощущает действие). Для клинического применения соединения изобретения вводят в состав фармацевтических композиций для перорального, ректального, парентерального или иного способа введения. Как правило, количество активных соединений составляет 0,1-95 мас.% препарата, предпочтительно 0,2-20 мас.%, в препаратах для парентерального применения и предпочтительно 1-50 мас.% в препаратах для перорального применения. Типичная суточная доза активного соединения меняется в широком интервале и будет зависеть от разных факторов, таких как, например, индивидуальная потребность каждого пациента и способ введения. Вообще, пероральные и парентеральные дозировки будут находиться в интервале от 5 до 1000 мг активного соединения в сутки, предпочтительно от 50 до 150 мг в сутки. Приведенные ниже конкретные примеры даются исключительно в качестве иллюстрации и не ограничивают объем настоящего изобретения. Предполагается, что специалист в данной области техники,без дополнительных уточнений, основываясь на данном описании, может использовать настоящее изобретение в самой полной мере. Все публикации, цитированные в данном описании, включены в него в качестве ссылок. Примеры Синтез примеров соединений, указанных в табл. I, и промежуточных соединений Схема 1 На схеме 1 используются следующие символы: (i) K2CO3, ДМФА, выбранный диамин; (ii) Н 2, Ni Ренея или Pd/C, ТГФ:этанол; (iii) (ВОС)2O, NaOH; (iv) R1-SO2-Cl, пиридин, CH2Cl2; (v) HCl в диэтиловом эфире; (vi) алкилгалогениды. TfO=трифторметансульфонат. Общий способ А. Восстановление нитронафталиновых производных до нафтиламинных производных К раствору нитронафталинового производного (1 экв.) в EtOH:ТГФ (4:1) добавляют Ni Ренея (1,0 мл суспензии в EtOH), а затем моногидрат гидразина (6 экв.). Смесь энергично перемешивают в течение 3 ч и затем фильтруют через целит, предварительно обработанный водой. Фильтрат концентрируют и затем добавляют толуол. Очистку осуществляют колоночной флэш-хроматографией (SiO2,CHCl3/MeOH/NH3, 9:1:0,4%, и 2 части петролейного эфира) и получают свободное основание нафтиламинного производного. Общий способ В. Взаимодействие 4-нитрохлорнафталинов с диаминами Диамины (1,2 экв.) добавляют к суспензии хлорнафталинового производного (1 экв.) и K2 СO3 (3,5) в ДМФА. Суспензии перемешивают при 65 С в течение 16 ч и затем фильтруют. Удаляют летучие вещества и получают остаток сырого вещества. Остаток очищают флэш-хроматографией (SiO2,CHCl3CHCl3/10% МеОН/0,4% водный NH3) и получают соответствующий продукт реакции в виде сво- 23008476 бодного основания.(а) Промежуточные соединения для получения соединений, указанных в табл. I, II, IV и V, согласно схеме 1. Промежуточное соединение 1. 1-Метил-4-(4-нитро-1-нафтил)-1,4-диазепан. К суспензии 1-хлор-4-нитронафталина (1,0 г, 4,82 ммоль) и K2 СO3 (2,0 г, 14,46 ммоль) в ДМФА (10 мл) добавляют 1-метил-1,4-диазепан (0,66 г, 5,78 ммоль). Суспензию перемешивают при 65 С в течение 16 ч и затем фильтруют. Удаляют летучие вещества и получают остаток сырого вещества. Остаток очищают флэш-хроматографией (SiO2, CHCl3HCl3/10% МеОН/0,4% водный NH3), и получают 0,79 г (57%) свободного основания. 1 Н ЯМР (CDCl3)8,85-8,75 (м, 1 Н), 8,35-8,25 (м, 1 Н), 8,20-8,12 (м, 1 Н), 7,70-7,60(4:1) добавляют Ni Ренея (1 мл суспензии в EtOH) и затем моногидрат гидразина (0,696 г, 13,9 ммоль). Смесь энергично перемешивают в течение 3 ч и затем фильтруют через целит, предварительно обработанный водой. Фильтрат концентрируют и затем добавляют толуол. Очистка колоночной флэшхроматографией (SiO2, CHCl3/MeOH/NH3, 9:1:0,4%, и 2 части петролейного эфира) дает 0,441 г (62%) свободного основания. 1 Н ЯМР (CDCl3)8,37-8,29 (м, 1 Н), 7,85-7,76 (м, 1 Н), 7,55-7,40 (м, 2 Н), 7,07-7,01(м, 1 Н), 6,75-6,68 (м, 1 Н), 3,96 (уш.с, 2 Н), 3,36-3,20 (м, 4 Н), 2,95-2,76 (м, 4 Н), 2,48 (с, 3 Н), 2,10-1,95 (м,2 Н); МС (пол.ESI) m/z=256 (M+H). Промежуточное соединение 3. 1-Этил-4-(4-нитро-1-нафтил)пиперазин. К смеси 1-хлор-4-нитронафталина (0,794 г, 3,82 ммоль) и K2CO3 (0,791 г, 5,73 ммоль) в ДМФА (3 мл) добавляют N-этилпиперазин (0,486 мл, 3,82 ммоль). Смесь греют в микроволновой печи при 100 Вт в течение 1 мин. Реакционную смесь охлаждают, и процедуру повторяют 5 раз. Смесь фильтруют и концентрируют. Сырой продукт реакции очищают колоночной хроматографией(SiO2,СНCl3CHCl3/MeOH/NH3, 9:1:0,4%), и получают 0,950 г (87%) красновато-коричневого твердого вещества. 1 Н ЯМР (CDCl3)8,75-8,70 (м, 1 Н), 8,30 (д, J=8,4 Гц, 1 Н), 8,24-8,20 (м, 1 Н), 7,72-7,66 (м, 1 Н), 7,607,54 (м, 1 Н), 7,02 (д, J=8,4 Гц, 1 Н), 3,32-3,24 (м, 4 Н), 2,85-2,70 (м, 4 Н), 2,54 (кв., J=7,3 Гц, 2 Н), 1,17 (тр.,J=7,3 Гц, 3); МС (пол.EI) m/z 385 (М+). Промежуточное соединение 4. (цис)-3,5-Диметил-1-(4-нитро-1-нафтил)пиперазин. Данное соединение получают из 1-хлор-4-нитронафталина (0,481 г, 2,32 ммоль) и цис-2,6 диметилпиперазина (0,481 г, 2,32 ммоль) способом, описанным выше; получают 0,554 г (84%) чистого продукта реакции в виде красновато-коричневого твердого вещества. 1 Н ЯМР (CDCl3)8,76-8,71 (м, 1 Н),8,30 (д, J=8,4 Гц, 1 Н), 8,23-8,14 (м, 1 Н), 7,72-7,66 (м, 1 Н), 7,61-7,55 (м, 1 Н), 7,0 (д, J=8,4 Гц, 1 Н), 3,45-3,37(м, 2 Н), 3,35-3,25 (м, 2 Н), 2,55-2,47 (м, 2 Н), 1,17-1,4 (м, 6 Н); МС (пол.EI) m/z 385 (М+). Промежуточное соединение 5. 3-Метил-1-(4-нитро-1-нафтил)пиперазин. Данное соединение получают из 1-хлор-4-нитронафталина (0,395 г, 1,90 ммоль) и 2 метилпиперазина (0,395 г, 1,90 ммоль) способом, описанным выше; получают 0,470 г (84%) чистого продукта реакции в виде твердого вещества. 1 Н ЯМР (CDCl3)8,75-8,70 (м, 1 Н), 8,29 (д, J=8,55 Гц, 1 Н),8,24-8,20 (м, 1 Н), 7,72-7,65 (м, 1 Н), 7,61-7,55 (м, 1 Н), 7,00 (д, J=8,55 Гц, 1 Н), 3,46-3,37 (м, 2 Н), 3,31-3,15(м, 3H), 2,95-2,89 (м, 1 Н), 2,61-2,53 (м, 1 Н), 1,15 (д, J=6,4 Гц, 3H); МС (EI) m/z 271 (М+). Промежуточное соединение 6. 2-(4-Нитро-1-нафтил)октагидропирроло[1,2-а]пиразин. Данное соединение получают из 1-хлор-4-нитронафталина (0,306 г, 1,47 ммоль) и октагидропирроло[1,2-а]пиразина (0,185 г, 1,47 ммоль) способом, описанным выше; получают 0,332 г (76%) чистого продукта реакции в виде желтого масла. 1 Н ЯМР (CDCl3)8,75-8,71 (м, 1 Н), 8,29 (д, J=8,5 Гц, 1 Н), 8,238,20 (м, 1 Н), 7,72-7,67 (м, 1 Н), 7,60-7,55 (м, 1 Н), 7,05 (д, J=8,5 Гц, 1 Н), 3,64-3,59 (м, 1 Н), 3,54-3,48 (м, 1 Н),3,27-3,10 (м, 3H), 2,90-2,80 (м, 1 Н), 2,70-2,65 (м, 1 Н), 2,60-2,30 (м, 2 Н), 2,00-1,80 (м, 3H), 1,65-1,50 (м,1 Н); МС (пол.ESI) m/z 298 (М+Н). Промежуточное соединение 7. 1-(4-Нитро-1-нафтил)-1,4-диазепан. К раствору 1-хлор-4-нитронафталина (0,971 г, 4,68 ммоль) и K2CO3 (0,973 г, 7,10 ммоль) в CH3CN(5,0 мл) добавляют гомопиперазин (0,711 г, 7,10 ммоль). Реакционную смесь нагревают в герметично закрытом сосуде при 120 С в микроволновой печи в течение 10 мин. Суспензию фильтруют и концентрируют. Очистка колоночной хроматографией (SiO2, СНCl3 СНCl3/МеОН, 9:1) дает 0,952 г чистого продукта реакции. 1 Н ЯМР (CDCl3)8,80-8,74 (м, 1 Н), 8,29 (д, J=8,5 Гц, 1 Н), 8,25-8,19 (м, 1 Н), 7,71-7,63(пол.EI) m/z 272 (М+). Промежуточное соединение 8. трет-Бутил-4-(4-нитро-1-нафтил)-1-пиперазинкарбоксилат. 1-Хлор-4-нитронафталин (2,7 г, 13 ммоль), трет-бутил-1-пиперазинкарбоксилат (2,4 г, 13 ммоль) и карбонат калия (2 г) вместе нагревают в ДМСО (100 мл) при 90 С в течение ночи. Раствор охлаждают до комнатной температуры и выливают в воду (500 мл). Продукт реакции собирают фильтрацией и пере- 24008476 кристаллизовывают из смеси метанол/вода, и получают 2,8 г (60%) названного в заголовке соединения; т.пл.158,2 С. 1 Н ЯМР (CDCl3)1,52 (с, 9 Н), 3,2 (уш., 4 Н), 3,75 (уш., 4 Н), 7,04 (д, J=8,53 Гц, 1 Н), 7,62 (т,J=7,02 Гц, 1 Н), 7,73 (т, J=7,02 Гц, 1 Н), 8,25 (д, J=8,53 Гц, 1 Н), 8,3 (д, J=8,54 Гц, 1 Н), 8,73 (д, J=8,53 Гц,1 Н). Промежуточное соединение 9. 1-трет-Бутил-4-(4-бис[(4-метилфенил)сульфонил]амино-1 нафтил)-1-пиперазинкарбоксилат. трет-Бутил-4-(4-нитро-1-нафтил)-1-пиперазинкарбоксилат (1 г, 2,8 ммоль) в этаноле (200 мл) гидрируют при атмосферном давлении над Pd/C (10%, 0,2 г) в течение 3 ч, после чего поглощение водорода прекращается. Раствор фильтруют и упаривают. Остаток растворяют в толуоле (100 мл), и раствор упаривают, и получают не совсем белое твердое вещество. Полученное твердое вещество растворяют в ацетонитриле (50 мл), содержащем 4-диметиламинопиридин (0,73 г). Добавляют толуолсульфонилхлорид(1,14 г, 6 ммоль), и смесь перемешивают при 35 С в течение ночи. Добавляют рассол, и продукт реакции экстрагируют этилацетатом (2100 мл). Органические экстракты сушат над MgSO4 и упаривают, и получают светло-коричневое твердое вещество, которое перекристаллизовывают из этанола. Получают 1,04 г(58%) белого твердого вещества. Т.пл.176-178 С. 1 Н ЯМР (400 МГц, CDCl3)1,40 (с, 9 Н), 2,36 (с, 6 Н),3,0 (уш., 4 Н), 3,6 (уш., 4 Н), 6,81 (АВ, J=8,03 Гц, 1 Н), 6,89 (АВ, J=8,03 Гц, 1 Н), 7,17 (м, 1 Н), 7,19 (д, J=7,53 Гц, 4 Н), 7,32 (м, 1 Н), 7,45 (д, J=8,53 Гц, 1 Н), 7,70 (д, J=8,54 Гц, 4 Н), 8,03 (д, J=8,03 Гц, 1 Н). Промежуточное соединение 10. 1-трет-Бутил-4-(4-[(4-метилфенил)сульфонил]амино-1-нафтил)-1 пиперазинкарбоксилат. 1-трет-Бутил-4-(4-бис[(4-метилфенил)сульфонил]амино-1-нафтил)-1-пиперазинкарбоксилат (1 г,1,6 ммоль) растворяют в этаноле (50 мл). Добавляют гидроксид калия (85%, 0,54 г) и раствор кипятят с обратным холодильником в течение 12 ч. Раствор выливают в воду (100 мл) и подкисляют уксусной кислотой (0,6 мл). Выпавший в осадок продукт реакции собирают фильтрацией, промывают водой и сушат. Выход 0,81 г. 1 Н ЯМР (400 МГц, CDCl3)1,36 (с, 9 Н), 2,22 (с, 3H), 2,8 (уш., 4 Н), 3,5 (уш., 4 Н), 6,47 (с,1 Н), 6,79 (д, J=8,03 Гц, 1 Н), 7,03 (д, J=8,03 Гц, 2 Н), 7,07 (д, J=8,03 Гц, 1 Н), 7,3 (м, 2 Н), 7,47 (д, J=8,53 Гц,2 Н), 7,69 (д, J=9,04 Гц, 1 Н), 8,03 (д, J=7,02 Гц, 1 Н). Промежуточное соединение 11. 1-трет-Бутил-4-(4-метил[(4-метилфенил)сульфонил]амино-1 нафтил)-1-пиперазинкарбоксилат. 1-трет-Бутил-4-(4-[(4-метилфенил)сульфонил]амино-1-нафтил)-1-пиперазинкарбоксилат (0,1 г,0,2 ммоль) растворяют в ДМСО (5 мл) и добавляют карбонат калия (0,2 г) и метилйодид (0,1 г). Смесь перемешивают и нагревают при 85 С в течение 15 ч. Раствор выливают в воду (50 мл) и продукт реакции собирают фильтрацией, промывают водой и сушат. Получают 0,078 г (78%) белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)1,60 (с, 9 Н), 2,56 (с, 3H), 3,1 (уш., 4 Н), 3,36 (с, 3H), 3,7 (уш., 4 Н), 6,90 (АВ,J=8,03 Гц, 1 Н), 6,97 (АВ, J=8,03 Гц, 1 Н), 7,41 (д, J=8,03 Гц, 2 Н), 7,6 (м, 2 Н), 7,75 (д, J=8,29 Гц, 2 Н), 8,3 (м,2 Н). Промежуточное соединение 12. 5-Нитро-8-хинолинилтрифторметансульфонат. К раствору 5-нитро-8-хинолинола (1,89 г, 9,40 ммоль) и Et3N (6,60 мл, 4,70 ммоль) в СН 2Cl2 (125 мл) добавляют N-фенилтрифторметансульфонимид (5,06 г, 14,1 ммоль). Смесь перемешивают при комнатной температуре в течение 16 ч, и затем еще добавляют N-фенилтрифторметансульфонимид (1,0 экв.), и смесь перемешивают еще в течение 16 ч. Реакционную смесь промывают 10% водным растворомNaHCO3, сушат над K2CO3, фильтруют и концентрируют. Сырой остаток обрабатывают в МеОН, и получают 1,2 г (40%) чистого продукта реакции. 1 Н ЯМР (CDCl3)9,20-9,18 (м, 1 Н), 9,11-9,07 (м, 1 Н), 8,488,45 (м, 1 Н), 7,83-7,79 (м, 1 Н), 7,76-7,72 (м, 1 Н); МС (пол.EI-DIP) m/z 321 (М+Н). Промежуточное соединение 13. 8-(4-Метил-1-пиперазинил)-5-нитрохинолин. К суспензии 5-нитро-8-хинолинилтрифторметансульфоната (0,50 г, 1,56 ммоль) и K2CO3 (0,43 г,3,12 ммоль) с CH3CN (6,0 мл) добавляют 1-метилпиперазин (0,19 мл, 1,71 ммоль). Суспензию перемешивают при комнатной температуре в течение 16 ч. Смесь фильтруют и концентрируют. Очистка колоночной флэш-хроматографией (SiO2, CHCl3/MeOH/NH3, 9:1:0,4%) дает 0,509 г чистого продукта реакции: ВЭЖХ с обращенной фазой показывает чистоту 95%; МС (пол.ESI) m/z 273 (М+Н). Промежуточное соединение 14. трет-Бутил-(2R,6S)-2,6-диметил-4-(4-нитро-1-нафтил)-1-пиперазинкарбоксилат. К раствору цис-3,5-диметил-1-(4-нитро-1-нафтил)пиперазина (0,565 г, 1,98 ммоль) и NaOH (0,198 г,4,95 ммоль) в смеси ТГФ:вода (20 мл, 1:1) добавляют ди-трет-бутилдикарбонат (1,30 г, 5,94 ммоль) в ТГФ (4 мл). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, и затем добавляют 3,0 экв. ди-трет-бутилдикарбоната и 2,5 экв. NaOH. Смесь перемешивают при комнатной температуре еще в течение 3 суток. Смесь концентрируют и экстрагируют СНCl3 (320 мл). Объединенные органические фазы сушат над K2CO3, фильтруют и концентрируют. Сырой остаток очищают колоночной хроматографией на диоксиде кремния с использованием СНCl3 в качестве элюента, и получают 0,200 г(26%) чистого продукта реакции в виде коричневого твердого вещества. МС (пол.ЕSI) m/z 386 (М+Н). Промежуточное соединение 15. трет-Бутил-2-метил-4-(4-нитро-1-нафтил)-1-пиперазинкарбоксилат получают из 3-метил-1-(4- 25008476 нитро-1-нафтил)пиперазина (0,436 г, 1,61 ммоль) способом, описанным выше. Получают 0,552 г (92%) чистого продукта реакции в виде желтого масла. 1 Н ЯМР (CDCl3)8,73-8,70 (м, 1 Н), 8,34-8,30 (м, 1 Н),8,28 (д, J=8,5 Гц, 1 Н), 7,74-7,69 (м, 1 Н), 7,63-7,58 (м, 1 Н), 7,02 (д, J=8,5 Гц, 1 Н), 4,50-4,442 (м, 1 Н), 4,104,03 (м, 1 Н), 3,52-3,39 (м, 2 Н), 3,32-3,27 (м, 1 Н), 3,08-3,03 (м, 1 Н), 2,89-2,82(м, 1 Н), 1,53 (с, 3H), 1,51 (с,9 Н); МС (пол.ЕSI) m/z 372 (М+Н). Примеры соединений по изобретению Пример 1. 4-Метил-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. 1-трет-Бутил-4-(4-[(4-метилфенил)сульфонил]амино-1-нафтил)-1-пиперазинкарбоксилат (промежуточное соединение 10) (0,4 г, 0,8 ммоль) растворяют в ТГФ (20 мл) и обрабатывают 1 N раствором НCl в диэтиловом эфире (30 мл) в течение 12 ч. Продукт реакции собирают в виде бледно-розового твердого вещества. Выход 0,2 г (60%). Т.пл. 181 С (разл.). 1 Н ЯМР (ДМСО-d6)2,80 (с, 3H), 3,1 (уш., 4 Н), 3,3(д, J=8,06 Гц, 1 Н), 8,07 (д, J=7,57 Гц, 1 Н), 9,2 (уш., 2 Н); МС (ESI+) для С 21 Н 23 N3 O2 S Найдено m/z 381,1499 М+ Вычислено, 381,1611. Пример 2. 3,4-Диметокси-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. трет-Бутил-4-(4-нитро-1-нафтил)-1-пиперазинкарбоксилат (1 г, 2,8 ммоль) в этаноле (200 мл) гидрируют при атмосферном давлении над Pd/C (10%, 0,2 г) в течение 3 ч, после чего поглощение водорода прекращается. Раствор фильтруют и упаривают. Остаток растворяют в толуоле (100 мл), раствор упаривают и получают не совсем белое твердое вещество. Полученное твердое вещество растворяют в ацетонитриле (50 мл), содержащем 4-диметиламинопиридин (0,73 г). Полученный раствор делят на три части. К одной части добавляют 3,4-диметоксибензолсульфонилхлорид (0,24 г). Смесь перемешивают в течение 4 ч при 40 С в атмосфере азота. Добавляют этилацетат (50 мл), и раствор промывают рассолом (2100 мл). Органическую фазу отделяют, сушат над MgSO4 и упаривают. Очистка флэш-хроматографией (SiO2,петролейный эфир:этилацетат, 1:1) дает продукт реакции, содержащий бутоксикарбонильную защитную группу, который растворяют в метаноле (2 мл) и обрабатывают 1 N раствором НCl в этилацетате (25 мл) в течение 3 ч. Продукт реакции осаждают эфиром (200 мл) и собирают в виде бледно-розового твердого вещества; получают 45 мг (12%). 1 Н ЯМР (ДМСО-d6)3,17 (уш., 4 Н), 3,35 (уш., 4 Н), 3,63 (с, 3H), 3,78 (с,3H), 7,03 (д, J=8,55 Гц, 1 Н), 7,07 (ab, J=13,92,8,06 Гц, 2 Н),7, 24 (дд, J=8,30, 2,19 Гц, 1 Н), 7,46 (м, 1 Н), 7,51N3 O4 S m/z 427 (М+Н)+. Пример 3. 3,4-Дифтор-N-[4-(4-метил-1,4-диазепан-1-ил)-1-нафтил]бензолсульфонамид, гидрохлорид. К раствору 4-(4-метил-1,4-диазепан-1-ил)-1-нафтиламина (промежуточное соединение 2) (0,173 г,0,67 6 ммоль) и пиридина (0,450 мл, 4,73 ммоль) в СН 2Cl2 (3 мл) добавляют раствор 2,4 дифторбензолсульфонилхлорида (0,158 г, 0,743 ммоль) в СН 2Cl2 (2 мл). Смесь перемешивают при комнатной температуре в течение 16 ч и затем концентрируют. Сырую смесь очищают колоночной хроматографией (SiO2, CHCl3/MeOH/NH3, 9:1:0,4%). Свободное основание превращают в его соль НCl и перекристаллизовывают из МеОН и эфира, и получают 0,227 г (79%) соли. 1 Н ЯМР (ДМCO-d6)11,23 (уш.с,1 Н), 10,49 (с, 1 Н), 8,21-8,17 (м, 1 Н), 7,72-7,65 (м, 1 Н), 7,55-7,46 (м, 3H), 7,19-7,10 (м, 3H), 3,65-3,35 (м,6 Н), 3,30-3,15 (м, 2 Н), 2,85-2,82 (м, 3H), 2,33-2,10 (м, 2 Н); МС (пол.ЕS-FIA) m/z 432 (М+Н). Пример 4. 3-Фтор-N-[4-(4-метил-1,4-диазепан-1-ил)-1-нафтил]бензолсульфонамид, гидрохлорид. К раствору 4-(4-метил-1,4-диазепан-1-ил)-1-нафтиламина (промежуточное соединение 3 после восстановления согласно способу А) (0,173 г, 0,676 ммоль) и пиридина (450 мкл, 4,73 ммоль) в СН 2Cl2 (3,0 мл) добавляют раствор 3-фторбензолсульфонилхлорида (0,145 г, 0,74 3 ммоль) в СН 2Cl2 (1,0 мл). Раствор перемешивают при комнатной температуре в течение 16 ч, и выпаривают летучие вещества. Сырой продукт реакции очищают колоночной хроматографией (SiO2, СНCl3/МеОН/NH3, 9:1:0,4%), и получают 240 мг продукта в виде твердого вещества, которое обрабатывают смесью МеОН/эфир, и получают 0,180 г(64%) свободного основания, которое превращают в его соль НCl. 1 Н ЯМР (ДМСО-d6)11,07 (уш.с, 1 Н),10,28 (уш.с, 1 Н), 8,20-8,16 (м, 1 Н), 7,98-7,94 (м, 1 Н), 7,60-7,40 (м, 6 Н), 7,16-7,12 (м, 1 Н), 7,06-7,02 (м, 1 Н),3,65-3,30 (м, частично затемнен сигналом растворителя, HDO, 6H), 3,26-3,18 (м, 2 Н), 2,84 (с, 3H), 2,302,05 (м, 2 Н); МС (пол.ES-FIA) m/z=414 (М+Н). Пример 5. N-[4-(4-Этил-1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. Названное в заголовке соединение получают из 4-(4-этил-1-пиперазинил)-1-нафтиламина (промежуточное соединение 3 после восстановления согласно способу А) (0,241 г, 0,945 ммоль) и бензолсульфонилхлорида (0,121 мл, 0,945 ммоль) способом, описанным выше, и получают 0,210 г (51%) соли НCl. 1 Н ЯМР (CD3OD)8,19-8,15 (м, 1 Н), 7,94-7,90 (м, 1 Н), 7,70-7,66 (м, 2 Н), 7,56-7,46 (м, 2 Н), 7,44-7,36 (м,3H), 7,19 (д, J=8,0 Гц, 1 Н), 7,11 (д, J=8,0 Гц, 1 Н), 3,75-3,40 (м, 6 Н), 3,34 (кв., J=7,6 Гц, 2 Н), 3,25-3,10 (м,2 Н), 1,43 (тр., J=7, 6 Гц, 3H); МС (пол.EI) m/z 387 (М+). Пример 6. N-(4-Гексагидропирроло[1,2-а]пиразин-2(1 Н)-ил-1-нафтил)-4-метилбензолсульфонамид,гидрохлорид. К раствору 2-(4-нитро-1-нафтил)октагидропирроло[1,2-а]пиразина (промежуточное соединение 6)(0,160 г, 0,54 ммоль) в 10 мл смеси ТГФ:EtOH (20 мл, 1:4) добавляют Ni Ренея (1,0 мл суспензии в EtOH) и затем гидразингидрат (0,135 г, 2,70 ммоль). Смесь энергично перемешивают при комнатной температуре в течение 16 ч и затем фильруют через целит, предварительно обработанный водой. Фильтрат концентрируют, и остаток растворяют в СН 2Cl2 (3 мл) и пиридине (0,35 мл, 3,78 ммоль), и к раствору добавляют п-толуолсульфонилхлорид (0,13 г, 0,54 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч и затем концентрируют. Сырой продукт реакции очищают колоночной хроматографией (SiO2, CHCl3/MeOH/NH3, 9:1:0,4%) и получают 0,217 г (95%) свободного основания, которое превращают в его соль НCl. 1 Н ЯМР (CD3OD)8,21-8,14 (м, 1 Н), 7,97-7,93 (м, 1 Н), 7,58-7,47 (м, 3H),7,43-7,37 (м, 1 Н), 7,25-7,10 (м, 4 Н), 4,12-4,02 (м, 1 Н), 3,80-3,0 (м, частично затемнен сигналом растворителя, 8 Н), 2,45-2,10 (м, 3H), 2,35 (с, 3H), 1,87-1,75 (м, 1 Н); МС (пол.ЕI) m/z 421 (М+). Пример 7. N-(4-Гексагидропирроло[1,2-а]пиразин-2(1 Н)-ил-1-нафтил)-3,4-диметоксибензолсульфонамид, гидрохлорид. Названное в заголовке соединение получают из 2-(4-нитро-1-нафтил)октагидропирроло[1,2 а]пиразина (промежуточное соединение 6) (0,133 г, 0,447 ммоль) способом, описанным выше; получают 0,160 г (76%) чистого продукта реакции в виде свободного основания, которое превращают в его соль НCl. 1 Н ЯМР (CD3OD)8,20-8,16 (м, 1 Н), 7,96-7,92 (м, 1 Н), 7,54-7,48 (м, 1 Н), 7,43-7,38 (м, 1 Н), 7,30-7,26(м, 1 Н), 7,23 (д, J=8,0 Гц, 1 Н), 7,16 (д, J=8,0 Гц, 1 Н), 7,09-7,07 (м, 1 Н), 6,95-6,92 (м, 1 Н), 3,83 (с, 3H), 3,823,0 (м, частично затемнен сигналом растворителя, 10H), 3,62 (с, 3H), 2,50-2,10 (м, 2 Н); МС (пол.EI) m/z 467 (М+). Пример 8. N-[4-(4-Этил-1-пиперазинил)-1-нафтил]-4-метилбензолсульфонамид, гидрохлорид. К раствору 4-(4-этил-1-пиперазинил)-1-нафтиламина (промежуточное соединение 3 после восстановления согласно способу А) (0,241 г, 0,945 ммоль) и пиридина (0,534 мл, 0,945 ммоль) в CH2Cl2 (3,0 мл) добавляют п-толуолсульфонилхлорид (0,180 мл, 0,945 ммоль) в СН 2Cl2 (2,0 мл). Смесь перемешивают при комнатной температуре в течение 16 ч и затем добавляют СН 2Cl2 (15 мл). Реакционную смесь промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4, фильтруют и концентрируют. Сырой остаток очищают колоночной хроматографией (SiO2, СНCl3 СНCl3/МеОН/NН 3, 9:1:0,4%) и получают твердое вещество, которое превращают в соль НCl. Выход соли НCl 0,372 г (88%); 1 Н ЯМР(CD3OD)8,20-8,15 (м, 1 Н), 7,97-7,93 (м, 1 Н), 7,58-7,54 (м, 2 Н), 7,53-7,47 (м, 1 Н), 7,43-7,37 (м, 1 Н), 7,257,20 (м, 2 Н), 7,18 (д, J=8,0 Гц, 1 Н), 7,10 (д, J=8,0 Гц, 1 Н), 3,80-3,10 (м, частично затемнен сигналом растворителя, 10H), 2,35 (с, 3H), 1,43 (тр., J=7,3 Гц, 3H); МС (пол.ЕI) m/z 409 (М+). Пример 9. 3,4-Диметокси-N-[4-(3-метил-1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. Названное в заголовке соединение получают из трет-бутил-4-(4-амино-1-нафтил)-2-метил-1 пиперазинкарбоксилата (промежуточное соединение 8 после восстановления согласно способу А) (0,189 г, 0,55 ммоль) и 3,4-диметоксибензолсульфонилхлорида (0,130 г, 0,55 ммоль) способом, описанным выше; выход соли НCl 0,068 г (26%). 1 Н ЯМР (CD3OD) Пример 10. 4-Метил-N-[4-(4-метил-1-пиперазинил)-1-нафтил]-1-бензолсульфонамид, гидрохлорид. К раствору 4-(4-метил-1-пиперазинил)-1-нафтиламина (полученного согласно способам А и В)(0,099 г, 0,409 ммоль) и пиридина (231 мкл, 2,86 ммоль) в CH2Cl2 (3,0 мл) добавляют 4 метилбензолсульфонилхлорид (0,078 г, 0,409 ммоль) в CH2Cl2 (1,0 мл). Раствор перемешивают при комнатной температуре в течение 16 ч и затем промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт реакции очищают колоночной хроматографией (SiO2, СНCl3 СНCl3/МеОН/NH3, 9:1:0,4%) и получают чистое основание, которое превращают в его соль НCl; выход 110 мг (62%). 1 Н ЯМР (ДМCO-d6)10,86 (уш.с, 1 Н), 10,02 (с, 1 Н), 8,11-8,03 (м, 2 Н),7,60-7,56 (м, 2 Н), 7,55-7,44 (м, 2 Н), 7,33-7,30 (м, 2 Н), 7,09-7,06 (м, 1 Н), 7,04-7,01 (м, 1 Н), 3,55-3,32 (м,6 Н), 3,19-3,10 (м, 2 Н), 2,86 (с, 3H), 2,34 (с, 3H); МС (пол.ES-FIA) m/z=395,1665 (M+H) (вычислено 395,1667). Пример 11. 4-Метил-N-[4-(5-метил-2,5-диазабицикло[2,2,1]гепт-2-ил)нафтил]бензолсульфонамид,гидрохлорид. К раствору 4-(5-метил-2,5-диазабицикло[2,2,1]гепт-2-ил)-1-нафтиламина (0,210 г, 0,829 ммоль) (полученного согласно способам А и В) и пиридина (468 мкл, 5,80 ммоль) в СН 2Cl2 (3,0 мл) добавляют 4 метилбензолсульфонилхлорид (0,158 г, 0,829 ммоль) в CH2Cl2 (1,0 мл). Раствор перемешивают при комнатной температуре в течение 16 ч и затем концентрируют. Сырой продукт реакции очищают колоночной хроматографией (SiO2, СНCl3 СНCl3/МеОН/NH3, 9:1:0,4%) и получают чистое основание, которое превращают в его соль НCl; выход 160 мг (43%). 1 Н ЯМР (ДМСО-d6)10,78 (уш.с, 1 Н), 9,90-9,88 (м, 1 Н),8,02-7,98 (м, 2 Н), 7,58-7,55 (м, 2 Н), 7,49-7,41 (м, 2 Н), 7,33-7,30 (м, 2 Н), 7,06-7,03 (м, 1 Н), 6,93-6,90 (м,1 Н), 4,38-4,30 (м, 3H), 3,65-3,60 (м, 3H), 2,90-2,87 (м, 1 Н), 2,86-2,83 (м, 3H), 2,36 (уш.с, 2 Н), 2,35 (с, 3H); МС (пол.ES-FIA) m/z=407,1655 (M+H) (вычислено 407,1667). Пример 12. 4-Метил-N-[4-(3-метил-1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. К раствору трет-бутил-4-(4-амино-1-нафтил)-2-метил-1-пиперазинкарбоксилата (промежуточное соединение 8 после обработки согласно способу А) (0,189 г, 0,55 ммоль) и пиридина (0,311 мл, 3,85- 27008476 ммоль) в СН 2Cl2 (3 мл) добавляют толуолсульфонилхлорид (0,105 г, 0,55 ммоль). Смесь перемешивают при комнатной температуре в течение 16 ч и затем концентрируют. Сырой остаток очищают колоночной хроматографией (SiO2, EtOAc:пентан, 3:7). Чистое промежуточное соединение растворяют в небольшом количестве МеОН и удаляют защитную группу с использованием эфира, насыщенного газообразным НCl. Выпавшее в осадок вещество собирают фильтрацией и обрабатывают МеОН и эфиром; выход соли НCl 0,047 г (19%). 1 Н ЯМР (CDCl3)8,28-8,20 (м, 1 Н), 7,85-7,79 (м, 1 Н), 7,65-7,55 (м, 1 Н), 7,50-7,10 (м,частично затемнен сигналом растворителя, 5 Н), 6,95-6,85 (м, 1 Н), 6,51 (уш.с, 1 Н), 4,50-4,25 (м, 1 Н), 4,053,85 (м, 1 Н), 3,52-3,33 (м, 1 Н), 3,28-3,05 (м, 2 Н), 2,97-2,85 (м, 1 Н), 2,82-2,67 (м, 1 Н), 2,85 (с, 3H), 1,52-1,47(м, частично затемнен сигналом Н 2O, 3H); МС (пол.ES) m/z=395 (M+H). Пример 13. 2-N-[4-(1-Пиперазинил)-1-нафтил]нафталинсульфонамид, гидрохлорид. К другой части раствора восстановленного нитросоединения добавляют 2 нафталинсульфонилхлорид (0,23 г). Смесь перемешивают в течение 4 ч при 40 С в атмосфере азота и обрабатывают так, как описано выше. Полученный продукт идентифицируют как 1-трет-бутил-4-(4 бис[(2-нафталин)сульфонил]амино-1-нафтил)-1-пиперазинкарбоксилат. Полученный биссульфонамид кипятят с обратным холодильником в течение 3 ч в этаноле (10 мл), содержащем NaOH (0,1 г). Полученный раствор добавляют к раствору НCl в этилацетате (1 N, 100 мл) и перемешивают в течение ночи. Раствор упаривают и получают сырой продукт реакции, который очищают препаративной ВЭЖХ(промежуточное соединение 14 после восстановления согласно способу А) (75 мг, 0,15 ммоль) растворяют в метаноле (5 мл) и обрабатывают 1 N раствором НCl в эфире (20 мл). После перемешивания в течение ночи продукт реакции, выпавший в осадок, собирают фильтрацией, промывают эфиром и сушат. Получают 60 мг (92%) не совсем белого твердого вещества. Пример 15. N-[4-(1,4-Диазепан-1-ил)-1-нафтил]-4-метилбензолсульфонамид, гидрохлорид. К раствору 4-(1,4-диазепан-1-ил)-1-нафтиламина (промежуточное соединение 7 после восстановления согласно способу А) (0,399 г, 1,17 ммоль), пиридина (661 мкл, 8,19 ммоль) и Et3N (329 мкл, 2,34 ммоль) в СН 2Cl2 (3,0 мл) добавляют 4-метилбензолсульфонилхлорид (0,223 г, 1,17 ммоль) в СН 2Cl2 (1,0 мл). Раствор перемешивают при комнатной температуре в течение 16 ч и затем концентрируют. Сырой продукт реакции очищают колоночной хроматографией (SiO2, СНCl3 СНCl3/МеОН/NH3, 9:1:0,4%) и получают 0,360 г соединения, содержащего защитную boc-группу. Удаление защитной группы осуществляют, растворяя промежуточное соединение в МеОН и добавляя затем раствор газообразного НCl в эфире. Выпавшее в осадок вещество собирают фильтрацией и получают 0,143 г (28%) чистого соединения в виде соли НCl. 1 Н ЯМР (ДМСО-d6)10,00 (с, 1 Н), 9,28 (уш.с, 1 Н), 8,20-8,16 (м, 1 Н), 8,04-7,99 (м,1 Н), 7,60-7,55 (м, 2 Н), 7,54-7,49 (м, 1 Н), 7,47-7,42 (м, 1 Н), 7,33-7,29 (м, 2 Н), 7,12 (д, J=8,16 Гц, 1 Н), 7,01m/z=395,1667 (M+H) (вычислено 395,1667). Пример 16. N-[4-(1,4-Диазепан-1-ил)-1-нафтил]-2-метокси-4-метилбензолсульфонамид, гидрохлорид. К раствору 4-(1,4-диазепан-1-ил)-1-нафтиламина (промежуточное соединение 7 после восстановления согласно способу А) (0,399 г, 1,17 ммоль), пиридина (661 мкл, 8,19 ммоль) и Et3N (329 мкл, 2,34 ммоль) в CH2Cl2 (3,0 мл) добавляют 2-метокси-4-метилбензолсульфонилхлорид (0,258 г, 1,17 ммоль) вCH2Cl2 (1,0 мл). Раствор перемешивают при комнатной температуре в течение 16 ч и затем концентрируют. Сырой продукт реакции растворяют в EtOH, и к раствору добавляют порошкообразный КОН. Смесь перемешивают при 70 С в течение 16 ч. Суспензию концентрируют и добавляют воду. Раствор нейтрализуют 1 N НCl и экстрагируют CH2Cl2 (220 мл). Объединенные органические фазы промывают рассолом,сушат над(SiO2,CH2Cl2CH2Cl2/MeOH, 95:5) дает 0,432 г красновато-коричневого твердого вещества. Удаление защитной группы из промежуточного соединения с использованием МеОН и эфира, насыщенного газообразным НCl, дает коричневое твердое вещество, которое собирают фильтрацией. Продукт перекристаллизовывают из смеси МеОН/эфир, и получают 109 мг (20%) продукта реакции в виде его соли НCl. 1 Н ЯМР(м, 2 Н), 7,02-7,00 (м, 1 Н), 6,75-6,74 (м, 1 Н), 3,85 (с, 3H), 3,42-3,27 (м, 6 Н), 3,18-3,14 (м, 2 Н), 2,31 (с, 3H),2,14-2,07 (м, 2 Н); МС (пол.ЕS-FIA) m/z=425,1768 (М+Н) (вычислено 425,1774). Пример 17. N-(2-Метокси-4-метилфенил)-4-(3,5-триметил-1-пиперазинил)-1-нафталинсульфонамид,гидрохлорид. К раствору 4-(2,6-диметил-1-пиперазинил)-1-нафтиламина (промежуточное соединение 4 после восстановления согласно способу А) (0,203 г, 0,563 ммоль) и пиридина (332 мкл, 3,99 ммоль) в DCM (3,0 мл) добавляют 4-метилбензолсульфонилхлорид (0,107 г, 0,563 ммоль) в DCM (1,0 мл). Раствор переме- 28008476 шивают при комнатной температуре в течение 16 ч и затем промывают насыщенным водным растворомNa2SO4, сушат над Na2SO4, фильтруют и концентрируют. Сырое промежуточное соединение очищают колоночной хроматографией на диоксиде кремния с использованием СНCl3/СНCl3+10% МеОН+0,4%boc-группы осуществляют, растворяя промежуточное соединение в МеОН и добавляя затем эфир, насыщенный газообразным НCl. Сырой продукт реакции растворяют в DCM и затем очищают колоночной хроматографией на диоксиде кремния с использованием СНCl3/СНCl3+10% МеОН+0,4% NH3, и получают 0,156 г (67%) чистого основания, которое превращают в его соль НCl. 1 Н ЯМР (ДМСО-d6)10,01 (с,1 Н), 9,86-9,78 (м, 1 Н), 9,14-9,00 (м, 1 Н), 8,13-8,10 (м, 1 Н), 8,05-8,02 (м, 1 Н), 7,58-7,55 (м, 2 Н), 7,53-7,49m/z=409,1838 (M+H) (вычислено 407,1824). Пример 18. N-[4-(4-Изопропил-1-пиперазинил)-1-нафтил]-4-метилбензолсульфонамид, гидрохлорид. К раствору 4-(4-изопропил-1-пиперазинил)-1-нафтиламина (0,209 г, 0,776 ммоль) (полученного согласно способам А и В) и пиридина (438 мкл, 5,43 ммоль) в CH2Cl2 (3,0 мл) добавляют 4 метилбензолсульфонилхлорид (0,163 г, 0,850 ммоль) в CH2Cl2 (1,0 мл). Раствор перемешивают при комнатной температуре в течение 16 ч, и собирают фильтрацией твердое вещество как соль НCl, выход 0,236 г (66%). 1 Н ЯМР (ДМСО-d6)10,65 (уш.с, 1 Н), 9,95 (уш.с, 1 Н), 8,10-8,05 (м, 1 Н), 8,02-7,94 (м, 1 Н), 7,567,49 (м, 2 Н), 7,48-7,37 (м, 2 Н), 7,28-7,22 (м, 2 Н), 7,02-6,94 (м, 2 Н), 3,53-3,40 (м, 3H), 3,37-3,15 (м, 8 Н), 2,28(М+Н)+. Пример 22. 2,3-Дихлор-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. 1 Н ЯМР (400 МГц, ДМСО-d6)3,1 (уш., 4 Н), 3,4 (уш., 4 Н), 7,01 (АВ, J=8,03 Гц, 1 Н), 7,03 (АВ,J=8,03 Гц, 1 Н), 7,42 (т, J=7,78 Гц, 1 Н), 7,50 (м, 2 Н), 7,81 (дд, J=1,51, 8,03 Гц, 1 Н), 7,85 (дд, J=1,51, 8,03 Гц,1 Н), 8,10 (дд, J=6,52, 2,0 Гц, 1 Н), 8,20 (дд, J=7,53, 2,01 Гц, 1 Н); МС (ESI+) для С 20 Н 19 Сl2 N3 O2 S m/z 436 (М+Н)+. Пример 23. 2,4-Дихлор-5-метил-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. 1 Н ЯМР (400 МГц, ДМСО-d6)2,27 (с, 3H), 3,15 (уш., 4 Н), 3,4 (уш., 4 Н), 7,07 (с, 2 Н), 7,54 (м, 2 Н),7,79 (с, 1 Н), 7,85 (с, 1 Н), 8,13 (м, 1 Н), 8,19 (м, 1 Н); МС (ESI+) для С 21 Н 21 Сl2 N3 O2 S m/z 450 (М+Н)+. Пример 24. 3-Трифторметил-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. 1 Н ЯМР (400 МГц, ДМСО-d6)3,2 (уш., 4 Н), 3,4 (уш., 4 Н), 7,05 (АВ, J=8,03 Гц, 1 Н), 7,10 (АВ,J=8,03 Гц, 1 Н), 7,40 (т, J=7,53 Гц, 1 Н), 7,50 (т, J=7,53 Гц, 1 Н), 7,76 (т, J=8,03 Гц, 1 Н), 7,81 (с, 1 Н), 7,88 (д,J=8,53 Гц, 1 Н), 7,95 (д, J=8,03 Гц, 1 Н), 7,99 (д, J=8,03 Гц, 1 Н), 8,12 (д, J=8,54 Гц, 1 Н); МС (ESI+) для С 21 Н 20 F3 N3 O2 S m/z 436 (М+Н)+. Пример 25. 2-Трифторметил-N-[4-(1-пиперазинил)-1-нафтил]бензолсульфонамид, гидрохлорид. 1 Н ЯМР (400 МГц, ДМСО-d6)3,0 (уш., 4 Н), 3,4 (уш., 4 Н), 6,93 (с, 2 Н), 7,36 (м, 1 Н), 7,41 (м, 1 Н),7,64 (м, 2 Н), 7,85 (дд, J=2,01, 7,53 Гц, 1 Н), 7,90 (дд, J=2,01, 7,03 Гц, 1 Н), 8,02 (д, J=8,54 Гц, 2 Н). Пример 26. 4-Бром-N-метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид. 1 Н ЯМР (ДМCO-d6)9,12 (уш.с, 2 Н), 8,22-8,07 (м, 2 Н), 7,89 (д, J=8,44 Гц, 2 Н), 7,74-7,58 (м, 4 Н),7,10 (д, J=7,91 Гц, 1 Н), 6,89 (д, 8,18 Гц, 1 Н), 3,50 (с, 3H), 3,43-3,27 (м, частично затемнен сигналом растворителя), МС (пол.ESI) m/z=460 (М+Н). Пример 27. (4-Пиперазин-1-илнафталин-1-ил)амид нафталин-1-сульфоновой кислоты, гидрохлорид. 1 Н ЯМР (ДМСО-d6)9,00 (уш.с, 1 Н), 8,77-8,71 (м, 1 Н), 8,18 (д, J=8,44 Гц, 1 Н), 8,10-8,02 (м, 2 Н),8,01-7,96 (м, 1 Н), 7,90 (д, J=8,18 Гц, 1 Н), 7,73-7,62 (м, 2 Н), 7,56-7,49 (м, 1 Н), 7,47-7,39 (м, 1 Н), 7,31-7,23(м, 2 Н), 7,23-7,12 (м, 3H), 3,43-3,28 (м, частично затемнен сигналом растворителя), 3,25-3,10 (м, 4 Н), МС(м, 6 Н), 7,13-7,01 (м, 2 Н), 3,40-3,26 (м, частично затемнен сигналом растворителя), 3,24-3,08 (м, 4 Н), МС(пол.ESI) m/z=402 (M+H). Пример 31. 2-Хлор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид. 1 Н ЯМР (CDCl3)8,24-8,12 (м, 2 Н), 7,90-7,83 (м, 1 Н), 7,60-7,43 (м, 3H), 7,32-7,27 (м, частично затемнен сигналом растворителя, 1 Н), 7,09 (с, 1 Н), 7,04 (д, J=8,44 Гц, 1 Н), 6,87-6,79 (м, 1 Н), 3,90-3,40 (м,4 Н), 3,12-2,80 (м, 4 Н), МС (пол.ЕSI) m/z=402 (M+H). Пример 32. N-(4-Пиперазин-1-илнафталин-1-ил)-4-трифторметилбензолсульфонамид, гидрохлорид. 1 Н ЯМР (ДМСО-d6)10,40 (уш.с, 1 Н), 9,03 (уш.с, 1 Н), 8,12 (д, J=7,65 Гц, 1 Н), 7,95-7,83 (м, 5 Н),7,55-7,39 (м, 2 Н), 7,13-7,02 (м, 2 Н), 3,40-3,30 (м, частично затемнен сигналом растворителя), 3,23-3,09 (м,4 Н), МС (пол.ЕSI) m/z=436 (M+H). Пример 33. 4-Фтор-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид. 1 Н ЯМР (ДМСО-d6)10,17 (уш.с, 1 Н), 9,18 (уш.с, 2 Н), 8,15-8,08 (м, 1 Н), 7,99-7,92 (м, 1 Н), 7,77-7,66(пол.ESI) m/z=408 (M+H). Пример 39. 3-Метил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид. 1 Н ЯМР (ДМCO-d6)8,14-8,07 (м, 1 Н), 8,04-7,97 (м, 1 Н), 7,55-7,35 (м, 6 Н), 7,07-6,97 (м, 2 Н), 3,302,98 (м, частично затемнен сигналом растворителя, 8 Н), 2,29 (с, 3H), МС (пол.ESI) m/z=442 (M+H). Пример 40. 4-Бутил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид. 1 Н ЯМР (ДМСО-d6)10,05 (с, 1 Н), 9,20 (уш.с, 2 Н), 8,11 (д, J=7,91 Гц, 1 Н), 7,93 (д, J=8,18 Гц, 1 Н),7,62-7,26 (м, 5 Н), 7,07 (с, 2 Н), 3,40-3,30 (м, затемнен сигналом растворителя), 3,25-3,15 (м, 4 Н), 2,66-2,55(м, частично затемнен сигналом растворителя, 2 Н), 1,58-1,15 (м, 2 Н), 1,32-1,15 (м, 2 Н), 0,92-0,83 (м, 3H),МС (пол.ESI) m/z=427 (M+H). Пример 41. 2,4,6-Триметил-N-(4-пиперазин-1-илнафталин-1-ил)бензолсульфонамид, гидрохлорид. 1 Н ЯМР (ДМСО-d6)9,92 (уш.с, 1 Н), 9,01 (уш.с, 2 Н), 8,15-8,09 (м, 1 Н), 8,05-7,98 (м, 1 Н), 7,55-7,42
МПК / Метки
МПК: C07D 487/06, C07D 405/04, C07C 311/21, A61K 31/47, C07D 215/38, C07D 403/04, A61K 31/18, C07D 217/22, C07D 241/04, A61K 31/495, C07D 295/04
Метки: средства, получения, лечебного, замещенные, качестве, сульфонамиды, лечения, способ, применение, ожирения, диабета, цнс, расстройств, типа
Код ссылки
<a href="https://eas.patents.su/30-8476-zameshhennye-sulfonamidy-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-lechebnogo-sredstva-dlya-lecheniya-rasstrojjstv-cns-ozhireniya-i-diabeta-tipa-ii.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные сульфонамиды, способ их получения и их применение в качестве лечебного средства для лечения расстройств цнс, ожирения и диабета типа ii</a>
Предыдущий патент: Способ получения спирта
Следующий патент: Способ получения катализатора полимеризации олефинов