Новые полициклические соединения и их применение
Номер патента: 7868
Опубликовано: 27.02.2007
Авторы: Биховски Рон, Данн Дерек, Хадкинс Роберт Л., Чаттерджи Санкар, Атор Марк А.
Формула / Реферат
1. Соединение формулы IIIa

где каждый А и В обозначает, независимо, С(=O), СН(ОН) или CH2;
Е и F вместе с атомами углерода, к которым они присоединены, образуют незамещенную С4-С7-циклоалкильную группу;
R1 обозначает водород, низший алкил, низший алкил, имеющий по меньшей мере один заместитель J; формил; ацетил, низший алканоил, низший алканоил, имеющий по меньшей мере один заместитель J, низший алкилсульфонил, низший арилсульфонил, остаток аминокислоты или защищенной аминокислоты;
R2 обозначает водород, низший алкил, низший алкил, имеющий заместитель ОН; низший алкил, имеющий фенильный заместитель; формил или ацетил;
J обозначает J3-(J2)n-(Jl)m, где каждый n и m, независимо, равен 0 или 1;
каждый J1 и J2 обозначает, независимо, карбонил, низший алкилкарбонил, арилкарбонил, карбонилокси, сульфонил, амино, низший алкиламино, низший диалкиламино, амидо, низший алкиламидо, низший диалкиламидо, низший алкилоксикарбониламино, арилоксикарбониламино, амидино, гуанидино, кислород, серу, низший алкокси, низший арилокси, аралкокси, низший алкил, С3-С7-циклоалкил, гетероциклоалкил, арил, гетероарил, сульфониламидо, алкилсульфониламидо, арилсульфониламидо, остаток аминокислоты или защищенной аминокислоты; и
J3 обозначает водород, галоген, гидрокси, тио, циано, остаток сульфоновой кислоты, карбоксил, низший алкил, арилоксикарбонил, алкилоксикарбонил, остаток фосфоновой кислоты, низший алкил, низший алкиловый эфир фосфоновой кислоты, ариловый эфир фосфоновой кислоты, аминокарбонилокси, гетероарил или гетероциклоалкил; и
любые две соседние группы J могут объединяться с образованием -Х-(СН2)p-Х-, где X обозначает, независимо, О или NH и р равно 1 или 2; и
каждый X1 и X2 обозначает, независимо, водород, галоген, группу J, низший алкил или низший алкил, имеющий по меньшей мере один заместитель J, или
X1 и X2 вместе с атомами, к которым они присоединены, образуют замещенную или незамещенную фенильную группу, где указанная замещенная фенильная группа имеет по меньшей мере один заместитель J; или замещенную или незамещенную гетероарильную группу, где указанная замещенная гетероарильная группа имеет по меньшей мере один заместитель J, и где указанная замещенная гетероарильная группа представляет собой замещенный пиридил или замещенный пиримидил;
где арил обозначает фенил, нафтил, антраценил или фенантренил;
циклоалкил обозначает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил;
гетероарил обозначает пиррил, пиридинил, фурил, пиридил, 1,2,4-тиадиазолил, пиримидил, тиенил, тиофенил, изотиазолил, имидазолил, тетразолил, пиразинил, хинолил, изохинолил, бензотиенил, изобензофурил, пиразолил, индолил, пуринил, карбазолил, бензимидазолил, изоксазолил или акридинил;
гетероциклоалкил обозначает 2-пирролидинил, 3-пирролидинил, пиперидинил, 2-тетрагидро-фуранил, 3-тетрагидрофуранил, 2-тетрагидротиенил или 3-тетрагидротиенил; и
аминокислота обозначает природную a-аминокислоту.
2. Соединение по п.1, где J3 обозначает водород, галоген, гидрокси, тио, циано, остаток сульфоновой кислоты, карбоксил, низший алкил, арилоксикарбонил, алкилоксикарбонил, остаток фосфоновой кислоты, низший алкил, низший алкиловый эфир фосфоновой кислоты или ариловый эфир фосфоновой кислоты.
3. Соединение по п.1, где Е и F вместе с атомами, к которым они присоединены, образуют C5-циклоалкильную группу.
4. Соединение по п.1, где X1 и X2 являются замещенной или незамещенной гетероарильной группой, где указанная замещенная гетероарильная группа имеет по меньшей мере один заместитель J и где указанная замещенная гетероарильная группа представляет собой пиридил или пиримидил.
5. Соединение по п.1, где А и В обозначают, независимо, С(=O) или СН2.
6. Соединение по п.1, где группы Е и F, взятые вместе с атомами, к которым они присоединены, образуют C5-циклоалкильную группу; X1 и X2 обозначают замещенную или незамещенную гетероарильную группу, где указанная замещенная гетероарильная группа имеет по меньшей мере один заместитель J и указанная замещенная гетероарильная группа представляет собой пиридил или пиримидил; и где А и В обозначают, независимо, С(=O) или CH2.
7. Соединение по п.6, где А и В обозначают С(=O).
8. Соединение формулы IVa
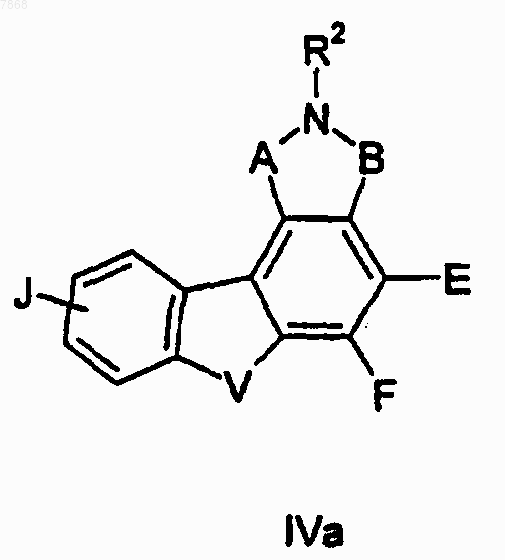
где каждый А и В обозначает, независимо, С(=O), СН(ОН) или CH2;
Е и F вместе с атомами углерода, к которым они присоединены, образуют незамещенную С4-С7-циклоалкильную группу;
V обозначает N(R1), О или S;
R1 обозначает водород, низший алкил, низший алкил, имеющий по меньшей мере один заместитель J; формил; ацетил, низший алканоил, низший алканоил, имеющий по меньшей мере один заместитель J, низший алкилсульфонил, низший арилсульфонил, остаток аминокислоты или защищенной аминокислоты;
R2 обозначает водород, низший алкил, низший алкил, имеющий заместитель ОН; низший алкил, имеющий фенильный заместитель; формил или ацетил;
J обозначает J3-(J2)n-(J1)m, где каждый n и m, независимо, равен 0 или 1;
каждый J1 и J2 обозначает, независимо, карбонил, низший алкилкарбонил, арилкарбонил, карбонилокси, сульфонил, амино, низший алкиламино, низший диалкиламино, амидо, низший алкиламидо, низший диалкиламидо, низший алкилоксикарбониламино, арилоксикарбониламино, амидино, гуанидино, кислород, серу, низший алкокси, низший арилокси, аралкокси, низший алкил, С3-С7-циклоалкил, гетероциклоалкил, арил, гетероарил, сульфониламидо, алкилсульфониламидо, арилсульфониламидо, остаток аминокислоты или защищенной аминокислоты; и
J3 обозначает водород, галоген, гидрокси, тио, циано, остаток сульфоновой кислоты, карбоксил, низший алкил, арилоксикарбонил, алкилоксикарбонил, остаток фосфоновой кислоты, низший алкил, низший алкиловый эфир фосфоновой кислоты, ариловый эфир фосфоновой кислоты, аминокарбонилокси, гетероарил или гетероциклоалкил; и
любые две соседние группы J могут объединяться с образованием -Х-(СН2)p-Х-, где X обозначает, независимо, О или NH и р равно 1 или 2;
где арил обозначает фенил, нафтил, антраценил или фенантренил;
циклоалкил обозначает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил;
гетероарил обозначает пиррил, пиридинил, фурил, пиридил, 1,2,4-тиадиазолил, пиримидил, тиенил, тиофенил, изотиазолил, имидазолил, тетразолил, пиразинил, хинолил, изохинолил, бензотиенил, изобензофурил, пиразолил, индолил, пуринил, карбазолил, бензимидазолил, изоксазолил или акридинил;
гетероциклоалкил обозначает 2-пирролидинил, 3-пирролидинил, пиперидинил, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидротиенил или 3-тетрагидротиенил; и
аминокислота обозначает природную a-аминокислоту.
9. Соединение по п.8, где J3 обозначает водород, галоген, гидрокси, тио, циано, остаток сульфоновой кислоты, карбоксил, низший алкил, арилоксикарбонил, алкилоксикарбонил, остаток фосфоновой кислоты, низший алкил, низший алкиловый эфир фосфоновой кислоты или ариловый эфир фосфоновой кислоты.
10. Соединение по п.8, где V обозначает N(R1); группы Е и F, взятые вместе с атомами, к которым они присоединены, образуют C5-циклоалкильную группу; и А и В обозначают, независимо, С(=O) или СН2.
11. Фармацевтическая композиция для лечения рака, содержащая соединение по пп.1-9 или 10 и фармацевтически приемлемый носитель.
12. Соединение формуыы IV
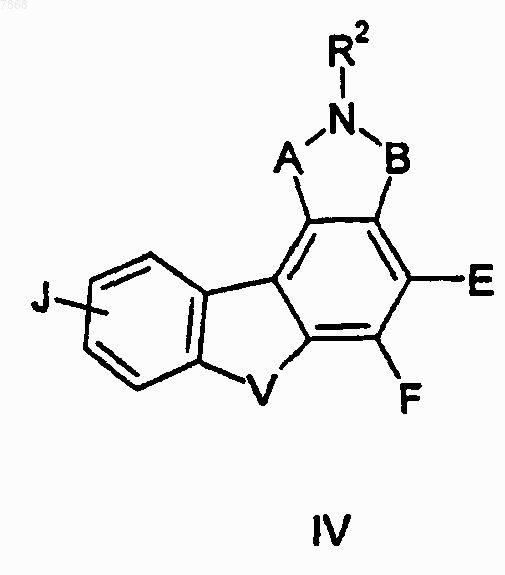
где В обозначает СО, J обозначает Н, V обозначает NR1; Е и F вместе с атомами, к которым они присоединены, образуют циклопентильную группу и A, R1 и R2 выбирают в соответствии со следующей таблицей:
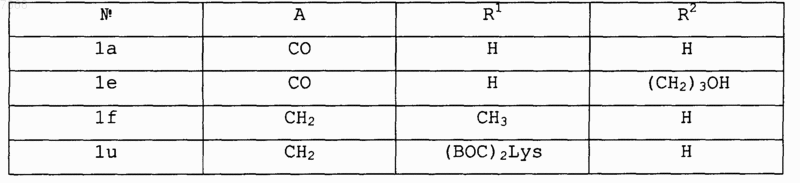
![]()
и его фармакологически приемлемые соли.
13. Соединение формулы IV
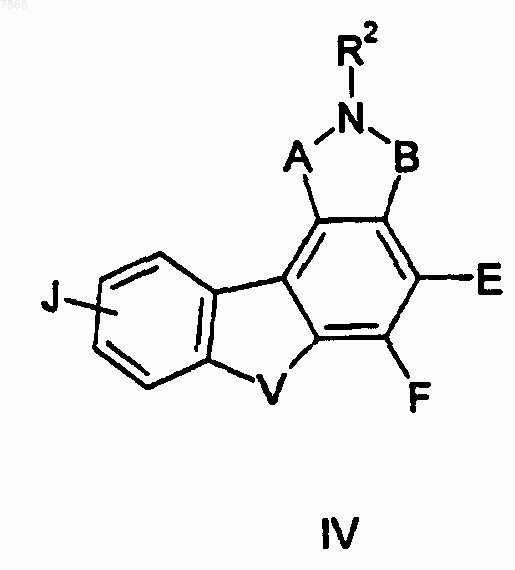
где В обозначает СО, R2 обозначает Н, V обозначает NH; Е и F вместе с атомами, к которым они присоединены, образуют циклопентильную группу и А и J выбирают в соответствии со следующей таблицей:


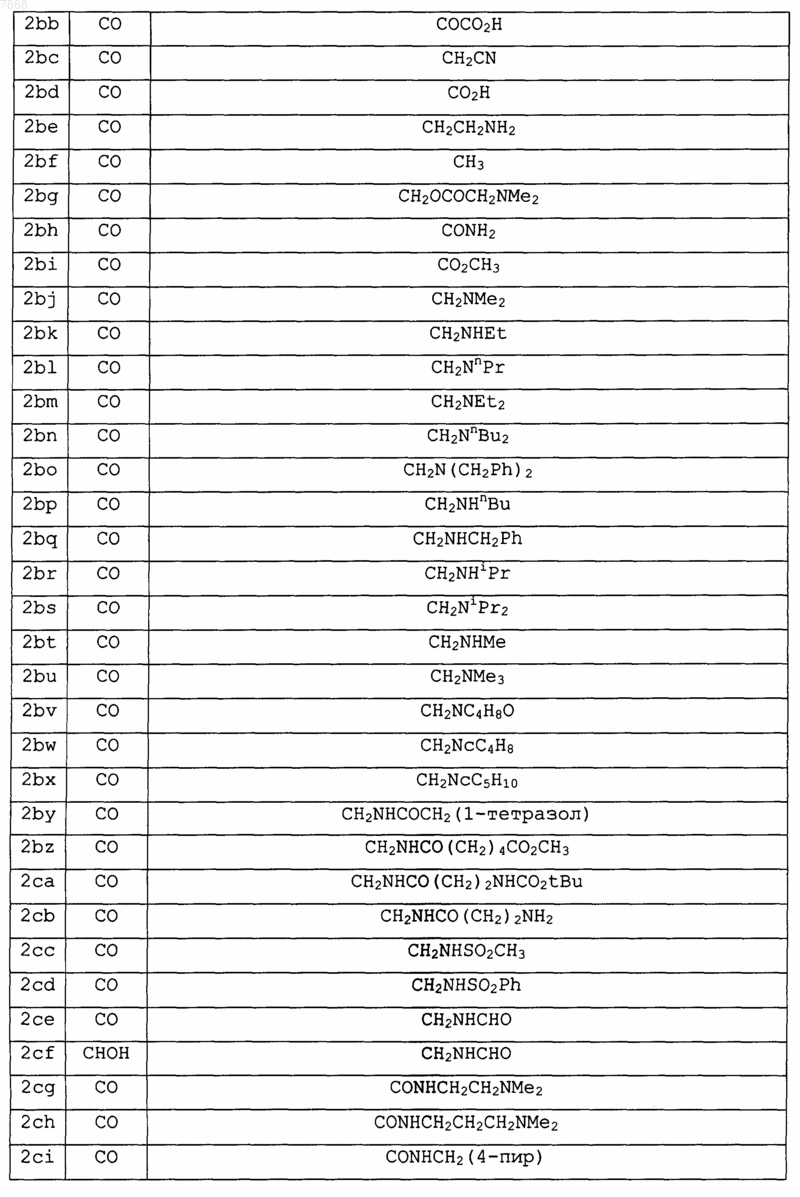
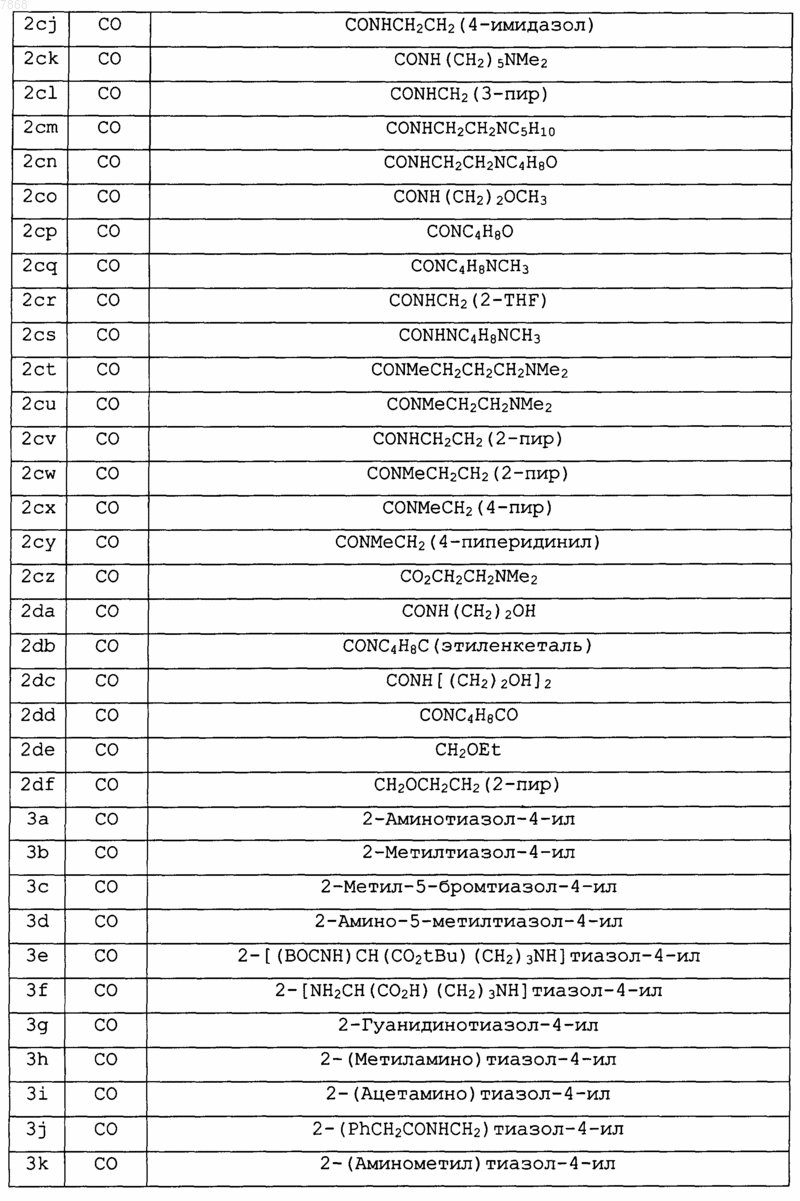

и его фармакологически приемлемые соли.
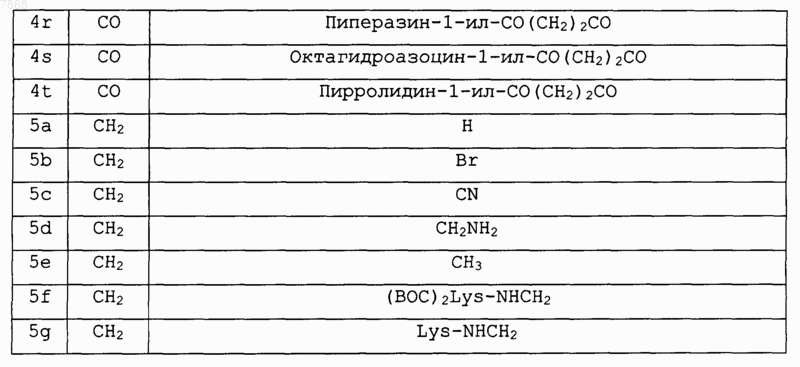
14. Соединение формулы IV
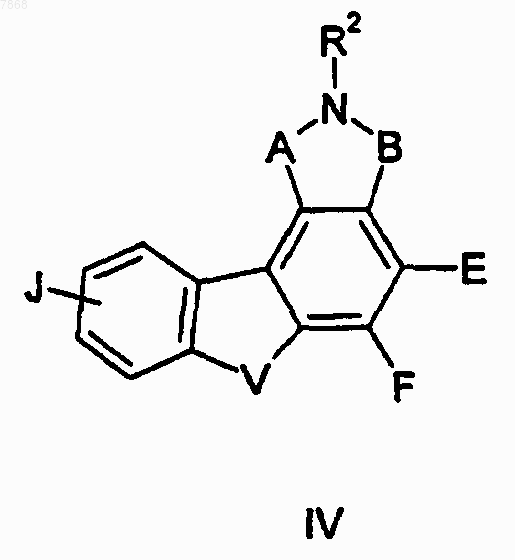
где V обозначает NR1; Е и F вместе с атомами, к которым они присоединены, образуют циклопентильную группу и А, В, J, R1 и R2 выбирают в соответствии со следующей таблицей:
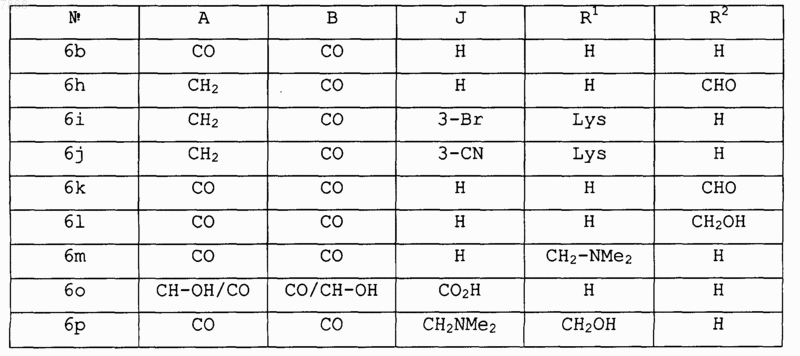
и его фармакологически приемлемые соли.
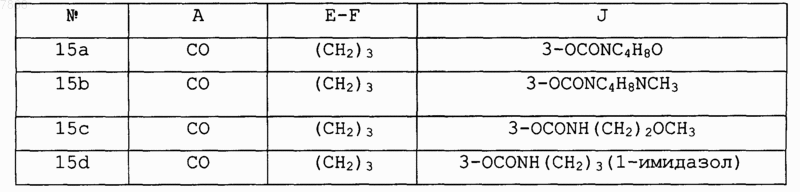
15. Соединение формулы IV
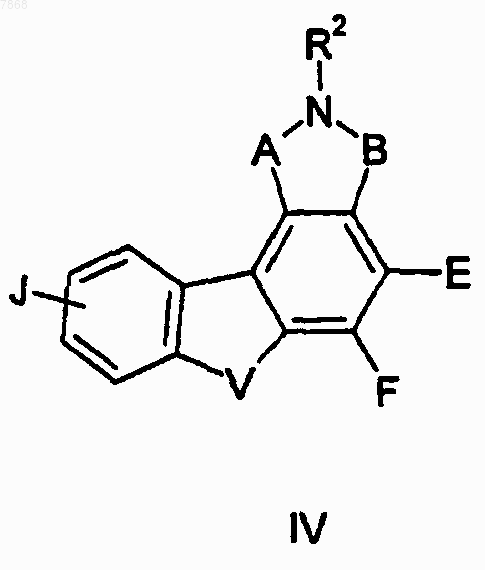
где R2 обозначает Н и А, В, E-F, V, J и R1 выбирают в соответствии со следующей таблицей:
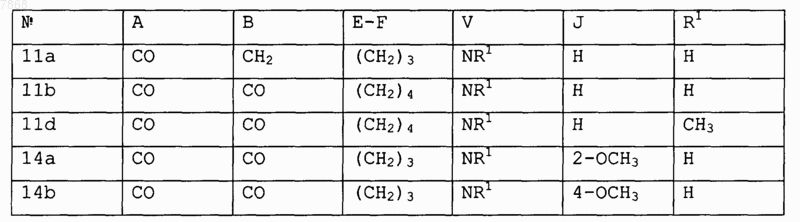
и его фармакологически приемлемые соли.
16. Соединение формулы IV
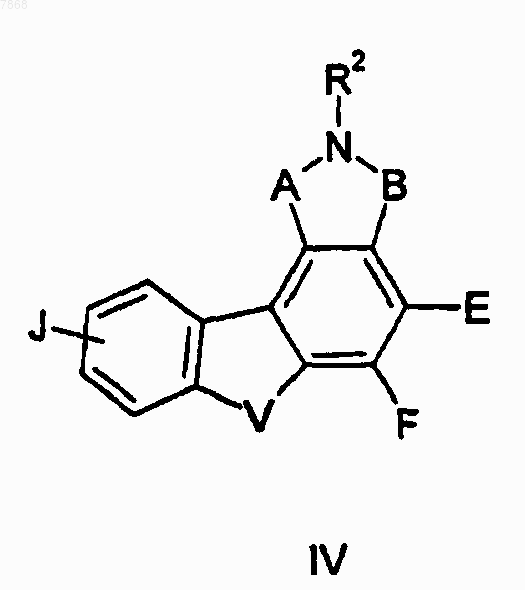
где В обозначает СО; V обозначает NH и A, E-F и J выбирают в соответствии со следующей таблицей:
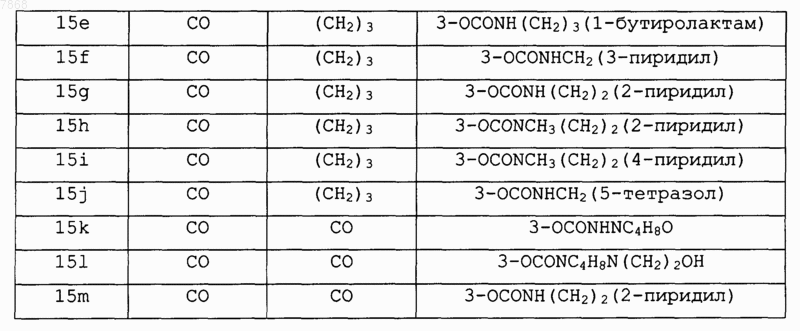
и его фармакологически приемлемые соли.
17. Соединение формулы
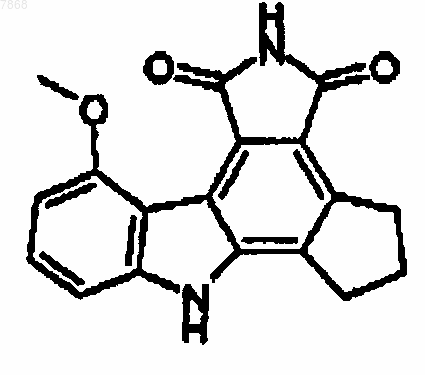
и его фармакологически приемлемые соли.
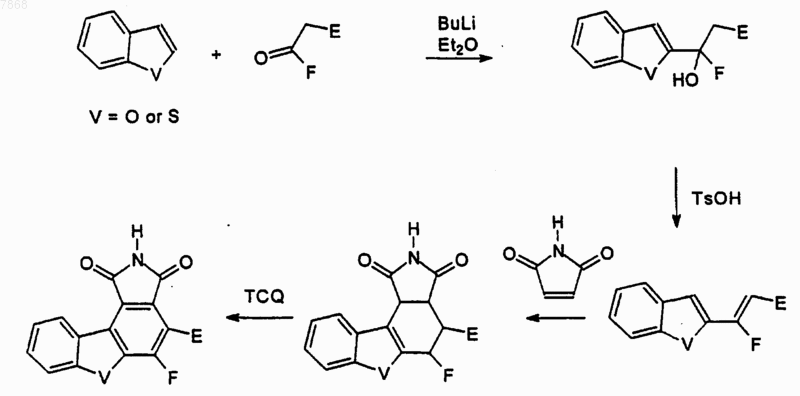
Текст
007868 Область изобретения Данное изобретение относится к новым полициклическим соединениям и их применению. Более конкретно, данное изобретение относится к новым полициклическим соединениям и их применению,например, для опосредования активности ферментов. Предпосылки изобретения Поли(АДФ-рибоза)полимераза (PARP, также называемая поли(АДФ-рибоза)синтетазой, или PARS) является ядерным ферментом, который катализирует синтез поли(АДФ-рибоза)-цепей из НАД+ в ответ на одноцепочечные разрывы ДНК как часть процесса репарации ДНК (de Murcia et al., Trends Biochem.Sci. 1994, 19, 172; Alvarez-Gonzalez et al., Mol. Cell. Biochem. 1994, 138, 33). Связанные с хроматином белковые субстраты для АДФ-рибозилирования, которые включают гистоны, ферменты метаболизма ДНК и сам PARP, модифицируются на поверхностных остатках глутамата. PARP катализирует присоединение одного АДФ-рибозного звена к белку (инициация) с последующей полимеризацией по меньшей мере 200 АДФ-рибозных мономеров (удлинение) через 2'-1-гликозидные связи. Кроме того, PARP катализирует разветвление полимера при более низкой частоте. Роль PARP в процессе репарации ДНК выяснена неполностью. Предполагается, что связываниеPARP с имеющей разрывы (ники) двухцепочечной ДНК облегчает процесс репарации временным блокированием репликации или рекомбинации ДНК. Последующее поли(АДФ-рибозил)ирование PARP и гистонов может приводить к введению существенного отрицательного заряда, что вызывает отталкивание модифицированных белков от ДНК. Предполагается, что после этого структура хроматина релаксируется, усиливая доступ ферментов репарации ДНК к участку повреждения. Существует гипотеза, что избыточная активация PARP в ответ на повреждение клетки или стресс приводит к некрозу клетки (Sims et al., Biochemistry 1983, 22, 5188; Yamamoto et al., Nature 1981, 294,284). Активация PARP разрывами цепи ДНК может быть опосредована оксидом азота (NO) или промежуточными продуктами активного кислорода. Когда степень повреждения ДНК является большой, PARP может катализировать огромное количество поли(АДФ-рибозил)ирования, истощая уровни НАД+ клетки. Поскольку клетка пытается сохранить гомеостаз повторным синтезом НАД+, уровни АТФ могут сильно уменьшаться (так как синтез одной молекулы НАД+ требует четырех молекул АТФ) и клетка может погибать вследствие истощения ее запасов энергии. Сообщалось, что активация PARP играет роль в некрозе клеток в ряде патологических состояний,что предполагает, что ингибиторы PARP могут иметь терапевтическую эффективность при этих состояниях. Усиленное поли(АДФ-рибозил)ирование наблюдали после очаговой (локальной) церебральной ишемии у крысы, согласующееся с активацией PARP при мозговом ударе (Tokime et al., J. Cereb. BloodFlow Metab. 1998, 18, 991). Значительный объем опубликованных фармакологических и генетических данных подтверждает гипотезу, что ингибиторы PARP могли бы быть нейрозащитными после церебральной ишемии, или мозгового удара. Ингибиторы PARP защищали против NMDA- или NOиндуцированной нейротоксичности в культурах коры головного мозга крыс (Zhang et al., Science 1994,263, 687; Eliasson et al., Nature Med. 1997, 3, 1089). Степень нейрозащиты, наблюдаемая для ряда соединений, непосредственно коррелировала с их активностью в качестве ингибиторов PARP. Ингибиторы PARP могут также проявлять нейрозащитную эффективность в моделях удара у животных. Эффективный ингибитор PARP DPQ (3,4-дигидро-5-[4-(1-пиперидинил)бутокси]-1(2 Н)изохинолинон) (Suto et al., патент США 5177075) обеспечивал 54% уменьшение объема инфаркта на крысиной модели очаговой (локальной) церебральной ишемии (постоянная МСАо и 90-минутная билатеральная окклюзия общей сонной артерии) после в.бр. введения (10 мг/кг) за 2 ч до и через 2 ч после инициации ишемии (Takahashi et al., Brain Res. 1997, 829, 46). Интрацеребровентрикулярное введение менее эффективного ингибитора PARP, 3-аминобензамида (3-АВ), давало 47% уменьшение объема инфаркта у мышей после 2 ч окклюзии МСА по способу с использованием нити для швов (Endres et al., J.Cereb. Blood Flow Metab. 1997, 17, 1143). Обработка 3-АВ также усиливала восстановление функции через 24 ч после ишемии, ослабляла снижение уровней НАД+ в ишемических тканях и уменьшала синтез поли(АДФ-рибоза)-полимеров, как было определено иммуногистохимией. Подобным образом, 3-АВ (10 мг/кг) значимо уменьшал объем инфаркта в модели окклюзии с использованием нити для наложения швов локальной ишемии у крысы (Lo et al., Stroke 1998, 29, 830). Нейрозащитное действие 3-АВ (3-30 мг/кг, и.ц.в.) наблюдали также на модели ишемии с перманентной окклюзией средней церебральной артерии (МСА) у крысы (Tokime et al., J. Cereb. Blood Flow Metab. 1998, 18, 991). Доступность мышей, у которых ген PARP был сделан нефункциональным (Wang, Genes Dev. 1995,9, 509), также способствовала подтверждению роли PARP в нейродегенерации. Нейротоксичность, вызываемая NMDA, NO или гипоксией/лишением глюкозы, фактически снималась в первичных культурах коры головного мозга от PARP-/мышей (Eliasson et al., Nature Med. 1997, 3, 1089). В модели ишемии у мышей с использованием нити для швов отмечали 80% уменьшение объема инфаркта у PARP-/мышей и 65% уменьшение у PARP+/мышей. В Endres et al., (1997) сообщалось 35% уменьшение объема инфаркта у PARP-/мышей и 31% уменьшение у PARP+/животных. Кроме нейрозащиты, у PARP-/мышей наблюдалось улучшение в нейрологической оценке и были обнаружены увеличенные уровни НАД+ после ишемии.-1 007868 Существует также преклиническое доказательство, которое доказывает, что ингибиторы PARP могут быть эффективными для лечения болезни Паркинсона. Это доказательство связано с тем, что потеря допаминергических нейронов в черном веществе является отличительным признаком болезни Паркинсона. Лечение экспериментальных животных или людей нейротоксином 1-метил-4-фенил-1,2,3,6 тетрагидропиридином (МРТР) копирует потерю допаминергических нейронов и двигательные симптомы болезни Паркинсона. МРТР активирует PARP в черном веществе, и мыши, не имеющие PARP, являются устойчивыми к нейродегенеративным действиям МРТР (Mandir et al., Proc. Natl. Acad. Sci. 1999, 96,5774). Подобным образом сообщалось, что ингибитор PARP 3-аминобензамид ослабляет потерю НАД+ в полосатом теле после введения МРТР мышам (Cosi et al., Brain Res. 1998, 809, 58). Предполагалась активация PARP в функциональных нарушениях, которые могут происходить вследствие травматического повреждения головного мозга и повреждения спинного мозга. В модели травматического повреждения головного мозга с регулируемым воздействием на кору головного мозга уPARP-/мыши обнаружена значимо улучшенная моторная (двигательная) и познавательная функции в сравнении с РАРР+/+-мышью (Whalen et al., J. Cereb. Blood Flow Metab. 1999, 19, 835). Образование пероксинитрита и активация PARP были также продемонстрированы у крыс с поврежденным спинным мозгом (Scott et al., Ann. Neurol. 1999, 45, 120). Эти результаты подтверждают, что ингибиторы PARP могут обеспечивать защиту от потери функции после травмы головы или спины. Роль PARP в качестве медиатора некроза клеток после ишемии и реперфузии может не ограничиваться нервной системой. В этой связи в недавней публикации сообщалось, что различные структурно отличающиеся ингибиторы PARP, в том числе 3-АВ и родственные соединения, уменьшают размер инфаркта после ишемии сердца и реперфузии у кролика (Thiemermann et al., Proc. Natl. Acad. Sci. 1997, 94,679). В модели выделенного перфузируемого сердца кролика ингибирование PARP уменьшало объем инфаркта и сократительную дисфункцию после глобальной ишемии и реперфузии. Некроз скелетных мышц после ишемии и реперфузии также ослаблялся ингибиторами PARP. Сходные кардиозащитные действия 3-АВ на крысиной модели миокардиальной ишемии/реперфузии сообщались в Zingarelli et al.(Zingarelli et al., Cardiovascular Research 1997, 36, 205). Эти результаты in vivo дополнительно подтверждаются данными экспериментов на культивируемых сердечных миоцитах крысы (Gilad et al., J. Mol.Cell Cardiol. 1997, 29, 2585). Ингибиторы PARP (3-АВ и никотинамид) защищали миоциты от уменьшений в митохондриальном дыхании, наблюдаемых после обработки оксидантами, такими как пероксид водорода, пероксинитрит или доноры оксида азота. Недавно было продемонстрировано генетическое нарушение PARP у мышей для обеспечения клеточного повреждения замедленного действия и получения воспалительных медиаторов после ишемии миокарда и реперфузии (Yang et al., Shock 2000, 13, 60). Эти данные поддерживают гипотезу, что введение ингибитора PARP могло бы способствовать положительному исходу после инфаркта миокарда. Особенно полезное применение ингибитора PARP могло бы включать введение, одновременное с лечением, назначенным для реперфузии пораженной зоны сердца, в том числе ангиопластики или растворяющим сгустки лекарственным средством, таким как tPA. Активность PARP участвует также в клеточном повреждении, которое имеет место при различных воспалительных заболеваниях. Активация макрофагов провоспалительными стимулами может приводить к продуцированию оксида азота и аниона супероксида, которые объединяются с выделением пероксинитрита, приводя к образованию разрывов одноцепочечных ДНК и активации PARP. Роль PARP в качестве медиатора воспалительного заболевания подтверждается экспериментами с использованием РАРР-/мышей или ингибиторов PARP на ряде животных моделей. Например, суставы мышей, подвергнутых коллаген-индуцированному артриту, содержат нитротирозин, что согласуется с образованием пероксинитрита (Szabo et al., J. Clin. Invest. 1998, 100, 723). Ингибитор PARP 5-иод-6-амино-1,2-бензопирон уменьшал частоту появления и тяжесть артрита у этих животных, снижая тяжесть некроза и гиперплазии синовия, как показано гистологическим исследованием. В модели острого локального воспаления при каррагенан-индуцированном плеврите 3-АВ ингибировал гистологическое повреждение, образование плеврального экссудата и инфильтрацию моноядерных клеток, характерные для воспалительного процесса (Cuzzocrea et al., Eur. J. Pharmacology 1998, 342, 67). Результаты, полученные на моделях колита грызунов, подтверждают, что активация PARP может участвовать в патогенезе воспалительной болезни пищеварительного тракта (Zingarelli et al., Gastroenterology 1999, 116, 335). Введение тринитробензолсульфоновой кислоты в просвет пищеварительного тракта вызывает эрозию слизистой оболочки, инфильтрацию нейтрофилов и появление нитротирозина. Делеция гена PARP или ингибирование PARP посредством 3-АВ уменьшали повреждение ткани и ослабляли инфильтрацию нейтрофилов и образование нитротирозина, подтверждается, что ингибиторыPARP могут быть полезны для лечения воспалительной болезни пищеварительного тракта. Предполагалась также роль PARP в патогенезе эндотелиальной дисфункции на моделях эндотоксического шока (Szabo et al., J. Clin. Invest. 1997, 100, 723). Это предположение связано с тем, что ингибирование PARP или генетическая делеция PARP может защищать против уменьшения митохондриального дыхания, которое имеет место после обработки эндотелиальных клеток пероксинитритом. Активация PARP участвует в индукции экспериментального диабета, инициированного селективным токсином бета-клеток стрептозоцином (SZ). Существенный разрыв ДНК может быть индуцированSZ, что приводит к активации PARP и истощению энергетических запасов клеток, как описано выше вYamamoto et al. (1981). В клетках, полученных от РАРР-/мышей, подвергание действию промежуточных продуктов активного кислорода приводит к ослабленному истощению НАД+ и повышенной жизнеспособности клеток относительно клеток дикого типа (Heller et al., J. Biol. Chem. 1995, 270, 11176). Подобные эффекты наблюдали в клетках дикого типа, обработанных 3-АВ. Дополнительные исследования на мышах, обработанных SZ, показали, что делеция гена PARP обеспечивает защиту от потери бета-клеток(Burkart et al., Nature Med. 1999, 5, 314; Pieper et al., Proc. Natl. Acad. Sci. 1999, 96, 3059). Эти наблюдения подтверждают гипотезу о том, что ингибитор PARP может иметь терапевтическое применение в лечении диабета типа I. Другое потенциальное терапевтическое применение ингибиторов PARP включает усиление противоопухолевой активности облучения или повреждающих ДНК химиотерапевтических агентов (Griffin etal., Biochemie 1995, 77, 408). Поскольку поли-АДФ-рибозилирование происходит в ответ на эти способы лечения и является частью процесса репарации ДНК, можно ожидать, что ингибитор PARP может обеспечивать синергическое действие. Подобно PARP, протеинкиназы играют критическую роль в регуляции клеток. В частности, известно, что киназы участвуют в росте и дифференцировке клеток. Было показано, что отклоняющиеся от нормы экспрессия или мутации в протеинкиназах приводят к неконтролируемой пролиферации клеток,такой как рост злокачественной опухоли, и различным дефектам в процессах развития, в том числе к миграции и инвазии клеток, и ангиогенезу. Таким образом, протеинкиназы являются решающими в контроле, регуляции и модуляции пролиферации клеток при заболеваниях и нарушениях, связанных с аномальной пролиферацией клеток. Предполагалось также, что протеинкиназы участвуют в качестве мишеней при нарушениях центральной нервной системы, таких как болезнь Альцгеймера, воспалительных заболеваниях, таких как псориаз, заболеваниях костей, таких как остеопороз, атеросклерозе, рестенозе, тромбозе, метаболических нарушениях, таких как диабет, и инфекционных заболеваниях, таких как вирусные и грибковые инфекции. Одним из наиболее часто исследуемых путей, в которых участвует киназная регуляция, является передача клеточных сигналов от рецепторов на поверхности клеток к ядру. Обычно, распределение экспрессии, доступность лигандов и множество путей ниже по ходу передачи сигнала, которые активируются конкретным рецептором, определяют функцию каждого рецептора. Один пример пути включает каскад киназ, в котором члены тирозинкиназ рецептора фактора роста доставляют сигналы посредством фосфорилирования к другим киназам, таким как семейство Src-тирозинкиназ и семейство Raf, Mek и Erkсерин/треонинкиназ. Каждая из этих киназ представлена несколькими членами семейств, которые играют сходные, но функционально отличающиеся роли. Потеря регуляции пути передачи сигналов фактора роста является частым явлением в случае рака, а также других патологических состояний (Fearon, Genetic Lesions in Human Cancer, Molecular Oncology 1996, 143-178). Один путь передачи сигнала с участием рецепторной тирозинкиназы включает киназу рецептора васкулярного эндотелиального фактора роста (VEGF). Было показано, что связывание VEGF с рецептором VEGFR2 влияет на пролиферацию клеток. Например, связывание VEGF с VEGFR-2/flt-1 рецептором, который экспрессируется первично на эндотелиальных клетках, приводит к димеризации рецептора и инициации сложного каскада, который приводит к росту новых кровеносных сосудов (Korpelainen andAlitalo, Curr. Opin. Cell. Biol. 1998, 10, 159). Подавление образования новых кровеносных сосудов ингибированием VEGFR-тирозинкиназ могло бы использоваться при различных заболеваниях, в том числе в лечении солидных опухолей, диабетической ретинопатии и других внутриглазных неоваскулярных синдромах, дегенерации желтого пятна, ревматоидном артрите, псориазе и эндометриозе. Дополнительным путем киназной трандукции сигнала является путь активируемой стрессом протеинкиназы (SAPK) (Ip and Davis Curr. Opin. Cell Biol. 1998, 10, 205). В ответ на такие стимулы, как цитокины, осмотический шок, тепловой шок или другой, вызываемый условиями среды, стресс, этот путь активируется, и наблюдается двойное фосфорилирование остатков Thr и Туг в мотиве Thr-Pro-Tyr c-junN-концевых киназ (JNK). Фосфорилирование активирует эти JNK для последующего фосфорилирования и активации различных факторов транскрипции, включая c-Jun, ATF2 и ELK-1.JNK являются митоген-активируемыми протеинкиназами (MAPK), которые кодируются тремя различными генами, jnk1, jnk2 и jnk3, которые могут быть альтернативно сплайсированы с получением множества различных изоформ JNK (Gupta et al., EMBO J 1996, 15, 2760). Эти изоформы отличаются по их способности взаимодействовать с их мишенями-субстратами и фосфорилировать их. Активацию JNK выполняют две MAPK-киназы (MAPKK), МKK4 и МKK7. МKK4 является активатором JNK, так же как дополнительной MAPK, р 38, тогда как МKK7 является селективным активатором JNK. Ряд киназMAPKK являются ответственными за активацию МKK4 и МKK7, в том числе семейство МЕKK и киназа смешанной линии дифференцировки, или семейство MLK. Семейство MLK состоит из шести членов, в том числе MLK1, MLK2, MLK3, MLK6, киназы с двойной лейциновой молнией (DLK) и несущей лейциновую молнию киназы (LZK). MLK2 известна также как MST (Katoh, et al., Oncogene, 1994, 10, 1447). Предполагается что многочисленные киназы находятся выше по ходу процесса от MAPKKK, включая,но не ограничиваясь ими, киназу герминативного центра (GCK), киназу гемопоэтических клеток-3 007868 предшественников (НРК) и Ras/cdc42. Специфичность в этом пути определяется, по крайней мере частично, каркасными белками, которые связывают выбранные члены этого каскада. Например, взаимодействующий с JNK белок-1 (JIP-1) связывает НРК 1, DLK или MLK3, МKK7 и JNK, что приводит к модулю,усиливающему активацию JNK (Dickens et al., Science 1997, 277, 693). Манипуляция активности SAPK-пути может иметь большой диапазон эффектов, в том числе стимулирование как некроза клеток, так и выживания клеток в ответ на различные проапоптотические стимулы. Например, даун-регуляция этого пути генетическим разрушением гена, кодирующего JNK3, у мыши обеспечивала защиту против индуцируемых каиновой кислотой судорог и предотвращала апоптоз нейронов гиппокампа (Yang et al. Nature 1997, 389, 865). Подобным образом, ингибиторы JNK-пути, такие как JIP-1, ингибируют апоптоз (Dickens, supra). В противоположность этому, активность JNK-пути,по-видимому, является в некоторых случаях защитной. Тимоциты, в которых МKK4 была делетирована,проявляют увеличенную чувствительность к CD95- и СD3-опосредованному апоптозу (Nishina et al., Nature 1997, 385, 350). Сверхэкспрессия MLK3 приводит к перерождению фибробластов NIH 3 Т 3 (Hartkampet al., Cancer Res. 1999, 59, 2195). Область данного изобретения направлена на идентификацию соединений, которые модулируютMLK-члены SAPK-пути и стимулируют либо некроз клеток, либо выживание клеток. Можно было бы предвидеть, что ингибиторы членов MLK-семейства приведут к выживанию клеток и проявят терапевтическую активность при различных заболеваниях, в том числе хронических нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона, и острых неврологических состояниях, таких как церебральная ишемия, травматическое повреждение головного мозга и повреждение спинного мозга. Ингибиторы членов MLK, приводящие к ингибированию SAPK-пути(JNK-активности), могли бы также проявлять активность при воспалительных заболеваниях и раке. Дополнительным членом семейства белков МАР-киназ является киназа р 38. Предполагалось, что активация этой киназы участвует в продуцировании провоспалительных цитокинов, таких как IL-1 иTNF. Таким образом, ингибирование этой киназы могло бы предоставлять лечение патологических состояний, в которых участвует продуцирование цитокинов с нарушенной регуляцией. Было показано, что сигналы, опосредуемые киназами, регулируют рост клеток, некроз клеток и дифференцировку в клетке регуляцией этих процессов клеточного цикла. Семейство киназ, называемых циклинзависимыми киназами (CDK), регулирует прохождение через эукариотический клеточный цикл. Потеря контроля CDK-регуляции является частым событием при гиперпролиферативных заболеваниях и при раке. Ингибиторы киназ, участвующих в опосредовании или поддержании конкретных патологических состояний, представляют новые средства терапии для этих заболеваний. Примеры таких киназ включаютSrc, raf, циклинзависимые киназы (CDK) 1, 2 и 4 и контрольно-пропускные киназы Chk1 и Cds1 в случае рака, CDK2 или PDGF-R-киназу при рестенозе, CDK5 и GSK3-киназы при болезни Альцгеймера,cSrc-киназу при остеопорозе, GSK3-киназу при диабете типа 2, р 38-киназу при воспалении, VEGFR 1-3 иTIE-1 и 2-киназы при ангиогенезе, UL97-киназу при вирусных инфекциях, CSF-1R-киназу при костных и гемопоэтических заболеваниях и Lck-киназу при аутоиммунных заболеваниях и отторжении трансплантата. Различные соединения, которые описаны в качестве ингибиторов PARP или ингибиторов киназ,раскрыты в литературе, в том числе в Banasik et al., J. Biol. Chem. 1992, 267, 1569 и Banasik et al., Mol.Cell. Biochem. 1994, 138, 185. Многие другие ингибирующие PARP соединения были предметом патентов. Например, соединения, которые описаны как ингибиторы PARP, раскрыты в WO 99/08680, WO 99/11622, WO 99/11623, WO 99/11624, WO 99/11628, WO 99/11644, WO 99/11645, WO 99/11649, WO 99/59973, WO 99/59975 и патенте США 5587384. Структурно-родственные соединения, которые описаны как имеющие другие активности, чем ингибирование PARP, описаны в WO 99/47522, ЕР 0695755 и WO 96/28447. Другие структурнородственные соединения, их синтезы и предшественники описаны в Piers et al. J. Org. Chem. 2000, 65,530, Berlinck et al. J. Org. Chem. 1998, 63, 9850, McCort et al. Tetrahedron Lett. 1999, 40, 6211, Mahboobi etWO 96/11933. Вследствие потенциальной роли в терапевтическом лечении нейродегенеративных заболеваний, раков и других связанных с PARP и киназами заболеваний, ингибиторы PARP и киназ являются важным классом соединений, требующих дополнительного обнаружения, исследования и развития. Хотя известно большое разнообразие ингибиторов PARP и киназ, многие из них имеют такие проблемы, как токсичность, плохая растворимость и ограниченная эффективность, которые препятствуют практическому те-4 007868 рапевтическому применению и мешают дальнейшему развитию в эффективные лекарственные средства. Таким образом, существует злободневная и насущная потребность в новых ингибиторах PARP и киназ для лечения связанных с PARP и киназами заболеваний. Данное изобретение направлено на это, а также на другие важные цели. Сущность изобретения Данное изобретение относится, в частности, к новым полициклическим соединениям. Конкретно, в одном варианте, обеспечены соединения формулы IIIa где радикалы формулы IIIa описаны подробно далее. Еще в одном варианте данное изобретение относится к соединениям формулы IV где радикалы формулы IV описаны подробно далее. В следующем варианте данное изобретение относится к соединениям формулы IVa где радикалы формулы IVa описаны подробно далее. Настоящее изобретение относиться также к фармацевтической композиции для лечения рака, содержащей соединения настоящего изобретения в качестве активного начала и фармацевтически приемлемый носитель. Краткое описание чертежей Фиг. 1 показывает схему, включающую в себя соединение в рамках данного изобретения и его предшественники. Фиг. 2 показывает общую синтетическую стратегию для получения соединений данного изобретения. Фиг. 3 показывает другую общую синтетическую стратегию для получения соединений данного изобретения. Фиг. 4 показывает еще одну общую синтетическую стратегию для получения соединений данного изобретения. Фиг. 5 показывает еще одну общую синтетическую стратегию для получения соединений данного изобретения. Фиг. 6 показывает еще одну общую синтетическую стратегию для получения соединений данного изобретения. Фиг. 7 показывает синтетическую стратегию для получения производных бензимидазола в рамках данного изобретения. Фиг. 8 показывает синтетическую стратегию для получения соединений в рамках данного изобретения.-5 007868 Описание предпочтительных вариантов Данное изобретение относится, в частности, к новым полициклическим соединениям, которые могут быть чрезвычайно полезны для ингибирования PARP, VEGFR2 и MLK3 или других ферментов. Эти новые соединения описаны ниже более подробно. Конкретно, в одном варианте данное изобретение относится к новым полициклическим соединениям формулы IIIaR1 обозначает водород, низший алкил, низший алкил, имеющий по меньшей мере один заместительJ; формил; ацетил, низший алканоил, низший алканоил, имеющий по меньшей мере один заместитель J,низший алкилсульфонил, низший арилсульфонил, остаток аминокислоты или защищенной аминокислоты;J обозначает J3-(J2)n-(J1)m, где каждый n и m, независимо, равен 0 или 1; каждый J1 и J2 обозначает, независимо, карбонил, низший алкилкарбонил, арилкарбонил, карбонилокси, сульфонил, амино, низший алкиламино, низший диалкиламино, амидо, низший алкиламидо, низший диалкиламидо, низший алкилоксикарбониламино, арилоксикарбониламино, амидино, гуанидино,кислород, серу, низший алкокси, низший арилокси, аралкокси, низший алкил, С 3-С 7-циклоалкил, гетероциклоалкил, арил, гетероарил, сульфониламидо, алкилсульфониламидо, арилсульфониламидо, остаток аминокислоты или защишенной аминокислоты; иJ3 обозначает водород, галоген, гидрокси, тио, циано, остаток сульфоновой кислоты, карбоксил,низший алкил, арилоксикарбонил, алкилоксикарбонил, остаток фосфоновой кислоты, низший алкил,низший алкиловый эфир фосфоновой кислоты, ариловый эфир фосфоновой кислоты, аминокарбонилокси, гетероарил или гетероциклоалкил; и любые две соседние группы J могут объединяться с образованием -Х-(CH2)р-Х-, где X обозначает,независимо, О или NH и р равно 1 или 2; и каждый X1 и X2 обозначает, независимо, водород, галоген, группу J, низший алкил или низший алкил, имеющий по меньшей мере один заместитель J, илиX1 и X2 вместе с атомами, к которым они присоединены, образуют замещенную или незамещенную фенильную группу, где указанная замещенная фенильная группа имеет по меньшей мере один заместитель J; или замещенную или незамещенную гетероарильную группу, где указанная замещенная гетероарильная группа имеет по меньшей мере один заместитель J, и где указанная замещенная гетероарильная группа представляет собой замещенный пиридил или замещенный пиримидил; где арил обозначает фенил, нафтил, антраценил или фенантренил; циклоалкил обозначает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил; гетероарил обозначает пиррил, пиридинил, фурил, пиридил, 1,2,4-тиадиазолил, пиримидил, тиенил,тиофенил, изотиазолил, имидазолил, тетразолил, пиразинил, хинолил, изохинолил, бензотиенил, изобензофурил, пиразолил, индолил, пуринил, карбазолил, бензимидазолил, изоксазолил или акридинил; гетероциклоалкил обозначает 2-пирролидинил, 3-пирролидинил, пиперидинил, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидротиенил или 3-тетрагидротиенил; и аминокислота обозначает природную -аминокислоту. В предпочтительном варианте в соединениях формулы IIIa J3 обозначает водород, галоген, гидрокси, тио, циано, остаток сульфоновой кислоты, карбоксил, низший алкил, арилоксикарбонил, алкилоксикарбонил, остаток фосфоновой кислоты, низший алкил, низший алкиловый эфир фосфоновой кислоты или ариловый эфир фосфоновой кислоты. В еще одном предпочтительном варианте соединения формулы IIIa имеют Е и F, объединенные вместе с атомами, к которым они присоединены, с образованием C5-циклоалкильной группы. Дополнительные предпочтительные варианты соединений формулы IIIa включают соединения, гдеX1 и X2 являются замещенной или незамещенной гетероарильной группой, где указанная замещенная гетероарильная группа имеет по меньшей мере один заместитель J и где указанная замещенная гетероа-6 007868 рильная группа представляет собой пиридил или пиримидил. Следующие предпочтительные варианты соединений формулы IIIa включают соединения, где А и В обозначают, независимо, С(=O) или СН 2. Другие предпочтительные варианты включают соединения формулы IIIa, где группы Е и F, взятые вместе с атомами, к которым они присоединены, образуют C5-циклоалкильную группу; X1 и X2 обозначают замещенную или незамещенную гетероарильную группу, где указанная замещенная гетероарильная группа имеет по меньшей мере один заместитель J и указанная замещенная гетероарильная группа представляет собой пиридил или пиримидил; и где А и В обозначают, независимо, С(=O) или СН 2. Более предпочтительно А и В обозначают С(=O). Еще в одном варианте данное изобретение относится к соединениям формулы IVaR1 обозначает водород, низший алкил, низший алкил, имеющий по меньшей мере один заместительJ; формил; ацетил, низший алканоил, низший алканоил, имеющий по меньшей мере один заместитель J,низший алкилсульфонил, низший арилсульфонил, остаток аминокислоты или защищенной аминокислоты;J обозначает J3-(J2)n-(J1)m, где каждый n и m, независимо, равен 0 или 1; каждый J1 и J2 обозначает, независимо, карбонил, низший алкилкарбонил, арилкарбонил, карбонилокси, сульфонил, амино, низший алкиламино, низший диалкиламино, амидо, низший алкиламидо, низший диалкиламидо, низший алкилоксикарбониламино, арилоксикарбониламино, амидино, гуанидино,кислород, серу, низший алкокси, низший арилокси, аралкокси, низший алкил, С 3-С 7-циклоалкил, гетероциклоалкил, арил, гетероарил, сульфониламидо, алкилсульфониламидо, арилсульфониламидо, остаток аминокислоты или защищенной аминокислоты; иJ3 обозначает водород, галоген, гидрокси, тио, циано, остаток сульфоновой кислоты, карбоксил,низший алкил, арилоксикарбонил, алкилоксикарбонил, остаток фосфоновой кислоты, низший алкил,низший алкиловый эфир фосфоновой кислоты, ариловый эфир фосфоновой кислоты, аминокарбонилокси, гетероарил или гетероциклоалкил; и любые две соседние группы J могут объединяться с образованием -Х-(СН 2)p-Х-, где X обозначает,независимо, О или NH и p равно 1 или 2; где арил обозначает фенил, нафтил, антраценил или фенантренил; циклоалкил обозначает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил; гетероарил обозначает пиррил, пиридинил, фурил, пиридил, 1,2,4-тиадиазолил, пиримидил, тиенил,тиофенил, изотиазолил, имидазолил, тетразолил, пиразинил, хинолил, изохинолил, бензотиенил, изобензофурил, пиразолил, индолил, пуринил, карбазолил, бензимидазолил, изоксазолил или акридинил; гетероциклоалкил обозначает 2-пирролидинил, 3-пирролидинил, пиперидинил, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидротиенил или 3-тетрагидротиенил; и аминокислота обозначает природную -аминокислоту. Дополнительные предпочтительные варианты соединений формулы IVa включают соединения, гдеJ3 обозначает водород, галоген, гидрокси, тио, циано, остаток сульфоновой кислоты, карбоксил, низший алкил, арилоксикарбонил, алкилоксикарбонил, остаток фосфоновой кислоты, низший алкил, низший алкиловый эфир фосфоновой кислоты или ариловый эфир фосфоновой кислоты. Следующие предпочтительные варианы включают соединения формулы IVa, где V обозначаетN(R1); группы Е и F, взятые вместе с атомами, к которым они присоединены, образуют С 5 циклоалкильную группу; и А и В обозначают, независимо, С(=O) или СН 2. Дополнительные предпочтительные варианты осуществления изобретения включают соединения формулы IV, причем те из них, которые могут быть особенно важными для ингибирования PARP или важны с точки зрения ингибирования VEGFR2. Так, в одном варианте данное изобретение относится к соединениям формулы IV где В обозначает СО, J обозначает Н, V обозначает NR1; Е и F вместе с атомами, к которым они присоединены, образуют циклопентильную группу и A, R1 и R2 выбирают в соответствии со следующей таблицей: и их фармакологически приемлемым солям. В другом предпочтительном варианте соединение формулы IV является соединением формулы IV,где В обозначает СО, R2 обозначает Н, V обозначает NH; Е и F вместе с атомами, к которым они присоединены, образуют циклопентильную группу и А и J выбирают в соответствии со следующей таблицей: и его фармакологически приемлемые соли. Дополнительные предпочтительные варианты описанных здесь соединений включают соединения формулы IV, где V обозначает NR1; Е и F вместе с атомами, к которым они присоединены, образуют циклопентильную группу и А, В, J, R1 и R2 выбирают в соответствии со следующей таблицей: и его фармакологически приемлемые соли. Другие предпочтительные варианты описанных здесь соединений включают соединения формулыIV, где R2 обозначает Н и А, В, E-F, V, J и R1 выбирают в соответствии со следующей таблицей: и его фармакологически приемлемые соли. Дополнительные предпочтительные варианты описанных здесь соединений включают соединения формулы IV, где В обозначает СО; V обозначает NH и A, E-F и J выбирают в соответствии со следующей таблицей: и его фармакологически приемлемые соли. Особенно предпочтительным соединением настоящего изобретения является соединение формулы- 13007868 и его фармакологически приемлемые соли. Термин алкил, используемый здесь, если нет других указаний, относится к насыщенному, прямому, разветвленному или циклическому С 1-С 20 углеводороду. Алкильные группы включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, циклопентил, изопентил, неопентил, н-гексил, изогексил, циклогексил, циклооктил, адамантил, 3-метилпентил,2,2-диметилбутил и 2,3-диметилбутил. Термин низший алкил, используемый здесь, если нет других указаний, относится к имеющему насыщенную прямую цепь, разветвленному или циклическому C1-С 6-углеводороду. Низшие алкильные группы включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил,трет-бутил, н-пентил, циклопентил, изопентил, неопентил, н-гексил, изогексил, циклогексил, 3 метилпентил, 2,2-диметилбутил и 2,3-диметилбутил. Термины циклоалкил и Cn-циклоалкил означают моноциклическую насыщенную или частично ненасыщенную углеводородную группу. Термин Cn в контексте данного описания, где n является целым числом, обозначает число атомов углерода, составляющих кольцо циклоалкильной группы. Например, C6-циклоалкил указывает на шестичленное кольцо. Связи, соединяющие эндоциклические атомы углерода циклоалкильной группы, могут быть простыми или быть частью конденсированной ароматической группы, пока данная циклоалкильная группа не является ароматической. Примеры циклоалкильных групп включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Термины гетероциклоалкил или Cn-гетероциклоалкил означают моноциклический насыщенный или частично ненасыщенный циклический радикал, который, кроме атомов углерода, содержит по меньшей мере один гетероатом в качестве членов кольца. Обычно гетероатомы включают, но не ограничиваются ими, атомы кислорода, азота, серы, селена и фосфора. В этом контексте термин Cn, где n представляет целое число, обозначает число атомов углерода, составляющих кольцо, но не указывает общее число атомов в кольце. Например, C4-гетероциклоалкил включает кольца с пятью или большим числом членов кольца, где четыре из атомов кольца являются углеродом, а остальные атомы кольца являются гетероатомами. Кроме того, связи, соединяющие эндоциклические атомы гетероциклоалкильной группы, могут быть частью конденсированной ароматической группы, пока эта гетероциклоалкильная группа не является ароматической. Примеры гетероциклоалкильных групп включают, но не ограничиваются ими,2-пирролидинил,3-пирролидинил,пиперидинил,2-тетрагидрофуранил,3 тетрагидрофуранил, 2-тетрагидротиенил и 3-тетрагидротиенил. Термин арил, используемый здесь, если нет других указаний, означает моно-, ди-, три- или полициклическую ароматическую циклическую систему. Неограничительные примеры включают фенил,нафтил, антраценил и фенантренил. Термин гетероарил, используемый здесь, означает ароматическую циклическую систему, которая включает по меньшей мере один гетероатом в качестве члена кольца. Неограничительными примерами являются пиррил, пиридинил, фурил, пиридил, 1,2,4-тиадиазолил, пиримидил, тиенил, тиофенил, изотиазолил, имидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, тиофенил, бензотиенил,изобензофурил, пиразолил, индолил, пуринил, карбазолил, бензимидазолил, изоксазолил и акридинил. Термин аралкил, используемый здесь, означает арилзамещенные алкильные радикалы, такие как бензил, дифенилметил, трифенилметил, фенилэтил и дифенилэтил. Термин низший аралкил, используемый здесь, означает арилзамещенные низшие алкильные радикалы. Неорганичительные примеры включают бензил, дифенилметил, трифенилметил, фенилэтил и дифенилэтил. Термин аралкокси, используемый здесь, означает группу RO-, где R обозначает аралкильную группу, определенную выше. Термин низший аралкокси, используемый здесь, означает группу RO-, где R обозначает низшую аралкильную группу, определенную выше. Термин алкокси, используемый здесь, означает RO-, где R обозначает алкильную группу, определенную выше. Термин низший алкокси, используемый здесь, означает RO-, где R обозначает низшую алкильную группу, определенную выше. Неограничительные примеры включают метокси, этокси и третбутокси. Термин арилокси, используемый здесь, означает RO-, где R обозначает арильную группу, определенную выше. Термины низший алкиламино и низший диалкиламино означают аминогруппу, которая несет один или два низших алкильных заместителя, соответственно. Термины амидо и карбониламино, используемыездесь, означают -C(O)N(H)-. Термин алкиламидо, используемый здесь, означает -C(O)NR-, где R обозначает алкильную группу, определенную выше. Термин диалкиламидо, используемый здесь, означает -C(O)NR'R", где R' и R обозначают, независимо, алкильные группы, определенные выше.- 14007868 Термин низший алкиламидо, используемый здесь, означает -C(O)NR-, где R обозначает низшие алкильные группы, определенные выше. Термин низший диалкиламидо, используемый здесь, означает -C(O)NR'R", где R' и R обозначают, независимо, низшие алкильные группы, определенные выше. Термины алканоил и алкилкарбонил, используемый здесь, означают RC(O)-, где R обозначает алкильную группу, определенную выше. Термины низший алканоил и низший алкилкарбонил, используемый здесь, обозначают RC(O)-,где R обозначает алкильную группу, определенную выше. Неограничительные примеры таких алканоильных групп включают ацетил, трифторацетил, гидроксиацетил, пропионил, бутирил, валерил и 4 метилвалерил. Термин арилкарбонил, используемый здесь, означает RC(O)-, где R обозначает арильную группу,определенную выше. Термин арилоксикарбонил, используемый здесь, означает ROC(O)-, где R обозначает арильную группу, определенную выше. Термин галоген, используемый здесь, означает фтор, бром или иод. Термин алкилсульфонил, используемый здесь, означает группу RSO2-, где R обозначает алкильную группу, определенную выше. Термин арилсульфонил, используемый здесь, означает группу RSO2-, где R обозначает арильную группу, определенную выше. Термин алкилоксикарбониламино, используемый здесь, означает группу ROC(O)N(H)-, где R обозначает алкильную группу, определенную выше. Термин низший алкилоксикарбониламино, используемый здесь, означает группу ROC(O)N(H)-,где R обозначает низшую алкильную группу, определенную выше. Термин арилоксикарбониламино, используемый здесь, означает группу ROC(O)N(H)-, где R обозначает арильную группу, определенную выше. Термин сульфониламидо, используемый здесь, означает группу -SO2C(O)NH-. Термин алкилсульфониламидо, используемый здесь, означает группу RSO2C(O)NH-, где R обозначает алкильную группу, определенную выше. Термин арилсульфониламидо, используемый здесь, означает группу RSO2C(O)NH-, где R обозначает арильную группу, определенную выше. Термин низший алкиловый эфир фосфоновой кислоты, используемый здесь, означает группу-Р(O)(OR')(OR), где R' и R обозначают низший алкил, определенный выше. Термин ариловый эфир фосфоновой кислоты, используемый здесь, означает группу-Р(О)(OR')(OR), где R' и R обозначают арил, определенный выше. Термин аминокарбонилокси, используемый здесь, означает группу RR'N-C(О)-O-, где R и R' обозначают алкильную группу, определенную выше. Термин ариламинокарбонилокси, используемый здесь, означает группу Ar-N(R)-С(О)-О)-, где Аr обозначает арил, определенный выше, a R обозначает алкильную группу, определенную выше. Термин гетероариламинокарбонилокси, используемый здесь, означает группу het-Ar-N(R)-С(О)O-, где het-Ar обозначает гетероарил, определенный выше, a R обозначает алкильную группу, определенную выше. Используемый здесь термин остаток аминокислоты обозначает молекулу, содержащую как аминогруппу, так и карбоксильную группу. Он включает "остаток -аминокислоты", которая хорошо известна специалисту в данной области как карбоновая кислота, которая несет аминогруппу на углероде,соседнем с карбоксильной группой. Аминокислоты могут быть природно встречающимися или не встречающимися в природе. Термин "остаток защищенной аминокислоты", используемый здесь, относится к остаткам аминокислот, описанным выше, содержащим защитные группы. Например, аминогруппа аминокислотного остатка может быть защищена трет-бутоксикарбонильной или бензилоксикарбонильной группами. Кроме того, карбоксильная группа этой аминокислоты может быть защищена алкиловым или аралкиловым эфирами. Кроме того, спиртовые группы аминокислот могут быть защищены в виде алкиловых простых эфиров, аралкиловых простых эфиров и силиловых простых эфиров. Термин "эндоциклически содержащий" описывает циклическую химическую часть молекулы, которая включает определенную химическую группу в качестве образующего кольцо члена. В качестве примера, фуранильная группа эндоциклически содержит атом кислорода, так как этот атом кислорода является членом данной циклической структуры. В контексте данного изобретения группы Е и F могут быть объединены вместе с атомами, к которым они присоединены, с образованием гетероциклоалкильной группы. Эта гетероциклоалкильная группа может эндоциклически содержать химическую группу G,т.е. по меньшей мере один атом группы G является образующим кольцо членом. В качестве неограничивающего примера, иллюстрированного ниже, Е и F могут быть объединены вместе с атомами, к которым они присоединены, с образованием гетероциклоалкильной группы, эндоциклически содержащей группу Используемый здесь термин терапевтически эффективное количество означает количество соединения данного изобретения, которое будет вызывать желаемое терапевтическое или профилактическое действие или желаемую терапевтическую или профилактическую реакцию при введении в соответствии с желаемой схемой лечения. Используемый здесь термин контактирование означает приведение в контакт, прямо или опосредованно, одной или нескольких молекул с другими молекулами, с облегчением посредством этого межмолекулярных взаимодействий. Контактирование может иметь место in vitro, ex vivo или in vivo. Используемый здесь термин клеточно-пролиферативные нарушения" означает как злокачественные, так и незлокачественные клеточные популяции, которые отличаются от окружающей ткани как морфологически, так и генотипически. Типы клеточно-пролиферативных нарушений включают, например, солидные опухоли, рак, диабетическую ретинопатию, внутриклеточные неоваскулярные синдромы,дегенерацию желтого пятна, ревматоидный артрит, псориаз и эндометриоз. Все другие термины, используемые в описании соединений данного изобретения, имеют значения,хорошо известные в данной области. Данное изобретение описывает способы получения полициклических соединений, описанных здесь,которые полезны в качестве ингибиторов PARP, VEGFR2 и MLK3. Способ состоит в многостадийном синтезе с использованием необходимых исходных гетероциклических соединений. Например, фиг. 1 описывает схему общего синтеза соединений данного изобретения для случая, когда гетероциклический исходный материал представляет собой индол. Конкретно, индол А, который является незамещенным или замещен в положениях 4-7 индольного кольца, обрабатывают последовательно, например, бутиллитием, диоксидом углерода, трет-бутиллитием и кетоном В (имеющим заместители Е и F) с получением замещенного 2-индолил третичного спирта С. Этот третичный спирт расщепляют, например, в кислотных условиях с использованием хлористо-водородной кислоты или толуолсульфоновой кислоты, с получением замещенного 2-винилиндола D. Циклоприсоединение Дильса-Альдера D с диенофилом, таким как (но не только) малеимид (Е), дает промежуточный продукт F циклоприсоединения. Ароматизация промежуточного продукта циклоприсоединения, например, кислородом в присутствии катализатора, такого как палладий или платина, или оксиданта, такого как DDQ или тетрахлорхинон, дает карбазол G. Последующая обработка G алкилирующим или ацилирующим реагентом дает индол-N-замещенные производные карбазола данного изобретения, как показано на фиг. 2. Обработка карбазола G (или лактамов карбазола на фиг. 5) различными электрофилами, такими какR+, дает 3-замещенные производные карбазола, как показано на фиг. 3. Таким образом могут быть введены галоген или ацильные группы, и галоген может быть замещен различными нуклеофилами, в том числе циано, как показано на фиг. 5. Галоген может быть также замещен различными алкильными, арильными и гетероалкильными группами. 3-циано-заместитель может быть восстановлен с образованием 3 аминометильного заместителя, который может быть алкилирован или ацилирован по аминогруппе. Когда карбазол G содержит бромацетильный или замещенный 2-бромацильный заместители, как показано на фиг. 4, бром может быть замещен различными нуклеофилами с образованием дополнительных соединений данного изобретения. Альтернативно, 2-бромацильная группа может взаимодействовать с различными тиоамидами с образованием замещенных тиазолов. Как обсуждалось, использование замещенных индолов в качестве исходного материала дает функционализованные производные G; однако, для получения замещенных винилиндолов D может быть также использована внутримолекулярная реакция Виттига. Кроме того, в реакции Дильса-Альдера могут быть использованы диенофилы, другие, чем малеимид (Е), и они включают, например, диалкилфумарат,фумаровую кислоту, диалкилмалеат, малеиновую кислоту, малеиновый ангидрид, диалкилацетилендикарбоксидат или 3-цианоакрилат. Промежуточные продукты, полученные циклоприсоединением с этими диенофилами, дают имиды или соответствующие лактамы, как показано на фиг. 5. Например, ангидриды, полученные циклоприсоединением малеинового ангидрида или дегидратацией дикислот, дают имиды при обработке бис(триметилсилил)амином или мочевиной. Эти ангидриды дают шестичленные гидразоны при обработке гидразином. Лактамы получают разделением цианоэфирных изомеров, ароматизацией каждого изомера и восстановлением цианоэфира до лактама, как показано на фиг. 5. Имиды могут быть также восстановлены до лактамов способами, хорошо известными специалистам в данной области.- 16007868 Соединения индольного типа данного изобретения получают согласно схемам, показанным на фиг. 6. Здесь исходные вещества замещенного винилпиррола получают реакцией пиррола с енамином кетона,как описано в литературе (Heterocycles 1974, 2, 575-584). Замещенный 2-винилпиррол взаимодействует с различными диенофилами, такими как описанные выше, с образованием промежуточного продукта циклоприсоединения, который является предшественником соединений данного изобретения. Защитная группа азота, например силилзащитная группа, в частности триизопропилсилил, может быть использована на всем протяжении синтеза, как показано на фиг. 6. Другие гетероциклические предшественники могут быть получены с использованием аналогичных реакций. Например, замещенный 5-винилимидазол взаимодействует с различными диенофилами, такими как описанные выше, с образованием промежуточного продукта циклоприсоединения, который может быть далее модифицирован реакциями, хорошо известными специалистам в данной области, с образованием бензимидазольных предшественников. Подобным образом, например, замещенный 5-винил-1,2,3 триазол или 4-винилтиазол может взаимодействовать с различными диенофилами, описанными выше,также с образованием промежуточных продуктов циклоприсоединения, дающих соединения данного изобретения. Соединения типа бензимидазола данного изобретения могут быть также получены в соответствии со способом, показанным на фиг. 7, в котором предварительно образованные бензимидазолы служат в качестве исходных материалов. Кроме того, как показано на фиг. 8, необязательно замещенный 2-винилбензофуран или 2 винилбензотиофен может взаимодействовать с различными диенофилами, такими как перечисленные выше, с образованием промежуточного продукта циклоприсоединения. Модификация этого промежуточного продукта циклоприсоединения может давать имиды, лактамы и родственные соединения данного изобретения. В некоторых предпочтительных вариантах соединения данного изобретения являются ингибиторами PARP. Эффективность ингибитора может быть протестирована измерением активности PARP in vitro или in vivo. Предпочтительный анализ проводит мониторинг переноса радиоактивно меченых АДФрибозных звеньев от [32P]NAD+ к белковому акцептору, такому как гистон или сам PARP. Рутинные анализы для PARP описаны в Purnell and Whish, Biochem. J. 1980, 185, 775, включенной сюда в качестве ссылки. В других предпочтительных вариантах соединения данного изобретения являются также ингибиторами VEGFR2 или MLK3. Эффективность ингибитора может быть протестирована измерением активности VEGFR2 или MLK3 in vitro или in vivo. Предпочтительный анализ активности VEGFR2-киназы включает фосфорилирование белкового субстрата, иммобилизованного на микротитрационном планшете. Полученный остаток фосфотирозина определяют антителом против фосфотирозина, конъюгированным с хелатом европия, что делает возможной количественное определение этого продукта флуорометрией с разделенным временем. Сходные способы анализа использовались для определения тирозинкиназы с-src, как описано в Braunwalder et al. Anal. Biochem. 1996, 238, 159, включенной сюда в качестве ссылки. Предпочтительный способ анализа для MLK3 использует фосфорилирование белкового субстрата, например, миелинового основного белка, [-32 Р]-АТФ, с последующим выделением кислотонерастворимого продукта 32 Р-фосфобелка на фильтрационном планшете. Аналогичные способы использовали для анализа протеинкиназы С, как сообщалось в Pitt and Lee, J. Biomol. Screening 1996, 1, 47, включенной сюда в качестве ссылки. В данном изобретении рассматриваются также способы ингибирования активностей ферментовPARP, VEGFR2 и MLK3. Ферментативная активность может уменьшаться или ингибироваться контактированием фермента по меньшей мере с одним описанным здесь соединением. Контактирование может происходить in vitro, in vivo или ex vivo. Контактирование может также стимулироваться использованием среды для контакта, которая усиливает скорость смешивания фермента и ингибитора. Предпочтительные среды для контакта включают воду, растворы на основе воды, забуференные растворы, водосмешиваемые растворители, солюбилизирующие фермент растворы и любую их комбинацию. В контактировании клеток, содержащих фермент, in vivo предпочтительно используют ингибитор, доставляемый в участок вблизи фермента, ассоциированного с клеткой, в биологически совместимой среде. Предпочтительные биологически совместимые среды включают воду, растворы на основе воды, солевой раствор,биологические жидкости и секреции и любой другой нетоксичный материал, который может эффективно доставлять ингибитор в участок вблизи фермента в биологической системе. Описанные здесь соединения могут использоваться для предупреждения или лечения возникновения или прогрессирования любого заболевания или состояния, связанного в активностью PARP у млекопитающих, в частности у человека. Такие состояния включают травматическое повреждение центральной нервной системы, такие как повреждения головного мозга и спинного мозга, и деградацию нейронов,связанную с травматическим повреждением центральной нервной системы. Родственные состояния и нарушения, которые могут также лечиться способами данного изобретения, включают васкулярные удары, сердечную ишемию, церебральную ишемию, цереброваскулярные нарушения, такие как рассеянный склероз, и нейродегенеративные заболевания, такие как болезни Альцгеймера, Хантингтона и Паркинсона. Другие связанные с PARP состояния или заболеваниия, которые могут лечиться описанными здесь- 17007868 соединениями, включают воспаление, такое как плеврит и колит, эндотоксиновый бактериальнотоксический шок, диабет, рак, артрит, ишемию сердца, ретинальную ишемия, старение кожи, хроническую и острую боль, геморрагический шок и другие. Например, после симптомов мозгового удара пациенту могут быть введены одно или несколько описанных здесь соединений для предупреждения или минимизации повреждения головного мозга. Пациентов с симптомами болезни Альцгеймера, Хантингтона или Паркинсона можно лечить соединениями данного изобретения для остановки прогрессирования заболевания или облегчения симптомов. Ингибиторы PARP могут быть также использованы для лечения пациентов, страдающих от рака. Например, раковым пациентам можно вводить соединения данного изобретения для увеличения противоопухолевых эффектов химиотерапии. Описанные здесь соединения могут быть использованы для предупреждения или лечения прогрессирования любого заболевания или состояния, связанного с киназной активностью (например, активностями VEGFR2 или MLK3) у млекопитающих, в частности у человека. Например, описанные здесь соединения могут быть использованы для лечения состояний, связанных с активностью MLK3, таких как,например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, и острые неврологические состояния, такие как ишемия сердца, церебральная ишемия, а также травматические повреждения головного и спинного мозга. Далее, описанные здесь соединения могут быть также использованы в лечении воспалительных заболеваний и рака, связанных с активностью MLK3. Подобным образом, описанные здесь соединения могут быть использованы для ингибирования VEGFR2, которое может приводить к подавлению образования новых кровеносных сосудов. Таким образом, такие соединения могут быть применимы в лечении состояний, связанных с образованием новых кровеносных сосудов, таких как, например, солидные опухоли, диабетическая ретинопатия и другие внутриглазные неоваскулярные синдромы, дегенерация желтого пятна, ревматоидный артрит, псориаз и эндометриоз. Описанные здесь соединения предпочтительно вводят млекопитающим в терапевтически эффективном количестве. Доза может изменяться в зависимости от соединения, эффективности этого соединения, типа заболевания и состояния пациента, среди других переменных факторов. Количество дозы может быть измерено введением предварительно измеренных дозированных количеств или унифицированных доз в форме таблеток, капсул, суппозиториев, порошков, эмульсий, эликсиров, сиропов, мазей, кремов или растворов. В терапевтическом или профилактическом применении ингибиторы PARP или киназ могут вводиться любым из способов, при помощи которых обычно вводят лекарственные средства. Такие способы введения включают внутрибрюшинный, внутривенный, внутримышечный, подкожный, внутриоболочечный, внутритрахевальный, внутрижелудочковый, пероральный, буккальный, ректальный, парентеральный, интраназальный, трансдермальный или интрадермальный. Введение может быть системным или локализованным. Описанные здесь соединения могут вводиться в чистой форме, в комбинации с другими активными ингредиентами или в комбинации с фармацевтически приемлемыми нетоксичными наполнителями или носителями. Пероральные композиции обычно включают инертный разбавитель-носитель или съедобный носитель. Фармацевтически совместимые связывающие агенты и/или адъювантные вещества могут быть включены как часть композиции. Таблетки, пилюли, капсулы, пастилки и подобные могут содержать любой из следующих ингредиентов или соединения сходной природы: связывающий агент, такой как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза, диспергирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; скользящее вещество, такое как коллоидальный диоксид кремния; подслащивающий агент, такой как сахароза или сахарин; или ароматизирующий агент, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор. Когда стандартной лекарственной формой является капсула, она может содержать, кроме вещества указанного выше типа,жидкий носитель, такой как жирное (нелетучее) масло. Кроме того, стандартные лекарственные формы могут содержать различные другие материалы, которые модифицируют физическую форму лекарственной формы, например, покрытия из сахара, шеллака или энтеросолюбильные агенты. Далее, сироп может содержать, кроме активных соединений, сахарозу в качестве подслащивающего агента и некоторые консерванты, красители, окрашивающие вещества и ароматизаторы. Альтернативные препараты для введения включают стерильные водные или неводные растворы,суспензии и эмульсии. Примерами неводных растворителей являются диметилсульфоксид, спирты, пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и пригодные для инъекций органические эфиры, например этилолеат. Водные носители включают смеси спиртов и воды,забуференные среды и солевой раствор. Внутривенные носители включают средства, восполняющие жидкость и питательные вещества, средства, восполняющие электролиты, такие как средства на основе декстрозы Рингера, и т.п. Могут также присутствовать консерванты и другие добавки, например, противомикробные вещества, антиоксиданты, хелатообразователи, инертные газы и подобные. Предпочтительные способы введения данных соединений млекопитающим включают внутрибрюшинную инъекцию, внутримышечную инъекцию и внутривенную инфузию. Для этих способов доставки возможны разнообразные жидкие композиции, в том числе солевой раствор, спирт, ДМСО и растворы на- 18007868 основе воды. Концентрация ингибитора может изменяться в соответствии с вводимыми дозой и объемом и может быть в диапазоне от приблизительно 1 до приблизительно 1000 мг/мл. Другие компоненты жидких композиций могу включать консерванты, неорганические соли, кислоты, основания, питательные вещества, витамины или другие фармацевтические вещества, такие как аналгезирующие средства или дополнительные ингибиторы PARP и киназ. Особенно предпочтительные композиции для введения данных соединений подробно описаны в следующих публикациях, которые описывают введение известных ингибиторов PARP и включены сюда в качестве ссылок в полном объеме. Kato, Т. et al. Anticancer Res. 1988, 5(2), 239, Nakagawa, K. et al. Carcinogenesis 1988, 9, 1167, Brown, D.M. et al. Int. J. Radial Oncol. Biol.et. al Jpn. J. Cancer Res. 1991,82(7), 739. Соединения данного изобретения могут также иметь форму фармакологически приемлемой соли,гидрата, сольвата или метаболита. Фармакологически приемлемые соли включают основные соли неорганических и органических кислот, в том числе, но не только, хлористо-водородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, яблочной кислоты,уксусной кислоты, щавелевой кислоты, винной кислоты, лимонной кислоты, молочной кислоты, фумаровой кислоты, янтарной кислоты, малеиновой кислоты, салициловой кислоты, бензойной кислоты, фенилуксусной кислоты, миндальной кислоты и т.п. В том случае, когда соединения данного изобретения содержат кислотную функциональную группу, такую как карбоксигруппа, подходящие фармацевтически приемлемые катионы, образующие пары с такой карбоксигруппой, хорошо известны для специалистов в данной области и включают катионы щелочных металлов, щелочно-земельных металллов, аммония, четвертичного аммония и т.п. Специалистам в данной области будет понятно, что многочисленные изменения и модификации могут быть произведены в отношении предпочтительных вариантов данного изобретения и что такие изменения и модификации могут быть выполнены без отклонения от идеи данного изобретения. Таким образом, предполагается, что прилагаемая формула изобретения охватывает все такие эквивалентные варианты как входящие в суть и объем данного изобретения. ПРИМЕРЫ Пример 1. Измерения ферментативной активности PARP. Активность PARP наблюдали с использованием переноса радиоактивно меченных АДФ-рибозных звеньев из [32P]NAD+ на белковый акцептор, такой как гистон или сам PARP. Смеси для анализа содержали 100 мМ Трис (рН 8,0), 2 мМ ДТТ, 10 мМ MgCl2, 20 мкг/мл ДНК (имеющей одноцепочечные разрывы, полученные обработкой ультразвуком), 20 мг/мл гистона H1, 5 нг рекомбинантного PARP человека и ингибитор или ДМСО (2,5% (об./об. в конечном объеме 100 мкл. Реакции инициировали добавлением 100 мкМ НАД+, дополненного 2 мкКи [32 Р] НАД+/мл, и выдерживали при комнатной температуре в течение 12 мин. Анализы останавливали добавлением 100 мкМ 50% ТХУ и радиоактивно меченный осадок собирали на 96-луночном фильтровальном планшете (Millipore, MADP NOB 50), промывали 25% ТХУ. Количество кислотонерастворимой радиоактивности, соответствующей поли-АДФ-рибозилированному белку,определяли на сцинтилляционном счетчике Wallac MicroBeta. Пример 2. Измерение ферментативной активности VEGFR2-киназы. 96-луночный планшет FluoroNUNC MaxiSorp покрывали 100 мкл на лунку раствора субстрата рекомбинантного PLC- человека/GST при концентрации 40 мкг/мл в Трис-забуференном солевом растворе(TBS). Активность VEGFR2 анализировали в 100 мкл смеси для анализа, содержащей 50 мМ HEPES (рН 7,4), 30 мкМ АТФ, 10 мМ MnCl2, 0,1% БСА, 2% ДМСО и 150 нг/мл экспрессируемого рекомбинантным бакуловирусом человека цитоплазматического домена VEGFR2 человека (предварительно фосфорилированного в течение 60 мин при 4 С в присутствии 30 мкМ АТФ и 10 мМ MnCl2 перед использованием). Киназной реакции давали протекать при 37 С в течение 15 мин. Меченое европием детектируемое антитело против фосфотирозина добавляли при разведении 1:5000 в блок-буфер (3% БСА в TBST). Через 1 ч инкубирования при 37 С добавляли 100 мкл усиливающего раствора (Wallac 1244-105) и планшет осторожно встряхивали. Через 5 мин разделенную во времени флуресценцию полученного раствора измеряли с использованием BMG PolarStar (Model 403) с применением длин волн возбуждающего света и испускаемого света 340 и 615 нм, соответственно, с задержкой в сборе данных 400 мкс и временем интеграции 400 мкс. Пример 3. Измерение ферментативной активности MLK3. Анализ активности для MLK3 выполняли в планшетах Millipore Multiscreen. Каждая смесь для анализа (50 мкл) содержала 50 мМ HEPES (рН 7,0), 1 мМ ЭГТА, 10 мМ MgCl2, 1 мМ ДТТ, 25 мМ глицерофосфат, 100 мкМ АТФ, 1 мкКи [-32 Р]АТФ, 0,1% БСА, 500 мкг/мл миелинового основного белка,- 19007868 2% ДМСО, различные концентрации тестируемых соединений и 2 мкг/мл бакуловирусного домена киназы GST-MLK1 человека. Пробы инкубировали в течение 15 мин при 37 С. Реакцию останавливали добавлением охлажденной на льду 50% ТХУ и белкам давали осаждаться в течение 30 мин при 4 С. Планшетам давали уравновешиваться в течение 1-2 ч перед счетом в сцинтилляционном счетчике Wallac MicroBeta 1450 Plus. Пример 4. Определение IC50 для ингибиторов. Данные ингибирования в единственной точке рассчитывали сравнением активности PARP,VEGFR2 или MLK в присутствии ингибиторов с активностью в присутствии только ДМСО. Кривые ингибирования для соединений получали построением графиков зависимости процента ингибирования отlog10 концентрации соединения. Величины IC50 рассчитывали при помощи метода нелинейной регрессии с использованием сигмоидального уравнения доза-ответ (вариабельный наклон) в GraphPad Prism следующим образом: у= bottom+(top-bottom)/(1+10(logIC50-x)Hillslope),где у является активностью в % при конкретной концентрации соединения, х является логарифмом концентрации соединения, bottom обозначает % ингибирования при самой низкой концентрации тестируемого соединения, a top обозначает % ингибирования при самой высокой концентрации тестируемого соединения. Величины для bottom и top фиксировали при 0 и 100 соответственно. Величины IC50 выражали в виде среднего из по меньшей мере трех отдельных определений. Следующие далее примеры 5-10 представляют данные ингибирования PARP, VEGFR2 и MLK3. Величины IC50 определяли, как описано в примерах 1 и 2. Для некоторых соединений данные по ингибированию представлены в виде процентного ингибирования при указанной концентрации. Соединения представлены в таблице вместе с номером соединения, заместителями и данными ингибирования фермента. Пример 5. Данные ингибирования PARP для соединений 1a-1v формулы IV, где В обозначает СО, R2 обозначает Н, J обозначает Н, V обозначает NR1 и Е и F вместе с атомами, к которым они присоединены, образуют циклопентильную группу. А и R1 изменяются, как показано в списке ниже. Таблица 1 Табл. 5 содержит данные ингибирования в процентах для ферментов MLK3 и VEGFR2 при указанных концентрациях, если нет других указаний. Для некоторых введенных данных указана величина IC50. Таблица 5 Пример 11. Синтез исходных материалов и промежуточных продуктов. Способы и материалы, используемые в синтезе исходных материалов, промежуточных продуктов и ингибиторов, являются следующими. Тонкослойную хроматографию выполняли на пластинках силикагеля (MK6F 60 А, размер 1x3 дюйм, толщина слоя 250 мм; Whatman Inc., Whatman House, UK). Препаративную тонкослойную хроматографию выполняли на пластинках силикагеля (размер 20 х 20 дюйм, толщина слоя 1000 мк; Analtech, Newark, NJ). Препаративную колоночную хроматографию проводили с использованием Merck, Whitehouse Station, NJ, силикагель, 40-63 мм, 230-400 меш. ВЭЖХ проводили при следующих условиях: 1) растворители: А=0,1% ТФУ в воде; В=0,1% ТФУ в ацетонитриле (10-100% В в течение 20 мин или 10-95% В в течение 20,5 мин), 2) колонка: zorbax Rx-C8 (4,6 мм х 15 см), 3) скорость потока: 1,6 мл/мин. 1 Н-ЯМР-спектры регистрировали на приборе GE QE Plus (300 МГц) с использованием тетраметилсилана в качестве внутреннего стандарта. Электрораспылительные масс-спектры регистрировали на приборе VG platform II (Fisons Instruments). На фиг. 1 показаны синтезы промежуточных продуктов, предшественников и исходных материалов для соединений данного изобретения. Синтез 1 а также изображен на этой фигуре. Промежуточное соединение С получали следующим образом. К охлажденному (-78 С) раствору индола (А, 20 г, 171 ммоль) в сухом ТГФ (80 мл) медленно (в течение 30 мин) добавляли 2,5 М нBuLi в гексанах (68,40 мл, 171 ммоль). Смесь перемешивали при -78 С еще в течение 30 мин, доводили до комнатной температуры и перемешивали в течение 10 мин и опять охлаждали до -78 С. Затем барботировали в реакционную смесь газ диоксид углерода в течение 15 мин с последующим дополнительным перемешиванием в течение 15 мин. Избыток CO2 (с некоторой сопутствующей потерей ТГФ) удаляли при комнатной температуре из реакционной колбы с использованием лабораторного вакуума. К реакционной смеси добавляли дополнительное количество сухого ТГФ (25 мл) и смесь охлаждали опять до -78 С. К реакционной смеси медленно добавляли 1,7 М трет-BuLi (100,6 мл, 171 ммоль) в течение 30 мин. Перемешивание продолжали в течение 2 ч при -78 С с последующим медленным добавлением раствора циклопентанона (В, 15,79 г, 188 ммоль) в сухом ТГФ (80 мл). После дополнительного перемешивания в течение 1 ч при -78 С реакционную смесь гасили добавлением по каплям воды (10 мл) с последующим добавлением насыщенного раствора NH4Cl (100 мл). В колбу добавляли этиловый эфир (300 мл) и смесь перемешивали в течение 10 мин при комнатной температуре. Органический слой отделяли, сушили(MgSO4), концентрировали и растирали с этиловым эфиром (40 мл). Выделевшееся твердое вещество фильтровали, промывали холодным эфиром и сушили в высоком вакууме с получением 22,40 г соединения С в виде белого твердого вещества. Другую порцию 4,88 г получали из маточного раствора и промывок. Физические свойства: Т.пл. 133-141 С; Rf 8,68 мин; 1 Н-ЯМР (ДМСО-d6)8,46 шир.с, 1 Н), 7,58 (д,1 Н), 7,36 (д, 1 Н), 7,17 (т, 1 Н), 7,09 (т, 1 Н), 6,34 (с, 1 Н), 2,2-1,6 (м, 8 Н). Аналитическую пробу перекристаллизовывали из кипящей смеси метанол-вода. Элементный анализ. Рассчитано для C13H15NO: С,77,58; Н, 7,51; N, 6,96. Найдено: С, 77,13; Н, 7,12; N, 6,96. Промежуточное соединение D получали следующим образом. К раствору соединения С (20 г, 99,50- 29007868 ммоль) в ацетоне (150 мл) добавляли медленно 2 н. НСl (20 мл) в течение 10 мин. Смесь перемешивали еще в течение 10 мин и добавляли к ней воду (300 мл). При стоянии медленно появлялся осадок. Осадок фильтровали, промывали смесью вода-ацетон (2:1, 3 х 50 мл) и сушили в вакууме с получением 13,57 г соединения D, которое использовали в следующей стадии без дополнительной очистки. Объединенные маточный раствор и промывки при стоянии давали дополнительно 3,72 г белого твердого вещества. Физические свойства D: Т.пл. 166-167 С; 1H-ЯМР (ДМСО-d6) : 8,12 (шир.с, 1 Н), 7,57 (д, 1 Н), 7,16 (т, 1 Н),7,06 (т, 1 Н), 6,42 (с, 1 Н), 6,01 (с, 1 Н), 2,79 (м, 2 Н), 2,60 (м, 2 Н), 2,08 (квинтет, 2 Н). Аналитическую пробу очищали хроматографией на силикагеле (гексаны-эфир, 80:20). Элементный анализ. Рассчитано дляC13H13N: С, 85,21; Н, 7,15; N, 7,64. Найдено: С, 85,08; Н, 7,16; N, 7,64. Промежуточное соединение F получали следующим образом. Смесь соединения D (13,57 г, 74,20 ммоль) и Е (14,4 г, 148 ммоль) перемешивали интенсивно и нагревали в чистом виде при 190 С в запаянной пробирке в течение 1 ч, охлаждали до комнатной температуры, растирали с холодным метанолом и фильтровали. Остаток промывали несколько раз холодным метанолом и сушили в высоком вакууме с получением 10,30 г соединения F, которое использовали на следующей стадии без какой-либо дополнительной очистки. Соединение F характеризуется как желтое аморфное вещество; 1 Н-ЯМР (ДМСО-d6)11,15 (с, 1 Н), 10,89 (с, 1 Н), 7,65 (д, 1 Н), 7,23 (д, 2 Н), 6,91 (м, 2 Н), 4,24 (д, 1 Н), 3,30 (м, 2 Н), 2,60 (м, 1 Н),2,14 (м, 1 Н), 1,92 (м, 1 Н), 1,45 (м, 3H), 1,13 (м, 1 Н). MS m/e 279 (М-Н)-. Соединение G (1 а, 5,7,8,9,10,11-гексагидроциклопент[а]-пирроло[3,4-с]карбазол-5(6 Н),7-дион) получали следующим образом. Смесь соединения F (10,20 г, 36,42 ммоль), DDQ (20,7 г, 91,18 ммоль) и толуола (100 мл) нагревали при 60 С в запаянной пробирке в течение ночи, охлаждали до комнатной температуры и фильтровали. Фильтрат промывали несколько раз метанолом (общий объем 250 мл) для удаления всех побочных продуктов. Сушка в высоком вакууме давала 7,8 г соединения G (1 а), которое использовали без какой-либо дополнительной очистки. Соединение G, также идентифицированное как 1 а,получают в виде желтого аморфного вещества, имеющего Rf 10,90 мин; 1 Н-ЯМР (ДМСО-d6)11,80 (с,1 Н), 10,90 (с, 1 Н), 8,70 (с, 1 Н), 7,50 (м, 2 Н), 7,20 (т, 1 Н), 3,25 (дт, 4 Н), 2,25 (шир.м, 2 Н); MS m/e 275 (МН). Следующие примеры являются примерами получения предшественников и соединений данного изобретения. Пример 12. Получение 1b. К суспензии гидрида натрия (60% в масле, 0,016 г, 0,4 ммоль) в сухом ДМФ (2 мл) медленно добавляли 1 а (0,1 г, 0,36 ммоль) в сухом ДМФ (3 мл). После прекращения выделения газа Н 2 в реакционную колбу добавляли бензил-3-мезилпропиловый эфир (0,11 г, 0,45 ммоль) в сухом ДМФ (1 мл). Смесь перемешивали при 60 С в течение 1,5 ч, выливали в смесь воды со льдом (приблизительно 10 г) и экстрагировали этилацетатом (2 х 15 мл). Объединенный органический слой промывали водой (1 х 10 мл), насыщенным солевым раствором (1 х 10 мл) и концентрировали с получением остатка, который растирали со смесью эфир-гексаны (1:1, 5 мл) с получением твердого вещества. Твердое вещество промывали метанолом и сушили с получением 0,046 г 1b. Соединение 1b характеризуется как желтое аморфное твердое вещество; Rf 17,92 мин; 1H-ЯМР (DMSO-d6)11,90 (с, 1 Н), 8,70 (д, 1 Н), 7,50 (м, 2 Н), 7,25 (т, 1 Н), 7,10 (м,5 Н), 4,30 (с, 2 Н), 3,70 (т, 2 Н), 3,50 (т, 2 Н), 3,25 (дт, 4 Н), 2,25 (м, 2 Н), 1,80 (м, 2 Н); MS m/e 423 (М-Н). Пример 13. Получение 1 с. К суспензии гидрида натрия (60% в масле, 0,016 г, 0,4 ммоль) в сухом ДМФ (2 мл) медленно добавляли 1 а (0,1 г, 0,36 ммоль) в сухом ДМФ (3 мл). После прекращения выделения газа H2 в реакционную колбу добавляли бензил-4-бромбутиронитрил (0,08 г, 0,54 ммоль) в сухом ДМФ (1 мл). Смесь перемешивали при 60 С в течение 1,5 ч, выливали в смесь воды со льдом (приблизительно 10 г) и фильтровали. Остаток промывали метанолом и сушили с получением 0,08 г 1 с. 1 с характеризуется как желтое аморфное твердое вещество; Rf 14,31 мин; 1 Н-ЯМР (DMSO-d6)11,90 (с, 1 Н), 8,70 (д, 1 Н), 7,50 (м, 2 Н), 7,25 (т,1 Н), 3,70 (т, 2 Н), 3,25 (дт, 4 Н), 2,50 (т, 2 Н), 2,25 (м, 2 Н), 1,90 (м, 2 Н); MS m/e 342 (М-Н). Пример 14. Получение 1d. К суспензии гидрида натрия (60% в масле, 0,088 г, 2,2 ммоль) в сухом ДМФ (4 мл) медленно добавляли 1 а (0,55 г, 2 ммоль) в сухом ДМФ (3 мл). После прекращения выделения газа H2 в реакционную колбу добавляли 1-хлор-3-иодпропан (0,49 г, 0,54 ммоль) в сухом ДМФ (3 мл). Смесь перемешивали при 100 С в течение 6 ч, концентрировали до меньшего объема, выливали в смесь воды со льдом (приблизительно 20 г) и фильтровали. Остаток промывали метанолом и сушили с получением 0,4 г 1d. Соединение 1d характеризуется как желтое аморфное твердое вещество; Rf 16,59 мин; 1H-ЯMP (DMSO-d6)11,90 (с,1 Н), 8,70 (д, 1 Н), 7,50 (м, 2 Н), 7,25 (т, 1 Н), 3,70 (м, 4 Н), 3,25 (дт, 4 Н), 2,25 (м, 2 Н), 2,10 (м, 2 Н); MS m/e 351 и 353 (М-Н для различных изотопов хлора). Пример 15. Получение 1 е.
МПК / Метки
МПК: A61K 31/4035, A61P 25/00, C07D 209/48, A61P 35/00, A61P 9/00, C07D 487/04, A61K 31/407
Метки: применение, полициклические, новые, соединения
Код ссылки
<a href="https://eas.patents.su/30-7868-novye-policiklicheskie-soedineniya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые полициклические соединения и их применение</a>
Предыдущий патент: Композиции для лечения флавивирусных и пестивирусных инфекций и способы их применения
Следующий патент: Устройство для удаления загрязнений и способ для его реализации
Случайный патент: Сжигающая колонна и способ ее работы












