Аналоги аденозина для лечения синдрома резистентности к инсулину и диабета
Номер патента: 7253
Опубликовано: 25.08.2006
Авторы: Херлинг Андреас, Эвинг Вилльям Р, Магвайр Мартин П., Полс Генри В., Майерс Майкл Р., Ене Герхард, Спейд Алфред П., Чои-Следески Йонг Ми
Формула / Реферат
1. Применение соединений формулы
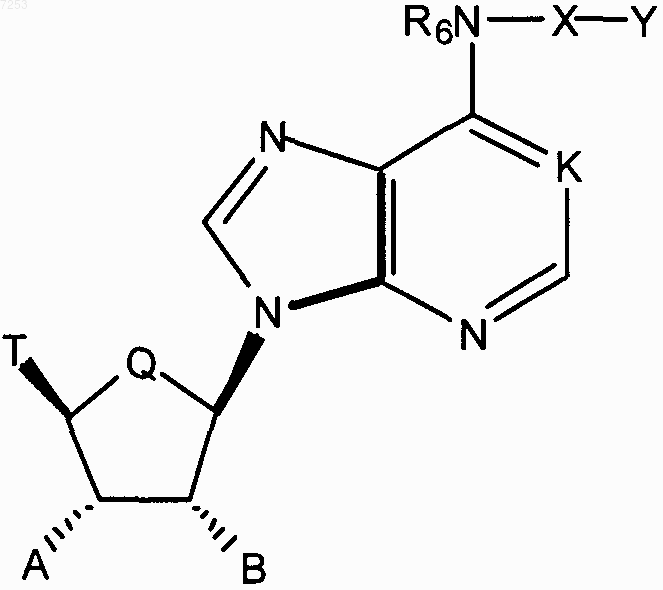
где K представляет N, N® O или СН;
Q представляет СН2 или О;
R6 представляет водород;
Х представляет  ;
;
где азот в кольце Х замещен Y;
Е представляет О или S;
Y представляет С1-С20алкил с прямой или разветвленной цепью, аралкил, замещенный аралкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, гетероциклилалкил, замещенный гетероциклилалкил;
n и р независимо представляют 0, 1, 2 или 3, при условии, что n+р равен по крайней мере 1;
Т представляет алкил, C(O)NR1R2, R3О-СН2;
R1, R2 независимо представляют Н, алкил или циклоалкил;
R3 представляет водород, С1-С20алкил с прямой или разветвленной цепью;
А представляет гидрокси;
В представляет гидрокси;
либо их фармацевтически приемлемой соли, N-оксида, гидрата или сольвата для изготовления лекарственного средства для лечения синдрома резистентности к инсулину и диабета.
2. Применение соединений по п.1, где K представляет N, Т представляет гидроксиметил, метоксиметил, А и В представляют гидрокси, Х представляет 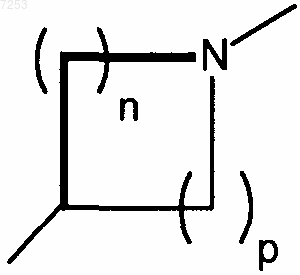 , а n+р=3 или 4, или их фармацевтически приемлемой соли, N-оксида, гидрата или сольвата.
, а n+р=3 или 4, или их фармацевтически приемлемой соли, N-оксида, гидрата или сольвата.
3. Применение соединений по п.1 или 2, которые представляют собой
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(5-хлорпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(R)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(4-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(5-бромпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(4-нитрофенил)пирролидин-3(S)-иламино]пурин-9-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-(5'-трифторметил-3,4,5,6-тетрагидро-2Н[1,2']бипиридинил-3-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-(фенилпирролидин-3(S)-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-(1-пиридин-2-илпирролидин-3(S)-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидpoкcимeтил-2-[6-[1-(4-хлорфенил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(5-метилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(5-тиофен-2-илпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(5-метилмеркаптопиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(6-метоксипиримидин-4-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-гидроксиметил-2-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-5-метоксиметил-2-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(4-нитрофенил)пиперидин-4-иламино]пурин-9-ил]циклопентан-1,2-диол;
дигидрохлорид (1R,2S,3R,5R)-5-гидроксиметил-3-[6-((3S)пирролидин-3-иламино)пурин-9-ил]циклопентан-1,2-диола;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(4-нитрофенил)пирролидин-3-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(R)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-((3R)-пирролидин-3-иламино)пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(5-бромпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(5-хлорпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(4-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(пиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(хинолин-3-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(4-нитрофенил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(4,5-бистрифторпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-5-метоксиметил-3-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(фенил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
4-[3(S)-[9-((1R,2S,3R,5R)-1,2-дигидрокси-5-гидроксиметилциклопент-3-ил)-9Н-пурин-6-иламино]пирролидин-1-ил]бензонитрил;
(1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(изохинолин-1-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(6-бромхинолин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(4-хлорфенил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(3-хлор-5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-5-метоксиметил-3-[6-[1-(6-метоксипиримидин-4-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(4-трифторметилфенил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(5-бромпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(5-хлорпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-5-метоксиметил-3-[6-[1-(4-трифторметилфенил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(4-хлорфенил)пирролидин-3(S)-иламино]пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(3-хлорфенил)пирролидин-3(S)-иламино]пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-[1-(3-хлорфенил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол;
(1R,2S,3R,5R)-5-метоксиметил-3-[6-[1-фенилпирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол;
(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол и
(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол,
или их фармацевтически приемлемой соли, N-оксида, гидрртр или сольвата.
Текст
007253 Настоящее изобретение относится к использованию соединений, полученных из аденозина, и их аналогов общей формулы (I) в качестве агентов против резистентности к инсулину. Аденозин имеет широкий спектр физиологического и фармакологического действия, включая значительное изменение сердечно-сосудистой и почечной функции. У животных и человека внутривенное введение аденозинового нуклеотида вызывает гипотензию. Физиологическое и фармакологическое действие аденозина опосредуется специфическими рецепторами, локализованными на поверхностях клеток. Было идентифицировано четыре подтипа аденозиновых рецепторов, обозначаемых рецепторами A1, A2A, А 2B и А 3. Рецептор A1 ингибирует образование сАМР (циклический аденозинмонофосфат) посредством подавления активности аденилатциклазы, а стимуляция рецепторов A2 приводит к повышению активности аденилатциклазы и уровня внутриклеточного сАМР. Каждый рецептор, очевидно, опосредует специфическое действие аденозина в различных тканях: например, васкулярное действие аденозина, очевидно, опосредуется через стимуляцию рецепторов A2,которая поддерживается позитивной корреляцией между продуцированием сАМР и вазорелаксацией в обработанной аденозином выделенной гладкой мышце сосуда, а стимуляция сердечных рецепторов A1 приводит к снижению уровня продуцирования сАМР в сердце и способствует вырабатыванию негативных дромотропных, инотропных и хронотропных сердечных эффектов. Следовательно, в отличие от большинства вазодилататоров, введение аденозина не вызывает рефлекторную тахикардию. Аденозин также оказывает значительное воздействие на почечную функцию. Внутрипочечное введение аденозина приводит к кратковременному снижению кровотока в почках и к повышению резистентности почечных сосудов. При продолжительном введении аденозина кровообращение в почках восстанавливается до нормальных уровней и резистентность почечных сосудов снижается. Начальное сужение сосудов в почках в ответ на введение аденозина обусловлено не прямым сосудосуживающим действием нуклеотида, а его участием во взаимодействии между аденозином и системой "ренин-ангиотензин". В широком смысле, аденозин рассматривается как главный физиологический медиатор реактивной гиперемии и ауторегуляции русла коронарных сосудов в ответ на ишемию миокарда. Сообщалось, что эндотелий коронарных сосудов имеет аденозиновые рецепторы A2, которые связываются с аденилатциклазой и которые активируются одновременно с увеличением коронарного кровотока, и сообщалось, что рецепторы кардиомиоцитов представляют собой преимущественно аденозиновые рецепторы подтипа A1 и ассоциируются с брадикардией. В соответствии с этим действие аденозина предоставляет уникальный механизм для лечения ишемии. Кардиоваскулярные ответы на действие аденозина являются кратковременными из-за быстрого поглощения и метаболизма этого эндогенного нуклеотида. В противоположность этому, аденозиновые аналоги являются более резистентными к метаболической деградации и, как сообщалось, вызывают продолжительные изменения артериального давления и частоты сердечных сокращений. В патенте ЕР А 0912520 описаны аденозиновые соединения общей формулы (I), используемые в качестве гипотензивных, кардиопротективных, противоишемических и антилипотических агентов. Было синтезировано несколько метаболически стабильных аналогов аденозина, которые обнаруживали различные степени селективности в отношении рецепторов двух подтипов. Агонисты аденозина, в основном, обнаруживают более высокую селективность по отношению к рецепторам A1, чем по отношению к рецепторам A2. Циклопентиладенозин (СРА) и R-фенилизопропиладенозин (R-PIA) представляют собой стандартные адонозиновые агонисты, которые обладают явно выраженной селективностью по отношению к рецептору A1 (отношение A2/A1=780 и 106, соответственно). В противоположность этому, N5'-этилкарбоксамидоаденозин (NECA) представляет собой сильный агонист рецептора A2 (Ki-12 нМ), но он обладает такой же аффинностью и по отношению к рецептору A1 (Ki-6,3 нМ; отношение A2/A1=l,87). Как было известно до настоящего времени, CV-1808 является наиболее доступным селективным агонистом A2 (A2/A1=0,19), хотя указанное соединение является в 10 раз менее сильным, чем NECA, с точки зрения его аффинности по отношению к рецептору A2. В недавно проведенных исследованиях были получены еще более новые соединения, которые являются очень сильными и селективными агонистами A2(1993) 77-111). В литературе сообщалось, что различные N6-арил и N6-гетероарилалкилзамещенные аденозины и замещенные (2-амино и 2-гидрокси)аденозины обладают различной фармакологической активностью,включая кардиологическую и сосудистую активность. См. например, описание патента Великобритании 1123245, выложенную заявку на патент Германии 2136624, выложенную заявку на патент Герма-1 007253 нии 2059922, патент США 4501735, публикацию ЕР 0139358 (где описаны N6-[гемдиарилзамещенный алкил]аденозины), ЕР-А 0305643 (где указывается, что N6-гетероциклзамещенные производные аденозина обладают активностью, вызывающей расширение сосудов сердца), выложенную заявку на патент Германии 2131938 (где описаны арил- и гетероарилалкилгидразинил производные аденозина), выложенную заявку на патент Германии 2151013 (где описаны N6-apил- и гетероарилзамещенные аденозины) и выложенную заявку на патент Германии 2205002 (где описаны аденозины с N6-заместителями, содержащие мостиковые кольцевые структуры, связывающие N6-азот с заместителями, включая тиенил). В патенте США 4954504 и в публикации ЕР 0267878, в основном, указывается, что карбоциклические рибозные аналоги аденозина и их фармацевтически приемлемые сложные эфиры, замещенные в 2- и/или N6-положениях арил(низшими)алкильными группами, включая тиенил, тетрагидропиранил,тетрагидротиопиранил, и бициклические бензоконденсированные 5- или 6-членные насыщенные гетероциклические (низшие)алкильные производные обладают агонистическими свойствами по отношению к аденозиновому рецептору. Аналоги аденозина, имеющие заместители типа тиенила, описаны в публикации ЕР 0277917 (где описаны N6-зaмещенные-2-гетероарилалкиламинозaмещенные аденозины, включая 2[(2-[тиен-2-ил]этил)амино]замещенный аденозин), в выложенной заявке на патент Германии 2139107(где описан N6-[бензотиенилметил]аденозин), в РСТ WO 85/04882 (где указывается, что N6-гетероциклилалкилзамещенные производные аденозина, включая N6-[2-(2-тиенил)этил]амино-9-(D-рибофуранозил)-9 Н-пурин, обладают сердечной сосудорасширяющей активностью и что N6-хиральные заместители обладают повышенной активностью), в опубликованной заявке ЕР 0232813 (где указывается, что N6(1-замещенный тиенил)циклопропилметилзамещенные аденозины обладают сердечно-сосудистой активностью), в патенте США 4683223 (где указывается, что N6-бензотиопиранилзамещенные аденозины обладают гипотензивными свойствами), в РСТ WO 88/03147 и в WO 88/03148 (где указывается, что N6[2-арил-2-(тиен-2-ил)]этилзамещенные аденозины обладают гипотензивными свойствами) и в патентах США 4636493 и 4600707 (где указывается, что N6-бензотиенилэтилзамещенные аденозины обладают гипотензивными свойствами). Амиды аденозин-5'-карбоновой кислоты описаны в патенте США 3914415 как агенты, обладающие гипотензивной активностью и активностью против стенокардии, а в патенте США 4738954 указывается, что N6-замещенные арил- и арилалкиладенозин-5'-этилкарбоксамиды обладают различной сердечно-сосудистой и гипотензивной активностью.N6-Aлкил-2'-О-алкиладенозины описаны в публикации ЕР 0378518 и в патентной заявке Великобритании 2226027 как агенты, обладающие гипотензивной активностью. N6-Aлкил-2',3'-ди-O-алкиладенозины также описаны в патенте США 4843066 как агенты, обладающие гипотензивным действием. В работе Stein et al., J. Med. Chem. 1980, 23, 313-319 и J. Med. Chem. 19(10), 1180 (1976) сообщалось,что сложные эфиры аденозин-5'-(N-замещенных)карбоксамидов и карбоксилатов и их N1-оксиды обладают коронарным сосудорасширяющим действием. В патенте США 4167565 также сообщалось, что аденозин-5'-карбоксамиды и их N1-оксиды являются ядами для мелких животных. В публикациях ЕР 0423776 и 0423777 описаны N6-замещенные аденозины и аналоги, которые могут быть использованы для лечения нарушений перистальтики желудочно-кишечного тракта. В патенте ЕР-А 0758897 описаны N6-гетероциклилалкиловые соединения, происходящие от аденозина и его аналогов, а также их использование для лечения гипертензии и ишемии миокарда, их использование в качестве кардиопротективных агентов, которые снижают размер области ишемического повреждения или инфаркта миокарда, вызываемого ишемией миокарда, их использование в качестве антилиполитических агентов, снижающих уровни липидов в плазме, уровни триглицеридов в сыворотке и уровни холестерина в плазме. В патенте США 5364862, поданном 2 октября 1992, также описаны N6 гетероциклильные соединения, происходящие от аденозина и его аналогов, и использование этих соединений для лечения ишемии миокарда и гипертензии. Очевидно, что токсичность, ЦНС-активность и увеличение чистоты сердечных сокращений, ассоциированные с аналогами аденозина, о которых сообщалось в литературе, вносят определенные трудности,препятствующие разработке гипотенсивного/противоишемического агента-аналога коммерчески доступного аденозина. Настоящее изобретение относится к классу метаболически стабильных аналогов аденозина и их производных, обладающих неожиданно благоприятными фармакологическими свойствами, то есть являющихся антилиполитическими агентами, имеющими уникальный терапевтический профиль. Неожиданно было обнаружено, что аденозиновые соединения, посредством стимуляции аденозинового рецептора A1, присутствующего на адипоцитах, могут ингибировать периферический липолиз запасных триглицеридов и, тем самым, могут вызывать быстрое снижение свободных жирных кислот в плазме. Этот антилиполитический эффект непосредственно приводит к началу увеличения чувствительности к инсулину у животных, резистентных к инсулину, включая человека. Поэтому агонисты аденозина могут быть использованы в качестве терапевтических средств для лечения синдрома резистентности к инсулину, а также в качестве противодиабетических средств при диабете, резистентном к инсулину. Настоящее изобретение относится к использованию аденозиновых соединений, описанных формулой I: Х представляет где азот на кольце Х замещен Y; Е представляет О или S;Y представляет водород, алкил, аралкил, замещенный аралкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, гетероциклилалкил или замещенный гетероциклилалкил; представляет водород или алкил где Rd и Re независимо представляют водород, алкил либо, взятые вместе с атомом углерода, с которым они связаны, они могут образовывать 1,1-циклоалкильную группу; или их фармацевтически приемлемой соли, их фармацевтически приемлемого пролекарства, их Nоксидов, гидратов или сольватов для изготовления лекарственного средства для лечения синдрома резистентности к инсулину и диабета. Если это не оговорено особо, то термины, используемые выше и во всем описании изобретения,имеют следующие значения."Ацил" означает прямую или разветвленную алкил-С=O-группу. "Тиоацил" означает прямую или разветвленную алкил-С=S-группу. Предпочтительными ацильными и тиоацильными группами являются низший алканоил и низший тиоалканоил, имеющие примерно от 1 до 6 атомов углерода в алкильной группе."Алкил" означает насыщенную алифатическую углеводородную группу, которая может быть прямой или разветвленной и содержит примерно от 1 до 20 атомов углерода в цепи. Предпочтительные алкильные группы могут быть прямыми или разветвленными и имеют примерно от 1 до 10 атомов углерода в цепи. Термин "разветвленный" означает, что низшая алкильная группа, такая как метил, этил или пропил, присоединена к прямой алкильной цепи."Низший алкил" означает алкильную группу, имеющую примерно от 1 до 6 атомов углерода."Циклоалкил" означает алифатическое кольцо, имеющее примерно от 3 до 10 атомов углерода в кольце. Предпочтительные циклоалкильные группы имеют в кольце примерно от 4 до 7 атомов углерода.. "Алкилкарбамоил" и "диалкилкарбамоил" означают карбамоильные группы, у которых атом азота замещен одной или двумя алкильными группами, соответственно."Алкокси" означает алкил-О-группу, где "алкил" определен выше. Предпочтительными являются низшие алкоксигруппы. Примерами таких групп являются метокси, этокси, н-пропокси, изопропокси и н-бутокси."Алкоксиалкил" означает определенную выше алкильную группу, замещенную алкоксигруппой,определенной выше."Аралкил" означает алкильную группу, замещенную арильным радикалом, где "арил" означает фенил или нафтил. "Замещенный аралкил" и "замещенный арил" означают, что арильная группа или арильная группа аралкильной группы замещена одним или несколькими заместителями, включая алкил, алкокси, амино, нитро, карбокси, карбоалкокси, циано, алкиламино, галоген, гидрокси, гидроксиалкил,меркаптил, алкилмеркаптил, тригалогеналкил, карбоксиалкил или карбамоил.CnH2n+1OH, где n равно примерно от 1 до 6."Гетероциклил" означает кольцевую структуру, имеющую примерно 4-10 членов, где один или несколько атомов в кольце представляют элемент, не являющийся углеродом, например N, О или S. Гетероциклил может быть ароматическим или неароматическим, т.е. он может быть насыщенным либо частично или полностью ненасыщенным. Предпочтительными гетероциклильными группами являются пиридильная, пиридазинильная, пиримидинильная, изохинолинильная, хинолинильная, хиназолинильная, имидазолильная, пирролильная,фуранильная, тиенильная, тиазолильная, бензотиазолильная, пиперидинильная, пирролидинильная, тетрагидрофуранильная, тетрагидропиранильная и морфолинильная группы."Замещенная гетероциклильная группа" означает гетероциклильную группу, замещенную одним или несколькими заместителями, где указанными заместителями являются алкокси, алкиламино, арил, карбалкокси,карбамоил, циано, галоген, гетероциклил, тригалогенметил, гидрокси, меркаптил, алкилмеркаптил или нитро."Гидроксиалкил" означает алкильную группу, замещенную гидроксигруппой. Предпочтительными являются гидрокси(низшие)алкильные группы. Примерами предпочтительных групп являются гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил и 3-гидроксипропил."Пролекарство" означает соединение, которое in vivo быстро превращается в исходное пептидное соединение, например, путем гидролиза в крови. "Фармацевтически приемлемое пролекарство" означает соединение, которое, на основании тщательной оценки специалистов-медиков, было признано подходящим для введения пациенту в качестве фармацевтического средства, но при этом оно не оказывает чрезмерного токсического действия, не вызывает раздражения, аллергической реакции и т.п. и является эффективным при применении в конкретных целях, и таким соединением может быть фармацевтически приемлемый сложный эфир, а также цвиттерионная форма, там, где это возможно, пептидных соединений настоящего изобретения. Фармацевтически приемлемые пролекарства настоящего изобретения описаны в работе T. HiguchiV. Stella, Pro-drugs as Novel Delivery Systems, Vol.14 of the A.C.S. Symposium Series и в работе Edward В. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Associationand Pergamon Press, 1987, каждая из которых вводится в настоящее описание посредством ссылки."Сольват" означает физическую связь соединения настоящего изобретения с одной или несколькими молекулами растворителя. Такая физическая связь приводит к изменению степени ионного и ковалентного связывания, включая водородную связь. В некоторых случаях, сольват может быть выделен,например, если одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. Термин "сольват" охватывает как сольваты, образованные фазой растворителя, так и выделяемые сольваты. Репрезентативными сольватами являются этаноляты, метаноляты и т.п. "Гидрат" означает сольват, где молекулой(ами) растворителя является/являются H2O. Соединения формулы I содержат хиральные (асимметрические) центры. Настоящее изобретение включает отдельные стереоизомеры и их смеси. Отдельные изомеры получают или выделяют хорошо известными методами или методами, описанными в настоящей заявке. Описанные здесь соединения могут быть использованы в форме свободного основания, в форме кислотно-аддитивных солей или гидратов. Все указанные формы входят в объем настоящего изобретения. Кислотно-аддитивные соли являются лишь более удобной формой для применения. На практике, использование солевой формы, по существу, равнозначно использованию основной формы. Кислотами, которые могут быть использованы для получения кислотно-аддитивных солей, предпочтительно являются такие кислоты, которые при взаимодействии со свободным основанием образуют фармацевтически приемлемые соли, то есть соли, анионы которых являются не токсичными для реципиента при введении ему фармацевтических доз этих солей, при этом необходимо, чтобы благоприятные гипотенсивные, кардиопротективные, противоишемические, и антилиполитические эффекты, продуцируемые свободным основанием, не ослаблялись побочными эффектами, присущими этим анионам. Хотя фармацевтически приемлемые соли соединений настоящего изобретения являются предпочтительными, однако, все кислотноаддитивные соли могут быть использованы как источники для образования свободного основания, даже если данная конкретная соль, per se, необходима только как промежуточный продукт, например, в случае, если данную соль получают только для очистки и идентификации или если она используется в качестве промежуточного соединения для получения фармацевтически приемлемой соли с помощью ионообменных процессов. Фармацевтически приемлемые соли, входящие в объем настоящего изобретения,-4 007253 получают из минеральных кислот, таких как соляная кислота, серная кислота, фосфорная кислота и сульфамовая кислота; и органических кислот, таких как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, фумаровая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, циклогексилсульфаминовая кислота, хинная кислота и т.п. Соответствующими кислотно-аддитивными солями являются следующие соли: гидрохлорид, сульфат, фосфат, сульфамат, ацетат, цитрат, лактат, тартрат, метансульфонат, фумарат,этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфонат и хиннат, соответственно. Кислотно-аддитивные соли соединений настоящего изобретения обычно получают либо путем растворения свободного основания в водном или в водно-спиртовом растворе либо в других растворителях,содержащих соответствующую кислоту, и выделения соли путем выпаривания раствора, либо посредством реакции взаимодействия свободного основания и кислоты в органическом растворителе, и в этом случае соль либо может быть выделена непосредственно, либо она может быть получена путем концентрирования раствора. В объем формулы I входят соединения тех классов, которые могут быть охарактеризованы, в основном, как N6-замещенныe аденозины; N6-замещенные карбоциклические аденозины (или, альтернативно, дигидрокси[N6-замещенные-9-аденил]циклопентаны) и их N-оксиды; и N6-замещенные-N'-1-деазааристеромицины (или, альтернативно, дигидрокси[N7-замещенный [4,5-b]имидазопиридил]циклопентаны). В объем формулы I входят также 5'-алкилкарбоксамидные производные аденозинов, карбоциклические аденозины и 1-деазааристеромицины, производные соединений вышеупомянутых классов, в которых одна или обе 2- или 3-гидроксильные группы циклопентанового кольца или, в случае классов соединений, содержащих рибозную часть, 2'- или 3'-гидроксильные группы рибозного кольца являются замещенными. Такие производные сами по себе могут содержать биологически активную химическую молекулу, обладающую нужной активностью для лечения гипертензии и ишемии миокарда, и могут представлять собой кардиопротективные и антилиполитические агенты, либо они могут действовать как пролекарства для таких биологически активных соединений, которые образуются из них в физиологических условиях. Репрезентативными соединениями, подходящими для использования, являются:(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)пурин-9-ил]-5-метоксиметилциклопентан 1,2-диол; 1(S)-метилпропиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-илциклопентанкарбоновой кислоты; и 1(R)-метилпропиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-илциклопентанкарбоновой кислоты. Предпочтительным классом используемых соединений являются соединения, представленные формулой I, где К представляет N, Т представляет гидроксиметил или метоксиметил, А и В представляют, а n+р=3 или 4, или их фармацевтически приемлемые соли. Репрезентативными соединениями этого предпочтительного класса соединений являются:(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)пурин-9-ил]-5-метоксиметилциклопентан 1,2-диол. Другим предпочтительным классом используемых соединений являются соединения, представлен ные формулой I, где Q представляет СН 2, К представляет N, Т представляет, а n+р=3 или 4, или их фармацевтически приемлемые соли. Репрезентативными соединениями этого другого предпочтительного класса соединений являются: этиламид(1S,2R,3S,4R)-2,3-дигидрокси-4-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3-иламино]пурин-9-ил]циклопентанкарбоновой кислоты; 1(S)-метилпропиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-илциклопентанкарбоновой кислоты; и 1(R)-метилпропиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-илциклопентанкарбоновой кислоты. Более предпочтительным классом используемых соединений являются соединения, представленные формулой I, где Q представляет СН 2, К представляет N, Т представляет гидроксиметил или метоксиме, а n+р=3 или 4, или их фармацевтичетил, А и В представляют гидрокси, Х представляет ски приемлемые соли. Репрезентативными соединениями этого более предпочтительного класса соединений являются:(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)пурин-9-ил]-5-метоксиметилциклопентан 1,2-диол; Наиболее предпочтительными используемыми соединениями настоящего изобретения являются:- 10007253 Количество соединения формулы (I), необходимое для достижения желаемого биологического эффекта, зависит от ряда факторов, таких как, например, выбор конкретного соединения, цели использования, способ введения и клиническое состояние пациента. В основном, суточная доза составляет в пределах от 0,3 до 100 мг (обычно от 3 до 50 мг) в день на килограмм массы тела, например 3-10 мг/кг/день. Внутривенная доза может составлять, например, от 0,3 мг до 1,0 мг/кг, и эта доза может быть предпочтительно введена путем вливания от 10 до 100 нг на килограмм в минуту. Подходящие для этих целей растворы для вливания могут содержать, например, от 0,1 нг до 10 мг, а обычно от 1 нг до 10 мг на миллилитр. Разовые дозы могут содержать, например, от 1 мг до 10 г активного ингредиента. Ампулы для инъекций могут содержать, например, от 1 до 100 мг, а препараты, включающие разовую дозу, которые могут быть введены перорально, такие как, например, таблетки или капсулы, содержат, например, от 1,0 до 1000 мг, обычно от 10 до 600 мг. В случае фармацевтически приемлемых солей, вышеуказанные количества даны по массе соли соединения формулы (I). Для профилактики или терапии вышеупомянутых состояний соединения формулы (I) могут быть использованы либо отдельно, либо, что предпочтительно,они могут быть использованы в форме фармацевтической композиции с приемлемым носителем. Само собой разумеется, что этот носитель должен быть приемлемым в том смысле, что он должен быть совместимым с другими ингредиентами указанной композиции, и при этом он не должен оказывать вредного воздействия на здоровье пациента. Носитель может быть твердым, или жидким, либо и тем, и другим, а предпочтительно, чтобы он, вместе с данным соединением, входил в состав композиции, приготовленной в виде разовой лекарственной формы, например в виде таблетки, которая может содержать от 0,05 до 95 мас.% активного ингредиента. Кроме того, в данной композиции могут также присутствовать и другие фармацевтически активные вещества, включая другие соединения формулы (I). Фармацевтические композиции настоящего изобретения могут быть получены любым из известных фармацевтических методов, которые, в основном, предусматривают смешивание этих ингредиентов с фармацевтически приемлемыми носителями и/или наполнителями. Фармацевтическими композициями настоящего изобретения являются композиции, подходящие для перорального, ректального, местного, внутриротового (например, подъязычного) и парентерального(например, подкожного, внутримышечного, чрескожного или внутривенного) введения, хотя наиболее подходящий способ введения в каждом конкретном случае зависит от природы и тяжести состояния,подвергаемого лечению, и от природы используемого соединения формулы (I). Препараты с покрытием и препараты с покрытием для пролонгированного высвобождения лекарственного средства также входят в объем настоящего изобретения. Предпочтительными являются препараты, устойчивые к действию кислоты и к желудочного сока. Подходящие покрытия, устойчивые к желудочному соку, включают ацетатфталат целлюлозы, поливинилацетат, фталат гидроксипропилметилцеллюлозы и анионные полимеры метакриловой кислоты и метилметакрилата. Подходящие фармацевтические соединения для перорального введения могут быть приготовлены в виде отдельных лекарственных форм, таких как, например, капсулы, облатки, таблетки для сосания или просто таблетки, каждая из которых содержит определенное количество соединения формулы (I); в виде порошков или гранул; в виде раствора или суспензии в водной или безводной жидкости; либо в виде эмульсии типа "масло в воде" или "вода в масле". Как уже упоминалось, эти композиции могут быть получены любым подходящим фармацевтическим методом, включающим стадию, в которой активный ингредиент и носитель (который может состоять из одного или нескольких дополнительных ингредиентов) подвергают контактированию. В основном, эти композиции приготавливают путем равномерного и гомогенного смешивания активного ингредиента с жидким и/или тонкоизмельченным твердым носителем,после чего полученному продукту, если это необходимо, придают соответствующую форму. Так, например, таблетка может быть изготовлена путем прессования или формования порошка или гранул данного соединения с одним или несколькими дополнительными ингредиентами, там, где это необходимо. Спрессованные таблетки могут быть изготовлены путем таблетирования соединения в свободнотекучей форме, такой как, например, порошки или гранулы, смешанные, если это необходимо, со связующим агентом, смазывающим агентом, инертным разбавителем и/или с одним (или несколькими) поверхностно-активным(и) веществом(ами)/диспергирующим(и) агентом(ами) в подходящем устройстве. Сформованные таблетки могут быть изготовлены путем формования соединения, полученного в форме порошка и пропитанного инертным жидким разбавителем, в подходящем устройстве. Фармацевтические композиции, подходящие для перорального (подъязычного) введения, включают таблетки для сосания, которые содержат соединения формулы (I) вместе с корригентом, обычно с сахарозой и аравийской камедью или трагакантом, и пастилки, которые содержат данное соединение в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь. Подходящие фармацевтические композиции для парентерального введения включают, предпочтительно, стерильные водные препараты соединения формулы (I), которые являются, предпочтительно,изотоничными с кровью реципиента. Эти препараты предпочтительно вводят внутривенно, хотя они могут быть также введены путем подкожной, внутримышечной или чрескожной инъекции. Эти препараты могут быть предпочтительно приготовлены путем смешивания данного соединения с водой с получени- 11007253 ем стерильного и изотоничного с кровью раствора. Композиции для инъекций настоящего изобретения обычно содержат от 0,1 до 5 мас.% активного соединения. Подходящие фармацевтические композиции для ректального введения предпочтительно получают в форме суппозиториев с разовой дозой. Они могут быть получены путем смешивания соединения формулы (I) с одним или несколькими подходящими твердыми носителями, такими как, например, масло какао, и последующего формования полученной смеси. Подходящие фармацевтические композиции для местного нанесения на кожу предпочтительно получают в форме мази, крема, лосьона, пасты, спрея, аэрозоля или масла. Носителями, которые могут быть использованы, являются вазелин, ланолин, полиэтиленгликоли, спирты и комбинации двух или нескольких из этих веществ. Активный ингредиент обычно присутствует в концентрации от 0,1 до 15% по массе композиции, например от 0,5 до 2%. Композиции могут быть также введены чреcкожно. Подходящие фармацевтические композиции для чреcкожного введения могут быть получены в форме одноразовых пластырей, которые являются подходящими для длительного тесного контакта с эпидермисом пациента. Такие пластыри обычно содержат активный ингредиент, необязательно, в буферном водном растворе, растворенный и/или диспергированный в адгезиве или диспергированный в полимере. Подходящая концентрация активного ингредиента составляет примерно от 1 до 35%, предпочтительно примерно от 3 до 15%. Если возможно, то высвобождение активного ингредиента может быть реализовано, как описано, например, в PharmaceuticalResearch, 2(6):318(1986), путем электронного транспорта или ионофореза. Нижеследующие примеры получения приводятся лишь для иллюстрации настоящего изобретения и не ограничивают его объема. Пример А. Мягкие желатиновые капсулы, содержащие 100 мг активного ингредиента на капсулу. На капсулу Активный ингредиент 100 мг Смесь триглицеридов, фракционированная из жира кокосового ореха 400 мг Содержимое капсулы 500 мг Пример В. Эмульсия, содержащая 60 мг активного ингредиента на 5 мл. Активный ингредиент Нейтральное масло Натрийсодержащая карбоксиметилцеллюлоза Полиоксиэтиленстеарат Глицерин, чистый Корригент Вода (деионизованная или дистиллированная) На 100 мл эмульсии 1,2 г Сколько потребуется 0,6 г Сколько потребуется 0,2-2,0 г Сколько потребуется до 100 мл Пример С. Ректальная фармацевтическая форма, содержащая 40 мг активного ингредиента на суппозиторий. На суппозиторий Активный ингредиент 40 мг Основа для суппозитория до 2 г Пример D. Таблетки, содержащие 40 мг активного ингредиента на таблетку. На таблетку Лактоза 600 мг Кукурузный крахмал 300 мг Растворимый крахмал 20 мг Стеарат магния 40 мг 1000 мг Пример Е. Таблетки с покрытием, содержащие 50 мг активного ингредиента на таблетку с покрытием. На таблетку с покрытием Активный ингредиент 50 мг Кукурузный крахмал 100 мг Лактоза 60 мг Вторичный фосфат кальция 30 мг Растворимый крахмал 5 мг Стеарат магния 10 мг Коллоидальная двуокись кремния 5 мг 260 мг- 12007253 Пример F. Нижеследующие формы являются подходящими для получения состава твердых желатиновых капсул: а) Активный ингредиент 100 мг Кукурузный крахмал 300 мг 400 мгb) Активный ингредиент Лактоза Кукурузный крахмал Пример G. Капли могут быть получены в соответствии с нижеследующей формулой (100 мг активного ингредиента в 1 мл=20 капель): Активный ингредиент 10 г Метилбензоат 0,07 г Этилбензоат 0,03 г 96% чистый этанол 5 мл Деминерализованная вода до 100 мл Соединения настоящего изобретения могут быть получены известными методами или в соответствии с последовательностью реакций, описанных в ЕР-А-0912520. После синтеза соединения настоящего изобретения обычно очищают с помощью жидкостной хроматографии среднего давления (ЖХСД), с использованием хроматотрона, с помощью тонкослойной хроматографии с радиальным ускорением, флеш-хроматографии или колоночной хроматографии на силикагеле или на флоризиловой матрице, с последующей кристаллизацией. Для соединений формулы I,где К представляет N, Q представляет О, а Т представляет R3 О-СН 2, типичными системами растворителей являются хлороформ:метанол, этилацетат:гексан и метиленхлорид:метанол. Элюаты могут быть кристаллизованы из метанола, этанола, этилацетата, гексана или хлороформа и т.п. Для соединений формулы I, где К представляет N, Q представляет О, а Т представляет R1R2N-C=O,типичными системами растворителей являются хлороформ:метанол. Например, элюаты могут быть кристаллизованы из 50-100% этанола (водного). Для соединений формулы I, где Q представляет СН 2, К представляет N, а Т представляет R1R2NC=O, типичными системами растворителей являются метиленхлорид:метанол. Например, элюаты могут быть кристаллизованы из метанола, этанола или гексана. Соединения, требующие нейтрализации, могут быть нейтрализованы слабым основанием, таким как бикарбонат натрия, с последующей промывкой метиленхлоридом и солевым раствором. Иногда, перед конечной кристаллизацией, продукты, которые были очищены в виде масел, растирают с гексаном/этанолом. Способ настоящего изобретения подробно проиллюстрирован и описан в нижеследующих примерах. Пример 1. Получение 5'-N-этил-2',3'-изопропилиден-N6-хлораденозин-5'-уронамидa. Стадия 1. N6-Xлop-2',3'-изопропилиденаденозин. Рибозид 6-хлорпурина (31,5 г), триэтилортоформиат (73 мл) и TsOH (19,8 г) перемешивали в 600 мл ацетона в течение 2 ч при комнатной температуре. Реакционную смесь концентрировали в вакууме, объединяли с этилацетатом и промывали насыщенным раствором NаНСО 3 и солевым раствором, а затем сушили (Na2SO4) и концентрировали с получением N6-xлop-2',3'-изопропилиденаденозина в виде белого твердого вещества. Стадия 2. N6-Xлop-2',3'-изопропилиденаденозин-5'-карбоновая кислота.N6-xлop-2',3'-изопропилиденаденозин (4,5 г, 13,8 ммоль) и 4-гидрокси-2,2,6,6-тетраметилпиперидинилоксибензоат (4-гидрокси-ТЕМРО-бензоат) (0,0381 г, 0,14 ммоль) объединяли в ацетонитриле, к реакционной смеси добавляли 5% NаНСО 3 (87%) и порциями, при 0-5 С, добавляли гидрат бромита натрия(10,41 г, 55,1 ммоль). Затем реакционную смесь нагревали до комнатной температуры и раствор интенсивно перемешивали примерно в течение 3 ч. После этого добавляли 10% раствор винной кислоты и водный слой отделяли и экстрагировали этилацетатом (3 х). Объединенные органические слои промывали 5% раствором бикарбоната натрия (3 х). Основные слои объединяли и снова подкисляли концентрированной соляной кислотой до рН 3. Водные слои экстрагировали этилацетатом (3 х). Затем объединенные органические слои промывали солевым раствором и сушили над сульфатом магния. Фильтрат концентрировали с получением аморфного белого твердого вещества, которое упаривали с 3 порциями толуола и сушили в вакууме с получением N6-xлop-2',3'-изопропилиденаденозин-5'-карбоновой кислоты. Стадия 3. 5'-N-Этил-2',3'-изопропилиден-N6-хлораденозин-5'-уронамид.N6-Xлop-2',3'-изопропилиденаденозин-5'-карбоновую кислоту (4,4 г, 12,9 ммоль), триэтиламин (1,64 мл,1,17 ммоль), изопропинилхлорформиат (1,28 мл, 11,7 ммоль) и метиленхлорид (50 мл) объединяли в ат- 13007253 мосфере аргона при -10 С и перемешивали примерно в течение 2 мин. К реакционной смеси добавляли этиламин (0,77 мл, 11,7 ммоль) и перемешивали еще в течение 1 мин. Реакционную смесь распределяли между метиленхлоридом и насыщенным бикарбонатом натрия. Водные слои промывали метиленхлоридом (3 х). Объединенные органические слои промывали раствором соли и сушили над сульфатом натрия,фильтровали, выпаривали в вакууме и остаток очищали флеш-хроматографией на силикагеле, элюируя 3% МеОН/СНСl3 с получением 5'-N-этил-2',3'-изопропилиден-N6-хлораденозин-5'-уронамида, 1H-ЯМР 15,5 г (54,6 ммоль) N-BOC-5,6-диметилендиокси-2-азабицикло[2,2,1]гептан-3-она (i) (полученного,как описано ниже в стадии (6) примера 3) растворяли в 16 мл изопропиламина и смесь перемешивали при комнатной температуре в течение примерно 2 ч. Смесь выпаривали в вакууме и остаток подвергали азеотропной перегонке с хлороформом с получением белого твердого вещества. Это твердое вещество растворяли в 250 мл этилацетата, раствор охлаждали до 0 С, а затем через этот раствор барботировали газообразный хлористый водород, при охлаждении в течение примерно 15 мин. После этого раствор перемешивали при комнатной температуре в течение примерно 4 ч. Раствор выпаривали в вакууме и подвергали азеотропной перегонке с метанолом, а затем с хлороформом, в результате чего получали аминовый продукт в виде гидрохлоридной соли. Гидрохлоридную соль распределяли между хлороформом и раствором бикарбоната натрия, после чего органический слой промывали солевым раствором, сушили,фильтровали и добавляли 1 эквивалент бензойной кислоты. Растворитель удаляли в вакууме и остаток растирали с эфиром, в результате чего получали требуемый амин (ii), указанный выше в виде бензоатной соли, т.пл. 183-184 С. Стадия (2). Получение. 54 ммоль продукта (ii), полученного в вышеописанной стадии (1) примера 2, растворяли в 110 мл нбутанола и добавляли 9,7 г 5-амино-4,6-дихлорпиримидина, а затем 23 мл триэтиламина, и смесь кипятили с обратным холодильником в течение примерно 18 ч. Смесь охлаждали и разбавляли хлороформом и насыщенным раствором хлорида аммония. Водный слой 3 раза экстрагировали хлороформом, а затем 2 раза экстрагировали смесью 10% изопропилового спирта/хлороформа. Органический слой объединяли,сушили над сульфатом натрия, фильтровали и концентрировали с получением масла (iii), которое использовали в следующей стадии без дополнительной обработки. Стадия (3). Получение.- 14007253 Продукт (iii), полученный в вышеописанной стадии (2) примера 2, растворяли в 150 мл н-бутилацетата и добавляли 11,2 г ацетата формамидина. Смесь кипятили с обратным холодильником в атмосфере аргона в течение примерно 9 ч, при этом через 2, 4 и 6 ч добавляли три порции (по 5,56 г) ацетата формамидина. Смесь охлаждали, разбавляли этилацетатом, промывали солевым раствором, водой и снова солевым раствором, а затем сушили над сульфатом натрия, фильтровали и концентрировали в вакууме и остаток очищали флеш-хроматографией, элюируя 40-80% этилацетатом в гексане с получением требуемого хлорпуринового продукта (iv), указанного выше. Стадия (4). Получение.(1,57 ммоль) триэтиламина и 270 мг (1,16 ммоль) 2-[(3S)-3-аминопирролидин-1-ил]-4-трифторметилпиридина (полученного, как описано ниже в стадиях 1-5 примера 3) растворяли вместе в 3 мл этанола и раствор кипятили с обратным холодильником в атмосфере аргона в течение примерно 20 ч. Смесь упаривали в вакууме и остаток распределяли между хлороформом и насыщенным раствором бикарбоната натрия. Водный слой экстрагировали 4 порциями хлороформа и объединенные органические слои сушили над сульфатом натрия, фильтровали и упаривали в вакууме. Остаток очищали флеш-хроматографией,образец помещали в смесь метиленхлорида/этилацетата (1:1) и элюировали 0-3% метанолом в этилацетате, в результате чего получали указанный выше продукт (v). Стадия (5). Продукт, полученный в вышеописанной стадии (4) примера 2, растворяли в 2 мл смеси метанол/тетрагидрофуран (1:1) и добавляли 3,3 мл 1,5 н водной соляной кислоты, а затем раствор перемешивали при комнатной температуре в течение примерно 20 ч. Смесь упаривали в вакууме. Полученный остаток растворяли в 10 мл 15% изопропилового спирта/хлороформа, 1 мл 1 н раствора гидроксида натрия и 9 мл насыщенного раствора бикарбоната натрия. Слои разделяли и водный слой экстрагировали 4 х 5 млпорциями 15% изопропилового спирта/хлороформа. Объединенный органический слой сушили над сульфатом натрия, фильтровали и выпаривали в вакууме с получением изопропиламида (1S,2R,3S,4R)2,3-дигидрокси-4-[6-[1-(4-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентанкарбоновой кислоты, т.пл. 227-228 С. Пример 3. Получение (1R,2S,3R,5R)-5-метоксиметил-3-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диолa. Стадия (1). 20 г (232 ммоль) (3S)-(-)-3-аминопирролидина и 26 мл (255 ммоль, 1,1 экв.) бензальдегида объединяли в 250 мл толуола и кипятили с обратным холодильником, удаляя воду с помощью ловушки ДинаСтарка в течение примерно 4,5 ч. Смесь охлаждали до 0 С и добавляли 55,7 г (255,2 ммоль, 1,1 экв.) дитрет-бутилдикарбоната, а затем перемешивали при комнатной температуре. Смесь концентрировали в вакууме, перемешивали с раствором KHSO4 и 3 раза экстрагировали эфиром. Водный слой подщелачивали и экстрагировали СН 2 Сl2. Органический слой промывали насыщенным солевым раствором, сушили над МgSO4, фильтровали и выпаривали в вакууме с получением N1-BOC-(3S)-(-)-3-аминопирролидина. Стадия (2). 34,25 г (183,0 ммоль) продукта, полученного в вышеописанной стадии (1) примера 3, растворяли в 200 мл CH2Cl2 и добавляли 25 мл (183,9 ммоль, 1 экв.) триэтиламина. Затем, в атмосфере азота, по каплям добавляли 34,7 мл (367,8 ммоль, 2 экв.) уксусного ангидрида, смесь перемешивали при комнатной температуре и распределяли между раствором NaHCO3/CH2Cl2. Органический слой промывали солевым раствором, сушили над MgSO4, фильтровали, упаривали в вакууме и продукт очищали флеш-хроматографией, элюируя 2-8% метанолом в метилене, в результате чего получали N1-BOC-(3S)-(-)-3-аминопирролидина. Стадия (3). 39,2 г (171,7 ммоль) продукта, полученного в вышеописанной стадии (2) примера 3, растворяли в 400 мл CH2Cl2 и по каплям добавляли 26,46 мл (343,4 ммоль, 2 экв.) трифторуксусной кислоты (далее обозначаемой TFA) при 0 С в атмосфере азота. Смесь кипятили с обратным холодильником, добавляя- 15007253 еще 26 мл, а затем еще 10 мл TFA, после чего снова кипятили с обратным холодильником в течение 3 ч и выпаривали в условиях высокого вакуума для удаления TFA. Остаток перемешивали с основной смолойaмберлит IRA-400 (называемой далее "основной смолой"), фильтровали, фильтрат растворяли в метаноле, а затем медленно фильтровали через основную смолу и фильтрат упаривали с получением (3S)-(-)-3 ацетиламинопирролидина. Стадия (4). 4 г (31,2 ммоль) продукта, полученного в вышеописанной стадии (3) примера 3, и 5,19 (40,6 ммоль) 2-хлор-5-трифторметилпиридина объединяли в 50 мл этанола и добавляли 13 мл (93,6 ммоль, 3 экв.) триэтиламина. Смесь кипятили с обратным холодильником в течение примерно 18 ч, концентрировали в вакууме и остаток распределяли между метиленхлоридом и раствором бикарбоната натрия. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали, выпаривали в вакууме и остаток очищали флеш-хроматографией, элюируя 2-5% метанолом в метиленхлориде, в результате чего получали 2-[(3S)-3-ацетиламинопирролидин-1-ил]-5-трифторметилпиридин в виде твердого вещества. Стадия (5). 7,52 г (27,5 ммоль) продукта, полученного в вышеописанной стадии (4) примера 3, объединяли с 75 мл 6 н водной соляной кислоты и смесь кипятили с обратным холодильником в течение примерно 18 ч. Смесь охлаждали до комнатной температуры, нейтрализовали твердым бикарбонатом натрия и распределяли между разбавленным раствором гидроксида натрия и метиленхлоридом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и выпаривали в вакууме с получением 2-[(3S)-3-аминопирролидин-1-ил]-5-трифторметилпиридина. Стадия (6). 22,5 г (0,123 моль) (-)-5,6-диметилендиокси-2-азабицикло[2,2,1]гептан-3-она (vi), 1,5 г 4-диметиламинопиридина (называемого далее "DMAP"), 12,4 г триэтиламина и 37,5 г ди-трет-бутилдикарбоната объединяли в метиленхлориде и перемешивали при комнатной температуре в течение примерно 18 ч. Смесь промывали 1 н соляной кислотой, 5% раствором бикарбоната натрия и солевым раствором, а затем сушили над сульфатом натрия, фильтровали, концентрировали в вакууме и остаток перекристаллизовывали из изопропилового спирта, в результате чего получали N-BOC-5,6-диметилендиокси-2-азабицикло 35,6 г (0,125 моль) продукта (i), полученного в вышеописанной стадии (6) примера 3, объединяли с 400 мл метанола. Затем, при быстром перемешивании и охлаждении в потоке аргона, в течение примерно 2 ч добавляли борогидрид натрия тремя равными порциями (всего 23,8 г, 0,63 моль). Смесь концентрировали в вакууме и распределяли между 200 мл воды и 300 мл этилацетата. Водный слой еще 2 раза экстрагировали этилацетатом и объединенный органический раствор промывали водой и солевым раствором, после чего сушили над сульфатом натрия, фильтровали, концентрировали в вакууме и получали NВОС-1-амино-2,3-диметилендиокси-4-гидроксиметилциклопентан (vii). Стадия (8).- 16007253 50 г продукта (vii), полученного в вышеописанной стадии (7) примера 3, помещали в 150 мл бензола. Затем добавляли 8,8 мл метилиодида и 33 г оксида серебра и смесь кипятили с обратным холодильником в течение примерно 18 ч. Затем в течение примерно 6 ч, порциями добавляли еще 25 г оксида серебра и еще 50 мл метилиодида и смесь кипятили с обратным холодильником в течение примерно 18 ч. Смесь фильтровали через целит и осадок на фильтре промывали этилацетатом. Объединенный фильтрат концентрировали в вакууме и остаток кристаллизовали из гексана с получением требуемого метоксиметилового соединения (viii), указанного выше. Стадия (9). В атмосфере аргона 31,6 г продукта (viii), полученного в вышеописанной стадии (8) примера 3, растворяли в 250 мл теплого безводного этилацетата. Раствор охлаждали в ледяной бане и через раствор примерно в течение 6 мин барботировали газообразный хлористый водород. Смесь оставляли для нагревания до комнатной температуры и перемешивали в течение примерно 3 ч, а затем концентрировали в вакууме с получением требуемого гидрохлорида амина (ix), указанного выше. Стадия (10). 24,2 г продукта (ix), полученного в вышеописанной стадии (9) примера 3, и 42,8 г бикарбоната натрия объединяли в 100 мл н-бутанола в атмосфере аргона и добавляли 20,1 г 5-амино-4,6-дихлорпиримидина. Смесь кипятили с обратным холодильником в течение примерно 20 ч, а затем концентрировали в вакууме. Остаток распределяли между этилацетатом и водой и этилацетатный слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток в 30% этилацетате в гексане пропускали через большую промывочную флеш-хроматографическую колонку и колонку промывали смесью 50% этилацетат/гексан, после чего объединенные фильтраты концентрировали в вакууме с получением требуемого пиримидиниламиноциклопентанового продукта (xi), описанного выше. Стадия (11). 26,7 г продукта (xi), полученного в вышеописанной стадии (10) примера 3, объединяли с 125 мл нбутилацетата в атмосфере аргона. Затем добавляли 33,5 г ацетата формамидина и смесь кипятили с обратным холодильником в течение примерно 3 ч до тех пор, пока тонкослойная хроматография не указывала на завершение реакции. После этого смесь охлаждали, распределяли между этилацетатом и солевым раствором и этилацетатный слой сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали флеш-хроматографией, элюируя 30-50% этилацетатом в гексане с получением хлорпуринового продукта (xii), указанного выше.(27,4 ммоль) 2-[(3S)-3-аминопирролидин-1-ил]-5-трифторметилпиридина объединяли в 20 мл этанола и добавляли 6,33 мл триэтиламина. Смесь нагревали в герметично закрытом сосуде при 105 С в течение примерно 4 ч. Смесь охлаждали, упаривали в вакууме и распределяли между метиленхлоридом и раствором бикарбоната натрия. Органический слой сушили над сульфатом магния, фильтровали, концентрировали в вакууме и остаток очищали флеш-хроматографией, элюируя 4% метанолом в метиленхлориде, в результате чего получали указанный продукт (xiii). Стадия (13). 10,81 г (20,3 ммоль) продукта (xiii), полученного в вышеописанной стадии (12) примера 3, объединяли с 90 мл трифторацетата и 10 мл воды и смесь перемешивали при комнатной температуре в течение примерно 30 мин. TFA выпаривали в высоком вакууме и остаток распределяли между метиленхлоридом и раствором бикарбоната натрия. Метиленхлоридный раствор промывали раствором бикарбоната натрия и солевым раствором, а затем добавляли изопропиловый спирт, раствор сушили над сульфатом магния,фильтровали, концентрировали в вакууме и остаток подвергали флеш-хроматографии, элюируя 5-10% метанолом в метиленхлориде. Соответствующие фракции собирали, концентрировали и остаток кристаллизовали из ацетонитрила с получением (1R,2S,3R,5R)-5-метоксиметил-3-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]циклопентан-1,2-диола, т.пл. 166-168 С. Пример 4. Получение (2R,3R,43,5R)-5-гидроксиметил-2-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(R)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диола. 267 мг 2-[(3R)-3-аминопирролидин-1-ил]-5-трифторметилпиридина, 331 мг 6-хлорпуринрибозида,233 мг триэтиламина и 0,5 мл этанола объединяли и нагревали в герметично закрытом сосуде при 100 С в течение примерно 5 ч. Смесь охлаждали и распределяли между метиленхлоридом (с добавлением некоторого количества изопропилового спирта) и бикарбонатом натрия. Органический слой промывали раствором соли, сушили над сульфатом магния, упаривали и остаток очищали флеш-хроматографией, элюируя 5% метанолом в метиленхлориде, в результате чего получали (2R,3R,4S,5R)-5-гидроксиметил-2-[6[1-(5-трифторметилпиридин-2-ил)пирролидин-3(R)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол, т.пл. 166-170 С. Пример 5. Получение (1R,2S,3R,5R)-3-[6-[1-(4-трифторметилфенил)пирролидин-3(S)-иламино]пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диола. Стадия (1). 1,00 г (11,6 ммоль) 3(S)-(-)-3-аминопирролидина, 1,35 мл (9,66 ммоль) 4-бромбензолтрифторида,2,69 г (29 ммоль) трет-бутоксида натрия и 1,01 г (1,16 ммоль) PdCl2(Р[о-толил]3)2 (полученного, как описано в патенте США 4196135) объединяли в 30 мл толуола и смесь нагревали в герметично закрытом сосуде при 100 С в течение примерно 40 ч. Смесь охлаждали, фильтровали, выпаривали в вакууме и остаток очищали флеш-хроматографией, элюируя смесью метиленхлорид/этанол, 10:1-7:1, в результате чего получали 1-(4-трифторметил)фенил-3(S)-пирролидин-3-иламин. Стадия (2). Раствор 24,7 мл (0,61 моль) метанола и 50 мл этилацетата охлаждали до 0 С в атмосфере аргона. Затем порциями добавляли 43,4 мл (0,61 ммоль) ацетилхлорида и раствор оставляли для доведения до комнатной температуры в течение примерно 45 мин. Это раствор снова охлаждали на льду и в течение примерно 45 мин добавляли раствор 50,0 г N-ВОС-1-амино-2,3-диметилендиокси-4-гидроксиметилцикло- 18007253 пентана (vii) в 100 мл этилацетата. Раствор оставляли для доведения до комнатной температуры, а затем выпаривали в вакууме с получением требуемого гидрохлорида амина (xiv), указанного выше. Стадия (3). Получение. 38,9 г продукта (xiv), полученного в вышеописанной стадии (2) примера 5, и 73 мг бикарбоната натрия объединяли в 150 мл н-бутанола в атмосфере аргона и смесь перемешивали при комнатной температуре в течение примерно 30 мин. Затем добавляли 34,2 г 5-амино-4,6-дихлорпиримидина и смесь перемешивали при кипячении с обратным холодильником в течение примерно 19 ч. Смесь концентрировали в вакууме и остаток растворяли в этилацетате и воде. Водный слой экстрагировали этилацетатом и объединенные органические экстракты промывали раствором соли, фильтровали и концентрировали в вакууме. Остаток очищали флеш-хроматографией, элюируя градиентом 30-100% этилацетата в гексане, в результате чего получали требуемый замещенный хлорпиримидин (xv), указанный выше. Стадия (4). Получение. 37,9 г продукта (xv), полученного в вышеописанной стадии (3) примера 5, и 25,1 г ацетата формамидина объединяли в 250 мл н-бутилацетата и смесь кипятили с обратным холодильником в атмосфере аргона в течение примерно 2 ч, добавляя примерно через 1 ч 12,5 г, а через 1,5 ч еще 10 г ацетата формамидина. Смесь охлаждали и распределяли между этилацетатом и солевым раствором, солевой раствор экстрагировали тремя порциями этилацетата и объединенные органические слои сушили над сульфатом магния, фильтровали и выпаривали в вакууме. Остаток очищали путем кристаллизации из смеси этилацетат/гексан с получением указанного выше хлорпурина (xvi). Для повышения выхода остаток, полученный после концентрирования маточного раствора, может быть очищен флеш-хроматографией при элюировании 80-100% этилацетата в гексане. Стадия (5). Получение.(1,04 ммоль) 1-(4-трифторметил)фенил-(3S)-пирролидин-3-иламина, полученного в вышеописанной стадии (1), и 0,582 г (6,93 ммоль) бикарбоната натрия объединяли в 20 мл этанола и кипятили с обратным холодильником в течение примерно 60 ч. Смесь фильтровали, концентрировали в вакууме и остаток очищали флеш-хроматографией, элюируя градиентом метиленхлорида/этанола, 30:110:1, в результате чего получали указанный выше пирролидиниламин (xvii). Стадия (6). 0,234 г продукта, полученного в вышеописанной стадии (5) примера 5, растворяли в 10 мл трифторуксусной кислоты и раствор перемешивали при комнатной температуре в течение ночи. Раствор выпари- 19007253 вали в вакууме и остаток очищали флеш-хроматографией, элюируя смесью метиленхлорид/этилацетат 7,1 г (24,5 ммоль) -трет-бутилового эфира N-тpeт-BOC-L-аспарагиновой кислоты растворяли в 120 мл тетрагидрофурана. Раствор охлаждали до 0 С и добавляли 2,73 г (27 ммоль) триэтиламина, а затем 2,66 г(24,5 ммоль) этилхлорформиата. Раствор перемешивали в течение примерно 30 мин и добавляли водный раствор 3,71 г (98,2 ммоль) борогидрида натрия. Смесь перемешивали при комнатной температуре в течение примерно 17 ч, концентрировали в вакууме и остаток разбавляли этилацетатом, а затем органический слой промывали 1 н соляной кислотой, 10% карбонатом натрия и солевым раствором, после чего сушили сульфатом магния, фильтровали, концентрировали в вакууме и остаток очищали флеш-хроматографией, элюируя 30-50% этилацетатом в гексане, в результате чего получали 3(S)-трет-бутил-3-ВОСамино-4-гидрокси-н-бутаноат (xix). Стадия (2). Получение. Раствор 0,73 г диметилсульфоксида в 9 мл метиленхлорида охлаждали до -70 С и по каплям добавляли 31 мл 2 М раствор оксалилхлорида в метиленхлориде. Раствор перемешивали в течение примерно 15 мин и добавляли раствор 0,85 г 3(S)-трет-бутил-3-ВОС-амино-4-гидрокси-н-бутаноата (xix) в 5 мл метиленхлорида. После перемешивания в течение примерно 45 мин добавляли 1,88 г триэтиламина. Раствор нагревали до комнатной температуры, перемешивали в течение примерно 30 мин, а затем разбавляли этилацетатом. Полученный раствор промывали 1 н соляной кислотой, 10% карбонатом натрия и раствором соли, а затем сушили над сульфатом магния, фильтровали, концентрировали в вакууме и получали 3(S)-трет-бутил-3-ВОС-амино-4-оксо-н-бутаноат (хх). Стадия (3). Продукт (хх), полученный в вышеописанной стадии (2) примера 6, растворяли в 9 мл метанола и добавляли 1,34 г гидрохлорида бензиламина, затем 0,94 г триэтиламина, а затем 200 мг молекулярного сита 3 . Раствор перемешивали в течение примерно 45 мин и добавляли раствор 0,23 г хлорида цинка и 0,22 г цианоборогидрида натрия в 5 мл метанола. Раствор перемешивали в течение примерно 4 ч, добав- 20007253 ляли 2 мл 1 н гидроксида натрия, а затем 10 мл воды, и смесь концентрировали примерно до половины объема, после чего экстрагировали этилацетатом. Этилацетатный раствор промывали 10% раствором карбоната натрия и солевым раствором, затем сушили над сульфатом магния, фильтровали, концентрировали в вакууме и остаток очищали флеш-хроматографией, элюируя 30-40% этилацетатом в гексане, в результате чего получали описанный выше бензиламин (xxi). Стадия (4). 0,90 г продукта, полученного в вышеописанной стадии (3) примера 6, растворяли в 12 мл смеси толуол/уксусная кислота (10:1) и раствор кипятили с обратным холодильником в течение примерно 1,5 ч. Смесь концентрировали в вакууме и остаток очищали флеш-хроматографией, элюируя 25-35% этилацетатом в метиленхлориде, в результате чего получали 1-бензил-4(S)-ВОС-амино-2-пирролидинон. Стадия (5). 0,64 г продукта, полученного в вышеописанной стадии (4) примера 6, растворяли в 20 мл этилацетата и раствор охлаждали до 0 С. Через этот раствор примерно в течение 5 мин барботировали газообразный хлористый водород и смесь перемешивали при комнатной температуре в течение примерно 18 ч. К смеси добавляли эфир и твердое вещество собирали фильтрацией с получением гидрохлорида 1-бензил-4(S)-амино-2-пирролидинона. Стадия (6). 0,33 г защищенного хлорпурина, полученного в вышеописанной стадии (4) примера 5, 0,26 г гидрохлорида 1-бензил-4(S)-амино-2-пирролидинона и 0,29 г триэтиламина объединяли в 10 мл этанола и смесь кипятили с обратным холодильником в течение примерно 50 ч. Смесь концентрировали в вакууме и остаток растворяли в 20 мл 1 н соляной кислоты и перемешивали при комнатной температуре в течение примерно 1 ч. Смесь концентрировали в вакууме и остаток очищали с помощью препаративной ВЭЖХ,элюируя градиентом 10% ацетонитрила 60% ацетонитрила в воде, содержащей 0,1% трифторуксусную кислоту. Соответствующие фракции объединяли, концентрировали и остаток растворяли в 20 мл 1 н соляной кислоты, после чего растворитель выпаривали в вакууме и эту процедуру повторяли еще 2 раза. Полученный остаток растворяли в метаноле, растворитель выпаривали в вакууме и остаток растирали в эфире, в результате чего получали 4(S)-1-бензил-4-[9-1R,2S,3R,5R)-1,2-дигидрокси-5-гидроксиметилциклопент-3-ил)-9 Н-пурин-6-иламино]пирролидин-2-он в виде тригидрата гидрохлорида, т.пл. 100 С (разл.). Пример 7. Получение (1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(4-нитрофенил)пирролидин-3-иламино]пурин-9-ил]циклопентан-1,2-диолa. Стадия (1). 4-Нитрофенол (1,0 г, 7,19 ммоль) и триэтиламин (3 мл, 21,6 ммоль) растворяли вместе в безводном метиленхлориде (10 мл) и раствор охлаждали до -15 С. Затем добавляли ангидрид трифторметансульфоновой кислоты (1,81 мл, 10,8 ммоль) и смесь перемешивали при -15 С в течение примерно 30 мин. Смесь разбавляли метиленхлоридом, промывали раствором бикарбоната натрия и солевым раствором и органический слой сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали флеш-хроматографией, элюируя метиленхлоридом, и получали 4-нитрофенилтрифторметансульфонат в виде светло-желтого твердого вещества. Стадия (2). 3(S)-Aмино-1-бензилпирролидин (3,0 г, 17,0 ммоль) и триэтиламин (2,50 мл, 17,9 ммоль) растворяли вместе в безводном метаноле (17 мл), в атмосфере азота, и по каплям добавляли этилтрифторацетат(2,53 мл, 21,3 ммоль). Раствор перемешивали в течение примерно 18 ч, выпаривали в вакууме и остаток растворяли в метиленхлориде. Раствор промывали раствором бикарбоната натрия и солевым раствором,а затем сушили над сульфатом магния, фильтровали, концентрировали в вакууме и получали 1-бензил 3(S)-трифторацетиламинопирролидин. Стадия (3). В атмосфере азота 1-бензил-3(S)-трифторацетиламинопирролидин (4,59 г, 16,7 ммоль) растворяли в безводном метаноле (50 мл) и добавляли ди-трет-бутилдикарбонат (3,68 г, 16,7 ммоль) и 10% палладий на угле (0,90 г). Затем смесь перемешивали в потоке водорода при атмосферном давлении в течение примерно 5 ч. Смесь фильтровали через целит, промывали метанолом и фильтрат упаривали в вакууме. Остаток очищали флеш-хроматографией, элюируя 5% метанолом в метиленхлориде, и получали 1-ВОС 3(S)-трифторацетиламинопирролидин. Стадия (4). 1-ВОС-3(S)-Трифторацетиламинопирролидин (4 г) растворяли в метиленхлориде (130 мл) и добавляли трифторуксусную кислоту (19 мл). Раствор перемешивали при комнатной температуре в течение примерно 1 ч, а затем концентрировали в вакууме. Остаток распределяли между метиленхлоридом и насыщенным раствором бикарбоната натрия. Слои разделяли и водный слой экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом магния, фильтровали, упаривали в вакууме и получали 3(S)-трифторацетиламинопирролидин. Стадия (5). 4-Нитрофенилтрифторметансульфонат (0,423 г, 1,56 ммоль) и триэтиламин (0,217 мл, 1,56 ммоль) растворяли вместе в безводном ацетонитриле (15 мл), добавляли 3(S)-трифторацетиламинопирролидин(0,852 г, 4,68 ммоль) и смесь кипятили с обратным холодильником в течение примерно 18 ч. Смесь охлаждали, концентрировали в вакууме и остаток очищали флеш-хроматографией, элюируя градиентом 25%-50% этилацетата в гексане, в результате чего получали 1-(4-нитро)фенил-3(S)-трифторацетиламинопирролидин. Стадия (6). 1-(4-Нитро)фенил-3(S)-трифторацетиламинопирролидин (0,334 г, 1,10 ммоль) объединяли с насыщенным раствором карбоната калия в смеси метанол/вода (2:3) (20 мл) и смесь нагревали при 55 С в течение примерно 2 ч, а затем оставляли при комнатной температуре в течение примерно 18 ч. Смесь концентрировали в вакууме и остаток растворяли в воде (10 мл). Водный слой экстрагировали этилацетатом,а органический слой сушили над сульфатом магния, фильтровали, выпаривали в вакууме и получали 3(S)-амино-1-(4-нитро)фенилпирролидин. Стадия (7). В соответствии, в основном, с процедурами стадий 12 и 13 примера 3 и стадий 5 и 6 примера 5 из 3(S)-амино-1-(4-нитро)фенилпирролидина получали (1R,2S,3R,5R)-5-гидроксиметил-3-[6-[1-(4-нитрофенил)пирролидин-3-иламино]пурин-9-ил]циклопентан-1,2-диол, т.пл. 119-120 С. В соответствии, в основном, с процедурами, описанными выше в pеакционных схемах и примерах,из соответствующих исходных материалов были получены нижеследующие соединения настоящего изобретения. Пример 8. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(5-хлорпиридин-2-ил)пирролидин-3(S)-иламино] пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 154-156 С. Пример 9. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 153-156 С. Пример 10. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(4-трифторметилпиридин-2-ил)пирролидин 3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 187-190 С. Пример 11. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(5-бромпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 153-154 С. Пример 12. (2R,3R,4S,5R)-5-Гидроксиметил-2-(6-(1-(4-нитрофенил)пирролидин-3(S)-иламино)пурин-9-ил)тетрагидрофуран-3,4-диол; т.пл. 230-232 С. Пример 13. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-(5'-трифторметил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридин-3-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 113-116 С. Пример 14. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-(фенилпирролидин-3(S)-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол. Пример 15. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-(1-пиридин-2-илпирролидин-3(S)-иламино)пурин 9-ил]тетрагидрофуран-3,4-диол; т.пл. 193-195 С. Пример 16. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(4-хлорфенил)пирролидин-3(S)-иламино]пурин 9-ил]тетрагидрофуран-3,4-диол; т.пл. 121-124 С. Пример 17. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(5-метилпиридин-2-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 164-166 С. Пример 18. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(5-тиофен-2-илпиридин-2-ил)пирролидин-3(S)иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 190-192 С. Пример 19. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(5-метилмеркаптопиридин-2-ил)пирролидин 3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 231-233 С. Пример 20. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(6-метоксипиримидин-4-ил)пирролидин-3(S)иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 251-253 С. Пример 21. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 154-156 С. Пример 22. (2R,3R,4S,5R)-5-Гидроксиметил-2-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3-иламино] пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 130 С (разлож). Пример 23. (2R,3R,4S,5R)-5-Метоксиметил-2-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)иламино]пурин-9-ил]тетрагидрофуран-3,4-диол; т.пл. 198-200 С. Пример 24. Этиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3-иламино]пурин-9-ил]циклопентанкарбоновой кислоты; т.пл. 135-138 С. Пример 25. (1R,2S,3R,5R)-5-Гидроксиметил-3-[6-[1-(4-нитрофенил)пиперидин-4-иламино]пурин-9 ил]циклопентан-1,2-диол; т.пл. 126-128 С. Пример 26. Дигидрохлорид (1R,2S,3R,5R)-5-гидроксиметил-3-[6-3S)-пирролидин-3-иламино)пурин-9-ил]циклопентан-1,2-диола; т.пл. 160 С (разл). Пример 27. (1R,2S,3R,5R)-5-Гидроксиметил-3-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин 3(R)-иламино]пурин-9-ил]циклопентан-1,2-диол; т.пл. 175-177 С. Пример 28. (1R,2S,3R,5R)-5-Гидроксиметил-3-[6-3R)пирролидин-3-иламино)пурин-9-ил]циклопентан-1,2-диол; т.пл. 166 С (разл.). Пример 29. (1R,2S,3R,5R)-5-Гидроксиметил-3-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин 3(S)-иламино]пурин-9-ил]циклопентан-1,2-диол; т.пл. 110-111 С.- 23007253 Пример 61. 1(S)-Метилпропиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-6-[1-(5-трифторметилпиридин-2 ил)пирролидин-3(S)-иламино]пурин-9-илциклопентанкарбоновой кислоты; т.пл. 215 С (разл.). Пример 62. 1(R)-Метилпропиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-6-[1-(5-трифторметилпиридин 2-ил)пирролидин-3(S)-иламино]пурин-9-илциклопентанкарбоновой кислоты; т.пл. 206-212 С (разл.). Аспекты патофизиологии резистентности к инсулину и диабета типа 2 Резистентность к инсулину, которая определяется как состояние, выражающееся в пониженной чувствительности к нормальным концентрациям инсулина в кровотоке, имеет характерные признаки диабета типа 2 и вызывает патологии в мышцах, жировой ткани и печени. Резистентность к инсулину предшествует началу диабета типа 2, который развивается в случае существования других нарушений на уровне панкреатических бета-клеток. Если периферическая резистентность к инсулину может компенсироваться повышением уровня продуцирования инсулина, то гомеостаз глюкозы является сбалансированным. Даже в отсутствиe диабета типа 2 резистентность к инсулину является основным признаком других патологических состояний человека. Нарушение действия инсулина, ассоциированное с гиперинсулинемией, приводит к различным патологиям, включая увеличение уровней триглицеридов, низкие уровни ЛВП, повышенную секрецию ЛОНП, нарушение свертывания крови, повышенное сосудистое сопротивление, изменения уровней стероидных гормонов, замедление периферического кровообращения и увеличение веса. Таким образом, резистентность к инсулину часто ассоциируется с церебральным ожирением,гипертензией, синдромом поликистоза яичника, дислипидемией и атеросклерозом (JCI 106, 163-164, 2000). Резистентность к инсулину характеризуется: в жировой ткани: увеличением липолиза, которое приводит к повышению уровней свободных жирных кислот, которые, в свою очередь, приводят к снижению утилизации глюкозы в мышцах,к снижению поступления жирных кислот в печень с последующим увеличением уровня продуцирования ЛОНП и к нарушению секреции инсулина из бета-клеток в печень вследствие увеличения уровня глюкозы в печени и секреции ЛОНП, которая приводит к гипергликемии и гипертриглицеридемии, соответственно; в мышце: снижением скорости утилизации глюкозы, которое приводит к гипергликемии. Ингибирование периферического липолиза триглицеридом липазы TGL 749 (агонистом аденозинового рецептора А 1) приводит к снижению уровня свободных жирных кислот в плазме (первичный фармакологический эффект). Пониженная доступность свободных жирных кислот для мышцы приводит к увеличению утилизации глюкозы и снижению уровней продуцирования ЛВОП в печени и параллельно с этим к снижению уровней триглицеридов в плазме (вторичный фармакологический эффект). Измерение антилиполитического действия Антилиполитическое действие соединений общей формулы (I) проиллюстрировано в табл. 1. Таблица 1 Измерения уровня липидов в плазме (свободных жирных кислот, триглицеридов, холестерина) у анестезированных крыс У анестезированных крыс анализировали уровни липидов в плазме. Для этого крыс анестезировали путем внутрибрюшинной инъекции пентобарбитала натрия (60 мг/кг), подвергали трахеотомии и в одну яремную вену каждой крысы вводили канюлю для внутривенного введения (инъекции или вливания ударной дозы вещества). Анестезию поддерживали в течение 7 ч путем подкожного вливания пентобарбитал-натрия (т.е. доводили отдельное животное до глубокого наркоза; примерно 24 мг/кг/ч). Мониторинг температуры тела проводили с помощью ректального термометра и температуру тела поддерживали при 37 С с помощью нагретой хирургической пластины. После хирургической операции, проводимой в течение 2 ч, крыс оставляли для стабилизации их уровней крови, а затем им внутрибрюшинно инъецировали тестируемое соединение. Пробы крови для анализа на глюкозу (10 мкл) брали из кончика хвоста через каждые 15 мин. Для анализа уровней липидов в плазме пробы крови (0,3 мл) брали из яремной вены либо через каждые 10-15 мин в течение 2 ч, либо через каждый час в течение 5 ч после введения соединения. Для определения уровня глюкозы в крови проводили стандартные процедуры с использованием ферментов (Bergmeyer, 1974). Таблица 2 Воздействие соединения примера 3 на уровни свободных жирных кислот в плазме у анестезированных самцов крыс Wistar, которых выдерживали в условиях голодания (исследование на животных: 00-009) Величины представлены как среднееср.кв.ош., n=4 крысы. Измерение чувствительности к инсулину у крыс, не находящихся под глубоким наркозом Крыс, резистентных к инсулину с ожирением, вызванным сахаром, или крыс с сахарным диабетом"тучных" (ZDF) перорально вводили тестируемое соединение 1 раз в день в течение примерно 3 недель. Параметры плазмы получали путем ретроорбитального забора крови во время ингаляционной анестезии в соответствующие дни исследования. По окончании исследования крыс выдерживали в течение ночи в условиях голодания, и этим крысам вводили инъекцию ударной дозы инсулина (3 ед/кг, s.c.), и проводили мониторинг снижения уровня глюкозы в крови в течение 6 ч. В случае повышения чувствительности к инсулину под действием тестируемого соединения снижение уровня глюкозы в крови было гораздо более явно выраженным и продолжительным по сравнению со снижением уровня глюкозы в крови в контрольной группе.- 25007253 Таблица 3 Тест на инсулинорезистентность (3 ед/кг, s.c.) у инсулинорезистентных крыс с сахарным ожирением,вызванным сахаром, после предварительной обработки (п.о.) 1-10 мг/кг соединения примера 3 в течение 3 недель (исследование на животных: 00-027) Величины представлены как среднееср.кв.ош., n=9. Соединения, входящие в объем настоящего изобретения, обнаруживали активность в стандартных анализах на связывание с рецепторами A1/A2, проводимых в целях определения активности агониста аденозинового рецептора у млекопитающих. Примеры процедур испытаний, используемых для определения аффинности связывания рецептора с соединениями настоящего изобретения, описаны ниже. А. Определение in vitro аффинности связывания с аденозиновым рецептором. Аффинность связывания с рецептором A1 определяли с помощью анализа на конкурентное связывание, основанного на вытеснении лигандом метки 3H-СНА (циклогексиладенозина) [Research BiochemicalsInc., Natick, Mass.] из рецептора с использованием мембранного препарата целого головного мозга крысы и проводимого в соответствии с процедурой, описанной R.F. Bruns et al., Mol. Pharmacol., 29:331(1986). Уровень неспецифического связывания оценивали в присутствии 1 мМ теофилина. Аффинность связывания с рецептором А 2 определяли аналогичным способом, основанным на вытеснении лигандом метки 3H-CGS 21680, известного агониста, специфичного к аденозиновому рецептору А 2, из рецептора с использованием мембранного препарата полосатого тела головного мозга крысы. Уровень неспецифического связывания оценивали в присутствии 20 мкМ 2-хлораденозина. Эти анализы проводили в стеклянных тест-пробирках в двух повторениях при 25 С. После добавления мембран эти пробирки интенсивно встряхивали и инкубировали при 25 С в течение 60 мин (анализ на A1) или 90 мин (анализ на А 2) на роторном шейкере. Тест-пробирки интенсивно встряхивали в середине процедуры инкубирования, а затем ближе к концу процедуры. Анализы завершали путем быстрой фильтрации через 2,4 см фильтры GF/B с использованием сборщика клеток (Brandel Cell Harvester). Тест-пробирки 3 раза промывали холодным 50 мМ Трис-НСl (рН 7,7 или 7,4) и фильтрацию завершали через 15 с. Влажные фильтровальные диски помещали в стеклянные сцинтилляционные сосуды, наполненные 10 мл Aquasol II (New England Nuclear). Эти сосуды оставляли на ночь на роторном шейкере для встряхивания и на 2 мин помещали в жидкий сцинтилляционный анализатор для измерения. ВеличиныIC50 для связывания с рецептором, то есть концентрацию, при которой соединение настоящего изобретения вытесняло стандартную радиоактивную метку, получали с использованием компьютерной программы построения кривых по точкам (RS/1, Bolt, BeranekNewman, Boston, MA). Аффинность с связывания с рецептором A1 также определяли с использованием мембранных препаратов жировой ткани в эпидидимисе. Мембранный препарат. Эпидидимальные жировые ткани гомогенизировали в буфере, содержащем 0,25 М сахарозы, 10 мМ триса, 2 мМ EDTA, 0,1 М фенилметилсульфонилфторида и 1 мкг/мл лейпептина (200 мг массы сырой ткани/мл буфера). Этот гомогенат помещали в 50 мл центрифужной пробирки и центрифугировали при 1000 х g (3000 об./мин) в течение 1 мин, после чего промежуточный супернатант удаляли и центрифугировали при 38000 х g в течение 15 мин. Осадки после центрифугирования ресуспендировали в аналитическом буфере (50 мМ триса и 1 мМ EDTA) (300 мг исходной массы ткани/мл аналитического буфере), к суспензии добавляли 2 мкл/мл раствора аденозин-дезаминазы (10 мг/мл) и эту суспензию инкубировали в течение 30 мин при 37 С. Суспензию центрифугировали при 38000 х g в течение 10 мин, осадок 1 раз- 26007253 промывали 20 мл аналитического буфера и ресуспендировали в аналитическом буфере (1,2 г исходной массы сырой ткани/мл буфера). Анализ и подсчет. Пробирки приготавливали следующим образом: пробирки общего связывания (для подсчета общего связывания), 100 мкл мембранной суспензии (полученной как описано выше), 50 мкл раствора 3Hциклогексиладенозина (полученного путем разведения раствора приблизительно 1 мКи/мл со специфической активностью приблизительно 29,9 Ки/ммоль аналитическим буфером до концентрации 100 нМ,называемого далее "раствором СНА"), 350 мкл аналитического буфера; пробирки неспецифического связывания, 100 мкл мембранной суспензии, 50 мкл раствора СНА, 50 мкл 100 мкМ 2-хлораденозина в аналитическом буфере, 300 мкл аналитического буфера; пробирки с образцами, 100 мкл мембранной суспензии, 50 мкл раствора СНА, 50 мкл раствора тестируемого соединения (который может быть получен путем серийного разведения раствора ДМСО в аналитическом буфере), 300 мкл аналитического буфера; пробирки для контроля, 50 мкл раствора СНА и 450 мкл аналитического буфера. Каждую пробирку подвергали интенсивному встряхиванию в течение 10 мин, инкубировали при 23 С в течение 2 ч и фильтровали через фильтр Brandel Filtration Unit с использованием фильтровальной бумаги Whatman GF/B FilterPaper, при этом 2 раза промывали 5 мл 50 мМ триса. Фильтровальные диски помещали в сцинтилляционные 7 мл сосуды, которые затем наполняли приблизительно 5 мл готовой сцинтилляционной смесиY представляет С 1-С 20 алкил с прямой или разветвленной цепью, аралкил, замещенный аралкил,арил, замещенный арил, гетероциклил, замещенный гетероциклил, гетероциклилалкил, замещенный гетероциклилалкил;n и р независимо представляют 0, 1, 2 или 3, при условии, что n+р равен по крайней мере 1; Т представляет алкил, C(O)NR1R2, R3 О-СН 2;R3 представляет водород, С 1-С 20 алкил с прямой или разветвленной цепью; А представляет гидрокси; В представляет гидрокси; либо их фармацевтически приемлемой соли, N-оксида, гидрата или сольвата для изготовления лекарственного средства для лечения синдрома резистентности к инсулину и диабета. 2. Применение соединений по п.1, где K представляет N, Т представляет гидроксиметил, метокси метил, А и В представляют гидрокси, Х представляет, а n+р=3 или 4, или их фармацевтически приемлемой соли, N-оксида, гидрата или сольвата. 3. Применение соединений по п.1 или 2, которые представляют собой(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)пурин-9-ил]-5-метоксиметилциклопентан 1,2-диол,или их фармацевтически приемлемой соли, N-оксида, гидрата или сольвата.
МПК / Метки
МПК: A61P 3/10, A61K 31/52
Метки: диабета, лечения, инсулину, аналоги, аденозина, резистентности, синдрома
Код ссылки
<a href="https://eas.patents.su/30-7253-analogi-adenozina-dlya-lecheniya-sindroma-rezistentnosti-k-insulinu-i-diabeta.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги аденозина для лечения синдрома резистентности к инсулину и диабета</a>
Предыдущий патент: Способ получения имипенема
Следующий патент: Соединения, специфические к аденозиновому а1, а2a и а3 рецептору, и их применение
Случайный патент: Корсет корригирующий для позвоночника












