Способы стерилизации биологических материалов
Формула / Реферат
1. Способ снижения уровня активных биологических примесей или патогенов в ткани, причем указанный способ включает в себя
(i) добавление к указанной ткани по меньшей мере одного стабилизатора, выбранного из группы, состоящей из аскорбиновой кислоты, аскорбата натрия, маннита, трегалозы, диметилсульфоксида (ДМСО), бутилированного гидрокситолуола (BHT), диметилтиомочевины, глутатиона, липоевой кислоты, 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты (Тролокс), мочевой кислоты, альбумина, гистидина, N-ацетилцистеина, триптофана, N-ацетилтриптофана, метионина, цистеина или N-трет-бутил-альфа-фенилнитрона; и
(ii) облучение указанной ткани подходящей дозой гамма-излучения, эффективного для снижения уровня биологически активных примесей или патогенов в указанной ткани.
2. Способ по п.1, где ткань представляет собой твердую ткань.
3. Способ по п.2, где твердая ткань выбрана из группы, состоящей из кости, деминерализованного костного матрикса, костного мозга, связок, бедренной кости, головки бедренной кости или зубов.
4. Способ по п.1, где ткань представляет собой мягкую ткань.
5. Способ по п.4, где мягкая ткань выбрана из группы, состоящей из связок, сухожилий, нервов, кожных трансплантатов, сердечных клапанов, хряща, роговицы, артерий, вен или органов.
6. Способ по п.5, где орган предназначен для трансплантации.
7. Способ по п.6, где орган выбран из группы, состоящей из сердца, легких, печени, почки, кишечника или поджелудочной железы.
8. Способ по п.1, где в процессе облучения указанная ткань содержится при температуре ниже ее точки замерзания.
9. Способ по п.1, где в процессе облучения указанная ткань содержится в инертной атмосфере.
10. Способ по п.9, где в процессе облучения указанная ткань содержится под вакуумом.
11. Ткань, облученная одним из способов по пп.1-10.
12. Способ снижения уровня активных биологических примесей или патогенов в белковом образце, причем указанный способ включает в себя
(i) добавление к указанному белковому образцу по меньшей мере одного стабилизатора, выбранного из группы, состоящей из аскорбиновой кислоты, маннита, трегалозы, диметилсульфоксида (ДМСО), диметилтиомочевины, глутатиона, липоевой кислоты, 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты (Тролокс), мочевой кислоты, альбумина, гистидина, N-ацетилцистеина, триптофана, N-ацетилтриптофана, метионина или N-трет-бутил-альфа-фенилнитрона; и
(ii) облучение указанного белкового образца подходящей дозой гамма-излучения, эффективного для снижения уровня биологически активных примесей или патогенов в указанном белковом образце.
13. Способ по п.12, где в процессе облучения указанный белковый образец содержится при температуре ниже его точки замерзания.
14. Способ по п.12, где в процессе облучения указанный белковый образец содержится в инертной атмосфере.
15. Способ по п.14, где в процессе облучения указанный белковый образец содержится под вакуумом.
16. Способ по п.12, где указанный белковый образец содержит один или более белков.
17. Способ по п.16, где белок представляет собой антитело, иммуноглобулин, гормон, фактор роста, антикоагулянт, фактор свертывания или белок комплемента.
18. Способ по п.17, где фактор свертывания выбран из группы, состоящей из тромбина, фактора II, фактора V, фактора VII, фактора VIIa, фактора VIII, фактора IX, фактора X, фактора XIII, фактора XIIIa, фактора фон Виллебранда, фибрина и фибриногена.
19. Способ по п.17, где антитела представляют собой поликлональные или моноклональные антитела или их смеси.
20. Способ по п.19, где иммуноглобулины представляют собой иммуноглобулин G, иммуноглобулин M или их смеси.
21. Способ по п.16, где белок выбран из группы, состоящей из белка C, белка S, альфа-1-антитрипсина (ингибитора альфа-1-протеазы), гепарина, инсулина, бутилхолинэстеразы, варфарина, стрептокиназы, тканевого активатора плазминогена (TPA), эриторопоэтина (EPO), урокиназы, нейпогена, антитромбина-3, альфа-глюкозидазы и альбумина.
22. Способ по п.16, где белок продуцируется рекомбинантными методами.
23. Белковый образец, облученный любым из способов по пп.12-22.
24. Белок, облученный любым из способов по пп.12-22.
25. Способ снижения уровня активных биологических примесей или патогенов в сыворотке или плазме, причем указанный способ включает в себя
(i) добавление к указанной сыворотке по меньшей мере одного стабилизатора, выбранного из группы, состоящей из аскорбиновой кислоты, аскорбата натрия, маннита, трегалозы, диметилсульфоксида (ДМСО), бутилированного гидрокситолуола (BHT), диметилтиомочевины, глутатиона, липоевой кислоты, 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты (Тролокс), мочевой кислоты, альбумина, гистидина, N-ацетилцистеина, триптофана, N-ацетилтриптофана, метионина, цистеина или N-трет-бутил-альфа-фенилнитрона; и
(ii) облучение указанной сыворотки подходящей дозой гамма-излучения, эффективного для снижения уровня биологически активных примесей или патогенов в указанной сыворотке.
26. Способ по п.25, где указанная сыворотка представляет собой эмбриональную бычью сыворотку.
27. Способ по п.25, где в процессе облучения указанная сыворотка содержится при температуре ниже ее точки замерзания.
28. Способ по п.25, где в процессе облучения сыворотка содержится в инертной атмосфере.
29. Способ по п.28, где в процессе облучения сыворотка содержится под вакуумом.
30. Сыворотка, облученная любым из способов по пп.25-29.
31. Способ по пп.1, 12 или 25, где уровень указанного излучения приблизительно составляет по меньшей мере от 3,0 кГр/ч приблизительно по меньшей мере до 45 кГр/ч.
32. Способ по пп.1, 12 или 25, где концентрация стабилизатора составляет по меньшей мере 20 мМ.
33. Способ по пп.1, 12 или 25, где концентрация стабилизатора составляет по меньшей мере 50 мМ.
34. Способ по пп.1, 12 или 25, где концентрация стабилизатора составляет по меньшей мере 100 мМ.
35. Способ по пп.1, 12 или 25, где концентрация стабилизатора составляет по меньшей мере 200 мМ.
36. Способ по пп.1, 12 или 25, где комбинацию двух или более стабилизаторов добавляют к указанной ткани, белковому образцу или сыворотке.
37. Способ по п.1 или 12, где ткань или белковый образец содержит один или более остаточных растворителей.
38. Способ по п.37, где остаточным растворителем является вода.
39. Способ по п.37, где остаточным растворителем является органический растворитель.
40. Способ по п.39, где органический растворитель выбран из группы, состоящей из этанола, изопропанола и полиэтиленгликоля.
41. Способ по п.37, где остаточное содержание растворителя снижается при лиофилизации.
42. Способ по п.41, где остаточное содержание растворителя составляет менее 8,0%.
43. Способ по п.41, где остаточное содержание растворителя составляет менее 6,0%.
44. Способ по п.41, где остаточное содержание растворителя составляет менее 1,0%.
45. Способ по п.41, где остаточное содержание растворителя составляет менее 0,5%.
46. Способ по пп.1, 12 или 25, где ткань, белковый образец или сыворотку облучают в течение времени, достаточного для снижения уровня одного или более биологических примесей в ткани, белковом образце или сыворотке.
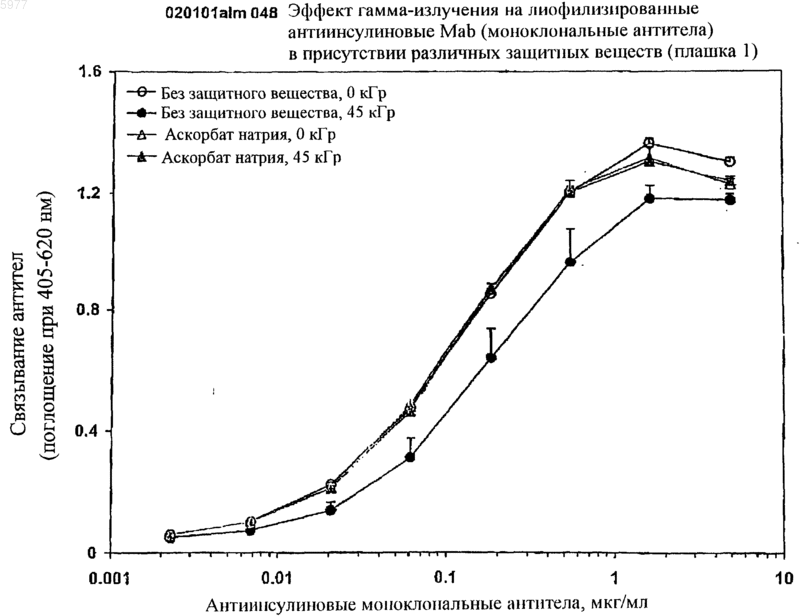
Текст
005977 Область изобретения Настоящее изобретение относится к способам стерилизации биологических материалов для снижения в них уровня биологически активных примесей, таких как вирусы, дрожжи, плесень, микоплазма и/или паразиты. Предпосылки изобретения Некоторые продукты, которые получают из организма человека, животного или же получают экспериментальным путем, могут содержать нежелательные и потенциально опасные примеси, такие как вирусы, дрожжи, плесень, микоплазма и/или паразиты. Следовательно, чрезвычайно важно, чтобы любая биологически активная примесь была инактивирована перед использованием этого продукта. Это особенно важно при непосредственном введении продукта пациенту, например при переливании крови,трансплантации органов и других видах терапии человека. Это также важно для различных продуктов биотехнологии, которые растут в среде, содержащей различные типы плазмы, и которые могут подвергаться воздействию микоплазмы и других вирусных примесей. Ранее большинство методик относилось к способам скринирования и тестирования продуктов на содержание определенного примесного компонента, а не к способам удаления или инактивации примесей в продукте. Продукты, которые были тестированы как позитивные по содержанию примесей, просто не использовались. Примеры процедур скрининга включают в себя тестирование донорской крови на определенные вирусы человека. Такие процедуры, однако, не всегда надежны или не дают возможность определить присутствие небольшого количества вируса. Это снижает значимость и достоверность анализа из-за ложных негативных результатов. В определенных случаях, например в случае синдрома приобретенного иммунодефицита (СПИДа), ложные негативные результаты могут быть угрозой для жизни. Кроме того, для того чтобы определить, содержит ли продукт примесь или нет, в некоторых случаях могут понадобиться недели, если не месяцы. Последние разработки были сосредоточены на способах удаления или инактивации примесей в продуктах. Такие способы включают в себя тепловую обработку, фильтрацию и добавление в продукт инактивирующих химических веществ или сенсибилизирующих веществ. Тепловая обработка требует нагревания продукта приблизительно до 60 С примерно в течение 70 ч, что может нанести вред чувствительному продукту. Инактивация путем нагревания может снизить биологическую активность продукта до 50%. Фильтрация включает в себя фильтрацию продукта для физического удаления примесей. К сожалению, при этом способе могут также удаляться продукты с высоким молекулярным весом. Более того, в определенных случаях небольшие вирусы не могут быть удалены с помощью фильтрации высокомолекулярного продукта. Способ химической сенсибилизации включает в себя введение ядовитых агентов, которые связываются с ДНК/РНК вируса и активируются либо ультрафиолетовым излучением, либо ионизирующей радиацией с образованием свободных радикалов, разрушающих химические связи в основной цепи ДНК/РНК вируса или его комплекса, таким образом нарушая репликацию вируса. При этой процедуре необходимо, чтобы несвязанное сенсибилизирующее вещество вымывалось из клеточных продуктов, так как сенсибилизирующие вещества токсичны или даже мутагенны и канцерогенны и не могут вводиться пациенту. Другим способом стерилизации продукта является облучение гамма-излучением. Гамма-излучение эффективно разрушает вирусы и бактерии при облучении высокими суммарными дозами (Keathly et al.,"Is There Life After Irradiation Part 2", BioPharm July-August, 1993, and Leitman, Use of Blood Cell Irradiation in the Prevention of Post Transfusion Graft-vs-Host Diseases", Transfusion Science 10:219-239(1989. В опубликованных статьях по данной проблеме, однако, утверждается, что гамма-излучение может повреждать продукт, чувствительный к радиации, как, например, кровь. В частности, было показано, что высокие дозы радиации повреждают эритроциты, тромбоциты и гранулоциты (Leitman). В патенте США 4620908 описано, что до облучения белковые продукты должны быть заморожены для сохранения своей жизнеспособности. В этом патенте был сделан вывод о том, что при облучении гамма-лучами белкового продукта, находящегося, например, при комнатной температуре, он будет полностью разрушен, и его активность будет настолько низкой, что материал будет фактически неэффективным. К сожалению,многие чувствительные биоматериалы, такие как кровь, могут потерять свою жизнеспособность и активность при замораживании для облучения и при последующем оттаивании для введения пациенту. Описанные выше сложности свидетельствуют о наличии потребности в способах стерилизации биоматериалов, которые бы эффективно снижали уровень биологически активных примесей без неблагоприятного действия на биоматериал. Краткое описание изобретения Таким образом, целью настоящего изобретения являются способы стерилизации биоматериалов посредством снижения уровня биологически активных примесей без неблагоприятного действия на биоматериал. Другие цели, возможности и преимущества настоящего изобретения будут изложены в подробном описании предпочтительных воплощений, следующем далее, и в части, относящейся к подробному описанию изобретения, или описаны в практической части данного изобретения. Эти цели и преимущества данного изобретения реализуются и достигаются с помощью композиций и способов, подробно описанных в описании и формуле изобретения.-1 005977 В соответствии с этими и другими целями первое воплощение настоящего изобретения относится к способу стерилизации биоматериала, чувствительного к ионизирующему излучению, который включает в себя (i) снижение остаточного количества растворителя в биоматериале до уровня, эффективного для защиты биоматериала от ионизирующей радиации; и (ii) облучение биоматериала эффективным уровнем радиации в течение времени, эффективного для стерилизации биоматериала. Второе воплощение согласно изобретению относится к способу стерилизации биоматериала, чувствительного к ионизирующей радиации, который включает в себя (i) добавление к биологическому материалу по меньшей мере одного стабилизатора в количестве, эффективном для защиты биоматериала от ионизирующей радиации; и (ii) облучение биоматериала эффективным уровнем радиации в течение времени, эффективного для стерилизации биоматериала. Третье воплощение согласно изобретению относится к способу стерилизации биоматериала, чувствительного к ионизирующей радиации, который включает в себя (i) снижение остаточного количества растворителя в биоматериале до уровня, эффективного для защиты биоматериала от ионизирующей радиации; и (ii) добавление к биологическому материалу по меньшей мере одного стабилизатора в количестве, эффективном для защиты биоматериала от ионизирующей радиации; и (iii) облучение биоматериала эффективным уровнем радиации в течение времени, эффективного для стерилизации биоматериала. В соответствии с этими воплощениями, стадии (i) и (ii) могут меняться местами. Описание чертежей Фиг. 1 и 2 представляют собой кривые, демонстрирующие защитные эффекты определенных стабилизаторов на лиофилизированные антиинсулиновые моноклональные антитела при облучении до 45 кГр низкой дозой гамма-излучения; фиг. 3 А-3 С представляют собой кривые, демонстрирующие защитные эффекты определенных стабилизаторов на лиофилизированные антиинсулиновые моноклональные антитела при облучении до 45 кГр низкой дозой гамма-излучения; фиг. 4 представляет собой кривую, демонстрирующую защитные эффекты первичной и вторичной лиофилизации на чувствительность моноклональных антител; фиг. 5 представляет собой кривую, демонстрирующую защитный эффект лиофилизации и/или добавления стабилизатора на активность фактора VIII. фиг. 6 представляет собой кривую, демонстрирующую защитные эффекты определенных стабилизаторов на жидкий или лиофилизированный антитромбин III, облученный 25 кГр слабой дозой гаммалучей; фиг. 7-14 представляют собой защитный эффект определенных стабилизаторов на активность лиофилизированных антиинсулиновых моноклональных антител; фиг. 15 представляет собой кривую, демонстрирующую защитный эффект стабилизирующих веществ на активность лиофилизированных антиинсулиновых моноклональных антител при облучении образца высокой дозой (30 кГр/ч); фиг. 16 представляет собой кривую, демонстрирующую эффект стабилизатора на лиофилизированный тромбин, облученный гамма-излучением; фиг. 17 представляет собой кривую, демонстрирующую эффект стабилизатора на активность IgM после облучения гамма-излучением; фиг. 18 представляет собой хроматограмму, демонстрирующую эффекты гамма-излучения на альбумин; фиг. 19 представляет собой кривую, демонстрирующую защитные эффекты лиофилизации и/или наличия стабилизатора на активность тромбина после облучения гамма-излучением; фиг. 20-25 представляют собой кривые, демонстрирующие защитные эффекты определенных стабилизирующих веществ на жидкие поликлональные антитела IVIG, облученные 45 кГр гаммаизлучением (1,8 кГр/ч); фиг. 26 представляет собой кривую, демонстрирующую эффекты рН на восстановление уровня урокиназы (жидкой или лиофилизированной) после облучения в присутствии стабилизатора. Подробное описание предпочтительных воплощений А. Определения. Если не указано иного, под всеми техническими и научными терминами, используемыми здесь,подразумеваются термины, которые, как правило, понятны специалистам в данной области. Все патенты и публикации, указанные здесь, приведены здесь только в качестве ссылки. Под используемым здесь термином биоматериал подразумевается любое вещество, полученное из живого организма или им произведенное. Примеры биоматериалов, приведенные в качестве иллюстрации, включают в себя, не ограничиваясь ими, клетки; ткани; кровь и ее компоненты; белки, в том числе рекомбинантные и трансгенные белки; растительные вещества; пищу и тому подобное. Предпочтительные примеры биоматериалов включают в себя, не ограничиваясь ими, связки; сухожилия; нервы; кости, в том числе деминерализованный костный матрикс, трансплантаты, суставы, бедренную кость и головку бедренной кости и тому подобное; зубы; кожный трансплантат; костный мозг, в том числе цельную или обработанную суспензию клеток костного мозга; сердечные клапаны; хрящевую ткань; роговицу; арте-2 005977 рии и вены; органы для трансплантации, такие как сердце, легкие, печень, почки, кишечник, поджелудочная железа, конечности и пальцы; липиды; углеводы; коллаген (простой, нефибриллярный, ателомерный, растворимый и нерастворимый); хитин и его производные, в том числе хитозан и его производные,включая NO-карбоксихитозан (NOCC); стволовые клетки, клетки островков Лангерганса; и другие пересаживаемые клетки, в том числе генетически измененные клетки; эритроциты, в том числе моноциты и стволовые клетки; и тромбоциты. Под используемым здесь термином стерилизовать подразумевается снижение уровня, по меньшей мере, какого-либо биологически активного примесного компонента, найденного в биологическом материале при обработке в соответствии с настоящим изобретением. Под используемым здесь термином биологическая примесь подразумевается примесной компонент, который при непосредственном или косвенном контакте с биологическим материалом может агрессивно на него действовать. Такие биологические примеси включают в себя различные вирусы, бактерии и паразиты, известные специалистам в данной области, которые обычно обнаруживают в биологических материалах, или они инфицируют биологические материалы, такие как цельная кровь или компоненты крови. Примеры биологических примесей включают в себя, не ограничиваясь ими, вирусы, такие как вирусы иммунодефицита человека и другие ретровирусы, вирусы герпеса, парамиксовирусы, цитомегаловирусы, вирусы гепатита (в том числе гепатита В и гепатита С), поксвирусы, тогавирусы, вирус Эпштейна-Барр и паравирусы; бактерии, такие как Escherichia, Bacillus, Campylobacter, Streptococcus,Staphyloccocus; паразиты, такие как Trypanosoma, и паразиты, вызывающие малярию, включая вид Plasmodium; дрожжи; плесневые грибы; микоплазму; и прионы. Под используемым здесь термином активный биологический - примесной компонент подразумевается биологическая примесь, вызывающая вредное воздействие. Под используемым здесь термином компоненты крови подразумевается один или несколько компонентов, которые могут быть выделены из цельной крови, которые включают в себя, не ограничиваясь ими, клеточные компоненты крови, такие как эритроциты, лейкоциты и тромбоциты; белки крови, такие как факторы свертывания крови, ферменты, альбумин, плазминоген, фибриноген и иммуноглобулины; и жидкие компоненты крови, такие как плазма и содержащие плазму композиции. Под используемым здесь термином клеточный компонент крови подразумевается один или несколько компонентов цельной крови, который включает в себя клетки, такие как эритроциты, лейкоциты и тромбоциты. Под используемым здесь термином белок крови подразумевается один или несколько белков, которые в норме присутствуют в цельной крови. Иллюстративные примеры белков крови, присутствующих в крови млекопитающих (в том числе человека), включают в себя, не ограничиваясь ими, белки коагуляции (как зависимые от витамина K, такие как фактор VII и фактор IX, так и независимые от витамина K,такие как фактор VIII и фактор фон Виллебранда), альбумин, липопротеины (липопротеины высокой плотности и/или липопротеины низкой плотности), белки комплемента, глобулины (такие как иммуноглобулины IgA, IgM, IgG и IgE) и тому подобное. В предпочтительную группу белков крови входят фактор I (фибриноген), фактор II (протромбин), фактор III (тканевой фактор), фактор IV (кальций), фактор V(фактор Стюарта-Прауэра), фактор XI (плазменный предшественник тромбопластина), фактор XII (фактор Хагемана), фактор XIII (протрансглутамидаза), фактор фон Виллебранда (vWF), фактор Iа, факторIIа, фактор Va, фактор VIa, фактор VIIa, фактор VIIIa, фактор IХа, фактор Ха и XIIIa. Под используемым здесь термином жидкие компоненты крови подразумевается один или несколько жидких, бесклеточных компонентов цельной крови, таких как плазма (жидкая, бесклеточная часть крови человека или животных после коагуляции). Под используемым здесь термином биологически совместимый раствор подразумевается раствор, в котором биоматериал может быть экспонирован, например, суспендирован или растворен, и при этом он остается жизнеспособным, т.е. сохраняет свои главные биологические и физиологические характеристики. Такие биологически совместимые растворы предпочтительно содержат эффективное количество по меньшей мере одного антикоагулянта. Под используемым здесь термином биологически совместимый буферный раствор подразумевается биологически совместимый раствор, имеющий рН и осмотические свойства (например, тоничность,осмоляльность и/или осмотическое давление), подходящие для сохранения цельности биоматериалов. Подходящие биологически совместимые буферные растворы имеют рН между 5 и 8,5 и являются изотоничными или же незначительно гипотоничными или гипертоничными. Известные биологически совместимые буферные растворы легко доступны специалистам в данной области. Под используемым здесь термином стабилизатор подразумевается соединение или вещество, которое снижает любое повреждение облученного биоматериала до уровня, при котором он остается неповрежденным и может эффективно использоваться. Иллюстративные примеры стабилизаторов включают в себя, не ограничиваясь ими, антиоксиданты, такие как аскорбиновая кислота и токоферол; поглотители свободных радикалов, такие как этанол. Предпочтительные примеры стабилизаторов включают в себя,-3 005977 не ограничиваясь ими, жирные кислоты, в том числе 6,8-димеркаптооктановую кислоту (липоевую кислоту) и ее производные и аналоги (альфа, бета, дигидро, биснор- и тетранорлипоевая кислота), тиоктовую кислоту, 6,8-димеркаптооктановую кислоту, дигидролопоат (метиловый эфир DL-6,8 дитиолоктановой кислоты), липоамид, биснорметиловый эфир и тетранордигидролипоевую кислоту,фурановые жирные кислоты, олеиновую, линолевую и пальмитиновую кислоту и их соли и производные; флавоноиды, фенилпропаноиды и флавенолы, такие как кверцетин, рутин и их производные, апигенин, аминофлавон, катехин, гесперидин и нарингин; каротины, в том числе бета-каротин; Co-Q10; ксантофилы; многоатомные спирты, такие как глицерин, маннит; сахара, такие как ксилоза, глюкоза, рибоза,манноза, фруктоза и трегалоза; аминокислоты, такие как гистидин, N-ацетилцистеин (NAC), глутаминовая кислота, триптофан, каприл N-ацетилтриптофан натрия и метионин; азиды, такие как азид натрия; ферменты, такие как супероксиддисмутаза (SOD) и каталаза; мочевую кислоту и ее производные, такие как 1,3-диметилмочевая кислота и диметилтиомочевина; аллопуринол; тиолы, такие как глутатион и цистеин; микроэлементы, такие как селен; витамины, такие как витамин А, витамин С (включая их производные и соли, такие как аскорбат натрия и пальмитоил аскорбиновой кислоты) и витамин Е (его производные и соли, такие как ацетат токоферола и альфа-токотриенол); хроманол-альфа-С 6; 6-гидрокси 2,5,7,8-тетраметилхрома-2-карбоновую кислоту (тролокс) и производные; чужеродные белки, такие как желатин и альбумин; трис-3-метил-1-фенил-2-пиразолин-5-он (MCI-186); цитиолон; пуерцетин, хрисин; диметилсульфоксид (ДМСО); пиперазин диэтансульфоновую кислоту (PIPES); имидазол; метоксипсорален (MOPS); 1,2-дитиан-4,5-диол; восстанавливающие вещества, такие как бутилированный гидроксианизол (ВНА) и бутилированный гидрокситолуол (ВНТ); холестерин; пробукол; производные индола; тимеросал; лазароид и тирилазад мезилат; проантенолы; проантоцианидины; сульфат аммония; пегорготеин (PEG-SOD); N-трет-бутил-альфа-фенилнитрон (PBN); и 4-гидрокси-2,2,6,6-тетраметилпиперидин-1 оксил (темпол). Под используемым здесь термином остаточное количество растворителя подразумевается количество свободно доступной жидкости в биологическом материале. Под свободно доступной жидкостью понимается такая жидкость, как вода или органический растворитель (например, этанол, изопропанол,полиэтиленгликоль и так далее), присутствующая в биологическом материале, которая с ним не связывается или не образует комплекс с одним или несколькими нежидкими компонентами биоматериала (например, белками, ионами металлов или солями и так далее). Свободно доступная жидкость включает в себя межклеточную воду. Указанное здесь остаточное количество растворителя относится к уровням,определенным одобренным FDA (Управление по контролю за продуктами и лекарствами (США модифицированным методом Карла Фишера (Meyer and Boyd, Analytical Chem., 31, 215-219, 1959; May, et al.,J. Bigl. Standardization, 10, 249-259, 1982; Centers for Biologies Evaluation and Research, FDA, Docket No. 89D-0140, 83-93; 1990). Под используемым здесь термином сенсибилизатор подразумевается вещество, которое селективно метит вирусные, бактериальные и/или паразитические примеси, делая их более чувствительными к инактивации под действием радиации, что позволяет, таким образом, использовать более низкий уровень радиации и/или более короткое время облучения, чем при отсутствии сенсибилизатора. Иллюстративные примеры подходящих сенсибилизаторов включают в себя, не ограничиваясь ими, псорален и его производные и аналоги (в том числе 3-карбоэтоксипсоралены); ангелицины, хелины и кумарины, которые содержат галогеновый заместитель и водосенсибилизирующую молекулу, такую как ион четвертичного аммония или фосфора; соединения, связывающие нуклеиновую кислоту; бромированный гематопорфирин; фталоцианины; пурпурины; порфирины; производные дигематопорфириновых эфиров, замещенные галогеном или атомом металла, гематопорфириновые производные, бензопорфириновые производные,гидродибензопорфириновые дималеимиды, гидродибензопорфирин, дицианодисульфон, тетракарбэтоксигидродибензопорфирин и дипропионамид тетракарбэтоксигидродибензопорфирин; доксорубицин и дауномицин, которые могут быть модифицированы атомами галогена или атомами металлов; нетропсин;BD пептид, S2 пептид; S-303 (ALE соединение); красители, такие как гиперицин, метиленовый синий,эозин, флуоресцеины (и их производные), флавины, мероцианин 540; светочувствительные соединения,такие как бергаптен; и SE пептиды. Под используемым здесь термином белковое вещество подразумевается клеточный материал, который содержит по меньшей мере один белок или пептид. Этот материал предпочтительно состоит из первичного(ых) белка(ов) и/или пептида(ов). Белок или пептид может быть природным и находится либо в своей нативной форме, либо обработан/очищен и/или преобразован в производные. Он может быть получен синтетически, либо путем химического синтеза, либо с использованием рекомбинантной/трансгенной технологии. Полученный синтетически продукт может также быть обработан/очищен и/или преобразован в производные. Иллюстративные примеры белковых веществ включают в себя, но ими не ограничиваются, белки/пептиды, полученные из культуры тканей; молоко (молочные продукты); перитонеальный выпот; гормоны; факторы роста; вещества, в том числе фармацевтические препараты,экстрагированные или выделенные из тканей животных (такие как гепарин и инсулин) или растительного субстрата; плазму (в том числе свежую, замороженную или лиофилизированную); фибриноген, фибрин и/или фибриновые продукты, служащие уплотняющим материалом; цельную кровь; белок С; белокS; альфа-1-антитрипсин (ингибитор альфа-1 протеазы); бутилхолинэстеразу; антикоагулянты, такие как лекарственные средства с кумарином (варфарин); стрептокиназы; активатор тканевого плазминогена(ТРА); эриторопоэтин (ЕРО); урокиназу; нейпоген; антитромбин-3; альфа-глюкозидазу; (эмбриональную) бычью сыворотку/лошадиную сыворотку; мясо; иммуноглобулины, в том числе антисыворотку,моноклональные антитела, поликлональные антитела и антитела, полученные с помощью методов генной инженерии; альбумин; альфа-глобулины; бета-глобулины; гамма-глобулины; коагулированные белки; комплементарные белки; и интерфероны. Под используемым здесь термином ионизирующая радиация подразумевается радиация с энергией, достаточной для ионизации (образования ионов) облученного биоматериала. Виды ионизирующей радиации включают в себя, не ограничиваясь ими (i) корпускулярную радиацию (потоки субатомарных частиц, таких как нейроны, электроны и/или протоны); (ii) электромагнитную радиацию (создаваемую различными электромагнитными волнами, такими как радиоволны, волны видимого и невидимого света,рентгеновское излучение и гамма-лучи). В. Особенно предпочтительные воплощения. Первое предпочтительное воплощение настоящего изобретения относится к способу стерилизации биоматериала, чувствительного к ионизирующей радиации, который включает в себя (i) снижение остаточного количества растворителя в биоматериале до уровня, эффективного для защиты биоматериала от ионизирующей радиации; и (ii) облучение биоматериала эффективным уровнем радиации в течение времени, эффективного для стерилизации биоматериала. Второе воплощение согласно изобретению относится к способу стерилизации биоматериала, чувствительного к ионизирующей радиации, который включает в себя (i) добавление к биоматериалу по меньшей мере одного стабилизатора в количестве, эффективном для защиты биоматериала от ионизирующей радиации; и (ii) облучение биоматериала эффективным уровнем радиации в течение времени,эффективного для стерилизации биоматериала. Третье воплощение согласно изобретению относится к способу стерилизации биоматериала, чувствительного к ионизирующей радиации, который включает в себя (i) снижение остаточного количества растворителя в биоматериале до уровня, эффективного для защиты биоматериала от ионизирующей радиации; (ii) добавление к биоматериалу по меньшей мере одного стабилизатора в количестве, эффективном для защиты биоматериала от ионизирующей радиации; и (iii) облучение биоматериала эффективным уровнем радиации в течение времени, эффективного для стерилизации биоматериала. Конечно, порядок следования стадий (i) и (ii) может быть при желании изменен. Биологический материал, стерилизуемый в соответствии со способами согласно изобретению, может быть любым материалом, полученным или извлеченным из живого или мертвого организма, и включает в себя твердое вещество, или жидкость, или суспензию любых(ого) твердых(ого) веществ(а) в любых(ой) жидкостях(и) или слой любого твердого или жидкого вещества на биологическом или небиологическом субстрате. В соответствии со способами согласно изобретению остаточное количество растворителя биоматериала снижают перед облучением биоматериала ионизирующей радиацией. Остаточное количество растворителя снижают до уровня, эффективного для защиты биоматериала от ионизирующей радиации. Подходящие уровни остаточного количества растворителя могут изменяться в зависимости от природы и свойств конкретного биоматериала, подвергающегося облучению, и могут быть определены эмпирически специалистом в данной области. Предпочтительно в тех случаях, когда растворителем является вода,содержание остаточного растворителя составляет приблизительно менее 2,0%, более предпочтительно приблизительно менее 1,0%, еще более предпочтительно приблизительно менее 0,5% и наиболее предпочтительно приблизительно менее 0,2%. Не соотносясь ни с какой теорией, используемой на практике, вероятно, снижение остаточного количества растворителя снижает степень свободы биоматериала и таким образом защищает его от действия ионизирующей радиации. Аналогичные результаты могут, таким образом, быть получены при снижении температуры биоматериала ниже его эвтектической точки или ниже его точки замерзания, что также снижает степень свободы биоматериала. Эти показатели допускают использование более высоких уровней излучения, чем те, которые допустимы обычно. Остаточное количество растворителя биоматериала может быть снижено любым способом или методикой удаления растворителя из биоматериала, известной специалисту в данной области. Наиболее предпочтительным способом снижения содержания остаточного растворителя в биоматериале является лиофилизация. В соответствии с особенно предпочтительным воплощением настоящего изобретения,лиофилизированный биоматериал до облучения хранят под вакуумом или в инертной атмосфере (предпочтительно в атмосфере благородных газов, таких как гелий или аргон, более предпочтительно в атмосфере высокомолекулярного благородного газа и наиболее предпочтительно в атмосфере аргона). Применяемой в настоящем изобретении ионизирующей радиацией может быть любая ионизирующая радиация, эффективная для инактивации одного или нескольких биологических примесей обрабатываемого биоматериала. Предпочтительно ионизирующей радиацией является электромагнитная радиация и особенно предпочтительной формой ионизирующей радиации является гамма-излучение.-5 005977 В соответствии со способами согласно изобретению биоматериал облучают уровнем ионизирующей радиации, эффективным для инактивации одного или нескольких биологических примесей в биологическом материале. Подходящие уровни радиации могут изменяться в зависимости от конкретной формы ионизирующей радиации, природы и свойств конкретного облучаемого биоматериала и конкретной инактивируемой биологической примеси. Подходящие уровни радиации могут быть эмпирически определены специалистом в данной области. Предпочтительно, чтобы уровень радиации в процессе стерилизации оставался постоянным. В соответствии с конкретным предпочтительным воплощением настоящего изобретения уровень облучения не превышает приблизительно 3,0 кГр/ч, более предпочтительно находится приблизительно между 0,1 и 3,0 кГр/ч, еще более предпочтительно между 0,25 и 2,0 кГр/ч и еще более предпочтительно приблизительно между 0,5 и 1,5 кГр/ч и наиболее предпочтительно приблизительно между 0,5 и 1,0 кГр/ч. В соответствии с другим предпочтительным воплощением настоящего изобретения уровень радиации составляет по меньшей мере приблизительно 3,0 кГр/ч, более предпочтительно по меньшей мере приблизительно 6 кГр/ч, еще более предпочтительно по меньшей мере приблизительно 16 кГр/ч и наиболее предпочтительно по меньшей мере приблизительно 30 кГр/ч. Биоматериал облучают ионизирующей радиацией в течение времени, эффективного для инактивации одного или нескольких биологических примесей биоматериала. Подходящее время облучения может изменяться в зависимости от конкретного вида и уровня ионизирующей радиации, природы и свойств конкретного облучаемого биоматериала и конкретной инактивируемой биологической примеси. Подходящее время облучения может быть определено специалистом в данной области. Перед облучением ионизирующей радиацией в биоматериал необязательно добавляют эффективное количество по меньшей мере одного сенсибилизирующего вещества. Подходящие сенсибилизирующие вещества известны специалистам в данной области. В соответствии со способами согласно изобретению облучение биоматериала может проходить при любой температуре, которая не является опасной для обрабатываемого биоматериала. В соответствии с предпочтительным воплощением биоматериал облучают при комнатной температуре. В соответствии с альтернативным предпочтительным воплощением биоматериал облучают при пониженной температуре,предпочтительно при температуре, ниже или равной эвтектической точке биоматериала. С. Примеры. Следующие примеры являются иллюстративными и не ограничивают настоящее изобретение. Дополнительные походящие изменения и улучшения относятся к многообразию изменений и улучшений, с которыми обычно сталкивается специалист в данной области, и полностью входят в сущность и рамки настоящего изобретения. Пример 1. Стерилизация крови. Использовали 200 мл упаковку осажденных эритроцитов, которые хранились один день. К клеткам добавляли этанол до конечной концентрации этанола 0,01% об./об. Эритроциты разводили в отношении один к десяти, используя модифицированный раствор цитрат-фосфатной декстрозы (CPD) с суммарным объемом 500 мл, рН которого составлял приблизительно 6,4-6,7 и в состав которого входили следующие компоненты: Моногидрат лимонной кислоты 0,2 г Дигидрат цитрата натрия 27,3 г Моноосновный фосфат натрия 2,2 г Двухосновный фосфат натрия 1,0 г Декстроза 3,2 г Клетки облучали коммерческим гамма-излучателем, содержащим источник кобальта 60. Облучение проводили без носителя в незащищенном боксе. Клетки облучали в течение 24 ч дозой облучения с мощностью 1 кГр/ч. После облучения эритроциты оценивали визуально. Они оказались жизнеспособными и имели ярко-красный цвет. Контрольный образец, содержащий осажденные эритроциты и неразведенный вышеописанным раствором CPD, после облучения был нежизнеспособным. Через четыре дня после облучения разведенные клетки оценивали на содержание различных примесей крови, результаты приведены в табл. 1. Контрольный образец содержал кровь из той же упаковки,как и в исследуемом образце, но его не подвергали облучению. В табл. 1 показано, что разведение и облучение клеток человеческой крови значительно не влияет на количество лейкоцитов. Количество тромбоцитов и значение гемотокрита были незначительно ниже контрольных; однако, эти значения оставались в пределах значений, наблюдаемых в норме в крови взрослого человека. Уровень гемоглобина был выше контрольного, что указывало на лизис некоторого количества эритроцитов в ходепроведения исследования. Этот факт также подтвердился снижением количества эритроцитов. Тем не менее, вопреки опубликованным ранее данным, радиация до 50 кГр не разрушала примеси в крови настоящим способом. Клетки также были подсчитаны, и было найдено, что жизнеспособность сохранялась после облучения 25 кГр гамма-излучения при низкой мощности дозы облучения, равной 1 кГр/ч. Пример 2. Стерилизация декстрозы. Растворы, содержащие декстрозу (или глюкозу), используются для восполнения недостатка углеводов и жидкости при лечении гипогликемии в качестве плазмозаменителя, при почечном диализе и нейтрализации гепатотоксинов (The Merck Index; Eleventh Edition, MerckCo., Inc. (1989), and Martindale'sExtra Pharmacopoeia, p. 1, 265). Декстроза также является предпочтительным источником углеводов при парентеральном питании (The Merck Index, Eleventh Edition, MerckCo., Inc. (1989), and Martindale'sExtra Pharmacopecia, p. 1, 265). Во всех вышеуказанных случаях применения декстроза должна быть стерилизована до ее использования. Стерилизацию декстрозосодержащих продуктов обычно проводят путем кипячения или автоклавирования. К сожалению, сообщалось, что эти методы приводят к деградации или кармелизации декстрозосодержащих растворов, что приводило к изменению цвета раствора (Martindale's Extra Phannacopecia p. 1,265). Также сообщалось, что гамма-облучение глюкозы приводит к разложению глюкозосодержащих растворов (Kawakishi, et al., Radiation-Induced Degradation of D-glucose inAnaerobic Contition, Agric. Biol. Chem., June 1977). Таким образом, существует потребность в способе стерилизации декстрозосодержащих продуктов, при котором бы не было их разложения. Учитывая предыдущие трудности, раствор декстрозы обрабатывали в соответствии со способом согласно изобретению следующим образом. 5% Раствор декстрозы облучали в течение 24 ч мощностью приблизительно 1 кГр/ч. После облучения продукт оценивали, и было показано, что изменений в спектре видимого света по сравнению с необлученным образцом не было. Таким образом, настоящий способ может использоваться для стерилизации продуктов, содержащих декстрозу. В дополнение к вышеописанным экспериментам, свежие растворы 5 и 50% декстрозы облучали 25 кГр более 36 ч при температуре окружающей среды. Результаты были аналогичны описанным выше результатам. Кроме того, проведенное UI/VIS сканирование (спектрофотометрический анализ в видимой и ультрафиолетовой областях света) показало полное отсутствие пиков при 283,4 нм для фурфурола в соответствии с U.S.Р. (фармакопея США). В противоположность этим данным стерилизованные автоклавированием образцы декстрозы содержали 283,4 фурфурольный пик. Фурфуролы являются канцерогенами. Пример 3. Стерилизация альбумина сыворотки человека. Сывороточный альбумин крови здорового человека в виде 25% слабосолевого раствора облучали общей дозой 25 кГр более 36 ч, используя Gammacell 220 (источником гамма-лучей в этом приборе был Со 60). В ходе облучения температуру не контролировали, но было определено, что температура в контейнере, содержащем альбуминовый раствор, составляла 23 С. Полученный анализ ВЭЖХ представлен в табл. 2. Таблица 2 Как показывают результаты, альбумин сыворотки крови здорового человека может быть безопасно облучен до 25 кГр (при мощности облучения 0,7 кГр/ч) при комнатной температуре без вредного воздействия на основные свойства белка. Ранее это не было показано. Все другие опыты по облучению альбумина сыворотки требуют облучения при заморозке. Это подразумевает дополнительные расходы и трудности проведения облучения. Пример 4. Человеческую кровь здорового донора помещали в пробирку с гепарином, три раза промывали стандартным раствором CPD, затем разводили 1:20 CPD, содержащим 0,01% об./об. этанола.-7 005977 Раствор CPD с 0,01% об./об. этанола обозначили как SCPD. В 10-миллилитровые пластиковые пробирки для исследования помещали аликвоты по 2 мл и облучали различными дозами до 26 кГр более 36 ч при комнатной температуре. Гемолиза не наблюдалось и клетки выглядели интактными, хотя несколько увеличенными и имеющими незначительно измененную форму. Результаты трех отдельных экспериментов приведены в табл. 3. Таблица 3 эксперимент 1 и эксперимент 2 1 количество эритроцитов: количество клеток 1012/л 2 гемоглобин: грамм/литр 3 гематокрит 4 средний атомарный объем: фемтолитры 5 средний атомарный гемоглобин: пикограммы 6 средняя атомарная концентрация гемоглобина: граммы/литры Клетки без труда ресуспендировали и восстанавливали в свежем буфере. Следующие три эксперимента (примеры 5, 6 и 7) проводили с целью определения эффективности способа для обработки зараженной ВИЧ крови. В каждом примере клетки обрабатывали одинаково. В этих экспериментах клетки аккуратно взбалтывали через 12, 16 и 24 ч облучения. Кроме того, в третьем эксперименте (пример 7) клетки помещали в колбы Т 25 для получения большей площади поверхности и снижали концентрацию осаждением на дне центрифужных пробирок. В каждом случае клетки облучали дозой облучения мощностью приблизительно 0,7 кГр/ч. Пример 5. Стерилизация крови, содержащей ВИЧ. Следующие эксперименты проводили со следующими определенными целями: 1. Оценить токсичность способа в отношении красных клеток крови (RBCs). 2. Оценить анти-ретровирусную активность способа. Способ. Сначала из ВИЧ-серонегативной крови донора отбирали 2 мл некоагулированной крови. Центрифугировали кровь и удаляли плазму. Осажденные клетки ресуспендировали в 10 мл буфера CPD и центрифугировали. Такую процедуру промывки повторяли в общей сложности три раза. Клетки, осажденные после последней промывки, ресуспендировали в 40 мл буфера SCPD и разделяли на аликвоты по 2 мл в пластиковые пробирки, 16 аликвот оставляли для дальнейших манипуляций. В 8 из этих пробирок добавляли аликвоты HTLV-IIIB. HTLV-IIIB представляет собой лабораторный штамм вируса ВИЧ, и в каждую пробирку для заражения добавляли 100 инфекционных доз тканевой культуры (TCID). Оставшиеся 8 пробирок ложно заражали, добавляя небольшое количество незараженного лабораторного буфера, а именно физиологического раствора, забуференного фосфатом (PBS). В эксперименте использовали четыре зараженные и четыре незараженные пробирки. Для сравнения оставшиеся 8 пробирок (четыре зараженные и четыре незараженные) обрабатывали тем же способом, исключая их участие в эксперименте. Необходимо указать, что в начале эксперимента донорскую кровь делили на аликвоты. Сбор крови проводили в клинической гематологической лаборатории, где делали полную гемограмму. Эти основные результаты сравнивали с повторным экспериментом исследуемых аликвот, который включал в себя оценку четырех проб обработанных и четырех необработанных, каждая из которых не была заражена ВИЧ. Аликвоты в 0,5 мл каждого из зараженных исследуемых образцов инокулировали мононуклеарными клетками (MCs), полученными тремя днями раньше. Эти клетки суспендировали в культуральной среде RMPI с 10% фетальной сывороткой теленка и другими добавками (пенициллин, стрептомицин,глутамин и буфер HEPES) вместе с 1 мкг/мл РНА-Р. Параллельно с инокуляцией клетки ресуспендиро-8 005977 вали в свежей среде с rIL-2 (20 ед/мл). Культуру поддерживали в течение 7 дней. Дважды в неделю порцию культуральной среды собирали для измерения уровня ВИЧ-антигена р 24 (коммерческий наборELISA, Coulter Electronics, Hialeah, FL) для оценки роста вируса. Разделенные на аликвоты восемь инфицированных исследуемых образцов использовали в экспериментах по вирусному титрованию. Кратко, серию четырех кратных разведений вируссодержащих жидкостей (изменяющихся от 1:16 до 1:65,536) раскапывали с тремя повторами каждого в 96-луночную плоскодонную плашку для тканевой культуры. В каждую лунку добавляли РНА-стимулированные MCs (4 миллиона клеток в 2 мл культуральной среды с IL-2). Аликвоты супернатанта культуры из каждой лунки собирали дважды в неделю для измерения уровня ВИЧ-антигена р 24. Лунка оценивалась как положительная, если значение уровня ВИЧ-антигена р 24 было 30 пг/мл. Вирусный титр подсчитывали в соответствии со способом Spearman-Karber (см. справочное руководство по вирусологии ACTG), используя следующее уравнение: М = xk + d[0,5 - (1/n)r] М - титр (в log 4),xk - доза наибольшего разведения,d - интервал между разведениями,n - число лунок на разведение,r - сумма всех лунок. Результаты. Параметры эритроцитов основного образца, а также обработанных и необработанных исследуемых образцов представлены в табл. 4. Таблица 4 Расшифровка аббревиатур, использованных в табл. 4, приведена после табл. 3. Как описано выше, ВИЧ культуры определяли, используя аликвоты в 0,5 мл необработанных и обработанных образцов. Уровни антигена Р 24 (пг/мл) в культуре исследуемых образцов на 4 и 7 день представлены в табл. 5. Таблица 5 Наконец, для проведения прямого бескультурального вирусного титрования брали один необработанный и один обработанный образец. Результаты приведены в табл. 6. Таблица 6-9 005977 Эритроциты крови минимально повреждались при проведении эксперимента, хотя наблюдалось некоторое количество репродуцирующих макроцитов. Хотя при аналогичном культурировании обработанных образцов в них оказалось некоторое количество остаточного живого вируса, этот факт не был подтвержден экспериментами по прямому титрованию. Пример 6. Цель данного эксперимента заключалась в оценке токсичности способа на эритроциты крови при полном анализе. Способ. Для данного эксперимента из той же ВИЧ-серонегативной крови донора, что и в первом эксперименте, отбирали 1 мл некоагулированной крови. Центрифугировали кровь и удаляли плазму. Осажденные клетки ресуспендировали в 10 мл буфера CPD и центрифугировали. Процедуру промывки повторяли в общей сложности три раза. Клетки, осажденные после последней промывки, ресуспендировали в 20 мл буфера SCPD и разделяли на 2-миллилитровые аликвоты в пластиковые пробирки, и все 10 аликвот оставляли для дальнейших манипуляций. Восемь пробирок участвовали в эксперименте, при этом оставшиеся две пробирки оставляли в качестве контроля, т.е. в качестве необработанных пробирок. После обработки все пробирки центрифугировали и полученные осажденные клетки ресуспендировали в 100 мкл буфера. Для этих ресуспендированных исследуемых образцов делали полную гемограмму. Как и в первом эксперименте, донорскую кровь делили на аликвоты и затем брали исследуемые образцы. Полную гемограмму делали для основного образца. Так как исследуемые образцы концентрировали до 33-50% от их первоначальной концентрации, можно было проводить более прямое сравнение с основным образцом, чем это было возможно в описанных ранее экспериментах. Результаты. Параметры эритроцитов основного образца, а также обработанных и необработанных исследованных образцов представлены в табл. 7. Аббревиатуры, использованные в табл. 7, такие же, как и в табл. 3. Таблица 7 Во всех обработанных образцах был отмечен макроцитоз клеток. В необработанных и обработанных образцах уровень гемоглобина был сопоставим. Абсолютные значения соответствовали конечному разведению. Эритроциты повреждены не были. Пример 7. Способ. Для этого эксперимента из той же ВИЧ-серонегативной крови донора, что и в первых двух экспериментах, отбирали 5 мл некоагулированной крови. Центрифугировали кровь и удаляли плазму. Осажденные клетки ресуспендировали в 100 мл буфера CPD и центрифугировали. Процедуру промывки повторяли в общей сложности три раза. Клетки, осажденные после последней промывки, ресуспендировали в 100 мл буфера SCPD и разделяли на аликвоты по 25 мл в колбы Т 25 для тканевой культуры, и все четыре аликвоты оставляли для дальнейших манипуляций. Две колбы участвовали в эксперименте, при этом оставшиеся две колбы служили в качестве контроля, т.е. в качестве необработанных колб. После обработки содержимое каждой колбы оценивали и визуально определяли способность клеток поглощать кислород (при воздействии окружающего воздуха они становились ярко-красными). После этого содержимое колб отбирали и центрифугировали, осажденные клетки ресуспендировали в небольшом количестве буфера. Делали полную гемограмму этих ресуспендированных исследуемых образцов. Как и в примерах 5 и 6, кровь донора разделяли на аликвоты и затем отбирали исследуемый образец. Проводили полную гемограмму основного образца. Так как исследуемые образцы концентрировали до 33-35% от их первоначальной концентрации, можно проводить более прямое сравнение с основным образцом, чем это было возможно в описанных ранее экспериментах.- 10005977 Результаты. При визуальной оценке заметного различия между обработанными и необработанными исследуемыми образцами не было. Характерно, что при тщательном суспендировании клеток наблюдалось их однородное распределение. При воздействии окружающего воздуха содержимое всех колб становилось ярко-красным. Специальных количественных измерений кислородонасыщаемости не проводили. Параметры эритроцитов крови основного образца, а также обработанных и необработанных исследованных образцов представлены в табл. 8. Аббревиатуры, использованные в табл. 8, такие же, как и в табл. 3. Таблица 8 Целью данного эксперимента было достижение более точных приближений к условиям трансфузии пациенту эритроцитов крови, и поэтому эксперимент проводили при больших объемах. По предварительной оценке оказалось, что процесс не снижает способность эритроцитов к переносу кислорода, хотя это должно быть подтверждено более формально. Интересен тот факт, что в данном эксперименте клетки обработанных и необработанных образцов не отличались по своим размерам, и в обоих случаях клетки были чрезвычайно схожи с клетками основного образца. Измеренные уровни гемоглобина во всех исследованных образцах были сопоставимы. Пример 8. В данном эксперименте облучали иммуноглобулин G (IgG) в лиофилизированной форме. Способ. Результаты анализа ВЭЖХ IgG приведены в табл. 9. Как показывают результаты, продукт, повидимому, не был поврежден после облучения дозой 25 кГр при комнатной температуре при облучении мощностью приблизительно 0,7 кГр/ч. Ранее это не было показано. Таблица 9 Результаты. Результаты, представленные Gergely, et al., с использованием лиофилизации IgG, показали, что часть белка не растворялась после облучения дозой 12-25 кГр при стандартных мощностях дозы облучения. (Gergely, J., et al., Studies of Gama-Ray-Irradiated. Human Immunoglobulin G. SM-92/12 I.A.E.A.). В отличие от этого при использовании способа с дозой облучения мощностью приблизительно 0,7 кГр/ч все белки были растворимы. Этот факт показывает, что никаких даже небольших изменений или деградации белка не происходило. Кроме того, Gergely, et al. показали, что жидкая композиция человеческогоIgG полностью теряла активность после облучения. При исследованиях с использованием настоящего изобретения на внутривенном иммуноглобулине (IVIG) в жидкой форме было показано, что более 70% специфических антител в гипериммунном IVIG оставались неповрежденными. Пример 9. В данном эксперименте облучали ингибитор альфа-1 протеиназы и фибриноген в лиофилизированной форме. Способ. Образцы помещали в установку Gammacell 220 и облучали в соответствии с настоящим способом общей дозой 25 кГр. Затем проводили лабораторный анализ образцов. Мощность дозы облучения составляла 0,72 кГр/ч. Результаты. Ингибитор альфа-1-протеиназы как в опыте, так и в контроле, представлял собой 40% образец нормальной стандартной объединенной плазмы. Для анализа использовали способ радиальной иммунодиффузии по Манчини. Жизнеспособный комплекс фибриногена в ампуле восстанавливали в 10 мл воды. Сульфат протамина, находившийся в ампуле, восстанавливали в 10 мл воды. В образцы добавляли сульфат протамина с концентрацией 10 мг/мл. Таким образом, получали растворимые комплексы мономеров во всех трех препаратах.- 11005977 Пример 10. В данном эксперименте облучали лиофилизированные факторы VII, VIII и IV. Способ. Образцы помещали в установку Gamacell 220 и облучали различными суммарными дозами при мощности дозы облучения приблизительно 1 кГр/ч. Результаты. Фактор VII сохранял 67% активности при 20 кГр и 75% при 10 кГр. Фактор VIII сохранял 77% активности при 20 кГр и 88% при 10 кГр. Подобным образом фактор IV показал уровень активности 70% при 20 кГр и 80% при 10 кГр. У трех факторов были превосходные результаты. До настоящего времени никому не удавалось достигнуть таких результатов облучения факторов при комнатной температуре при таких высоких дозах облучения с такой низкой потерей активности. Эти данные полностью противоположны данным, полученным Kitchen, et al., Effect of Gamma Irradiation on the Human Immunodeficiency Virus and Human Coagulation Proteins, Vox Sang 56:223-229 (1989), которые показали, что способ облучения лиофилизированных концентратов не сохраняет их жизнеспособность. Аналогично, Hiemstra, et al., Inactivation ofhuman immunodeficiency virus by gamma radiation and its effect on plasma and coagulation factors, Transfusion 31:32-39 (1991), также пришли к выводу о том, что гамма-облучение должно быть исключено как способ стерилизации плазмы и производных плазмы, так как при облучении дозами радиации, сохраняющими приемлемое восстановление биологической активности компонентов плазмы, наблюдается лишь небольшое снижение вирусной инфекционности. Пример 11. В этом эксперименте эритроциты крови облучали дозой излучения мощностью 0,5 кГр/ч в период времени от 7,5 до 90 мин для удаления бактериальных примесей. Способ. Эритроциты из крови здорового донора переносили в ЭДТА, промывали 3 раза раствором CPD и ресуспендировали в DPC с получением основного разведения 1:20 от начального объема крови. Клеточную суспензию затем делили на 14 пробирок. К семи пробиркам добавляли приблизительно 1,0104Staphylococcus epicermidia. Клетки помещали на лед для транспортировки к месту проведения облучения. Все образцы помещали в камеру с комнатной температурой и облучали при 0,5 кГр/ч в период времени для получения общих доз 0,625, 0,125, 0,250, 0,375, 0,500 и 0,750 кГр соответственно. После истечения каждого периода времени образцы убирали из камеры, встряхивали и помещали на лед для транспортировки либо в микробиологическую лабораторию, либо в гематологическую лабораторию для анализа. Результаты. Результаты микробиологических исследований представлены в табл. 10. Таблица 10 Таким образом, доза 0,75 кГр дает 4,5 lоg10 снижение бактериальной жизнеспособности. Это означает значительное обеспечение сохранности факторов крови. Кроме того, значение D10 составляет приблизительно 0,125 кГр, что соответствует значениям, представленным в литературе для подобных штаммов стафилококка (В.A. Bridges, The effect of N-Ethylmaleimide on the radiation sensitivity of bacteria, J.aureus by p-hydroxybenzoic acid, Int. J, Radiat. Biol. 47:351-356 (1982). С тем чтобы показать, что эритроциты крови остаются жизнеспособными после облучения, были определены следующие параметры для клеток WBC, нейтрофилов, лимфоцитов, моноцитов, эозинофилов и базофилов. Эти только часть от числа существующих клеток. Все клетки, содержащие ядра, конечно, будут инактивированы при облучении. Другие параметры эритроцитов крови перечислены в табл. 11. Значение метагемоглобина не изменялось по отношению к контрольным образцам даже после облучения дозой радиации 0,75 кГр. Этот эксперимент показывает, что эритроциты могут быть безопасно облучены дозой 0,75 кГр при комнатной температуре с помощью настоящего способа без потери функции клеткой. Пример 12. Этот эксперимент проводили для подтверждения полученных в примере 11 данных и с целью увеличения параметров измерения, используя способ примера 11. Результаты данного эксперимента приведены в табл. 12.(См. табл. 12 ниже). Эти результаты подтверждают данные, полученные ранее, и показывают, что несомненно эритроциты могут быть облучены дозой, достаточной для получения 4,5 lоg10 снижения количества бактерий. Можно предположить, что будущие эксперименты дадут сходные результаты для тромбоцитов. Таким образом, с помощью настоящего способа эритроциты могут быть обработаны без дополнительных манипуляций, или же с помощью крайне незначительных дополнительных манипуляций и без добавления веществ извне, с получением бактериологически безопасного продукта, что сокращает риск дальнейших неблагоприятных реакций у реципиента. Таблица 11 Параметры эритроцитов как функция полученной дозы облучения Таблица 12 Параметры эритроцитов как функция полученной дозы облучения Пример 13. В данном эксперименте оценивали защитные эффекты определенных стабилизаторов,используя лиофилизированные антиинсулиновые моноколональные антитела, облученные 45 кГр низкой дозой гамма-излучения. Анализируемыми стабилизаторами были аскорбат натрия, метионин и липоевая кислота. Способ. В 2-миллилитровых стеклянных пробирках лиофилизировали суммарный объем 0,5 мл, содержащий 50 мкг антиинсулиновых моноклональных антител, 5 мг бычьего сывороточного альбумина (1%) без добавления или с добавлением 50 мМ интересующего стабилизатора. Образцы держали под вакуумом. Образцы облучали гамма-излучением (общая доза 45 кГр, мощность дозы облучения 1,83 кГр/ч, температура 4 С) и затем восстанавливали в воде. Связывающую активность антител независимых парных образцов определяли по стандартному протоколу ELISA: 96-луночную микротитрационную плашку покрывали 2,5 мкг/мл инсулина в качестве антигена и оставляли на ночь. Использовали трехкратные последовательные разведения образцов антиинсулиновых моноклональных антител, начиная с 5 мкг/мл. Конъюгированный с фосфатазой козий антимышиный Ig использовался в концентрации 50 нг/мл. В качестве субстрата использовалась щелочная фосфатаза, производства Sigma 104 в концентрации 1 мг/мл, в буфере DEA. Связывающую активность определяли по поглощению при 405-620 нм.- 13005977 Относительную активность определяли, оценивая изменения в кривой титрования (т.е. концентрацию антител, необходимую для получения того же количества связывания) облученных образцов по сравнению с необлученным образцом примерно при 50% от максимума поглощения для необработанного образца. Результаты. Не содержащие стабилизатора лиофилизированные образцы после облучения 45 кГр гаммаизлучением сохраняли 50% авидность антител. Эти результаты отличаются от результатов предыдущих экспериментов, в которых активность иммуноглобулина после облучения раствора 45 кГр гаммаизлучения практически полностью исчезала. Таким образом, по-видимому снижение остаточного содержания воды путем лиофилизации позволяет существенно защитить собственные белки. Добавление аскорбата натрия позволяло полностью восстановить активность после облучения образца. Как метионин, так и липоевая кислота давали значительное восстановление активности (76-83%) после облучения по сравнению с необлученными образцами. Результаты приведены на фиг. 1 и 2. Пример 14. В этом эксперименте защитные эффекты определенных стабилизаторов оценивали, используя лиофилизированные антиинсулиновые моноклональные антитела, облученные до 45 кГр низкой дозой гамма-излучения. Анализируемыми стабилизаторами были аскорбат натрия, N-ацетилцистеин,глутатион и смеси урат/тролокс и аскорбат/урат/тролокс. Способ. В 3-миллилитровых стеклянных пробирках лиофилизировали суммарный объем 1,0 мл, содержащий 100 мкг антиинсулиновых моноклональных антител, 10 мг бычьего сывороточного альбумина (1%) без добавления или с добавлением 50 мМ интересующего стабилизатора. Образцы держали под вакуумом. Образцы облучали гамма-излучением (общая доза 45 кГр, мощность дозы облучения 1,83 кГр/ч,температура 4 С) и затем восстанавливали в 1,0 мл воды. Связывающую активность антител независимых парных образцов определяли по стандартному протоколу ELISA: Maxisorb плашки покрывали инсулиновыми антителами в количестве 2,5 мкг/мл и оставляли на ночь. Применяли трехкратные последовательные разведения образцов антиинсулиновых моноклональных антител, начиная с 5 мкг/мл. Конъюгированные с фосфотазой козьи антимышиные Ig применяли в концентрации 50 нг/мл. Связывающую активность определяли, оценивая поглощение при 405-620 нм. Относительную защиту оценивали, используя программное обеспечение для анализа параллельных линий (PLA 1,2 от Stegmann Systemberatung). Результаты. Не содержащие стабилизатора лиофилизированные образцы после облучения 45 кГр гаммаизлучением сохраняли 75% авидность антител. Эти результаты отличаются от результатов предыдущих экспериментов, в которых активность иммуноглобулина в растворе после облучения 45 кГр гаммаизлучения практически полностью отсутствовала. Таким образом, по-видимому снижение остаточного количества воды после лиофилизации позволяет существенно увеличить защиту белков. В присутствии аскорбата натрия восстановление увеличивалось на 20%, т.е. после облучения авидность восстанавливалась до 90%. В присутствии остальных стабилизаторов авидность восстанавливалась до 77-84%. Результаты показаны на фиг. 3 А и 3 С. Пример 15. В данном эксперименте определяли защитные эффекты первичной лиофилизации (при которой в продукте сохраняется относительно высокое содержащие влаги) и вторичной лиофилизации(при которой в продукте содержится относительно низкое содержание влаги) на чувствительность моноклональных антител. Способ. В 3-миллилитровых стеклянных пробирках лиофилизировали суммарный объем 1,0 мл, содержащий 100 мкг антиинсулиновых моноклональных антител, 10 мг бычьего сывороточного альбумина (1%),либо в отсутствие стабилизатора, либо с добавлением 100 мМ аскорбата натрия. Образцы хранили под вакуумом. Образцы облучали гамма-излучением (общая доза 45 кГр, мощность дозы облучения от 2,03 до 2,13 кГр/ч, температура 4 С) и затем восстанавливали в 1,0 мл воды. Связывающую активность антител независимых парных образцов определяли по стандартному протоколу ELISA: Maxisorb плашки покрывали 2,5 мкг/мл инсулина в качестве ангигена и оставляли на ночь. Применяли трехкратные последовательные разведения образцов антиинсулиновых моноклональных антител, начиная с 5 мкг/мл. Конъюгированные с фосфатазой козьи антимышиные Ig использовали в концентрации 50 нг/мл. Связывающую активность определяли, оценивая поглощение при 405-620 нм. Результаты. Не содержащие стабилизатора образцы, которые подвергались циклу сушки с низким содержанием влаги, после облучения лучше восстанавливали активность антиинсулиновых моноклональных антител, то есть низкое содержание влаги в отсутствие стабилизатора улучшало восстановление. Однако в присутствии стабилизатора в образцах наблюдалось хорошее восстановление активности антител после облучения 45 кГр независимо от того, подвергался ли образец первичному циклу сушки с высоким содержанием влаги или вторичному циклу сушки с низким содержанием влаги.- 14005977 Результаты данного эксперимента показаны на фиг. 4. Пример 16. В данном эксперименте определяли защитный эффект лиофилизации и/или добавления стабилизатора на активность фактора VIII. Анализируемыми стабилизаторами были аскорбат натрия; урат натрия; тролокс; смеси аскорбат/тролокс; смеси аскорбат/урат/тролокс; смеси урат/тролокс; смеси аскорбат/урат. Способ. Образцы лиофилизировали и держали под вакуумом. Образцы облучали гамма-излучением (общая доза 45 кГр, мощность дозы облучения 1,9 кГр/ч, температура 4 С) и затем восстанавливали в воде. Измерение активности фактора VIII в образцах проводили одностадийным исследованием свертываемости крови, используя автоматический анализатор коагуляции MLA Electra 1400C. Результаты. После облучения лиофилизированных образцов в отсутствие стабилизатора наблюдалось хорошее восстановление активности фактора VIII (69-88% по сравнению с необлученным образцом). В присутствии стабилизатора после облучения наблюдалось такое же восстановление активности фактора VIII (6989% по сравнению с необлученным образцом). Однако комбинирование лиофилизации и стабилизатора обеспечивало активность фактора VIII на уровне от 83 до 90% по сравнению с необлученным контролем (аскорбат натрия + лиофилизация: 90% восстановление; тролокс + лиофилизация: 84% восстановление; урат натрия + лиофилизация: 83% восстановление). Результаты показаны на фиг. 5. Пример 17. В данном эксперименте оценивали защитные эффекты определенных стабилизаторов,используя жидкий или лиофилизированный антитромбин III (ATIII), облученный 25 кГр низкой дозой гамма-излучения. Анализируемым стабилизатором был аскорбат натрия (200 мМ). Способ.ATIII либо облучали самостоятельно, либо в присутствии аскорбата натрия в качестве стабилизатора. Смешивание со стабилизатором проводили одним из следующих способов: (i) смешивали ATIII и стабилизатор в виде жидкости и затем лиофилизировали смесь и хранили под вакуумом или (ii) смешивали ATIII и стабилизатор в виде сухих порошков (т.е. их отдельно лиофилизировали, а потом смешивали). После облучения (общая доза 25 кГр, мощность 1,8 кГр/ч) лиофилизированный порошок антитромбина III (Sigma A 9141, лот 113 Н 9316) + аскорбат натрия восстанавливали водой до концентрации 40 ед/мл. После облучения образцов и жидкий, и восстановленный сухой порошок ATIII (+ аскорбат натрия) разбавляли водой до 20 ед/мл. Готовили растворы тромбина (1 ед/мл) и гепарина (800 ед/мл) в воде. В предварительно охлажденной аналитической 96-луночной плашке делали 2-кратные серийные разведения образцов ATIII. В каждую лунку добавляли гепарин (25 мкл из раствора, содержащего 800 ед/мл) или воду и затем инкубировали при 37 С. Добавляли тромбин (50 мкл раствора, содержащего 1 ед/мл) и затем снова инкубировали при 37 С. Затем добавляли 100 мкл 1600 мкМ тромбина в воде (конечная концентрация тромбина составляла 800 мкМ) и инкубировали при комнатной температуре. После добавления тромбина определяли активность, измеряя поглощение при 405-620 нм за определенное время. Результаты. После облучения 25 кГр низкой дозой гамма-излучения активность по ингибированию тромбина раствора ATIII без стабилизатора полностью пропадала. Однако в присутствии аскорбата натрия активность ATIII после облучения сохранялась на уровне 55-66%. После облучения 25 кГр низкой дозой гамма-излучения сухой порошок ATIII в смеси с сухим порошком стабилизатора терял активность только на 43%. Результаты данного эксперимента представлены на фиг. 6. Пример 18. В данном эксперименте определяли защитный эффект определенных стабилизаторов на активность лиофилизированных антиинсулиновых моноклональных антител. Анализируемыми стабилизаторами были аскорбат натрия; смеси тролокс/урат/аскорбат; N-ацетилцистеин и глутатион. Способ. Антиинсулиновые моноклональные антитела с добавлением 1% альбумина сыворотки человека(HSA) (и, необязательно, 5% сахарозы) лиофилизировали, держали под вакуумом и облучали (общая доза 45 кГр; мощность дозы от 1,83 до 1,88 кГр/ч). Активность связывания антител определяли, используя стандартный протокол ELISA, описанный выше. Результаты. Облучение лиофилизированных антиинсулиновых моноколональных антител с добавлением 1%HSA дозой 45 кГр в среднем приводило к потере авидности приблизительно на 33%. Добавление перечисленных далее стабилизаторов значительно улучшало восстановление активности: 20 мМ аскорбата натрия (100% восстановление);. 200 мкМ тролокс/1,5 мМ урата/20 мМ аскорбата (87% восстановление); 20 мМ N-ацетилцистеин (82% восстановление) и 20 мМ глутатиона (76% восстановление).HSA, приводило в среднем к потере авидности приблизительно на 30% после облучения дозой 45 кГр. Добавление перечисленных далее стабилизаторов значительно улучшало восстановление: 20 мМ аскорбат натрия (88% восстановление); 200 мМ тролокс/1,5 мМ урат/20 мМ аскорбат (84% восстановление); 20 мМ N-ацетилцистеин (72% восстановление) и 20 мМ глутатиона (69% восстановление). Результаты этих экспериментов показаны на фиг. 7-14. Пример 19. В данном эксперименте определяли защитный эффект стабилизаторов (аскорбата натрия) на активность лиофилизированных антиинсулиновых моноклональных антител после облучения образцов дозой облучения с высокой мощностью (30 кГр/ч). Способы. Антиинсулиновые моноклональные антитела лиофилизировали и облучали дозой облучения с мощностью 30 кГр/ч (общая доза 45 кГр). Связывающую активность антител определяли, используя стандартный протокол ELISA, описанный выше. Результаты. Облучение лиофилизированных антиинсулиновых моноклональных антител дозой 45 кГр приводило в среднем к потере активности приблизительно на 32%. Добавление 20 мМ аскорбата натрия давало 85% восстановление по сравнению с необлученным образцом. Результаты показаны на фиг. 15. Пример 20. В данном эксперименте облучали лиофилизированный тромбин в смеси со стабилизатором. Способ. Образцы, облученные дозой с низкой мощностью облучения, облучали при комнатной температуре дозой облучения с мощностью 0,326 кГр/ч до суммарной дозы 45 кГр. Образцы, облученные дозой облучения с высокой мощностью, облучали при комнатной температуре дозой облучения с мощностью 30 кГр/ч до суммарной дозы 45 кГр. После облучения все образцы восстанавливали в 500 мкл 50% раствора глицерина до концентрации 100 ед/мл, а затем разбавляли до 0,5 ед/мл. После этого определяли активность тромбина стандартным хромогенным способом, используя субстрат SAR-Pro-Arg-PHK. Значения Vмакс и Km тромбина определяли с помощью Sigma Plot 2000, используя обычное уравнение подходящей равносторонней гиперболы для каждого среднего набора данных. Также определяли активность тромбина, используя время свертывания крови, определяемое на анализаторе MLA 1400C. Результаты. Подсчитанный Vmax тромбина, облученного 30 кГр/ч при комнатной температуре, составлял 0,216 по сравнению с Vмакс необлученного контрольного образца, составляющим 0,287, и показал 77% восстановление активности тромбина. Подсчитанный Vmax тромбина, облученного мощностью 0,326 кГр/ч при комнатной температуре,составлял 0,189 по сравнению с Vмакс необлученного контрольного образца, составляющим 0,264, и показал 72% восстановление активности тромбина. Время свертывания крови, полученное на образцах,облученных низкой дозой, составляло 74% относительной эффективности по сравнению с необлученным контрольным образцом. Результаты данного эксперимента показаны на фиг. 16. Пример 21. В данном эксперименте крысиные моноклональные антитела IgM, специфические в отношении мышиных IgG3, облучали дозой облучения при низкой мощности в присутствии или в отсутствие стабилизатора. Способ. Жидкое крысиное моноклональное антитело IgM против мышиного антитела IgG3 (в РВS-буфере с 10 мМ азида натрия; концентрация антител составляла 666 нг/мкл) облучали дозой облучения с мощностью 1,8 кГр/ч до общей дозы либо 10 кГр, либо 45 кГр. Образцы либо не содержали стабилизатор, либо содержали смесь стабилизаторов, состоящую из 20 мМ цитрата, 300 мкМ урата и 200 мМ аскорбата. Активность антител анализировали по стандартному протоколу ELISA, используя мышиные IgG3 в качестве покрывающего антигена и конъюгированное с фосфатазой антитело, распознающее антикрысиный IgМ. Результаты. После облучения как 10 кГр, так и 45 кГр гамма-излучением жидкие образцы, не содержащие стабилизатора, теряли всю свою функциональную активность антител. Присутствие смеси стабилизаторов,однако, давало полное восстановление активности после облучения 10 кГр гамма-излучением и 88% восстановление активности после облучения 45 кГр гамма-излучением. Результаты данного эксперимента графически показаны на фиг. 17. Пример 22. В данном эксперименте лиофилизированные и жидкие образцы альбумина облучали гамма-излучением.- 16005977 Способ. Образцы облучали общей дозой гамма-излучения либо в 10 кГр, либо в 40 кГр. После облучения лиофилизированные образцы восстанавливали в 1,1 мл аналитического буфера (50 мМ Tris, pH 8,8; 50 мМ NaCl; 0,1% PEG 8000). Образцы (лиофилизированные и жидкие) анализировали с помощью эксклюзионной хроматографии по размеру молекул (TSK гель G4000SWx1 30 см х 7,8 мм; буфер для элюирования 0,1 М фосфата натрия рН 6,5/0,1 М сульфата натрия; скорость потока 1 мл/мин) с УФ-защитной системой, установленной на 280 нм. Результаты. В жидких или лиофилизированных образцах альбумина, облученных общей дозой 10 кГр гаммаизлучения, деградации продуктов не наблюдалось. Хотя небольшая деградация продуктов наблюдалась в жидких образцах альбумина, облученных общей дозой 40 кГр гамма-излучения, в лиофилизированных образцах, облученных общей дозой 40 кГр гамма-излучения, деградации не наблюдали. Результаты хроматографии данного эксперимента показаны на фиг. 18. Пример 23. В данном эксперименте измеряли чувствительность прионов (агенты трансмиссивной спонгиоформной энцефалопатии) к ионизирующей радиации при низкой мощности дозы. Способ. К 29,7 мл альбумина в 50-миллиметровой полипропиленовой пробирке добавляли 0,3 мл физиологического раствора, забуференного фосфатом, содержащего 10% гомогената (содержимое мозга золотистых сирийских хомячков в завершающей стадии скрейпи инфекции). Образцы облучали общей дозой либо 30 кГр или 55 кГр (контрольные образцы не облучали). Зародышам золотистых сирийских хомячков вводили внутрицеребрально 50 мкл неразведенного образца. Всех животных затем оценивали на развитие скрейпи и отмечали появление качающейся походки, остановки роста и завершающуюся стадию заболевания (в этот момент их умерщвляли). Посчитывали дни от инокуляции до появления каждого признака заболевания. Результаты. Облучение более высоким общими дозами (55 кГр) давало отсрочку от тридцати до пятидесяти дней среднего времени инкубации по сравнению с необлученным контролем для любого из трех симптоматических проявлений, что эквивалентно приблизительно 2 log10ID50 снижению в титре патогена. Облучение низкими общими дозами (30 кГр) давало отсрочку от восьми до тринадцати дней времени инкубации, что эквивалентно приблизительно 1 log10ID50 снижению в титре патогена. Эти цифры тем не менее значительно ниже, чем в случае необлученного контроля. Анализ линейной регрессии полученных данных дает в результате 95% доверительный интервал,что указывает на то, что резкое снижение уровней патогена может быть выше, чем 3,5 log10ID50 снижение в титре патогена. Пример 24. В данном эксперименте оценивали защитный эффект лиофилизации и/или наличия стабилизаторов на активность тромбина после облучения 45 кГр гамма-излучения. Способ. Готовили образцы тромбина, содержащие 1% бычьего сывороточного альбумина и лиофилизировали до желаемого уровня влажности. В качестве стабилизаторов в некоторые образцы добавляли аскорбат натрия до концентрации 200 мМ. Все образцы облучали гамма-излучением (общей дозой 45 кГр, мощностью от 2,03 до 2,13 кГр/ч,при 4 С) и измеряли активность тромбина. Результаты. В присутствии стабилизатора в облученных образцах, прошедших первичный цикл лиофилизации,восстанавливалось 67% активности тромбина. Добавление стабилизатора увеличивало восстановление до 86%. Результаты данного эксперимента показаны на фиг. 19. Пример 25. В данном эксперименте оценивали защитные эффекты определенных стабилизаторов,используя жидкие поликлональные антитела IVIG, облученные гамма-излучением до 45 кГр (1,8 кГр/ч). Анализированными стабилизаторами были аскорбат натрия и смесь акскорбата натрия и Nацетилцистеина. Результаты. В облученных образцах, не содержащих стабилизатор, наблюдали следующую потерю активности: 1 log в отношении краснухи; 0,5-0,75 log в отношении свинки; и 1 log в отношении CMV (цитомегаловирус). В облученных образцах, содержащих в качестве стабилизатора аскорбат натрия или смесь аскорбата натрия и N-ацетилцистеина, не было потери активности по сравнению с необлученными контрольными образцами. Результаты данного эксперимента графически представлены на фиг. 20-26. Пример 26. Данный эксперимент предназначен для рассмотрения эффектов рН на восстановление урокиназы (жидкой или лиофилизированной), облученной в присутствии стабилизатора (аскорбат натрия, урат натрия и их смесь).- 17005977 Способ. Урокиназу (1000 ед/мл) смешивали с 200 мМ аскорбата натрия и/или 300 мкМ в присутствии 35 мМ фосфатного буфера с различными показателями рН. Все проанализированные образцы облучали общей дозой гамма-излучения 45 кГр при мощности 2 кГр/ч. Результаты. В лиофилизированных облученных образцах, содержащих аскорбат натрия, восстановление активности урокиназы составляло приблизительно 88-90% в интервале рН от 5,5 до 7,8 включительно. В жидких облученных образцах, содержащих аскорбат натрия, восстановление активности составляло около 65-70% в интервале рН от 5,5 до 7,8. Результаты данного эксперимента графически представлены на фиг. 26. Имея полное описание данного изобретения специалисту в данной области понятно, что способы согласно изобретению могут быть использованы в широком диапазоне условий, композиций и других параметров, не выходя за рамки изобретения или любых его воплощений. Все патенты и публикации,указанные здесь, приведены здесь в качестве ссылки в своем полном объеме. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ снижения уровня активных биологических примесей или патогенов в ткани, причем указанный способ включает в себя(i) добавление к указанной ткани по меньшей мере одного стабилизатора, выбранного из группы,состоящей из аскорбиновой кислоты, аскорбата натрия, маннита, трегалозы, диметилсульфоксида(ii) облучение указанной ткани подходящей дозой гамма-излучения, эффективного для снижения уровня биологически активных примесей или патогенов в указанной ткани. 2. Способ по п.1, где ткань представляет собой твердую ткань. 3. Способ по п.2, где твердая ткань выбрана из группы, состоящей из кости, деминерализованного костного матрикса, костного мозга, связок, бедренной кости, головки бедренной кости или зубов. 4. Способ по п.1, где ткань представляет собой мягкую ткань. 5. Способ по п.4, где мягкая ткань выбрана из группы, состоящей из связок, сухожилий, нервов,кожных трансплантатов, сердечных клапанов, хряща, роговицы, артерий, вен или органов. 6. Способ по п.5, где орган предназначен для трансплантации. 7. Способ по п.6, где орган выбран из группы, состоящей из сердца, легких, печени, почки, кишечника или поджелудочной железы. 8. Способ по п.1, где в процессе облучения указанная ткань содержится при температуре ниже ее точки замерзания. 9. Способ по п.1, где в процессе облучения указанная ткань содержится в инертной атмосфере. 10. Способ по п.9, где в процессе облучения указанная ткань содержится под вакуумом. 11. Ткань, облученная одним из способов по пп.1-10. 12. Способ снижения уровня активных биологических примесей или патогенов в белковом образце,причем указанный способ включает в себя(i) добавление к указанному белковому образцу по меньшей мере одного стабилизатора, выбранного из группы, состоящей из аскорбиновой кислоты, маннита, трегалозы, диметилсульфоксида (ДМСО),диметилтиомочевины, глутатиона, липоевой кислоты, 6-гидрокси-2,5,7,8-тетраметилхроман-2 карбоновой кислоты (Тролокс), мочевой кислоты, альбумина, гистидина, N-ацетилцистеина, триптофана,N-ацетилтриптофана, метионина или N-трет-бутил-альфа-фенилнитрона; и(ii) облучение указанного белкового образца подходящей дозой гамма-излучения, эффективного для снижения уровня биологически активных примесей или патогенов в указанном белковом образце. 13. Способ по п.12, где в процессе облучения указанный белковый образец содержится при температуре ниже его точки замерзания. 14. Способ по п.12, где в процессе облучения указанный белковый образец содержится в инертной атмосфере. 15. Способ по п.14, где в процессе облучения указанный белковый образец содержится под вакуумом. 16. Способ по п.12, где указанный белковый образец содержит один или более белков. 17. Способ по п.16, где белок представляет собой антитело, иммуноглобулин, гормон, фактор роста,антикоагулянт, фактор свертывания или белок комплемента. 18. Способ по п.17, где фактор свертывания выбран из группы, состоящей из тромбина, фактора II,фактора V, фактора VII, фактора VIIa, фактора VIII, фактора IX, фактора X, фактора XIII, фактора XIIIa,фактора фон Виллебранда, фибрина и фибриногена.- 18005977 19. Способ по п.17, где антитела представляют собой поликлональные или моноклональные антитела или их смеси. 20. Способ по п.19, где иммуноглобулины представляют собой иммуноглобулин G, иммуноглобулин М или их смеси. 21. Способ по п.16, где белок выбран из группы, состоящей из белка С, белка S, альфа-1 антитрипсина (ингибитора альфа-1-протеазы), гепарина, инсулина, бутилхолинэстеразы, варфарина,стрептокиназы, тканевого активатора плазминогена (ТРА), эриторопоэтина (ЕРО), урокиназы, нейпогена,антитромбина-3, альфа-глюкозидазы и альбумина. 22. Способ по п.16, где белок продуцируется рекомбинантными методами. 23. Белковый образец, облученный любым из способов по пп.12-22. 24. Белок, облученный любым из способов по пп.12-22. 25. Способ снижения уровня активных биологических примесей или патогенов в сыворотке или плазме, причем указанный способ включает в себя(i) добавление к указанной сыворотке по меньшей мере одного стабилизатора, выбранного из группы, состоящей из аскорбиновой кислоты, аскорбата натрия, маннита, трегалозы, диметилсульфоксида(ii) облучение указанной сыворотки подходящей дозой гамма-излучения, эффективного для снижения уровня биологически активных примесей или патогенов в указанной сыворотке. 26. Способ по п.25, где указанная сыворотка представляет собой эмбриональную бычью сыворотку. 27. Способ по п.25, где в процессе облучения указанная сыворотка содержится при температуре ниже ее точки замерзания. 28. Способ по п.25, где в процессе облучения сыворотка содержится в инертной атмосфере. 29. Способ по п.28, где в процессе облучения сыворотка содержится под вакуумом. 30. Сыворотка, облученная любым из способов по пп.25-29. 31. Способ по пп.1, 12 или 25, где уровень указанного излучения приблизительно составляет по меньшей мере от 3,0 кГр/ч приблизительно по меньшей мере до 45 кГр/ч. 32. Способ по пп.1, 12 или 25, где концентрация стабилизатора составляет по меньшей мере 20 мМ. 33. Способ по пп.1, 12 или 25, где концентрация стабилизатора составляет по меньшей мере 50 мМ. 34. Способ по пп.1, 12 или 25, где концентрация стабилизатора составляет по меньшей мере 100 мМ. 35. Способ по пп.1, 12 или 25, где концентрация стабилизатора составляет по меньшей мере 200 мМ. 36. Способ по пп.1, 12 или 25, где комбинацию двух или более стабилизаторов добавляют к указанной ткани, белковому образцу или сыворотке. 37. Способ по п.1 или 12, где ткань или белковый образец содержит один или более остаточных растворителей. 38. Способ по п.37, где остаточным растворителем является вода. 39. Способ по п.37, где остаточным растворителем является органический растворитель. 40. Способ по п.39, где органический растворитель выбран из группы, состоящей из этанола, изопропанола и полиэтиленгликоля. 41. Способ по п.37, где остаточное содержание растворителя снижается при лиофилизации. 42. Способ по п.41, где остаточное содержание растворителя составляет менее 8,0%. 43. Способ по п.41, где остаточное содержание растворителя составляет менее 6,0%. 44. Способ по п.41, где остаточное содержание растворителя составляет менее 1,0%. 45. Способ по п.41, где остаточное содержание растворителя составляет менее 0,5%. 46. Способ по пп.1, 12 или 25, где ткань, белковый образец или сыворотку облучают в течение времени, достаточного для снижения уровня одного или более биологических примесей в ткани, белковом образце или сыворотке.
МПК / Метки
МПК: A61L 2/08
Метки: способы, материалов, биологических, стерилизации
Код ссылки
<a href="https://eas.patents.su/30-5977-sposoby-sterilizacii-biologicheskih-materialov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы стерилизации биологических материалов</a>
Предыдущий патент: Хинолинил и бензотиазолил ppar-гамма модуляторы
Следующий патент: Добыча нефти и газа с применением внутрискважинного отделения и повторного закачивания газа
Случайный патент: Одноразовый шприц












