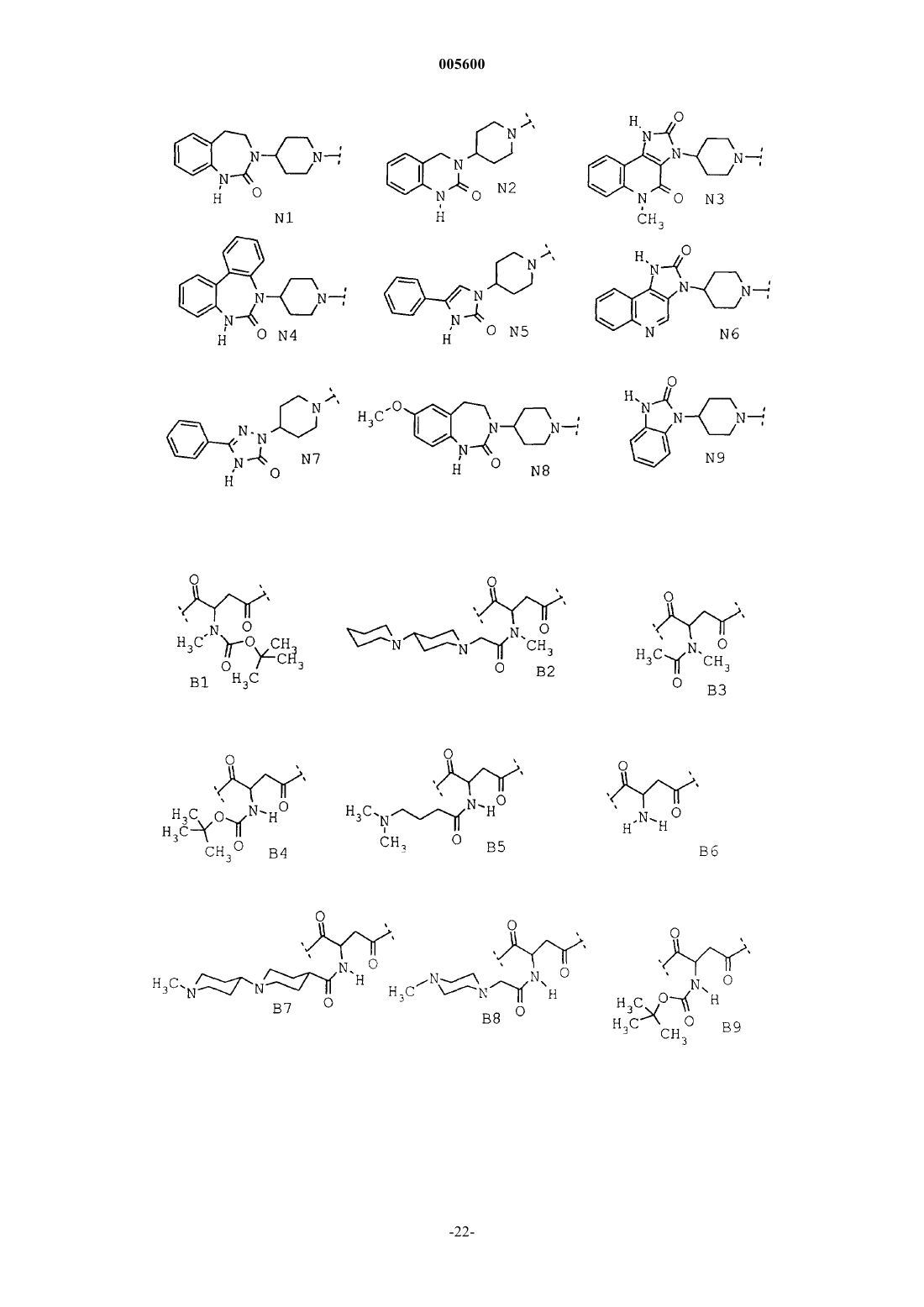
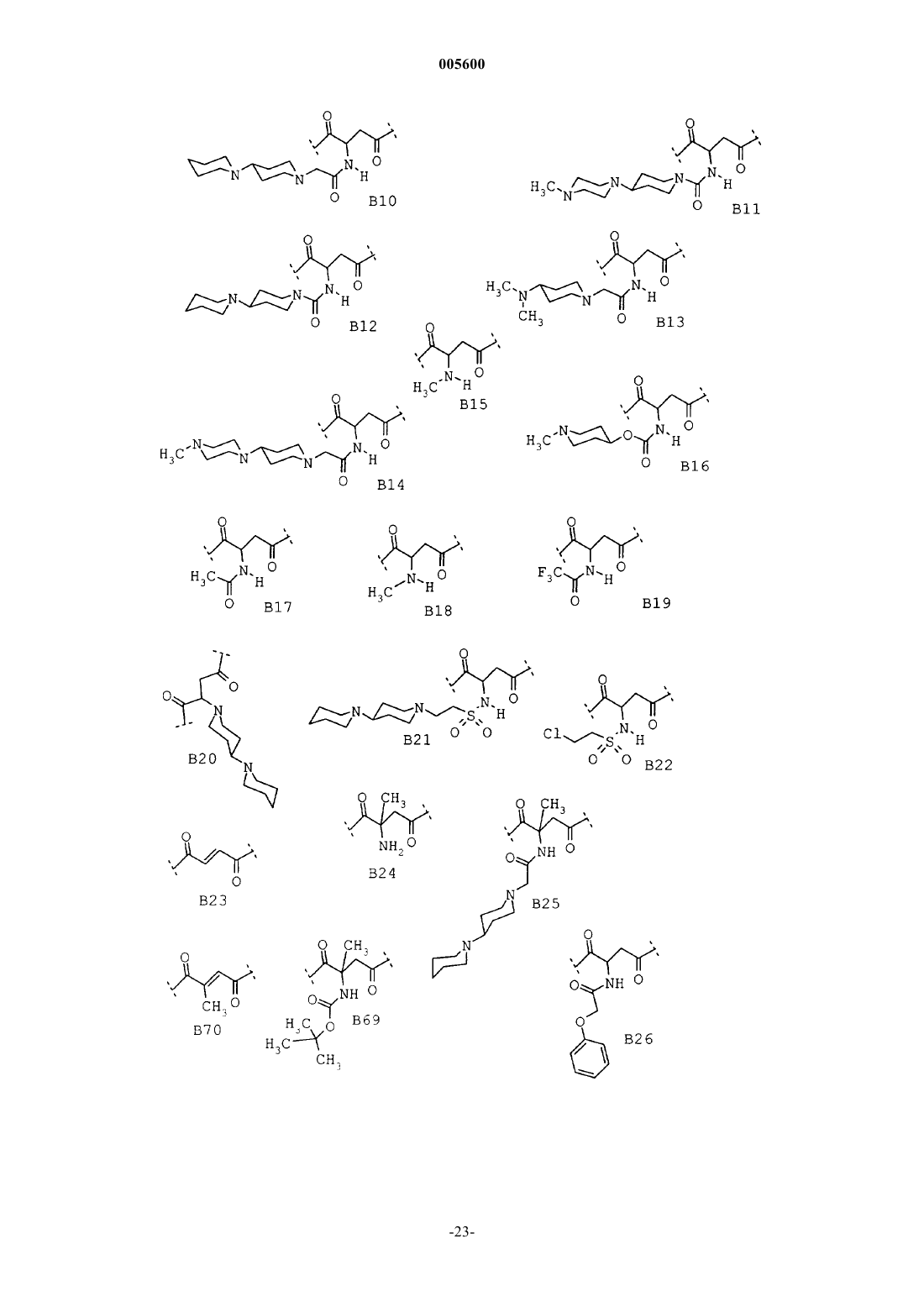
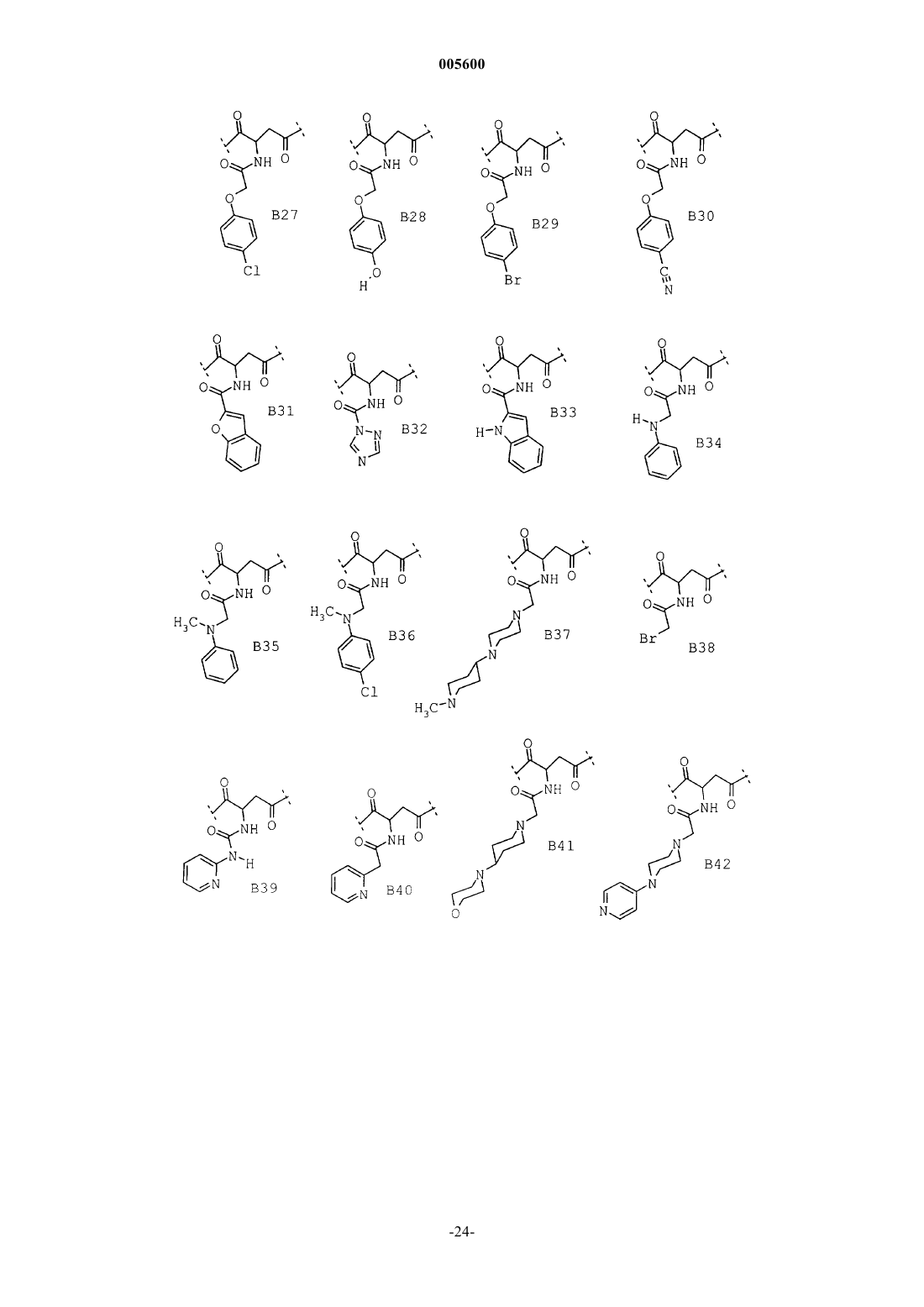
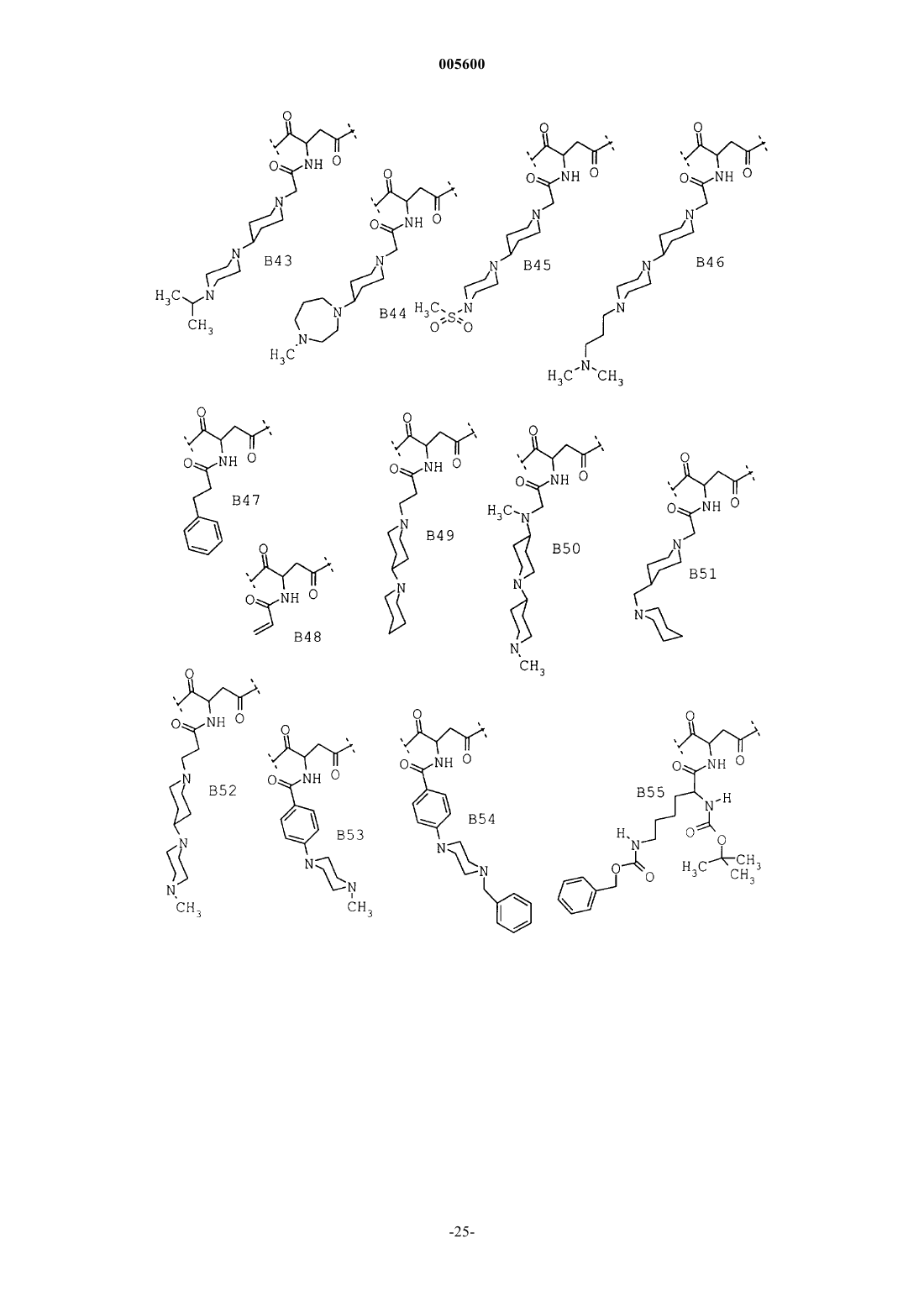
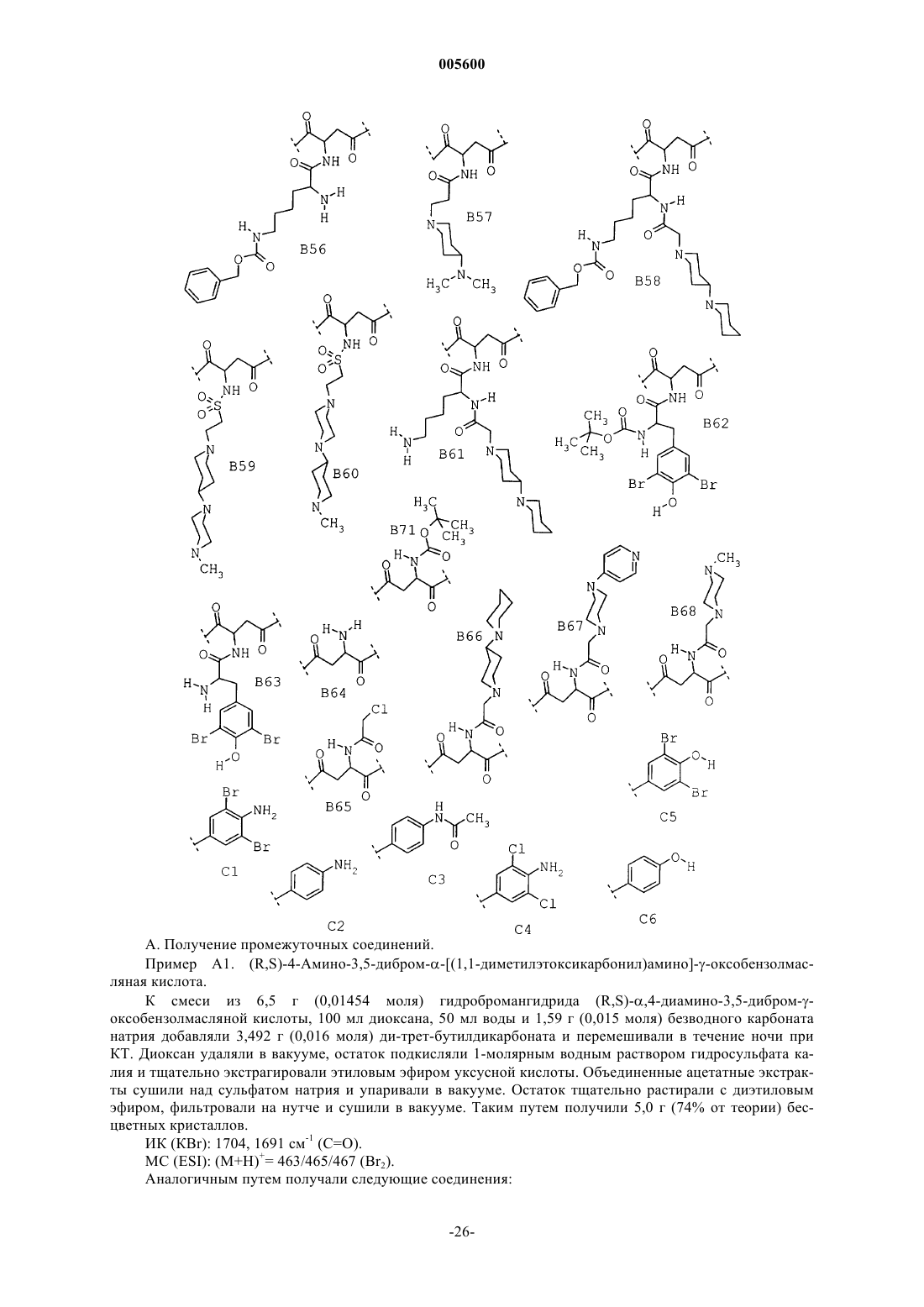
Замещенные пиперидины, содержащие эти соединения лекарственные средства и способ их получения
Номер патента: 5600
Опубликовано: 28.04.2005
Авторы: Додс Хенри, Рудольф Клаус, Эберлайн Вольфганг, Бауер Эккхарт, Хурнаус Рудольф, Дрейер Александер, Мюллер Штефан Георг
Формула / Реферат
1. Замещенные пиперидины общей формулы
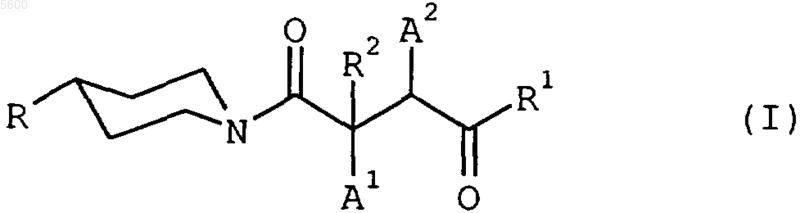
в которой
R означает однократно ненасыщенный 5-7-членный диаза- или триазагетероцикл,
при этом вышеуказанные гетероциклы присоединены через атом азота, содержат карбонильную группу, смежную с атомом азота, и дополнительно могут быть замещены у атома углерода фенилом, и одна или две олефиновые двойные связи одного из вышеуказанных ненасыщенных гетероциклов могут быть сконденсированы с бензольным или хинолиновым кольцом, либо с необязательно замещенным у атома азота метилом 2(1H)-оксохинолиновым кольцом, причем содержащиеся в R фенильные группы, а также сконденсированные с бензольным кольцом гетероциклы дополнительно могут быть моно-, ди- или тризамещены в углеродном скелете атомами фтора, хлора или брома, метильными, метокси-, трифторметильными, гидрокси-, циано- или трифторметоксигруппами, при этом заместители могут быть одинаковыми или различными, предпочтительно, однако, являются незамещенными или монозамещенными атомом фтора, хлора или брома, метилом или метоксигруппой,
R1 означает необязательно моно-, ди- или тризамещенный атомами фтора, хлора или брома, метильными, метокси-, трифторметильными, гидрокси- или аминогруппами фенил, при этом заместители могут быть одинаковыми или различными,
R2 означает атом водорода или метил и
один из остатков A1 и A2 означает атом водорода, а другой означает амино- или метиламиногруппу, [1,4']бипиперидинил-1'-ильную группу либо группу формулы

в которой
R3 представляет собой атом водорода или метил,
Z представляет собой карбонил или сульфонил и
R4 представляет собой разветвленную или неразветвленную C1-5алкоксигруппу, необязательно замещенный 1-метил-4-пиперидинильной, 4-метил-1-пиперазинильной или 1-пиперидинильной группой 1- либо 4-пиперидинильный остаток, 1-метил-4-пиперидинилоксиостаток, 2-пиридиниламино-, бензо[b]фуран-2-ильную, 1,2,4-триазол-1-ильную или 1H-индол-2-ильную группу, необязательно замещенный 4-метил-1-пиперазинильным или 4-фенилметил-1-пиперазинильным остатком фенил или же имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который
в w -положении замещен амино-, фенильной, 2-пиридинильной, фенокси-, фениламино-, фенилметоксикарбониламино- или N-метилфениламиногруппой, диметиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-метилгексагидро-1H-1,4-диазепин-1-ильной, 4-метил-1-пиперазинильной, 4-метилэтил-1-пиперазинильной, 4-(метилсульфонил)-1-пиперазинильной, 4-(3-диметиламинопропил)-1-пиперазинильной, (2-диметиламиноэтил)-1-пиперазинильной, 1-метил-4-пиперидинильной или 1-пиперидинильной группой 1-пиперидинильным или 1-пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком или
в a-положении замещен амино-, трет-бутоксикарбониламино- или {{{[1,4']бипиперидинил-1'-ил}ацетил}амино}группой либо в w-положении замещен амино-, фенильной или фенилметоксикарбониламиногруппой, а в a -положении замещен амино-, трет-бутоксикарбониламино- или {{{[1,4']бипиперидинил-1'-ил}ацетил}амино}группой, при этом вышеуказанные алкильные группы или содержащиеся в вышеуказанных остатках алкильные группы содержат, если не указано иное, от 1 до 4 атомов углерода и могут быть разветвленными или неразветвленными, а вышеуказанные ароматические и гетероароматические остатки дополнительно могут быть моно-, ди- или тризамещены атомами фтора, хлора или брома, циано- или гидроксигруппами, их таутомеры, их диастереомеры, их энантиомеры и их соли.
2. Соединения общей формулы I по п.1, в которой R означает 3,4-дигидро-2(1H)-оксохиназолин-3-ил, 1,3-дигидро-4-фенил-2H-2-оксоимидазол-1-ил, 2,4-дигидро-5-фенил-3(3H)-оксо-1,2,4-триазол-2-ил, 1,3-дигидро-2(2H)-оксоимидазо[4,5-c]хинолин-3-ил, 1,3,4,5-тетрагидро-2-оксо-1,3-бензодиазепин-3-ил, 1,3-дигидро-5-метил-2,4(2H,5H)-диоксоимидазо[4,5-c]хинолин-3-ил, 5,7-дигидро-6-оксо-1,3-дибензодиазепин-5-ил или 1,3-дигидро-2-оксобензимидазол-1-ил,
при этом вышеуказанные бициклические гетероциклы дополнительно могут быть монозамещены в углеродном скелете метоксигруппой,
R1 означает необязательно моно-, ди- или тризамещенный атомами фтора, хлора или брома, гидрокси- или аминогруппами фенил, при этом заместители могут быть идентичными или различными,
R2 означает атом водорода или метил и
один из остатков A1 и A2 означает атом водорода, а другой означает амино- или метиламиногруппу, [1,4']бипиперидинил-1'-ильную группу либо группу формулы
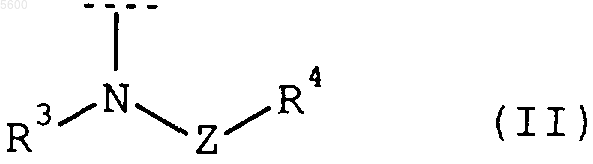
в которой
R3 представляет собой атом водорода или метил,
Z представляет собой карбонил или сульфонил и
R4 представляет собой разветвленную или неразветвленную C1-4алкоксигруппу, необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1-пиперазинилом или 1-пиперидинилом 1- либо 4-пиперидинильный остаток, 1-метил-4-пиперидинилоксиостаток, 2-пиридиниламино-, бензо[b]фуран-2-ильную, 1,2,4-триазол-1-ильную или 1H-индол-2-ильную группу, необязательно замещенный 4-метил-1-пиперазинилом или 4-фенилметил-1-пиперазинилом фенил или же имеющий от 1 до 7, предпочтительно от 1 до 5 атомов углерода, разветвленный или неразветвленный алкильный остаток, который в w -положении замещен амино-, 2-пиридинильной, фенокси-, фениламино-, фенилметоксикарбониламино- или N-метилфениламиногруппой, диметиламиногруппой, необязательно замещенным фенильной, 4-пиридинильной, диметиламино-, 4-морфолинильной, 4-метилгексагидро-1H-1,4-диазепин-1-ильной, 4-метил-1-пиперазинильной, 4-(метилсульфонил)-1-пиперазинильной, 4-(3-диметиламинопропил)-1-пиперазинильной, 1-метил-4-пиперидинильной или 1-пиперидинильной группой 1-пиперидинильным или 1-пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком или
в w-положении замещен амино-, фенильной или фенилметоксикарбониламиногруппой, а в a-положении замещен амино-, трет-бутоксикарбониламино- или {{{[1,4']бипиперидинил-1'-ил}ацетил} амино}группой,
при этом вышеуказанные алкильные группы или содержащиеся в вышеуказанных остатках алкильные группы содержат, если не указано иное, от 1 до 4 атомом углерода и могут быть разветвленными или неразветвленными, а вышеуказанные ароматические и гетероароматические остатки дополнительно могут быть моно-, ди- или тризамещены атомами фтора, хлора или брома, циано- или гидроксигруппами, их таутомеры, их диастереомеры, их энантиомеры и их соли.
3. Соединения общей формулы I по п.1 из группы, включающей
(1) (R,S)-4-(4-амино-3,5-дибромфенил)-2-[(1,1-диметилэтоксикарбонил)метиламино]-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(2) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{[1,4']бипиперидинил-1'-ил}ацетил}метиламино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(3) (R,S)-2-[(ацетил)метиламино]-4-(4-амино-3,5-дибромфенил)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(4) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[1,4-дигидро-2(2H)-оксохиназолин-3-ил]-1-пиперидинил}-2-[(1,1-диметилэтоксикарбонил)амино]-1,4-бутандион,
(5) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[1,4-дигидро-2(2H)-оксохиназолин-3-ил]-1-пиперидинил}-2-{[4-(диметиламино)-1-оксобутил]амино}-1,4-бутандион,
(6) (R,S)-2-амино-4-(4-аминю-3,5-дибромфенил)-1-{4-[1,4-дигидро-2(2H)-оксохиназолин-3-ил]-1-пиперидинил}-1,4-бутандион,
(7) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[1,4-дигидро-2(2H)-оксохиназолин-3-ил]-1-пиперидинил}-2-{{{1'-метил-[1,4']бипиперидинил-4-ил}карбонил}амино}-1,4-бутандион,
(8) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[1,4-дигидро-2(2H)-оксохиназолин-3-ил]-1-пиперидинил}-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1,4-бутандион,
(9) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[5-метил-2,4-диоксо-2,3,4,5-тетрагидро-1H-имидазо[4,5-c]хинолин-3-ил]-1-пиперидинил}-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1,4-бутандион,
(10) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[5,7-дигидро-6(6H)-оксодибензо[d,f][1,3]диазепин-5-ил]-1-пиперидинил}-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1,4-бутандион,
(11) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[1,3-дигидро-2(2H)-оксо-4-фенил-1-имидазолил]-1-пиперидинил}-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1,4-бутандион,
(12) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[1,3-дигидро-2(2H)-оксоимидазо[4,5-c]хинолин-3-ил]-1-пиперидинил}-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1,4-бутандион,
(13) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[1,4-дигидро-5(5H)-оксо-3-фенил-[1,2,4]триазол-1-ил]-1-пиперидинил}-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1,4-бутандион,
(14) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[7-метокси-2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1,4-бутандион,
(15) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(16) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[2(2H)-оксо-1,3-дигидробензимидазол-1-ил]-1-пиперидинил}-2-{[(4-метил-1-пиперазинил)ацетил]амино}-1,4-бутандион,
(17) (R,S)-4-(4-амино-3,5-дибромфенил)-2-[(1,1-диметилэтоксикарбонил)амино]-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(18) (R,S)-2-амино-4-(4-амино-3,5-дибромфенил)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(19) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{[1,4']бипиперидинил-1'-ил}ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(20) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[4-(4-метил-1-пиперазинил)-1-пиперидинил]карбонил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(21) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{[1,4']бипиперидинил-1'-ил}карбонил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(22) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[4-(диметиламино)-1-пиперидинил]ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(23) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[4-(4-метил-1-пиперазинил)-1-пиперидинил]ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(24) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[(1-метил-4-пиперидинил)окси]карбонил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(25) (R,S)-2-(ацетиламино)-4-(4-амино-3,5-дибромфенил)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(26) (R,S)-4-(4-амино-3,5-дихлорфенил)-2-{{{[1,4']бипиперидинил-1'-ил}ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(27) (R,S)-4-(4-амино-3,5-дихлорфенил)-2-{{[4-(4-метил-1-пиперазинил)-1-пиперидинил]ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(28) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{[1,4']бипиперидинил-1'-ил}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(29) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{2-{[1,4']бипиперидинил-1'-ил}этил}сульфонил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(30) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{[1,4']бипиперидинил-1'-ил}ацетил}амино}-2-метил-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(31) (R,S)-4-(4-амино-3,5-дибромфенил)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-2-(феноксиацетиламино)-1,4-бутандион,
(32) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(4-хлорфеноксиацетиламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(33) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(4-гидроксифеноксиацетиламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(34) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(4-бромфеноксиацетиламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(35) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(4-цианофеноксиацетиламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(36) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(бензо[b]фуран-2-карбониламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(37) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(1,2,4-триазол-1-карбониламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(38) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(1H-индол-2-карбониламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(39) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(фениламиноацетиламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(40) (R,S)-4-(4-амино-3,5-дибромфенил)-2-[(N-метилфениламино)ацетиламино]-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(41) (R,S)-4-(4-амино-3,5-дибромфенил)-2-[(N-метил-4-хлорфениламино)ацетиламино]-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(42) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[4-(1-метил-4-пиперидинил)-1-пиперазинил]ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(43) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(2-пиридинилацетиламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(44) (R,S)-4-(4-амино-3,5-дибромфенил)-2-(2-пиридиниламинокарбониламино)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(45) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[4-(4-морфолинил)-1-пиперидинил]ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(46) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[4-(4-пиридинил)-1-пиперазинил]ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(47) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{4-[4-(1-метилэтил)-1-пиперазинил]-1-пиперидинил}ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(48) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[4-(гексагидро-4-метил-1H-1,4-диазепин-1-ил)-1-пиперидинил]ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(49) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{4-[4-(метилсульфонил)-1-пиперазинил]-1-пиперидинил}ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(50) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{4-[4-(3-диметиламинопропил)-1-пиперазинил]-1-пиперидинил}ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(51) (R,S)-4-(4-амино-3,5-дибромфенил)-2-[(1-оксо-3-фенилпропил)амино]-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(52) (R,S)-4-(4-аминю-3,5-дибромфенил)-2-{{3-{[1,4']бипиперидинил-1'-ил}-1-оксопропил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(53) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{N-метил-N-{1'-метил-[1,4']бипиперидинил-4-ил}амино}ацетил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(54) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{[4-(1-пиперидинилметил)-1-пиперидинил]ацетил} амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(55) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{3-[4-(4-метил-1-пиперазинил)-1-пиперидинил]-1-оксопропил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(56) (R,S)-4-(4-амино-3,5-дибромфенил)-2-[4-(4-метил-1-пиперазинил)бензоиламино]-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(R,S)-4-(4-амино-3,5-дибромфенил)-2-[4-(4-фенилметил-1-пиперазинил)бензоиламино]-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(58) 4-(4-амино-3,5-дибромфенил)-2-{[2-(1,1-диметилэтоксикарбониламино)-1-оксо-6-(фенилметоксикарбониламино)гексил]амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(59) 4-(4-амино-3,5-дибромфенил)-2-{[2-амино-1-оксо-6-(фенилметоксикарбониламино)гексил] амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(60) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{3-[4-(диметиламино)-1-пиперидинил]-1-оксопропил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(61) 4-(4-амино-3,5-дибромфенил)-2-{[2-{{{[1,4']бипиперидинил-1'-ил}ацетил}амино}-1-оксо-6-(фенилметоксикарбониламино)гексил]амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(62) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{2-[4-(4-метил-1-пиперазинил)-1-пиперидинил]этил}сульфонил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(63) (R,S)-4-(4-амино-3,5-дибромфенил)-2-{{{2-[4-(4-метил-1-пиперидинил)-1-пиперазинил]этил}сульфонил}амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(64) 2-{[6-амино-2-{{{[1,4']бипиперидинил-1'-ил}-ацетил}амино}-1-оксогексил]амино}-4-(4-амино-3,5-дибромфенил)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(65) 4-(4-амино-3,5-дибромфенил)-2-{[3-(3,5-дибром-4-гидроксифенил)-2-(1,1-диметилэтоксикарбониламино)-1-оксопропил]амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(66) 2-{[2-амино-3-(3,5-дибром-4-гидроксифенил)-1-оксопропил]амино}-4-(4-амино-3,5-дибромфенил)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(67) (R,S)-3-{{{[1,4']бипиперидинил-1'-ил}ацетил}амино}-4-(3,5-дибром-4-гидроксифенил)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион,
(68) (R,S)-4-(3,5-дибром-4-гидроксифенил)-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-3-{{[4-(4-пиридинил)-1-пиперазинил]ацетил}амино}-1,4-бутандион,
(69) (R,S)-4-(3,5-дибром-4-гидроксифенил)-3-{[(4-метил-1-пиперазинил)ацетил]амино}-1-{4-[2(2H)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил}-1,4-бутандион и их соли.
4. Физиологически приемлемые соли соединений по любому из пп.1-3 с неорганическими или органическими кислотами или основаниями.
5. Лекарственное средство, содержащее соединение по любому из пп.1-3 или физиологически приемлемую соль по п.4, а также необязательно один или несколько инертных носителей и/или разбавителей.
6. Применение соединения по любому из пп.1-4 для получения лекарственного средства, обладающего свойствами CGRP-антагониста.
7. Применение соединения по любому из пп.1-4 для получения лекарственного средства, пригодного для экстренного и профилактического лечения головных болей, для лечения инсулиннезависимого сахарного диабета, сердечно-сосудистых заболеваний, заболеваний кожи, воспалительных заболеваний, аллергического ринита, астмы, заболеваний, обусловленных избыточным расширением сосудов и связанным с этим пониженным кровоснабжением тканей, толерантности к морфию или для устранения приливов в период менопаузы.
8. Способ получения лекарственного средства по п.5, отличающийся тем, что соединение по любому из пп.1-4 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями.
9. Применение соединений общей формулы I по п.1 для получения и очистки антител.
10. Применение меченых соединений общей формулы I по п.1 при радиоиммуноанализе (РИА) и твердофазном иммуноферментном анализе (ELISA) либо в качестве диагностического или аналитического вспомогательного средства в исследовании нейротрансмиттеров.
Текст
005600 Настоящее изобретение относится к новым замещенным пиперидинам общей формулы их таутомерам, их диастереомерам, их энантиомерам, их смесям и их солям, прежде всего их физиологически приемлемым солям, с неорганическими или органическими кислотами или основаниями, к содержащим эти соединения лекарственным средствам, к их применению и к способу их получения. В приведенной выше общей формуле (I)R означает насыщенный, однократно или двукратно ненасыщенный 5-7-членный аза-, диаза-, триаза-, оксаза-, тиаза-, тиадиаза- или S,S-диоксидотиадиазагетероцикл, причем вышеуказанные гетероциклы присоединены через атом углерода или азота и содержат одну или две карбонильные группы, смежные с атомом азота, у одного из атомов азота могут быть замещены алкилом, у одного или двух атомов углерода могут быть замещены алкилом, фенилом, фенилметилом, нафтилом, дифенилилом, пиридинилом,диазинилом, фурилом, тиенилом, пирролилом, 1,3-оксазолилом, 1,3-тиазолилом, изоксазолилом, пиразолилом, 1-метилпиразолилом, имидазолилом или 1-метилимидазолилом, при этом заместители могут быть идентичными или различными, и двойная связь одного из вышеуказанных ненасыщенных гетероциклов может быть сконденсирована с бензольным, пиридиновым, диазиновым, 1,3-оксазольным, тиофеновым, фурановым, тиазольным, пиррольным, N-метилпиррольным или хинолиновым кольцом, с необязательно замещенным у атома азота алкилом 2(1 Н)-оксохинолиновым кольцом или с имидазольным либо N-метилимидазольным кольцом или же две олефиновые двойные связи одного из вышеуказанных ненасыщенных гетероциклов в каждом случае могут быть сконденсированы с бензольным кольцом, причем содержащиеся в R фенильные, пиридинильные, диазинильные, фурильные, тиенильные, пирролильные, 1,3-оксазолильные, 1,3-тиазолильные, изоксазолильные, пиразолильные, 1-метилпиразолильные,имидазолильные или 1-метилимидазолильные группы, а также сконденсированные с бензольным, тиеновым, пиридиновым и диазиновым кольцом гетероциклы дополнительно могут быть моно-, ди- или тризамещены в углеродном скелете атомами фтора, хлора или брома, алкильными, алкокси-, нитро-, алкилтио-, алкилсульфинильными, алкилсульфонильными, алкилсульфониламино-, фенил-, трифторметильными, алкоксикарбонильными, карбокси-, диалкиламино-, гидрокси-, амино-, ацетиламино-, пропиониламино-, аминокарбонильными, алкиламинокарбонильными, диалкиламинокарбонильными, (4 морфолинил)карбонильными, (1-пирролидинил)карбонильными, (1-пиперидинил)карбонильными, (гексагидро-1-азепинил)карбонильными, (4-метил-1-пиперазинил)карбонильными, метилендиокси-, аминокарбониламино-, алканоильными, циано-, трифторметокси-, трифторметилтио-, трифторметилсульфинильными или трифторметилсульфонильными группами, при этом заместители могут быть идентичными или различными,R1 означает фенил, 1-нафтил, 2-нафтил, 1H-индол-3-ил, 1-метил-1H-индол-3-ил, 1-формил-1 Ниндол-3-ил, 4-имидазолил, 1-метил-4-имидазолил, 2-тиенил, 3-тиенил, тиазолил, 1H-индазол-3-ил, 1 метил-1H-индазол-3-ил, бензо[b]фур-3-ил, бензо[b]тиен-3-ил, пиридинил, хинолинил или изохинолинил,при этом вышеуказанные ароматические и гетероароматические остатки дополнительно могут быть моно-, ди- или тризамещены в углеродном скелете атомами фтора, хлора или брома, алкильными группами,циклоалкильными группами с 3-8 атомами углерода, фенилалкильными группами, алкенильными, алкокси-, фенильными, фенилалкокси-, трифторметильными, алкоксикарбонильными, карбокси-, диалкиламино-, нитро-, гидрокси-, амино-, алкиламино-, ацетиламино-, пропиониламино-, метилсульфонилокси-,аминокарбонильными, алкиламинокарбонильными, диалкиламинокарбонильными, алканоильными, циано-, тетразолильными, фенильными, пиридинильными, тиазолильными, фурильными, трифторметокси-,трифторметилтио-, трифторметилсульфинильными или трифторметилсульфонильными группами, причем заместители могут быть идентичными или различными,R2 означает атом водорода или С 1-3 алкил,один из остатков А 1 и А 2 означает атом водорода, а другой означает аминогруппу,[1,4']бипиперидинил-1'-ил или алкиламиногруппу либо группу формулыR3 представляет собой атом водорода или алкильный остаток,Z представляет собой карбонил или сульфонил иR4 представляет собой алкокси-, амино-, алкиламино- или диалкиламиногруппу, необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1-пиперазинилом или пиперидинилом пиперидинильный остаток, 1-метил-4-пиперидинилоксиостаток, пиридиниламино-, бензо[b]фуранильную, 1,2,4-триазол-1 ильную или 1H-индолильную группу, необязательно замещенный 4-алкил-1-пиперазинильным или 4 арилалкил-1-пиперазинильным остатком фенил или же имеющий от 1 до 7 атомов углерода разветвлен-1 005600 ный или неразветвленный алкильный остаток, который в -положении может быть замещен амино-, фенильной, пиридинильной, фенокси-, фениламино-, фенилметоксикарбониламино- или N-алкилфениламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4-диазепин-1-ильной, 4-алкил-1-пиперазинильной,4-(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или пиперидинильной группой пиперидинильным или пиперазинильным остатком, 4 метил-1-пиперазинильным остатком, N-(С 1-3 алкил)-N-(1'-С 1-3 алкил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком и независимо от этого в -положении может быть замещен амино-, трет-алкоксикарбониламино- или [1,4']бипиперидинил-1'-илацетиламино группой,при этом вышеуказанные алкильные и алкенильные группы или содержащиеся в вышеуказанных остатках алкильные группы содержат, если не указано иное, от 1 до 5 атомов углерода и могут быть разветвленными или неразветвленными, а вышеуказанные ароматические и гетероароматические остатки дополнительно могут быть моно-, ди- или тризамещены атомами фтора, хлора или брома, циано- или гидроксигруппами, причем заместители могут быть идентичными или различными. Настоящее изобретение относится также к соответствующим рацематам, если соединения общей формулы I имеют только один хиральный центр. Однако в объем изобретения включены и отдельные диастереомерные пары антиподов или смеси таких антиподов, в виде которых соединения общей формулы (I) могут существовать при наличии у них более одного хирального центра, а также отдельные оптически активные энантиомеры, из которых состоят вышеуказанные рацематы. Соединения общей формулы (I) обладают ценными фармакологическими свойствами, основанными на их селективной активности в качестве CGRP-антагонистов. Другими объектами изобретения являются содержащие эти соединения лекарственные средства, их применение и их получение. К предпочтительным соединениям вышеприведенной общей формулы I относятся соединения, в которыхR означает однократно или двукратно ненасыщенный 5-7-членный аза-, диаза-, триаза- или тиазагетероцикл, при этом вышеуказанные гетероциклы присоединены через атом углерода или азота и содержат одну или две карбонильные группы, смежные с атомом азота, могут быть замещены у атома углерода фенилом, пиридинилом, диазинилом, тиенилом, пирролилом, 1,3-тиазолилом, изоксазолилом, пиразолилом или 1-метилпиразолилом и олефиновая двойная связь одного из вышеуказанных ненасыщенных гетероциклов может быть сконденсирована с бензольным, пиридиновым, диазиновым или хинолиновым кольцом либо с необязательно замещенным у атома азота метилом 2(1 Н)-оксохинолиновым кольцом или же две олефиновые двойные связи одного из вышеуказанных ненасыщенных гетероциклов в каждом случае могут быть сконденсированы с бензольным кольцом, причем содержащиеся в R фенильные, пиридинильные, диазинильные, тиенильные, пирролильные, 1,3-тиазолильные, изоксазолильные, пиразолильные или 1-метилпиразолильные группы, а также сконденсированные с бензольным, пиридиновым и диазиновым кольцом гетероциклы дополнительно могут быть моно-, ди- или тризамещены в углеродном скелете атомами фтора, хлора или брома, алкильными, алкокси-, нитро-, трифторметильными, гидрокси-,амино-, ацетиламино-, ацетильными, циано- или трифторметоксигруппами, при этом заместители могут быть идентичными или различными,R1 означает фенил, 1-нафтил или 2-нафтил, причем указанные ароматические остатки могут моно-,ди- или тризамещены атомами фтора, хлора или брома, разветвленными или неразветвленными алкильными группами, алкокси-, трифторметильными, нитро-, гидрокси-, амино- или ацетиламиногруппами,при этом заместители могут быть идентичными или различными,R2 означает атом водорода или метил, один из остатков А 1 и А 2 означает атом водорода, а другой означает амино-, метиламино- или этиламиногруппу, [1,4']бипиперидинил-1'-ильную группу либо группу формулыR3 представляет собой атом водорода, метил- или этил,Z представляет собой карбонил или сульфонил иR4 представляет собой алкокси-, амино-, алкиламино- или диалкиламиногруппу, необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1-пиперазинилом или 1-пиперидинилом 1- либо 4 пиперидинильный остаток, 1-метил-4-пиперидинилоксиостаток, пиридиниламино-, бензо[b]фуранильную, 1,2,4-триазол-1-ильную или 1H-индолильную группу, необязательно замещенный 4-метил-1 пиперазинилом или 4-фенилметил-1-пиперазинилом фенил или же имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении может быть замещен амино-, фенильной, пиридинильной, фенокси-, фениламино-, фенилметоксикарбониламино- или Nметилфениламиногруппой, диметиламиногруппой, необязательно замещенным фенильной, пиридиниль-2 005600 ной, диметиламино-, 4-морфолинильной, 4-метилгексагидро-1H-1,4-диазепин-1-ильной, 4-метил-1 пиперазинильной, 4-(метилсульфонил)-1-пиперазинильной, 4-(диметиламиноалкил)-1-пиперазинильной,1-метил-4-пиперидинильной или 1-пиперидинильной группой 1-пиперидинильным или 1 пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком и независимо от этого может быть замещен в -положении амино-, трет-бутоксикарбониламино- или [1,4']бипиперидинил 1'-илацетиламино-группой,при этом вышеуказанные алкильные группы или содержащиеся в вышеуказанных остатках алкильные группы содержат, если не указано иное, от 1 до 4 атомов углерода и могут быть разветвленными или неразветвленными, а вышеуказанные ароматические и гетероароматические остатки дополнительно могут быть моно-, ди- или тризамещены атомами фтора, хлора или брома, циано-или гидроксигруппами,причем заместители могут быть идентичными или различными. их таутомеры, их диастереомеры, их энантиомеры и их соли. Более предпочтительными соединениями вышеприведенной общей формулы I являются соединения, в которыхR означает однократно ненасыщенный 5-7-членный диаза- или триазагетероцикл,при этом вышеуказанные гетероциклы присоединены через атом азота, содержат карбонильную группу, смежную с атомом азота, и дополнительно могут быть замещены у атома углерода фенилом и олефиновая двойная связь одного из вышеуказанных ненасыщенных гетероциклов может быть сконденсирована с бензольным или хинолиновым кольцом либо с необязательно замещенным у атома азота метилом 2(1 Н)-оксохинолиновым кольцом или же две олефиновые двойные связи одного из вышеуказанных ненасыщенных гетероциклов в каждом случае могут быть сконденсированы с бензольным кольцом,причем содержащиеся в R фенильные группы, а также сконденсированные с бензольным кольцом гетероциклы дополнительно могут быть моно-, ди- или тризамещены в углеродном скелете атомами фтора, хлора или брома, метальными, метокси-, нитро-, трифторметильными, гидрокси-, амино-, ацетиламино-, ацетильными, циано- или трифторметоксигруппами, при этом заместители могут быть идентичными или различными, предпочтительно, однако, являются незамещенными или монозамещены атомом фтора, хлора или брома, метилом или метоксигруппой,R1 означает необязательно моно-, ди- или тризамещенный атомами фтора, хлора или брома, метильными, метокси-, трифторметильными-, нитро-, гидрокси- или аминогруппами фенил, при этом заместители могут быть идентичными или различными, R2 означает атом водорода или метил и один из остатков А 1 и А 2 означает атом водорода, а другой означает амино- или метиламиногруппу,[1,4']бипиперидинил-1'-ильную группу либо группу формулыR3 представляет собой атом водорода или метил, Z представляет собой карбонил или сульфонил и 4R представляет собой разветвленную или неразветвленную С 1-5 алкоксигруппу, необязательно замещенный 1-метил-4-пиперидинильной, 4-метил-1-пиперазинильной или 1-пиперидинильной группой 1- либо 4-пиперидинильный остаток, 1-метил-4-пиперидинилоксиостаток, 2-пиридиниламино-, бензо[b]фуран-2 ильную, 1,2,4-триазол-1-ильную или 1 Н-индол-2-ильную группу, необязательно замещенный 4-метил-1 пиперазинильным или 4-фенилметил-1-пиперазинильным остатком фенил или же имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении замещен амино-, фенильной, 2-пиридинильной, фенокси-, фениламино-, фенилметоксикарбониламино- или N-метилфениламиногруппой, диметиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-метилгексагидро-1 Н-1,4 диазепин-1-ильной, 4-метил-1-пиперазинильной, 4-(метилсульфонил)-1-пиперазинильной, 4-(3-диметиламинопропил)-1-пиперазинильной, (2-диметиламиноэтил)-1-пиперазинильной, 1-метил-4-пиперидинильной или 1-пиперидинильной группой 1-пиперидинильным или 1-пиперазинильным остатком, 4 метил-1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1 пиперидинилметил)-1-пиперидинильным остатком или в -положении замещен амино-, трет-бутоксикарбониламино- или [1,4']бипиперидинил-1'илацетиламиногруппой либо в -положении замещен амино-, фенильной или фенилметоксикарбониламиногруппой, а в положении замещен амино-, трет-бутоксикарбониламино- или [1,4']бипиперидинил-1'-илацетил аминогруппой, при этом вышеуказанные алкильные группы или содержащиеся в вышеуказанных остатках алкильные группы содержат, если не указано иное, от 1 до 4 атомов углерода и могут быть разветвленными или неразветвленными, а вышеуказанные ароматические и гетероароматические остатки дополнительно могут быть моно-, ди- или тризамещены атомами фтора, хлора или брома, циано- или гидроксигруппами,их таутомеры, их диастереомеры, их энантиомеры и их соли.-3 005600 Наиболее предпочтительными соединениями вышеприведенной общей формулы (I) являются соединения, в которыхR означает 3,4-дигидро-2(1 Н)-оксохиназолин-3-ил, 1,3-дигидро-4-фенил-2 Н-2-оксоимидазол-1-ил,2,4-дигидро-5-фенил-3(3 Н)-оксо-1,2,4-триазол-2-ил, 1,3-дигидро-2(2 Н)-оксоимидазо[4,5-с]хинолин-3-ил,1,3,4,5-тетрагидро-2-оксо-1,3-бензодиазепин-3-ил, 1,3-дигидро-5-метил-2,4(2 Н,5 Н)-диоксоимидазо[4,5-с] хинолин-3-ил, 5,7-дигидро-6-оксо-1,3-дибензодиазепин-5-ил или 1,3-дигидро-2-оксобензимидазол-1-ил,при этом вышеуказанные бициклические гетероциклы дополнительно могут быть монозамещены в углеродном скелете метоксигруппой, R1 означает необязательно моно-, ди- или тризамещенный атомами фтора, хлора или брома, гидрокси- или аминогруппами фенил, при этом заместители могут быть идентичными или различными,R2 означает атом водорода или метил и один из остатков А 1 и А 2 означает атом водорода, а другой означает амино- или метиламиногруппу, [1,4']бипиперидинил-1'-ильную группу либо группу формулыR3 представляет собой атом водорода или метил, Z представляет собой карбонил или сульфонил иR4 представляет собой разветвленную или неразветвленную С 1-4 алкоксигруппу, необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1-пиперазинилом или 1-пиперидинилом 1- либо 4 пиперидинильный остаток, 1-метил-4-пиперидинилоксиостаток, 2-пиридиниламино-, бензо[b]фуран-2 ильную, 1,2,4-триазол-1-ильную или 1 Н-индол-2-ильную группу, необязательно замещенный 4-метил-1 пиперазинилом или 4-фенилметил-1-пиперазинилом фенил или же имеющий от 1 до 7, предпочтительно от 1 до 5 атомов углерода, разветвленный или неразветвленный алкильный остаток, который в положении замещен амино-, 2-пиридинильной, фенокси-, фениламино-, фенилметоксикарбониламиноили N-метилфениламиногруппой, диметиламиногруппой, необязательно замещенным фенильной, 4 пиридинильной, диметиламино-, 4-морфолинильной, 4-метилгексагидро-1 Н-1,4-диазепин-1-ильной, 4 метил-1-пиперазинильной,4-(метилсульфонил)-1-пиперазинильной,4-(3-диметиламинопропил)-1 пиперазинильной, 1-метил-4-пиперидинильной или 1-пиперидинильной группой 1-пиперидинильным или 1-пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N-(1'-метил[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком или в положении замещен амино-, фенильной или фенилметоксикарбониламиногруппой, а в -положении замещен амино-, трет-бутоксикарбониламино- или [1,4']бипиперидинил-1'-илацетиламино-группой,при этом вышеуказанные алкильные группы или содержащиеся в вышеуказанных остатках алкильные группы содержат, если не указано иное, от 1 до 4 атомом углерода и могут быть разветвленными или неразветвленными, а вышеуказанные ароматические и гетероароматические остатки дополнительно могут быть моно-, ди- или тризамещены атомами фтора, хлора или брома, циано- или гидроксигруппами,их таутомеры, их диастереомеры, их энантиомеры и их соли. В качестве примера особо предпочтительных соединений можно назвать следующие:(69) (R,S)-4-(3,5-дибром-4-гидроксифенил)-3-[(4-метил-1-пиперазинил)ацетил]амино-1-4-[2(2 Н)оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил-1,4-бутандион и их соли. Особо следует отметить подгруппу соединений общей формулы (I), в которыхR означает насыщенный, однократно или двукратно ненасыщенный 5-7-членный аза-, диаза-, триаза-, оксаза-, тиаза-, тиадиаза- или S,S-диоксидотиадиазагетероцикл, причем вышеуказанные гетероциклы присоединены через атом углерода или азота и могут содержать одну или две карбонильные группы,смежные с атомом азота, у одного из атомов азота могут быть замещены алкилом, у одного или двух атомов углерода могут быть замещены алкилом, фенилом, фенилметилом, нафтилом, дифенилилом, пиридинилом, диазинилом, фурилом, тиенилом, пирролилом, 1,3-оксазолилом, 1,3-тиазолилом, изоксазолилом, пиразолилом, 1-метилпиразолилом, имидазолилом или 1-метилимидазолилом, при этом заместители могут быть идентичными или различными и двойная связь одного из вышеуказанных ненасыщенных гетероциклов может быть сконденсирована с бензольным, пиридиновым, диазиновым, 1,3 оксазольным, тиофеновым, фурановым, тиазольным, пиррольным, N-метилпиррольным или хинолиновым кольцом, с необязательно замещенным у атома азота алкилом 2(1 Н)-оксохинолиновым кольцом или с имидазольным либо N-метилимидазольным кольцом или же две олефиновые двойные связи одного из вышеуказанных ненасыщенных гетероциклов в каждом случае могут быть сконденсированы с бензольным кольцом, причем содержащиеся в R фенильные, пиридинильные, диазинильные, фурильные, тиенильные, пирролильные, 1,3-оксазолильные, 1,3-тиазолильные, изоксазолильные, пиразолильные, 1 метилпиразолильные, имидазолильные или 1-метилимидазолильные группы, а также сконденсированные с бензольным, тиеновым, пиридиновым и диазиновым кольцом гетероциклы дополнительно могут быть моно-, ди- или тризамещены в углеродном скелете атомами фтора, хлора или брома, алкильными, алкокси-, нитро-, алкилтио-, алкилсульфинильными, алкилсульфонильными, алкилсульфониламино-, фенильными, трифторметильными, алкоксикарбонильными, карбокси-, диалкиламино-, гидрокси-, амино-, ацетиламино-, пропиониламино-, аминокарбонильными, алкиламинокарбонильными, диалкиламинокарбонильными, (4-морфолинил)карбонильными, (1-пирролидинил)карбонильными, (1-пиперидинил)карбонильными, (гексагидро-1-азепинил)карбонильными, (4-метил-1-пиперазинил)карбонильными, метилендиокси-, аминокарбониламино-, алканоил-, циано-, трифторметокси-, трифторметилтио-, трифторметилсульфинильными или трифторметилсульфонильными группами, при этом заместители могут быть идентичными или различными,R1 означает фенил, 1-нафтил, 2-нафтил, 1H-индол-3-ил, 1-метил-1 Н-индол-3-ил, 1-формил-1 Ниндол-3-ил, 4-имидазолил, 1-метил-4-имидазолил, 2-тиенил, 3-тиенил, тиазолил, 1H-индазол-3-ил, 1 метил-1 Н-индазол-3-ил, бензо[b]фур-3-ил, бензо[b]тиен-3-ил, пиридинил, хинолинил или изохинолинил,при этом вышеуказанные ароматические и гетероароматические остатки дополнительно могут быть моно-, ди- или тризамещены в углеродном скелете атомами фтора, хлора или брома, алкильными группами,циклоалкильными группами с 3-8 атомами углерода, фенилалкильными, алкенильными, алкокси-, фенильными, фенилалкокси-, трифторметильными, алкоксикарбонильными, карбокси-, диалкиламино-,нитро-, гидрокси-, амино-, алкиламино-, ацетиламино-, пропиониламино-, метилсульфонилокси-, аминокарбонильными, алкиламинокарбонильными, диалкиламинокарбонильными, алканоильными, циано-,тетразолильными, фенильными, пиридинильными, тиазолильными, фурильными, трифторметокси-,трифторметилтио-, трифторметилсульфинильными или трифторметилсульфонильными группами, причем заместители могут быть идентичными или различными, R2 означает атом водорода,один из остатков А 1 и А 2 означает атом водорода, а другой означает аминогруппу,[1,4']бипиперидинил-1'-ил или алкиламиногруппу либо группу формулуR3 представляет собой атом водорода или алкильный состаток,Z представляет собой карбонил или сульфонил иR4 представляет собой алкокси-, амино-, алкиламино- или диалкиламиногруппу, необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1 пиперазинилом или пиперидинилом пиперидинильный остаток, 1-метил-4-пиперидинилоксиостаток или же имеющий от 1 до 4 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении может быть замещен диалкиламиногруппой, необязательно замещенным диметиламиногруппой, 4-метил-1-пиперазинилом или пиперидинилом пиперидинильным остатком или 4-метил-1 пиперазинильным остатком,при этом вышеуказанные алкильные и алкенильные группы или содержащиеся в вышеуказанных остатках алкильные группы содержат, если не указано иное, от 1 до 5 атомов углерода и могут быть разветвленными или неразветвленными.-7 005600 Соединения общей формулы I получают по методам, которые в принципе известны. Рассмотренные ниже методы зарекомендовали себя как наиболее приемлемые для получения предлагаемых в изобретении соединений общей формулы I. а) В этом варианте для получения соединений общей формулы (I), в которых А 1 и А 2 имеют вышеуказанные значения, за исключением необязательно замещенной алкилом аминогруппы, карбоновую кислоту общей формулы в которой А 1a и А 2a имеют указанные выше для А 1 и А 2 значения, за исключением необязательно замещенной алкилом аминогруппы, a R1 и R2 имеют вышеуказанные значения, подвергают реакции сочетания с соединением общей формулы в которой R имеет вышеуказанные значения. Указанную реакцию сочетания предпочтительно проводить с использованием известных из химии пептидов методов (см., например, Houben-Weyl, Methoden der Organischen Chemie, т. 15/2), при этом используют, например, карбодиимиды, такие как дициклогексилкарбодиимид (ДЦК), диизопропилкарбодиимид (ДИК) или этил(3-диметиламинопропил)карбодиимид, гексафторофосфат либо тетрафтороборатO-(1 Н-бензотриазол-1-ил)-N,N-N',N'-тетраметилурония (ГБТУ, соответственно ТБТУ) или гексафторофосфат 1 Н-бензотриазол-1-илокси-трис-(диметиламино)фосфония (БОФ). Добавление 1-гидроксибензотриазола (ГОБТ) или 3-гидрокси-4-оксо-3,4-дигидро-1,2,3-бензотриазина (ГООБТ) позволяет дополнительно при необходимости подавить возможную рацемизацию, соответственно повысить скорость реакции. Реакции сочетания обычно проводят с использованием эквимолярных количеств подвергаемых сочетанию компонентов, а также агента сочетания в растворителях, таких как дихлорметан, тетрагидрофуран, ацетонитрил, диметилформамид (ДМФ), диметилацетамид (ДМА), N-метилпирролидон (N-МП) или их смеси, при температуре от -30 до +30 С, предпочтительно от -20 до +25 С. При необходимости в качестве дополнительного вспомогательного основания предпочтительно используют Nэтилдиизопропиламин (ДИЭА) (основание Хюнига). Другим пригодным для синтеза соединений общей формулы I методом сочетания является так называемый "ангидридный метод" (см. также М. Bodanszky, "Peptide Chemistry", изд-во Springer-Verlag 1988, с. 58-59; М. Bodanszky, "Principles of Peptide Synthesis", изд-во Springer-Verlag 1984, с. 21-27). Предпочтительным при этом является "метод смешанных ангидридов", проводимый по методикеVaughan (J.R. Vaughan Jr., J. Amer. Chem. Soc. 73: 3547 (1951, согласно которой при использовании изобутилового эфира хлоругольной кислоты в присутствии оснований, таких как 4-метилморфолин или 4 этилморфолин, из подвергаемых сочетанию карбоновой кислоты общей формулы (III) и моноизобутилового эфира угольной кислоты получают смешанный ангидрид. Процесс получения такого смешанного ангидрида и реакцию сочетания с аминами проводят так называемым методом осуществления реакции в одном реакционном аппарате с применением вышеуказанных растворителей при температуре от -20 до+25 С, предпочтительно от 0 до +25 С. б) В этом варианте для получения соединений общей формулы (I), в которых А 1 и А 2 имеют вышеуказанные значения, за исключением необязательно замещенной алкилом аминогруппы, соединение общей формулы в которой А 1 а и А 2 а имеют вышеуказанные для А 1 и А 2 значения, за исключением необязательно замещенной алкилом аминогруппы, R1 и R2 имеют вышеуказанные значения, a Nu означает уходящую группу, например атом галогена, такой как атом хлора, брома или йода, алкилсульфонилоксигруппу с 1-10 атомами углерода в алкильном фрагменте, необязательно моно-, ди- или тризамещенную атомами хлора или брома, метильными или нитрогруппами фенилсульфонилокси- или нафтилсульфонилоксигруппу,при этом заместители могут быть идентичными или различными, 1 Н-имидазол-1-ил, необязательно замещенный в углеродном скелете 1 или 2 метильными группами 1 Н-пиразол-1-ил, 1 Н-1,2,4-триазол-1-ил,1 Н-1,2,3-триазол-1-ил, 1 Н-1,2,3,4-тетразол-1-ил, винил, пропаргил, и-нитрофенил, 2,4-динитрофенил,трихлорфенил, пентахлорфенил, пентафторфенил, пиранил либо пиридинил, диметиламинилокси-,2(1 Н)-оксопиридин-1-илокси-, 2,5-диоксопирролидин-1-илокси-, фталимидилокси-, 1 Н-бензотриазол-1 илокси- или азидогруппу, подвергают реакции сочетания с соединением общей формулы-8 005600 в которой R имеет вышеуказанные значения. Вышеописанное взаимодействие проводят в условиях реакции Шоттена-Баумана или реакции Айнхорна, т.е. компоненты вводят в реакцию в присутствии по меньшей мере одного эквивалента вспомогательного основания при температуре от -50 до +120 С, предпочтительно от -10 до +30 С, и необязательно в присутствии растворителей. В качестве вспомогательных оснований предпочтительны гидроксиды щелочных и щелочно-земельных металлов, например гидроксид натрия, гидроксид калия или гидроксид бария, карбонаты щелочных металлов, например карбонат натрия, карбонат калия или карбонат цезия,ацетаты щелочных металлов, например ацетат натрия или калия, а также третичные амины, например пиридин, 2,4,6-триметилпиридин, хинолин, триэтиламин, N-этилдиизопропиламин, N-этилдициклогексиламин, 1,4-диазабицикло[2,2,2]октан или 1,8-диазабицикло[5,4,0]ундец-7-ен, а в качестве растворителя предпочтительны, например, дихлорметан, тетрагидрофуран, 1,4-диоксан, ацетонитрил, диметилформамид, диметилацетамид, N-метилпирролидон либо их смеси, при этом при применении в качестве вспомогательных оснований гидроксидов щелочных или щелочно-земельных металлов, карбонатов или ацетатов щелочных металлов в реакционную смесь можно также добавлять воду в качестве сорастворителя. в) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой R3 имеет вышеуказанные значения, R4 означает бензо[b]фуранил или 1H-индолил, необязательно замещенный 4-алкил-1-пиперазинилом или 4-арилалкил-1-пиперазинилом фенил или же имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в положении может быть замещен пиридинильной, фенильной, фенокси- или фенилметоксикарбониламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4-диазепин-1-ильной, 4-алкил-1-пиперазинильной, 4(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или пиперидинильной группой пиперидинильным или пиперазинильным остатком, 4-метил 1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком и независимо от этого может быть замещен в положении трет-алкоксикарбониламино- или [1,4']бипиперидинил-1'-илацетиламино-группой, и Z означает карбонил, карбоновую кислоту общей формулы в которой R4' означает бензо[b]фуранил или 1H-индолил, необязательно замещенный 4-алкил-1 пиперазинилом или 4-арилалкил-1-пиперазинилом фенил или же имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении может быть замещен пиридинильной, фенильной, фенокси- или фенилметоксикарбониламиногруппой, диалкиламиногруппой,необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4 алкилгексагидро-1 Н-1,4-диазепин-1-ильной, 4-алкил-1-пиперазинильной, 4-(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или пиперидинильной группой пиперидинильным или пиперазинильным остатком, 4-метил-1-пиперазинильным остатком,N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)аминоили 4-(1-пиперидинилметил)-1 пиперидинильным остатком и независимо от этого может быть замещен в -положении треталкоксикарбониламино- или [1,4']бипиперидинил-1'-илацетиламино-группой, подвергают реакции сочетания с амином общей формулы в которой один из остатков А 1b и А 2b означает атом водорода, а другой означает остаток формулы в которой R, R1, R2 и R3 имеют вышеуказанные значения. Эту реакцию сочетания предпочтительно проводить с применением известных из химии пептидов методов (см., например, Houben-Weyl, Methoden der Organischen Chemie, т. 15/2), при этом используют,например, карбодиимиды, такие как дициклогексилкарбодиимид (ДЦК), диизопропилкарбодиимид(ДИК) или этил(3-диметиламинопропил)карбодиимид, гексафторофосфат либо тетрафтороборат О-(1 Нбензотриазол-1-ил)-N,N-N',N'-тетраметилурония (ГБТУ, соответственно ТБТУ) или гексафторофосфат 1 Н-бензотриазол-1-илокси-трис-(диметиламино)фосфония (БОФ). Добавление 1-гидроксибензотриазола(ГОБТ) или 3-гидрокси-4-оксо-3,4-дигидро-1,2,3-бензотриазина (ГООБТ) позволяет дополнительно при необходимости подавить возможную рацемизацию, соответственно повысить скорость реакции. Реакции сочетания обычно проводят с использованием эквимолярных количеств подвергаемых сочетанию компонентов, а также агента сочетания в растворителях, таких как дихлорметан, тетрагидрофуран, ацетонитрил, диметилформамид (ДМФ), диметилацетамид (ДМА), N-метилпирролидон (N-МП) или их смеси,при температуре от -30 до +30 С, предпочтительно от -20 до +25 С. При необходимости в качестве дополнительного вспомогательного основания предпочтительно используют N-этилдиизопропиламин(ДИЭА) (основание Хюнига). Другим пригодным для синтеза соединений общей формулы I методом сочетания является так называемый "ангидридный метод" (см. также М. Bodanszky, "Peptide Chemistry", изд-во Springer-Verlag 1988, с. 58-59; М. Bodanszky, "Principles of Peptide Synthesis", изд-во Springer-Verlag 1984, с. 21-27). Предпочтительным при этом является "метод смешанных ангидридов", проводимый по методикеVaughan (J.R. Vaughan Jr., J. Amer. Chem. Soc. 73: 3547 (1951, согласно которой при использовании изобутилового эфира хлоругольной кислоты в присутствии оснований, таких как 4-метилморфолин или 4 этилморфолин, из подвергаемых сочетанию карбоновой кислоты общей формулы VI и моноизобутилового эфира угольной кислоты получают смешанный ангидрид. Процесс получения такого смешанного ангидрида и реакцию сочетания с аминами проводят так называемым методом осуществления реакции в одном реакционном аппарате с применением вышеуказанных растворителей при температуре от -20 до+25 С, предпочтительно от 0 до +25 С. г) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой R3 имеет вышеуказанные значения, R4 означает бензо[b]фуранил или 1H-индолил, необязательно замещенный 4-алкил-1-пиперазинилом или 4-арилалкил-1-пиперазинилом фенил или же имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в положении может быть замещен пиридинильной, фенильной, фенокси- или фенилметоксикарбониламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4-диазепин-1-ильной, 4-алкил-1-пиперазинильной, 4(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или пиперидинильной группой пиперидинильным или пиперазинильным остатком, 4-метил 1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1 пиперидинилметил)-1-пиперидинильным остатком и в -положении может быть замещен треталкоксикарбониламино- или [1,4']бипиперидинил-1'-илацетиламино-группой, и Z означает карбонил, соединение общей формулы в которой Nu означает уходящую группу, например атом галогена, такой как атом хлора, брома или йода,алкилсульфонилоксигруппу с 1-10 атомами углерода в алкильном фрагменте, необязательно моно-, диили тризамещенную атомами хлора или брома, метильными или нитрогруппами фенилсульфонилоксиили нафтилсульфонилоксигруппу, при этом заместители могут быть идентичными или различными, 1 Нимидазол-1-ил, необязательно замещенный в углеродном скелете 1 или 2 метильными группами 1 Нпиразол-1-ил, 1 Н-1,2,4-триазол-1-ил, 1 Н-1,2,3-триазол-1-ил, 1 Н-1,2,3,4-тетразол-1-ил, винил, пропаргил,n-нитрофенил, 2,4-динитрофенил, трихлорфенил, пентахлорфенил, пентафторфенил, пиранил или пиридинил, диметиламинилокси-, 2(1 Н)-оксопиридин-1-илокси-, 2,5-диоксопирролидин-1-илокси-, фталимидилокси-, 1 Н-бензотриазол-1-илокси- или азидогруппу, a R4' означает бензо[b]фуранил или 1H-индолил,необязательно замещенный 4-алкил-1-пиперазинилом или 4-арилалкил-1-пиперазинилом фенил или же имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в-положении может быть замещен пиридинильной, фенильной, фенокси- или фенилметоксикарбониламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4-диазепин-1-ильной, 4-алкил-1-пиперазинильной,4-(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или пиперидинильной группой пиперидинильным или пиперазинильным остатком, 4-метил 1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком и в -положении может быть замещен трет-алкоксикарбониламино- или [1,4']бипиперидинил-1'-илацетиламиногруппой, подвергают реакции сочетания с амином общей формулы в которой R, R1 и R2 имеют вышеуказанные значения и один из остатков А 1b и А 2b означает атом водорода, а другой означает остаток формулы в которой R3 означает атом водорода или алкил. Вышеописанное взаимодействие проводят в условиях реакции Шоттена-Баумана или реакции Айнхорна, т.е. компоненты вводят в реакцию в присутствии по меньшей мере одного эквивалента вспомогательного основания при температуре от -50 до +120 С, предпочтительно от -10 до +30 С, и необязательно в присутствии растворителей. В качестве вспомогательных оснований предпочтительны гидроксиды щелочных и щелочно-земельных металлов, например гидроксид натрия, гидроксид калия или гидроксид бария, карбонаты щелочных металлов, например карбонат натрия, карбонат калия или карбонат цезия,ацетаты щелочных металлов, например ацетат натрия или калия, а также третичные амины, например пиридин, 2,4,6-триметилпиридин, хинолин, триэтиламин, N-этилдиизопропиламин, N-этилдициклогексиламин, 1,4-диазабицикло[2,2,2]октан или 1,8-диазабицикло[5,4,0]ундец-7-ен, а в качестве растворителя предпочтительны, например, дихлорметан, тетрагидрофуран, 1,4-диоксан, ацетонитрил, диметилформамид, диметилацетамид, N-метилпирролидон либо их смеси, при этом при применении в качестве вспомогательных оснований гидроксидов щелочных или щелочно-земельных металлов, карбонатов или ацетатов щелочных металлов в реакционную смесь можно также добавлять воду в качестве сорастворителя. д) В этом варианте для получения соединений общей формулы (I), в которой один из остатков А 1 и 2 А означает атом водорода, а другой означает необязательно замещенную алкилом аминогруппу, соединение общей формулы в которой один из двух остатков А 1c и А 2c означает атом водорода, а другой означает группу формулы в которой R5 означает трет-алкильную группу, a R, R1, R2 и R3 имеют вышеуказанные значения, подвергают ацидолизу. Для такого ацидолиза предпочтительно использовать трифторуксусную кислоту, при этом реакцию проводят с применением инертного растворителя, например дихлорметана, или без него и предпочтительно в отсутствие воды. Эту реакцию проводят при температуре от -50 до +90 С, предпочтительно от 0 С до комнатной температуры. Как эффективный зарекомендовал себя также ацидолиз соединений общей формулы (X), проводимый с использованием раствора соляной кислоты в метаноле при кипячении с обратным холодильником, однако, при этом согласно полученным на практике данным нельзя полностью исключить воздействие на карбоксамидную и сложноэфирную функции, и поэтому предпочтение,как правило, следует отдавать трифторуксусной кислоте. е) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой один из остатков А 1b и А 2b означает атом водорода, а другой означает остаток формулы(XII) 4f в которой R означает алкокси-, амино-, алкиламино- или диалкиламиногруппу, необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1-пиперазинилом или пиперидинилом 1-пиперидинил, 1-метил 4-пиперидинилоксиостаток, пиридиниламино- или 1,2,4-триазол-1-ильную группу, а также с производным угольной кислоты общей формулы в которой Х 1 и X2, которые могут быть идентичными или различными, в каждом случае означают нуклеофобную группу, предпочтительно 1 Н-имидазол-1-ил, 1H-1,2,4-триазол-1-ил, трихлорметокси-, 2,5 диоксопирролидин-1-илоксигруппу или же атом хлора. Эти реакции, которые в принципе являются двухстадийными, обычно проводят по методу осуществляения реакций в одном реакционном аппарате, причем в предпочтительном варианте на первой стадии один из обоих компонентов XII или VII в пригодном для этой цели растворителе при более низкой температуре вводят в реакцию с эквимолярным количеством производного угольной кислоты общей формулы XIII, после чего по меньшей мере в эквимолярном количестве добавляют другой из компонентов VII или XII и завершают взимодействие при более высокой температуре. Если компонентом общей формулыXII является спирт, то реакцию можно также ускорить добавлением каталитических количеств соответствующего алкоголята или имидазолнатрия, однако, если соединение общей формулы VII является первичным амином, то необходимость в катализаторах обычно отсутствует. Взаимодействие с бис(трихлорметил)карбонатом предпочтительно проводить в присутствии по меньшей мере 2 эквивалентов (в пересчете на бис(трихлорметил)карбонат) третичного основания, например триэтиламина, Nэтилдиизопропиламина, пиридина, 1,5-диазабицикло[4,3,0]нон-5-ена, 1,4-диазабицикло[2,2,2]октана или 1,8-диазабицикло[5,4,0]ундец-7-ена. В качестве растворителей, которые должны быть безводными, можно использовать, например, тетрагидрофуран, диоксан, диметилформамид, диметилацетамид, N-метил-2 пирролидон, 1,3-диметил-2-имидазолидинон или ацетонитрил, а при использовании бис(трихлорметил)карбоната в качестве карбонильного компонента предпочтительны безводные хлорированные углеводороды, например дихлорметан, 1,2-дихлорэтан или трихлорэтилен. Реакции на первой стадии проводят при температуре от -30 до +25 С, предпочтительно от -5 до +10 С, а на второй стадии - от +15 С до температуры кипения используемого растворителя, предпочтительно от +20 до +70 С (см. также Н.А.Chem. 33, 2101-2108, 2106 и далее (1990. ж) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой Z означает карбонил, а R4 означает амино-, алкиламино- или диалкиламиногруппу либо необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1-пиперазинилом или пиперидинилом 1 пиперидинил, амин общей формулы в которой один из остатков А 1d и А 2d означает атом водорода, а другой означает аминогруппу и R и(XII') 4' в которой R означает амино-, алкиламино- или диалкиламиногруппу либо необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1-пиперазинилом или пиперидинилом пиперидинил, а также с производными угольной кислоты общей формулы 1-12 005600 в которой Х 3 означает феноксигруппу, если Х 4 представляет собой (1 Н)-1,2,3,4-тетразол-1-ил, или означает 4-нитрофеноксигруппу, если Х 4 представляет собой 4-нитрофеноксигруппу, или же означает атом хлора, если Х 4 представляет собой 2,4,5-трихлорфеноксигруппу. Эти реакции в принципе являются двухстадийными и сопровождаются образованием промежуточных уретанов, которые можно выделять. Однако такие реакции можно также проводить по методу осуществления реакций в одном реакционном аппарате. В предпочтительном варианте при проведении этих реакций на первой стадии один из обоих компонентов XII' или VII' в пригодном для этой цели растворителе при более низких температурах вводят в реакцию с эквимолярным количеством производного угольной кислоты общей формулы XV, после чего добавляют по меньшей мере в эквимолярном количестве другой из компонентов VII' или XII' и взаимодействие завершают при более высокой температуре. Реакции предпочтительно проводить в безводных растворителях, например в тетрагидрофуране, диоксане, диметилформамиде, диметилацетамиде, N-метил-2-пирролидоне, 1,3-диметил-2-имидазолидиноне,ацетонитриле или безводных хлорированных углеводородах, например дихлорметане, 1,2-дихлорэтане или трихлорэтилене. Реакции на первой стадии предпочтительно проводить при температуре от -15 до+40 С, более предпочтительно от -10 до +25 С, а на второй стадии - от +20 С до температуры кипения используемого растворителя, предпочтительно от +20 до 100 С (см. также R.W. Adamiak и J. Stawinski,Tetrahedron Letters 22, 1935-1936 (1977); A.W. Lipkowski, S.W. Tam и P.S. Portoghese, J. Med. Chem. 29,1222-1225 (1986); J. Izdebski и D. Pawlak, Synthesis, 423-425 (1989. з) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой Z означает сульфонил, a R4 означает амино-, алкиламино- или диалкиламиногруппу либо необязательно замещенный 1-метил-4-пиперидинилом, 4-метил-1-пиперазинилом или пиперидинилом пиперидинил, соединение общей формулы в которой один из остатков А 1e и А 2e означает атом водорода, а другой означает группу формулы в которой R и R1 имеют вышеуказанные значения, Z означает сульфонил, a Nu' означает уходящую группу, например атом галогена, такой как атом хлора, брома или йода, алкил или арилсульфонилоксигруппу или алкоксигруппу в каждом случае с числом атомов углерода до 10 включительно, например метоксиили этоксигруппу, либо необязательно моно-, ди- или тризамещенную атомами хлора или брома, метильными, нитро- или гидроксигруппами фенокси- или нафтоксигруппу, при этом заместители могут быть идентичными или различными, подвергают взаимодействию с амином общей формулы(XII') 4' в которой R означает амино-, алкиламино- или диалкиламиногруппу либо необязательно замещенный 1 метил-4-пиперидинилом, 4-метил-1-пиперазинилом или пиперидинилом пиперидинил. Если в общей формуле XVI Nu' представляет собой атом галогена, алкил или арилсульфонилоксигруппу, то вышеописанное взаимодействие проводят в условиях реакции Шоттена-Баумана или реакции Айнхорна, т.е. компоненты вводят в реакцию в присутствии по меньшей мере одного эквивалента вспомогательного основания при температуре от -50 до +120 С, предпочтительно от -10 до +100 С, и необязательно в присутствии растворителей. В качестве вспомогательных оснований предпочтительны гидроксиды щелочных и щелочно-земельных металлов, например гидроксид натрия или гидроксид калия, карбонаты щелочных металлов, например карбонат натрия, карбонат калия или карбонат цезия, ацетаты щелочных металлов, например ацетат натрия или калия, а также третичные амины, например пиридин,2,4,6-триметилпиридин, хинолин, триэтиламин, N-этилдиизопропиламин, N-этилдициклогексиламин,1,4-диазабицикло[2,2,2]октан или 1,8-диазабицикло[5,4,0]ундец-7-ен, а в качестве растворителя используют, например, дихлорметан, тетрагидрофуран, 1,4-диоксан, ацетонитрил, диметилформамид, диметилацетамид, N-метилпирролидон либо их смеси, при этом при применении в качестве вспомогательных оснований гидроксидов щелочных или щелочно-земельных металлов, карбонатов или ацетатов щелочных металлов в реакционную смесь можно также добавлять воду в качестве сорастворителя. В качестве нуклеофобной группы Nu' в соединениях общей формулы XVI предпочтительна 2 гидроксифеноксигруппа, а предпочтительным растворителем для взаимодействия с аминами общей формулы XII' является кипящий диоксан. К промежуточным продуктам, образующимся при проведении вышеописанной реакции, следует отнести не выделяемые азасульфены частичной структуры XVII и) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой R4 означает имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении может быть замещен диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1H-1,4 диазепин-1-ильной,4-алкил-1-пиперазинильной,4-(алкилсульфонил)-1-пиперазинильной,4(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или 1-пиперидинильной группой пиперидинильным или пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком и в -положении может быть замещен трет-алкоксикарбониламино- или [1,4']бипиперидинил-1'илацетиламино-группой, диалкиламин, необязательно замещенный фенилом, пиридинилом, диметиламиногруппой,4-морфолинилом,4-алкилгексагидро-1H-1,4-диазепин-1-илом,4-алкил-1-пиперазинилом, 4-(алкилсульфонил)-1-пиперазинилом, 4-(диалкиламиноалкил)-1-пиперазинилом, 1-алкил-4 пиперидинилом или 1-пиперидинилом, но не замещенный в положении 1 пиперидин либо пиперазин, 4 метилпиперазин, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амин или 4-(1-пиперидинилметил)пиперидин подвергают взаимодействию с соединением общей формулы в которой один из двух остатков А 1i и А 2i означает атом водорода, а другой означает группу формулы в которой R, R1, R2 и R3 и Z имеют вышеуказанные значения, R4i означает имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкиленовый остаток, который в -положении может быть замещен трет-алкоксикарбониламино- или [1,4']бипиперидинил-1'-илацетиламино-группой, и Nu" означает уходящую группу в -положении, например атом галогена, такой как атом хлора, брома или йода, алкилсульфонилоксигруппу с 1-10 атомами углерода в алкильном фрагменте, необязательно моно-,ди- или тризамещенную атомами хлора или брома, метильными или нитрогруппами фенилсульфонилокси- или нафтилсульфонилоксигруппу, при этом заместители могут быть идентичными или различными. Вышеописанную реакцию проводят с использованием вспомогательных оснований или без них при температуре от 0 до +140 С, предпочтительно от +20 до +100 С, и предпочтительно в присутствии растворителей. При этом в качестве вспомогательных оснований используют гидроксиды щелочных и щелочно-земельных металлов, например гидроксид натрия, гидроксид калия или гидроксид бария, предпочтительно, однако, карбонаты щелочных металлов, например карбонат натрия, карбонат калия или карбонат цезия, и наряду с ними ацетаты щелочных металлов, например ацетат натрия или калия, а также третичные амины, например пиридин, 2,4,6-триметилпиридин, хинолин, триэтиламин, N-этилдиизопропиламин, N-этилдициклогексиламин, 1,4-диазабицикло[2,2,2]октан или 1,8-диазабицикло[5,4,0]ундец-7-ен, а в качестве растворителей применяют, например, дихлорметан, тетрагидрофуран, 1,4-диоксан,предпочтительно, однако, диполярные апротонные растворители, например ацетонитрил, диметилформамид, диметилацетамид, N-метилпирролидон, метилизобутилкетон либо их смеси, причем при использовании в качестве вспомогательных оснований гидроксидов щелочных или щелочно-земельных металлов, карбонатов или ацетатов щелочных металлов в реакционную смесь можно также добавлять воду в качестве сорастворителя. Для повышения реакционной способности группы Х в исходных соединениях общей формулы V в реакционную смесь, кроме того, можно добавлять органические или предпочтительно неорганические йодиды, например йодид натрия или калия. к) В этом варианте для получения соединений общей формулы (I), в которой А 2 означает атом водорода, а А 1 означает необязательно замещенную алкилом аминогруппу или [1,4']бипиперидинил-1'-ил,соединение общей формулы в которых R, R1 и R2 имеют вышеуказанные значения, подвергают взаимодействию с аммиаком, алкиламином или [1,4']бипиперидинилом. Эту реакцию проводят, как правило, в мягких условиях и без добавления катализаторов. В более общем случае взаимодействие можно проводить при температуре от -10 до +150 С, предпочтительно от+15 до +35 С, при давлении от нормального до 300 бар и в отсутствие или в присутствии дополнительных растворителей. В качестве возможных растворителей предпочтительны спирты, такие как метанол или этанол, и простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан. При необходимости применения катализатора используют основные и кислотные катализаторы. К предпочтительным для применения в этих целях основным катализаторам относятся гидроксиды щелочных или щелочно-земельных металлов, такие как гидроксид натрия, калия или бария, алкоголяты щелочных металлов, такие как этилат натрия или метилат калия, а также гидроксид бензилтриметиламмония (Тритон В), а к кислотным катализаторам - прежде всего уксусная кислота. л) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой R3 имеет вышеуказанные значения, R4 означает имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении несет [1,4']бипиперидинил 1'-илацетиламино-остаток и в -положении может быть замещен фенильной, пиридинильной, фенокси-, фенилметоксикарбониламино- или N-алкилфениламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4-диазепин-1-ильной,4-алкил-1-пиперазинильной,4-(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или 1-пиперидинильной группой 1-пиперидинильным или 1-пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1 пиперидинильным остатком, и Z означает карбонил, [1,4']бипиперидинил-1'-уксусную кислоту подвергают реакции сочетания с амином общей формулы в которой один из остатков А 1k и А 2k означает атом водорода, а другой означает остаток формулы в которой R, R1 и R2 имеют вышеуказанные значения, R4k означает имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении несет аминогруппу и в-положении может быть замещен фенильной, пиридинильной, фенокси-, фенилметоксикарбониламиноили N-алкилфениламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4-диазепин-1-ильной, 4-алкил 1-пиперазинильной,4-(алкилсульфонил)-1-пиперазинильной,4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или 1-пиперидинильной группой 1-пиперидинильным или 1 пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком, и Z означает карбонил. Указанную реакцию сочетания предпочтительно проводить с использованием известных из химии пептидов методов (см., например, Houben-Weyl, Methoden der Organischen Chemie, т. 15/2), при этом используют, например, карбодиимиды, такие как дициклогексилкарбодиимид (ДЦК), диизопропилкарбодиимид (ДИК) или этил(3-диметиламинопропил)карбодиимид, гексафторофосфат либо тетрафтороборатO-(1 Н-бензотриазол-1-ил)-N,N-N',N'-тетраметилурония (ГБТУ, соответственно ТБТУ) или гексафторофосфат 1 Н-бензотриазол-1-илокси-трис-(диметиламино)фосфония (БОФ). Добавление 1-гидроксибензотриазола (ГОБТ) или 3-гидрокси-4-оксо-3,4-дигидро-1,2,3-бензотриазина (ГООБТ) позволяет дополнительно при необходимости подавить возможную рацемизацию, соответственно повысить скорость реакции. Реакции сочетания обычно проводят с использованием эквимолярных количеств подвергаемых со-15 005600 четанию компонентов, а также агента сочетания в растворителях, таких как дихлорметан, тетрагидрофуран, ацетонитрил, диметилформамид (ДМФ), диметилацетамид (ДМА), N-метилпирролидон (N-МП) или их смеси, при температуре от -30 до +30 С, предпочтительно от -20 до +25 С. При необходимости в качестве дополнительного вспомогательного основания предпочтительно используют N-этилдиизопропиламин (ДИЭА) (основание Хюнига). Другим пригодным для синтеза соединений общей формулы I методом сочетания является так называемый "ангидридный метод" (см. также М. Bodanszky, "Peptide Chemistry", изд-во Springer-Verlag 1988, с. 58-59; М. Bodanszky, "Principles of Peptide Synthesis", изд-во Springer-Verlag 1984, с. 21-27). Предпочтительным при этом является "метод смешанных ангидридов", проводимый по методикеVaughan (J.R. Vaughan Jr., J. Amer. Chem. Soc. 73: 3547 (1951, согласно которой при использовании изобутилового эфира хлоругольной кислоты в присутствии оснований, таких как 4-метилморфолин или 4 этилморфолин, из подвергаемых сочетанию карбоновой кислоты общей формулы VI и моноизобутилового эфира угольной кислоты получают смешанный ангидрид. Процесс получения такого смешанного ангидрида и реакцию сочетания с аминами проводят так называемым методом осуществления реакции в одном реакционном аппарате с применением вышеуказанных растворителей при температуре от -20 до+25 С, предпочтительно от 0 до +25 С. м) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой R3 и Z имеют вышеуказанные значения, a R4 означает 1,2-этилен,который в -положении может быть замещен амино-, [1,4']бипиперидинил-1-ильной, фениламиноили N-алкилфениламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4-диазепин-1-ильной, 4-алкил 1-пиперазинильной, 4-(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или пиперидинильной группой 1-пиперидинильным или 1-пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком, соединение общей формулы в которой R, R1 и R2 имеют вышеуказанные значения и один из остатков А 1l и А 2l означает атом водорода, а другой означает группу формулы в которой R3 и Z имеют вышеуказанные значения, подвергают взаимодействию с аммиаком, фениламином или N-алкил-фениламином, с [1,4']бипиперидинилом, с диалкиламином, с необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4 диазепин-1-ильной, 4-алкил-1-пиперазинильной, 4-(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или пиперидинильной группой пиперидином либо пиперазином, с 1-метилпиперазином, N-метил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амином или 4-(1-пиперидинилметил)пиперидином. Эту реакцию проводят, как правило, в мягких условиях и без добавления катализаторов. В более общем случае взаимодействие можно проводить при температуре от -10 до +150 С, предпочтительно от+15 до +35 С, при давлении от нормального до 300 бар и в отсутствие или в присутствии дополнительных растворителей. В качестве возможных растворителей предпочтительны спирты, такие как метанол или этанол, и простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан. При необходимости применения катализатора используют основные и кислотные катализаторы. К предпочтительным для применения в этих целях основным катализаторам относятся гидроксиды щелочных или щелочно-земельных металлов, такие как гидроксид натрия, калия или бария, алкоголяты щелочных металлов, такие как этилат натрия или метилат калия, а также гидроксид бензилтриметиламмония (Тритон В), а к кислотным катализаторам - прежде всего уксусная кислота. н) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы-16 005600 в которой R3 и Z имеют вышеуказанные значения, a R4 означает имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении замещен аминогруппой и в -положении может быть замещен амино-, фенильной, пиридинильной, фенокси-, фениламино-, фенилметоксикарбониламино- или N-алкилфениламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4-морфолинильной, 4-алкилгексагидро-1 Н-1,4 диазепин-1-ильной, 4-алкил-1-пиперазинильной, 4-(алкилсульфонил)-1-пиперазинильной, 4-(диалкиламиноалкил)-1-пиперазинильной, 1-алкил-4-пиперидинильной или пиперидинильной группой пиперидинильным или пиперазинильным остатком, 4-метил-1-пиперазинильным остатком, N-метил-N-(1'-метил[1,4']бипиперидинил-1-ил)амино- или 4-(1-пиперидинилметил)-1-пиперидинильным остатком, соединение общей формулы в которой один из двух остатков A1m и A2m означает атом водорода, а другой означает группу формулы в которой R, R1 и R2 и Z имеют вышеуказанные значения, а R4m означает имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении несет треталкоксикарбониламиногруппу и в -положении может быть замещен амино-, фенильной, пиридинильной, фенокси-, фениламино-, фенилметоксикарбониламино- или N-алкилфениламиногруппой, диалкиламиногруппой, необязательно замещенным фенильной, пиридинильной, диметиламино-, 4 морфолинильной,4-алкилгексагидро-1 Н-1,4-диазепин-1-ильной,4-алкил-1-пиперазинильной,4(алкилсульфонил)-1-пиперазинильной,4-(диалкиламиноалкил)-1-пиперазинильной,1-алкил-4 пиперидинильной или пиперидинильной группой пиперидинильным или пиперазинильным остатком, 4 метил-1-пиперазинильным остатком, N-мeтил-N-(1'-метил-[1,4']бипиперидинил-1-ил)амино- или 4-(1 пиперидинилметил)-1-пиперидинильным остатком, подвергают ацидолизу. Для такого ацидолиза предпочтительно использовать трифторуксусную кислоту, при этом реакцию проводят с применением инертного растворителя, например дихлорметана, или без него и предпочтительно в отсутствие воды. Эту реакцию проводят при температуре от -50 до +90 С, предпочтительно от 0 С до комнатной температуры. Как эффективный зарекомендовал себя также ацидолиз соединений общей формулы (XXVI), проводимый с использованием раствора соляной кислоты в метаноле при кипячении с обратным холодильником, однако, при этом согласно полученным на практике данным нельзя полностью исключить воздействие на карбоксамидную и сложноэфирную функции, и поэтому предпочтение, как правило, следует отдавать трифторуксусной кислоте. о) В этом варианте для получения соединений общей формулы (I), в которой один из двух остатков А 1 и А 2 означает атом водорода, а другой означает группу формулы в которой R3 и Z имеют вышеуказанные значения, a R4 означает имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении замещен амино- или в которой один из двух остатков А 1n и А 2n означает атом водорода, а другой означает группу формулы в которой R, R1, R2 и Z имеют вышеуказанные значения, a R4n означает имеющий от 1 до 7 атомов углерода разветвленный или неразветвленный алкильный остаток, который в -положении замещен аминоили [1,4']бипиперидинил-1'-илацетиламино-группой и в -положении замещен фенилметоксикарбониламиногруппой, подвергают ацидолизу. Для такого ацидолиза используют бромисто-водородную кислоту в органических кислотах, таких как трифторуксусная кислота, пивалиновая кислота, изомасляная кислота, изовалериановая кислота,предпочтительно, однако, в уксусной кислоте, при температуре от 0 до 40 С, предпочтительно, однако,-17 005600 при комнатной температуре, и предпочтительно в присутствии вспомогательных веществ, таких как анизол, тиоанизол, пентаметилбензол или диметилсульфид. Предлагаемые в изобретении новые замещенные пиперидины общей формулы (I) содержат по меньшей мере один хиральный центр. Если же хиральным является также один из остатков R, А 1 или А 2,то такие соединения могут также существовать в виде двух диастереомерных пар антиподов. В объем настоящего изобретения включены отдельные изомеры, а также их смеси. Соответствующие диастереомеры разделяют на основе различий их физико-химических свойств,например фракционированной кристаллизацией из пригодных для этой цели растворителей, жидкостной хроматографией высокого давления или колоночной хроматографией с использованием хиральных или предпочтительно ахиральных неподвижных фаз. Подпадающие под общую формулу (I) рацематы разделяют, например, с помощью ЖХВР на пригодных для этой цели хиральных неподвижных фазах (например на Chiral AGP, Chiralpak AD). Рацематы,содержащие основную или кислотную функцию, можно разделять также путем получения их диастереомерных, оптически активных солей, образующихся при взаимодействии с оптически активной кислотой,например с (+)- или (-)-винной кислотой, (+)- или (-)-диацетилвинной кислотой, (+)- или (-)-монометилтартратом или (+)-камфорсульфоновой кислотой, соответственно соптически активным основанием, например с (R)-(+)-1-фенилэтиламином, (S)-(-)-1-фенилэтиламином или (S)-бруцином. В соответствии с одним из обычных методов разделения изомеров рацемат соединения общей формулы (I) подвергают взаимодействию в эквимолярном количестве в растворителе с одной из вышеуказанных оптически активных кислот, соответственно с одним из вышеуказанных оптически активных оснований и полученные кристаллические диастереомерные оптически активные соли разделяют на основе различий их растворимости. Подобное взаимодействие можно проводить в растворителях любого типа,при условии, что такие растворители способны растворять указанные соли в различной, достаточной для разделения таких солей степени. При этом предпочтительно применять метанол, этанол либо их смеси,например в объемном соотношении 50:50. При таком подходе каждую из оптически активных солей растворяют в воде, нейтрализуют основанием, таким как карбонат натрия или карбонат калия, едкий натр или едкое кали, и в результате получают соответствующее свободное соединение в (+)- или (-)-форме. Кроме того, существует также возможность сразу получать только соответствующий (R)- или (S)энантиомер, соответственно смесь двух оптически активных, подпадающих под общую формулу I диастереомерных соединений, если рассмотренные выше процессы синтеза проводить в каждом случае с использованием имеющего соответствующую (R)- или (S)-конфигурацию компонента реакции. Исходные соединения общей формулы (III) можно получать аналогично известным из литературы методам из уже описанных -аминооксоаренмасляных кислот (см., например, J.E. Nordlander, M.J.Payne, F.G. Njoroge, V.M. Vishwanath, G.R. Han, G.D. Laikos и M.A. Balk, J. Org. Chem. 50, 3619 (1985 или из -аминооксоаренмасляных кислот (см., например, М. Seki, H. Kubota, Т. Moriya, М. Yamagishi,S. Nishimoto и К. Matsumoto, Chem. Pharm. Bull. (Japan) 34, 4516-4522 (1986); К. Basheeruddin, A.A. Siddiqui, N.H. Khan и S. Saleha, Synth. Commun. 9, 705-712 (1979); S. Ceriani и G. Tarzia, Ann. Chim. (Rom) 63, 457-466 (1973 либо из их производных. Исходные соединения общей формулы (IV) получают, если они не известны из литературы или отсутствуют в продаже, в соответствии с описанными в WO 98/11128 и DE 19952146 методами. Исходные соединения общей формулы (V) можно получать из соединений общей формулы (III) путем дериватизации по обычной методике. Необходимые в качестве исходных соединений карбоновые кислоты общей формулы (VI) имеются в продаже либо их можно получать по известным методам. Исходные соединения общих формул VII и VII' можно получить в соответствии с описанным выше вариантом д). Производные карбоновой кислоты общей формулы (IX) либо являются известными соединениями, либо их получают аналогично известным из литературы методам из исходных соединений общей формулы (VI). Исходные соединения общей формулы Х можно получать из соответствующих продуктов-предшественников в соответствии с описанными выше вариантами а) и б). Исходные соединения общих формул (XII) и (ХII') либо имеются в продаже, либо их получают аналогично известным из литературы методам. Исходные соединения общих формул (XIII) и (XV) также имеются в продаже или известны из литературы. Необходимые в качестве исходных соединений соединения общей формулы VII" можно получать из аминов общей формулы VII или VII' взаимодействием с сульфатами общей формулы(XXI) в которой Nu' имеет указанные в варианте з) значения, a Nu" может иметь отличное от Nu' значение или же может принимать те же значения, что и Nu'. Предпочтительным сульфатом является циклическое соединение XXII(см. также G.E. DuBois и R.A. Stephenson, J. Org. Chem. 45, 5371-5373 [1980]). Исходные соединения общей формулы XVIII можно получать из вышеописанных соединений общей формулы VII, соответствен-18 005600 но VII' взаимодействием, например в присутствии триэтиламина, с обычно имеющимися в продаже соединениями общей формулы в которой Х означает атом галогена, такого как хлора, брома или йода. Исходные соединения общих формул (XX) и (XX') можно получать по описанному в DE 19952146 методу, однако, эти соединения образуются также in situ из соответствующим образом замещенных пиперидидов 4-арил-4-оксомасляной кислоты, которые в положении 2 несут соответственно амино-, алкиламино- или диалкиламиногруппу. Исходные соединения общих формул (XXI) и (XXVII) подпадают под определение общей формулы (I) и их можно получать по описанным выше методам. Исходные соединения общей формулы (XXIII) можно легко получить известным методом, например, из таких соединений общей формулы (I), в которых А 1 или А 2 означает необязательно замещенную алкилом аминогруппу, взаимодействием с пригодными для этой цели хлор- или бромангидридами кислот. Исходные соединения общей формулы (XXV) равным образом можно получать из соединений общей формулы (I) взаимодействием с соответствующим образом замещенными, имеющимися в продаже или легко получаемыми по известным методам карбоновыми кислотами или их производными в условиях, описанных в варианте в) или г). Полученные соединения общей формулы I, если они содержат соответствующую основную функцию, можно переводить в их пригодные прежде всего для фармацевтического применения физиологически приемлемые соли с неорганическими или органическими кислотами. В качестве примера пригодных для этой цели кислот можно назвать соляную кислоту, бромисто-водородную кислоту, фосфорную кислоту, азотную кислоту, серную кислоту, метансульфоновую кислоту, n-толуолсульфоновую кислоту,уксусную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, миндальную кислоту,яблочную кислоту, лимонную кислоту, винную кислоту и малеиновую кислоту. Помимо этого новые соединения формулы (I), если они содержат кислотную функцию, например карбоксигруппу, при необходимости можно переводить в их аддитивные соли с неорганическими или органическими основаниями, прежде всего в их пригодные для фармацевтического применения физиологически приемлемые аддитивные соли. В качестве примера пригодных для этой цели оснований можно назвать гидроксид натрия, гидроксид калия, аммиак, циклогексиламин, дициклогексиламин, этаноламин, диэтаноламин и триэтаноламин. Новые соединения общей формулы I и их физиологически приемлемые соли обладают свойствамиCGRP-антагонистов и проявляют высокое сродство при анализе связывания с CGRP-рецептором. Предлагаемые в изобретении соединения проявляют свойства CGRP-антагонистов в описанных ниже фармакологических тест-системах. Для выявления сродства соединений общей формулы I к CGRP-рецепторам человека и подтверждения их антагонистических свойств проводили следующие опыты. А. Исследование связывания с использованием (экспрессирующих CGRP-рецептор человека) клеток линии SK-N-MC. Клетки линии SK-N-MC культивируют в среде DMEM (модифицированная по способу Дульбекко среда Игла). Среду со слипшимися культурами удаляют. Клетки дважды промывают ЗФР (забуференный фосфатом физиологический раствор) (Gibco 041-04190 М), отделяют добавлением ЗФР, смешанного с 0,02% ЭДТК, и выделяют путем центрифугирования. После ресуспендирования в 20 мл сбалансированного солевого раствора [ССР, состав (в мМ): NaCl 120, КСl 5,4, NаНСО 3 16,2, MgSO4 0,8, NaHPO4 1,0,CaCl2 1,8, D-глюкоза 5,5, HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота) 30, рН 7,40] клетки дважды центрифугируют при 100 g и ресуспендируют в ССР. После определения количества клеток последние гомогенизируют с помощью гомогенизатора типа Ultra-Turrax и в течение 10 мин центрифугируют при 3000 g. Супернатант отбрасывают, а осадок после центрифугирования повторно центрифугируют в трис-буфере (10 мМ трис, 50 мМ NaCl, 5 мМ MgCl2, 1 мМ ЭДТК, рН 7,40), обогащенном 1% бычьего сывороточного альбумина (БСА) и 0,1% бацитрацина, и ресуспендируют (1 мл/1000000 клеток). Гомогенат замораживают охлаждением до -80 С. При этих условиях мембранные препараты остаются стабильными в течение более 6 недель. После оттаивания гомогенат разбавляют в соотношении 1:10 буфером для анализа (50 мМ трис, 150 мМ NaCl, 5 мМ MgCl2, 1 мМ ЭДТК, рН 7,40) и в течение 30 с гомогенизируют с помощью гомогенизатора типа Ultra-Turrax. 230 мкл гомогената в течение 180 мин инкубируют при комнатной температуре с 50 пМ меченного 125I-иодтирозилом пептида, связанного с геном кальцитонина (CGRP, фирма Amersham), и с возрастающими концентрациями тестируемых соединений общим объемом 250 мкл. Инкубацию прекращают с помощью харвестера (сборщика) клеток быстрой фильтрацией через обработанные полиэтиленимином (0,1%) стекловолоконные фильтры типа GF/B. Связанную с протеином радиоактивность определяют с помощью гамма-счетчика. В качестве неспецифического связывания во время инкубации определяют связанную радиоактивность в присутствии 1 мкМ человеческого CGRP-альфа. Кривые концентрация-связывание анализируют путем компьютерного нелинейного согласования кривых. В описанном опыте значения IC50 соединений общей формулы I составляли 10000 нМ.-19 005600 Б. CGRP-антагонизм в клетках линии SK-N-MC. Клетки линии SK-N-MC (1 млн клеток) дважды промывают 250 мкл буфера для инкубации (HEPESсреда Хэнкса, 1 мМ 3-изобутил-1-метилксантин, 1% БСА, рН 7,4) и предварительно инкубируют при 37 С в течение 15 мин. После добавления CGRP (10 мкл) в качестве агониста в возрастающих концентрациях (от 10-11 до 10-6 М), соответственно после дополнительного добавления субстанции в 3-4 различных концентрациях инкубацию продолжают еще в течение 15 мин. Затем межклеточный цАМФ (циклический аденозиномонофосфат) экстрагируют путем добавления 20 мкл 1 М НСl и центрифугирования (2000 g, 4 С, в течение 15 мин). Супернатанты замораживают в жидком азоте и хранят при -20 С. Содержание цАМФ в образцах выявляют с помощью радиоиммуноанализа (фирма Amersham), а рА 2-значения обладающих антагонистическим действием соединений определяют построением соответствующих графиков. Соединения общей формулы I проявляют в описанной тест-модели in vitro свойства CGRPантагонистов в интервале концентраций от 10-11 до 10-5 М. Соединения общей формулы I благодаря их фармакологическим свойствам и их соли с физиологически приемлемыми кислотами, соответственно основаниями пригодны тем самым для экстренного и профилактического лечения головных болей, прежде всего мигрени, соответственно гистаминовой цефалгии. Кроме того, соединения общей формулы I оказывают также положительное действие при таких заболеваниях, как инсулиннезависимый сахарный диабет, сердечно-сосудистые заболевания, толерантность к морфию, заболевания кожи, прежде всего повреждения кожи под действием высоких температур и облучения, включая солнечный ожог, воспалительные заболевания, например воспалительные заболевания суставов (артрит), воспалительные заболевания легких, аллергический ринит, астма, заболевания,сопровождающиеся избыточным расширением сосудов и обусловленным этим снижением кровоснабжения тканей, например шок и сепсис. На симптоматическое проявление обусловленных расширением сосудов и повышением кровотока приливов в период менопаузы у женщин с дефицитом эстрогенов благодаря предусмотренному согласно изобретению применению CGRP-антагонистов можно оказывать положительное профилактическое и экстренное терапевтическое воздействие, при этом такому терапевтическому подходу отдается предпочтение перед гормонозаместительной терапией, поскольку он характеризуется практически полным отсутствием побочных эффектов. Кроме того, соединения общей формулыI в целом проявляют болеутоляющее действие. Требуемая для достижения соответствующего эффекта доза составляет при внутривенном или подкожном введении предпочтительно от 0,001 до 30 мг/кг веса тела, более предпочтительно от 0,01 до 5 мг/кг, а при пероральном, назальном или ингаляционном введении - предпочтительно от 0,01 до 50 мг/кг веса тела, более предпочтительно от 0,1 до 30 мг/кг, в каждом случае из расчета на 1-3 приема в сутки. В этих целях получаемые согласно изобретению соединения общей формулы I, при необходимости в сочетании с другими действующими веществами, такими как противорвотные средства, прокинетики,нейролептическими средства, антидепрессанты, антагонисты нейрокинина, противосудорожные средства, антагонисты рецептора гистамина H1, антимускариновые средства,-блокаторы, -агонисты и антагонисты, эрготалкалоиды, слабые анальгетики, нестероидные противовоспалительные средства, кортикостероиды, антагонисты кальция, 5-НТ 1D-агонисты или иные средства против мигрени, совместно с одним либо несколькими обычными инертными носителями и/или разбавителями, например с кукурузным крахмалом, лактозой, тростниковым сахаром, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, водой/этанолом, водой/глицерином, водой/сорбитом, водой/полиэтиленгликолем, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или жиросодержащими соединениями, такими как oтвержденный жир, либо их соответствующими смесями, можно прорабатывать в обычные галеновы формы, такие как таблетки, драже, капсулы, порошки, суспензии, растворы, дозируемые аэрозоли или суппозитории. В качестве примера других действующих веществ, которые пригодны для применения в указанном выше сочетании с соединениями общей формулы I, можно назвать мелоксикам, эрготамин, дигидроэрготамин, метоклопрамид, домперидон, дифенгидрамин, циклизин, прометазин, хлорпромазин, дексаметазон, флунаризин, декстропропоксифен, меперидин, пропранолол, надолол, атенолол, клонидин, индорамин, карбамазепин, фенитоин, вальпроат, амитриптилин, лидокаин, дилтиазем или суматриптан и другие 5-НТ 1D-агонисты, такие, например, как наратриптан, золмитриптан, авитриптан, ризатриптан и элетриптан. Дозу таких действующих веществ целесообразно выбирать при этом в пределах от 1/5 от обычно рекомендуемой самой низкой дозы до 1/1 от нормально предписываемой дозы, т.е., например, применительно к суматриптану эта доза составляет от 20 до 100 мг. Еще одним объектом изобретения является применение соединений общей формулы I в качестве ценных вспомогательных веществ для получения и очистки (аффинной хроматографией) антител, а также после введения соответствующей радиоактивной метки, например путем непосредственного введения в качестве радиоактивной метки изотопа 125I либо 131I или путем тритиирования соответствующих предшественников, например путем замены атомов галогена на тритий, при радиоиммуноанализе (РИА) и-20 005600 твердофазном иммуноферментном анализе (ELISA), а также в качестве диагностических или аналитических вспомогательных средств в исследованиях нейротрансмиттеров. Ниже изобретение более подробно поясняется на примерах. Предварительные пояснения Для всех соединений были получены удовлетворительные данные элементного анализа, а также ИК-, УФ-, 1 Н-ЯМР- и, как правило, также масс-спектра. Значения Rf определяли, если не указано иное, с использованием готовых пластин силикагель 60 F254 для ТСХ (фирма Е. Merck, Дармштадт, каталожный 1.05714) без насыщения камер. При отсутствии более подробной информации о конфигурации остается открытым вопрос, идет ли речь о чистых энантиомерах либо имеет место частичная или даже полная рацемизация. Для хроматографии использовали следующие растворители, соответственно системы растворителей (СР): СР А СР Б СР В СР Г СР Д СР Е СР Ж СР З СР И СР К СР Л СР М СР Н СР О СР П СР Р СР С этиловый эфир уксусной кислоты/метанол в объемном соотношении 100:5 этиловый эфир уксусной кислоты/метанол в объемном соотношении 80:20 этиловый эфир уксусной кислоты/метанол/конц. аммиак в объемном соотношении 80:20:1 дихлорметан/циклогексан/метанол/конц. аммиак в объемном соотношении 70:15:15:2 этиловый эфир уксусной кислоты/ледяная уксусная кислота в объемном соотношении 99:1 этиловый эфир уксусной кислоты/метанол/ледяная уксусная кислота в объемном соотношении 90:10:1 дихлорметан/метанол/конц. аммиак в объемном соотношении 90:10:1 петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 1:1 дихлорметан/метанол/ледяная уксусная кислота в объемном соотношении 90:10:1,5 дихлорметан/изопропанол в объемном соотношении 9:1 этиловый эфир уксусной кислоты/метанол в объемном соотношении 9:1 дихлорметан/метанол/конц. аммиак в объемном соотношении 75:25:5 дихлорметан/этиловый эфир уксусной кислоты в объемном соотношении 1:1 дихлорметан/метанол в объемном соотношении 95:5 дихлорметан/этиловый эфир уксусной кислоты/циклогексан/метанол/конц. aммиак в объемном соотношении 60:16:5:5:0,6 дихлорметан/метанол/конц. аммиак в объемном соотношении 90:10:0,5 дихлорметан/метанол/ледяная уксусная кислота в объемном соотношении 80/20/1 В приведенном ниже описании опытов и примерах использованы следующие сокращения и аббревиатуры:(1,1-диметилэтокси)карбонил ТБТУ тетрафторборат 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония ГОБТ гидрат 1-гидроксибензотриазола КДТ 1,1'-карбонилди(1,2,4-триазол) ТГФ тетрагидрофуран ДМФ диметилформамид ЭУ этиловый эфир уксусной кислоты ПЭ петролейный эфир р-ль растворитель КТ комнатная температура соед.порядковый номер соединений Значения условных буквенно-цифровых обозначений, используемых в примерах, поясняются ниже в обобщенном виде: А. Получение промежуточных соединений. Пример А 1. (R,S)-4-Aмино-3,5-дибром[(1,1-диметилэтоксикарбонил)амино]оксобензолмасляная кислота. К смеси из 6,5 г (0,01454 моля) гидробромангидрида (R,S)-,4-диамино-3,5-дибром-оксобензолмасляной кислоты, 100 мл диоксана, 50 мл воды и 1,59 г (0,015 моля) безводного карбоната натрия добавляли 3,492 г (0,016 моля) ди-трет-бутилдикарбоната и перемешивали в течение ночи при КТ. Диоксан удаляли в вакууме, остаток подкисляли 1-молярным водным раствором гидросульфата калия и тщательно экстрагировали этиловым эфиром уксусной кислоты. Объединенные ацетатные экстракты сушили над сульфатом натрия и упаривали в вакууме. Остаток тщательно растирали с диэтиловым эфиром, фильтровали на нутче и сушили в вакууме. Таким путем получили 5,0 г (74% от теории) бесцветных кристаллов. ИК (КВr): 1704, 1691 см-1 (С=O). МС (ESI): (M+Н)+= 463/465/467 (Вr2). Аналогичным путем получали следующие соединения: Пример А 2. Гидробромангидрид (R,S)-,4-диамино-3,5-дибромоксобензолмасляной кислоты. К раствору 14,7 г (0,0523 моля) дигидрохлорангидрида (R,S)-,4-диаминооксобензолмасляной кислоты в 150 мл 70%-ной водной уксусной кислоты по каплям добавляли 5,822 мл (0,1067 моля) брома и перемешивали в течение 2 ч при температуре реакции 70 С. Смесь концентрировали в вакууме, остаток растирали с диэтиловым эфиром, фильтровали на нутче и сушили в вакууме. Таким путем получили 21,5 г (92% от теории) бесцветного кристаллического вещества. ИК (КВr): 1664 см-1 (С=O). МС (ESI): (М+H)+=365/367/369 (Вr2). Аналогичным путем получали следующее соединение: Пример A3. Дигидрохлорангидрид (R,S)-,4-диаминооксобензолмасляной кислоты. Смесь из 18,1 г (0,0523 моля) (R,S)-4-ацетиламинотрифторацетиламинооксобензолмасляной кислоты и 200 мл полуконцентрированной соляной кислоты в течение 2 ч кипятили с обратным холодильником, после чего упаривали в вакууме. Остаток тщательно растирали с тетрагидрофураном, фильтровали на нутче и сушили в вакууме. Таким путем получили 14,1 г (96% от теории) бесцветных кристаллов. ИК (КВr): 1709, 1678 см-1 (СО). МС (ESI): (M+H)+=209. Пример А 4. (R,S)-4-ацетиламинотрифторацетиламинооксобензолмасляная кислота. К смеси из 133,341 г (1,0 моль) безводного хлорида аммония и 21,591 мл (0,28 моля) безводного диметилформамида добавляли, поддерживая температуру реакции не выше 40 С, смесь из 13,517 г (0,1 моля) ацетанилида и 21,11 г (0,1 моля) ангидрида -трифторацетиламиноянтарной кислоты и затем смесь выдерживали в течение 2 ч при 80 С. После охлаждения реакционную смесь вмешивали в смесь из 500 г колотого льда и 60 мл конц. соляной кислоты и тщательно экстрагировали этиловым эфиром уксусной кислоты. Объединенные ацетатные экстракты пятикратно экстрагировали полунасыщенным водным раствором гидрокарбоната натрия порциями по 200 мл. Эти водные экстракты объединяли, осторожно подкисляли соляной кислотой и вновь тщательно экстрагировали этиловым эфиром уксусной кислоты. Полученные таким путем ацетатные экстракты объединяли, сушили над сульфатом натрия, фильтровали через активированный уголь и упаривали в вакууме. Остаток выкристаллизовывался при растирании с диэтиловым эфиром. Выход: 22,2 г (64% от теории) бесцветных кристаллов с Rf 0,35 (СР Е). ИК (КВr): 1741, 1714, 1648 см-1 (С=O). Пример А 5. [1,4']Бипиперидинил-1'-уксусная кислота. Смесь из 3,86 г (0,012 моля) бензилового эфира [1,4']бипиперидинил-1'-уксусной кислоты, 100 мл метанола и 1,0 г палладиевой черни гидрировали до прекращения поглощения водорода. После этого катализатор отфильтровывали, фильтрат упаривали в вакууме и остаток растирали с диэтиловым эфиром, фильтровали на нутче и сушили в вакууме. Выход: 2,13 г (78% от теории). ИК(КВr): 1674 cм-1 (C=O). МС (ESI): (М+Н)+=227; (М-Н)-=225; (М+Na)+=249. Пример А 6. 4-(4-Метил-1-пиперазинил)-1-пиперидинуксусная кислота. К раствору 10,0 г (135,069 тмоля) безводной глиоксиловой кислоты и 24,76 г (135,08 ммоля) 4-(4 метил-1-пиперазинил)пиперидина в 500 мл тетрагидрофурана добавляли 500 мг n-толуолсульфоновой кислоты и 12 мл (0,21 моля) ледяной уксусной кислоты, а затем небольшими порциями добавляли 37,2 г(175,555 ммоля) триацетоксиборогидрида натрия и оставляли на ночь для перемешивания при КТ. При последующем перемешивании по каплям добавляли 60 мл воды, тетрагидрофурановый раствор деканти-27 005600 ровали и оставшийся продукт несколько раз дигерировали свежим дихлорметаном порциями по 20 мл,который отбрасывали. Далее продукт растворяли в 50 мл воды, полученный раствор трижды встряхиванием экстрагировали дихлорметаном порциями по 30 мл и упаривали в вакууме. Остаток трижды тщательно промывали смесью ацетон/дихлорметан (в объемном соотношении 1:1) порциями по 20 мл и сушили в вакууме. Таким путем получили целевой продукт в виде бесцветных кристаллов с выходом 18,8 гMC (ESI): (M+H)+=242; (М-Н)-=240. Пример А 7. (R,S)-4-Aмино-3,5-дибром[(4-метил-1-пиперазинил)ацетил]аминооксобензолмасляная кислота. К раствору 8,7 г (0,01672 моля) метилового эфира (R,S)-4-амино-3,5-дибром[(4-метил-1 пиперазинил)ацетил]аминооксобензолмасляной кислоты в 200 мл метанола добавляли 18 мл 1 молярного раствора едкого натра и перемешивали в течение ночи при КТ. После этого по каплям добавляли 18 мл 1 М соляной кислоты и смесь упаривали в вакууме. Остаток взмучивали в смеси дихлорметан/изопропанол (в объемном соотношении 5:1) и фильтровали и остаток тщательно промывали той же смесью растворителей. Из объединенных фильтратов удаляли растворитель в вакууме, остаток растирали с диэтиловым эфиром, фильтровали на нутче и сушили в вакууме. Таким путем получили 5,6 г (66% от теории) целевого соединения в виде бесцветных кристаллов. ИК (КВr): 1670 см-1 (С=O).MC (ESI): (М-Н)-=503/505/507 (Вr2). Аналогичным образом получали следующее соединение: Пример А 8. Бензиловый эфир [1,4']бипиперидинил-1'-уксусной кислоты. К раствору 4,0 г (0,01746 моля) [1,4']бипиперидинила и 2,08 мл (0,018 моля) бензилового эфира бромуксусной кислоты в 100 мл тетрагидрофурана по каплям добавляли раствор 3,264 мл (0,019 моля) ДИЭА в 50 мл ТГФ. После этого перемешивали в течение ночи, смесь упаривали в вакууме и остаток распределяли между насыщенным водным раствором гидрокарбоната натрия и этиловым эфиром уксусной кислоты. Органическую фазу сушили над сульфатом натрия и удаляли растворитель, остаток растворяли в диизопропиловом эфире и вновь упаривали. Таким путем получили 3,86 г (70% от теории) бесцветного целевого соединения. ИК (КВr): 1751 см-1 (С=O).MC (ESI): (M+H)+=317. Пример А 9. Метиловый эфир (R,S)-4-амино-3,5-дибром[(4-метил-1-пиперазинил)ацетил]аминооксобензолмасляной кислоты. Указанное в заголовке соединение получали аналогично примеру 1 из гидробромида метилового эфира (R,S)-,4-диамино-3,5-дибромоксобензолмасляной кислоты, дигидрохлорангидрида 4-метил-1 пиперазинуксусной кислоты, ТБТУ и ГОБТ в присутствии триэтиламина и ДМФ с выходом 43% от теории. Бесцветные кристаллы с Rf 0,65 (СР Г). ИК (КВr): 1751, 1672 см-1 (С=O). МС: M+=518/520/522 (Вr2). Аналогичным путем получали следующие соединения:-28 005600 Пример А 10. Трифторацетат (R,S)-2-амино-4-(4-амино-3,5-дихлорфенил)-1-4-[2(2 Н)-оксо-1,3,4,5 тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил-1,4-бутандиона. Указанное в заголовке соединение получали аналогично примеру 2 из (R,S)-4-(4-амино-3,5 дихлорфенил)-2-[(1,1-диметилэтоксикарбонил)амино]-1-4-[2(2 Н)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил-1,4-бутандиона и трифторуксусной кислоты в дихлорметане с количественным выходом. Бесцветные кристаллы с Rf 0,41 (CP Ж). ИК (КВr): 1657 (С=O); 1203, 1176 (трифторацетат) см-1. МС (ESI): (М-Н)-=502/504/506 (Cl2); (M+Н)+=504/506/508 (Cl2). Аналогичным путем получали следующие соединения: Пример А 11. (R,S)-,4-диамино-3,5-дихлороксобензолмасляная кислота. 4,0 г (15,38 ммоля) (Е)-4-амино-3,5-дихлороксобензолбутеновой кислоты и 100 мл насыщенного аммиаком метанола выдерживали в течение 4 ч при 30 С с применением высокоэффективного холодильника с помещенной в него смесью сухой лед/метанол. После этого из смеси удаляли растворитель, остаток размешивали с диизопропиловым эфиром, фильтровали на нутче и сушили в вакууме. Таким путем получили 3,69 г (87% от теории) бесцветных кристаллов. ИК (КВr): 3460, 3392, 3338, 3184, 3072 (NH2,ОН); 1668 (С=O) см-1. МС (ESI): (М-Н)-=275/277/279 (Сl2); (М+Н)+=277/279/281 (Cl2). Аналогичным путем получали следующее соединение: Пример А 12. (Е)-4-(4-Aмино-3,5-дихлорфенил)-4-оксо-2-бутеновая кислота. Смесь из 69,583 г (0,341 моля) 1-(4-амино-3,5-дихлорфенил)-1-этанона, 47,038 г (0,511 моля) гидрата глиоксиловой кислоты, 0,8 г n-толуолсульфоновой кислоты и 500 мл ледяной уксусной кислоты в течение 7 ч кипятили с обратным холодильником. После этого смесь оставляли на ночь при КТ, а затем отфильтровывали на нутче выпавшие кристаллы, которые тщательно промывали водой и сушили при 70 С в камерной сушилке с циркуляцией воздуха до постоянной массы. Таким путем получили 24,0 гMC (ESI): (M-H)-=258/260/262 (Cl2). Пример А 13. (R,S)-4-(4-Aмино-3,5-дибромфенил)-2-(2-хлорэтансульфониламино)-1-4-[2(2 Н)-оксо 1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил-1,4-бутандион. К смеси из 1,00 г (1,414 ммоля) трифторацетата (R,S)-2-амино-4-(4-амино-3,5-дибромфенил)-1-4[2(2 Н)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил-1,4-бутандиона (соед.18),0,418 мл (3,0 ммоля) триэтиламина и 20 мл дихлорметана по каплям добавляли, поддерживая температуру реакции не выше 10 С, 0,152 мл (1,414 ммоля) 97%-ного хлорангидрида 2-хлорэтансульфоновой кислоты, перемешивали в течение ночи при КТ, повторно добавляли 0,3 мл хлорангидрида 2 хлорэтансульфоновой кислоты и перемешивали в течение 24 ч при КТ. После этого растворитель удаляли в вакууме, остаток распределяли между 100 мл воды и 100 мл дихлорметана, отфильтровывали нерастворимый остаток, дихлорметановую фазу сушили над сульфатом натрия и вновь упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле с использованием для элюирования СР Ж. Из соответствующих фракций получили 200 мг (20% от теории) бесцветных кристаллов (диизопропиловый эфир) с Rf 0,52 (СР Ж). МС (ESI): (М-Н)-=716/718/720 (Вr2). Аналогичным путем получали следующие соединения: Пример А 14. Этиловый эфир 4-(4-амино-3,5-дибромфенил)-2-метил-4-оксо-2-бутеновой кислоты. При внешнем охлаждении и поддержании внутренней температуры в 0 С приготавливали смесь из 20,0 г (61,546 ммоля) гидрата 4-амино-3,5-дибромоксофенилацетальдегида и 22,305 г (61,546 ммоля) этилового эфира 2-(трифенилфосфилен)пропионовой кислоты в 300 мл ТГФ, после чего в течение 2 ч давали нагреться до КТ, перемешивали в течение ночи при КТ, удаляли растворитель в вакууме и остаток хроматографировали на силикагелевой колонке с использованием для элюирования смеси петролейный эфир/этиловый эфир уксусной кислоты в объемном соттношении 1:1. После обычной переработки соответствующих элюатов получили 12,8 г (53% от теории) бесцветных кристаллов с Rf 0,79 (СР петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 1:1). ИК (КВr): 3429, 3330 (NH2); 1712, 1658, (С=O) см-1. МС (ESI): (М-Н)-=388/390/392 (Вr2); (M+Na)+=412/414/416 (Вr2). Пример А 15. Гидрат 4-амино-3,5-дибромоксо-фенилацетальдегида. К раствору 27,2 г (0,245 моля) диоксида селена в смеси из 240 мл диоксана и 8 мл воды порциями добавляли 72,1 г (0,246 моля) 4-амино-3,5-дибромацетофенона и затем смесь в течение 4 ч кипятили с обратным холодильником. Еще горячую реакционную смесь очищали (осветляли) с помощью активированного угля, фильтровали и разбавляли 240 мл воды. Светло-желтые кристаллы, выпавшие после часового перемешивания фильтрата, отфильтровывали на нутче, тщательно промывали водой, после чего суспендировали в диэтиловом эфире, вновь фильтровали на нутче и сушили в вакууме. Выход: 40,02 г(53% от теории). Rf 0,65 (петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 1:1). ИК (КВr): 3462, 3354 (NH2); 1676, (С=O) см-1. МС: М+=305/307/309 (Вr2) Пример А 16. Гидробромангидрид (R,S)амино-4-гидроксиоксобензолмасляной кислоты. Смесь из 8,0 г (14,5 ммоля) дибензилового эфира -(4-бензилоксибензоил)формиламиноянтарной кислоты и 42 мл 33%-ного раствора бромисто-водородной кислоты в ледяной уксусной кислоте перемешивали в течение ночи при КТ, а затем в течение 3 ч при внутренней температуре 50 С. После этого удаляли растворитель, остаток растворяли в воде и полученный раствор однократно промывали этиловым эфиром уксусной кислоты. После упаривания водного раствора получили кристаллический продукт, который без дополнительной очистки использовали на последующей стадии. Выход: 1,0 гMC (ESI): (M+H)+=210. Пример А 17. Дибензиловый эфир -(4-бензилоксибензоил)формиламиноянтарной кислоты. К раствору 6,468 г (0,02 моля) дибензилового эфира -изоцианоянтарной кислоты (получение см. М. Seki, H. Kubota, Т. Moriya, M. Yamagishi, S. Nishimoto и К. Matsumoto, Chem. Pharm. Bull. 34, 45164522 (1986 и 6 мл триэтиламина в 15 мл ТГФ по каплям при интенсивном перемешивании и при поддержании температуры реакции в пределах от 27 до 34 С добавляли 5,3 г (0,02 моля) сырого 4 бензилоксибензоилхлорида, по окончании этой операции добавления смесь перемешивали еще в течение 2 ч при КТ и после этого летучие вещества удаляли в вакууме. Остаток растворяли в 30 мл этилового эфира уксусной кислоты, образовавшуюся суспензию трижды промывали водой порциями по 15 мл, сушили над сульфатом натрия и упаривали. Остаток растворяли в 20 мл 98%-ной муравьиной кислоты и полученную смесь перемешивали в течение 3 ч при температуре в пределах от 40 до 50 С. Муравьиную кислоту удаляли в вакууме, остаток растворяли в этиловом эфире уксусной кислоты, полученный раствор промывали водой, сушили над сульфатом натрия и вновь упаривали. Остаток кристаллизовался при растирании с н-гексаном. Выход: 8,6 г (78% от теории). ИК (КВr): 3340 (NH2); 1735, 1690, 1640 (С=O) см-1. МС (ESI): (M+H)+=550/552/554. Б. Получение конечных соединений. Пример 1. (R,S)-4-(4-Aмино-3,5-дибромфенил)-2-[(1,1-диметилэтоксикарбонил)метиламино]-1-4[2(2 Н)-оксо-1,3,4,5-тетрагидро-1,3-бензодиазепин-3-ил]-1-пиперидинил-1,4-бутандион (соед.1). Смесь из 1,5 г (3,124 ммоля) (R,S)-4-(4-амино-3,5-дибромфенил)-2-[(1,1-диметилэтоксикарбонил) метиламино]-4-оксомасляной кислоты, 0,7664 г (3,124 ммоля) 3-(4-пиперидинил)-1,3,4,5-тетрагидро-1,3-30
МПК / Метки
МПК: C07K 5/00, A61K 31/445, C07D 401/04, C07D 401/14
Метки: получения, эти, средства, замещенные, способ, содержащие, соединения, пиперидины, лекарственные
Код ссылки
<a href="https://eas.patents.su/30-5600-zameshhennye-piperidiny-soderzhashhie-eti-soedineniya-lekarstvennye-sredstva-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные пиперидины, содержащие эти соединения лекарственные средства и способ их получения</a>
Предыдущий патент: Замещенные аналоги бензопирана
Следующий патент: Способ лечения злокачественных опухолей у млекопитающего, характеризующихся аномально высокой экспрессией лиганда, индуцирующего пролиферацию клеток (april)
Случайный патент: Солнечный коллектор