Антитела повышенной продуктивности к белку активации фибробластов и способы их применения
Номер патента: 5401
Опубликовано: 24.02.2005
Авторы: Парк Джон Эдуард, Реттиг Вольфганг Й., Леже Оливье, Салдана Джоуз, Гарин-Чеса Пилар, Бамбергер Уве
Формула / Реферат
1. Антитело, имеющее гипервариабельные участки моноклонального антитела F19 мыши (ATCC HB 8269), специфически связывающееся с белком активации фибробластов, отличающееся тем, что оно имеет модификации каркасного участка, которые приводят к повышенной продуктивности данного антитела в клетках-хозяевах по сравнению с химерным антителом, содержащим вариабельные области указанного антитела F19 и чужеродные константные области, причем уровень его продуктивности в неочищенных образцах сред, который определен с помощью ELISA и/или по выходу очищенных антител, превышает уровень продуктивности и/или выход указанных очищенных химерных антител, не имеющих модификации каркасного участка, по меньшей мере в 10 раз, а аминокислота в положении 87 по Кэбату в его легкой цепи является любой аминокислотой, за исключением аспарагина.
2. Антитело, отличающееся тем, что оно имеет вариабельную область легкой цепи и вариабельную область тяжелой цепи антитела по п.1, каждая из которых соединена с константной областью антитела человека.
3. Антитело по п.2, отличающееся тем, что константная область легкой цепи антитела человека представляет собой область каппа-цепи.
4. Антитело по п.2, отличающееся тем, что константная область тяжелой цепи антитела человека представляет собой область гамма-1-цепи.
5. Антитело по любому из пп.1-4, отличающееся тем, что уровень его продуктивности в неочищенных образцах сред, который определен с помощью ELISA и/или по выходу очищенных антител, превышает уровень продуктивности и/или выход указанных очищенных химерных антител, не имеющих модификации каркасного участка, по меньшей мере в 20 раз.
6. Антитело по любому из пп.1-4, отличающееся тем, что уровень его продуктивности в неочищенных образцах сред, который определен с помощью ELISA и/или по выходу очищенных антител, превышает уровень продуктивности и/или выход указанных очищенных химерных антител, не имеющих модификации каркасного участка, по меньшей мере в 100 раз.
7. Антитело по любому из пп.1-6, отличающееся тем, что оно обладает повышенной продуктивностью в эукариотических клетках.
8. Антитело по п.7, отличающееся тем, что эукариотическая клетка представляет собой клетку яичника китайского хомячка (CHO).
9. Антитело по п.8, отличающееся тем, что аминокислота в положении 87 по Кэбату в легкой цепи выбрана из ароматических или алифатических аминокислот.
10. Антитело по п.9, отличающееся тем, что ароматическая аминокислота в положении 87 по Кэбату в легкой цепи представляет собой тирозин или фенилаланин.
11. Антитело по любому из пп.1-10, отличающееся тем, что аминокислота в положении 36 по Кэбату в легкой цепи выбрана из ароматических аминокислот.
12. Антитело по любому из пп.1-11, отличающееся тем, что оно содержит вариабельную область легкой цепи, которая имеет аминокислотную последовательность SEQ ID NO:2, как указано в Списке последовательностей.
13. Антитело по п.12, отличающееся тем, что вариабельная область легкой цепи кодируется нуклеотидной последовательностью SEQ ID NO:1, как указано в Списке последовательностей.
14. Антитело по любому из пп.1-11, отличающееся тем, что оно содержит вариабельную область легкой цепи, которая имеет аминокислотную последовательность SEQ ID NO:6, как указано в Списке последовательностей.
15. Антитело по п.14, отличающееся тем, что вариабельная область легкой цепи кодируется нуклеотидной последовательностью SEQ ID NO:5, как указано в Списке последовательностей.
16. Антитело по любому из пп.1-15, отличающееся тем, что оно содержит вариабельную область тяжелой цепи, которая имеет любую из последовательностей SEQ ID NO:8, 10, 12, 14.
17. Антитело по п.16, отличающееся тем, что вариабельная область тяжелой цепи кодируется нуклеотидной последовательностью, выбранной из SEQ ID NO:7, 9, 11, 13.
18. Антитело по любому из пп.12-17, отличающееся тем, что оно содержит вариабельную область легкой цепи, которая имеет аминокислотную последовательность SEQ ID NO:2, и вариабельную область тяжелой цепи, которая имеет аминокислотную последовательность SEQ ID NO:12.
19. Антитело по п.18, отличающееся тем, что вариабельная область легкой цепи кодируется нуклеотидной последовательностью SEQ ID NO:1, а вариабельная область тяжелой цепи кодируется нуклеотидной последовательностью SEQ ID NO:11.
20. Антитело по п.18 или 19, отличающееся тем, что оно содержит константную область легкой цепи, которая имеет аминокислотную последовательность SEQ ID NO:20, и константную область тяжелой цепи, которая имеет аминокислотную последовательность SEQ ID NO:22.
21. Антитело по любому из пп.1-12, 16 или 17, отличающееся тем, что оно содержит вариабельную область легкой цепи, которая имеет аминокислотную последовательность SEQ ID NO:2, и вариабельную область тяжелой цепи, которая имеет аминокислотную последовательность SEQ ID NO:8.
22. Антитело по п.21, отличающееся тем, что вариабельная область легкой цепи кодируется нуклеотидной последовательностью SEQ ID NO:1, а вариабельная область тяжелой цепи кодируется нуклеотидной последовательностью SEQ ID NO:7.
23. Нуклеотидная последовательность, кодирующая антитело по любому из пп.1-22.
24. Вектор на основе рекомбинантной ДНК, который содержит нуклеотидную последовательность по п.23.
25. Вектор на основе рекомбинантной ДНК по п.24, представляющий собой экспрессионный вектор.
26. Клетка-хозяин, которая содержит вектор по п.24 или 25.
27. Клетка-хозяин по п.26, отличающаяся тем, что представляет собой эукариотическую клетку.
28. Клетка-хозяин по п.27, отличающаяся тем, что представляет собой клетку млекопитающего.
29. Клетка-хозяин по п.28, отличающаяся тем, что представляет собой CHO- или COS-клетку.
30. Способ получения антитела по любому из пп.1-22, включающий стадии
(а) культивирования клетки-хозяина по любому из пп.26-29 в условиях, обеспечивающих экспрессию антитела клеткой-хозяином, и
(б) выделения антитела.
31. Способ по п.30, отличающийся тем, что клетка-хозяин представляет собой клетку млекопитающего, предпочтительно CHO- или COS-клетку.
32. Способ получения антитела по любому из пп.1-22, заключающийся в том, что культивируют клетку-хозяин, которую предварительно подвергли совместной трансфекции (котрансфекции) двумя плазмидами, несущими экспрессионные единицы легкой и тяжелой цепей соответственно, и выделяют антитело.
33. Антитело по любому из пп.1-22, отличающееся тем, что оно конъюгировано с терапевтическим агентом.
34. Антитело по п.33, отличающееся тем, что терапевтический агент выбран из группы, включающей радиоизотопы, токсины, токсоиды, воспалительные агенты и химиотерапевтические агенты.
35. Антитело по п.34, отличающееся тем, что радиоизотоп представляет собой радиоизотоп с b-излучением.
36. Антитело по п.35, отличающееся тем, что радиоизотоп выбран из группы, включающей 186рений, 188рений, 131иод и 90иттрий.
37. Антитело по любому из пп.1-22, отличающееся тем, что оно является меченым.
38. Антитело по п.37, отличающееся тем, что метка представляет собой выявляемый маркер.
39. Антитело по п.38, отличающееся тем, что выявляемый маркер выбран из группы, включающей ферменты, красители, радиоизотопы, дигоксигенин и биотин.
40. Антитело по любому из пп.1-22, конъюгированное с визуализирующим агентом.
41. Антитело по п.40, отличающееся тем, что визуализирующий агент представляет собой радиоизотоп.
42. Антитело по п.41, отличающееся тем, что радиоизотоп представляет собой изотоп с g-излучением.
43. Антитело по п.42, отличающееся тем, что радиоизотоп представляет собой 125I.
44. Фармацевтическая композиция, содержащая антитело по любому из пп.1-22 и фармацевтически приемлемый носитель.
45. Фармацевтическая композиция, содержащая антитело по любому из пп.33-36 и фармацевтически приемлемый носитель.
46. Фармацевтическая композиция, содержащая антитело по любому из пп.40-43 ш фармацевтически приемлемый носитель.
47. Фармацевтическая композиция по пп.44-46, предназначенная для лечения или визуализации опухолей, связанных с активированными фибробластами стромы и предпочтительно представляющих собой опухоли, выбранные из группы злокачественных опухолей, включающей колоректальные опухоли, немелкоклеточный рак легкого, опухоли молочной железы, рак головы и шеи, опухоли яичника, опухоли легкого, опухоли мочевого пузыря, опухоли поджелудочной железы и метастатические опухоли головного мозга.
48. Применение антитела по любому из пп.1-22 для лечения раковых заболеваний, связанных с активированными фибробластами.
49. Применение антитела по любому из пп.33-36 для лечения раковых заболеваний, связанных с активированными фибробластами.
50. Применение антитела по любому из пп.40-43 для визуализации активированных фибробластов стромы.
51. Применение антитела по любому из пп.37-39 для обнаружения в образце активированных фибробластов стромы.
52. Способ лечения опухолей, связанных с активированными фибробластами стромы, обладающими способностью образовывать специфический комплекс с антителами по любому из пп.1-22 или 33-36, предусматривающий осуществление контакта опухоли с количеством указанных антител, эффективным для лечения опухоли.
53. Способ по п.52, отличающийся тем, что опухоль выбрана из группы злокачественных опухолей, включающей колоректальные опухоли, немелкоклеточный рак легкого, опухоли молочной железы, рак головы и шеи, опухоли яичника, опухоли легкого, опухоли мочевого пузыря, опухоли поджелудочной железы и метастатические опухоли головного мозга.
54. Способ по п.52, отличающийся тем, что контакт осуществляют in vitro.
55. Способ по п.52, отличающийся тем, что контакт осуществляют in vivo.
56. Способ обнаружения активированных фибробластов стромы в области заживления раны, воспаления или в опухоли, отличающийся тем, что
(а) осуществляют контакт образца, который может содержать активированные фибробласты стромы с антителом по любому из пп.1-22 или 37-39 в условиях, обеспечивающих формирование комплекса между антителом и антигеном, и
(б) обнаруживают комплекс, тем самым выявляя присутствие активированных фибробластов стромы в области заживления раны, воспаления или в злокачественной опухоли.
57. Способ по п.56, отличающийся тем, что опухоль выбрана из группы злокачественных опухолей, включающей колоректальные опухоли, немелкоклеточный рак легкого, опухоли молочной железы, рак головы и шеи, опухоли яичника, опухоли легкого, опухоли мочевого пузыря, опухоли поджелудочной железы и метастатические опухоли головного мозга.
58. Способ по п.56 или 57, отличающийся тем, что антитело представляет собой антитело по любому из пп.37-39.
59. Способ визуализации активированных фибробластов стромы в области заживлении раны, воспаленной кожи или в опухоли больного человека, отличающийся тем, что
(а) больному вводят антитело по любому из пп.1-22, конъюгированное с визуализирующим агентом в условиях, обеспечивающих образование комплекса антитело-антиген, и
(б) осуществляют визуализацию любого полученного таким образом комплекса.
60. Способ по п.59, отличающийся тем, что опухоль выбрана из группы злокачественных опухолей, включающей колоректальные опухоли, немелкоклеточный рак легкого, опухоли молочной железы, рак головы и шеи, опухоли яичника, опухоли легкого, опухоли мочевого пузыря, опухоли поджелудочной железы и метастазирующие опухоли головного мозга.
61. Способ обнаружения стромы опухоли, отличающийся тем, что
(а) осуществляют контакт тестируемого образца с антителом по любому из пп.1-22 в условиях, обеспечивающих образование комплекса антитело-антиген,
(б) обнаруживают любой полученный таким образом комплекс и
(в) устанавливают взаимосвязь между выявленным комплексом и наличием стромы опухоли.
62. Способ по п.60, отличающийся тем, что антитело метят выявляемым маркером.
63. Способ визуализации стромы опухоли у больного человека, предусматривающий
(а) введение больному антитела по любому из пп.40-43 в условиях, обеспечивающих образование комплекса антитело-антиген, и
(б) выявляют любой полученный таким образом комплекс, тем самым осуществляя визуализацию стромы опухоли у больного человека.
64. Антитело, имеющее гипервариабельные участки моноклонального антитела F19 мыши (ATCC HB 8269), специфически связывающееся с белком активации фибробластов, содержащее вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:2.
65. Антитело по п.64, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:12.
66. Антитело по пп.64 или 65, содержащее константную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:20, и константную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:22.
67. Молекула ДНК, кодирующая антитело по любому из пп.64-66.
68. Клетка-хозяин, содержащая молекулу ДНК по п.67.
69. Способ получения антитела по любому из пп.64-66, предусматривающий стадии
(а) культивирования клетки-хозяина по п.68 в условиях, обеспечивающих экспрессию антитела клеткой-хозяином, и
(б) выделения антитела.
70. Антитело по любому из пп.64-66, конъюгированное с радиоизотопом, предпочтительно с 131I, 125I, 186Re, 188Re или 90Y.
71. Фармацевтическая композиция, содержащая антитело по любому из пп. 64-66 или 70 и фармацевтически приемлемый носитель.
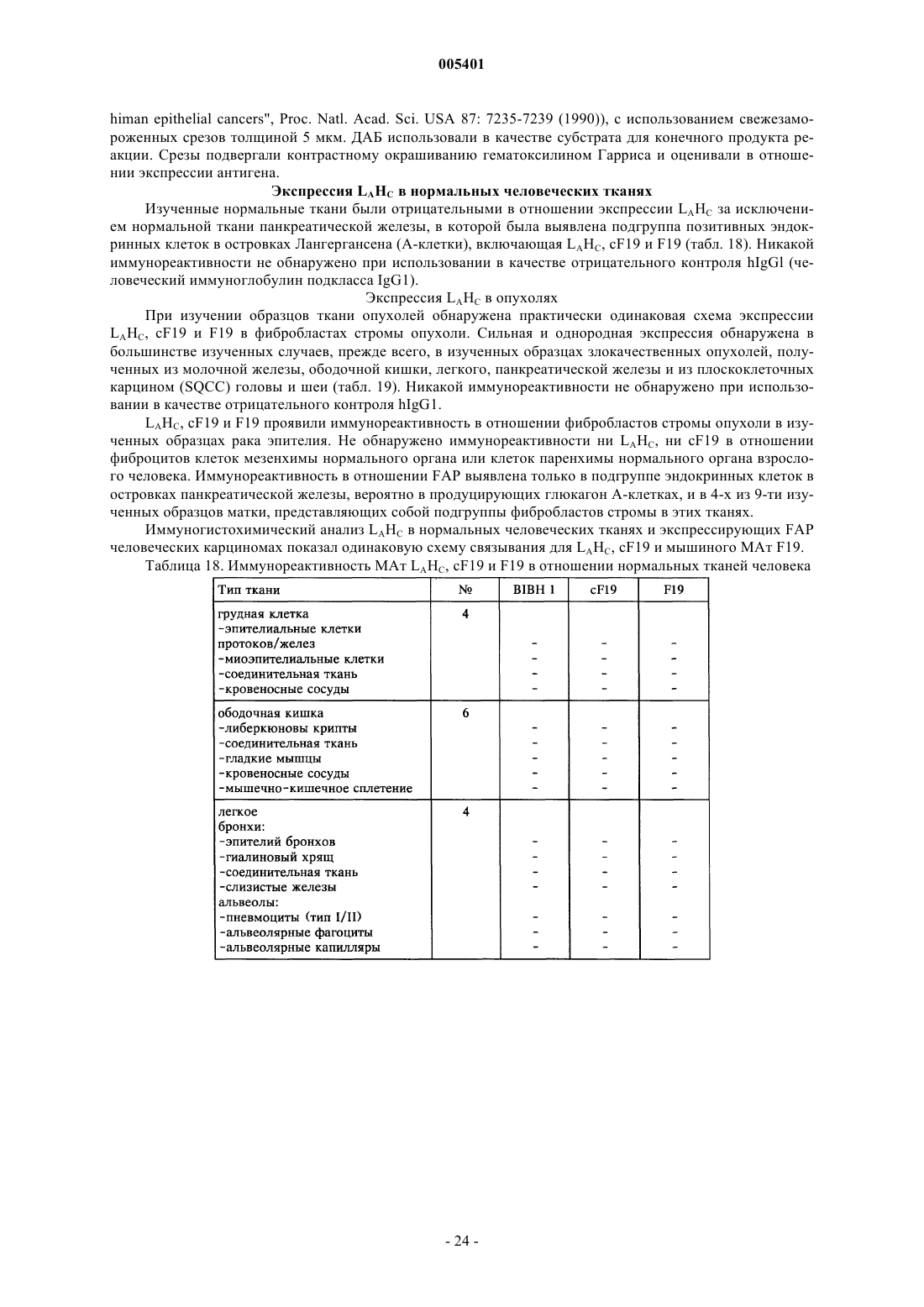
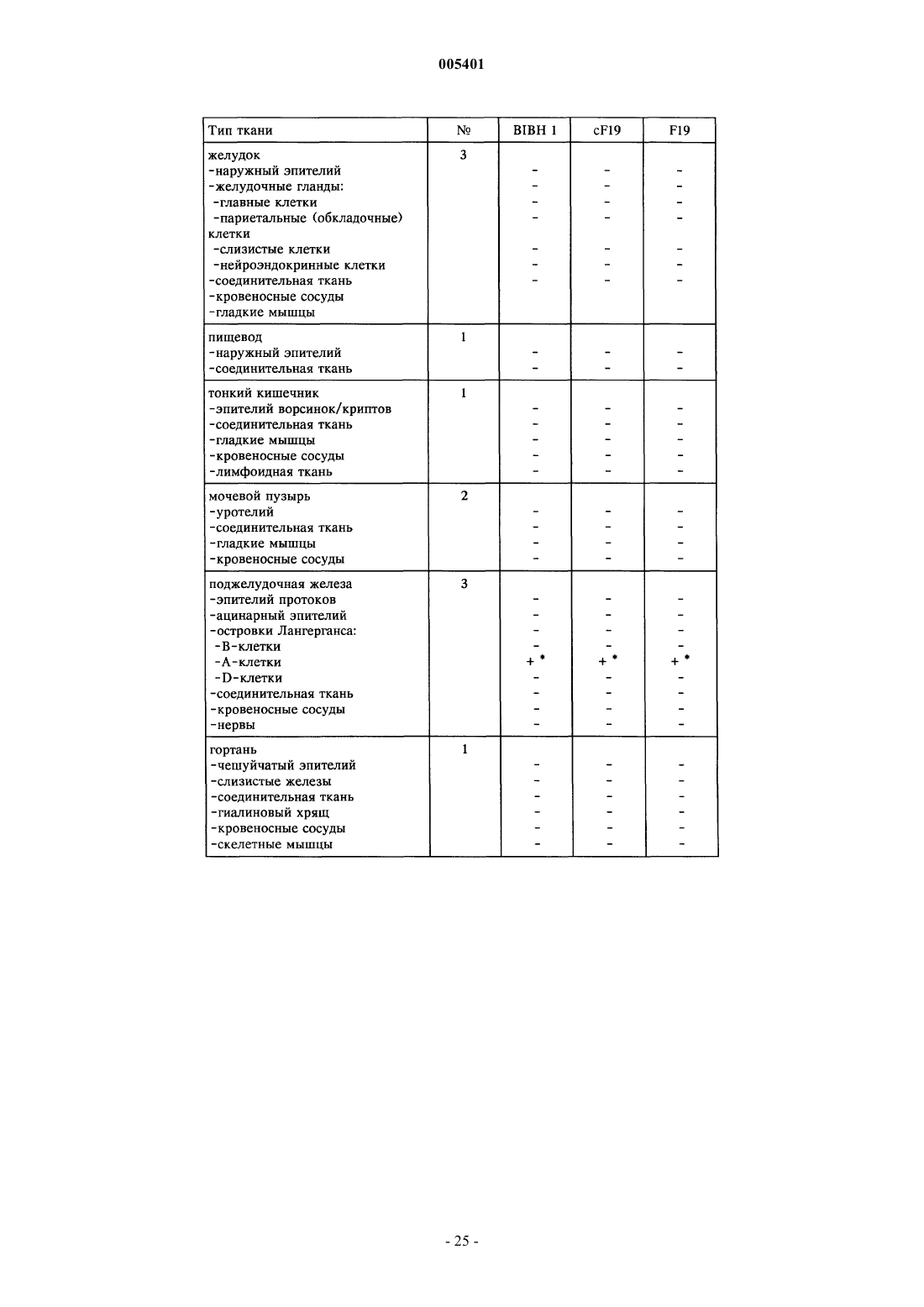
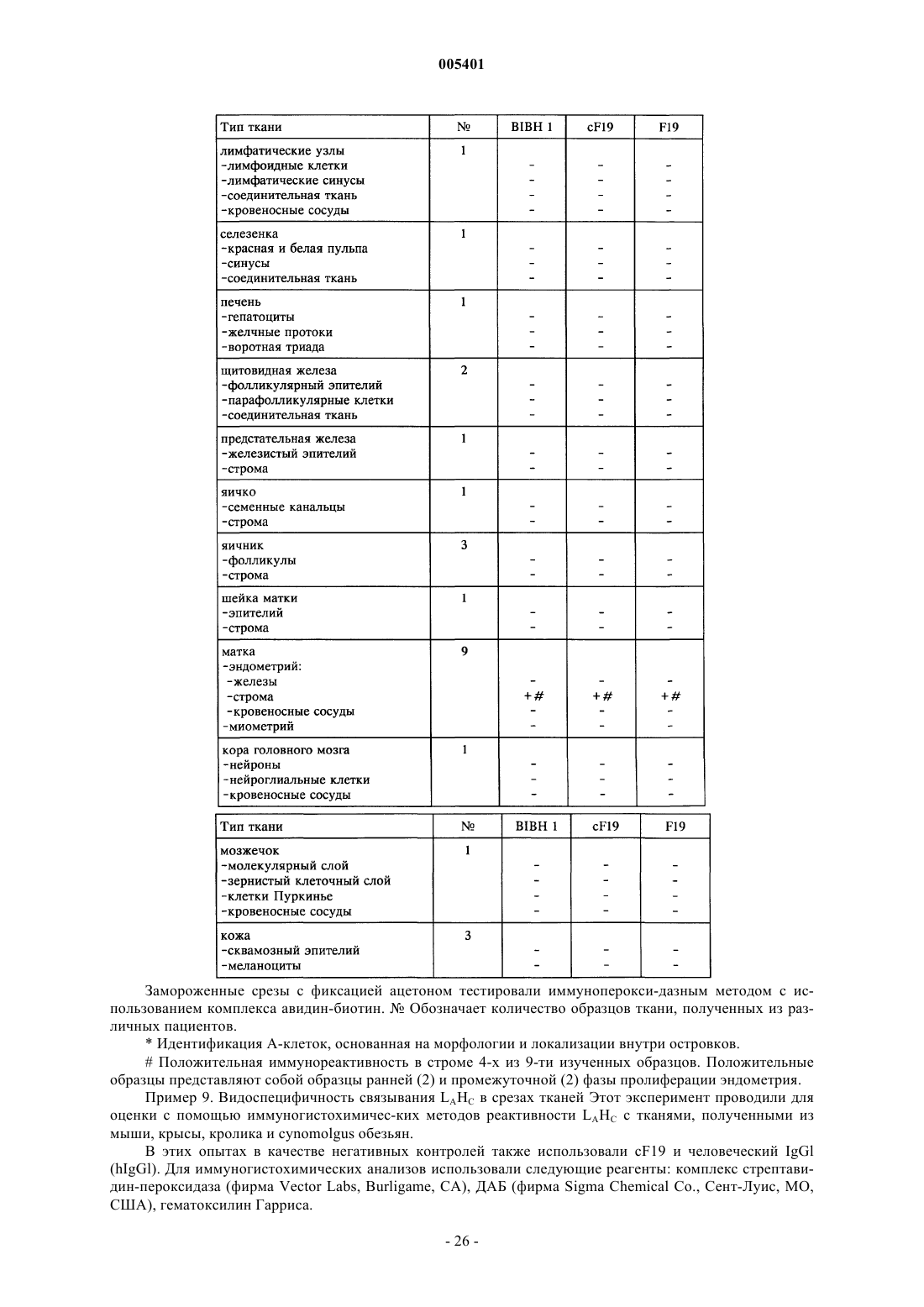
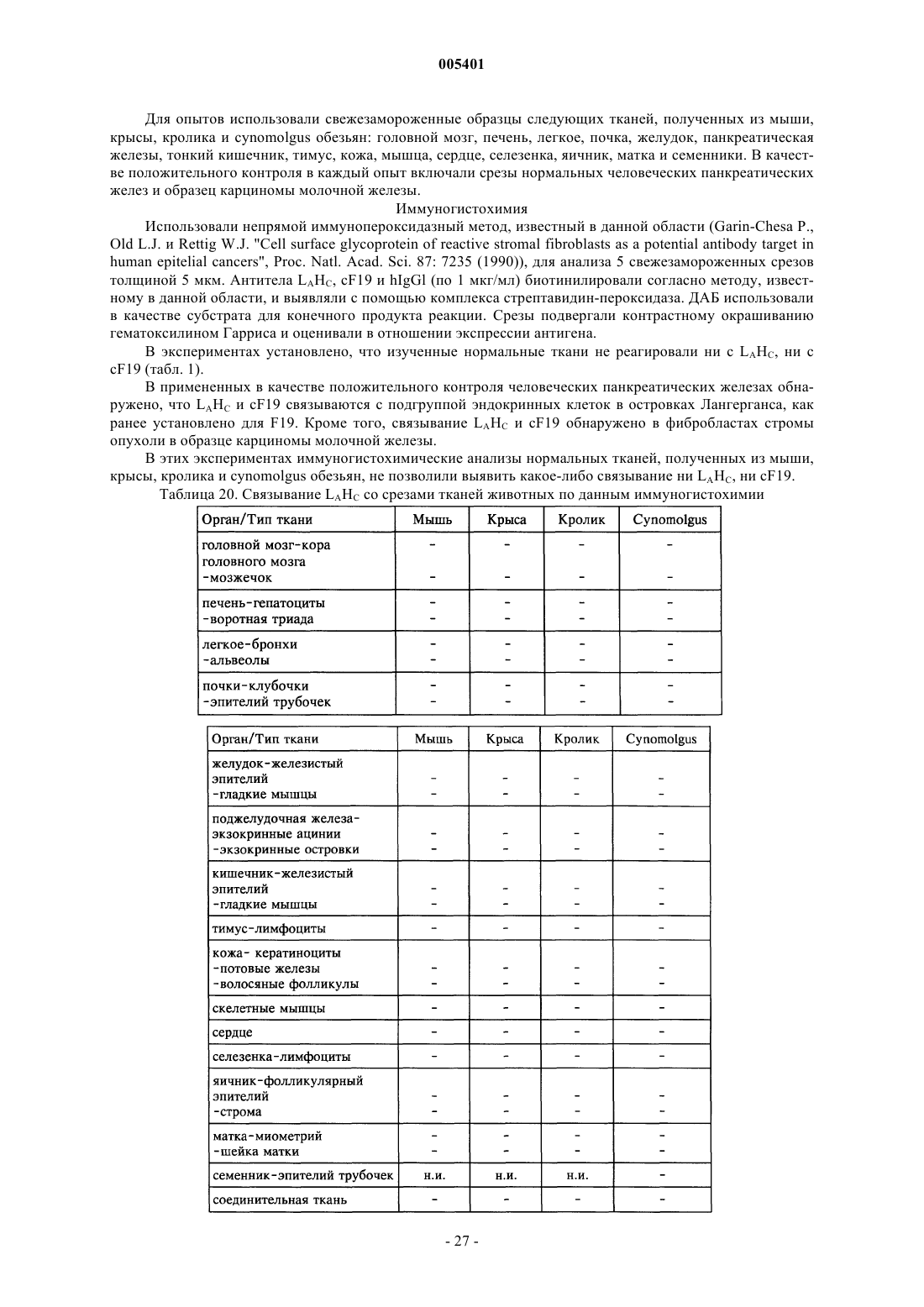
Текст
005401 Область техники, к которой относится изобретение Настоящее изобретение относится к антителам, специфично связывающимся с белком активации фибробласта (FAP). Изобретение также относится к применению этих антител для диагностических и терапевтических целей и к способам получения антител. Предпосылки создания изобретения Инвазивный рост злокачественных опухолей эпителиальной ткани связан с многочисленным характерными изменениями в поддерживающей строме на клеточном и молекулярном уровне. Наиболее постоянным признаком на молекулярном уровне реактивной стромы при многих типах злокачественных опухолей эпителиальной ткани является индукция белка активации фибробласта альфа (далее обозначен как FAP), молекулы клеточной поверхности реактивных фибробластов стромы, которые первоначально были идентифицированы с помощью моноклонального антитела F19 (Garin-Chesa P., Old L.J. и Rettigcancers", Proc. Natl. Acad. Sci. 87: 7235 (1990. Поскольку антиген FAP избирательно экспрессируется в строме ряда эпителиальных карцином, независимо от их локализации и гистологического типа, разрабатывалась связанная с использованием в качестве мишени FAP концепция для визуализации, диагностики и лечения злокачественных опухолей эпителиальной ткани и некоторых других состояний. Для этой цели было создано моноклональное антитело, которое специфично связывается с FAP, обозначенное какF19 и описанное в патенте US 5059523 и WO 93/05804, которые полностью включены в настоящее описание в виде ссылки. Одной из серьезных проблем, возникающих когда антитела, полученные не из человека, а из других источников, применяют in vivo на людях. Гуманизация антител, как правило, может быть осуществлена с помощью одного из двух путей: (1) с помощью конструирования химерных антител человека, когда вариабельные области антитела связывают с константными областями антитела человека (Boulianne G.L.,Hozumi N. и Shulman M.J. "Production of functional chimeric mouse/human antibody", Nature 312: 643(1984 или (2) путем трансплантации гипервариабельных участков (CDR) из вариабельных областей в вариабельные области антител человека и затем соединения этих "преобразованных" вариабельных областей антител человека с константными областями антител человека (Riechmann L., Clark M., Waldmann Н. и Winter G. "Reshaping human antibody for therapy", Nature 332: 323 (1988. Химерные антитела, хотя они обладают значительно более высокой активностью, чем антитела мыши, все еще могут вызвать у людей реакцию на антитело мыши (LoBuglio A.F., Wheeler R.H., Trang J., Haynes A., Rogers K., Harveyimmune response. Proc. Natl. Acad. Sci. 86: 4220 (1989. Антитела человека с трансплантированными CDR или "преобразованные" антитела человека содержат лишь небольшую часть или не содержат вообще последовательностей протеина, которые могут быть идентифицированы как антитела, происходящие из мыши. Хотя антитело, гуманизированное с помощью трансплантации CDR, все еще может вызвать определенные иммунные ответы, такие как антиаллотипическая реакция или антиидиотипическая реакция,которые также могут быть обнаружены даже и при применении природных антител человека, антитело с трансплантированными CDR должно быть в значительной степени менее иммуногенным, чем антитело мыши, что дает возможность осуществлять более пролонгированное лечение пациента. Другим серьезным ограничением коммерческого применения антител для диагностики, визуализации и терапии является необходимость их получения в больших количествах. Во многих случаях рекомбинантная экспрессия природного, химерного антитела и/или антитела с трансплантированными CDR в системах для культивирования клеток является весьма низкой. Факторы, обусловливающие низкую продуктивность, могут зависеть от выбора лидерных последовательностей и выбора клеток-хозяев для производства, а также от несоответствующей складчатости цепи антитела и пониженной секреции. Несоответствующая складчатость может привести к плохой сборке тяжелых и легких цепей или транспорту некомпетентной конформации, что предотвращает секрецию одной или обеих цепей. В целом, считается,что L-цепь обусловливает способность к секреции собранного белка. В некоторых случаях несколько или даже одна замена может привести к повышенной продуктивности антител. Из-за клинической важности специфической иммунологической направленности in vitro и in vivo связанных с конкретными болезнями антигенов для диагностики и терапии людей, имеется растущая потребность в антителах, которые объединяют такие особенности, как специфичность в отношении антигенов, низкая иммуногенность и высокая продуктивность. Таким образом, основной задачей настоящего изобретения являются антитела, которые объединяют такие свойства как специфичность связывания с FAP, низкая иммуногенность для людей и высокая продуктивность в рекомбинантных системах. Описание изобретения Техническая проблема решается с помощью вариантов осуществления, представленных в формуле изобретения. Настоящее изобретение относится к антителам, имеющим гипервариабельные участки моноклонального антитела F19 (АТСС регистрационный номер НВ 8269), причем эти антитела специфически связываются с белками активации фибробласта и отличаются тем, что они имеют модификации каркас-1 005401 ного участка, которые приводят к повышенной продуктивности в клетках-хозяевах по сравнению с химерным антителом, содержащим вариабельные области F19 и чужеродные константные области. В контексте настоящего описания понятие "антитела" обозначает белок, обладающий специфичностью моноклонального антитела в отношении связывания антигена. Понятие "гипервариабельные участки моноклонального антитела" обозначает такие аминокислотные последовательности, которые участвуют в специфичном связывании антигена согласно Кэбату (Kabat E.A.m Wu T.T., Perry Н.М., Gotteasman K.S. и Foeller С. "Sequences of Proteins of ImmunologicalBiol. 196: 901-917 (1987. В контексте настоящего описания понятие "модификации каркасного участка" обозначает изменение, делецию или добавление одной или нескольких аминокислот в вариабельные области, окружающие отдельные гипервариабельные участки. Модификации каркасного участка могут оказывать влияние на иммуногенность, продуктивность или специфичность связывания антитела. Понятие "белок активации фибробласта (FAP)", также обозначаемый как белок активации фибробласта альфа (FAP ), представляет собой связанный с мембраной гликопротеин, принадлежащий к семейству серинпротеаз (WO 97/34927). Не известна ни выделяемая, ни секретируемая форма FAP. FAP может быть охарактеризован путем его связывания с моноклональным антителом F19 (F19 может быть получен из линии клеток гибридомы с регистрационным номером НВ 8269, депонированной в АТСС). Понятие "специфическое связывание белка активации фибробласта" антителом в контексте настоящего описания относится к его способности специфически распознавать и связывать экспрессирующие FAP человеческие клетки. Специфичность связывания белков по изобретению может быть определена стандартными методами по оценке специфичности связывания, такими как описанные в качестве иллюстрации в примерах 6, 8 и примере 12. Понятие "химерное антитело" обозначает антитело, имеющее вариабельные области легкой и тяжелой цепи, такие как приведенные на фиг. 17 и 18, и чужеродные константные области. "Чужеродные константные области" в контексте настоящего описания обозначают константные области, которые отличны от константных областей F19. При сравнении антитела по изобретению с химерным антителом должно быть очевидно, что такое химерное антитело должно содержать такие же константные области, что и антитело. Исключительно для цели демонстрации и сравнения в качестве примера использовали константную область тяжелой и легкой цепей антитела человека, как представлено на фиг. 19-22. Для создания антител по настоящему изобретению нуклеотидные последовательности генов тяжелой и легкой цепей антитела мыши были выделены с использованием РНК, экстрагированной из клеток линии гибридомы F19 (регистрационный номер АТСС НВ 8269). Согласно одному из вариантов осуществления настоящее изобретение относится к антителам,имеющим гипервариабельные участки моноклонального антитела F19 (регистрационный номер АТСС НВ 8269), причем эти новые антитела специфически связываются с белком активации фибробласта(FAP), которые отличаются тем, что они имеют модификации каркасного участка, приводящие к повышенной продуктивности в клетках-хозяевах по сравнению с химерным антителом, включающим вариабельные области F19 и чужеродные константные области, причем это антитела получают из антитела мыши, обозначенного F19 (регистрационный номер АТСС НВ 8269). Для получения гуманизированных FAP-специфических антител конструировали химерное антитело, имеющее вариабельные области легкой и тяжелой цепей F19 и, соответственно, константные области легкой и тяжелой цепей антитела человека. Конструирование и производство химерных антител мышь/человек являются хорошо известными (Boulianne и др. (1984), см. выше) и с целью иллюстрации продемонстрированы в примерах 1 и 2. Вариабельные области антитела по настоящему изобретению, как правило, связаны по меньшей мере с частью константной области иммуноглобулина (Fc), обычно иммуноглобулина человека. Последовательности ДНК константной области антитела человека могут быть выделены с помощью хорошо известных методик из разнообразных клеток человека, но предпочтительно из иммортализованных Вклеток (см. Kabat и др., выше и WO 87/02671). Следовательно, антитела по изобретению могут содержать всю константную область или только ее часть, лишь бы они специфически связывались с антигеном FAP. Выбор типа и протяженности константной области зависит от того, требуется ли сохранить эффекторные функции типа фиксации комплемента или зависящая от антитела цитотоксичность, а также от требуемых фармакологических свойств антитела. Антитела по изобретению могут представлять собой тетрамер,состоящий из двух пар легкая цепь/тяжелая цепь, но также может представлять собой димер, т.е. состоять из пары легкая цепь/тяжелая цепь, например Fab- или Fv-фрагмент. Таким образом, еще одним объектом настоящего изобретения являются антитела, отличающиеся тем, что они имеют вариабельную область легкой цепи и вариабельную область тяжелой цепи, каждая из которых соединена с константной областью антитела человека. В частности вариабельная область легкой цепи соединена с каппа-константной областью антитела человека (константная область каппа-цепи) и вариабельная область тяжелой цепи соединена с гамма-1-константной областью антитела человека (кон-2 005401 стантная область гамма-1-цепи). Специалистам также известны другие константные области антитела человека, пригодные для гуманизации легкой и тяжелой цепей. Таким образом, согласно одному из вариантов осуществления антитела по изобретению содержат каппа-константную область антитела человека. Согласно еще одному варианту осуществления антитела по изобретению содержат гамма-1 константную область антитела человека. Конкретное "химерное антитело F19" (cF19) состоит из вариабельных и константных областей тяжелой и легкой цепей, приведенных на фиг. 17-22. cF19 проявляет специфичность связывания и высокую авидность к антигену FAP. Как продемонстрировано в примере 2, продукция cF19 COS-клетками (клетками, полученными из почки африканской зеленой мартышки) является невысокой, составляющей от примерно 10 до 60 нг/мл, что по меньшей мере в 10 раз ниже, чем для большинства антител. С целью попытки повысить продуктивность cF19 лидерная последовательность VL- области F19 была изменена путем замены пролина на лейцин в положении -9. Эта одна замена аминокислоты в лидерной последовательности привела к увеличению по меньшей мере в 2 раза количества химерного антитела, продуцируемого в COS-клетках. Для обеспечения экспрессии этого конкретного химерного антитела в COS-клетках использовали следующую мутантную лидерную последовательность легкой цепи:MDSQAQVLMLLLLWVSGTCG и следующую лидерную последовательность тяжелой цепи:MGWSWVFLFLLSGTAGVLS. Согласно изобретению понятие "повышенная продуктивность" в клетках-хозяевах относится к значительному повышению продуктивности и/или выхода очищенного антитела по сравнению с продуктивностью и/или выходом очищенного химерного антитела, не имеющего указанных выше модификаций каркасного участка. Двумя конкретными, не огранивающими объем изобретения примерами, демонстрирующими повышение продуктивности, являются повышение продуктивности в системе экспрессии COSклеток (примеры 2 и 5) и в системе экспрессии СНО-клеток (примеры 10 и 11). В то время как мутация лидерной последовательности приводит только к двукратному повышению продуктивности химерного антитела F19, значительное повышение согласно настоящему изобретению обозначает повышение продуктивности и/или выхода очищенного антитела по меньшей с 10 раз. Согласно предпочтительному варианту осуществления изобретение относится к антителам, отличающимся тем, что их продуктивность в неочищенных образцах сред, которые определены с помощьюELISA и/или по выходу очищенных антител, превышают продуктивность и/или выход очищенных химерных антител, не имеющих модификации каркасного участка, по меньшей мере в 10 раз. Согласно более предпочтительному варианту осуществления изобретение относится к антителам,отличающимся тем, что их продуктивность в неочищенных образцах сред, которые определены с помощью ELISA и/или по выходу очищенных антител, превышает продуктивность и/или выход очищенных химерных антител, не имеющих модификации каркасного участка, по меньшей мере в 20 раз. Согласно наиболее предпочтительному варианту осуществления изобретение относится к антителам, отличающимся тем, что их продуктивность в неочищенных образцах сред, которые определены с помощью ELISA и/или по выходу очищенных антител, превышает продуктивность и/или выход очищенных химерных антител, не имеющих модификации каркасного участка, по меньшей мере в 100 раз. Повышенная продуктивность рекомбинантных протеинов по изобретению может быть продемонстрирована на эукариотических клетках в целом, например, на эукариотических клетках COS и СНО (клетки яичника китайского хомячка) (см. примеры 5 и 11). Согласно еще одному варианту осуществления настоящее изобретение относится к рекомбинантым антителам повышенной продуктивности в эукариотических клетках. Согласно предпочтительному варианту осуществления настоящее изобретение относится к антителам, отличающимся тем, что эукариотическая клетка представляет собой клетку яичника китайского хомячка (СНО-клетку). При создании изобретения неожиданно было установлено, что определенные модификации каркасного участка вариабельных областей легкой цепи определяют повышенную продуктивность антитела по изобретению. Были получены три версии преобразованных вариабельных областей легкой цепи, обозначенные как версии А, В и С, приведены на фиг. 1-6. Для версий А, В и С вариабельных областей легкой цепи обнаружена в значительной степени повышенная продуктивность в СНО-клетках (см. пример 11). Хотя версии А и С вариабельных областей легкой цепи отличаются от версии В вариабельной области только двумя общими аминокислотными остатками, для них характерно еще более значительное повышение продуктивности. Существует по меньшей мере еще 10-кратное различие по уровням секреции антитела между версией В преобразованной легкой цепи антитела человека F19 и версиями А или С. Аминокислотные последовательности версий А и В преобразованной легкой цепи антитела человека F19 отличаются только двумя остатками в положениях 36 (замена Туr на Phe) и 87 (замена Туr на Asp) (номенклатура дана согласно Кэбату). Это отрицательное воздействие на секреторную способность антител, содержащих версию В вариабельной области легкой цепи, может оказаться косвенным, если замены Туr на Asp и Туr на Phe, при их рассмотрении индивидуально или в сочетании, главным образом, вызывают неправильную складчатость антитела. Но это-3 005401 предположение является маловероятным, поскольку опыты по связыванию антигена показали, что иммуноглобулины, содержащие версию В легкой цепи F19, обладают такими же авидностями, что и версии А и С легкой цепи F19, что позволяет предположить, что они не могут иметь значительное нарушение складчатости. Остаток 87 в версии В преобразованной легкой цепи антитела человека F19, вероятно, ответственен за уменьшение секреции по сравнению с версиями А и С. Согласно более предпочтительному варианту осуществления изобретение относится к антителам, в которых аминокислота в положении 87 по Кэбату в легкой цепи является любой аминокислотой, за исключением аспарагина. Согласно более предпочтительному варианту осуществления изобретение относится к антителам, в которых аминокислоту в положении 87 по Кэбату в легкой цепи выбирают из ароматических или алифатических аминокислот. Согласно еще более предпочтительному варианту осуществления изобретение относится к антителам, в которых аминокислота в положении 87 по Кэбату в легкой цепи представляет собой тирозин или фенилаланин. Согласно еще одному варианту осуществления изобретение также относится к антителам по изобретению, в которых аминокислоту в положении 36 по Кэбату в легкой цепи выбирают из ароматических аминокислот. Согласно предпочтительному варианту осуществления изобретение относится к специфическим антителам, которые могут быть получены из описанных по отдельности преобразованных вариабельных областей легкой и тяжелой цепей. Для практического воплощения изобретения особенно предпочтительны версии А и С вариабельной области легкой цепи вследствие их очень высокой продуктивности в сочетании с полным сохранением специфичности FAP-связывания и низкой иммуногенностью. Эти положения особенно важны при сравнении с химерным антителом, имеющим вариабельные области F19 и такие же константные области,а также при сравнении с версией В легкой цепи. Таким образом, согласно одному из вариантов осуществления настоящее изобретение относится к антителам, которые содержат вариабельную область легкой цепи, представленную в SEQ ID NO:2. Согласно еще одному из вариантов осуществления настоящее изобретение также относится к антителам, отличающимся тем, что вариабельная область легкой цепи кодируется нуклеотидной последовательностью, представленной в SEQ ID NO:1. Согласно одному из вариантов осуществления настоящее изобретение относится к антителам, которые содержат вариабельную область легкой цепи, представленную в SEQ ID NO:6. Согласно еще одному из вариантов осуществления настоящее изобретение относится к антителам,отличающимся тем, что вариабельная область легкой цепи кодируется нуклеотидной последовательностью, представленной в SEQ ID N0:5. В настоящем изобретении также описано несколько различных вариабельных областей тяжелой цепи, которые обеспечивают повышение продуктивности, с А и С вариабельными областями легкой цепи. Согласно одному из вариантов осуществления настоящее изобретение относится к антителам, которые содержат вариабельную область тяжелой цепи, соответствующей любой из последовательностей,представленных в SEQ ID NO:8, 10, 12, 14. Согласно еще одному из вариантов осуществления настоящее изобретение относится к антителам,отличающимся тем, что вариабельная область тяжелой цепи кодируется нуклеотидной последовательностью, соответствующей любой из последовательностей, представленных в SEQ ID NO:7, 9, 11, 13. Согласно особенно предпочтительному варианту осуществления изобретение относится к антителам, которые содержат вариабельную область легкой цепи, представленную в SEQ ID NO:2, и вариабельную область тяжелой цепи, представленную в SEQ ID NO:12. Наиболее предпочтительно это антитело дополнительно содержит константную область легкой цепи, представленную в SEQ ID NO:20, и константную область тяжелой цепи, представленную в SEQ ID NO:22. Таким образом, еще одним объектом настоящего изобретения является антитело, содержащее аминокислотную последовательность, представленную в SEQ ID NO:2. Более предпочтительно это антитело дополнительно содержит аминокислотную последовательность, представленную в SEQ ID NO:12. Более предпочтительно это антитело кроме того содержит аминокислотную последовательность, представленную в SEQ ID NO:20, и аминокислотную последовательность, представленную в SEQ ID NO:22. Еще одним объектом настоящего изобретения является описанное в настоящем разделе антитело, которое конъюгировано с радиоактивным изотопом, предпочтительно с 131I, 125I, 186Re, 188Re или 90Y. Еще одним объектом настоящего изобретения является молекула ДНК, которая кодирует антитело, описанное в этом разделе. Еще одним объектом изобретения является клетка-хозяин, несущая такую молекулу ДНК. Кроме того, объектом изобретения является способ получения антитела, как он описан в этом разделе, предусматривающий стадии культивирования такой клетки-хозяина в условиях, обеспечивающих экспрессию антитела клеткой-хозяином, и его выделение. Еще одним объектом изобретения является фармацевтическая композиция, включающая антитело по настоящему изобретению и фармацевтически приемле-4 005401 мый носитель. Согласно еще одному варианту осуществления изобретение относится к антителу, которое отличается тем, что вариабельная область легкой цепи кодируется нуклеотидной последовательностью, представленной в SEQ ID NO:1, а вариабельная область тяжелой цепи кодируется нуклеотидной последовательностью, представленной в SEQ ID NO:11. Согласно особенно предпочтительному варианту осуществления изобретение относится к антителам, которые содержат вариабельную область легкой цепи, представленную в SEQ ID NO:2, и вариабельную область тяжелой цепи, представленную в SEQ ID NO:8. Согласно еще одному из вариантов осуществления настоящее изобретение относится к антителам,отличающимся тем, что вариабельная область легкой цепи кодируется нуклеотидной последовательностью, представленной в SEQ ID NO:l, а вариабельная область тяжелой цепи кодируется нуклеотидной последовательностью, представленной в SEQ ID NO: 7. Гуманизация вариабельной области антитела мыши может быть осуществлена с помощью методов,хорошо известных в данной области. В ЕР 0239400 описана трансплантация CDR вариабельной области антитела мыши в каркасный участок вариабельной области антитела человека. В WO 90/07861 описаны способы преобразования трансплантированного CDR вариабельной области путем интродукции дополнительных модификаций каркасного участка. В WO 92/11018 описаны способы получения гуманизированного Ig путем объединения CDR доноров с каркасным участком акцептора, который обладает высоким уровнем гомологии с каркасным участком донора. В WO 92/05274 описано получение каркасного участка мутантных антител с использованием в качестве исходного антитела мыши. Дополнительными известными из существующего уровня техники документами, в которых описана гуманизация моноклональных антител мыши, являются ЕР 0368684; ЕР 0438310; WO 92/07075 или WO 92/22653. Таким образом, специалист в данной области может получить антитела по настоящему изобретению, используя в качестве исходного известное из литературы моноклональное антитело F19 мыши и применяя методы,известные в данной области, например, описанные в WO 92/05247. Молекулы ДНК, кодирующие антитела по настоящему изобретению, естественно также могут быть получены с использованием известных для данной области методов синтеза, например, с помощью химического синтеза соответствующих олигонуклеотидов и последующего лигирования и амплификации (см., например, Frank и др., Methods Enzymol. 154: 221-249 (1987. Еще одним объектом настоящего изобретения являются молекулы нуклеиновой кислоты, кодирующие антитела по изобретению, как они описаны выше. Предпочтительно молекула нуклеиновой кислоты по настоящему изобретению представляет собой молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15. Еще одним объектом изобретения является включающий рекомбинантную ДНК вектор, содержащий нуклеотидную последовательность любой из перечисленных выше нуклеиновых кислот, прежде всего, если эта нуклеотидная последовательность функционально связана с контролирующей экспрессию последовательностью, как это принято для экспрессионных векторов. Предпочтительным является включающий рекомбинантную ДНК вектор, причем этот вектор представляет собой экспрессионный вектор. Еще одним объектом настоящего изобретения является клетка-хозяин, несущая описанный выше вектор, предпочтительно экспрессионный вектор. Такой клеткой-хозяином может быть прокариотическая или эукариотическая клетка. Предпочтительно такая клетка-хозяин представляет собой эукариотическую клетку, дрожжевую клетку или клетку млекопитающего. Более предпочтительно эта клеткахозяин представляет собой СНО-клетку (клетку яичника китайского хомячка) или COS-клетку. Таким образом, еще одним объектом настоящего изобретения является способ получения антитела по изобретению. Такой способ включает стадии:(а) культивирования клетки-хозяина, как она описана выше, в условиях обеспечивающих экспрессию антитела клеткой-хозяином, и(б) выделения антитела. Предпочтительными являются клетки-хозяева, представляющие собой клетки млекопитающего,предпочтительно СНО- или COS-клетки. Клетки-хозяева для получения протеинов антитела по изобретению могут быть трансфектированы одним вектором, несущим единицы экспрессии как легкой, так и тяжелой цепи (см., например, WO 94/11523). Согласно одному из предпочтительных вариантов осуществления способа получения антитела по изобретению применяют клетки-хозяева, отличающиеся тем, что эти клетки-хозяева котрансфектируют двумя плазмидами, несущими единицы экспрессии легкой и тяжелой цепи, соответственно (см., например, ЕР 0481790). Антитела по изобретению представляют собой высокоспецифичный инструмент для направленного переноса терапевтических агентов к антигену FAP. Таким образом, согласно еще одному варианту осуществления изобретение относится к антителам, отличающимся тем, что антитело конъюгировано с терапевтическим агентом. Из множества терапевтических агентов, известных в данной области, предпочтительными являются такие агенты, как радиоизотопы, токсины, токсоиды, воспалительные агенты,ферменты, атисмысловые молекулы, пептиды, цитокины и химиотерапевтические агенты. Из радиоизо-5 005401 топов в качестве терапевтического агента могут применяться радиоизтопы с гамма-, бета- и альфаизлучением. Предпочтительными в качестве радиоизотопов являются радиоизотопы с -излучением. Наиболее предпочтительными из радиоизотопов с -излучением, позволяющими осуществлять локализованное облучение и разрушение злокачественных опухолевых клеток, являются 186 рений, 188 рений,131 иод и 90 иттрий. Таким образом, радиоизотопы, выбранные из группы, включающей 186 рений, 188 рений,131 иод и 90 иттрий, являются особенно предпочтительными в качестве терапевтических агентов, конъюгированных с антителами по изобретению. Например, для введения радиоактивной метки в антитело по изобретению может применяться метод, описанный в WO 93/05804. Еще одним объектом настоящего изобретения являются антитела, отличающиеся тем, что они являются мечеными. Такое антитело, несущее специфичную для FAP метку, позволяет локализовать и/или выявлять антиген FAP in vitro и in vivo. Под меткой понимают маркер, который может быть выявлен прямо или косвенно. Под косвенным маркером понимают маркер, который не может быть выявлен сам по себе, а нуждается в дополнительном непосредственно выявляемом маркере, специфичном для косвенного маркера. Предпочтительными метками для практического воплощения изобретения являются выявляемые маркеры. Из широкого разнообразия выявляемых маркеров наиболее предпочтительными являются выявляемые маркеры, выбранные из группы, включающей ферменты, красители, радиоизотопы,дигоксигенин и биотин. Еще одним объектом настоящего изобретения являются антитела, отличающиеся тем, что они конъюгированы с визуализирующим агентом. Из существующего уровня техники известно широкое разнообразие визуализирующих агентов, прежде всего радиоизотопов. Для практического воплощения изобретения особенно предпочтительными являются радиоизотопы с гамма-излучением. Наиболее предпочтительным является иод. Еще одним объектом настоящего изобретения являются фармацевтические композиции, содержащие антитела по настоящему изобретению, как они описаны выше, и фармацевтически приемлемый носитель. Такие фармацевтические композиции могут применяться для лечения опухолей, где опухоли связаны с активированными фибробластами стромы. Существует два возможных действенных принципа противоопухолевой иммунотерапии стромы, которые могут действовать синергетически: (а) немодифицированное (неконъюгированное, "обнаженное") антитело по изобретению может вызывать иммунное нарушение или воспалительные реакции в строме опухоли, в то время как (б) антитело, конъюгированное с терапевтическим агентом, таким как, например, радиоизотоп или другое токсичное соединение,может осуществлять локализованное облучение и разрушение злокачественных опухолевых клеток. Таким образом, еще одним объектом настоящего изобретения является применение антитела, как оно описано выше, для приготовления фармацевтической композиции, прежде всего для лечения опухолей. Еще одним вариантом осуществления изобретения являются фармацевтические композиции, содержащие антитело, конъюгированное с терапевтическим агентом, как описано выше, и фармацевтически приемлемый носитель, пригодные для лечения опухолей, где опухоли связаны с активированными фибробластами стромы. Другим вариантом осуществления являются фармацевтические композиции,содержащие антитело по изобретению, конъюгированное с визуализирующим агентом, как описано выше, и фармацевтически приемлемый носитель, пригодные для визуализации наличия активированных фибробластов стромы в заживающей ране, воспаленном участке кожи или опухоли у больного человека. Наиболее предпочтительный вариант осуществления относится к указанным выше фармацевтическим композициям, где опухоли представляют собой опухоли, выбранные из группы злокачественных опухолей, включающей колоректальные опухоли, немелкоклеточный рак легкого, опухоли молочной железы,рак головы и шеи, опухоли яичника, опухоли легкого, инвазивные опухоли мочевого пузыря, опухоли поджелудочной железы и метастазирующие опухоли головного мозга. При лечении животного или человека это может быть осуществлено путем введения фармацевтических композиций, как они описаны выше, внутривенным или другим путем, например, системно, локально или местно к представляющей интерес ткани или органу в зависимости от типа и происхождения болезни или цели лечения, например, опухоли. Например, системный механизм действия является желательным, когда различные органы или системы органов подлежат лечению, например, при системных аутоиммунных болезнях или аллергиях, или при трансплантациях чужеродных органов или тканей, или при опухолях, которые являются диффузными или их трудно локализовать. Местный механизм действия предусматривается, когда ожидаются только местные проявления неопластического или иммунологического действия, как, например, при локальных опухолях. Антитела по настоящему изобретению могут применяться различными путями, известными в данной области, прежде всего внутривенной инъекцией или прямой инъекций в ткани-мишени. Для системного применения предпочтительными являются внутривенный, внутиваскулярный, внутримышечный,внутиартериальный, внутибрюшинный, оральный или внутритрахеальный пути введения. Предпочтительное местное нанесение представляет собой подкожный, внутикожный, внутикардиальный, внутридольковый, интрамедуллярный, внутрилегочный путь введения или непосредственную обработку или обработку вблизи подлежащей лечению ткани (соединительной, костной, мышечной, нервной, эпитель-6 005401 нальной ткани). В зависимости от требуемой продолжительности и эффективности лечения фармацевтические композиции антитела могут быть введены один раз или несколько раз, например, периодически,например, ежедневно в течение нескольких дней, недель или месяцев, и с использованием различных доз. Для получения приемлемых композиций антитела для описанных выше способов применения специалист может использовать известные инъецируемые, физиологически приемлемые стерильные растворы. Для приготовления готового к употреблению раствора для парентеральной инъекции или инфузии легко доступны водные изотонические растворы, такие как, например, физиологические растворы или растворы соответствующего протеина плазмы. Фармацевтические композиции могут присутствовать в виде лиофилизатов или безводных препаратов, которые могут быть восстановлены с помощью известных инъецируемых растворов непосредственно перед применением в стерильных условиях, например, в качестве набора составляющих. Конечную форму композиций антитела по настоящему изобретению готовят для инъекции, инфузии или перфузии путем смешения очищенных антител по изобретению со стерильным физиологическим раствором, в который могут быть добавлены известные носители и/или добавки (например, сывороточный альбумин, декстроза, бисульфит натрия, ЭДТК). Количество введенного антитела зависит от природы болезни. В случае страдающих раком пациентов внесенная доза "обнаженного" антитела может находиться в диапазоне от 0,1 до 100 мг/м 2, предпочтительно от 5 до 50 мг/м 2 на обработку. Для радиоактивномеченных, например, с помощью иода антител должна быть определена максимальная переносимая доза (MTD), которая не должна превышать терапевтически рекомендованные дозы. Затем может быть проведено лечение радиоактивномеченным антителом страдающих раком пациентов путем повторной (ежемесячной или еженедельной) внутривенной инфузии дозы, которая ниже MTD (см., например, Welt и др., J. Clin. Oncol. 12: 1193-1203 (1994. Таким образом, одним из объектов настоящего изобретения является применение антитела по изобретению для лечения рака. Согласно предпочтительному варианту осуществления настоящее изобретение относится к применению антител по изобретению, конъюгированных с терапевтическим агентом,как описано выше, для лечения рака. Согласно другому предпочтительному варианту осуществления настоящее изобретение относится к применению антител по изобретению, конъюгированных с визуализирующим агентом для визуализации активированных фибробластов стромы. Согласно еще одному предпочтительному варианту осуществления настоящее изобретение относится к применению меченных антител по изобретению для обнаружения присутствия активированных фибробластов стромы в образце. Одним из объектов изобретения является способ лечения опухолей, где опухоль связана с активированными фибробластами стромы, обладающими способностью специфично формировать комплекс с антителами по изобретению, присутствующими в виде "обнаженных"/немодифицированных антител,модифицированных антител, таких как слитые белки, или антител, конъюгированных с терапевтическим агентом, предусматривающий контактирование опухоли с терапевтически эффективным количеством указанных антител. Согласно предпочтительному варианту осуществления настоящее изобретение относится к способу лечения опухолей, как указано выше, где опухоль представляет собой опухоль, включающую раковые клетки, выбранную из группы злокачественных опухолей, включающей колоректальные опухоли, немелкоклеточный рак легкого, опухоли молочной железы, рак головы и шеи, опухоли яичника, опухоли легкого, инвазивные опухоли мочевого пузыря, опухоли поджелудочной железы и метастазирующие опухоли головного мозга. Описанный выше способ лечения опухолей может осуществляться in vitro или in vivo. Еще одним объектом изобретения является способ выявления присутствия активированных фибробластов стромы в области заживления раны, воспаления или в опухоли, отличающийся тем, что(а) образец, который может содержать активированные фибробласты стромы, приводят в контакт с антителом по изобретению в условиях, обеспечивающих формирование комплекса между антителом и антигеном,(б) производят обнаружение присутствия комплекса, тем самым обнаруживая присутствие активированных фибробластов стромы в области заживления раны, воспаления или в злокачественной опухоли. Согласно предпочтительному варианту осуществления настоящее изобретение относится к способу выявления присутствия активированных фиброблатов стромы в опухоли, где опухоль представляет собой опухоль, включающую раковые клетки, выбранную из группы злокачественных опухолей, включающей колоректальные опухоли, немелкоклеточный рак легкого, опухоли молочной железы, рак головы и шеи, опухоли яичника, опухоли легкого, опухоли мочевого пузыря, опухоли поджелудочной железы и метастазирующие опухоли головного мозга. Наиболее предпочтительными антителами по изобретению являются антитела, отличающиеся тем, что их метят как указано выше. Еще одним объектом настоящего изобретения является способ визуализации наличия активированных фибробластов стромы в области заживлении раны, воспаленной ткани (также рассматриваются ревматоидный артирит и цирроз) или в опухоли больного человека, отличающийся тем, что(а) больному человеку вводят антитело по изобретению, конъюгированное с визуализирующим агентом, в условиях, обеспечивающих образование комплекса антитело-антиген,(б) выявляют полученный таким образом комплекса,-7 005401(в) тем самым обнаруживают присутствие активированных фибробластов стромы у больного человека. Согласно предпочтительному варианту осуществления настоящее изобретение относится к способу визуализации, как описано выше, присутствия активированных фибробластом стромы в опухоли, где опухоль представляет собой опухоль, включающую раковые клетки, выбранную из группы злокачественных опухолей, включающей колоректальные опухоли, немелкоклеточный рак легкого, опухоли молочной железы, рак головы и шеи, опухоли яичника, опухоли легкого, опухоли мочевого пузыря, опухоли поджелудочной железы и метастазирующие опухоли головного мозга. Еще одним объектом настоящего изобретения является способ обнаружения присутствия стромы опухоли, отличающийся тем, что(а) приемлемый образец, приводят в контакт с антителом по изобретению в условиях, обеспечивающих формирование комплекса между антителом и антигеном,(б) обнаруживают присутствие любого сформированного таким образом комплекса,(в) соотносят присутствие этого комплекса с присутствием стромы опухоли. Антитела по изобретению для воплощения изобретения на практике предпочтительно метят с помощью выявляемого маркера. И еще одним объектом настоящего изобретения является способ визуализации стромы опухоли у пациента, отличающийся тем, что(а) больному человеку вводят антитело по изобретению, конъюгированное с визуализирующим агентом, в условиях, обеспечивающих образование комплекса антитело-антиген,(б) выявляют любой полученный таким образом комплекс, тем самым обнаруживая присутствие стромы опухоли у больного человека. Описание чертежей Фиг. 1. Последовательность ДНК версии А преобразованной человеческой вариабельной области легкой цепи F19 (hF19LA), SEQ ID NO:l. Фиг. 2. Аминокислотная последовательность версии А преобразованной человеческой вариабельной области легкой цепи F19 (hF19LA), SEQ ID NO:2. Фиг. 3. Последовательность ДНК версии В преобразованной человеческой вариабельной области легкой цепи F19 (hF19LB), SEQ ID NO:3. Отличные от версии А нуклеотиды подчеркнуты и выделены жирным шрифтом. Фиг. 4. Аминокислотная последовательность версии В преобразованной человеческой вариабельной области легкой цепи F19 (hF19LB), SEQ ID NO:4. Отличные от версии А аминокислоты подчеркнуты и выделены жирным шрифтом. Фиг. 5. Последовательность ДНК версии С преобразованной человеческой вариабельной области легкой цепи F19 (hF19LC), SEQ ID NO:5. Отличные от версии А нуклеотиды подчеркнуты и выделены жирным шрифтом. Фиг. 6. Аминокислотная последовательность версии Б преобразованной человеческой легкой цепиF19 (hF19LcC), SEQ ID NO:6. Отличные от версии А аминокислоты подчеркнуты и выделены жирным шрифтом. Фиг. 7. Последовательность ДНК версии А преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19HA), SEQ ID NO:7. Фиг. 8. Аминокислотная последовательность версии А преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19 НA), SEQ ID NO:8. Фиг. 9. Последовательность ДНК версии В преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19HB), SEQ ID NO:9. Отличные от версии А нуклеотиды подчеркнуты и выделены жирным шрифтом. Фиг. 10. Аминокислотная последовательность версии Б преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19HB), SEQ ID NO:10. Отличные от версии А аминокислоты подчеркнуты и выделены жирным шрифтом. Фиг. 11. Последовательность ДНК версии С преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19HC), SEQ ID NO:11. Отличные от версии А нуклеотиды подчеркнуты и выделены жирным шрифтом. Фиг. 12. Аминокислотная последовательность версии В преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19HC), SEQ ID NO:12. Отличные от версии А аминокислоты подчеркнуты и выделены жирным шрифтом. Фиг. 13. Последовательность ДНК версии D преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19 НD), SEQ ID NO:13. Отличные от версии А нуклеотиды подчеркнуты и выделены жирным шрифтом. Фиг. 14. Аминокислотная последовательность версии D преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19 НD), SEQ ID NO:14. Отличные от версии А аминокислоты подчеркнуты и выделены жирным шрифтом.-8 005401 Фиг. 15. Последовательность ДНК версии Е преобразованной человеческой вариабельной области тяжелой цепи F19 (hF19HE), SEQ ID NO:15. Отличные от версии А нуклеотиды подчеркнуты и выделены жирным шрифтом. Фиг. 16. Аминокислотная последовательность преобразованной версии Е человеческой варибельной области тяжелой цепи F19 (hF19HE), SEQ ID NO:16. Отличные от версии А аминокислоты подчеркнуты и выделены жирным шрифтом. Фиг. 17. Аминокислотная последовательность химерной вариабельной области легкой цепи F19(chF19LC), SEQ ID NO:16. Фиг. 18. Аминокислотная последовательность химерной вариабельной области тяжелой цепи F19(chF19HC), SEQ ID NO:18. Фиг. 19. Последовательность ДНК человеческой каппа-константной области легкой цепи, SEQ IDNO:19. Фиг. 20. Аминокислотная последовательность человеческой каппа-константной области легкой цепи, SEQ ID NO:20. Фиг. 21. Последовательность ДНК человеческой константной области тяжелой цепи, SEQ IDNO:21. Фиг. 22. Аминокислотная последовательность человеческой константной области тяжелой цепи,SEQ ID NO:22. Фиг. 23. Экспрессионные векторы клеток млекопитающих, которые применялись для получения химерных и преобразованных человеческих антител с человеческими легкими капа-цепями и человеческими тяжелыми гамма-1-цепями. А. Экспрессионный вектор легкой цепи: pKN100 Б. Экспрессионный вектор тяжелой цепи: pG1D105. Фиг. 24. Последовательность ДНК и аминокислотная последовательность мышиной вариабельной области легкой цепи F19, модифицированные для применения при конструировании химерной легкой цепи F19. Сайты рестрикции выделены жирными буквами. Подчеркнуты последовательность Козака,CDR с 1 по 3 и сайт сплайсинга донора. Фиг. 25. Последовательность ДНК и аминокислотная последовательность мышиной вариабельной области тяжелой цепи F19, модифицированные для применения при конструировании химерной тяжелой цепи F19. Сайты рестрикции выделены жирными буквами. Подчеркнуты последовательность Козака,CDR с 1 по 3 и сайт сплайсинга донора. Фиг. 26. Последовательность ДНК химерного антитела F19, клонированная в экспрессионном векторе млекопитающих pKN100. Сайты рестрикции выделены жирными буквами и подчеркнуты. Подчеркнуты CDR с 1 по 3 и сайт сплайсинга донора. Эта последовательность представляет собой последовательность ДНК легкой цепи мышиного F19, клонированную внутри эукариотического экспрессионного вектора pKN100. Этот вектор имеет версию кДНК гена человеческой каппа-константной области (аллотип Km(3, заканчивающуюся сильной искусственной терминирующей последовательностью. Кроме того, ген для отбора по прзнаку устойчивости к неомицину (Neo) также заканчивается этой искусственной последовательностью и также находится в такой же ориентации, что и кассета экспрессии легкой каппа-цепи. Основными компонентами эукариотического экспрессионного вектора pKN100 являются: 1-6 = сайт EcoRI 7-1571 = промотор/энхансер HCMVi (человеческий цитомегаловирус) 583-587 = ТАТАА-бокс 610 = сайт инициации транскрипции 728-736 = сайт сплайсинга донора 731 = начало интрона 1557 = конец интрона 1544-1558 = сайт сплайсинга акцептора 1590-1598 = последовательность Козака 1599-1658 = пептидная лидерная последовательность 1659-1997 = легкая цепь мышиного F19 1996-2004 = сайт сплайсинга донора 2011-2657 = копия кДНК гена человеческой каппа-константной области(аллотип Km(3 2664-2880 = искусственная терминирующая последовательность spaC2 2887-7845 = ДНК-фрагмент вектора pSV2neo, включающий ген, обусловливающий устойчивость к ампициллину (Аmp) (в противоположной ориентации), сайты инициации репликации CoIEI и SV40 и ген, обусловливающий устойчивость к неомицину Neo (в такой же ориентации, что и кассета HCMViKCT) 7852-8068 = искусственная терминирующая последовательность spaC2.-9 005401 Эта последовательность заканчивается непосредственно против хода транскрипции за сайтом EcoRI(положение 1-6) в точке начала последовательности. В качестве вектора эта последовательность ДНК должна быть кольцевой. Фиг. 27. Последовательность ДНК химерного антитела F19, клонированная в экспрессионном векторе млекопитающих pG1Dl05. Сайты рестрикции выделены жирными буквами и подчеркнуты. Подчеркнуты CDR 1-3 и сайт сплайсинга донора. Эта последовательность представляет собой последовательность ДНК тяжелой цепи мышиного F19, клонированную в эукариотическом экспрессионном векторе pG1D105. Этот вектор имеет версию кДНК гена человеческой гамма-1-константной области (аллотипGlm (non-a, z,-x), также известный как аллотип Gm(17. Основными компонентами конструкции pKN100 являются: 1-2501 = базирующаяся на pBR322 последовательность, включающая ген, обусловливающий устойчивость к ампициллину и сайт инициации репликации ColEI плюс сайт инициации репликации SV40 и деформированный ранний промоторSV40 2502-3226 = ген dhfr 3233-4073 = поли А-последовательность SV40 и т.д. 4074-4079 = лигированные сайты BamHI и BgIII (BstYI) 4080-4302 = сайт SPA плюс сигнал терминации С 2 4303-5867 = промотор HCMVi 5879-5885 = уникальный сайт рестрикции HindIII для клонирования генов вариабельных областей иммуноглобулина 5886-5894 = последовательность Козака 5895-5951 = сигнальный пептид 5952-6323 = тяжелая цепь мышиного F19 6323-6330 = сайт сплайсинга донора 6331-6336 = уникальный сайт рестрикции BamHI для клонирования генов вариабельных областей иммуноглобулина 6337-7388 = копия кДНК гена человеческой гамма-1-константной области, предшествующей интрону длиной 62 пары оснований 7389-7709 = терминирующая последовательность Arnie. Примененная в этой последовательности человеческая гамма-1-константная область имеет аллотипGlm (non-a, z,-x), также известный как аллотип Gm(17), для которого характерно наличие остатка глутаминовой кислоты (Е) в положении 356 (согласно Еu-нумерации), остатка метионина (М) в положении 358 (согласно Еu-нумерации) и остатка лизина (К) в положении 214 (согласно Еu-нумерации). Эти остатка подчеркнуты в приведенной выше последовательности. Фиг. 28. Основанный на ПЦР способ конструирования пребразованной человеческой легкой цепиF19. На этом чертеже дано схематическое изображение стратегии конструирования. Пунктирными линиями показана комплементарная последовательность, состоящая по меньшей мере из 21 пары оснований, между праймерами. Фиг. 29. Нуклеотидная и выведенная аминокислотная последовательности версий А, В и С преобразованных человеческих вариабельных областей легкой цепи F19. Проведен анализ нуклеотидной и выведенной аминокислотной последовательностей и сравнение с последовательностями версии А, штрихами обозначены нуклеотиды, идентичные с этой последовательностью, точками обозначены аминокислоты,идентичные с этой последовательностью. Нумерация аминокислот соответствует нумерации, описанной у Kabat и др. (1991). Прямоугольником обозначены местоположения CDR. Фиг. 30. Последовательность ДНК F19LA (версия А преобразованной человеческой легкой цепи),клонированная в экспрессионном векторе млекопитающих pKN100. Сайты рестрикции выделены жирными буквами и подчеркнуты. Подчеркнуты CDR 1-3 и сайт сплайсинга донора. Эта последовательность представляет собой версию А преобразованной легкой цепи F19, клонированную внутри эукариотического экспрессионного вектора pKN100. Этот вектор содержит версию кДНК гена человеческой каппаконстантной области (аллотип Кm(3, заканчивающуюся сильной искусственной терминирующей последовательностью. Кроме того, ген для отбора по признаку устойчивости к неомицину Neo также заканчивается этой искусственной последовательностью и также находится в такой же ориентации, что и кассета экспрессии легкой каппа-цепи. Основными компонентами вектора являются: 7-1571 = промотор/энхансер HCMVi 583-587 = ТАТАА-бокс 610 = сайт инициации транскрипции 728-736 = сайт сплайсинга донора 731 = начало интрона 1557 = конец интрона 1544-1558 = сайт сплайсинга акцептора 1590-1598 = последовательность Козака 1599-1658 = пептидная лидерная последовательность- 10005401 1659-1997 = версия А пребразованной легкой цепи F19 1996-2004 = сайт сплайсинга донора 2011-2657 = копия кДНК гена человеческой каппа-константной области (аллотип Km(3 2664-2880 = искусственная терминирующая последовательность spaC2 2887-7845 = ДНК-фрагмент вектора pSV2neo, включающий ген, обусловливающий устойчивость к ампициллину (Аmр) (в противоположной ориентации), сайты инициации репликации ColEI и SV40 и ген,обусловливающий устойчивость к неомицину Neo (в такой же ориентации, что и кассета HCMVi-KCT) 7852-8068 = искусственная терминирующая последовательность spaC2. Эта последовательность заканчивается непосредственно против хода транскрипции за сайтом EcoRI(положение 1-6) в точке начала приведенной ниже последовательности. В качестве вектора эта последовательность ДНК должна быть кольцевой. Фиг. 31. Основанный на ПЦР способ конструирования преобразованной человеческой тяжелой цепи F19. На этом чертеже дано схематическое изображение стратегии конструирования. Пунктирными линиями показана комплементарная последовательность, состоящая по меньшей мере из 21 пары оснований между праймерами. Фиг. 32. Нуклеотидная и выведенная аминокислотная последовательности версий А-Е преобразованных человеческих вариабельных областей тяжелой цепи F19. Проведен анализ нуклеотидной и выведенной аминокислотной последовательностей и сравнение с последовательностями версии А, штрихами обозначены нуклеотиды, идентичные с этой последовательностью, точками обозначены аминокислоты,идентичные с этой последовательностью. Нумерация аминокислот соответствует нумерации, описанной у Kabat и др. (1991). Прямоугольником обозначены местоположения CDR. Фиг. 33. Последовательность ДНК F19 НA (версия А преобразованной человеческой тяжелой цепи),клонированная в экспрессионном векторе млекопитающих pG1D105. Сайты рестрикции выделены жирными буквами и подчеркнуты. Подчеркнуты CDR 1-3 и сайт сплайсинга донора. Эта последовательность представляет собой последовательность ДНК эукариотического экспрессионного вектора pGlD105, содержащую версию А преобразованной вариабельной области тяжелой цепи F19. Этот вектор содержит версию кДНК гена человеческой гамма-1-константной области (аллотип Glm (non-a, z,-x), также известный как аллотип Gm(17. Основными компонентами конструкции являются: 1-2501 = базирующаяся на pBR322 последовательность, включающая ген, обусловливающий устойчивость к ампициллину и сайт инициации репликации CoIEI плюс сайт инициации репликации SV40 и деформированный ранний промотор SV40 2502-3226 = ген dhfr 3233-4073 = SV40-поли А-последовательность и т.д. 4074-4079 = лигированные сайты BamHI и Bg1II (BstYI) 4080-4302 = сайт SPA плюс сигнал терминации С 2 4303-5867 = промотор HCMVi 5879-5885 = уникальный сайт рестрикции HindIII для клонирования генов вариабельных областей иммуноглобулина 5886-5894 = последовательность Козака 5895-5894 = сигнальный пептид 5952-6323 = тяжелая цепь мышиного F19 6323-6330 = сайт сплайсинга донора 6331-6336 = уникальный сайт рестрикции BamHI для клонирования генов вариабельных областей иммуноглобулина 6337-7388 = копия кДНК гена человеческой гамма-1-константной области, предшествующей интрону длиной 62 пары оснований 7389-7709 = терминирующая последовательность Arnie. Примененная в этой последовательности человеческая гамма-1-константная область имеет аллотипGlm (non-a, z,-x), также известный как аллотип Gm(17), для которого характерно наличие остатка глутаминовой кислоты (Е) в положении 356 (согласно Еu-нумерации), остатка метионина (М) в положении 358 (согласно Еu-нумерации) и остатка лизина (K) в положении 214 (согласно Eu-нумерации). Эти остатка подчеркнуты в приведенной выше последовательности. Фиг. 34. Случаи сплайсинга РНК тяжелой (панель А) и легкой (панель Б) цепи, имеющие место при экспрессии антитела F19 в клетках млекопитающих -схематическое изображение. А. Сплайсинг РНК тяжелой цепи. Б. Сплайсинг РНК легкой каппа-цепи. Фиг. 35. Зависимость связывания супернатанта LAНA с CD8-FAP от концентрации. Фиг. 36. Связывание биотинилированного LAНA с человеческим FAP. Фиг. 37. CD8-FAP несет эпитоп F19, что обнаружено с помощью cF19.- 11005401 Примеры Пример 1. Конструирование мышиных-человеческих химерных генов. Создавали химерное антитело F19 (cF19), включающее мышиные VL- и VH-области, связанные с человеческими константными областями каппа-цепи и гамма-1-цепи соответственно. Для модификации 5'- и 3'-последовательностей, фланкирующих последовательности кДНК, которые кодируют мышиныеVL- и VH-области, использовали ПЦР-праймеры (табл. 1). Конструировали ГТЦР-праймеры, специфичные для V-области легкой цепи F19. Затем эти адаптированные мышиные вариабельные области F19 субклонировали в экспрессионных векторах, функционирующих в клетках млекопитающих, которые уже содержат человеческую каппа-(вектор pKN100) или гамма-1-(вектор pG1D105)-константные области(фиг. 23). В этих векторах используются промотор/энхансер человеческого цитомагаловируса (HCMV) для эффективной транскрипции легкой и тяжелой цепей. Векторы также содержат сайт инициации репликации SV40 для осуществления эффективной репликации ДНК и последующей экспрессии протеина вHindIII-BamHI-фрагментов ДНК. Для интродукции этих сайтов рестрикции на 5'-(HindIII) и 3'-(BamHI)концы кДНК, кодирующих V-области, создавали ПЦР-праймеры. Кроме того, создавали ПЦР-праймеры для интродукции последовательности Козака (GCCGCCACC) на 5'-концы кДНК легкой и тяжелой цепи,что позволяло эффективно осуществлять трансляцию (Kozak М.: "At least six nucleotides preceding theAUG initiator codon enhance translation in mammalian cells", J. Mol. Biol. 196:947 (1987 и интродуцировать сайты сплайсинга донора на 3'-концы кДНК легкой и тяжелой цепи для объединения (сплайсинга) вариабельных областей с константными областями. ПЦР-праймеры, которые использовали для конструирования легкой и тяжелой цепи химерного F19, приведены в таблице 1. Последовательности ДНК и аминокислотные последовательности мышиных VL- и VH-областей, адаптированных для применения в конструкции легкой и тяжелой цепи химерного F19, приведены на фиг. 24 и 25. Последовательности ДНК легкой и тяжелой цепей мышиного F19, клонированные в эукариотических экспрессионных векторах pKN100 и pG1D105 соответственно, приведены на фиг. 26 и 27. Таблица 1. ПЦР-праймеры для конструирования химерного антитела F19. А. Вариабельная область легкой цепи 1. Праймер для конструирования 5'-конца (37-мерный) последовательность Козака 2. Праймер для конструирования 3'-конца (35-мерный) Б. Вариабельная область тяжелой цепи 1. Праймер для конструирования 5'-конца (37-мерный) последовательность Козака 2. Праймер для конструирования 3'-конца (35-мерный) Пример 2. Экспрессия и активность связывания химерного антитела F19. Двумя плазмидными ДНК, кодирующими легкую и тяжелую цепи химерного F19 (см. пример 1),котрансфектировали COS-клетки, оценивая временную экспрессию химерного антитела F19, как описано ниже. После инкубации в течение 72 ч среду собирали, центрифугировали для удаления клеточного дебриса и анализировали с помощью ELISA в отношении производства человеческого IgG1-подобного антитела. Супернатант COS-клеток, содержащий химерное антитело F19, анализировали на способность связываться с клетками линии НТ 1080 (см. пример 13), экспрессирующих на поверхности антиген FAP. Трансфекция COS-клеток с помощью электропорации Функционирующие в клетках млекопитающих экспрессионные векторы pG1D105 и pKN100, содержащие химерные или преобразованные человеческие версии тяжелой и легкой цепи соответственно,тестировали в COS-клетках, оценивая временную экспрессию антител F19. СOS7-клетки пересевали общепринятым методом в среду DMEM (каталожный номер фирмы Gibco BRL 41966), содержащую пенициллин (50 ед./мл), стрептомицин (50 мкг/мл), L-глутамин и 10%-ную инактивированную нагреванием не содержащую гаммаглобулин фетальную телячью сыворотку (ФТС каталожный номер фирмы HarlanSera-Lab D0001). ДНК интродуцировали в COS-клетки электропорацией с использованием устройства типа Gene Pulsar (фирма BioRad). ДНК (10 мкг из каждого вектора) добавляли к аликвотам по 0,8 мл,включающим 1 х 10 клеток/мл, в забуфернном фосфатом физиологическом растворе (ЗФР, без Са 2+ иMg2+). Импульс создавали при напряжении 1900 В, емкости конденсатора 25 мкФ. После восстановления в течение 10 мин при температуре окружающей среды полученные в результате электропорации клетки- 12005401 добавляли к 8 мл среды DMEM, дополненной 5% ФТС. После инкубации при 37 С в течение 72 ч среду собирали, центрифугировали для удаления клеточного дебриса и хранили в стерильных условиях при 4 С в течение непродолжительных периодов времени или при -20 С в течение более продолжительных периодов. Метод ELISA для оценки концентраций слитого антитела IgGl/каппа в супернатантах COS-клеток Образцы антител, полученных в трансфектированных COS-клетках, анализировали с помощьюELISA для определения количеств продуцированного химерного или преобразованного человеческого антитела. Для определения антитела планшеты сенсибилизировали козьим антителом к человеческомуIgG (специфическим для Fc-фрагмента) (фирма Jackson Immuno Research Laboratories Inc., 109-005098). Приготавливали серийные разведения образцов COS-клеток и добавляли в каждую лунку. После инкубации в течение 1 ч при 37 С и промывки добавляли конъюгированное с пероксидазой из хрена козье антитело к человеческой легкой каппа-цепи (фирма Sigma, A-7164). После инкубации в течение 30 мин при 37 С и промывки при комнатной температуре добавляли в течение 30 мин субстрат К-голубой(смесь 3,3',5,5'-тетраметилбензидина и перекиси водорода, фирма Bionostics Limited, КВ 175). Реакцию прекращали, используя раствор Red Stop (Bionostics Limited, RS20), и определяли оптическую плотность с помощью микропланшет-ридера при 650 нм. В качестве стандарта использовали очищенное человеческое IgGl/каппа-антитело (фирма Sigma, 1-3889) известной концентрации. Экспрессия химерного антитела F19 в COS-клетках была невысокой (таблица 2), находясь в диапазоне от 10 до 60 нг/мл, что по меньшей мере в 10 раз ниже, чем экспрессия большинства антител. С целью повышения уровней экспрессии химерного антитела F19 лидерную последовательностьVL-области F19 изменяли путем замены лейцина на пролин в положении -9. Эта одна аминокислотная замена в лидерной последовательности привела к по меньшей мере двукратному увеличению количества химерного антитела, продуцируемого в COS-клетках. Результаты оценки клеточного связывания показали, что химерное антитело F19 связывается сFAP-мишенью специфически и с ожидаемой авидностью. Таблица 2. Концентрации химерного антитела F19 в супернатантах COS-клеток (приведены результаты трех независимых трансфекций) Пример 3. Конструирование версий А-С(LA-LC)преобразованной человеческой легкой цепи F19. Конструирование первой версии преобразованной человеческой VL-области (LA) проводили с использованием перекрывающихся ПЦР-фрагментов согласно методу, описанному у Daugherty B.L., DeMartino J.A., Law M.F., Kawka D.W., Singer I.I. и Mark G.E., "Polymerase chain reaction (PCR) facilitates thecloning, CDR-grafting, and rapid expression of murine monoclonal antibody directed against the CD18 component of leukocyte integrins. Nucl. Acid. Res. 19: 2471 (1991). Синтезировали 10 олигонуклеотидов, которые состояли из пяти пар праймеров, APCRl-vall, vla2-vla3, vla40-vla5, vla6-vla7 и vla8-APCR4 (табл. 3 и фиг. 28). Между соседними парами праймеров находилась перекрывающая последовательность, состоящая по меньшей мере из 21 пары оснований (фиг. 28). APCR1 и APCR4 гибридизовались с фланкирующими последовательностями вектора pUC19. Создавали мутагенные праймеры таким образом, чтобы их 5'-конец был расположен непосредственно за кодоном в нестрогом положении. Эту стратегию использовали для нейтрализации случайного добавления одного нуклеотида на 3'-конец цепи, комплементарной мутагенному праймеру, с помощью ДНК-полимеразы в процессе ПЦР (Sharrocks A.D. и Shaw P.E., "Improvedprimer design for PCR-based, site-directed mutagenesis", Nucl. Acid. Res. 20: 1147 (1992. Соответствующую пару праймеров (по 0,2 мкМ каждого) объединяли с 10 нг версии "В" преобразованной человеческой L25VL-области кДНК и 1 ед. ДНК-полимеразы AmpliTaq (фирма Perkin Elmer Cetus) в 50 мкл ПЦРбуфера, содержащего 10 мМ Трис-НСl (рН 8,3), 50 мМ КС 1, 200 мкМ дНТФ и 1,5 мМ MgCl2. Эту смесь покрывали минеральным маслом и осуществляли ПЦР, включающую 25 циклов, каждый из которых включал стадию денатурации при 94 С в течение 1 мин, стадию ренатурации праймера при 55 С в течение 1 мин и стадию удлинения при 72 С в течение 2 мин. После этого проводили 1 цикл, включающий- 13005401 дополнительную стадию удлинения при 72 С в течение 10 мин, после чего смесь охлаждали до 4 С. Промежуток времени между стадиями ренатурации праймера и удлинения составлял 2,5 мин. ПЦРпродукты из 5 реакций (А, Б, В, Г и Д) затем очищали гель-электрофорезом с последующей элюцией ДНК с использованием набора Wizard CR preps (фирма Promega). ПЦР-продукты А, Б, В, Г и Д объединяли в соответствии с их комплементарностью друг с другом. Во второй серии ПЦР ПЦР-продукты Б и В и Г и Д (по 50 нг каждого) добавляли к 50 мкл смеси для ПЦР (как описано выше), каждая из которых содержала по 1 ед. ДНК-полимеразы AmpliTaq (фирма Perkin Elmer Cetus). Реакции повторяли в течение 20 циклов, как описано выше, за исключением того, что температуру ренатурации поднимали до 60 С. В третьей серии ПЦР ПЦР-продукты Е и Ж подвергали ПЦР-амплификации с использованием по 1 мкл смеси каждой из проведенных ранее ПЦР и соответствующей пары ПЦР-праймеров (vla2-vla5 или vla6APCR4). Смеси для ПЦР содержали 1 ед. ДНК-полимеразы AmpliTaq в 50 мкл смеси для ПЦР (как описано выше) и их амплифицировали с использованием одной стадии из 25 циклов. В четвертой серии ПЦР ПЦР-продукт 3 подвергали ПЦР-амплификации с использованием по 1 мкл смеси каждой из предыдущих смесей для ПЦР и val2-APCR4 в качестве пары ПЦР-праймеров. И наконец, ПЦР-продукты А и 3 объединяли в соответствии с их собственной комплементарностью с помощью состоящей из двух стадий ПЦР, аналогичной описанной выше, с использованием а качестве терминирирующих праймеров RSP иUP. Полностью сконструированный фрагмент, соответствующий полной преобразованной человеческойVL-области F19, включающей лидерную последовательность, расщепляли с помощью HindIII и BamHI и клонировали в векторе pUC19 для секвенирования. Клон, имеющий правильную последовательность ДНК, обозначили как reshF19La (фиг. 29), и его субклонировали в эукариотическом экспрессионном векторе pKN100. Последовательность ДНК reshF19La, клонированная в pKN100, показана на фиг. 30. Вторую версию преобразованной человеческой VL-области (LB) F19 конструировали, используя такую же схему, которая описана для LA, но в которой праймеры vla4 и vla7 были заменены на vlb4 и vlb7 соответственно (табл. 3). Последовательность ДНК LB приведена на фиг. 29. Третью версию преобразованной человеческой VL-области (LC) F19 конструировали, используя набор для сайтнаправленного мутагенеза QuikChange фирмы Stratagene. Метод QuikChange-сайтнаправленного мутагенеза осуществляли согласно инструкциям производителя, используя reshF19La в вектореpKN100 в качестве двухцепочечной ДНК-матрицы. Необходимые для этого протокола мутагенные олигонуклеотидные праймеры F19LC-смысловой и F19LC-aнтиcмыcлoвoй (табл. 3) создавали согласно инструкциям производителя. Вкратце метод состоит в следующем: оба мутагенных праймера содержали требуемую точковую мутацию (кодон ТТТ в положении 49 (Phe) в последовательности Кэбата заменяли на кодон ТАТ, кодирующий Туr) и их ренатурировали до одной и той же последовательности в противоположных цепях LA в векторе pKN100. Точковую мутацию подтверждали с помощью секвенирования ДНК полной VL-области. Последовательность ДНК LC приведена на фиг. 29. Для устранения возможности возникновения случайной мутации в pKN100 в процессе ПЦР, VL-область вырезали из вектора pKN100 в виде HindIII/BamHI-фрагмента и повторно субклонировали в немодифицированном векторе pKN100,расщепленном с помощью указанных выше двух рестриктаз. Таблица 3. ПЦР-праймеры для конструирования преобразованных человеческих вариабельных областей легкой цепи F19 1. Праймеры для синтеза версии "А" 4. Праймеры для гибридизации с фланкирующими последовательностями вектора pUC19 Пример 4. Конструирование версий А-Е (HA-HE) преобразованной человеческой тяжелой цепи F19. Версию "А" преобразованной человеческой VH-области (НA) F19 конструировали с использованием таких же методов ПЦР, которые описаны для конструирования версии "А" преобразованной человеческой VL-области F19 (LA) (фиг. 31). ДНК-матрица представляла собой версию "А" преобразованной человеческой VH 226 (Leger O. J. P., Yednock T. A., Tanner L., Horner H. C., Hines D. K., Keen S., Saldanha J.,Jones Т., Fritz L. C. и Bendig M. M, "Humanization of mouse antibody against human alpha-4 integrin: a potential therapeutic for the treatment of multiple sclerosis", Hum. Antibod. 8: 3 (1997. Шесть ПЦР-праймеров создавали и синтезировали для конструирования версии "А" преобразованной человеческой VH-областиF19 (табл. 4). ПЦР-продукты А, В, С и D получали, используя в качестве пар ПЦР-праймеров APCR1Vha1, Vha2-Vha3, Vha4-Vha5 и Vha6-APCR4 соответственно. Условия для ПЦР в основном соответствовали описанным для конструирования преобразованной человеческой VL-области F19. Клон, имеющий правильную последовательность ДНК, обозначили как reshF19Ha (фиг. 32) и затем его субклонировали в эукариотическом векторе pG1D105. Последовательность reshF19Ha, клонированная в pG1D105, приведена на фиг. 33. Третью версию преобразованной человеческой VH-области F19 (НC) конструировали с использованием такой же схемы, которая описана для НA, но праймер Vha4 заменяли на Vhc4 (табл. 4). Последовательность ДНК НC приведена на фиг. 32. Вторую (HB) и четвертую (НD) версию преобразованной человеческой VH-области F19 конструировали на основе ПЦР-мутагенеза, описанного Kamman с соавторамиBamHI и субклонировали в reshF19Ha и reshF19Hc, соответственно, предварительно расщепленных с помощью этих же двух рестриктаз. Последовательности ДНК HB и HD приведены на фиг. 32. Версию "Е" преобразованной человеческой VH-области F19 (HE) конструировали на основе методов ПЦР-мутагенеза, описанных у Kamman с соавторами (1989) выше. Для reshF19He использовали мутагенный праймер F19Msc1He (табл. 5) в паре с праймеромF19VHHindIII (табл. 5) в ПРЦ с использованием HC, клонированной в функционирующем в клетках млекопитающих экспрессионном векторе pG1D105, в качестве ДНК-матрицы. Соответствующую пару праймеров (по 0,2 мкМ каждого) объединяли с 10 нг кДНК версии "А" преобразованной человеческой- 15005401 8,8), 2 мМ MgSO4, 0,1% тритона Х-100 и 200 мкМ дНТФ. Реакционные смеси покрывали минеральным маслом и выдерживали при 94 С в течение 5 мин. Затем добавляли 1 ед. ДНК-полимеразы Deep VentThermal Cycler (фирма Biometra, Геттинген, Германия). Каждый цикл включал стадию денатурации при 94 С в течение 1 мин, стадию ренатурации праймера при 70 С в течение 1 мин и стадию удлинения при 72 С в течение 2 мин. После этого проводили 1 цикл, включающий дополнительную стадию удлинения при 72 С в течение 10 мин, после чего смесь охлаждали до 4 С. ПЦР-продукты затем экстрагировали и очищали из стандартного агарозного геля с 1,4% ТАЕ, с использованием набора для гель-экстракции типа QIAquick согласно протоколу производителя (фирма QIAGEN Ltd., Великобритания). Затем ПЦРпродукт VHe расщепляли с помощью рестриктаз MscI и HindIII и встраивали в reshF19Hc, клонированный в pG1D105, предварительно расщепленном с помощью этих же двух рестриктаз. Сайт рестрикции,распознаваемый MscI, представляет собой уникальный сайт для всех версий преобразованной человеческой VH-области, и он не присутствует в экспрессионном векторе pG1D105. Сайт рестрикции, распознаваемый HindIII, представляет собой уникальный сайт pG1D105 для клонирования генов VH-области иммуноглобулина. Компетентные в отношении электропорации клетки Е.coli линии XL-1 BLue трансформировали 1 мкл лигированной ДНК и высевали на агарозные пластины, содержащие ампициллин. Затем колонии подвергали скринингу в отношении присутствия и правильного размера вставок путем прямой ПЦР этих колоний (Gussow D. и Clackson Т., "Direct clone characterization from plaques and colonies by thepolymerase chain reaction", Nucl, Acid Res. 17:4000 (1989 с помощью праймеров HCMi и HucI, гибридизующихся с фланкирующими последовательностями вектора pGlD105 (табл. 5). ДНК из позитивных колонийв получали с помощью набора Plasmid Midi, следуя протоколу производителя (фирма QIAGENLtd., Великобритания). Секвенирование ДНК проводили с помощью дидезокси-метода на основе разрыва цепи (Sanger F., Nicklen S. и Coulson A., "DNA sequencing with chain-terminating inhibitors", Proc. Natl.Acad. Sci. U.S.A. 74: 5463 (1977 непосредственно из кольцевой векторной ДНК с использованием общепринятой тепловой денатурации (Andersen A., Pettersson А. и Kieldsen Т., "A fast and simple techniguesfor sequencing plasmid DNA with sequenase using heat denaturation", Biotechniques 13: 678 (1992 и секвеназы 2.0 (фирма USB, Кливленд, штат Огайо). Последовательность ДНК reshF19He приведена на фиг. 32. Таблица 4. ПЦР-праймеры для конструирования версий A-D, преобразованных человеческих вариабельных областей тяжелой цепи. 1. Праймеры для синтеза версии "А"- 16005401 4. Праймеры, гибридизующиеся в фланкирующими последовательностями вектора pUC19 Таблица 5. ПЦР-праймеры для конструирования версии Е преобразованных человеческих вариабельных областей тяжелой цепи. 1. Праймеры для синтеза версии "Е" F19MscIHe (65 mer, антисмысловой): 2. Праймеры, гибридизующиеся с фланкирующими последовательностями функционирующего в клетках млекопитающих вектора pG1D105 Пример 5. Концентрации преобразованного человеческого антитела F19 в супернатантах COSклеток.COS-клетки трансфектировали одной парой из серий конструкций преобразованного человеческого антитела F19 и определяли концентрацию человеческого антитела с помощью IgG1/каппа-ELISA, как описано в примере 2. Таблица 6. Концентрации преобразованного человеческого антитела F19 в супернатантах COSклеток. Таблица 7. Концентрации преобразованного человеческого антитела F19 в супернатантах COSклеток Случаи сплайсинга РНК, необходимые для экспрессии генов иммуноглобулина в клетках млекопитающих. Оба экспрессионных вектора, функционирующих в клетках млекопитающих, т.е. pKN100 иpG1D105, содержат интрон между вариабельной и константной областями, который удаляется в процессе экспрессии гена, приводя к образованию матричной РНК. Случай сплайсинга, включающий рекомбинацию ДНК между сайтами сплайсинга донора тяжелой или легкой цепи и сайтом сплайсинга акцептора иммуноглобулина представлены на фиг. 34. Пример 6. Анализ методом проточной цитометрии связывания cF19 и LAHС с экспрессирующимиFAP человеческими клетками. Оценивали способность LAHС связываться как с рекомбинантным, так и с эндогенно экспрессируемым на клеточной поверхности FAP. Пример определения связывания LAНC с клеточным FAP.- 17005401 В качестве клеток-мишеней применяли как встречающиеся в естественных условиях, экспрессирующие FAP клетки опухоли человека линии MF-SH (Shirasuma К. и др., Cancer, 55: 2521-2532 (1985,так и трансфектированные FAP человеческие линии опухолевых клеток. Эффективность LAHC оценивали с помощью цитофлуорометрических анализов, позволяющих оценить прямое связывание с клеткамимишенями, а также по ингибирующему действию на связывание с FAP либо мышиного F19, либо химерного антитела cF19. Использовали такие антитела и линии клеток, как F19 (мышиное моноклональное антитело к человеческому FAP, подкласс IgGl), mIgG (мышиный иммуноглобулин, класс IgG), cF19 (химерное моноклональное антитело к человеческому FAP, подкласс IgG1), LAНC (преобразованное моноклональное антитело к человеческому FAP, подкласс IgGl), hIgGl (человеческий иммуноглобулин, подкласс IgGl), MF-SH(линия клеток человеческой злокачественной фиброзной гистоцитомы), НТ-1080 (линия клеток человеческой фибросаркомы), клон 33 HT-1080FAP (линия клеток НТ-1080, трансфектированная кДНК, кодирующей человеческий FAP). Антитела биотинилировали, как описано в примерах 8 и 12. Непосредственное связывание LAHC с FAP на поверхности человеческих линий опухолевых клеток При исследовании 5 х 10 клеток линии опухолевых клеток инкубировали с определенными концентрациями тестируемого или контрольного антитела в общем объеме 0,2 мл забуференного фосфатом физиологического раствора (ЗФР), дополненного 1% бычьим сывороточным альбумином (БСА), в течение 30 мин на льду. Затем клетки промывали дважды 2 мл ЗФР, ресуспендировали в 0,2 мл ЗФР, дополненного 1% БСА, добавляли в качестве вторичного реагента разбавленное в соотношении 1:20 мышиное антитело к человеческому IgG, меченное ФИТЦ (фирма Dianiva) и инкубировали в течение еще 30 мин на льду. В другом варианте исследования 5 х 10 клеток линии опухолевых клеток инкубировали с определенными концентрациями меченного биотином cF19 в общем объеме 0,2 мл ЗФР, дополненного 1% БСА, в течение 30 мин на льду. Затем клетки промывали дважды 2 мл ЗФР, ресуспендировали в 0,2 мл ЗФР, дополненного 1 % БСА, и инкубировали в течение еще 30 мин на льду с разбавленным в соотношении 1:40 стрептавидином-ФИТЦ (фирма Dianiva) в качестве вторичного реагента. Клетки вновь промывали дважды 2 мл ЗФР, ресуспендировали в общем объеме 0,5 мл ЗФР, дополненного 1% параформальдегда (ПФА) и выдерживали на льду. Флуоресценцию одной клетки определяли цитофлуорометрически, анализируя клеточную флуоресценцию зеленого цвета при 488 нм в анализаторе клеток с активированной флуоресценцией типа EPICS XL (фирма Coulter). Конкуренция LAHC с биотинилированным cF19 за связывание с FAP на клеточной поверхности экспрессирующих FAP человеческих линий клеток При исследовании 5 х 105 клеток линии опухолевых клеток инкубировали с определенными концентрациями немеченого тестируемого или контрольного антитела вместе с 1 мкг/мл меченного биотином антитела cF19. Затем клетки промывали дважды 2 мл ЗФР, ресуспендировали в 0,2 мл ЗФР, дополненного 1% БСА, и инкубировали в течение еще 30 мин на льду с разбавленным в соотношении 1:40 стрептавидином-ФИТЦ (фирма Dianiva) в качестве вторичного реагента и инкубировали в течение еще 30 мин на льду. Затем клетки промывали дважды 2 мл ЗФР, ресуспендировали в общем объеме 0,5 мл ЗФР, дополненного 1% ПФА и выдерживали на льду. Флуоресценцию одной клетки определяли цитофлуорометрически, анализируя клеточную флуоресценцию зеленого цвета при 488 нм в анализаторе клеток с активированной флуоресценцией типа EPICS XL (фирма Coulter). Как cF19, так и LAHC специфично связывалось в зависимости от концентрации с клоном 33 трансфектированных FAP человеческих опухолевых клеток линии HT-1080FAP (табл. 8). Не обнаружено никакого связывания с FAP-негативными клетками линии НТ-1080 (табл. 9). Как cF19, так и LAНC специфично связывалось в зависимости от концентрации с человеческими клетками лини MF-SH, эндогенно экспрессирующих FAP (табл. 10). Биотинилированное cF19 связывалось с клоном 33 человеческой линии HT-1080FAP (табл. 11) в зависимости от концентрации. Не обнаружено никакого связывания с FAP-негативными клетками линии НТ-1080 (табл. 12). Связывание биотинилированного cF19 с клоном 33 клеток линии HT-1080FAP ингибировалось как немеченым cF19, так и немеченым LAНC (табл. 13). Установлено, что химерное моноклональное антитело к человеческому FAP cF19, а также преобразованное человеческое антитело к человеческому FAP LAНC (пример 10) связываются непосредственно сFAP, который экспрессируется на поверхности человеческих линий клеток, либо в результате эндогенной экспрессии этого протеина, либо в результате трансфекции клеток кодирующей его кДНК. Установлено, что это связывание зависит от концентрации. Связывание биотинилированного cF19 может ингибироваться как немеченым cF19, так и немеченым LAHC. Цитофлуометрический анализ непосредственного связывания, а также ингибирования специфически связывающихся реагентов позволил установить специфичность химерного cF19 и преобразованных человеческих антител LAНC в отношении экспрессируемого на клеточной поверхности FAP. н/о обозначает "не определяли" Таблица 11. Связывание биотинилированного антитела cFAP с клетками клона 33 HT-1080FAP Таблица 12. Связывание биотинилированного антитела cFAP с нетрансфектированными клетками НТ-1080 Биотинилированное cF19 использовали в концентрации 1 мкг/мл во всех опытах, приведенных в табл. 13. Пример 7. Иммуноэффекторные функции моноклонального антитела LAHC в опытах in vitro. Этот эксперимент проводили с целью выявления потенциальной активности моноклонального антитела (МАт) LAНC со специфичностью в отношении антигена активации фибробласта (FAP) в отношении лизиса экспрессирующих FAP мишеней в присутствии человеческого комплемента или человеческих мононуклеарных лейкоцитов соответственно. В частности, изучали способность LAHC опосредовать цитотоксические действия в отношении клеток клона 33 HT-1080FAP, которые экспрессируют человеческий FAP на своей поверхности. Цитотоксичность определяли in vitro с помощью следующего метода: меченные с помощью 51 Сr клетки-мишени инкубировали в присутствии LAНC с человеческой сывороткой в качестве источника комплемента или с человеческими MNC (мононуклеары периферической крови) в качестве клеток-эффекторов. Для количественной оценки лизиса клеток-мишеней использовали выделение 51Cr. Использовали следующие антитела и линии клеток: LAНC (преобразованное человеческое антитело к человеческому FAP, подкласс IgGl), h1gG1 (человеческий изотип IgG1, контроль), 3S193 (мышиное моноклональное антитело к IgG3 Lewisy (один из антигенов Льюиса), mIgG (мышиный IgG, контроль),НТ-1080 (человеческая фибросаркома), клон 33 HT-1080FAP (линия клеток НТ-1080, трансфектированная кДНК, кодирующей человеческий FAP), MCF-7 (клетки линии человеческой аденокарциномы молочной железы). Опосредованный комплементом лизис клеток-мишеней с помощью LAНC Опухолевые клетки метили с помощью радиоактивного изотопа путем инкубации в средеRPMI1640 с 100 мкКи 51 Сr (фирма NEN) при 37 С в течение 1 ч. Затем клетки промывали дважды средой без 51Cr и ресуспендирова-ли в концентрации 2 х 10 клеток/мл. Человеческая сыворотка, являющаяся источником комплемента, представляла собой свежеприготовленную сыворотку из крови различных добровольцев. Кровь брали путем пункции из вены руки, выдерживали при комнатной температуре в течение 1 ч, давая произойти свертыванию крови, и хранили при 4 С в течение ночи. Сыворотку отделяли центрифугированием и отбирали из осадка. Исследуемое антитело разбавляли из маточного раствора до соответствующей концентрации средой для культуры клеток RPMI1640. 1 х 10 радиоактивномеченных опухолевых клеток из исследуемой линии клеток инкубировали в течение 2 ч при 37 С в термостате (95% воздуха и 5% CO2) в присутствии различных концентраций тестируемого или контрольного антитела и 25 об.% человеческой сыворотки в качестве источника человеческого комплемента. Инкубацию осуществляли в U-образных 96-луночных планшетах в общем объеме 200 мкл среды RPMI1640 в трех повторностях. После периода инкубации планшеты центрифугировали,удаляли 100 мкл супернатанта и подсчитывали радиоактивность с помощью счетчика гамма-лучей. Общее количество включенной радиоактивности определяли для 10 клеток-мишеней. Спонтанное выделение определяли как радиоактивность, выделившуюся из клеток в отсутствии как антитела, так и комплемента в процессе указанного периода инкубации. Удельный лизис рассчитывали из следующего уравнения: Зависящая от антитела клеточная цитотоксичность (АЗКЦ) LAHC. Опухолевые клетки метили с помощью радиоактивного изотопа путем инкубации в средеRPMI1640 с 100 мкКи 51 Сr при 37 С в течение 1 ч. Затем клетки промывали дважды средой без 51Cr и ресуспендировали в концентрации 2 х 105 клеток/мл.MNC (мононуклеары периферической крови) получали из периферической крови путем пункции из вены руки здоровых добровольцев. Для предотвращения свертывания крови добавляли 20%-ный цитратный буфер. MNC из 4 мл этого препарата крови очищали центрифугированием (30 мин при 400 x g и комнатной температуре) на 3 мл среды для фракционирования лимфоцитов (фирма Boehringer Mannheim,Германия). MNC (мононуклеары периферической крови) получали из градиента, трижды промывали и разбавляли средой RPMI1640 до соответствующей концентрации. Лимфокинактивированные киллеры(LAK-клетки) получали из MNC (мононуклеары периферической крови) инкубацией в течение 5 дней при 37 С в термостате (95% воздуха, 5% СО 2) с начальной плотностью клеток 1,3 х 106 клеток/мл в присутствии 100 ед. рекомбинантного человеческого интерлейкина-2 (IL-2). Исследуемое антитело разбавляли из маточного раствора до соответствующей концентрации средой для культуры клеток RPMI1640. 1 х 10 радиоактивномеченных опухолевых клеток из исследуемой линии клеток инкубировали в течение 5 ч при 37 С в атмосфере 5% СО 2 в присутствии различных концентраций тестируемого или контрольного антитела и MNC. MNC добавляли в количестве, достаточном для достижения требуемого соотношения эффектор : клетка-мишень. Инкубацию осуществляли в U-образных 96-луночных планшетах в общем объеме 200 мкл среды RPMI1640 с дублированием. После периода инкубации планшеты центрифугировали, отбирали 100 мкл супернатанта и подсчитывали радиоактивность с помощью счетчика гамма-лучей. Общее количество включенной радиоактивности определяли для 104 клеток-мишеней. Спонтанное выделение определяли как радиоактивность, выделившуюся из клеток-мишеней в отсутствии как антитела, так и клеток -эффекторов в процессе указанного периода инкубации. Удельный лизис рассчитывали из следующего уравнения: Опосредованный антителом вызванный комплементом лизис опухолевых клеток Никакого специфичного в отношении LAHC опосредуемого комплементом лизиса (превышающего лизис, обнаруженный при использовании изотипа в качестве контроля) не обнаружено в клетках клона 33 HT-1080FAP, обработанных концентрациями LAНC до 50 мкг/мл (табл. 14, табл. 15 а). Литическая активность человеческой сыворотки, которую использовали в качестве источника комплемента, обнаружена по лизису клеток линии человеческой аденокарциномы молочной железы MCF-7 в присутствии 12,5 мкг/мл мышиного моноклонального aнти-Lewisy антитела 3S193 с известной способностью к активации комплемента (табл. 156). Опосредованный антителом клеточный лизис опухолевых клеток В присутствии LAНC в концентрации до 10 мкг/мл никакой АЗКЦ (зависящей от антитела клеточной цитотоксичности), опосредуемой человеческими MNC (табл. 16) или человеческими LAK-клетками(лимфокинактивированные киллеры, табл. 17 LAHC в отношении клеток клона 33 HT-1080FAP, которая бы превышала обнаруженную при использовании изотипа в качестве контроля, не обнаружено при соотношении эффектор:мишень 50:1. В аналогичных анализах in vitro с использованием либо человеческого комплемента, либо человеческих MNC в качестве эффекторных механизмов, человеческое моноклональное антитело к FAP LAHC не проявило никаких выраженных цитотоксических воздействий, превышающих таковые взятых в качестве контролей изотипов в отношении экспрессирующего FAP клона 33 линии опухолевых клеток HT1080FAP. Таблица 14. Удельный вызванный комплементом лизис (в %) клона 33 линии опухолевых клетокмишеней HT-1080FAP, опосредованный LAHC- 21005401 Инкубация: 2 ч при 37 С, 25% сыворотка, взятая у добровольцев А или Б соответственно, в качестве источника комплемента. Таблица 15 а. Удельный вызванный комплементом лизис (в %) клона 33 линии опухолевых клетокмишеней HT-1080FAP, опосредованный человеческим моноклональным антителом к FAP LAHC Инкубация: 2 ч при 37 С, 25% сыворотка, взятая у добровольцев А, Б или В, соответственно, в качестве источника комплемента Таблица 15b. Удельный вызванный комплементом лизис (в %) линии опухолевых клеток-мишеней Инкубация. 2 ч при 37 С, 25% сыворотка, взятая у добровольцев А, Б или В, соответственно, в качестве источника комплемента Таблица 16. АЗКЦ (зависящая от антитела клеточная цитотоксичность) (удельный лизис в %) в отношении клона 33 линии опухолевых клеток-мишеней HT-1080FAP человеческих MNC (мононуклеары периферической крови), опосредованная LAHC Клон 33 HT-1080FAP Инкубация: 5 ч при 37 С, 104 клеток-мишеней и соотношение эффекто-ры:клетки-мишени 50:1. Таблица 17. АЗКЦ (зависящая от антитела клеточная цитотоксичность) (удельный лизис в %) в отношении клона 33 линии опухолевых клеток-мишеней HT-1080FAP LAK-клетками (лимфокинактивированные киллеры), опосредованная LAНC Инкубация. 5 ч при 37 С, 10 клеток-мишеней и соотношение эффекторы:клетки-мишени 50:1. Пример 8. Иммуногистохимический анализ связывания моноклонального антитела LAHC с нормальной и неопластической тканями человека. Этот эксперимент осуществляли для того, чтобы определить характеристики связывания гуманизированного МАт LAНC с нормальной и неопластической тканями человека. Использовали следующие антитела: LAНC, cF19 и в качестве отрицательного контроля hIgGl, их непосредственно биотинилировали согласно методам, известным в данной области, и использовали в концентрациях от 2,5 до 0,25 мг/мл в 2% БСА/ЗФР (бычий сывороточный альбумин в забуференном фосфатом физиологическом растворе). Мышиное МАт F19 использовали в качестве супернатанта культуры ткани гибридомы F19 в разбавлениях от 1:5 до 1:10 в 2% БСА/ЗФР. Для иммунохимических анализов использовали следующие реагенты: комплекс стрептавидинпероксидаза (фирма Vector Labs, Burligame, CA), комплекс авидин-биотин-пероксидаза (фирма VectorLabs), биотинилированное лошадиное антимышиное антитело (фирма Vector Labs), ДАБ (диаминобензидин, фирма Sigma Chemical Co., Сент-Луис, МО, США), гематоксилин Гарриса. Оценивали свежезамороженные образцы ткани, такие как нормальная ткань ободочной кишки, молочной железы, легкого, желудка, панкреатической железы, кожи, гортани, мочевого пузыря, гладкой и скелетной мускулатуры. Изученные ткани опухолей включали карциномы молочной железы, ободочной кишки, пищевода, матки, яичника, панкреатической железы, желудка и головы и шеи. Применяли непрямой иммуноперексидазный метод, известный в данной области (Garin-Chesa P.,Old L.J., Rettig W.J., "Cell surface glycoprotein of reactive stromal fibroblasts as potential antibody target inhiman epithelial cancers", Proc. Natl. Acad. Sci. USA 87: 7235-7239 (1990, с использованием свежезамороженных срезов толщиной 5 мкм. ДАБ использовали в качестве субстрата для конечного продукта реакции. Срезы подвергали контрастному окрашиванию гематоксилином Гарриса и оценивали в отношении экспрессии антигена. Экспрессия LAHС в нормальных человеческих тканях Изученные нормальные ткани были отрицательными в отношении экспрессии LAНC за исключением нормальной ткани панкреатической железы, в которой была выявлена подгруппа позитивных эндокринных клеток в островках Лангергансена (А-клетки), включающая LAНC, cF19 и F19 (табл. 18). Никакой иммунореактивности не обнаружено при использовании в качестве отрицательного контроля hIgGl (человеческий иммуноглобулин подкласса IgG1). Экспрессия LAHC в опухолях При изучении образцов ткани опухолей обнаружена практически одинаковая схема экспрессииLAHC, cF19 и F19 в фибробластах стромы опухоли. Сильная и однородная экспрессия обнаружена в большинстве изученных случаев, прежде всего, в изученных образцах злокачественных опухолей, полученных из молочной железы, ободочной кишки, легкого, панкреатической железы и из плоскоклеточных карцином (SQCC) головы и шеи (табл. 19). Никакой иммунореактивности не обнаружено при использовании в качестве отрицательного контроля hIgG1.LAHC, cF19 и F19 проявили иммунореактивность в отношении фибробластов стромы опухоли в изученных образцах рака эпителия. Не обнаружено иммунореактивности ни LAНC, ни сF19 в отношении фиброцитов клеток мезенхимы нормального органа или клеток паренхимы нормального органа взрослого человека. Иммунореактивность в отношении FAP выявлена только в подгруппе эндокринных клеток в островках панкреатической железы, вероятно в продуцирующих глюкагон А-клетках, и в 4-х из 9-ти изученных образцов матки, представляющих собой подгруппы фибробластов стромы в этих тканях. Иммуногистохимический анализ LAНC в нормальных человеческих тканях и экспрессирующих FAP человеческих карциномах показал одинаковую схему связывания для LAНC, cF19 и мышиного МАт F19. Таблица 18. Иммунореактивность МАт LAHC, cF19 и F19 в отношении нормальных тканей человека Замороженные срезы с фиксацией ацетоном тестировали иммуноперокси-дазным методом с использованием комплекса авидин-биотин.Обозначает количество образцов ткани, полученных из различных пациентов.Идентификация А-клеток, основанная на морфологии и локализации внутри островков.Положительная иммунореактивность в строме 4-х из 9-ти изученных образцов. Положительные образцы представляют собой образцы ранней (2) и промежуточной (2) фазы пролиферации эндометрия. Пример 9. Видоспецифичность связывания LAHC в срезах тканей Этот эксперимент проводили для оценки с помощью иммуногистохимичес-ких методов реактивности LAHC с тканями, полученными из мыши, крысы, кролика и cynomolgus обезьян. В этих опытах в качестве негативных контролей также использовали cF19 и человеческий IgGl(hIgGl). Для иммуногистохимических анализов использовали следующие реагенты: комплекс стрептавидин-пероксидаза (фирма Vector Labs, Burligame, СА), ДАБ (фирма Sigma Chemical Co., Сент-Луис, МО,США), гематоксилин Гарриса.- 26005401 Для опытов использовали свежезамороженные образцы следующих тканей, полученных из мыши,крысы, кролика и cynomolgus обезьян: головной мозг, печень, легкое, почка, желудок, панкреатическая железы, тонкий кишечник, тимус, кожа, мышца, сердце, селезенка, яичник, матка и семенники. В качестве положительного контроля в каждый опыт включали срезы нормальных человеческих панкреатических желез и образец карциномы молочной железы. Иммуногистохимия Использовали непрямой иммунопероксидазный метод, известный в данной области (Garin-Chesa P.,Old L.J. и Rettig W.J. "Cell surface glycoprotein of reactive stromal fibroblasts as a potential antibody target inhuman epitelial cancers", Proc. Natl. Acad. Sci. 87: 7235 (1990, для анализа 5 свежезамороженных срезов толщиной 5 мкм. Антитела LAНC, cF19 и hIgGl (по 1 мкг/мл) биотинилировали согласно методу, известному в данной области, и выявляли с помощью комплекса стрептавидин-пероксидаза. ДАБ использовали в качестве субстрата для конечного продукта реакции. Срезы подвергали контрастному окрашиванию гематоксилином Гарриса и оценивали в отношении экспрессии антигена. В экспериментах установлено, что изученные нормальные ткани не реагировали ни с LAНC, ни сcF19 (табл. 1). В примененных в качестве положительного контроля человеческих панкреатических железах обнаружено, что LAНC и cF19 связываются с подгруппой эндокринных клеток в островках Лангерганса, как ранее установлено для F19. Кроме того, связывание LAНC и cF19 обнаружено в фибробластах стромы опухоли в образце карциномы молочной железы. В этих экспериментах иммуногистохимические анализы нормальных тканей, полученных из мыши,крысы, кролика и cynomolgus обезьян, не позволили выявить какое-либо связывание ни LAНC, ни cF19. Таблица 20. Связывание LAНC со срезами тканей животных по данным иммуногистохимии- 27005401 н.и.- не испытывали Пример 10. Создание линий клеток, продуцирующих химерные и преобразованные моноклональные антитела к FAP. Целью этого эксперимента была демонстрация получения стабильных линий клеток по изобретению, экспрессирующих LAHC, LAНA, LBHB, LBHD и cF19 в СНО-клетках линии DG44. Получали стабильные линии клеток, трансфектированные гуманизированным или химерными антителами F19, и их идентичность подтверждали с помощью ПЦР-амплификации вариабельных областей тяжелой и легкой цепи с использованием в качестве матрицы геномной ДНК, полученной из каждого трансфектанта. СНО-клетки линии DG44 поддерживали в бессывороточных условиях в среде SFM-II. Липофектин и бессывороточную среду SFM-II получали от фирмы Gibco/BRL. Генетицин и все рестриктазы получали от фирмы Boehringer Mannheim. Полимеразу Pfu получали от фирмы Stratagene. ДНК для трансфекции выделяли из клеток Е.coli, используя QiaFilter Maxi Cartridges (фирмаQiagen) согласно инструкциям поставщика. Все препараты ДНК оценивали с помощью расщепления рестриктазами. Последовательности вариабельных областей LAНC в соответствующих векторах подтверждали с использованием секвенатора типа ABI PRISM 310 (фирма Perkin-Elmer). Дополнительная информация, касающаяся примененных векторов и последовательностей ДНК,может быть получена из приведенных ранее примеров. Трансфекция СНО-клеток линии DG44 Клетки на логарифмической фазе роста высаживали в 6-луночные планшеты, содержащие 1 мл свежей среды SFM-II. СНО-клетки линии DG44 котрансфектировали плазмидами, кодирующими тяжелую и легкую цепи гуманизированной или химерной версий F19 с помощью трансфекции липосомами. Липосомы получали, используя 6 мкл реагента липофектина и 0,5 мкг каждого вектора (один для требуемой тяжелой цепи и один для легкой цепи), как описано для трансфекции с использованием LipofectAMINE, за исключением того, что для разбавления всех реагентов использовали среду SFM-II. Через 24 ч клетки разбавляли в соотношении 1:10, средой SFM-II, содержащей 300 мкг/мл генетицина. После прохождения начальной фазы уничтожения клеток (10-14 дней) концентрацию генетицина уменьшали до 200 мг/мл и добавляли метотрексат до получения конечной концентрации 5 нМ. Через 1014 дней концентрации метотрексата повышали до получения конечной концентрации 20 нМ. ПЦР-амплификация ДНК трансфектантов 107 СНО-клеток линии DG44 центрифугировали в микроцентрифуге Эппендорфа в течение непродолжительного периода времени при полной скорости, промывали однократно ЗФР и вновь один раз пеллетировали. Геномную ДНК получали осаждением этанолом после лизиса ДСН и обработки дебриса протеиназой К. Для амплификации вариабельной области либо тяжелой, либо легкой цепи с использованием в качестве матрицы геномной ДНК, применяли смесь, содержащую один из приведенных ниже праймеров,дНТФ, буфер и полимеразу Pfu. Полученные в результате ПЦР продукты расщепляли обработкой соответствующей рестриктазой и для подтверждения их идентичности анализировали с помощью электрофореза на агарозном геле. Набор праймеров для легкой цепи: Нерасщепленный ПЦР-продукт тяжелой цепи имел предсказанный размер 469 пар оснований, а ПЦР-продукт легкой цепи имел предсказанный размер 286 пар оснований. Проверку идентичности осуществляли обработкой рестриктазами BstEII (тяжелая цепь) или N1aIV (легкая цепь). Линии СНО-клеток трансфектировали LAНC, LAНA, LBHB, LBНD, а также cF19. Получали устойчивые к генетицину линии и эти клетки подвергали дальней селекции по признаку устойчивости к метотрексату. После ПЦР-амплификации с последующим расщеплением рестриктазами ДНК легкой и тяжелой цепи получали ожидаемые полосы и подтверждали идентичность трансфектантов LAНC, LAНA, LBHB и LBHD. Описанные клетки все время поддерживали в бессывороточных условиях и не обрабатывали продуктами животного происхождения, такими как трипсин. Получали трансфектированные линии клеток-продуцентов, которые экспрессировали моноклональные антитела LAНC, LAНA, LBHB, LBHD и cF19. Их идентичность подтверждали, используя ПЦРамплификацию и расщепление растриктазами полученных ПЦР-продуктов вариабельных областей как тяжелой, так и легкой цепи.- 28005401 Пример 11. Экспрессия протеинов антитела в клетках яичника китайского хомячка линии DG44 и их очистка. Целю данного эксперимента была экспрессия и очистка МАт LAHC, LAНA, LBHB и LBHD для получения их характеристик. Другие задачи включали применение количественного анализа ELISA для оценки концентраций антитела как образцах неочищенных сред, так и в очищенных образцах Ig, и определение с помощью этого анализа относительных уровней экспрессии различных гуманизированных конструкцийF19. Выращенные в бессывороточной среде СНО-клетки линии DG44 и метотрексат, имеющий чистоту,соответствующую фармакопеи США (USP-чистоту) получали от фирмы Biotechnical Production Unit ofthe Dr. Karl Thomae GmbH, Biberach, Германия; оба продукта также имеются в продаже. Клетки все время поддерживали в бессывороточных условиях. Бессывороточную среду SFM-II получали от фирмыGibco/BRL. Протеин-А агарозу получали от фирмы Pierce Chemical (Индианаполис, IN, США). Стандартные образцы человеческого IgGl (каталожный номер I 3889), таблетки пара-нитрофенилфосфата (N 2640), бычий сывороточный альбумин (БСА) (А 7906) и специфическое конъюгиро-ванное с щелочной фосфатазой козье антитело к человеческой каппа-цепи (А 3813) получали от фирмы Sigma Chemical(Сент-Луис, МО, США). Специфическое конъюгированное с щелочной фосфатазой козье антитело к человеческой гамма-цепи получали от фирмы Jackson Immunoresearch Laboratiries (через фирму StratechScientific). TBS (забуференный трис физиологический раствор) содержал 150 мМ NaCl, 50 мМ трис, рН 7,5. Условия культивирования клеток для экспрессии антител Клетки культивировали и поддерживали в матрасах типа Т-175 в бессывороточной среде SFM-II без перемешивания. Среда содержала 200 мкг/мл генетицина и 20 нМ метотрексат и не содержала антибиотиков. Клетки пересевали разбавлением, они не склеивались и вырастали с образованием небольших кластеров. Когда клетки достигали стационарной фазы роста, среду собирали и центрифугировали для удаления клеток и хранили при -20 С до употребления. Очистка LAHC Все стадии очистки проводили при 4 С. Колонку типа С 10/10 (фирма Pharmacia Fine Chemicals) упаковывали протеин-А агарозой (объем гранул 3 мл). Колонку промывали TBS и однократно предварительно элюировали 0,1 М Na-цитратным буфером, рН 3,0 для гарантии того, что никакого свободно связанного материала не осталось на колонке. Затем колонку немедленно повторно уравновешивали TBS и хранили при 4 С. Использованные супернатанты культуры подвергали оттаиванию и центрифугировали при 10000xg в течение 30 мин до проведения хроматографии на протеине-А для удаления дебриса и разбавляли равным объемом TBS. Этот продукт загружали в колонку с протеином-А со скорость 0,5 мл/мин,используя перистальтический насос типа Р-1 (фирма Pharmacia), и промывали TBS до тех пор пока абсорбция при 280 нм не становилась невыявляемой. Элюцию антитела начинали при 280 нм и собирали 1 мл фракции элюированного продукта в пробирки, содержащие достаточное для нейтрализации цитратного буфера количество трис-буфера, рН 9. Содержащие протеин фракции объединяли и концентрировали, используя устройство для фильтрации типа Amicon с фильтром YM-30 и диализ в противотоке ЗФР. Колонку немедленно регенерировали с помощью TBS. Анализы связывания протеина с красителем проводили с помощью набора для определения протеинов фирмы BioRad (Hercules, Калифорния) согласно инструкциям производителя, используя в качестве стандарта бычий сывороточный альбумин. Анализ с помощью ELISA человеческого IgG (гамма-иммуноглобулин) Планшеты для ELISA покрывали (сенсибилизировали) в течение ночи 100 мкл специфического конъюгированного с щелочной фосфатазой козьего антитела к человеческой гамма-цепи в концентрации 0,4 мг/мл в буфере для сенсибилизации поверхностей при 4 С. Сенсибилизирующее антитело удаляли и планшеты блокировали 2%-ным БСА в ЗФР в течение 2 ч. Все последующие стадии проводили при 37 С. Блокирующий буфер заменяли образцами антител или используемым в качестве стандарта человеческимIgGl, разбавленным в буфере для разведения, получали серийные разведения в объеме 200 мл и инкубировали в течение 1 ч. Отрицательные контроли включали буфер для разведения и/или культуральную среду нетрансфектированных клеток. Лунки промывали и добавляли 100 мкл специфического конъюгированного с щелочной фосфатазой козьего антитела к человеческой каппа-цепи, разбавленного в соотношении 1:5000, и инкубировали в течение 1 ч. Лунки промывали и добавляли 100 мкл буфера для проведения реакции и инкубировали 30 мин. Реакцию прекращали, добавляя 1 М NaOH и определяли абсорбцию при 405 нм с помощью планшет-ридера для ELISA. Результаты анализировали с помощью итеративной аппроксимации четырехпараметрической кривой. Анализ аминокислот проводили согласно методам, известным в данной области. Получали моноклональное антитело LAHC и очищали до гомогенного состояния с помощью аффинной хроматографии на протеине-А. Анализ ELISA с использованием в качестве стандарта человеческогоIgGl позволил установить, что выход LAHC превышает 70%. По данным, полученным с помощью гельэлектрофореза в ДСН-полиакриламидном геле, чистота продукта составляла более 90%. Репрезентативные данные об экспрессии и типичные выходы после очистки приведены в табл. 21.- 29005401 Таблица 21. Данные об экспрессии и уровнях выхода протеинов антител к FAP в СНО-клетках В этом эксперименте получены репрезентативные данные об экспрессии каждого антитела к FAP. Данные о выходе после аффинной хроматографии на протеин-А агарозе получены на основе оценок связывания протеина с красителем очищенного Ig с использованием БСА в качестве стандарта. Пример 12. Связывание моноклонального антитела LAHC с выделенным рекомбинантным человеческим FAP. Целью этого исследования была характеризация связывания LAНC с выделенным рекомбинантным человеческим FAP. Оценка с помощью ELISA CD8-FAP Планшеты для ELISA покрывали (сенсибилизировали) в течение ночи 100 мкл мышиного антикрысиного антитела (фирма Sigma Chemical, R0761), разбавленного в соотношении 1:2000 в буфере для сенсибилизации поверхностей при 4 С. Сенсибилизирующее антитело удаляли и планшеты блокировали 2%-ным БСА в ЗФР в течение 1 ч. Все последующие стадии проводили при комнатной температуре. Блокирующий буфер заменяли образцами 100 мл крысиного антитела к CD8 (фирма Pharmingen) в концентрации 1 мг/мл и инкубировали в течение 1 ч. Планшеты промывали и добавляли 100 мкл супернатанта культуры CD8-FAP (см. пример 14) (1:2 в ЗФР) и позволяли связываться в течение 1 ч. Планшеты промывали и добавляли образцы антитела (двукратные серийные разведения) в объеме 100 мкл и инкубировали в течение 1 ч. Отрицательные контроли включали человеческий IgG и/или культуральную среду нетрансфектированных клеток. Лунки промывали и добавляли 100 мкл мышиного антитела к человеческому IgGl, конъюгированного с пероксидазой из хрена (HRP) (фирма Zymed, 05-3320), разбавленного в соотношении 1:500 буфером для разведения, и инкубировали в течение 1 ч. Лунки промывали и добавляли 100 мкл субстрат для HRP (азинобис(3-этилбензтиазолин-6-сульфоновая) кислота, фирма SigmaChemical, A9941) и инкубировали 60 мин. Реакцию прекращали, добавляя 1 М NaOH и определяли абсорбцию при 405/490 нм с помощью планшет-ридера для ELISA. Результаты анализировали с помощью итеративной аппроксимации четырехпараметрической кривой. В альтернативном варианте планшеты непосредственно сенсибилизировали cF19. Согласно описанному выше способу давали связаться с этими планшетами FAP (рекомбинантный человеческий FAP,см. пример 13) и затем добавляли биотинилированное LAHC (1 мкг/мл). Связывание антитела определяли с помощью конъюгата HRP-стрептавидин, как описано выше. Солюбилизация связанного с мембраной человеческого FAP Экспрессирующие FAP клетки линии 293FAP 1/2 или контрольные клетки линии 293 промывали ЗФР и лизировали с помощью 1%-ного тритона Х-114 в забуференном трис физиологическом растворе. Ядра и дебрис удаляли центрифугированием при 10000xg. Супернатант раздели на фазы (Estreicher A.,Wohlend A., Belin D., Scheuning W.D., Vasalli J.D., "Characterization of cellular binding site for the urokinasetype plasminogen activator", J. Biol. Chem., 264: 1180-1189 (1989 с целью обогащения мембранных протеинов. Собирали полученную с помощью детергента фазу и разбавляли буфером, содержащим 1%-ный эмпиген ВВ (фирма Calbochem) для предотвращения повторной агрегации тритона Х-114. Этот продукт подвергали хроматографии на конканавалин-А агарозе (Retting W.J., Garin-Chesa P., Healey J.H., Su S.L.,Ozer H.L., Schwab M., Albino A. P., Old L.J., "Regulation and heteromeric structure of fibroblast activationLAНC (1-2 мг) подвергали диализу в противотоке 50 мМ бикарбонатного буфера и биотинилировали с помощью 10-кратного молярного избытка сульфосукцинимидил-6-биотинамидогексаноата (NHS-LCбиотин) (фирма Pierce Chemical, Rockford, Иллинойс, США) в течение 2 ч при комнатной температуре. Непрореагировавший продукт удаляли путем повторного микродиализа в микроконцентраторе. Кратковременные трансфекции Клетки линии COS-7 (Американская коллекция типовых культур тканей, регистрационный номерLAНC. Моноклональное антитило к CD 8 иммобилизовывали на титрационных микропланшетах. CD8-FAP из среды культуры клеток насекомых, зараженных бакуловирусами, CD8-FAP, давали связаться с этими
МПК / Метки
МПК: C12N 15/13, A61K 47/48, G01N 33/577, C07K 16/40, A61P 35/00
Метки: активации, антитела, повышенной, фибробластов, применения, продуктивности, способы, белку
Код ссылки
<a href="https://eas.patents.su/30-5401-antitela-povyshennojj-produktivnosti-k-belku-aktivacii-fibroblastov-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела повышенной продуктивности к белку активации фибробластов и способы их применения</a>
Предыдущий патент: Комбинация на основе производного камптотецина и комбретастатина
Следующий патент: Соединения пиримидин-4-она способ их получения и содержащие их фармацевтические композиции
Случайный патент: Хиноксалиндионы.