Рекомбинантное антитело, взаимодействующее с антигенным комплексом ior c2, fv- фрагмент указанного антитела и способ их применения
Номер патента: 5169
Опубликовано: 30.12.2004
Авторы: Иснага Эскобар Нормандо, Моралес Моралес Алехо, Белль Гарсия Анссель, Рамос Сусарте Майра, Дуэньяс Порто Марта, Матео Де Акоста Дель Рио Кристина Мария, Ренхифо Кальсадо Энрике, Перес Родригес Роландо, Роке Наварро Лоурдес Татьяна, Гавилондо Ковлей Хорхе Виктор, Айяла Авила Марта
Формула / Реферат
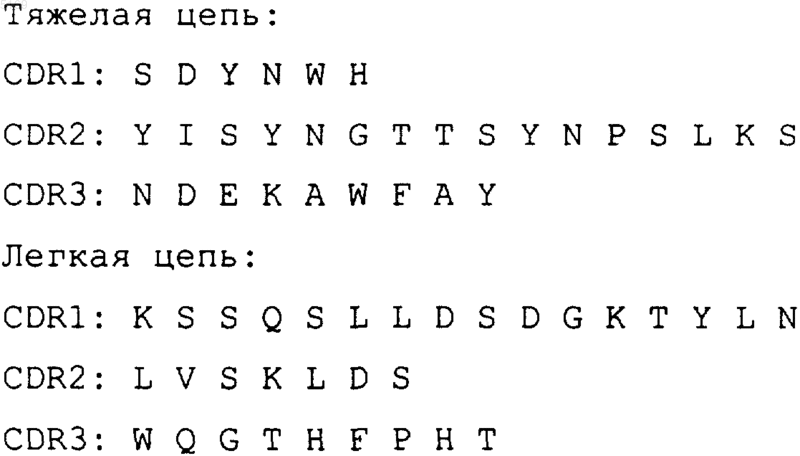
1. Рекомбинантное антитело, взаимодействующее с антигенным комплексом ior C2, полученное из мышиного моноклонального антитела IOR C5, продуцируемое гибридомой, депонированной под номером ECCC 97061101, при том, что последовательности участков, определяющих комплементарность связывания с антигеном (CDR), легкой и тяжелой цепей представляют собой
2. Рекомбинантное антитело по п.1, отличающееся тем, что содержит участки CDR и каркасные области (FR) антитела IOR C5 и константные области легкой и тяжелой цепей антитела человека, при том, что аминокислотные последовательности указанных каркасных областей тяжелой и легкой цепей представляют собой

3. Рекомбинантное антитело по п.1, отличающееся тем, что дополнительно содержит точечные мутации в каркасных областях тяжелой и легкой цепей для снижения его иммуногенности.
4. Рекомбинантное антитело по п.3, отличающееся тем, что содержит в каркасных областях тяжелой и легкой цепей любую из следующих точечных мутаций:

5. Линия клеток, экспрессирующих рекомбинантное антитело по любому из пп.1-4.
6. Фармацевтическая композиция для лечения злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов, включающая рекомбинантное антитело по любому из пп.1-4 и приемлемый носитель.
7. Диагностическая композиция для локализации и идентификации in vivo злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов, включающая рекомбинантное антитело по любому из пп.1-4.
8. Диагностическая композиция по п.7, дополнительно включающая соединения для радиоактивного мечения антитела, выбранные из группы, состоящей из технеция 99, рения 186 и рения 188.
9. Диагностический способ идентификации in vivo злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов, включающий введение пациенту физиологически приемлемой композиции, которая содержит антитело по любому из пп.1-4, предварительно меченной Tc-99 или любым другим радиоактивным аналогом, и мониторинг биораспределения указанной композиции иммуногаммаграфическими методами.
10. Одноцепочечный фрагмент Fv рекомбинантного антитела, полученный из мышиного моноклонального антитела IOR C5, продуцируемое гибридомой, депонированной под номером ECCC 97061101, при том, что последовательности CDR и каркасных областей (FR) указанного фрагмента представляют собой

11. Одноцепочечный фрагмент Fv по п.10, отличающийся тем, что содержит в каркасных областях тяжелой и легкой цепей любую из следующих точечных мутаций для снижения иммуногенности:


12. Линия клеток, экспрессирующих одноцепочечный Fv фрагмент по п.10 или 11.
13. Фармацевтическая композиция для лечения злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов, включающая одноцепочечный Fv фрагмент по п.10 или 11 и приемлемый носитель.
14. Диагностическая композиция для локализации и идентификации in vivo злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов, включающая одноцепочечный Fv фрагмент по п.10 или 11.
15. Диагностическая композиция по п.14, дополнительно включающая соединения для радиоактивного мечения антитела, выбранные из группы, состоящей из технеция 99, рения 186 и рения 188.
16. Диагностический способ идентификации in vivo злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов, включающий введение пациенту физиологически приемлемой композиции, которая содержит одноцепочечный Fv фрагмент по п.10 или 11, предварительно меченной Tc-99 или любым другим радиоактивным аналогом, и мониторинг биораспределения указанной композиции иммуногаммаграфическими методами.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к биотехнологии, и в частности к новым рекомбинантным антителам, получаемым с использованием методов генной инженерии, и конкретно к химерному антителу, гуманизированному антителу и одноцепочечному фрагменту Fv, получаемому на основе антитела мыши IOR С 5, которое распознает эпитопы, экспрессированные в антигене ior C2, представляющем собой гликопротеиновый комплекс, экспрессируемый в нормальных и злокачественных колоректальных клетках. Предпосылки создания изобретения Были испытаны различные виды лечения колоректальной карциномы, но до настоящего времени единственным способом излечения остается хирургия. При этом хирургическое вмешательство позволяет достичь высокого процента выживаемости, в том случае, когда опухоль обнаруживается на ранней стадии, но, к сожалению, в большинстве случаев она диагностируется уже при наличии метастаз. Применяемая в настоящее время стратегия по увеличению выживаемости включает комплекс методов диагностики, терапии и эпидемиологических мероприятий на тех стадиях,когда поражение еще не распространяется на внешние слои органов и опухоль все еще операбельна. И в этом случае знание и учет эпидемиологических факторов, а также разработка новых методов терапии позволят повысить уровень выживаемости. В последние годы получило распространение использование моноклональных антител(Мав) или их фрагментов, меченных радиоактивными изотопами, для обнаружения рака иммуногаммаграфическими методами. Показано,что Мав могут применяться в качестве носителей радиоизотопов при нацеливании их на ассоциированные опухолевые антигены. Некоторые радиоактивно меченные антитела использовались для обнаружения ассоциированных с опухолью карциноэмбриональных антигенов (КЭА). Антитела против КЭА, меченные 131I или 125I, использовались для обнаружения опухолей, продуцирующих КЭА или ассоциированных с указанным маркером (патенты США 3 663 684,3 867 363 и 3 927 193). Кроме того, Мав могут быть помечены Тс-99m для достижения нужных молекул при диагностике in vivo. Разработка техники гибридомных антител(Kohler and Milstein) совершилa буквально революционный переворот в иммунохимии и предоставилa полученное новое семейство реагентов, перспективных в плане их применения как с исследовательскими целями, так и для клинической диагностики заболеваний (Kohler G.,Milstein С., 1975, Nature, 256, 495-497). Однако указанные антитела не продемонстрировали высокой терапевтической эффективности, и, 005169 2 хотя получение мышиных моноклональных антител (mAbs) стало рутинной процедурой, применяемой в области фундаментальных исследований и в клинической диагностике, использовать такую иммунотерапию in vivo было затруднительно, поскольку она снижала время полужизни антитела у человека, приводила к слабому распознаванию эффекторных доменов мышиных антител иммунной системой человека, а также в связи с тем, что чужеродные иммуноглобулины могли вызывать антиглобулиновый ответ (ГАМК ответ), который мешал проведению терапии. Развитие методов генной инженерии кардинально расширило возможности генетической манипуляции с генами, кодирующими антитела,что позволило продуцировать mAbs, обладающие сниженной антигенностью или не обладающие антигенностью вовсе или усиленными желательными эффекторными функциями в ситуациях, когда эти антитела использовались при лечении или с целью диагностики различных патологических состояний. Указанные манипуляции представляют собой альтернативу в тех случаях, когда мышиные Мав могли быть превращены в преимущественно человеческую форму, обладающую такими же антигенсвязывающими свойствами (Morrison S.L. et al., 1984,P.N.A.S. USA, 81, 6851-6855). Недавно был разработан ряд методов для гуманизации мышиных или крысиных антител,с тем чтобы снизить ксегенную реакцию в ответ на введение в организм человека чужеродных белков. Один из числа основных методов, направленный на снижение антигенности, был получен через механизм образования химерных антител. В таких молекулах в рамку считывания человека вводили вариабельные домены, причем в этом случае можно добиться не только снижения иммуногенности, но и улучшения эффекторных свойств, поскольку молекулы в этом случае становятся человеческими и распознаются, таким образом, иммунной системой человека(Morrison S.L. et al., 1984, P.N.A.S. USA, 81,6851-6855). Указанные химерные молекулы сохраняют способность распознавать исходный антиген, и его константный участок не является иммуногенным, хотя иммуногенность против мышиного вариабельного участка сохраняется. Другие авторы пытались создать сайты связывания антигенов грызунов непосредственно на молекулах человеческих антител при трансплантации от мышиного антитела только антигенсвязывающего сайта, а не полностью вариабельного домена (Jones P.Т. et al., 1986,Nature, 321, 522-524, Verhoeyen M. et al., 1988,Science, 239, 1534-1536). Указанные авторы разработали несколько применений метода Рейчманна (Rietchmann L. et al., 1988, Nature, 332,323-327; Quee С. et al., 1989, P.N.A.S. USA, 86,10029-10033), однако, ряд других авторов работали с измененными по форме антителами, 3 включающими некоторые остатки мышиных молекул в человеческие рамки считывания (FR) для целей восстановления аффинности к исходному антигену (Tempest, P.R., 1991, Biotechnology,9, 266-272). Матео с соавт. (Mateo et al., патент США 5711210) описали процедуру снижения иммуногенности мышиных антител. В указанной процедуре вводимые модификации ограничиваются только вариабельными доменами и конкретно мышиными рамками считывания химерных антител. Более того, указанные модификации вводятся только в участки FR, имеющие амфипатическую спиральную структуру, что,таким образом, делает их возможными эпитопами, которые могут распознаваться Т клетками. Указанный метод предлагается для замены мышиных остатков внутри амфипатических участков аминокислотами, находящимися в тех же самых положениях в человеческих иммуноглобулинах, разумеется, аминокислоты, которые участвуют в образовании трехмерной структуры сайта связывания, т.е. зоны Вернье, канонической структуры гипервариабельного участка и аминокислоты межфазного участка, между легкой и тяжелой цепями исключаются. Антитело, модифицированное методом,описанным Матео с соавт., сохраняют способность распознавать и связывать антиген, который распознавало исходное антитело, что приводит к меньшей иммуногенности, и в этой связи отмечается повышение терапевтической эффективности. При использованной указанной процедуре необходимо ввести лишь небольшое число мутаций для получения модифицированных антител, обладающих сниженной иммуногенностью по сравнению с химерными антителами. Относящееся к изотипу IgG1 моноклональное антитело мыши IOR C5 (заявка на патент WO 97/33916), которое получают при иммунизации Ваlb/С клетками SW116 (клетки колоректальной аденокарциномы), распознает антиген, экспрессируемый преимущественно на поверхности и в цитоплазме злокачественных и нормальных колоректальных клеток. Указанное антитело не распознает ни КЭА, ни антигены Льюиса а, Льюиса b, асиалилированный антиген Льюиса, ни антигены на мембранах моноядерных клеток, ни красные глобулы (Vazquez A.M.et al., Hybridoma, 11, 245-256, 1992). Исследования методом вестерн-блоттинга экстракта мембран клеток SW116 показали, что указанное антитело распознает гликопротеиновый комплекс, обозначенный как ior C2, и имеет две формы с разным молекулярным весом (145 и 190) (Vazquez A.M. et al., Year Immunol. Basel,Karger, vol. 7, 137-145, 1993). Из уровня техники известно также, что генно-инженерными методами можно сконструировать рекомбинантные фрагменты на основе моноклональных антител. Имеется много отчетов, оценивающих потенциал использова 005169 4 ния фрагментов различных антител для целей диагностики in vivo и лечения заболеваний. Ира Пастан с соавт. (Ira Pastan et al., EP 0796334 A1) описывает процедуру конструирования одноцепочечных Fv фрагментов с использованием вариабельных участков антител, специфически распознающих углеводы, родственные тем, что имеются в антигене Льюиса Y. На основе таких фрагментов ими был разработан метод обнаружения клеток, несущих этот антиген. Кроме того, были представлены доказательства ингибирующего действия указанных фрагментов на клетки, несущие антиген. Описание изобретения Настоящее изобретение относится к рекомбинантным антителам, получаемым с использованием методов генной инженерии, и конкретно к химерному антителу, гуманизированному антителу и одноцепочечному фрагменту Fv,получаемому на основе антитела мыши IOR С 5,которое продуцирует гибридома с одноименным названием, депонированная в соответствии с Будапештским Договором под номером ЕССС 97061101 в Европейской коллекции клеточных культур 11 июня 1997 г. Указанное антитело распознает эпитопы, экспрессированные в антигенеior C2, представляющем собой гликопротеиновый комплекс, экспрессируемый в нормальных и злокачественных колоректальных клетках. Подробное описание изобретения Синтез кДНК и амплификация гена вариабельного участка С 5 мыши Проводят экстракцию цитоплазматической РНК из примерно 106 гибридомных клеток, продуцирующих моноклональное антитело С 5(Vazquez A.M. et al., Year Immunol., Basel, Karger,vol. 7, 137-145, 1993). Указанный метод, используемый для экстракции РНК, описан Фалоро с соавт. (Faloro, J., Treisman, R., and Kemen, R.,1989, Methods in Enzymology, 65: 715-749). Реакционная среда для синтеза кДНК состоит из 5 мкг РНК, полученной с использованием 25 пкмолей сконструированных праймеров для гибридизации с началом константного участка мышиного IgG1 и с константным каппа участком легкой цепи мыши, 2,5 мМ каждого дезоксинуклеотида (дНТФ), 50 мМ Трис-HCl, рН 7,5,75 мМ КСl, 10 мМ ДТТ, 8 мМ MgCl2 и 15 мкг ингибитора рибонуклеазы (РНК guard, Pharmacia) в общем объеме 50 мкл. Образцы нагревают при температуре 70 С в течение 10 мин и затем медленно охлаждают до 37 С в течение 30 мин. Затем добавляют 100 единиц обратной транскриптазы и продолжают инкубацию при 42 С в течение 1 ч. Вариабельный участок легкой цепи (VK) и тяжелой цепи (VH) амплифицируют с помощью полимеразной цепной реакции (ПЦР). Вкратце: 5 мкл кДНК VH или VK смешивают с 25 пкмолями специфических праймеров, 2,5 мМ каждого дНТФ, 5 мкл буфера 10 Х для рестриктазной ДНК-полимеразы и 1 единицей этой рестрикта 5 зы. Образцы подвергают воздействию 25 термических циклов при 94 С 30 с, при 50 С - 30 с,при 72 С - 1 мин и последнюю инкубацию проводят в течение 5 мин при 72 С. Клонирование и секвенирование амплифицированной кДНК Очищенные VH и VK кДНК клонируют в ТА вектор (ТА Cloning kit, Promega, США). Клоны секвенируют дидезоксиметодом с использованием ДНК-полимеразы Т 7 (Pharmacia, Швеция). Конструирование химерных генов Вариабельные участки легкой и тяжелой цепей получают при обработке рестрикционными ферментами из ТА векторов и затем клонируют в векторы экспресии (Coloma et al., Journalof Immunological Methods, 152, 89-104, 1992). Гены VH вырезают из ТА вектора расщеплением EcoR5 и NheI и затем клонируют их в вектор экспрессии РАН 4604, в который включены человеческий константный IgG1 и ген устойчивости к гистидинолу. Полученная конструкция представляет собойC5VH-PAH4604. Гены VK вырезают из ТА вектора расщеплением EcoR5 и SalI и затем клонируют их в PAG4622. Указанный вектор содержит ген устойчивости к gpt и использует каппа константный участок человека. Полученная конструкция представляет собой C5VK-PAG4622. Экспрессия химерного антитела Клетки NSO подвергают электропорации с использованием 10 мкг C5VH-PAH4604 и 10 мкг C5VK-PAG4622 и затем линеаризуют при расщеплении с использованием PvuI. Полученные ДНК смешивают друг с другом, осаждают этанолом и растворяют в 25 мкл воды. Выращивают до полуслияния примерно 107 клеток NSO,собирают их центрифугированием и ресуспендируют в 0,5 мл DMEN вместе с расщепленной ДНК в кювете для проведения электропорации. После 5-минутного выдерживания во льду клетки обрабатывают импульсным током (170 В и 960 мкФ) и оставляют во льду еще на 30 мин. Затем клетки помещают в 20 мл DMEN, содержащей 10% околоплодную сыворотку теленка, и оставляют для восстановления на 48 ч. К этому времени клетки разносят на 96-луночный планшет и добавляют селективную среду (DMEN,10% околоплодная сыворотка теленка, 0,8 мкг/мл микофеноловая кислота и 250 мкг/мл ксантин). Трансфицированные клоны становятся видимыми невооруженным глазом через 10 дней. Наличие человеческого антитела в среде ячеек, содержащей трансфицированные клоны,определяют методом ТИФА (ELISA). Микротитрационные ячейки покрывают козьим антителом, направленным против человека (специфичным к гамма-цепи). После промывания ФБСР (фосфатно-буферный солевой раствор,содержащий 0,02% Твина 20, рН 7,5) к каждой микротитрационной ячейке добавляют 100 мкл культуральной среды из ячеек, содержащих трансфектанты, на 1 ч при 37 С. Далее ячейки 6 промывают ФБСР и добавляют конъюгированный козий каппа фрагмент, направленный против человека, специфичный к легкой цепи, и инкубируют при комнатной температуре в течение 1 ч. Затем ячейки промывают ФБСР и добавляют субстратный буфер, содержащий диэтаноламин. Через 30 мин измеряют поглощение при длине волны 405 нм. Конструирование гуманизированного IOR C5h путем гуманизации Т эпитопов Предсказание Т эпитопов Последовательности вариабельных участков IOR C5 анализируют с помощью программыAMPHI, которая позволяет предсказывать сегменты последовательностей длиной от 7 до 11 аминокислот со структурой амфипатической спирали, которая связана с проявлением Тиммуногенности. Используют также программуSOHHA, которая дает возможность предсказывать гидрофобные участки спирали (Elliot et al.,J. Immunol. 138: 2949-2952, 1987). Указанные алгоритмы позволяют предсказывать фрагменты,связанные с презентацией Т эпитопов в легкой и тяжелой цепях вариабельных участков IOR С 5. Анализ гомологии вариабельных участков Вариабельные домены IOR C5 сравнивают с соответствующими вариабельными доменами человека с целью определения наибольшей гомологии последовательности человеческой и мышиной молекул. Для этого используют информацию по последовательностям молекул человека, имеющейся в базах данных Gene Bank и EMBL, доступных через Интернет. Сравнение проводят в режиме автоматизированного метода при использовании компьютерной программыPC-DOS HIBIO PROSIS 06-00, Hitachi. Анализ на снижение иммуногенности Сущность указанного метода состоит в снижении иммуногенности путем гуманизации возможных эпитопов Т клеток с введением лишь незначительных мутаций в PC, и конкретно в амфипатическую спираль, за исключением положений, участвующих в образовании трехмерной структуры сайта связывания. В рамках указанного метода проводят сравнение участков VH и VK мышиного иммуноглобулина с последовательностью человеческого иммуноглобулина с наибольшей гомологией для выявления различающихся остатков в последовательностях молекул человека и животных, причем только в пределах амфипатических участков внутри зоны PC (Kabat E. 1991,Sequences of proteins of immunological interest,Fifth Edition, National Institute of Health), поскольку только такие мышиные остатки будут подвергнуты мутации человеческой последовательностью в тех же положениях. Те остатки в мышиной PC, которые определяют канонические структуры входящих в зону Вернье остатков, не подвергают мутациям,поскольку они могут оказать существенное влияние на третичную структуру и воздейство 7 вать на сайт связывания. Дополнительная информация о возможных замещениях в третичной структуре может быть получена при создании трехмерной модели вариабельных участков. Клонирование и экспрессия гуманизированногоIOR C5 антитела в NSO клетки После осуществления перекрывания в рамках ПЦР для получения мутаций и гуманизации VH и VK полученную генетическую конструкцию, соответствующую, после гуманизации Т-клеточных эпитопов, IOR С 5, клонируют в векторы экспрессии с применением процедур,аналогичных тем, которые были использованы для экспрессии химерного антитела, с получением следующих плазмид: C5Vkhu-PAG4622 иC5Vhhu-PAH4604. Трансфекцию указанных генов в NSO клетки проводят точно в тех же условиях,что приведены для случая химерного антитела. Получение одноцепочечного Fv фрагмента Конструирование и экспрессия scFv Стратегия включает первую амплификацию с использованием ПЦР, которая приводит к модификации последовательностей VH и VL,включая сайты рестрикции эндонуклеазами, для последующего клонирования в векторы экспрессии. В рамках проводимой амплификации используются соответствующие олигонуклеотиды для воссоздания точной последовательности. После амплификации вариабельные участки очищают и расщепляют соответствующими рестрикционными эндонуклеазами. Фрагменты ДНК очищают и лигируют в векторы экспрессии. Позже с использованием традиционных методов осуществляют экспрессию указанных генетических конструкций в E.coli. В процессе экстракции белка из продуцирующих клеток проводят разрушение клеток ультразвуком и далее с использованием комбинации методик электрофореза в ДСН-полиакриламидном геле, методов переноса на нитроцеллюлозных мембранах и вестерн-блоттинга разделяют растворимую и нерастворимую фракции. Частичную очистку белка проводят в ходе процесса, который включает (1) разделение растворимого и нерастворимого материала ультразвуковой обработкой с последующим центрифугированием, (2) промывание в низкомолярном растворе мочевины и солюбилизацию в высококонцентрированном растворе мочевины. Для очистки белка из солюбилизированного материала проводят аффинную хроматографию с применением атомов металла. Затем белок восстанавливают диализом против буфера. Примеры Пример 1. Получение химерного моноклонального антитела. кДНК VH и VK получают из РНК, экстрагированной из гибридомы, продуцирующей моноклональное антитело IOR С 5 с использованием обратной транскриптазы. Используют следующие специфические праймеры: АДН в цепях VH и VK амплифицируют с использованием полимеразной цепной реакции(ПЦР) с использованием Taq полимеразы и праймеров, специфичных для сайтов рестрикции EcoRV/NheI для VH и EcoRV/SalI для VK,соответственно. Специфические праймеры представляют собой:(набор для клонирования ТА, Invitrogen). Двенадцать независимых клонов секвенируют дидезокси-методом с использованием ДНК полимеразы Т 7 (Фармация (Pharmacia. Последовательности VH и VK характеризуются высоким сродством с подгруппой 2 Кабата (Kabat). Далее VH цепь расщепляют EcoRV/NheI иVH и VK, соответственно. Указанные векторы,которые используются для экспрессии иммуноглобулинов в клетках млекопитающих, были любезно предоставлены Шери Моррисон (SherieMorrison, UCLA, California, США). Вектор РАН 4604 включает константный участок человеческого IgG1, и PAG4622 несет человеческийCk (из группы новых векторов, применяемых для экспрессии молекул антител с использованием вариабельных участков, получаемых в результате полимеразной цепной реакции, М.Methods, 152, 1992, 89-104). Полученные после клонирования IOR С 5 участков конструкции представляют собой VHC5-PAH4604 и VKC5PAG4622. Клетки NSO подвергают электропорации с использованием 10 мкг химерного вектораC5VH-PAH4604 и 10 мкг C5VK-PAG4622 и затем линеаризуют расщеплением с использованием PvuI. Полученные ДНК смешивают друг с другом, осаждают этанолом и растворяют в 25 мкл воды. Выращивают до полуслияния примерно 107 клеток NSO, собирают их центрифугированием и ресуспендируют в 0,5 мл DMEN вместе с расщепленной ДНК в кювете для проведения электропорации. После 5-минутного выдерживания во льду клетки обрабатывают импульсным током (170 В и 960 мкФ) и оставляют во льду еще на 30 мин. Затем клетки помещают в 20 мл DMEN, содержащей 10% околоплодную сыворотку теленка, и оставляют для 9 восстановления на 48 ч. К этому времени клетки разносят на 96-луночном планшете и добавляют селективную среду (DMEN, 10% околоплодная сыворотка теленка, 10 мМ). Трансфицированные клоны становятся видимыми невооруженным глазом через 10 дней. Наличие химерного антитела в среде лунок, содержащей трансфицированные клоны,определяют методом ТИФА (ELISA). Микротитрационные ячейки покрывают козьим антителом, направленным против человека (специфичным к гамма-цепи). После промывания ФБСР(фосфатно-буферный солевой раствор, содержащий 0,02% Твина 20, рН 7,5) к каждой микротитрационной ячейке добавляют 20 мкл культуральной среды из ячеек, содержащих трансфектанты, на 1 ч инкубации при 37 С. Далее ячейки промывают ФБСР и добавляют конъюгированный с щелочной фосфатазой козий каппа фрагмент, направленный против человека, специфичный к легкой цепи, и инкубируют при комнатной температуре в течение 1 ч. Затем ячейки промывают ФБСР и добавляют субстратный буфер, содержащий диэтаноламин. Через 30 мин измеряют поглощение при длине волны 405 нм. Пример 2. Получение различных вариантов гуманизированного антитела.IOR С 5 последовательности VH и VK сравнивают с базами данных последовательностей человека для получения последовательностей человека с наивысшей степенью гомологии, к IOR C5. Затем в участках VH и VK определяют амфипатические участки или возможные Т клеточные эпитопы. В случае VH, мутации вводятся в положения 10 и 17 и аминокислоты Asp и Ser на Gly и Thr,соответственно, замещают. Указанные мутации получают путем ПЦР-перекрывания с использованием праймеров 1, 2, 3 и 4 в первой ПЦР и полученные в результате реакций продукты подвергают следующему перекрыванию во второй ПЦР с использованием праймеров 2 и 4, последовательности которых указаны ниже (Kamman, M.,Laufs, J., Schell, J., Gronemborg, В. Rapid insertional(PCR) Nucleic Acids Research 17: 5404, 1989). Праймеры для мутаций в положениях 10 и 17 тяжелой цепи После подтверждения секвенированием образования первой серии мутаций в такую мутированную ДНК вводят новые мутации в положения 43 и 44, где Lys и Gly заменяют на Asn и Lys, соответственно. Процедуру перекрывания проводят, как указано выше. Затем наличие му 005169 10 таций вновь подтверждают секвенированием, и образованная новая конструкция получает название C5VHhu. Праймеры, описанные для указанных мутаций, были следующими. Праймеры для мутаций в положениях 43 и 44 тяжелой цепи Праймер 1:Ser, соответственно. Мутации вводят при перекрывании в ходе ПЦР, как описано ранее. Показаны последовательности используемых праймеров. Новая генетическая конструкция была обозначена C5Vkhu. Праймеры для мутаций в положении 15 легкой цепи Праймеры для мутаций в положении 45 легкой цепи Праймеры для мутаций в положении 63 легкой цепи Все мутации подтверждаются секвенированием. Гуманизированные VK и VH клонируют в векторы PAG4622 и РАН 4604, получая в результате следующие конструкции: C5VkhuPAG4622 и C5VHhu-PAH4604. Клетки NSO подвергают электропорации с использованием 10 мкг гуманизированной C5VHhuPAH4604 и 10 мкг C5VKhu-PAG4622. Указанные векторы линеаризуют при расщеплении PvuI. Процедуры электропорации и выявления клонов, экспрессирующих гуманизированное антитело IOR C5h, идентичны тем, что были описаны выше для химерного антитела. 11 Пример 3. Конструирование одноцепочечного Fv фрагмента. Конструирование ScFv фрагмента (VНлинкер-VL) на основе вариабельных доменов(VH и VL) в Мав IORC5. Клонирование в вектор экспрессии для экспрессии в клетках E.coli. Процедура (а). Конструирование scFv. Стратегия включает первый цикл амплификации с помощью ПЦР, модификацию секвенированных участков VH и VL, включая сайты рестрикционных эндонуклеаз, для клонирования в векторы экспрессии pPACIB.7plus и pPACIB.9plus. В процессе амплификации используют олигонуклеотиды с конкретной последовательностью. После амплификации участки очищают и расщепляют VH (EcoRV) и VL (SalI-ApaI). Фрагменты ДНК очищают и лигируют в векторы pPACIB.9plus и pPACIB.7plus, предварительно расщепленные рестриктазами. Плазмиду pPACIB.7plus модифицируют для переноса в периплазму гетерологичных белков, гены которых экспрессируются в E.coli. Указанная плазмида содержит регуляторные последовательности для выполнения следующих функций: промоторную последовательность (триптофан), последовательность для сигнального пептида (ОМРА), последовательность для линкерного пептида (Chaudhary et al., 1990) и домен, состоящий из 6 гистидинов, модифицированный в С-концах зрелых белков, для облегчения очистки указанного белка (Gavilondo,J.V. et al. Proceedings of the IV Annual ConferenceCoranado, CA. December 8-10, 1993). Плазмиду pPACIB9.plus (фиг. 1) модифицируют для экспрессии в цитоплазме гетерологичных белков, гены которых экспрессируются в E.coli. Указанная плазмида содержит регуляторные последовательности для выполнения следующих функций: промоторную последовательность(триптофан), 27 аа фрагмент, полученный из IL-2h,для достижения эффективной экспрессии белка и домен, состоящий из 6 гистидинов, модифицированный в С-концах зрелых белков, для облегчения последующей очистки указанного белкаConference on Antibody Engineering. IBC Conferences Inc. Coranado, CA. December 8-10, 1993). Продукт ПЦР используют для трансформации компетентных клеток E.coli (штамм МС 1061),которые помещают в твердую селективную сре 005169 12 ду и выращивают при 37 С. Для отбора рекомбинантных векторов бактериальные колонии инокулируют в жидкую среду и экстрагируют плазмидную ДНК из культуры (Molecular Cloning,A Laboratory Manual, second edition, 1989, Sambrook,Fritsch and Maniatis). Плазмидную ДНК расщепляют EcoRV, SalI/ApaI, XhoI/ApaI в соответствии со стадией клонирования, разгоняют в агарозном геле и визуализируют в УФ свете, выбирая рекомбинантные клоны из клонов с двухполосным профилем расщепления, один из которых соответствует pPACIB.7 и 9plus (примерно 2,9 кбайт) и второй - ожидаемому домену (примерно 320 нп VH или VL и 720 нп для scFv). В случае VH домена вставку подтверждают секвенированием ДНК. Процедура (б). Экспрессия scFv в E.coli,достигаемая в случае генов вариабельных доменов Мав IOR С 5. Трансформируют четыре штамма E.coli(TG1, coliB, W3110 и ММ 294) для изучения экспрессии клонированных генов с использованием двух рекомбинантных плазмид, выбранных в соответствии с п. (а). В основном, рекомбинантные бактерии выращивают в жидкой среде (LB) с ампициллином в течение ночи при 37 С. Из указанных культур инокулируют свежие культуры, содержащие ампициллин, и инкубируют в течение 3 ч при 37 С. Затем индуцируют экспрессию добавлением к культуре бетаиндолакриловой кислоты (индуктор триптофанового промотора). Анализ образцов в 12% ДСНполиакриламидных гелях показывет, что в описываемых условиях в периплазматической фракции экспрессируется белок размером примерно 28 кДа, относящийся к конструкции PACIB.7plus,и полоса, соответствующая белку размером 30 кДа, который относится к рекомбинантному клону в pPACIB.9plus, экспрессируемому в TG1 на уровне 6-11% от общего количества бактериального белка. Методом вестерн-блот-анализаedition, 1989, by Sambrook, Fritsch and Maniatis) с использованием антисыворотки кролика противFab фрагмента IOR C5 после очистки его иммуноферментной техникой было показано, что указанный белок представляет собой scFv IORC5. Пример 4. Получение scFv из бактериальных культур, восстановление и определение способности распознавать антиген. Процедура (а). Экстракция и восстановление scFv от IOR C5 из рекомбинантного клона вpPACIB.9plus. В процессе экстракции белка из клетокпродуцентов с использованием разрушения клеток ультразвуком достигается разделение растворимой и нерастворимой фракции, и далее при комбинировании методов гель-электрофореза в ДСН-полиакриламиде, переноса на нитроцеллюлозных мембранах и вестерн-блоттинга 13 было доказано, что указанный белок остается в нерастворимой фракции бактериальных клеток. В описываемых условиях белок подвергают частичной очистке в ходе процесса, включающего следующие стадии:(1) разделение растворимого и нерастворимого материала ультразвуковой обработкой с последующим центрифугированием,(2) промывание в низкомолярном растворе мочевины (2 М) и(3) солюбилизация в высокомолярном растворе мочевины (6 М). Из солюбилизированного материала белок очищают аффинной хроматографией с ионами металла и затем восстанавливают диализом против буферного раствора. Процедура (б). Тест на связывание опухолевых клеток с scFv-IORC5 фрагментом. Используемые для исследования клетки получают из Центра молекулярной иммунологии (Centro de Immunologia Molecular). Клеточную линию аденокарциномы SW948 выращивают в среде L-15, дополнительно содержащей 10% околоплодную сыворотку теленка, при 37 С c 6% содержанием СО 2. В качестве отрицательных контролей используют клеточную линию Раджи (Raji) (лимфома Буркитта человека) и Hut 78 (Т-клеточная линия человека). Указанные клеточные линии растят в средеRPMI 1629, дополнительно содержащей 10% околоплодную сыворотку теленка, при 37 С. Клеточные суспензии фиксируют в концентрации 106 клеток/мл в ФБР, содержащем 1% бычьего сывороточного альбумина. К каждой ячейке добавляют 10 мкл клеточной суспензии. Препараты высушивают на воздухе, не содержащем пыли, в течение 3 ч и фиксируют в растворе ацетон-метанол (1:1) в течение 5 мин,после чего в течение 10 мин проводят гидратацию в TBS. В конце процедуры проводят иммуноцитохимический анализ клеток. Активность scFv IORC5 фрагмента определяют в рамках иммуноцитохимического анализа с использованием иммунопероксидного метода. Клетки инкубируют в течение 2 ч при 37 С с одноцепочечным Fv IORC5 и затем инкубируют с антисывороткой против Fab и с противомышиной конъюгированной пероксидазой(HRPO), каждый раз по 30 мин при комнатной температуре. Сайт локализации пероксидазы визуализируют с помощью раствора, содержащего 5 мг 3-3-диаминобенцидина, 5 мл TBS и 5 мкл 30% H2O2. В перерывах между инкубациями препараты промывают холодным TBS. После внесения в воду препараты окрашивают контрастным красителем гематоксилином Майера (Hematoxilline of Mayer) и добавляют канадский бальзам. Каждый эксперимент включает положительный и отрицательный контроль. Иммуноцитохимические исследования показывают, что рассматриваемый фрагмент является позитивным лишь по отношению к клеточ 005169 14 ной линии SW948, что демонстрирует умеренный характер мечения в сравнении с полным Мав, указывая на специфическую картину распознавания scFv IOR С 5 указанной клеточной линии. Метка связывается с мембранным и цитоплазматическим компартментом в злокачественных клетках ободочной кишки. Краткое описание рисунков На фигуре показано генетическое конструирование плазмиды pPACIB.9plus, которая представляет собой плазмиду, модифицированную для экспрессии химерных белков в цитоплазмеE.coli. Указанная плазмида содержит регуляторные последовательности для выполнения следующих функций: промоторная последовательность (триптофан), 27 аа фрагмент, полученный из IL-2h для достижения эффективной экспрессии белка, и домен, состоящий из 6 гистидинов,модифицированный в С-концах зрелых белков,для облегчения очистки указанного белка. Список последовательностей Матео де Акоста дель Рио, Мария Кристина(Заявитель только для Соединенных Штатов Америки) Року Наварро, Лурдес Татьяна(Заявитель только для Соединенных Штатов Америки) Моралес Моралес, Алехо(Заявитель только для Соединенных Штатов Америки) Перес Родригес, Роландо(Заявитель только для Соединенных Штатов Америки) Айяла Авила, Марта(Заявитель только для Соединенных Штатов Америки) Гавилондо Каули, Джордже Виктор(Заявитель только для Соединенных Штатов Америки) Дуенас Порто, Марта(Заявитель только для Соединенных Штатов Америки) Белл Гарсия, Ханссел(Заявитель только для Соединенных Штатов Америки) Ренгифо Кальсадо, Энрике(Заявитель только для Соединенных Штатов Америки) Изнага Эскобар, Нормандо(Заявитель только для Соединенных Штатов Америки) Рамос Сусарте, Майра(Заявитель только для Соединенных Штатов Америки) 18 что последовательности участков, определяющих комплементарность связывания с антигеном (CDR), легкой и тяжелой цепей представляют собой 2. Рекомбинантное антитело по п.1, отличающееся тем, что содержит участки CDR и каркасные области (FR) антитела IOR C5 и константные области легкой и тяжелой цепей антитела человека, при том, что аминокислотные последовательности указанных каркасных областей тяжелой и легкой цепей представляют собой 3. Рекомбинантное антитело по п.1, отличающееся тем, что дополнительно содержит точечные мутации в каркасных областях тяжелой и легкой цепей для снижения его иммуногенности. 4. Рекомбинантное антитело по п.3, отличающееся тем, что содержит в каркасных областях тяжелой и легкой цепей любую из следующих точечных мутаций: ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантное антитело, взаимодействующее с антигенным комплексом ior C2, полученное из мышиного моноклонального антителаIOR C5, продуцируемое гибридомой, депонированной под номером ЕССС 97061101, при том, 5. Линия клеток, экспрессирующих рекомбинантное антитело по любому из пп.1-4. 6. Фармацевтическая композиция для лечения злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов,включающая рекомбинантное антитело по любому из пп.1-4 и приемлемый носитель. 7. Диагностическая композиция для локализации и идентификации in vivo злокачествен 19 ных опухолей прямой и ободочной кишки, их метастазов и рецидивов, включающая рекомбинантное антитело по любому из пп.1-4. 8. Диагностическая композиция по п.7, дополнительно включающая соединения для радиоактивного мечения антитела, выбранные из группы, состоящей из технеция 99, рения 186 и рения 188. 9. Диагностический способ идентификацииin vivo злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов,включающий введение пациенту физиологически приемлемой композиции, которая содержит антитело по любому из пп.1-4, предварительно меченную Тс-99 или любым другим радиоактивным аналогом, и мониторинг биораспределения указанной композиции иммуногаммаграфическими методами. 10. Одноцепочечный фрагмент Fv рекомбинантного антитела, полученный из мышиного моноклонального антитела IOR С 5, продуцируемое гибридомой, депонированной под номером ЕССС 97061101, при том, что последовательности CDR и каркасных областей (FR) указанного фрагмента представляют собой 12. Линия клеток, экспрессирующих одноцепочечный Fv фрагмент по п.10 или 11. 13. Фармацевтическая композиция для лечения злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов,включающая одноцепочечный Fv фрагмент по п.10 или 11 и приемлемый носитель. 14. Диагностическая композиция для локализации и идентификации in vivo злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов, включающая одноцепочечный Fv фрагмент по п.10 или 11. 15. Диагностическая композиция по п.14,дополнительно включающая соединения для радиоактивного мечения антитела, выбранные из группы, состоящей из технеция 99, рения 186 и рения 188. 16. Диагностический способ идентификации in vivo злокачественных опухолей прямой и ободочной кишки, их метастазов и рецидивов,включающий введение пациенту физиологически приемлемой композиции, которая содержит одноцепочечный Fv фрагмент по п.10 или 11,предварительно меченную Тс-99 или любым другим радиоактивным аналогом, и мониторинг биораспределения указанной композиции иммуногаммаграфическими методами. 11. Одноцепочечный фрагмент Fv по п.10,отличающийся тем, что содержит в каркасных областях тяжелой и легкой цепей любую из следующих точечных мутаций для снижения иммуногенности:
МПК / Метки
МПК: G01N 33/574, C07K 16/00, A61K 39/395, A61P 35/00
Метки: антитела, фрагмент, антитело, указанного, антигенным, рекомбинантное, комплексом, применения, способ, взаимодействующее
Код ссылки
<a href="https://eas.patents.su/11-5169-rekombinantnoe-antitelo-vzaimodejjstvuyushhee-s-antigennym-kompleksom-ior-c2-fv-fragment-ukazannogo-antitela-i-sposob-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантное антитело, взаимодействующее с антигенным комплексом ior c2, fv- фрагмент указанного антитела и способ их применения</a>
Предыдущий патент: Способ индуцирования у растительной клетки или растения устойчивости к вирусу, растение и растительная клетка, обладающие такой устойчивостью
Следующий патент: Узел датчика давления в технологической линии производственной установки
Случайный патент: Постметаллоценовые комплексы на основе бис-(нафтокси)пиридиновых и бис-(нафтокси)тиофеновых лигандов для полимеризации этилена и альфа-олефинов












