Композиции на основе пирроло [2,3d] пиримидинов и их применение
Номер патента: 3604
Опубликовано: 26.06.2003
Авторы: Уиттер Дэвид Дж., Маккиббен Брайан, Кастелано Арлиндо Л.
Формула / Реферат
1. Соединение, имеющее формулу I
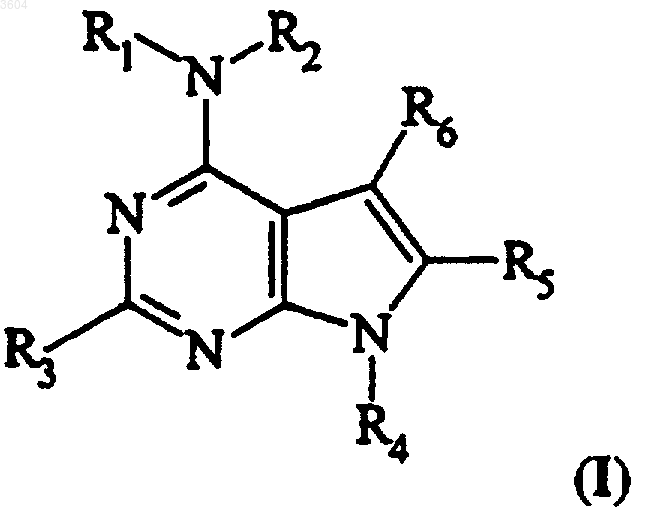
где каждый из R1 и R2 независимо представляет собой атом водорода, замещенный прямой (C1-C30)алкил, замещенный разветвленный (C3-C30)алкил, замещенный (C4-C10)циклоалкил, замещенный циклопропил или замещенный или незамещенный арил;
где только один из R1 и R2 может быть водородом;
где, когда алкил представляет собой (C1)алкил или (C2)алкил, тогда любой заместитель фенила, если он имеется, замещен; или
R1 и R2 вместе образуют замещенное или незамещенное 4-10-членное гетероциклическое кольцо;
R3 представляет собой замещенный или незамещенный арил;
R4 представляет собой атом водорода, незамещенный прямой (C1-C30)алкил, незамещенный разветвленный (C3-C30)алкил или замещенный или незамещенный арил; и
каждый из R5 и R6 независимо представляет собой атом галогена, атом водорода или замещенный или незамещенный прямой (C1-C30)алкил, разветвленный (C1-C30)алкил или арил;
где любой заместитель, если он имеется, представляет собой галоген, гидроксил, прямой (C1-C30)алкилкарбонилокси, разветвленный (C3-C30)алкилкарбонилокси, арилкарбонилокси, прямой (C1-C30)алкоксикарбонилокси, разветвленный (C3-C30)алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, прямой (C1-C30)алкилкарбонил, разветвленный (C3-C30)алкилкарбонил, прямой (C1-C30)алкоксикарбонил, разветвленный (C3-C30)алкоксикарбонил, аминокарбонил, прямой (C1-C30)алкилтиокарбонил, разветвленный (C3-C30)алкилтиокарбонил, прямой (C1-C30)алкоксил, разветвленный (C3-C30)алкоксил, фосфат, фосфонато, циано, амино, прямой (C1-C30)алкиламино, разветвленный (C3-C30)алкиламино, прямой (C1-C30)диалкиламино, разветвленный (C3-C30)диалкиламино, ариламино, диариламино, прямой (C1-C30)алкилариламино, разветвленный (C3-C30)алкилариламино, ациламино, прямой (C1-C30)алкилкарбониламино, разветвленный (C3-C30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, сульфгидрил, прямой (C1-C30)алкилтио, разветвленный (C3-C30)алкилтио, арилтио, тиокарбоксилат, сульфаты, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, 4-10-членный гетероциклил, прямой (C1-C30)алкиларил, разветвленный (C3-C30)алкиларил или ароматическую или 5-6-членную гетероароматическую группу, где заместитель, в свою очередь, может быть замещен любым из вышеуказанных заместителей,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой водород, R2 представляет собой замещенный (C4-C10)циклоалкил, замещенный прямой (C1-C30)алкил, замещенный разветвленный (C3-C30)алкил или R1 и R2 вместе образуют замещенное или незамещенное 4-10-членное гетероциклическое кольцо, R3 представляет собой незамещенный или замещенный арил, R4 представляет собой водород и каждый из R5 и R6 независимо представляет собой водород или прямой (C1-C30)алкил, разветвленный (C3-C30)алкил, или его фармацевтически приемлемая соль.
3. Соединение по п.2, где R2 представляет собой замещенный (C4-C10)циклоалкил.
4. Соединение по п.3, где R1 и R4 представляют собой водород; R3 представляет собой незамещенный или замещенный фенил и каждый из R5 и R6 представляет собой прямой (C1-C30)алкил или разветвленный (C3-C30)алкил.
5. Соединение по п.4, где R2 представляет собой моногидроксициклопентил.
6. Соединение по п.4, где R2 представляет собой моногидроксициклогексил.
7. Соединение по п.2, где R1 и R2 вместе образуют замещенное или незамещенное 4-10-членное гетероциклическое кольцо.
8. Соединение по п.7, где указанное гетероциклическое кольцо замещено амином или ацетамидом.
9. Соединение по п. 2, где R2 представляет собой -A-NHC(=O)B, где A представляет собой незамещенный (C1-C4)алкил и B представляет собой замещенный или незамещенный (C1-C4)алкил.
10. Соединение по п.9, где R1 и R4 представляют собой водород, R3 представляет собой незамещенный или замещенный фенил и каждый из R5 и R6 представляет собой прямой (C1-C30)алкил или разветвленный (C3-C30)алкил.
11. Соединение по п.2, где R3 представляет собой замещенный или незамещенный фенил.
12. Соединение по п.11, где каждый из R5 и R6 представляет собой прямой (C1-C30)алкил или разветвленный (C3-C30)алкил.
13. Соединение по п.12, где R3 представляет собой незамещенный фенил.
14. Соединение по п.12, где R3 представляет собой замещенный фенил.
15. Соединение по п.14, где R3 представляет собой фенил, замещенный, по крайней мере, одним заместителем.
16. Соединение по п.1, где R3 представляет собой замещенный или незамещенный арил, где арил является гетероарильной группой.
17. Соединение по п.16, где каждый из R5 и R6 представляет собой прямой (C1-C30)алкил или разветвленный (C3-C30)алкил.
18. Соединение по п.2, где каждый из R5 и R6 представляет собой водород.
19. Соединение по п.2, где каждый из R5 и R6 представляет собой метил.
20. Соединение по п.2, где соединение выбрано из группы, включающей
4-(цис-3-гидроксициклопентил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
соль трифторуксусной кислоты 4-(цис-3-(2-аминоацетокси)циклопентил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(2-N'-метилуреидопропил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетамидобутил)амино-5,6-диметил-2-фенил-7H-пирроло-[2,3d]пиримидин,
4-(2-N'-метилуреидобутил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин и
4-(2-аминоциклопропилацетамидоэтил)амино-2-фенил-7H-пирроло[2,3d]пиримидин.
21. Соединение, представленное формулой II
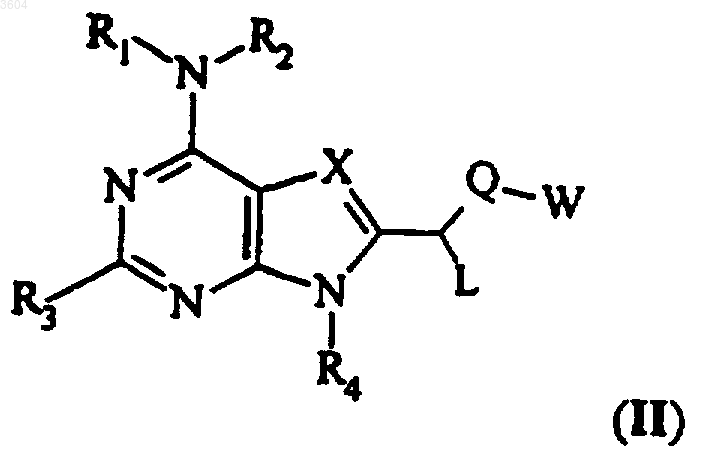
где X представляет собой N или CR6,
каждый из R1 и R2 независимо представляет собой водород, замещенный или незамещенный прямой (C1-C30)алкокси, разветвленный (C3-C30)алкокси, амино (прямой (C1-C30)алкил), амино (разветвленный (C3-C30)алкил), прямой (C1-C30)алкил, разветвленный (C3-C30)алкил или арил;
где только один из R1 и R2 может быть водородом,
R1 и R2 вместе образуют замещенное или незамещенное 4-10-членное гетероциклическое кольцо;
R3 представляет собой замещенный или незамещенный арил или гетероарил;
R4 представляет собой водород;
L представляет собой водород, замещенный или незамещенный пряьющ (C1-C30)алкил или разветвленный (C3-C30)алкил;
R6 представляет собой водород, замещенный или незамещенный прямой (C1-C30)алкил, разветвленный (C3-C30)алкил или галоген;
Q представляет собой CH2, O, S или NR7, где R7 представляет собой водород или замещенный или незамещенный (C1-C6)алкил и
W представляет собой незамещенный или замещенный прямой (C1-C30)алкил, разветвленный (C3-C30)алкил, (C4-C10)циклоалкил, прямой (C2-C30)алкинил, разветвленный (C3-C30)алкинил, арил, биарил, гетероарил, замещенный карбонил, замещенный тиокарбонил или замещенный сульфонил;
где любой заместитель, если он имеется, представляет собой галоген, гидроксил, прямой (C1-C30)алкилкарбонилокси, разветвленный (C3-C30)алкилкарбонилокси, арилкарбонилокси, прямой (C1-C30)алкоксикарбонилокси, разветвленный (C3-C30)алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, прямой (C1-C30)алкилкарбонил, разветвленный (C3-C30)алкилкарбонил, прямой (C1-C30)алкоксикарбонил, разветвленный (C3-C30)алкоксикарбонил, аминокарбонил, прямой (C1-C30)алкилтиокарбонил, разветвленный (C3-C30)алкилтиокарбонил, прямой (C1-C30)алкоксил, разветвленный (C3-C30)алкоксил, фосфат, фосфонато, циано, амино, прямой (C1-C30)алкиламино, разветвленный (C3-C30)алкиламино, прямой (C1-C30)диалкиламино, разветвленный (C3-C30)диалкиламино, ариламино, диариламино, прямой (C1-C30)алкилариламино, разветвленный (C3-C30)алкилариламино, ациламино, прямой (C1-C30)алкилкарбониламино, разветвленный (C3-C30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, сульфгидрил, прямой (C1-C30)алкилтио, разветвленный (C3-C30)алкилтио, арилтио, тиокарбоксилат, сульфаты, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, 4-10-членный гетероциклил, прямой (C1-C30)алкиларил, разветвленный (C3-C30)алкиларил или ароматическую или 5-6-членную гетероароматическую группу, где заместитель, в свою очередь, может быть замещен любым из вышеуказанных заместителей.
22. Соединение по п.21, где Q представляет собой CH2, O, S или NH.
23. Соединение по п.22, где R4 представляет собой водород, L представляет собой водород или метил и R3 представляет собой незамещенный или замещенный арил.
24. Соединение по п.23, где W представляет собой замещенный или незамещенный прямой (C1-C30)алкил, разветвленный (C3-C30)алкил, (C4-C10)циклоалкил, прямой (C2-C30)алкинил или разветвленный (C3-C30)алкинил.
25. Соединение по п.24, где W представляет собой прямой (C2-C30)алкинил или разветвленный (C3-C30)алкинил.
26. Соединение по п.25, где W замещен одним или несколькими заместителями, выбранными из группы, включающей галоген, гидрокси, замещенный или незамещенный прямой (C1-C30)алкил, разветвленный (C3-C30)алкил, (C4-C10)циклоалкил, арил или NHR10, где R10 представляет собой водород, замещенный или незамещенный прямой (C1-C30)алкил, разветвленный (C3-C30)алкил, (C4-C10)циклоалкил или арил.
27. Соединение по п.24, где W представляет собой замещенный или незамещенный циклопентил.
28. Соединение по п.23, где W представляет собой -(CH2)a-C(=O)Y или -(CH2)a-C(=S)Y, где a равно 0, 1, 2 или 3, Y представляет собой арил, прямой (C1-C30)алкил, разветвленный (C3-C30)алкил, (C4-C10)циклоалкил, гетероарил, NHR11R12, или, при условии что Q представляет собой NH, OR13, и где каждый из R11, R12 и R13 независимо представляет собой водород или незамещенный или замещенный прямой (C1-C30)алкил, разветвленный (C3-C30)алкил, арил или (C4-C10)циклоалкил.
29. Соединение по п.22, где R3 выбран из группы, включающей замещенный и незамещенный фенил, пиридил, пиримидил, пиридазинил, пиразинил, пирролил, триазолил, тиазолил, оксазолил, оксадиазолил, пиразолил, фуранил, метилендиоксифенил и тиофенил.
30. Соединение по п.29, где R3 представляет собой незамещенный фенил.
31. Соединение по п.29, где R3 представляет собой фенил, замещенный, по крайней мере, одним заместителем.
32. Соединение по п.1 или 22, где R1 и R2 вместе представляют собой
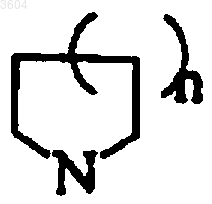
где n равно 1 или 2, и где кольцо может быть необязательно замещено одной или несколькими группами гидроксила, амино, аминокарбонила, тиола, карбоксила, галогена, CH2OH, CH2NHC(=O)-(C1-C30)прямого алкила, CH2NHC(=O)-(C3-C30) разветвленного алкила или CH2NHC(=O)NH-(C1-C30) прямого алкила или CH2NHC(=O)NH-(C3-C30) разветвленного алкила.
33. Соединение по п.32, где n равно 1 или 2 и указанное кольцо замещено -NHC(=O)-(C1-C30) прямым алкилом или CH2NHC(=O)-(C3-C30) разветвленным алкилом.
34. Соединение по п.22, где R1 представляет собой водород, R2 представляет собой замещенный или незамещенный C1-C6алкил, R3 представляет собой замещенный или незамещенный фенил, R4 представляет собой водород, L представляет собой водород или замещенный или незамещенный (C1-C6)алкил, Q представляет собой O, S или NR7, где R7 представляет собой водород или замещенный или незамещенный (C1-C6)алкил, и W представляет собой замещенный или незамещенный арил.
35. Соединение по п.34, где указанное соединение выбрано из группы, включающей
4-(2-ацетиламиноэтил)амино-6-феноксиметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(4-фторфенокси)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(4-хлорфенокси)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(4-метоксифенокси)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(2-пиридилокси)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(N-фениламино)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(N-метил-N-фениламино)метил-2-фенил-7H-пирроло[2,3d]пиримидин и
4-(2-N'-метилуреидоэтил)амино-6-феноксиметил-2-фенил-7H-пирроло[2,3d]пиримидин.
36. Применение соединения по любому из пп.1, 2, 4, 10, 21 или 22 для ингибирования активности аденозинового рецептора в клетках.
37. Применение по п.36, где соединение выбрано из группы, включающей
4-(2-ацетиламиноэтил)амино-6-феноксиметил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(2-ацетиламиноэтил)амино-6-(4-фторфенокси)метил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(2-ацетиламиноэтил)амино-6-(4-хлорфенокси)метил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(2-ацетиламиноэтил)амино-6-(4-метоксифенокси)метил-2-фенил-7H-пирролю[2,3d]пиримидина,
4-(2-ацетиламиноэтил)амино-6-(2-пиридилокси)метил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(2-ацетиламиноэтил)амино-6-(N-фениламино)метил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(2-ацетиламиноэтил)амино-6-(N-метил-N-фениламино)метил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(2-N'-метилуреидоэтил)амино-6-феноксиметил-2-фенил-7H-пирроло[2,3d]пиримидина.
38. Применение по п.36, где соединение выбрано из группы, включающей
4-(цис-3-гидроксициклопентил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
соль трифторуксусной кислоты 4-(цис-3-(2-аминоацетокси)циклопентил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(3-ацетамидо)пиперидинил-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-N'-метилуреидопропил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетамидобутил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-N'-метилуреидобутил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-аминоциклопропилацетамидоэтил)амино-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(транс-4-гидроксициклогексил)амино-2-(3-хлорфенил)-7H-пирроло[2,3d]пиримидин,
4-(транс-4-гидроксициклогексил)амино-2-(3-фторфенил)-7H-пирроло[2,3d]пиримидин и
4-(транс-4-гидроксициклогексил)амино-2-(4-пиридил)-7H-пирроло[2,3d]пиримидин.
39. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по пп.1, 2, 4, 10, 21 или 22 и фармацевтически приемлемый носитель.
40. Фармацевтическая композиция по п.39, где указанное соединение выбрано из группы, включающей
4-(2-ацетиламиноэтил)амино-6-феноксиметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(4-фторфенокси)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(4-хлорфенокси)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(4-метоксифенокси)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(2-пиридилокси)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(N-фениламино)метил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетиламиноэтил)амино-6-(N-метил-N-фениламино)метил-2-фенил-7H-пирроло[2,3d]пиримидин и
4-(2-N'-метилуреидоэтил)амино-6-феноксиметил-2-фенил-7H-пирроло[2,3d]пиримидин.
41. Фармацевтическая композиция по п.39, где соединение выбрано из группы, включающей
4-(цис-3-гидроксициклопентил)амино-5,6-диметил-2-фенил -7H-пирроло[2,3d]пиримидина,
соль трифторуксусной кислоты 4-(цис-3-(2-аминоацетокси)циклопентил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидина,
4-(3-ацетамидо)пиперидинил-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-N'-метилуреидопропил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-ацетамидобутил)амино-5,6-диметил-2-фенил-7H-пирроло-[2,3d]пиримидин,
4-(2-N'-метилуреидобутил)амино-5,6-диметил-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(2-аминоциклопропилацетамидоэтил)амино-2-фенил-7H-пирроло[2,3d]пиримидин,
4-(транс-4-гидроксициклогексил)амино-2-(3-хлорфенил)-7H-пирроло[2,3d]пиримидин,
4-(транс-4-гидроксициклогексил)амино-2-(3-фторфенил)-7H-пирроло[2,3d]пиримидин и
4-(транс-4-гидроксициклогексил)амино-2-(4-пиридил)-7H-пирроло[2,3d]пиримидин.
42. Фармацевтическая композиция по п.39, где указанное терапевтически эффективное количество является эффективным для лечения респираторного заболевания или желудочно-кишечного заболевания.
43. Фармацевтическая композиция по п.41, где указанным желудочно-кишечным заболеванием является диарея.
44. Фармацевтическая композиция по п.42, где указанным респираторным заболеванием является астма, аллергический ринит или хроническая обструктивная болезнь легких.
45. Фармацевтический препарат по п.39, где указанным фармацевтическим препаратом является офтальмологический препарат.
46. Фармацевтический препарат по п.45, где указанным фармацевтическим препаратом является препарат для инъекции в окологлазную, ретробульбарную или внутриглазную область.
47. Фармацевтический препарат по п.45, где указанным фармацевтическим препаратом является препарат для системного введения.
48. Фармацевтический препарат по п.45, где указанным фармацевтическим препаратом является хирургический раствор для промывания.
49. Применение соединения по пп.1, 2, 21 или 22 для получения лекарственного средства, используемого для лечения заболевания или состояния, связанного с повышенными уровнями аденозина у субъекта, где заболеванием или состоянием является нарушение центральной нервной системы, заболевание почек, воспалительное заболевание, аллергия, желудочно-кишечное заболевание, глазная болезнь или заболевание дыхательных путей.
50. Упакованная фармацевтическая композиция для лечения заболевания или нарушения, опосредованного аденозином, у млекопитающего, включающая контейнер, содержащий терапевтически эффективное количество, по крайней мере, одного соединения по пп.1, 2, 4, 10, 21 или 22 и инструкции по применению соединения для лечения опосредованного аденозином заболевания состояния у млекопитающего.
51. Способ получения
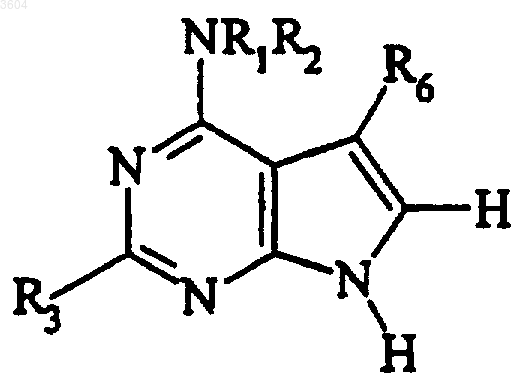
включающий следующие стадии:
a) взаимодействия
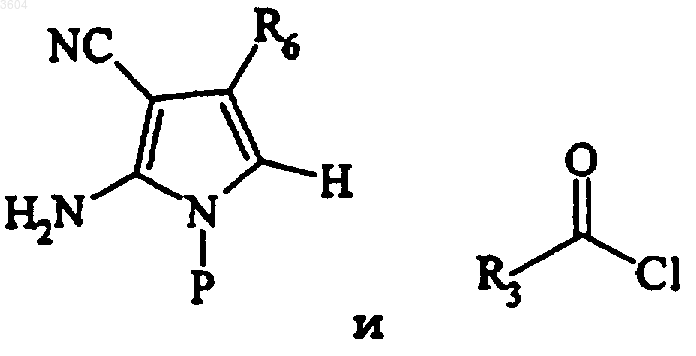
с получением
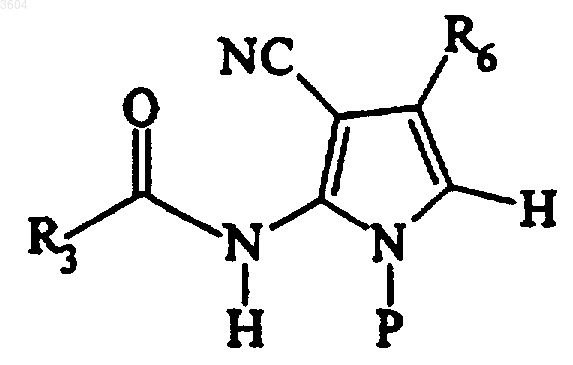
где P представляет собой удаляемую защитную группу;
b) обработки продукта стадии a) в условиях циклизации с получением
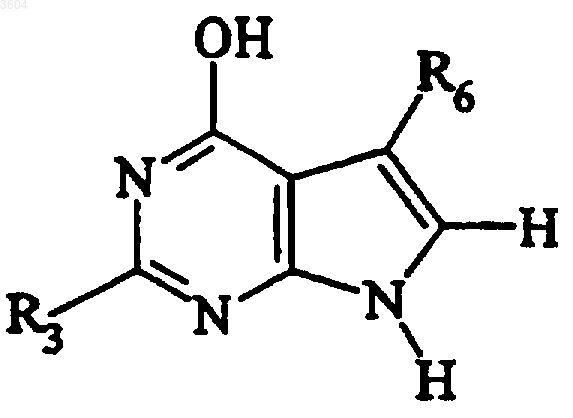
c) обработки продукта стадии b) в подходящих условиях с получением
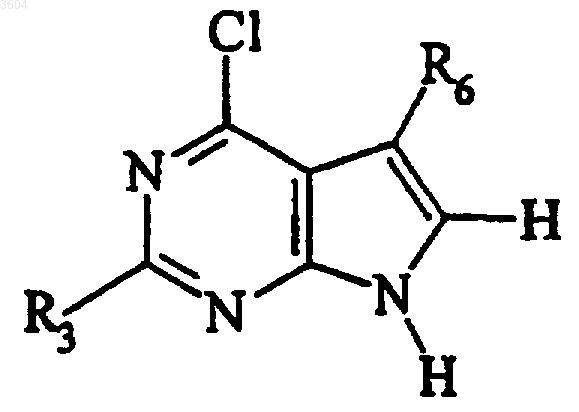
и d) обработки хлорированного продукта стадии c) амином с получением

где каждый из R1 и R2 независимо представляет собой атом водорода или замещенный прямой (C1-C30)алкил или разветвленный (C3-C30)алкил, замещенный (C4-C10)циклоалкил, замещенный циклопропил или замещенный или незамещенный арил;
где только один из R1 и R2 может быть водородом;
где, когда алкил представляет собой (C1)алкил или (C2)алкил, тогда любой заместитель фенила, если он имеется, в свою очередь замещен; или
R1 и R2 вместе образуют замещенное или незамещенное 4-10-членное гетероциклическое кольцо;
R3 представляет собой замещенный или незамещенный арил, прямой (C1-C30)алкиларил или разветвленный (C3-C30)алкиларил; и
R6 представляет собой атом галогена, атом водорода или замещенный или незамещенный прямой (C1-C30)алкил или разветвленный (C1-C30)алкил или арил;
где любой заместитель, если он имеется, представляет собой галоген, гидроксил, прямой (C1-C30)алкилкарбонилокси, разветвленный (C3-C30)алкилкарбонилокси, арилкарбонилокси, прямой (C1-C30)алкоксикарбонилокси, разветвленный (C3-C30)алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, прямой (C1-C30)алкилкарбонил, разветвленный (C3-C30)алкилкарбонил, прямой (C1-C30)алкоксикарбонил, разветвленный (C3-C30)алкоксикарбонил, аминокарбонил, прямой (C1-C30)алкилтиокарбонил, разветвленный (C3-C30)алкилтиокарбонил, прямой (C1-C30)алкоксил, разветвленный (C3-C30)алкоксил, фосфат, фосфонато, циано, амино, прямой (C1-C30)алкиламино, разветвленный (C3-C30)алкиламино, прямой (C1-C30)диалкиламино, разветвленэыщ (C3-C30)диалкиламино, ариламино, диариламино, прямой (C1-C30)алкилариламино, разветвленный (C3-C30)алкилариламино, ациламино, прямой (C1-C30)алкилкарбониламино, разветвленный (C3-C30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, сульфгидрил, прямой (C1-C30)алкилтио, разветвленный (C3-C30)алкилтио, арилтио, тиокарбоксилат, сульфаты, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, 4-10-членный гетероциклил, прямой (C1-C30)алкиларил, разветвленный (C3-C30)алкиларил или ароматическую или 5-6-членную гетероароматическую группу, где заместитель, в свою очередь, может быть замещен любым из вышеуказанных заместителей.
52. Соединение по п.6, имеющее структуру
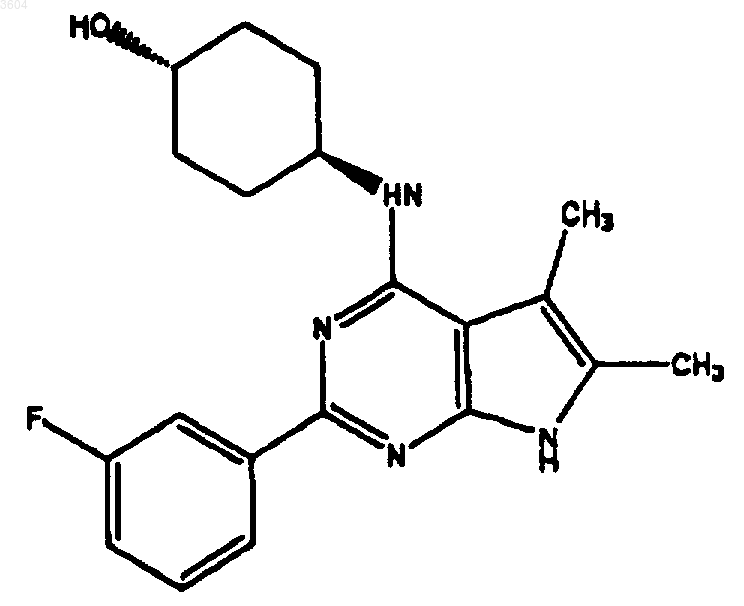
53. Соединение по п.6, имеющее структуру
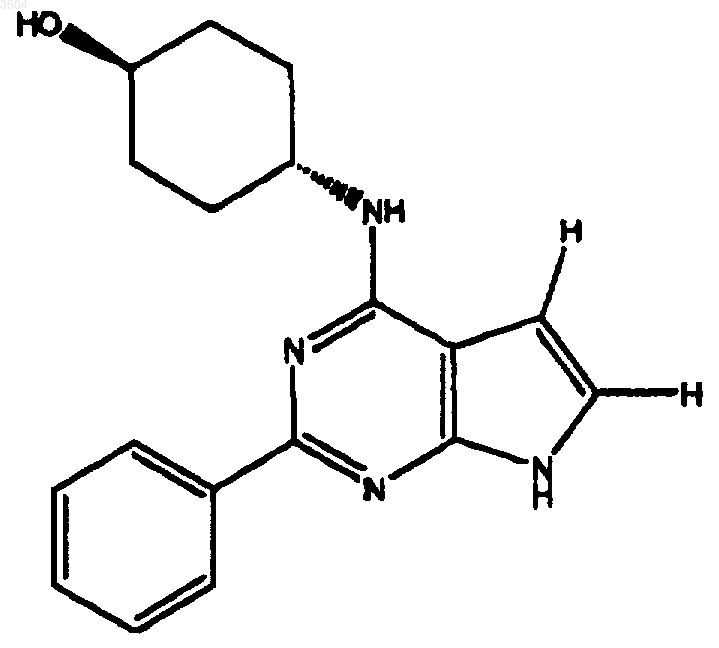
54. Соединение по п.6, имеющее структуру
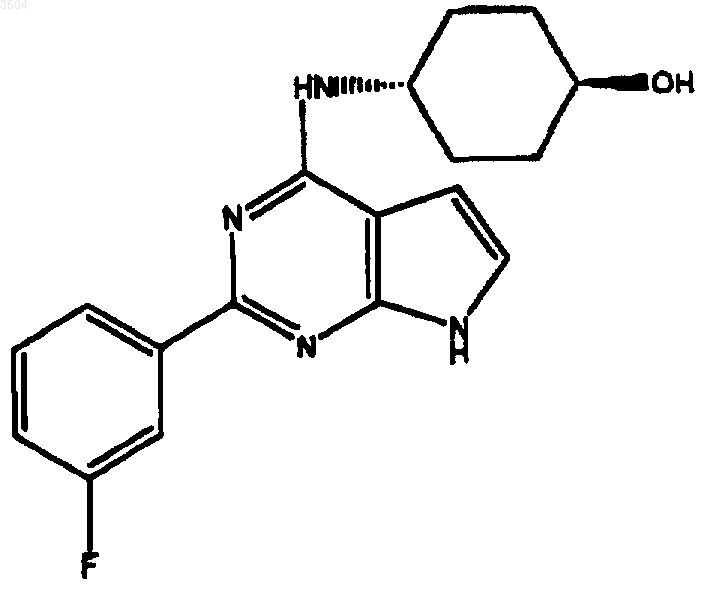
55. Соединение по п.6, имеющее структуру
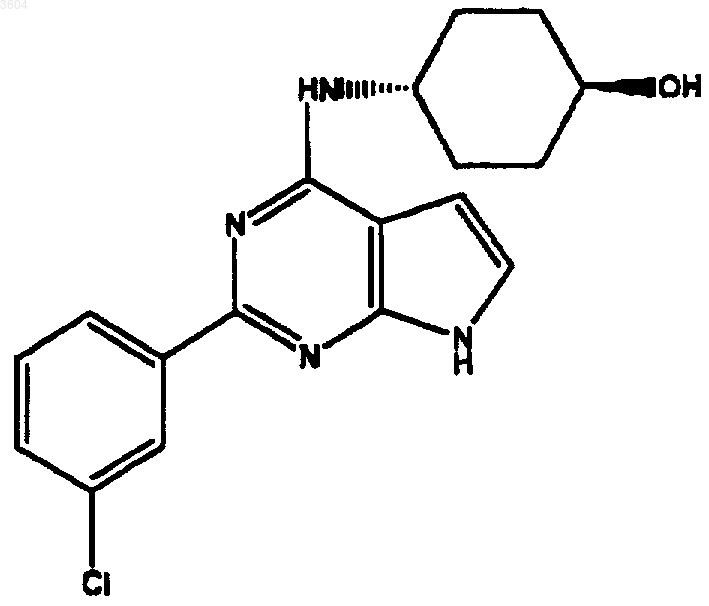
56. Соединение по п.2, имеющее структуру
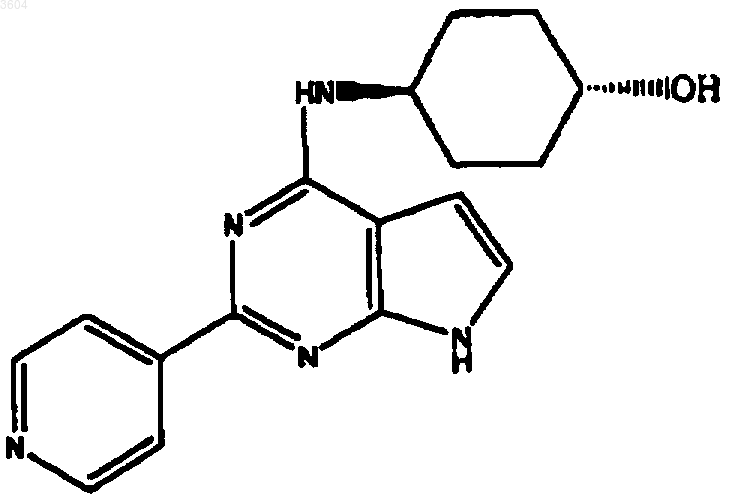
57. Соединение по п.9, имеющее структуру
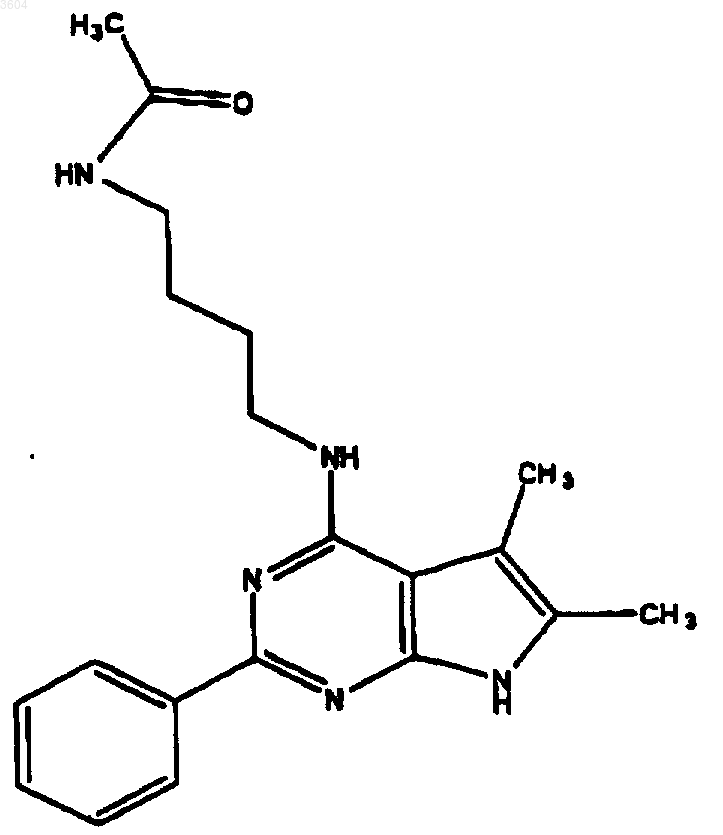
58. Соединение по п.9, имеющее структуру
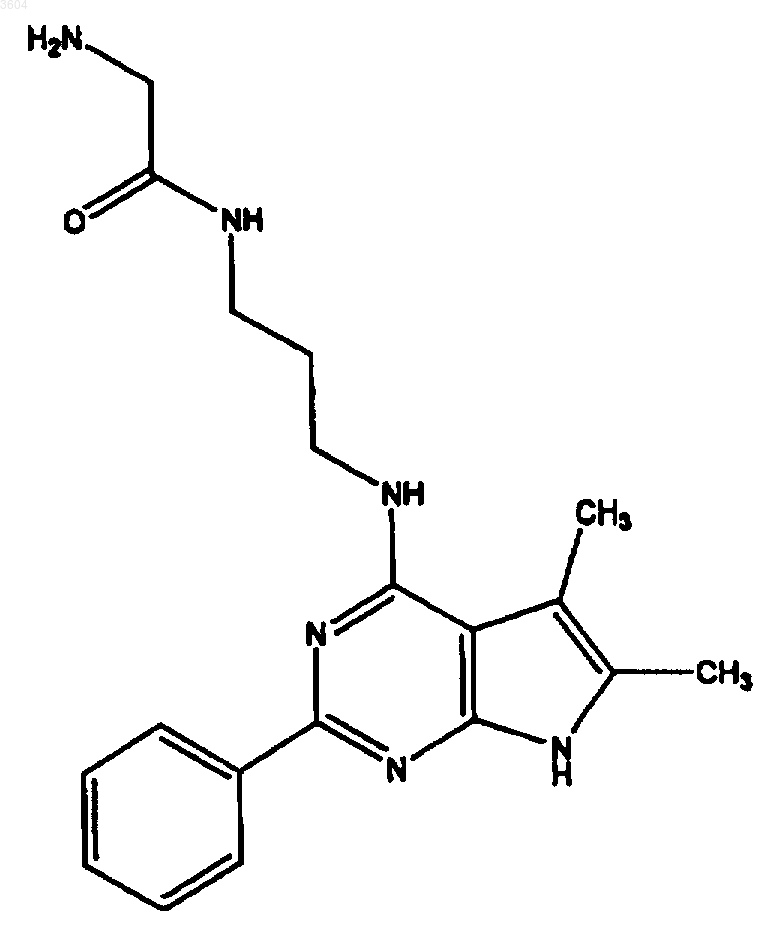
59. Соединение по п.1, имеющее структуру
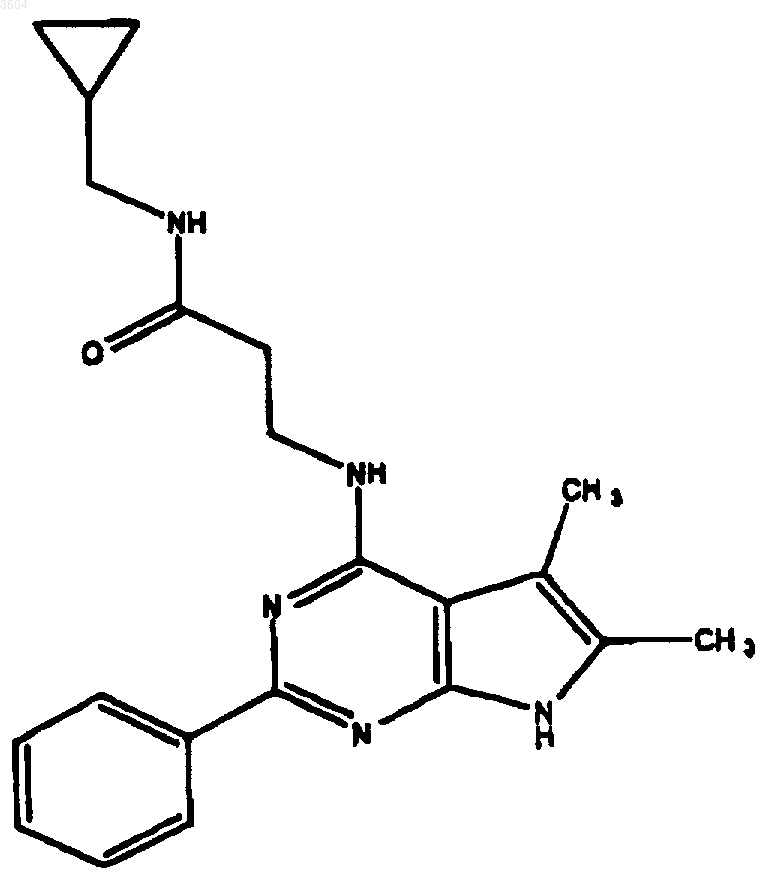
60. Соединение по п.9, имеющее структуру
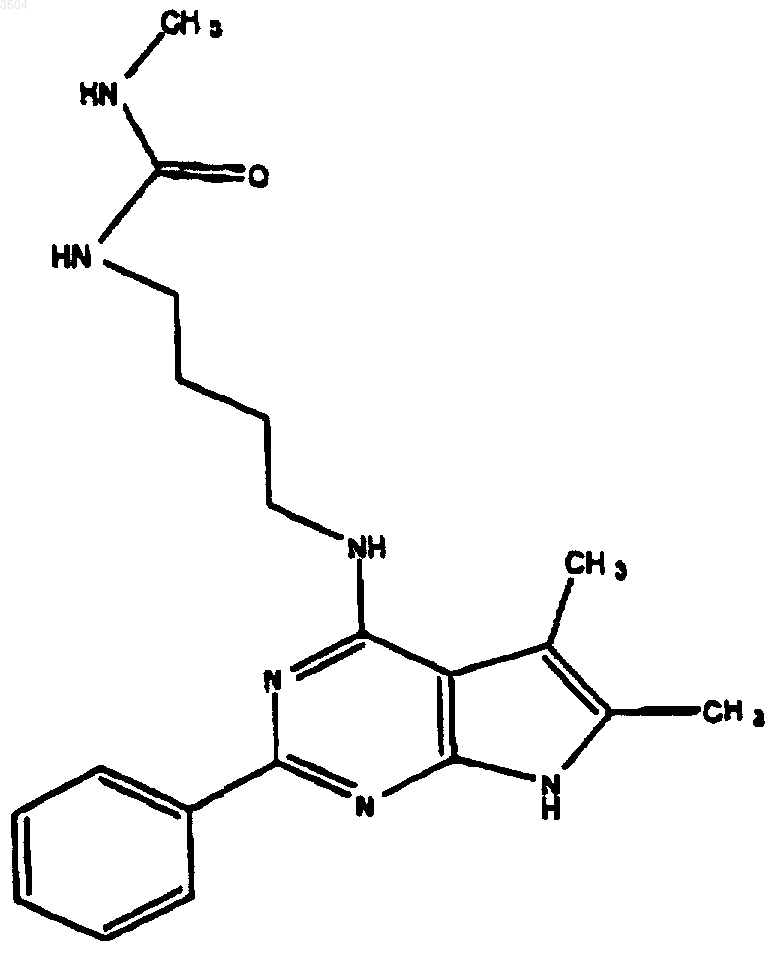
61. Соединение по п.9, имеющее структуру
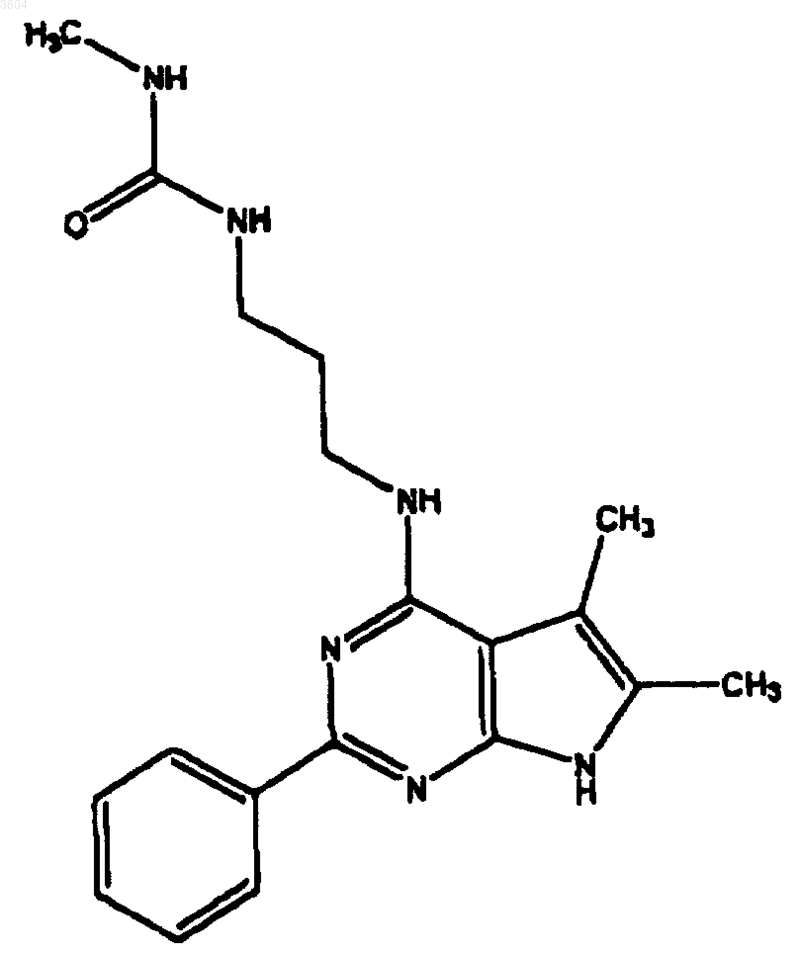
62. Соединение по п.8, имеющее структуру

63. Соединение по п.62, имеющее структуру
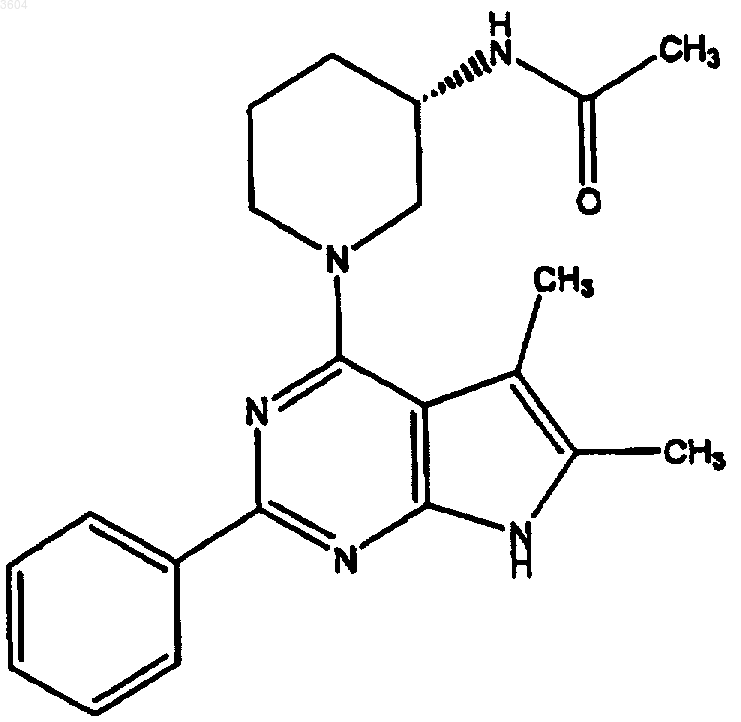
64. Соединение по п.62, имеющее структуру
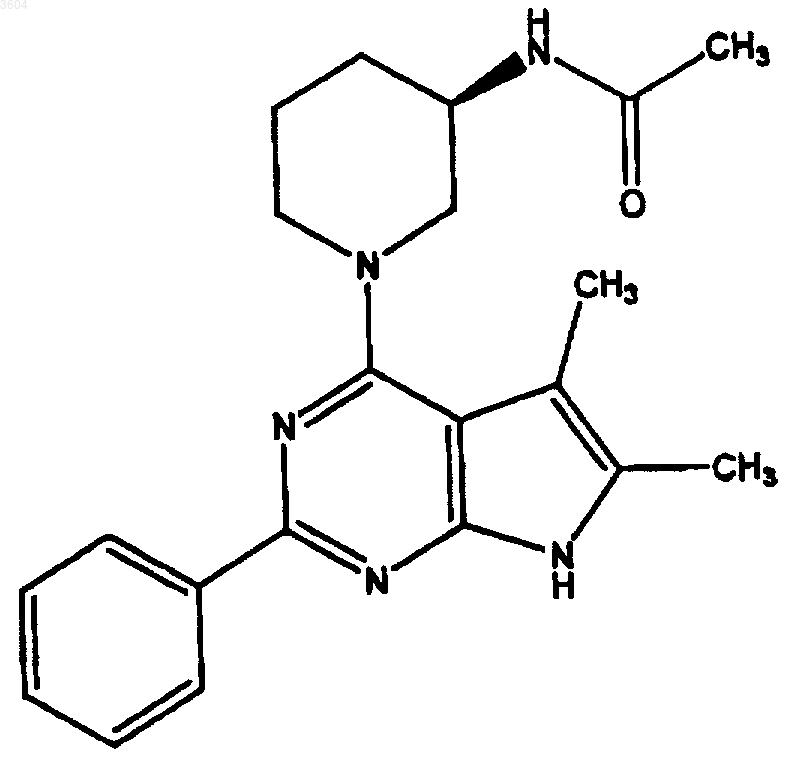
65. Соединение по п.1, где любой заместитель, если он имеется, представляет собой галоген, гидроксил, прямой (C1-C30)алкилкарбонилокси, разветвленный (C3-C30)алкилкарбонилокси, прямой (C1-C30)алкоксикарбонилокси, разветвленный (C3-C30)алкоксикарбонилокси, карбоксилат, прямой (C1-C30)алкилкарбонил, разветвленный (C3-C30)алкилкарбонил, прямой (C1-C30)алкоксикарбонил, разветвленный (C3-C30)алкоксикарбонил, аминокарбонил, прямой (C1-C30)алкилтиокарбонил, разветвленный (C3-C30)алкилтиокарбонил, прямой (C1-C30)алкоксил, разветвленный (C3-C30)алкоксил, амино, прямой (C1-C30)алкиламино, разветвленный (C3-C30)алкиламино, прямой (C1-C30)диалкиламино, разветвленный (C3-C30)диалкиламино, ациламино, прямой (C1-C30)алкилкарбониламино, разветвленный (C3-C30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, нитро, 4-10-членный гетероциклил, прямой (C1-C30)алкиларил, разветвленный (C3-C30)алкиларил или ароматическую или 5-6-членную гетероароматическую группу, где заместитель, в свою очередь, может быть замещен любым из вышеуказанных заместителей.
66. Соединение по п.65, где заместитель представляет собой галоген, гидроксил, прямой (C1-C30)алкилкарбонилокси, разветвленный (C3-C30)алкилкарбонилокси, прямой (C1-C30)алкоксикарбонилокси, разветвленный (C3-C30)алкоксикарбонилокси, карбоксилат, прямой (C1-C30)алкилкарбонил, разветвленный (C3-C30)алкилкарбонил, прямой (C1-C30)алкоксикарбонил, разветвленный (C3-C30)алкоксикарбонил, аминокарбонил, прямой (C1-C30)алкилтиокарбонил, разветвленный (C3-C30)алкилтиокарбонил, прямой (C1-C30)алкоксил, разветвленный (C3-C30)алкоксил, амино, прямой (C1-C30)алкиламино, разветвленный (C3-C30)алкиламино, прямой (C1-C30)диалкиламино, разветвленный (C3-C30)диалкиламино, ациламино, прямой (C1-C30)алкилкарбониламино, разветвленный (C3-C30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, нитро, 4-10-членный гетероциклил или 5-6-членную гетероароматическую группу, где заместитель, в свою очередь, может быть замещен любым из вышеуказанных заместителей.
67. Соединение по п.1, где R1 и R2 представляют собой замещенный прямой (C1-C30)алкил или замещенный разветвленный (C3-C30)алкил, содержащие два заместителя.
Текст
1 Предпосылки создания изобретения Аденозин представляет собой повсеместно распространенный модулятор многих физиологических процессов, особенно в сердечнососудистой и нервной системах. Действие аденозина, очевидно, опосредовано специфическими рецепторными белками клеточной поверхности. Аденозиновые модуляторы различаются по своим физиологическим функциям, включая такие функции, как индуцирование седативного эффекта, расширение сосудов, снижение частоты сердечных сокращений, ингибирование агрегации тромбоцитов, стимуляцию глюконеогенеза и ингибирование липолиза. Кроме того, было показано, что, помимо своего воздействия на аденилатциклазу, аденозин открывает калиевые каналы, снижает поток через кальциевые каналы и ингибирует или стимулирует метаболизм фосфоинозитидина под действием рецепторопосредованных механизмов (См., например,C.E.MullerВ.Stein "Adenosine Receptor Antagonists: Structures and Potential Therapeutic Applications", Current Pharmaceutical Design, 2:501(1996), и C.E.Muller "A1-Adenosine Receptor Antagonists: Exp.Opin.Ther.Patents 7(5):419 (1997. Аденозиновые рецепторы принадлежат к суперсемейству пуриновых рецепторов, которые, в настоящее время, подразделяются на рецепторы P1 (аденозин) и рецепторы P2 (АТР,ADP и другие нуклеотиды). До настоящего времени, от различных видов, включая человека,было клонировано четыре подтипа рецепторов для нуклеозидаденозина. Рецепторы двух подтипов (A1 и А 2a) обладают сродством к аденозину в наномолярном диапазоне, а рецепторы двух других известных подтипов А 2b и А 3 являются низкоафинными рецепторами, обладающими аффинностью по отношению к аденозину в низкомикромолярном диапазоне. Активация аденозиновых рецепторов A1 и А 3 может приводить к ингибированию аденилатциклазной активности,тогда как активация А 2a и А 2b приводит к стимуляции аденилатциклазы. Для лечения заболевания познавательной способности, почечной недостаточности и сердечной аритмии было получено несколько антагонистов рецепторов A1. Было высказано предположение, что антагонисты рецепторов A2a могут быть использованы для лечения пациентов, страдающих синдромом Паркинсона (болезнью Паркинсона). В частности, вероятно, что при локальной доставке, антагонисты аденозиновых рецепторов могут оказаться эффективными для лечения аллергических воспалительных реакций и астмы. Имеющиеся данные (например, NyceMetzger "DNA antisense Therapyfor Asthma in an Animal Model" Nature (1997) 385:721-5) указывают, что в данных патофизиологических условиях, антагонисты A1 могут блокировать сокращение гладкой мышцы нижерасположенного эпителия дыхательных путей,тогда как антагонисты рецепторов А 2b или А 3 2 могут блокировать дегрануляцию тучных клеток, снижая уровень высвобождения гистамина и других медиаторов воспаления. Было обнаружено, что рецепторы А 2b присутствуют на протяжении всего желудочно-кишечного тракта,особенно в эпителии толстого и тонкого кишечника. Было сделано предположение, что рецепторы А 2b опосредуют сАМР-ответ (Strohmeier etal., J.Biol.Chem., (1995) 270:2387-94). Было показано, что аденозиновые рецепторы присутствуют на сетчатке глаза многих видов млекопитающих, включая, коров, свиней,обезьян, крыс, морских свинок, мышей, кроликов и человека (См., например, Blazynski et al. ,Discret Distribution of Adenosine Receptors inreceptors localized to ganglion cells of the retina,Proceedings of the National Academy of Science,volume 84, pages 3906-3910 (1987. Недавно, в работе Williams сообщалось о наблюдении сайтов транспорта аденозина в культивированной клеточной линии сетчатки глаза человека (Williams et al., Nucleoside Transport Sites in a Cultured Human Retinal Cell Line Established by SV40 Т Antigen Gene, Current Eye Research, volume 13, pages 109-118 (1994. Ранее было высказано предположение, что соединения, которые регулируют поглощение аденозина, могут быть использованы в качестве потенциальных терапевтических агентов для лечения поражения сетчатки глаза и диска зрительного нерва. В патенте США 5780450,Shade, обсуждается использование ингибиторов поглощения аденозина для лечения глазных болезней. В патенте Shade не описано использование специфических ингибиторов рецептора А 3. Полное описание патента США 5780450 вводится в настоящее описание посредством ссылки. Необходимость в получении других антагонистов аденозиновых рецепторов в качестве фармакологических средств остается актуальной, и особый интерес представляют лекарственные средства для лечения вышеупомянутых болезней и/или патологических состояний. Краткое описание изобретения Настоящее изобретение основано, по крайней мере, частично, на обнаружении того факта, что N-6-замещенные 7-деазапурины,описанные ниже, могут быть использованы для лечения состояний, отвечающих на N-6 замещенный 7-деазапурин. Примерами таких состояний являются состояния, ассоциированные с повышенной активностью аденозиновых рецепторов, например, бронхит, желудочнокишечные заболевания или астма. Эти состояния отличаются тем, что в них активация адено 3 зинового рецептора может приводить к ингибированию или стимуляции активности аденозинциклазы. Композиции и способы настоящего изобретения включают энантиомерно или диастереомерно чистые N-6-замещенные 7-деазапурины. Предпочтительными N-6-замещенными 7 деазапуринами являются такие N-6-замещенные 7-деазапурины, которые имеют ацетамидную,карбоксамидную, замещенную циклогексильную, например, циклогексанольную или карбамидную группу, связанную с N-6-азотом посредством алкиленовой цепи. Настоящее изобретение относится к способам модуляции аденозинового(ых) рецептора(ов) у млекопитающего путем введения этому млекопитающему терапевтически эффективного количества N-6-замещенного 7-деазапурина,так, чтобы это введение приводило к модуляции активности аденозинового рецептора. Подходящими аденозиновыми рецепторами являются рецепторы семейств A1, А 2 или А 3. В предпочтительном варианте осуществления настоящего изобретения, N-6-замещенный 7-деазапурин представляет собой антагонист аденозинового рецептора. Кроме того, настоящее изобретение относится к способам лечения заболеваний, отвечающих на N-6-замещенный 7-деазапурин, например, астмы, бронхита, аллергического ринита, хронической обструктивной болезни легких,почечных болезней, желудочно-кишечных заболеваний и глазных болезней у млекопитающих путем введения этому млекопитающему терапевтически эффективного количества N-6 замещенного 7-деазапурина, так, чтобы это введение приводило к излечению указанного млекопитающего. Подходящими N-6-замещенными 7-деазапуринами являются соединения, имеющие общую формулу I и их фармацевтически приемлемые соли. Каждый из R1 и R2 независимо представляет собой атом водорода или замещенную или незамещенную алкильную, арильную или алкиларильную группу, либо, взятые вместе, они образуют замещенное или незамещенное гетероциклическое кольцо. R3 представляет собой атом водорода или замещенную или незамещенную алкильную, арильную или алкиларильную группу.R4 представляет собой атом водорода или замещенную или незамещенную алкильную, арильную или алкиларильную группу. Каждый из R5 и R6 независимо представляет собой атом галогена, например, атом хлора, фтора или брома,атом водорода или замещенную или незамещенную алкильную, арильную или алкиларильную группу; либо, R4 и R5 или R5 и R6, взятые вместе, образуют замещенное или незамещен 003604 4 ное гетероциклическое или карбоциклическое кольцо. В некоторых вариантах осуществления настоящего изобретения каждый из R1 и R2 может независимо представлять собой замещенные или незамещенные циклоалкильные или гетероарилалкильные группы. В другом варианте осуществления изобретения R3 представляет собой атом водорода или замещенную или незамещенную гетероарильную группу. В еще одном варианте осуществления настоящего изобретения, каждый из R4, R5 иR6 может независимо представлять собой гетероарильные группы. В предпочтительном варианте осуществления изобретения, R1 представляет собой атом водорода, R2 представляет собой циклогексанол, например, транс-циклогексанол, R3 представляет собой фенил, R4 представляет собой атом водорода, R5 представляет собой метильную группу и R6 представляет собой метильную группу. В еще одном варианте осуществления настоящего изобретения, R1 представляет собой атом водорода, R2 представляет собойR3 представляет собой фенил, R4 представляет собой атом водорода, a R5 и R6 представляют собой метильную группу. Настоящее изобретение также относится к фармацевтическим композициям для лечения заболеваний у млекопитающих, отвечающих наN-6-замещенный 7-деазапурин, например, астмы, бронхита, аллергического ринита, хронической обструктивной болезни легких, почечных болезней, желудочно-кишечных заболеваний и глазных болезней. Эта фармацевтическая композиция включает терапевтически эффективное количество N-6-замещенного 7-деазапурина и фармацевтически приемлемый носитель. Настоящее изобретение также относится к фармацевтическим композициям для лечения заболеваний, отвечающих на N-6-замещенный 7-деазапурин, у млекопитающих. Эта упакованная фармацевтическая композиция включает контейнер, содержащий терапевтически эффективное количество, по крайней мере, одного N6-замещенного 7-деазапурина, и инструкции по применению указанного N-6-замещенного 7 деазапурина, используемого для лечения состояния, отвечающего на N-6-замещенный 7 деазапурин, у млекопитающего. Настоящее изобретение, кроме того, относится к соединениям формулы I, гдеR2 представляет собой замещенный или незамещенный циклоалкил, замещенный или незамещенный алкил, либо R1 и R2, взятые вместе, образуют замещенное или незамещенное гетероциклическое кольцо;R3 представляет собой замещенный или незамещенный арил;R4 представляет собой водород; и каждый из R5 и R6 независимо представляет собой водород или алкил, и их фармацевтически приемлемые соли. Деазапурины данного варианта изобретения могут быть преимущественно селективными антагонистами рецептора А 3. Эти соединения могут быть использованы для различных терапевтических целей, таких как, например, лечение астмы, почечной недостаточности, ассоциированной с сердечной недостаточностью, и глаукомы. В особенно предпочтительном варианте настоящего изобретения, деазапурин представляет собой водорастворимое пролекарство, которое в результате метаболизма in vivo, например, благодаря гидролизу, катализируемому эстеразой, способно превращаться в активное лекарственное вещество. В еще одном варианте своего осуществления, настоящее изобретение относится к способу ингибирования активности аденозинового рецептора (например, А 3) в клетке, предусматривающему контактирование этой клетки с N-6 замещенным 7-деазапурином (например, предпочтительно, с антагонистом аденозинового рецептора). В другом своем аспекте, настоящее изобретение относится к способу лечения поражения глаз у животного (например, у человека) путем введения указанному животному эффективного количества N-6-замещенного 7-деазапурина формулы I. Предпочтительным N-6 замещенным 7-деазапурином является антагонист аденозиновых рецепторов А 3 в клетках данного животного. Указанным поражением глаз является поражение сетчатки глаза или диска зрительного нерва, и это поражение может быть острым или хроническим. Указанное поражение может возникать в результате глаукомы, отека, ишемии, гипоксии или травмы. Настоящее изобретение также относится к фармацевтической композиции, содержащей N6-замещенный 7-деазапурин формулы I. Указанным фармацевтическим препаратом, предпочтительно, является офтальмическая готовая препаративная форма (например, готовая препаративная форма для инъекции в окологлазную,ретробульбарную или внутриглазную область,готовая препаративная форма для системного введения или хирургический раствор для промывания). В другом варианте своего осуществления,настоящее изобретение относится к деазапурину, имеющему формулу II 6 каждый из R1 и R2 независимо представляет собой водород или замещенный или незамещенный алкокси, аминоалкил, алкил, арил или алкиларил, либо, взятые вместе, они образуют замещенное или незамещенное гетероциклическое кольцо, при условии, что R1 и R2 оба не являются водородом;R3 представляет собой замещенный или незамещенный алкил, арилалкил или арил;R4 представляет собой водород или замещенный или незамещенный C1-С 6 алкил;L представляет собой водород, замещенный или незамещенный алкил, либо R4 и L, взятые вместе, образуют замещенное или незамещенное гетероциклическое или карбоциклическое кольцо;R6 представляет собой водород, замещенный или незамещенный алкил или галоген;Q представляет собой CH2, О, S или NR7,где R7 представляет собой водород или замещенный или незамещенный C1-С 6 алкил иW представляет собой незамещенный или замещенный алкил, циклоалкил, арил, арилалкил, биарил, гетероарил, замещенный карбонил, замещенный тиокарбонил или замещенный сульфонил; при условии, что если R3 представляет собой пирролидино, то R4 не является метилом. Настоящее изобретение также относится к фармацевтически приемлемым солям и пролекарствам соединений настоящего изобретения. В предпочтительном варианте осуществления изобретения, Х представляет собой CR6, aQ представляет собой СН 2, О, S или NH в формуле II, где R6 определен выше. В другом варианте формулы II, Х представляет собой N. Кроме того, настоящее изобретение относится к способу ингибирования активности аденозинового рецептора (например, аденозинового рецептора А 2b) в клетке путем контактирования этой клетки с соединением настоящего изобретения. Предпочтительным соединением является антагонист данного рецептора. Настоящее изобретение также относится к способу лечения желудочно-кишечных заболеваний (например, диареи) или респираторного заболевания (например, аллергического ринита,хронической обструктивной болезни легких) у животного путем введения этому животному эффективного количества соединения формулыII (например, антагониста рецептора А 2b). Предпочтительным животным является человек. Подробное описание изобретения Отличительные признаки и другие характерные особенности настоящего изобретения будут подробно изложены в нижеследующем описании и в формуле изобретения. При этом,следует отметить, что конкретные варианты настоящего изобретения представлены лишь в иллюстративных целях и не ограничивают данное изобретение. Принципиальные отличия на 7 стоящего изобретения могут быть использованы в различных вариантах его осуществления, не выходящих за рамки объема изобретения. Настоящее изобретение относится к способам лечения состояния, отвечающего на N-6 замещенный 7-деазапурин, у млекопитающего. Эти способы предусматривают введение этому млекопитающему терапевтически эффективного количества N-6-замещенного 7-деазапурина,описанного ниже, так, чтобы это введение приводило к излечению указанного состояния у млекопитающего, отвечающего на N-6-замещенный 7-деазапурин. Выражение "состояние, отвечающее на действие N-6-замещенного 7-деазапурина" означает болезнь или болезненное состояние, характеризующееся тем, что оно поддается лечению N-6-замещенным 7-деазапурином настоящего изобретения, описанным ниже, например,лечению, которое приводит к значительному ослаблению, по крайней мере, одного симптома или болезненного эффекта этого состояния, достигаемому с использованием N-6-замещенного 7-деазапурина настоящего изобретения. Обычно такие состояния ассоциируются с увеличением уровня аденозина у хозяина, которое часто приводит к возникновению физиологических симптомов у данного хозяина, включая, но не ограничиваясь ими, высвобождение токсинов, воспаление, кому, удерживание воды в организме,увеличение или потерю веса, панкреатит, энфизему, ревматоидный артрит, остеоартрит, множественную недостаточность органов, респираторный дистресс-синдром у детей и взрослых,аллергический ринит, хроническую обструктивную болезнь легких, поражения глаз, желудочно-кишечные заболевания, стимуляцию опухолей кожи, иммунодефицит и астму. (См., например, C.E.MullerВ.Stein "Adenosine Receptor Antagonists: Structures and Potential Therapeutic Applications", Current Pharmaceutical Design,2:501 (1996) и C.E. Muller "A1-Adenosine Receptor Antagonists: Exp.Opin.Ther.Patents 7(5):419(1998. Патологическими эффектами, часто ассоциирующимися с указанными симптомами,являются, но не ограничиваются ими, повышение температуры, учащенное дыхание, тошнота,диарея, слабость, головная боль и даже смерть. В одном из вариантов изобретения, состоянием,отвечающим на воздействие N-6-замещенного 7-деазапурина, является такие болезненные состояния, которые опосредуются стимуляцией аденозиновых рецепторов, например, A1, А 2a,А 2b, А 3 и т.п., в результате чего происходит модуляция концентраций кальция в клетках и/или активация PLC (фосфолипазы С). В предпочтительном варианте осуществления изобретения,состояние, отвечающее на N-6-замещенный 7 деазапурин, ассоциируется с аденозиновым(и)N-6-замещенный 7-деазапурин действует как антагонист. Примерами подходящих положительно реагирующих состояний, которые могут излечиваться соединениями настоящего изобретения, являются состояния, например, ассоциированные с подтипами аденозиновых рецепторов, опосредующими биологические эффекты,например, эффекты центральной нервной системы (ЦНС), сердечно-сосудистые эффекты,почечные эффекты, респираторные эффекты,иммунологические эффекты,желудочнокишечные эффекты и метаболические эффекты. Относительное количество аденозина у индивидуума может быть ассоциировано с нижеперечисленными эффектами, так, что повышенные уровни аденозина могут стимулировать определенный эффект, например, нежелательный физиологический ответ, например, астматическую атаку. ЦНС-эффектами являются снижение уровня высвобождения трансмиттера (A1), седативный эффект (A1), пониженная двигательная активность (А 2a), противосудорожная активность,стимуляция хеморецепторов (А 2) и гипералгезия. Терапевтическими применениями соединений настоящего изобретения является лечение деменции и болезни Альцгеймера и улучшение памяти. Сердечно-сосудистыми эффектами являются расширение сосудов (А 2a), (А 2b) и (А 3),сужение сосудов (A1), брадикардия (A1), ингибирование тромбоцитов (А 2a), отрицательная инотропия и дромотропия сердца (A1), аритмия,тахикардия и ангиогенез. Терапевтическими применениями соединений настоящего изобретения являются, например, предупреждение вызванного ишемией повреждения сердца и снижения его тонуса, защита ткани миокарда и восстановление сердечной функции. Почечными эффектами является снижение СКФ (скорости клубочковой фильтрации) (A1),сморщивание мезангиальных клеток (A1), антидиурез (A1) и ингибирование высвобождения ренина (A1). Подходящими терапевтическими применениями соединений настоящего изобретения является их использование в качестве диуретиков, натриуретиков, калийудерживающих агентов, агентов для защиты/предохранения почек от острой почечной недостаточности,гипотензивных, противоотечных и противонефритных агентов. Респираторными эффектами являются бронхолитические эффекты (А 2), бронхостеноз(A1), хроническая обструктивная болезнь легких, аллергический ринит, секреция слизи и угнетение дыхания (А 2). Подходящими терапевтическими применениями для соединений настоящего изобретения являются их использование в качестве противоастматических средств,лечение болезней легких после трансплантации и респираторных заболеваний. 9 Иммунологическими эффектами являются иммуносупрессия (А 2), хемотаксис нейтрофилов(A1), генерация супероксида нейтрофилами (А 2a) и дегрануляция тучных клеток (А 2b и А 3). Терапевтическим применением антагонистов являются их использование в качестве медиаторов аллергических и неаллергических воспалительных реакций, например, медиаторов высвобождения гистамина и других медиаторов воспаления. Желудочно-кишечными эффектами является ингибирование секреции кислоты (A1). Терапевтическим применением соединений настоящего изобретения является их использование при рефлюкс-состояниях и язвах. Желудочно-кишечными эффектами также являются заболевания толстой кишки, тонкой кишки и диарея, например, диарея, ассоциированная с воспалением тонкой кишки (А 2b). Глазными болезнями являются повреждение сетчатки и диска зрительного нерва, и заболевания, ассоциированные с травмами (А 3). В предпочтительном варианте осуществления изобретения, такой глазной болезнью является глаукома. Другими терапевтическими применениями соединений настоящего изобретения является лечение ожирения (благодаря липолитическим свойствам этих соединений), гипертензии и депрессии; использование в качестве седативного средства, транквилизатора, антилептического средства и в качестве слабительного средства,например, для стимуляции перистальтики, не приводящей к диарее. Термин "болезненное состояние" означает состояния, вызываемые или ассоциированные с нежелательными уровнями аденозина, аденилилциклазной активности, повышенной физиологической активности, связанной с нарушением стимуляции аденозиновых рецепторов и/или с возрастанием сАМР. В одном из вариантов осуществления изобретения, патологическим состоянием является, например, астма, хроническая обструктивная болезнь легких, аллергический ринит, бронхит, заболевание почек, желудочно-кишечные заболевания или глазные болезни. Другими примерами являются хронический бронхит и фиброз мочевого пузыря. Подходящими примерами воспалительных заболеваний являются нелимфатический лейкоз, ишемия миокарда, стенокардия, инфаркт, цереброваскулярная ишемия, перемежающаяся хромота,угрожающая ишемия конечностей, венозная гипертензия, варикозное расширение вен, изъязвления вен и артериосклероз. Повреждениями,ассоциированными с реперфузией, являются,например, любая травма после хирургической операции, такой как восстановительная хирургическая операция, тромболиз или ангиопластика. Выражение "воздействие на состояние, отвечающее на N-6-замещенный 7-деазапурин" 10 или "лечение состояния, отвечающего на N-6 замещенный 7-деазапурин" означает такие изменения в патологическом состоянии или заболевании, описанном выше, которые могут приводить к уменьшению или минимизации физиологических симптомов у млекопитающего. Это выражение означает также регуляцию, предупреждение или ингибирование физиологических симптомов или эффектов, ассоциированных с аномальным количеством аденозина. В предпочтительном варианте настоящего изобретения, такой регуляцией патологического состояния или заболевания является его полное излечение. В другом предпочтительном варианте настоящего изобретения, эту регуляцию выбирают так, чтобы осуществлялся контроль за отклонением уровней активности аденозинового рецептора, но, при этом, другие физиологические системы и параметры оставались неизменными. Термин "N-6-замещенный 7-деазапурин" понятен специалистам и означает соединения,имеющие формулу I"N-замещенный 7-деазапурин" включает его фармацевтически приемлемые соли, и, в одном из вариантов, также означает некоторые описанные здесь N-6-замещенные пурины. В некоторых вариантах осуществления изобретения, N-6-замещенный 7-деазапурин не замещен N-6-бензилом или N-6-фенилэтилом. В других вариантах изобретения, R4 не замещен бензилом или фенилэтилом. В предпочтительных вариантах изобретения, R1 и R2 оба не являются атомами водорода. В других предпочтительных вариантах, R3 не является атомом водорода. Термин "терапевтически эффективное количество" N-6-замещенного 7-деазапурина, описанного ниже, означает количество терапевтического соединения, необходимого или достаточного для осуществления его целевой функции в организме млекопитающего, например,для лечения состояния, отвечающего на N-6 замещенный 7-деазапурин, или патологического состояния у млекопитающего. Эффективное количество терапевтического соединения может варьироваться в зависимости от таких факторов,как количество этиологического агента, уже присутствующего в организме млекопитающего, возраста, пола и веса млекопитающего, и от способности терапевтических соединений настоящего изобретения влиять на состояние, отвечающее на N-6-замещенный деазапурин у млекопитающего. Каждый средний специалист может сам исследовать вышеупомянутые факторы и определить эффективное количество терапевтического соединения без какого-либо 11 излишнего экспериментирования. Для определения "эффективного количества" терапевтических соединений, описанных ниже, может быть использован in vitro- и in vivo-анализ. Каждый средний специалист может выбрать соответствующее количество терапевтического соединения для использования в вышеупомянутом анализе или для терапевтического лечения. Терапевтически эффективное количество предпочтительно ослабляет, по крайней мере,один симптом или эффект, ассоциированный с состоянием или заболеванием, отвечающим на действие N-6-замещенного 7-деазапурина, и подвергаемым лечению, по крайней мере, примерно на 20% (более предпочтительно, по крайней мере, примерно на 40%, еще более предпочтительно, по крайней мере, примерно на 60%, и наиболее предпочтительно, по крайней мере,примерно на 80%) по сравнению с симптомом или эффектом у индивидуума, не подвергаемого такому лечению. Анализы для определения степени ослабления таких симптомов и/или эффектов могут быть разработаны любым специалистом. Любой известный анализ, позволяющий определить такие параметры, является частью настоящего изобретения. Так, например, если подвергаемым лечению заболеванием является астма, то объем воздуха, выдыхаемого из легких индивидуума, может быть измерен до и после лечения для определения увеличения этого объема методом, известным специалисту. Аналогично, если подвергаемым лечению заболеванием является воспалительное заболевание, то для определения уменьшения области воспаления,эта область воспаления может быть измерена до и после лечения методом, известным специалисту. Термин "клетка" означает как прокариотическую клетку, так и эукариотическую клетку. Термин "животное" означает любой организм с аденозиновыми рецепторами или любой организм, восприимчивый к состоянию, отвечающему на N-6-замещеный 7-деазапурин. Примерами таких животных являются дрожжи,млекопитающие, рептилии и птицы. В это понятие входят также трансгенные животные. Термин "млекопитающее" понятен специалисту и означает животное, более предпочтительно, теплокровное животное, а наиболее предпочтительно, крупный рогатый скот, овцы,свиньи, лошади, собаки, кошки, крысы, мыши и человек. В объем настоящего изобретения также входят, например, млекопитающие, восприимчивые к состоянию, отвечающему на введениеN-6-замещенного 7-деазапурина, воспалительным заболеваниям, эмфиземе, астме, заболеваниям центральной нервной системы или к острому респираторному дистресс-синдрому. В другом своем аспекте настоящее изобретение относится к способам модуляции аденозинового рецептора(ов) у млекопитающих путем введения указанному млекопитающему те 003604 12 рапевтически эффективного количества N-6 замещенного 7-деазапурина, так, чтобы это введение приводило к модуляции аденозинового рецептора у млекопитающего. Подходящими аденозиновыми рецепторами являются рецепторы семейств A1, А 2 или А 3. В предпочтительном варианте, N-6-замещенный 7-деазапурин является антагонистом аденозинового рецептора. Термин "модуляция аденозинового рецептора" означает такие события, при которых соединение взаимодействует с аденозиновым(и) рецептором(ами), вызывая повышенную, пониженную или аномальную физиологическую активность, ассоциированную с аденозиновым рецептором, или последующий каскад реакций,индуцированный в результате модуляции аденозинового рецептора. Физиологическими активностями, ассоциированными с аденозиновым рецептором, являются индуцирование седативного эффекта, расширения сосудов, снижение частоты сердечных сокращений и сократительной способности сердца, ингибирование агрегации тромбоцитов, стимуляция глюконеогенеза,ингибирование липолиза, открытие калиевых каналов, снижение потока ионов кальция в кальциевых каналах и т.п. Термины "модулировать", "модулирование" или "модуляция" означают предупреждение, устранение или ингибирование суммарного увеличения нежелательной физиологической активности, ассоциированной с аномальной стимуляцией аденозинового рецептора, например, с использованием терапевтических способов настоящего изобретения. В другом варианте настоящего изобретения, термин "модуляция" означает антагонистические эффекты, например, снижение активности или продуцирования медиаторов аллергии или аллергического воспаления, вызываемых сверхстимуляцией аденозинового(ых) рецептора(ов). Так, например, терапевтические деазапурины настоящего изобретения могут взаимодействовать с аденозиновым рецептором с ингибированием, например, аденилатциклазной активности. Термин "состояние, характеризующееся аномальной активностью аденозинового рецептора" означает заболевания, расстройства или состояния, которые ассоциируются с нарушением стимуляции аденозинового рецептора, таким,что эта стимуляция рецептора вызывает каскад биохимических или физиологических реакций,которые прямо или опосредованно ассоциированы с данным заболеванием, расстройством или состоянием. Указанная стимуляция аденозинового рецептора не является единственным этиологическим фактором данного заболевания,расстройства или состояния, но она лишь ответственна за возникновение некоторых симптомов, обычно ассоциируемых с данным заболеванием, расстройством или состоянием, подвергаемым лечению. Такое нарушение стимуляции рецептора может быть единственным фактором 13 или, по крайней мере, одним другим агентом,который может вызывать состояние, нуждающееся в лечении. Примерами таких состояний являются состояния, перечисленные выше,включая воспаление, желудочно-кишечные заболевания и симптомы, проявляемые в присутствии повышенной активности аденозинового рецептора. Предпочтительными примерами являются симптомы, ассоциированные с астмой,аллергическим ринитом, хронической обструктивной болезнью легких, эмфиземой, бронхитом, желудочно-кишечными заболеваниями и глаукомой. Термин "терапия или лечение состояния,характеризующегося нарушением активности аденозинового рецептора" означает облегчение или ослабление, по крайней мере, одного симптома, ассоциированного с данным состоянием. Таким лечением также является облегчение или ослабление более чем одного симптома. Предпочтительно, если такое лечение приводит к излечению, например, в основном, к устранению симптомов, ассоциированных с данным состоянием. Настоящее изобретение относится к соединениям, N-6-замещенным 7-деазапуринам,имеющим формулу I где каждый из R1 и R2 независимо представляет собой атом водорода или замещенную или незамещенную алкильную, арильную или алкиларильную группу, либо, взятые вместе, они образуют замещенное или незамещенное гетероциклическое кольцо;R3 представляет собой атом водорода или замещенную или незамещенную алкильную,арильную или алкиларильную группу;R4 представляет собой атом водорода или замещенную или незамещенную алкильную,арильную или алкиларильную группу. Каждый из R5 и R6 независимо представляет собой атом галогена, например, хлор, фтор или бром, атом водорода или замещенную или незамещенную алкильную, арильную или алкиларильную группу; либо, R4 и R5 или R5 и R6, взятые вместе,образуют замещенное или незамещенное гетероциклическое или карбоциклическое кольцо. Настоящее изобретение также относится к фармацевтически приемлемым солям N-6-замещенных 7-деазапуринов. В некоторых вариантах осуществления изобретения, каждый из R1 и R2 независимо может представлять собой замещенные или незамещенные циклоалкильные или гетероарилалкильные группы. В других вариантах осуществления изобретения, R3 означает атом водорода или замещенную или незамещенную гетероарильную группу. В других вариантах осуществления изобретения, каждый из R4, R5 и R6 может 14 независимо представлять собой гетероарильную группу. В одном варианте осуществления изобретения, R1 представляет собой атом водорода, R2 представляет собой замещенную или незамещенную циклогексановую, циклопентильную,циклобутильную или циклопропановую группу,R3 представляет собой замещенную или незамещенную фенильную группу, R4 представляет собой атом водорода, а R5 и R6 оба представляют собой метильные группы. В другом варианте осуществления изобретения, R2 представляет собой циклогексанол,циклогександиол,циклогексилсульфонамид,циклогексанамид, циклогексиловый сложный эфир, циклогексен, циклопентанол или циклопентандиол, а R3 представляет собой фенильную группу. В еще одном варианте осуществления изобретения, R1 представляет собой атом водорода,R2 представляет собой циклогексанол, R3 представляет собой замещенную или незамещенную фенильную, пиридиновую, фурановую, циклопентановую или тиофеновую группу, R4 представляет собой атом водорода, замещенную алкильную, арильную или арилалкильную группу,а каждый из R5 и R6 независимо представляет собой атом водорода или замещенную или незамещенную алкильную, арильную или алкиларильную группу. В другом варианте осуществления изобретения, R1 представляет собой атом водорода, R2 представляет собой замещенный или незамещенный алкиламин, ариламин или алкилариламин, замещенный или незамещенный алкиламид, ариламид или алкилариламид, замещенный или незамещенный алкилсульфонамид, арилсульфонамид или алкиларилсульфонамид, замещенную или незамещенную алкилмочевину,арилмочевину или алкиларилмочевину, замещенный или незамещенный алкилкарбамат,арилкарбамат или алкиларилкарбамат, либо замещенную или незамещенную алкилкарбоновую кислоту, арилкарбоновую кислоту или алкиларилкарбоновую кислоту, R3 представляет собой замещенную или незамещенную фенильную группу, R4 представляет собой атом водорода, a R5 и R6 представляют собой метильные группы. В еще одном варианте осуществления изобретения, R2 представляет собой гуанидин, модифицированный гуанидин, цианогуанидин,тиомочевину, тиоамид или амидин. В одном из вариантов осуществления изобретения, R2 может представлять собой: где каждый из R2a-R2c независимо представляет собой атом водорода или насыщенную или ненасыщенную алкильную, арильную или алкил 15 арильную группу, a R2d представляет собой атом водорода или насыщенную или ненасыщенную алкильную, арильную или алкиларильную группу, NR2eR2f или OR2g, где каждый из R2e-R2g независимо представляет собой атом водорода или насыщенную или ненасыщенную алкильную,арильную или алкиларильную группы. Альтернативно, R2a и R2b, взятые вместе, могут образовывать карбоциклическое или гетероциклическое кольцо, имеющее приблизительно 3-8 членов, например, циклопропильные, циклопентильные, циклогексильные группы. В одном из аспектов настоящего изобретения, R5 и R6 оба не являются метильными группами, а предпочтительно, один из R5 и R6 представляет собой алкильную группу, например,метильную группу, а другой представляет собой атом водорода. В другом аспекте настоящего изобретения,если R4 представляет собой 1-фенилэтил, a R1 представляет собой атом водорода, то R3 не является фенилом, 2-хлорфенилом, 3-хлорфенилом, 4-хлорфенилом, 3,4-дихлорфенилом, 3 метоксифенилом или 4-метоксифенилом, либо если R4 и R1 представляют собой 1-фенилэтил,то R3 не является атомом водорода, или если R4 представляет собой атом водорода, а R3 представляет собой фенил, то R1 не является фенилэтилом. В другом аспекте настоящего изобретения,если R5 и R6, взятые вместе, образуют карбоциклическое кольцо, например: пиримидо[4,5-6]индол, то R3 не является фенилом, а если R4 представляет собой 1-(4-метилфенил)этил, фенилизопропил, фенил или 1-фенилэтил или если R3 не является атомом водорода, то R4 представляет собой 1-фенилэтил. Карбоциклическое кольцо, образованное R5 иR6, может быть либо ароматическим, либо алифатическим, и может иметь от 4 до 12 атомов углерода, например, нафтил, фенилциклогексил,и т.п., а предпочтительно, от 5 до 7 атомов углерода, например, циклопентил или циклогексил. Альтернативно, R5 и R6, взятые вместе, могут образовывать гетероциклическое кольцо, такое как кольцо, описанное ниже. Обычными гетероциклическими кольцами являются кольца,имеющие от 4 до 12 атомов углерода, а предпочтительно, от 5 до 7 атомов углерода, и эти кольца могут быть либо ароматическими, либо алифатическими. Это гетероциклическое кольцо может быть, кроме того, замещенным, включая замещение одного или нескольких атомов углерода кольцевой структуры одним или несколькими гетероатомами. В еще одном аспекте настоящего изобретения, R1 и R2 образуют гетероциклическое кольцо. Характерными примерами являются, но 16 не ограничиваются ими, гетероциклические кольца, перечисленные ниже, такие как морфолино, пиперазин и т.п., например, 4-гидроксипиперидины, 4-аминопиперидины. Если R1 и R2,взятые вместе, образуют пиперазиногруппу, то R7 может представлять собой атом водорода или замещенную или незамещенную алкильную, арильную или алкиларильную группу. В еще одном аспекте настоящего изобретения, R4 и R5, взятые вместе, могут образовывать гетероциклическое кольцо, например: Гетероциклическое кольцо может быть либо ароматическим, либо алифатическим, и может образовывать кольцо, которое имеет от 4 до 12 атомов углерода, например, нафтил, фенилциклогексил и т.п., и может быть либо ароматическим, либо алифатическим, например, циклогексил, циклопентил. Гетероциклическое кольцо может быть, кроме того, замещенным, включая замещение атомов углерода кольцевой структуры одним или несколькими гетероатомами. Альтернативно, R4 и R5, взятые вместе, могут образовывать гетероциклическое кольцо, такое как кольцо, описанное ниже. В некоторых вариантах осуществления изобретения, N-6-замещенный 7-деазапурин не является N-6-бензил- или N-6-фенилэтилзамещенным. В других вариантах настоящего изобретения, R4 не является бензил- или фенилэтилзамещенным. В предпочтительных вариантах осуществления изобретения, R1 и R2 оба не являются атомами водорода. В еще одном предпочтительном варианте осуществления изобретения, R3 не является атомом водорода. Соединения настоящего изобретения могут содержать водорастворимые пролекарства,которые в результате метаболизма in vivo превращаются в активное лекарственное вещество,например, в результате гидролиза, катализируемого эстеразой. Примерами потенциальных пролекарств являются деазапурины, где, например, R2 представляет собой циклоалкил, замещенный -ОС(О)(Z)NH2, где Z представляет собой боковую цепь природной или неприродной аминокислоты или ее аналога, -, -, - или аминокислоты или дипептида. Предпочтительными боковыми цепями аминоксилот являются боковые цепи глицина, аланина, валина, лейцина, изолейцина, лизина, -метилаланина, аминоциклопропанкарбоновой кислоты, азетидин 2-карбоновой кислоты, -аланина, -аминомасляной кислоты, аланин-аланина или глициналанина. 17 В другом своем предпочтительном варианте, настоящее изобретение относится к диазапуринам формулы (I), гдеR2 представляет собой замещенный или незамещенный циклоалкил, замещенный или незамещенный алкил, либо R1 и R2, взятые вместе, образуют замещенное или незамещенное гетероциклическое кольцо;R3 представляет собой незамещенный или замещенный арил;R4 представляет собой водород и каждый из R5 и R6 независимо представляет собой водород или алкил; и их фармацевтически приемлемые соли. В этом варианте настоящего изобретения, указанные деазапурины могут быть селективными антагонистами рецептора А 3. В одном из вариантов настоящего изобретения, R2 представляет собой замещенный (например, гидроксизамещенный) или незамещенный циклоалкил. В предпочтительном подварианте, R1 и R4 представляют собой водород, R3 представляет собой незамещенный или замещенный фенил, а каждый из R5 и R6 представляет собой алкил. Предпочтительно, R2 представляет собой моногидроксициклопентил или моногидроксициклогексил. R2 также может быть замещен -NH-С(=O)Е, где Е представляет собой замещенный или незамещенный C1-С 4-алкилR1 и R2, взятые вместе, могут образовывать замещенное или незамещенное гетероциклическое кольцо, которое может быть замещено амином или ацетамидогруппой. В другом аспекте изобретения, R2 может быть -A-NHC(=O)B, где А представляет собой незамещенный С 1-С 4 алкил (например, этил,пропил, бутил), а В представляет собой замещенный или незамещенный С 1-С 4 алкил (например, метил, аминоалкил, например, аминометил или аминоэтил, алкиламино, например, метиламино, этиламино), а предпочтительно, если R1 иR4 представляют собой водород, то R3 представляет собой замещенный или незамещенный фенил, а каждый из R5 и R6 представляет собой алкил. "В" может быть замещенным или незамещенным циклоалкилом (например, циклопропилом или 1-аминоциклопропилом). В другом варианте настоящего изобретения, R3 может представлять собой замещенный или незамещенный фенил, а предпочтительно,каждый из R5 и R6 представляет собой алкил. Предпочтительно, R3 может иметь один или несколько заместителей (например, о-, м- или пхлорфенил, о-, м- или п-фторфенил).R3 может, преимущественно, представлять собой замещенный или незамещенный гетероарил, а предпочтительно, каждый из R5 и R6 представляет собой алкил. Примерами гетероарильных групп являются пиридил, пиримидил,пиридазинил, пиразинил, пирролил, триазолил, 003604 18 тиазолил, оксазолил, оксадиазолил, фуранил,метилендиоксифенил и тиофенил. R3, предпочтительно, представляет собой 2-пиридил, 3 пиридил, 4-пиридил, 2-пиримидил или 3 пиримидил. В одном из предпочтительных вариантов осуществления изобретения, каждый из R5 и R6 представляет собой водород. В другом варианте,каждый из R5 и R6 представляет собой метил. В особенно предпочтительном варианте,деазапуринами настоящего изобретения являются водорастворимые пролекарства, которые в результате метаболизма in vivo превращаются в активное лекарственное вещество, например, в результате гидролиза, катализируемого эстеразой. Предпочтительные пролекарства содержат группу R2, которая представляет собой циклоалкил, замещенный -ОС(О)(Z)NH2, где Z представляет собой боковую цепь природной или неприродной аминокислоты или ее аналога, -,-, - или -аминокислоты или дипептида. Предпочтительными боковыми цепями аминокислот являются боковые цепи глицина, аланина, валина, лейцина, изолейцина, лизина, метилаланина, аминоциклопропанкарбоновой кислоты, азетидин-2-карбоновой кислоты, аланина, -аминомасляной кислоты, аланиналанина или глициналанина. В особенно предпочтительном варианте, Z представляет собой боковую цепь глицина, R2 представляет собой циклогексил, R3 представляет собой фенил, a R5 и R6 представляют собой метил. В предпочтительном варианте осуществления настоящего изобретения, деазапурином является 4-(цис-3-гидроксициклопентил)амино 5,6-диметил-2-фенил-7 Н-пирроло[2,3d]пиримидин. В другом варианте осуществления настоящего изобретения, деазапурином является соль трифторуксусной кислоты и 4-(цис-3-(2-аминоацетокси)циклопентил)амино-5,6-диметил-2 фенил-7 Н-пирроло[2,3d]пиримидина. В другом варианте осуществления настоящего изобретения, деазапурином является 4-(3 ацетамидо)пиперидинил-5,6-диметил-2-фенил 7 Н-пирроло-[2,3d]пиримидин. В другом варианте осуществления настоящего изобретения, деазапурином является 4-(2N'-метилкарбомидопропил)амино-5,6-диметил 2-фенил-7 Н-пирроло[2,3d]пиримидин. В другом варианте осуществления настоящего изобретения, деазапурином является 4-(2 ацетамидобутил)амино-5,6-диметил-2-фенил 7 Н-пирроло[2,3d]-пиримидин. В другом варианте осуществления настоящего изобретения, деазапурином является 4-(2N'-метилкарбамидобутил)амино-5,6-диметил-2 фенил-7 Н-пирроло[2,3d]пиримидин. В другом варианте осуществления настоящего изобретения, деазапурином является 4-(2 19 аминоциклопропилацетамидоэтил)амино-2 фенил-7 Н-пирроло-[2,3d]пиримидин. В другом варианте осуществления настоящего изобретения, деазапурином является 4(транс-4-гидроксициклогексил)амино-2-(3 хлорфенил)-7 Н-пирроло[2,3d]пиримидин. В другом варианте осуществления настоящего изобретения, деазапурином является 4(транс-4-гидроксициклогексил)амино-2-(3 фторфенил)-7 Н-пирроло[2,3d]пиримидин. В другом варианте осуществления настоящего изобретения, деазапурином является 4(транс-4-гидроксициклогексил)амино-2-(4-пиридил)-7 Н-пирроло[2,3d]пиримидин. В еще одном варианте своего осуществления, настоящее изобретение относится к способу ингибирования активности аденозинового рецептора (например, A1, А 2A, А 3B или предпочтительно, А 3) в клетке путем контактирования этой клетки с N-6-замещенным 7-деазапурином(например, предпочтительно, с антагонистом аденозинового рецептора). В другом аспекте своего осуществления,настоящее изобретение относится к способу лечения поражения глаз у животного (например,у человека) путем введения этому животному эффективного количества N-6-замещенного 7 деазапурина. Предпочтительным N-6-замещенным 7-деазапурином является антагонист аденозиновых рецепторов А 3 в клетках животного. Указанным поражением глаз является поражение сетчатки или диска зрительного нерва, и это поражение может быть острым или хроническим. Указанное поражение может возникать в результате глаукомы, отека, ишемии, гипоксии или травмы. В предпочтительном варианте своего осуществления, настоящее изобретение относится к деазапурину, имеющему формулу II, см. выше,где Х представляет собой N или CR6; каждый из R1 и R2 независимо представляет собой водород или замещенный или незамещенный алкокси, аминоалкил, алкил, арил или алкиларил, либо, взятые вместе, они образуют замещенное или незамещенное гетероциклическое кольцо, при условии, что оба R1 и R2 не являются водородом;R3 представляет собой замещенный или незамещенный алкил, арилалкил или арил;R4 представляет собой водород или замещенный или незамещенный C1-С 6 алкил;L представляет собой водород, замещенный или незамещенный алкил, либо R4 и L, взятые вместе, образуют замещенное или незамещенное гетероциклическое или карбоциклическое кольцо;R6 представляет собой водород, замещенный или незамещенный алкил или галоген;Q представляет собой СН 2, О, S или NR7,где R7 представляет собой водород или замещенный или незамещенный C1-С 6 алкил иW представляет собой незамещенный или замещенный алкил, циклоалкил, алкинил, арил,арилалкил, биарил, гетероарил, замещенный карбонил, замещенный тиокарбонил или замещенный сульфонил; при условии, что если R3 представляет собой пирролидино, то R4 не является метилом. В одном из вариантов настоящего изобретения, в соединениях формулы II, X представляет собой CR6 и Q представляет собой CH2, О, S или NH. В другом варианте изобретения, Х представляет собой N. В другом варианте соединений формулыII, W представляет собой замещенный или незамещенный арил, 5- или 6-членный гетероарил или биарил. W может быть замещен одним или несколькими заместителями. Примерами заместителей являются: галоген, гидрокси, алкокси,амино, аминоалкил, аминокарбоксиамид, CN,СF3, CO2R8, CONHR8, CONR8R9, SOR8, SO2R8 иSО 2NR8R9, где каждый из R8 и R9 независимо представляет собой водород или замещенный или незамещенный алкил, циклоалкил, арил или арилалкил. Предпочтительно, W может представлять собой замещенный или незамещенный фенил, например, метилендиоксифенил. W также может представлять собой замещенное или незамещенное 5-членное гетероарильное кольцо, например, пиррол, пиразол, оксазол, имидазол, триазол, тетразол, фуран, тиофен, тиазол и оксадиазол. Предпочтительно, W может представлять собой 6-членное гетероарильное кольцо, например, пиридил, пиримидил, пиридазинил, пиразинил и тиофенил. В предпочтительном варианте осуществления изобретения, W представляет собой 2-пиридил, 3-пиридил, 4 пиридил, 2-пиримидил, 4-пиримидил или 5 пиримидил. В одном преимущественном варианте соединений формулы II, Q представляет собойNH, а W представляет собой 3-пиразольное кольцо, которое является незамещенным или Nзамещено замещенным или незамещенным алкилом, циклоалкилом, арилом или арилалкилом. В другом преимущественном варианте соединений формулы II, Q представляет собой кислород, а W представляет собой 2-тиазольное кольцо, которое является незамещенным или замещено замещенным или незамещенным алкилом, циклоалкилом, арилом или арилалкилом. В другом варианте соединений формулыII, W представляет собой замещенный или незамещенный алкил, циклоалкил, например, циклопентил или арилалкил. Примерами заместителей являются галоген, гидрокси, замещенный или незамещенный алкил, циклоалкил, арил арилалкил или NHR10, где R10 представляет собой водород, либо замещенный или незамещенный алкил, циклоалкил, арил или арилалкил. В еще одном варианте своего осуществления, настоящее изобретение относится к деазапурину формулы II, где W представляет собой-(CH2)a-C(=O)Y или -(CH2)a-C(=S)Y, где а равно целому числу от 0 до 3, Y представляет собой арил, алкил, арилалкил, циклоалкил, гетероарил,алкинил, NHR11R12, либо в случае, если Q представляет собой NH, то Y представляет собойOR13, и где каждый из R11, R12 и R13 независимо представляет собой водород или незамещенный или замещенный алкил, арил, арилалкил или циклоалкил. Y предпочтительно представляет собой 5- или 6-членное гетероарильное кольцо. Кроме того, W представляет собой -(СН 2)bS(=O)jY, где j равно 1 или 2, b равно 0, 1, 2 или 3, Y представляет собой арил, алкил, арилалкил,циклоалкил, алкинил, гетероарил, NHR14R15 или в случае, если b равно 1, Q представляет собой СН 2, и где каждый из R14, R15 и R16 независимо представляют собой водород или незамещенный или замещенный алкил, арил, арилалкил или циклоалкил. В другом варианте осуществления изобретения, R3 выбирают из группы, состоящей из замещенного и незамещенного фенила, пиридила, пиримидила, пиридазинила, пиразинила,пирролила, триазолила, тиазолила, оксазолила,оксадиазолила, пиразолила, фуранила, метилендиоксифенила и тиофенила. Если R3 представляет собой фенил, то он может быть замещен, например, гидроксилом, алкокси (например, метокси), алкилом (например, толилом) и галогеном (например, о-, м- или п-фторфенилом или о-, м- или п-хлорфенилом). R3 преимущественно может представлять собой 2-, 3- или 4 пиридил или 2- или 3-пиримидил. Настоящее изобретение также относится к деазапурину, где R6 представляет собой водород или C1-С 3 алкил. R6 предпочтительно представляет собой водород. Настоящее изобретение также относится к деазапуринам, где R1 представляет собой водород, a R2 представляет собой замещенный или незамещенный алкил или алкокси, замещенный или незамещенный алкиламин, ариламин или алкилариламин, замещенный или незамещенный аминоалкил, аминоарил или аминоалкиларил, замещенный или незамещенный алкиламид, ариламид или алкилариламид, замещенный или незамещенный алкилсульфонамид, арилсульфонамид или алкиларилсульфонамид, замещенную или незамещенную алкилмочевину,арилмочевину или алкиларилмочевину, замещенный или незамещенный алкилкарбамат,арилкарбамат или алкиларилкарбамат, либо замещенную или незамещенную алкилкарбоновую кислоту, арилкарбоновую кислоту или алкиларилкарбоновую кислоту. R2 предпочтительно представляет собой замещенный или незамещенный циклоалкил, например, моноили дигидроксизамещенный циклогексил или циклопентил (предпочтительно, моногидроксизамещенный циклогексил или моногидроксизамещенный циклопентил). Преимущественно, R2 может иметь фор где А представляет собой C1-С 6 алкил, С 3-С 7 циклоалкил, цепь из 1-7 атомов или кольцо из 37 атомов, необязательно замещенное C1-С 6 алкильной, галогеновой, гидроксильной, карбоксильной, тиоловой или аминогруппами; В представляет собой метил, N(Me)2,N(Et)2, NHMe, NHEt, (CH2)rNH3+, NН(СН 2)rСН 3,(CH2)rNH2, (CH2)rСНСН 3NH2, (СН 2)rNHМе,(CH2)rOH, CH2CN, (CH2)mCO2H, CHR18R19 или СНМеОН, где r означает целое число от 0 до 2,m равно 1 или 2, R18 представляет собой алкил,R19 представляет собой NН 3+ или СO2 Н, либоR18 и R19, взятые вместе, представляют собой где р равно 2 или 3 иR17 представляет собой C1-С 6 алкил, С 3-С 7 циклоалкил, цепь из 1-7 атомов или кольцо из 37 атомов, необязательно замещенное C1-С 6 алкильной, галогеновой, гидроксильной, карбоксильной, тиольной или аминогруппами."А" преимущественно представляет собой незамещенный или замещенный C1-С 6 алкил. "В" может представлять собой незамещенный или замещенный C1-С 6 алкил. В предпочтительном варианте осуществления изобретения, R2 представляет собой формулу -A-NHC(=O)B. В особенно предпочтительном варианте изобретения, А представляет собой -СН 2 СН 2-, а В представляет собой метил. Соединения настоящего изобретения могут содержать водорастворимые пролекарства,которые в результате метаболизма in vivo превращаются в активное лекарственное вещество,например, в результате гидролиза, катализируемого эстеразой. Примерами потенциальных пролекарств являются деазапурины, где, например, R2 представляет собой циклоалкил, замещенный -ОС(О)(Z)NH2, где Z представляет собой боковую цепь природной или неприродной аминокислоты или ее аналога, -, -, - или аминокислоты или дипептида. Предпочтительными боковыми цепями аминоксилот являются боковые цепи глицина, аланина, валина, лейцина, изолейцина, лизина, -метилаланина, аминоциклопропанкарбоновой кислоты, азетидин 2-карбоновой кислоты, -аланина, -аминомасляной кислоты, аланин-аланина или глициналанина. В другом варианте осуществления изобретения, R1 и R2, взятые вместе, представляют собой: где n равно 1 или 2 и где указанное кольцо может быть, но не обязательно, замещено одной 23 или несколькими гидроксильной, амино, тиольной, карбоксильной, галогеновой, СН 2 ОН,СН 2NНС(=O)-алкильной или CH2NHC(=O)NHалкильной группами. В одном из предпочтительных вариантов осуществления изобретения, R1 представляет собой водород, R2 представляет собой замещенный или незамещенный C1-С 6 алкил, R3 представляет собой замещенный или незамещенный фенил, R4 представляет собой водород, L представляет собой водород или замещенный или незамещенный C1-С 6 алкил, Q представляет собой О, S или NR7, где R7 представляет собой водород или замещенный или незамещенныйC1-С 6 алкил, a W представляет собой замещенный или незамещенный арил. R2 предпочтительно представляет собой -A-NHC(=O)B, где каждый из А и В независимо представляет собой незамещенный или замещенный C1-C4 алкил. Так, например, А может представлять собой CH2CH2. В может представлять собой,например, алкил (например, метил) или аминоалкил (например, аминометил). R3 предпочтительно представляет собой незамещенный фенил, a L представляет собой водород. R6 может представлять собой метил или, предпочтительно, водород. Q предпочтительно представляет собой О, S или NR7, где R7 представляет собой водород или замещенный или незамещенныйC1-С 6 алкил, например, метил. W представляет собой незамещенный или замещенный фенилW также может представлять собой гетероарил,например, 2-пиридил. В особенно предпочтительном варианте осуществления изобретения, указанным деазапурином является 4-(2-ацетиламиноэтил)амино-6-феноксиметил-2-фенил-7 Н-пирроло[2,3d]пиримидин. В особенно предпочтительном варианте осуществления изобретения, указанным деазапурином является 4-(2-ацетиламиноэтил)амино-6-(4-фторфенокси)метил-2-фенил-7 Н-пирроло[2,3d]пиримидин. В особенно предпочтительном варианте осуществления изобретения, указанным деазапурином является 4-(2-ацетиламиноэтил)амино-6-(4-хлорфенокси)метил-2-фенил-7 Н-пирроло[2,3d]пиримидин. В особенно предпочтительном варианте осуществления изобретения, указанным деазапурином является 4-(2-ацетиламиноэтил)амино 6-(4-метоксифенокси)метил-2-фенил-7 Н-пирроло[2,3d]пиримидин. В особенно предпочтительном варианте осуществления изобретения, указанным деазапурином является 4-(2-ацетиламиноэтил)амино-6-(2-пиридилокси)метил-2-фенил-7 Н-пирроло[2,3d]пиримидин. 24 В особенно предпочтительном варианте осуществления изобретения, указанным деазапурином является 4-(2-ацетиламиноэтил)амино-6-(N-фениламино)метил-2-фенил-7 Н-пирроло[2,3d]пиримидин. В особенно предпочтительном варианте осуществления изобретения, указанным деазапурином является 4-(2-ацетиламиноэтил)амино 6-(N-метил-N-фениламино)метил-2-фенил-7 Нпирроло[2,3d]пиримидин. В особенно предпочтительном варианте осуществления изобретения, указанным деазапурином является 4-(2-N'-метилкарбамидоэтил) амино-6-феноксиметил-2-фенил-7 Н-пирроло[2,3d]пиримидин. Настоящее изобретение также относится к способу ингибирования активности аденозинового рецептора (например, аденозинового рецептора А 2b) в клетках путем контактирования указанной клетки с соединением настоящего изобретения. Предпочтительным соединением является антагонист рецептора. Настоящее изобретение также относится к способу лечения желудочно-кишечного заболевания (например, диареи) у животного путем введения этому животному эффективного количества соединения настоящего изобретения (например, антагониста А 2b). Предпочтительным животным является человек. В другом варианте своего осуществления,настоящее изобретение относится к композиции, содержащей N-6-замещенный 7-деазапурин настоящего изобретения и фармацевтически приемлемый носитель. Настоящее изобретение относится к способу лечения состояния, отвечающего за N-6 замещенный 7-деазапурин, у животного, путем введения млекопитающему терапевтически эффективного количества деазапурина настоящего изобретения, необходимого для лечения состояния, отвечающего на N-6-замещенный 7 деазапурин у животного. Указанным патологическим состоянием преимущественно может быть заболевание, опосредованное аденозином. Предпочтительными примерами патологических состояний являются: заболевания центральной нервной системы, сердечно-сосудистые заболевания, почечные заболевания,воспалительные заболевания, аллергические заболевания, желудочно-кишечные заболевания,глазные болезни и респираторные заболевания. Термин "алкил" означает радикал насыщенных алифатических групп, включая алкильные группы с прямой цепью, алкильные группы с разветвленной цепью, циклоалкильные (алициклические) группы, алкилзамещенные циклоалкильные группы и циклоалкилзамещенные алкильные группы. Термин "алкил", кроме того,означает алкильные группы, которые могут,кроме того, включать атомы кислорода, азота,серы или фосфора, заменяющие один или несколько атомов углерода углеводородного осто 25 ва, например, атомы кислорода, азота, серы или фосфора. В предпочтительных вариантах осуществления изобретения, алкил с прямой или разветвленной цепью имеет 30 или менее атомов углерода на своем остове (например, C1-С 30 для прямой цепи, С 3-С 30 для разветвленной цепи) и более предпочтительно, 20 атомов углерода или менее. Аналогично, предпочтительные циклоалкилы имеют от 4 до 10 атомов углерода на своей кольцевой структуре, а более предпочтительно, 5, 6 или 7 атомов углерода на кольцевой структуре. Более того, термин "алкил", используемый в описании и в формуле изобретения, включает как "незамещенные алкилы", так и "замещенные алкилы", где указанные замещенные алкилы означают алкильные группы, имеющие заместителей, заменяющие водород на одном или нескольких атомах углерода углеводородного остова. Такими заместителями могут быть, например, галоген, гидроксильная, алкилкарбонилокси-, арилкарбонилокси-, алкоксикарбонилокси-, арилоксикарбонилокси-, карбоксилатная, алкилкарбонильная, алкоксикарбонильная,аминокарбонильная,алкилтиокарбонильная,алкоксильная, фосфатная, фосфонато-, фосфинато-, циано-, амино- (включая алкиламино-,диалкиламино-, ариламино-, диариламино- и алкилариламино-), ациламино- (включая алкилкарбониламино-, арилкарбониламино-, карбамоильную и уреидо-), амидино-, имино-, сульфгидрильная, алкилтио-, арилтио-, тиокарбоксилатная, сульфатная, сульфонато-, сульфамоильная, сульфонамидо-, нитро-, трифторметильная,циано-, азидо-, гетероциклильная, алкиларильная, либо ароматическая или гетероароматическая группы. Следует отметить, что эти группы,замещенные на углеводородной цепи, сами могут быть замещены, если это необходимо. Циклоалкилы могут быть, кроме того, замещены,например, заместителями, описанными выше. Термин "алкиларильная" группа означает алкил,замещенный арилом (например, фенилметилом(бензилом. Термин "алкил" также означает ненасыщенные алифатические группы, которые имеют длину и возможные заместители, аналогичные алкилам, описанным выше, но которые содержат, по крайней мере, одну двойную или тройную связь, соответственно. Используемый здесь термин "арил" означает радикал арильных групп, включая 5- и 6 членные ароматические группы с одним кольцом, которые могут иметь от 0 до 4 гетероатомов, например, бензол, пиррол, фуран, тиофен,имидазол, бензоксазол, бензотиазол, триазол,тетразол, пиразол, пиридин, пиразин, пиридазин и пиримидин и т.п. Арильными группами также являются полициклические конденсированные ароматические группы, такие как нафтил, хинолил, индолил и т.п. Эти арильные группы,имеющие гетероатомы на своей кольцевой структуре, могут быть также названы "ариль 003604"гетероароматическими группами". Это ароматическое кольцо может быть замещено в одном или нескольких положениях кольца заместителями, описанными выше, например, такими как галоген, гидроксильная, алкокси, алкилкарбонилокси-, арилкарбонилокси-, алкоксикарбонилокси-, арилоксикарбонилокси-, карбоксилатная, алкилкарбонильная, алкоксикарбонильная,аминокарбонильная,алкилтиокарбонильная,фосфатная, фосфонато-, фосфинато-, циано-,амино- (включая алкиламино-, диалкиламино-,ариламино-, диариламино- и алкилариламино-),ациламино- (включая алкилкарбониламино-,арилкарбониламино-, карбамоильную и уреидо-),амидино-, имино-, сульфгидрильная, алкилтио-,арилтио-, тиокарбоксилатная, сульфатная, сульфонато-, сульфамоильная, сульфонамидо-, нитро-, трифторметильная, циано-, азидо-, гетероциклильная, алкиларильная либо ароматическая или гетероароматическая группы. Арильные группы могут быть также конденсированы или соединены мостиковой связью с алициклическими или гетероциклическими кольцами, которые не являются ароматическими, так чтобы образовывался полицикл (например, тетралин). Термины "алкенил" и "алкинил" означают ненасыщенные алифатические группы, которые имеют длину и возможные заместители, аналогичные алкилам, описанным выше, но которые содержат, по крайней мере, одну двойную или тройную связь, соответственно. Так, например,в настоящем изобретении рассматриваются циано- и пропаргильные группы. Что касается числа атомов углерода, то используемый здесь термин "низший алкил", если это не оговорено особо, означает алкильную группу, определенную выше, но имеющую от одного до десяти атомов углерода, более предпочтительно, от одного до шести атомов углерода на своей каркасной структуре, и даже более предпочтительно, от одного до трех атомов углерода на своей каркасной структуре. Подобно этому, "низший алкенил" и "низший алкинил" имеют аналогичные длины цепей. Термины "алкоксиалкил", "полиаминоалкил" и "тиоалкоксиалкил" означают алкильные группы, описанные выше, которые, кроме того,включают атомы кислорода, азота или серы,заменяющие один или несколько атомов углерода углеводородного остова, например, атомы кислорода, азота или серы. Термины "полициклил" или "полициклический радикал" означают радикал из двух или более циклических колец (например, циклоалкилов, циклоалкенилов, циклоалкинилов, арилов и/или гетероциклилов), где два сопряженные кольца имеют общие два или более атомов углерода, например, эти кольца называются 27 полицикла могут быть замещены заместителями, описанными выше, такими как, например,галоген, гидроксильная, алкилкарбонилокси-,арилкарбонилокси-,алкоксикарбонилокси-,арилоксикарбонилокси-, карбоксилатная, алкилкарбонильная, алкоксикарбонильная, аминокарбонильная, алкилтиокарбонильная, алкоксильная, фосфатная, фосфонато-, фосфинато-,циано-, амино- (включая алкиламино-, диалкиламино-, ариламино-, диариламино- и алкилариламино), ациламино- (включая алкилкарбониламино-, арилкарбониламино-, карбамоильную и уреидо-), амидино-, имино-, сульфгидрильная,алкилтио-,арилтио-,тиокарбоксилатная, сульфатная, сульфонато, сульфамоильная, сульфонамидо-, нитро-, трифторметильная, циано, азидо-, гетероциклильная, алкильная, алкиларильная, либо ароматическая или гетероароматическая группы. Используемый здесь термин "гетероатом" означает атом любого элемента кроме углерода или водорода. Предпочтительными гетероатомами являются атомы азота, кислорода, серы и фосфора. Термин "аминокислоты" означает природные и неприродные аминокислоты, обнаруженные в белках, например, глицин, аланин, валин,цистеин, лейцин, изолейцин, серин, треонин,метионин, глутаминовая кислота, аспарагиновая кислота, глутамин, аспарагин, лизин, аргинин,пролин, гистидин, фенилаланин, тирозин и триптофан. Аминокислотными аналогами являются аминокислоты с удлиненными или укороченными боковыми цепями или с модифицированными боковыми цепями с соответствующими функциональными группами. Аминокислотами также являются D- и L-стереоизомеры аминокислоты, если структура этой аминокислоты позволяет образовывать такие стереоизомерные формы. Термин "дипептид" означает две или более аминокислот, присоединенных друг к другу. Предпочтительными дипептидами являются две аминокислоты, соединенные пептидной связью. Особенно предпочтительными дипептидами являются, например, аланиналанин и глицин-аланин. Следует отметить, что структура некоторых соединений этого изобретения включает асимметрические атомы углерода. Следует также отметить, что в объем настоящего изобретения, если это не оговорено особо, входят изомеры, образующиеся в результате такой асимметрии (например, все энантиомеры и диастереомеры). Такие изомеры могут быть получены, в основном, в чистом виде классическими методами разделения и стереохимически регулируемого синтеза. Настоящее изобретение относится к фармацевтическим композициям для лечения состояний, отвечающих на N-6-замещенный 7 деазапурин у млекопитающих, например, респираторных заболеваний (например, астмы, 003604 28 бронхита, хронической обструктивной болезни легких и аллергического ринита), почечных заболеваний, желудочно-кишечных заболеваний и глазных болезней. Эта фармацевтическая композиция включает терапевтически эффективное количество N-6-замещенного 7-деазапурина,описанного выше, и фармацевтически приемлемый носитель. Следует отметить, что все деазапурины, описанные выше, предназначены для терапевтического лечения. Кроме того, следует отметить, что деазапурины настоящего изобретения могут быть использованы как отдельно,так и в комбинации с другими деазапуринами настоящего изобретения, либо в комбинации со вспомогательными терапевтическими соединениями, такими как, например, антибиотики,противовоспалительные средства или противораковые средства. Термин "антибиотик" понятен специалисту и означает вещества, продуцируемые путем культивирования микроорганизмов, и их синтетические производные, которые предотвращают или ингибируют рост патогенов и обладают избирательной токсичностью по отношению к патогенам, но которые, при этом, оказывают минимальное воздействие или не оказывают негативного воздействия на организм инфицированного хозяина. Подходящими примерами антибиотиков являются, но не ограничиваются ими, основные классы аминогликозидов, цефалоспоринов, хлорамфениколов, фусидных кислот, макролидов, пенициллинов, полимиксинов, тетрациклинов и стрептомицинов. Термин "противовоспалительное средство" понятен специалистам и означает агенты, действующие на определенные механизмы в организме хозяина без какого-либо прямого антагонизирующего действия на этиологический фактор воспаления, такие как глюкокортикостероиды, аспирин, ибупрофен, НСПВС и т.п. Термин "противораковое средство" понятен специалисту и означает агенты, которые способствуют уменьшению или уничтожению опухоли или предупреждению роста раковых клеток, предпочтительно, не оказывая неблагоприятного действия на другие физиологические функции. Характерными примерами являются цисплатин и циклофосфамид. Если соединения настоящего изобретения вводят в виде фармацевтических препаратов человеку или млекопитающему, то они могут быть введены как таковые, либо в виде фармацевтической композиции, содержащей, например, 0,1-99,5% (более предпочтительно 0,5-90%) активного ингредиента в комбинации с фармацевтически приемлемым носителем. Используемый здесь термин "фармацевтически приемлемый носитель" означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, носитель, растворитель или инкапсулирующий материал, обеспе 29 чивающий доставку или транспорт соединения(й) настоящего изобретения в данный участок или к данному участку организма, так, чтобы он мог осуществлять нужную функцию. В основном, такие соединения переносятся или транспортируются от одного органа или части тела к другому органу или части тела. Каждый носитель должен быть "приемлемым" в том смысле, что он должен быть совместимым с другими ингредиентами данной композиции и не должен оказывать негативного воздействия на пациента. Некоторыми примерами материалов, которые могут служить в качестве фармацевтически приемлемых носителей, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрийсодержащая карбоксиметилцеллюлоза, этилцеллюлоза и ацетатцеллюлозы; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как масло-какао и воски для суппозиториев; масла, такие как арахисовое масло, масло семян хлопчатника,сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический физиологический раствор; раствор Рингера; этиловый спирт; фосфатно-буферные растворы и другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях. Как описано выше, некоторые варианты соединений настоящего изобретения могут включать основную функциональную группу,такую как амино или алкиламино, а поэтому они способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми кислотами. Термин "фармацевтически приемлемые соли" в этом аспекте означает относительно нетоксичные аддитивные соли соединений настоящего изобретения, образованные неорганическими или органическими кислотами. Эти соли могут быть получены in situ в процессе конечного выделения и очистки соединений настоящего изобретения, либо посредством отдельной реакции очищенного соединения настоящего изобретения в его свободной основной форме с подходящей органической или неорганической кислотой и выделения полученной таким образом соли. Характерными солями являются гидробромид, гидрохлорид,сульфат, бисульфат, фосфат, нитрат, ацетат,валерат, олеат, пальмитат, стеарат, лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат,фумарат, сукцинат, тартрат, нафтилат, мезилат,глюкогептонат,лактобионат и лаурилсульфонат и т.п. (См. например, Berge et al.(1977) "Pharmaceutical Salts", J.Pharm. Sci. 66:119). В других случаях, соединения настоящего изобретения могут содержать одну или несколько кислотных функциональных групп и таким образом, они обладают способностью образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми основаниями. В этих случаях, термин "фармацевтически приемлемые соли" означает относительно нетоксичные аддитивные соли соединений настоящего изобретения, образованные с неорганическими или органическими основаниями. Эти соли могут быть получены in situ в процессе конечного выделения и очистки соединений настоящего изобретения, либо посредством отдельной реакции очищенного соединения настоящего изобретения в его свободной кислотной форме с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, с аммиаком или с фармацевтически приемлемым органическим первичным, вторичным или третичным амином. Характерными солями щелочных или щелочно-земельных металлов являются соли лития, натрия, калия, кальция, магния,алюминия и т.п. Характерными органическими аминами, которые могут быть использованы для образования основно-аддивных солей являются этиламин, диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин и т.п. Термин "фармацевтически приемлемые сложные эфиры" означает относительно нетоксичные этерифицированные продукты соединений настоящего изобретения. Эти сложные эфиры могут быть получены in situ в процессе конечного выделения и очистки соединений настоящего изобретения, либо посредством отдельной реакции очищенного соединения настоящего изобретения в его свободной кислотной форме или в форме гидроксила с подходящим этерифицирующим агентом. Карбоновые кислоты могут быть превращены в сложные эфиры путем обработки спиртом в присутствии катализатора. Гидроксилсодержащие производные могут быть превращены в сложные эфиры путем обработки этерифицирующим агентом,таким как алканоилгалогениды. Этот термин,кроме того, означает низшие углеводородные группы, способные подвергаться сольватации в физиологических условиях, например, алкиловые сложные эфиры, метиловые, этиловые и пропиловые сложные эфиры (см., например,Berge et al., см. выше). В настоящем изобретении, кроме того,рассматривается использование пролекарств,которые превращаются in viva в терапевтические соединения настоящего изобретения (см.,например, R.B.Silverman, 1992, "The OrganicChemistry of Drug Design and Drug Action", Academic Press, Chp.8). Такие пролекарства могут быть использованы для модификации биологи 31 ческого распределения (например, соединений,которые обычно не должны входить в реакционный сайт протеазы) или фармакокинетики терапевтического соединения. Так, например,карбоновокислотная группа может быть этерифицирована, например, метильной группой или этильной группой с образованием сложного эфира. При введении этого сложного эфира индивидууму, указанный сложный эфир подвергается ферментативному или неферментативному,восстановительному или гидролитическому расщеплению с образованием анионной группы. Анионная группа может быть этерифицирована группами (например, ацилоксиметиловыми сложными эфирами), отщепляемыми с образованием промежуточного соединения, которое затем разлагается с образованием активного соединения. В другом варианте осуществления изобретения, указанное пролекарство представляет собой восстановленную форму сульфата или сульфоната, например, тиол, который окисляется in vivo с образованием терапевтического соединения. Кроме того, анионная группа может быть этерифицирована с образованием группы,которая активно транспортируется in vivo, или которая избирательно поглощается органамимишенями. Этот сложный эфир может быть выбран так, чтобы он обеспечивал специфическую доставку терапевтических молекул в конкретные реакционные сайты, описанные ниже для молекул носителя. В этих композициях могут также присутствовать смачивающие агенты, эмульгаторы и замасливатели, такие как лаурилсульфат натрия и стеарат магния, а также красители, высвобождающие агенты, агенты для нанесения покрытия, подсластители, отдушки и ароматизаторы,консерванты и антиоксиданты. Примерами фармацевтически приемлемых антиоксидантов являются: водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия,метабисульфат натрия, сульфит натрия и т.п.; растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфатокоферол и т.п.; и агенты, образующие хелатные комплексы с металлами, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и т.п. Композициями настоящего изобретения являются композиции, подходящие для перорального, назального, местного, чрескожного,трансбуккального, подъязычного, ректального,вагинального и/или парентерального введения. Эти композиции могут, в основном, присутствовать в виде разовой лекарственной формы и могут быть получены любыми методами, хорошо известными специалистам-фармацевтам. Количеством активного ингредиента, которое 32 может быть объединено с материаломносителем с получением разовой дозы, обычно является такое количество соединения, которое необходимо для достижения терапевтического эффекта. В основном, исходя из массы всей композиции, составляющей 100%, это количество составляет в пределах от около 1% до около 99% активного ингредиента, предпочтительно, от около 5% до около 70%, а наиболее предпочтительно, от около 10% до около 30% активного ингредиента. Способы получения этих фармацевтических препаратов или композиций включают стадии объединения соединения настоящего изобретения с указанным носителем и, необязательно, с одним или несколькими дополнительными ингредиентами. В основном, эти композиции получают путем однородного и равномерного смешивания соединения настоящего изобретения с жидкими носителями или с тонкодисперсными твердыми носителями, либо с теми и другими носителями, и, если это необходимо, с последующим приданием нужной формы этому продукту. Композиции настоящего изобретения,подходящие для перорального введения, могут быть изготовлены в форме капсул, облаток,драже, таблеток, пастилок (с использованием ароматизирующей основы, обычно, сахарозы,аравийской камеди или трагакантовой камеди),порошков, гранул, либо в виде раствора или суспензии в водной и безводной жидкости, либо в виде жидкой эмульсии типа "масло в воде" или "вода в масле", либо в виде эликсира или сиропа, либо в виде пастилок (с использованием инертной основы, такой как желатин и глицерин или сахароза и аравийская камедь) и/или в виде жидкости для полоскания рта и т.п., каждая из которых содержит предварительно определенное количество соединения настоящего изобретения в качестве активного ингредиента. Соединение настоящего изобретения может быть также введено в виде болюса, лекарственной кашки или пасты. В твердых лекарственных формах настоящего изобретения для перорального введения(капсулах, таблетках, пилюлях, драже, порошках, гранулах и т.п.), активный ингредиент смешивают с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или дикальцийфосфат, и/или с любым из следующих носителей или добавок,таких как крахмалы, лактоза, сахароза, глюкоза,маннит и/или кремниевая кислота; связующие,такие как, например, карбоксиметилцеллюлоза,альгинаты, желатин, поливинилпирролидон,сахароза и/или аравийская камедь; увлажнители, такие как глицерин; дезинтегрирующие агенты, такие как агар-агар, карбонат кальция,картофельный крахмал или крахмал тапиоки,альгиновая кислота, некоторые силикаты и карбонат натрия; ингибиторы растворения, такие 33 как парафин; ускорители абсорбции, такие как соединения четвертичного аммония; смачивающие агенты, такие как, например, цетиловый спирт и моностеарат глицерина; абсорбенты,такие как каолиновая и бентонитовая глины; замасливатели, такие как тальк, стеарат кальция,стеарат магния, твердые полиэтиленгликоли,лаурилсульфат натрия и их смеси; и красители. В случае капсул, таблеток и драже, фармацевтические композиции могут также содержать забуферивающие агенты. Твердые композиции аналогичного типа могут быть также введены в качестве наполнителей в мягкие и жесткие желатиновые капсулы с использованием таких носителей, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п. Таблетки могут быть изготовлены путем прессования или формования, необязательно, с одним или несколькими вспомогательными ингредиентами. Спрессованные таблетки могут быть получены с использованием связующего(например, желатина или гидроксипропилметилцеллюлозы), замасливателя, инертного разбавителя, консерванта, дезинтегрирующего агента (например, натрийсодержащего гликолята крахмала или структурированной натрийсодержащей карбоксиметилцеллюлозы), поверхностно-активного вещества или диспергирующего агента. Сформованные таблетки могут быть изготовлены путем формования смеси порошкообразного соединения, увлажненной инертным жидким разбавителем, в соответствующем устройстве. Таблетки и другие твердые лекарственные формы фармацевтических композиций настоящего изобретения, такие как драже, капсулы,пилюли и гранулы, могут быть, но не обязательно, сделаны с насечками, или на них могут быть нанесены покрытия и оболочки, такие как солюбилизированные покрытия и другие покрытия, хорошо известные специалистамфармацевтам. Для медленного или регулируемого высвобождения активного ингредиента настоящего изобретения, эти композиции могут быть также изготовлены, например, с использованием гидроксипропилметилцеллюлозы в различных соотношениях с получением нужного профиля высвобождения, других полимерных матриц, липосом и/или микросфер. Они могут быть стерилизованы, например, путем фильтрации через удерживающий бактерии фильтр, или путем введения стерилизующих агентов в форме стерильных твердых композиций, которые,непосредственно перед их использованием, могут быть растворены в стерильной воде или в некоторой другой стерильной среде для инъекций. Эти композиции могут быть также, но необязательно, содержать агенты, придающие непрозрачность, и они могут быть изготовлены в виде композиций, которые высвобождают активный(е) ингредиент(ы) только, или предпоч 003604 34 тительно, в определенной области желудочнокишечного тракта, необязательно в пролонгированном режиме. Примерами инкапсулированных композиций, которые могут быть использованы, являются полимерные вещества и воски. Активный ингредиент может также присутствовать в микроинкапсулированной форме, если это необходимо, в сочетании с одним или несколькими из вышеуказанных наполнителей. Жидкими лекарственными формами для перорального введения соединений настоящего изобретения являются фармацевтически приемлемые эмульсии, микроэмульсии, растворы,суспензии, сиропы и эликсиры. Помимо активного ингредиента, жидкие лекарственные формы могут содержать инертные разбавители,обычно используемые специалистами, такие как, например, вода и другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт,этилкарбонат, этилацетат, бензиловый спирт,бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, масло из семян хлопчатника, арахисовое масло, кукурузное масло, масло зародышей семян, оливковое масло, касторовое масло и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, и их смеси. Помимо инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие агенты,эмульгирующие и суспендирующие агенты,подслащивающие агенты, ароматизаторы, красители, отдушки и консерванты. Суспензии, помимо активных соединений,могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит,агар-агар и трагакант и их смеси. Препараты фармацевтических композиций настоящего изобретения для ректального или вагинального введения могут быть изготовлены в форме суппозиториев, которые могут быть получены путем смешивания одного или нескольких соединений настоящего изобретения с одним или несколькими подходящими нераздражающими наполнителями или носителями, содержащими, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, и которые являются твердыми при комнатной температуре, и жидкими при температуре тела, а следовательно, они будут расплавляться в прямой кишке и во влагалище с высвобождением активного соединения. Препаратами настоящего изобретения,подходящими для вагинального введения, также являются пессарии, тампоны, кремы, гели, пасты, пены или спреи, содержащие указанные но 35 сители, и такие препараты хорошо известны специалистам. Лекарственными формами для местного или чрескожного введения соединения настоящего изобретения являются порошки, спреи,мази, пасты, кремы, лосьоны, гели, растворы,пластыри и ингаляторы. Активное соединение может быть смешано в стерильных условиях с фармацевтически приемлемым носителем и с любыми необходимыми консервантами, буферами или пропеллентами. Мази, пасты, кремы и гели, помимо активного соединения настоящего изобретения, могут содержать наполнители, такие как животные и растительные жиры, масла, воски, парафины,крахмал, трагакантовую камедь, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и окись цинка или их смеси. Порошки и спреи, помимо соединения настоящего изобретения, могут содержать наполнители, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси этих веществ. Спреи могут, кроме того, содержать стандартные пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Пластыри для чрескожного введения имеют дополнительные преимущества, заключающиеся в том, что они обеспечивают регулируемую доставку соединения настоящего изобретения в организм. Такие лекарственные формы могут быть изготовлены путем растворения или диспергирования этого соединения в подходящей среде. Для увеличения скорости прохождения данного соединения через кожу могут быть также использованы усилители абсорбции. Скорость такого прохождения может регулироваться либо путем использования скоростьрегулирующей мембраны, либо путем диспергирования активного соединения в полимерной матрице или геле. Офтальмические препараты, глазные мази,порошки, растворы и т.п. также входят в объем настоящего изобретения. Таким фармацевтическим препаратом, предпочтительно, является офтальмическая готовая препаративная форма(например, готовая препаративная форма для инъекций в окологлазную, ретробульбарную или внутриглазную область, готовая препаративная форма для системного введения или хирургический раствор для промывания). Офтальмические композиции настоящего изобретения могут включать один или несколько деазапуринов и фармацевтически приемлемый носитель. При этом, могут быть использованы различные типы носителей. Эти носители,по своей природе, обычно являются водными. В основном, предпочтительными являются водные растворы, полученные на основе композиции, а также с тем расчетом, чтобы эти компо 003604 36 зиции можно было легко закапывать пациенту по одной или две капли в пораженные глаза. Однако деазапурины настоящего изобретения могут быть также легко введены в композиции других типов, таких как суспензии, вязкие или полувязкие гели, либо твердые или полутвердые композиции других типов. Офтальмические композиции настоящего изобретения могут также включать другие различные ингредиенты,такие как буферы, консерванты, сорастворители и агенты, придающие вязкость. Для предупреждения изменения рН в условиях хранения, могут быть добавлены соответствующие буферные системы (например,фосфат натрия, ацетат натрия или борат натрия). Офтальмические продукты обычно упаковывают в упаковки для многоразового использования. А поэтому, для предупреждения микробного заражения в процессе использования,необходимо добавлять консерванты. Подходящими консервантами являются хлорид бензалкония, тимерозал, хлорбутанол, метилпарабен,пропилпарабен, фенилэтиловый спирт, динатрийэдетат, сорбиновая кислота, поликватерний 1 или другие агенты, известные специалистам. Такие консерванты обычно используются в количестве от около 0,001 до 1,0% мас./об.("% мас./об."). Если деазапурины настоящего изобретения вводят в процессе внутриглазных хирургических операций, таких как инъекция в ретробульбарную или окологлазную область и перфузия или инъекция во внутриглазную область, то, в качестве носителей, наиболее предпочтительным является использование сбалансированных физиологических растворов для промывания. Примерами сбалансированных физиологических растворов для промывания являются стерильные промывочные растворыBSS Plus для внутриглазного введения (AlconLaboratories, Inc., Fort Worth, Тех.USA). Последний из указанных типов растворов описан в патенте США 4550022 (Garabedian, et al.), полное содержание которого вводится в настоящее описание посредством ссылки. Инъекции в ретробульбарную и окологлазную области известны каждому специалисту и описаны во многих публикациях, включая, например, OphthalmicW.B. Sanders Co., Philadelphia, Pa., USA, pages 85-87 (1990). Как указано выше, использование деазапуринов для предупреждения или снижения поражения тканей сетчатки и диска зрительного нерва на клеточном уровне является наиболее важным аспектом одного из вариантов осуществления настоящего изобретения. Глазными болезнями, которые могут быть подвергнуты лечению, являются, но не ограничиваются ими, ретинопатия, дегенерация желтого пятна, ишемия глаза, глаукома и поражения, ассоциированные 37 с повреждениями глазных тканей, такие как повреждения в результате реперфузии при ишемии, фотохимические повреждения и повреждения, ассоциированные с хирургией глаза, а в частности, повреждения сетчатки или диска зрительного нерва под действием светового излучения или хирургических инструментов. Эти соединения могут быть также использованы в качестве вспомогательного средства для хирургии глаза, такой как инъекция в стекловидное тело или в субконъюктиву глаза после хирургии глаза. Эти соединения могут быть использованы для экспресс-лечения преходящих состояний,либо они могут вводиться непрерывно при дегенеративных заболеваниях. Эти соединения могут быть также использованы в профилактических целях, а в частности, перед проведением хирургической операции на глазах или неинвазивных офтальмических процедурах или хирургии других типов. Фармацевтические композиции настоящего изобретения, подходящие для парентерального введения, содержат одно или более соединений настоящего изобретения в комбинации с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или безводными растворами, дисперсиями, суспензиями или эмульсиями, или со стерильными порошками, которые, непосредственно перед их использованием, могут быть превращены в стерильные растворы или дисперсии для инъекций, и которые могут содержать антиоксиданты, буферы, бактериостаты, растворенные вещества, которые придают им изотоничность по отношению к крови данного реципиента, или суспендирующие или загущающие агенты. Примерами подходящих водных или безводных носителей, которые могут быть использованы в фармацевтических композициях настоящего изобретения, является вода, этанол,полиолы (такие как глицерин, пропиленгликоль,полиэтиленгликоль и т.п.), и их подходящие смеси, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. При этом, может поддерживаться соответствующая текучесть,например, путем использования материалов для покрытия, таких как лецитин, путем поддержания нужного размера частиц в случае дисперсий и путем использования поверхностно-активных веществ. Эти композиции могут также содержать адъюванты, такие как консерванты, смачивающие агенты, эмульгирующие агенты и диспергирующие агенты. Для предохранения от действия микроорганизмов, в композиции могут быть включены различные антибактериальные и противогрибковые агенты, например, парабен,хлорбутанол, фенолсорбиновая кислота и т.п. Может также оказаться желательным включить в данные композиции изотонические агенты, 003604 38 такие как сахара, хлорид натрия и т.п. Кроме того, пролонгированная абсорбция инъецируемой фармацевтической формы может быть достигнута благодаря включению агентов, обеспечивающих замедленную абсорбцию, таких как моностеарат алюминия и желатин. В некоторых случаях, для достижения пролонгированного действия лекарственного средства, желательно замедлить абсорбцию лекарственного средства после подкожной или внутримышечной инъекции. Это может быть осуществлено благодаря использованию жидкой суспензии кристаллического или аморфного материала, имеющего плохую растворимость в воде. Следовательно, скорость абсорбции лекарственного средства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, замедленная абсорбция вводимой парентерально лекарственной формы достигается путем растворения или суспендирования лекарственного средства в масляном носителе. Депоформы для инъекций изготавливают путем формирования вводимых в микрокапсулы матриц, в которых данные соединения включены в биологически разлагаемые полимеры, такие как полилактид-полигликолид. Скорость высвобождения лекарственного средства может регулироваться в зависимости от отношения количества лекарственного средства к количеству полимера и от природы конкретно используемого полимера. Примерами других биологически разлагаемых полимеров являются поли(ортоэфиры) и поли(ангидриды). Композиции для инъекций в виде депоформ также изготавливают путем введения лекарственного средства в липосомы или микроэмульсии, совместимые с тканями организма. Препараты настоящего изобретения могут быть введены перорально, парентерально, местно или ректально. Разумеется, они должны быть изготовлены в форме, подходящей для каждого способа введения. Так, например, они могут быть введены в виде таблеток или капсул путем инъекции, ингаляции, примочек для глаз или мази, или в виде суппозиториев путем ректального введения. При этом, предпочтительным является пероральное введение. Используемые здесь термины "парентеральное введение" и "введенный парентерально" означают другие способы введения, отличающиеся от введения вовнутрь или местно, а обычно, они означают способы введения путем инъекции, которыми являются, но не ограничиваются ими, внутривенная, внутримышечная,внутриартериальная, внутриоболочечная, внутрикапсулярная, внутриглазная, внутрисердечная, чрезкожная, внутрибрюшинная, транстрахеальная, подкожная, субкутикулярная (через подкожный слой), интраартикулярная, субкап 39 сулярная, субарахноидальная, интраспинальная и внутригрудинная инъекция и инфузия. Используемые здесь термины "системное введение", "введенный системно", "периферическое введение" и "введенный периферически" означают такое введение соединения, лекарственного средства или другого материала, при котором не происходит прямой доставки в центральную нервную систему, но при котором это лекарственное средство поступает в организм пациента и, тем самым, подвергается метаболизму и другим аналогичным процессам, например, подкожное введение. Указанные соединения могут быть введены человеку и другому животному, подвергаемому лечению, любым подходящим способом введения, включая пероральное; интраназальное, например, в виде спрея; ректальное; вагинальное; парентеральное; интрацистернальное или местное введение, например, в виде порошков, мазей или капель, включая трансбуккальное и сублингвальное введение. Независимо от выбранного способа лечения, соединения настоящего изобретения, которые могут быть использованы в подходящей гидратированной форме, и/или фармацевтические композиции настоящего изобретения изготавливают в виде фармацевтически приемлемых лекарственных форм стандартными методами,известными специалистам. Конкретные дозы активных ингредиентов в фармацевтических композициях настоящего изобретения могут варьироваться в зависимости от эффективного количества активного ингредиента, необходимого для достижения нужного терапевтического ответа у данного пациента, от композиции и от способа введения, и не оказывают токсического действия на пациента. Выбранная доза будет зависеть от ряда факторов, включая активность конкретно используемого соединения настоящего изобретения или его сложного эфира, соли или амида,способ введения, время введения, скорость высвобождения конкретно используемого соединения, продолжительность лечения, другие лекарственные средства, соединения и/или материалы, используемые в комбинации с данным соединением, возраст, пол, вес, заболевание,общее состояние и историю болезни пациента,подвергаемого лечению, и также от других факторов, хорошо известных специалистам. Средний специалист, врач или ветеринар,может легко определить и прописать эффективное количество требуемой фармацевтической композиции. Так, например, врач или ветеринар может начать с более низких доз соединений настоящего изобретения, присутствующих в данной фармацевтической композиции, чем это требуется для достижения желаемого терапевтического эффекта, а затем постепенно увеличивать дозу вплоть до достижения нужного эффекта. 40 В основном, подходящей суточной дозой соединения настоящего изобретения может быть такое количество данного соединения, которое является самой низшей дозой, эффективной для продуцирования терапевтического эффекта. Такая эффективная доза будет, в основном, зависеть от факторов, описанных выше. В основном, дозы соединений настоящего изобретения для внутривенного и подкожного введения пациенту составляют в пределах от около 0,0001 до около 200 мг на килограмм веса тела в день, более предпочтительно, от около 0,01 до около 150 мг на килограмм веса тела в день, а еще более предпочтительно, от около 0,02 до около 140 мг на килограмм веса тела в день. Если необходимо, то эффективная суточная доза активного соединения может быть введена в виде двух, трех, четырех, пяти, шести или более дробных доз отдельно через соответствующие интервалы времени в течение дня, и необязательно в виде разовых лекарственных форм. Хотя соединение настоящего изобретения может быть введено отдельно, однако, предпочтительно, чтобы оно было введено в виде фармацевтической композиции. Настоящее изобретение также относится к упакованным фармацевтическим композициям для лечения состояния, отвечающего на N-6 замещенный 7-деазапурин, например, нежелательного увеличения активности аденозиновых рецепторов у млекопитающего. Эти упакованные фармацевтические композиции включают контейнер, содержащий терапевтически эффективное количество, по крайней мере, один деазапурин, описанный выше, и инструкции по применению указанного деазапурина, используемого для лечения состояния, отвечающего на деазапурин, у млекопитающего. Деазапурины настоящего изобретения могут быть получены стандартными методами органического синтеза. Деазапурины могут быть очищены с помощью обращенно-фазовой ВЭЖХ, хроматографии, перекристаллизации и т.п., и их структуры подтверждаются массспектральным анализом, элементным анализом,ИК- и/или ЯМР-спектроскопией. Обычно синтез промежуточных соединений, а также деазапуринов настоящего изобретения осуществляют в растворе. Добавление и удаление одной или нескольких защитных групп также являются обычной практикой и хорошо известны специалистам. Типичные схемы синтеза для получения промежуточных соединений деазапурина настоящего изобретения описаны ниже в схеме I. Настоящее изобретение, кроме того, проиллюстрировано нижеследующими примерами,которые не должны рассматриваться как ограничение настоящего изобретения. Содержание всех работ, рассматриваемых патентных заявок и опубликованных патентных заявок, цитируе 41 мых в настоящей заявке, включая и те работы,которые указаны в разделе "Предпосылки создания изобретения", вводится в настоящее описание посредством ссылки. При этом, следует отметить, что модели, используемые в примерах, являются общепринятыми моделями, и что иллюстрация эффективности с использованием этих моделей позволяет прогнозировать эффективность для человека. Деазапурины настоящего изобретения могут быть получены стандартными методами органического синтеза. Деазапурины могут быть очищены с помощью обращенно-фазовой ВЭЖХ, хроматографии, перекристаллизации и т.п., и их структуры могут быть подтверждены масс-спектральным анализом, элементным анализом, ИК- и/или ЯМР-спектроскопией. Обычно, синтез промежуточных соединений, а также деазапуринов настоящего изобретения осуществляют в растворе. Добавление и удаление одной или нескольких защитных групп также является обычными процедурами и хорошо известны специалистам. Типичные схемы синтеза для получения промежуточных соединений деазапурина настоящего изобретения описаны ниже в схеме I. Схема I где R3, R5 и R6 определены выше. В основном, защищенный 2-амино-3 цианопиррол может быть обработан ацилгалогенидом с получением карбоксиамидо-3-цианопиррола, который может быть обработан подкисленным метанолом для закрытия кольца с образованием пирроло[2,3d]пиримидина-4(3 Н)она (Muller, C.E. et al., J.Med.Chem. 40:4396(1997. Удаление пирролозащитной группы с последующей обработкой хлорирующим реагентом, например, оксихлоридом фосфора, приводит к образованию замещенных или незамещенных 4-хлор-7 Н-пирроло-[2,3d]пиримидинов. В результате обработки хлорпиримидина аминами получают 7-деазапурины. Так, например, как показано в схеме I, N(1-d1-фенилэтил)-2-амино-3-цианопиррол обрабатывают ацилгалогенидом в пиридине или дихлорметане. Полученный N-(1-d1-фенилэтил)-2 фенилкарбоксиамидо-3-цианопиррол обрабаты 003604 42 вают смесью (10:1) метанола/серной кислоты для закрытия кольца с получением d1-7H-7-(1 фенилэтил)пирроло[2,3d]пиримидина-4(3 Н)она. В результате удаления фенилэтильной группы путем обработки пиримидина полифосфорной кислотой (РРА), а затем РОСl3, получают ключевое промежуточное соединение 4 хлор-7 Н-пирроло[2,3d]пиримидина. После обработки 4-хлор-7 Н-пирроло[2,3d]пиримидина различными аминами, указанными в табл. 1,получают соединения формулы (I) и (II). Таблица 1 Общий способ получения 6-замещенных пирролов проиллюстрирован на нижеследующей схеме (схема II). Схема II где R1 - R5 определены выше. В результате переэтерификации и алкилирования этилцианоацетата -галогенкетоном получают кетометиловый эфир. После проведения реакции защиты кетона с последующей обработкой гидрохлоридом амидина (напр., алкил-,арил- или алкилариламидина) получают пиримидин, защищенный путем превращения в кеталь. После удаления защитной группы с последующей циклизацией и обработкой оксихлоридом фосфора получают хлоридное промежуточное соединение, которое может быть затем обработано амином с получением амин-6-замещенного пиррола. Кроме того, алкилирование пиррола у атома азота может быть достигнуто в условиях, известных специалисту. Общий способ получения 5-замещенных пирролов проиллюстрирован в нижеследующей схеме (схема III). где R1-R6 определены выше, a R представляет собой удаляемую защитную группу. В результате конденсации малононитрила и избытка кетона с последующим бромированием этого продукта получают смесь исходного материала, монобромированного и дибромированного продуктов, которую затем обрабатывают алкиламином, ариламином или алкилариламином. Полученный аминовый продукт ацилируют хлорангидридом, и этот моноацилированный пиррол циклизуют в присутствии кислоты с получением соответствующего пиримидина. Пирролзащитную группу удаляют с использованием полифосфорной кислоты и обрабатывают оксихлоридом фосфора с получением хлорированного продукта. Этот хлорированный пиррол может быть затем обработан амином с получением амино-5-замещенного пиррола. Алкилирование пиррола у атома азота может быть проведено в условиях, известных специалисту. На схемах IV и V проиллюстрированы способы получения деазапуринов 1 и 2 настоящего изобретения. где R5 и R6 являются такими, как они были определены выше, например, СН 3. Конкретный пример получения 6 метилпирролопиримидинов Ключевой реакцией получения 6-метилпирролопиримидинов (1) [R5 = СН 3] является реакция циклизации цианоацетата с бензамидином с образованием пиримидина. Очевидно, что метилцианоацетат должен циклизоваться с бензамидином с образованием пиримидина более эффективно, чем соответствующий этиловый эфир. Поэтому, в результате переэтерификации и алкилирования этилцианоацетата в присутствии NaOMe и избытка -галогенацетильной группы, например, хлорацетона, получали нужный метиловый сложный эфир (3) с выходом 79% (схема IV). Сложный кетоэфир (3) был защищен в виде ацеталя (4) с выходом 81%. Новый способ циклизации для получения пирими 45 дина (5) проводили с гидрохлоридом амидина,например, гидрохлоридом бензамидина и с 2 эквивалентами DBU, в результате чего был получен пиримидин 5 с выходом 54%. Этот способ позволяет увеличить выход от 20% и более с использованием описанных в литературе условий, которые предусматривают использование(6) достигается путем удаления ацеталевой группы в водном НСl с выходом 78%. В результате реакции соединения (6) с оксихлоридом фосфора при нагревании с обратным холодильником получали соответствующее 4-хлорпроизводное (7). В результате реакции взаимодействия с транс-4-аминоциклогексанолом в диметил-сульфоксиде при 135 С получали соединение (1) с выходом 57% исходя из соединения (7). Каждому специалисту очевидно, что выбор реагентов дает большую свободу в выборе нужного заместителя R5. 46 единение (13) (23%), которое подвергали реакции снятия защиты с использованием полифосфорной кислоты с получением соединения (14). После проведения реакции соединения (14) с оксихлоридом фосфора при нагревании с обратным холодильником получали соответствующее 4-хлор-производное (15). В результате реакции взаимодействия с транс-4-аминоциклогексанолом в диметилсульфоксиде при 135 С получали соединение (2) [R6 =СН 3] из соединения(14) с выходом 30% (см. схему V). Каждому специалисту очевидно, что выбор реагентов дает большую свободу в выборе нужного заместителя R6. Схема V Конкретный пример получения 5 метилпирролопиримидинов В результате конденсации Knoevengel малононитрила и избытка кетона, например ацетона в кипящем бензоле, после дистилляции получали соединение 8 с выходом 50%. В результате бромирования соединения 8 N-бромсукцинимидом в присутствии бензоилпероксида в хлороформе, после дистилляции, получали смесь исходного материала, моно- (9) и дибромированных продуктов (5/90/5) (70%). Эту смесь подвергали реакции с -метилалкиламином или-метилариламином, например, -метилбензиламином, в результате чего получали аминопиррол (10). После пропускания через короткую колонку с силикагелем, частично очищенный амин (выход 31%) ацилировали хлорангидридом, например, бензоилхлоридом, с получением моно-(11) и диацилированных (12) пирролов,которые были разделены с помощью флэшхроматографии. После кислотного гидролиза дизамещенного пиррола (12) получали ацилпиррол (11) с суммарным выходом 29%. В результате циклизации в присутствии концентрированной серной кислоты и ДМФ получали со Альтернативный способ синтеза R6 замещенных пирролов, например, 5 метилпирролопиримидинов Этот альтернативный способ синтеза R6 замещенных пирролов, например, 5-метилпирролопиримидинов, предусматривает переэтерификацию и алкилирование этилцианоацетата с получением соединения (16) (схема VI). В результате конденсации соединения (16) с гидрохлоридом бензамидина и с 2 эквивалентамиDBU получали пиримидин (17). Циклизация с образованием пиррол-пиримидина (14) достигается путем удаления ацетальной группы в водном НСl. В результате реакции соединения (14) с оксихлоридом фосфора при нагревании с обратным холодильником получали соответствующее 4-хлор-производное (15). В результате реакции взаимодействия с транс-4-аминоциклогексанолом в диметилсульфоксиде при 135 С получали соединение 2. Эта методика позволяет снизить число реакций синтеза целевого соединения (2) с 9 до 4 стадий. При этом, значительно увеличивается выход. Каждому специалисту также очевидно, что выбор реагентов дает большую свободу в выборе нужного заместителя R6. Общий способ получения дезметилпиррола проиллюстрирован в нижеследующей схеме где R1-R3 определены выше. В результате алкилирования алкилцианоацетата диэтилацеталем в присутствии основания получали цианодиэтилацеталь, который обрабатывали солью амидина с получением метилпирролопиримидинового предшественника. Этот предшественник хлорировали и обрабатывали амином с образованием целевого дезметилпирролопиримидина, показанного выше. Так, например, на схеме VIII проиллюстрирован синтез соединения (18). Коммерчески доступный метилцианоацетат алкилировали диэтилацеталем бромацетальдегида в присутствии карбоната калия и NaI с образованием соединения (19). Циклизацию с образованием пиримидина (20) проводили в две стадии. Сначала пиримидинацеталь получали посредством реакции соединения (19) с гидрохлоридом бензамидина и с двумя эквивалентамиDBU. Полученный пиримидинацеталь подвергали реакции снятия защиты без очистки водным 1 н. НСl, и полученный альдегид циклизовали с получением пирролпиридина (20) , который выделяли путем фильтрации. После проведения реакции соединения (20) с оксихлоридом фосфора при нагревании с обратным холодильником получали соответствующее 4-хлорпроизводное (21). В результате реакции взаимодействия хлорпроизводного с транс-4-аминоциклогексанолом в ДМСО при 135 С получали соединение (18) из соединения (21). На схемах II-VIII показано, что в 5- и 6 положения пирролпиримидинового кольца могут быть введены функциональные группы. Различные функциональные группы могут быть введены в 5- и 6-положения соединений формулы (I) и (II) путем использования различных исходных реагентов и проведения небольшой модификации в вышеуказанных реакционных схемах. Некоторые примеры представлены в табл. 2. Таблица 2. Выбранный список 5- и 6 замещенных пирролпиримидинов 49 Настоящее изобретение, кроме того, проиллюстрировано нижеследующими примерами,которые не должны рассматриваться как ограничение настоящего изобретения. Содержание всех работ, рассматриваемых патентных заявок и опубликованных патентных заявок, цитируемых в настоящей заявке, включая работы, которые указаны в разделе "Предпосылки создания изобретения", вводится в настоящее описание посредством ссылки. При этом, следует отметить, что используемые в примерах модели являются общеизвестными моделями, и что иллюстрация эффективности на этих моделях позволяет прогнозировать эффективность для человека. Примеры Препаративный пример 1. Использовали модификацию метода алкилирования SeelaLpke1. К охлажденному на льду (0 С) раствору этилцианоацетата (6,58 г,58,1 ммоль) в МеОН (20 мл) медленно добавляли раствор NaOMe (25% мас./об.; 58,1 ммоль). Через 10 мин медленно добавляли хлорацетон (5 мл; 62,8 ммоль). Через 4 ч, растворитель удаляли. Коричневое масло разбавляли EtOAc (100 мл) и промывали Н 2 О (100 мл). Органическую фракцию сушили, фильтровали и концентрировали с получением коричневого масла (7,79 г; 79%). Масло (3) (схема IV) представляло собой смесь продуктов метилового/этилового сложного эфира (9/1), и было использовано без дополнительной очистки. 1Seela, FLpke U, Chem.Ber. 1977, 110,1462-1469. Препаративный пример 2. Использовали методику Seela и Lpke1. В результате реакции защиты кетона (3) (схемаEtOAc/гексан, Rf 0,35). Остаточное содержание составляло примерно 5% этилового эфира: 1DBU (1,5 мл, 10,04 ммоль) в сухом ДМФ (15 мл) нагревали до 85 С в течение 15 ч. Смесь разбавляли СНСl3 (30 мл) и промывали 0,5 н. NaOH (10 мл) и H2O (20 мл). Органическую фракцию сушили, фильтровали и концентрировали с образованием коричневого масла. Была предпринята попытка проведения флэш-хроматографии(SiO2; 1/9 EtOAc/CH2Cl2, Rf=0,35), но материал кристаллизовался на колонке. Силикагель промывали МеОН. Фракции, содержащие продукт(5) (cхема IV) , концентрировали и использовали без дополнительной очистки (783 мг, 54,3%). 1 Н-ЯМР (200 МГц, СDСl3) : 8,24 (м, 2 Н,Аr-Н), 7,45 (м, 3 Н, Аr-Н), 5,24 (шир.с., 2 Н, NH2),3,98 (с, 4 Н, 2 х ацеталь-СН 2), 3,60-3,15 (м, 2 Н,СН 2), 1,38 (с, 3 Н, СН 3); МС (ЭН): 288,1 (M1). Получение соединения (20) (cхема VIII): Раствор ацеталя (19)(4,43 г, 20,6 ммоль)1, гидрохлорида бензамина (3,22 г, 20,6 ммоль) и DBUH2O (2 х 50 мл). Органическую фракцию сушили, фильтровали и концентрировали с получением темно-коричневого масла. Темно-коричневое масло перемешивали в 1 н. НСl (100 мл) в течение 2 ч при комнатной температуре. Полученную суспензию фильтровали с получением гидрохлоридной соли соединения (20) в виде коричневатого твердого вещества (3,60 г,70,6%); 1 Н-ЯМР (200 МГц, ДМСО-d6) : 11,92 (с,1 Н), 8,05 (м, 2 Н, Аr-Н), 7,45 (м, 3 Н, Аr-Н), 7,05(с, 1 Н, пиррол-Н); МС (ЭН): 212,1 (M1). Препаративный пример 4. Раствор ацеталя (5) (700 мг, 2,44 ммоль) в 1 н. НСl (40 мл) перемешивали в течение 2 ч при комнатной температуре. Полученную суспензию фильтровали с получением HCl-соли 2 фенил-6-метил-7 Н-пирроло[2,3d]пиримидин-4(3 Н)-она в виде коричневатого твердого вещества (498 мг, 78,0%): 1(с, 1 Н, пиррол-Н), 2,25 (с, 3H, СН 3); МС (ЭН): 226,1 (M1). Препаративный пример 5. Использовали модифицированный метод циклизации Chen и др.1. К охлажденному льдом(60 мл) медленно добавляли раствор -метилбензиламина (12,5 мл, 97,3 ммоль). Черный раствор оставляли для нагревания до комнатной температуры и перемешивали 15 ч. Смесь разбавляли EtOAc (200 мл) и промывали 0,5 н.NaOH (50 мл). Органическую фракцию сушили,фильтровали и концентрировали с получением соединения в виде черного дегтя (19,2 г,94%).Остаток частично очищали с помощью флэш-хроматографии (SiO2; 4/96 MeOH/CH2Cl2, 51Rf 0,35) и получали соединение dl-1-(1 фенилэтил)-2-амино-3-циано-4-метилпиррол в виде черного твердого вещества (6,38 г, 31%). МС (ЭН): 226,1 (M1). 1Schulz, D.W. J.Med.Chem. 1997, 40, 1749-1754. Препаративный пример 6. К раствору d1-1-(1-фенилэтил)-2-амино-3 циано-4,5-диметилпиррола 1 (14,9 г, 62,5 ммоль) и пиридина (10,0 мл) в дихлорметане (50,0 мл) добавляли бензоилхлорид (9,37 г, 66,7 ммоль) при 0C. После перемешивания в течение 1 ч при 0 С, для облегчения осаждения продукта добавляли гексан (10,0 мл). Растворитель удаляли в вакууме и твердое вещество перекристаллизовывали из смеси EtOH/H2O с получением 13,9 г (65%) d1-1-(1-фенилэтил)-2-фенилкарбониламино-3-циано-4,5-диметилпиррола,т.пл. 218-221 С; 1Liebigs Ann. Chem. 1986, 1485-1505. Нижеследующие соединения получали способом, аналогичным описанному в препаративном примере 6.(с, 1 Н, пиррол-Н), 5,52 (кв, 1 Н, J=7,2 Гц, СНСН 3), 1,77 (д, 3H, J=7,2 Гц, СН-СН 3), 1,74 (с, 3H,пиррол-СН 3); МС (ЭН): 434,1 (M1). Препаративный пример 7. К раствору dl-1-(1-фенилэтил)-2-фенилкарбоксиамидо-3-циано-4,5-диметилпиррола (1,0 г,2,92 ммоль) в метаноле (10,0 мл) добавляли концентрированную серную кислоту (1,0 мл) при 0 С. Полученную смесь нагревали с обратным холодильником в течение 15 ч и охлаждали до комнатной температуры. Осадок фильтровали с получением 0,48 г (48%) dl-5,6-диметил-2 фенил-7 Н-7-(1-фенилэтил)пирроло[2,3d]пиримидин-4 (3H)-она.(M1). Нижеследующие соединения получали способом, описанным в препаративном примере 7.(1 мл) в ДМФ (13 мл) перемешивали при 130 С в течение 48 ч. Черный раствор разбавляли СНСl3 (100 мл) и промывали 1 н. NaOH (30 мл) и солевым раствором (30 мл). Органическую фракцию сушили, фильтровали, концентрировали и очищали с помощью флэш-хроматографии[2,3d] пиримидин-4(3H)-она в виде коричневого твердого вещества (184 мг, 24%). 1dl-1-(1-фенилэтил)-2-амино-3-циано-4,5-диметилпиррола (9,60 г, 40,0 ммоль) и муравьиной кислоты (50,0 мл, 98%) нагревали с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры и отскабливания стенок колбы образовывался обильный осадок, который затем фильтровали. Продукт промывали водой до тех пор, пока рН промывок не становился нейтральным, в результате чего получали dl-5,6-диметил-7 Н-7-(1 фенилэтил)пирроло[2,3d]пиримидин-4(3H)-он. 1dl-5,6-Диметил-2-фенил-7 Н-7-(1-фенилэтил)пирроло[2,3d]пиримидин-4(3H)-он (1,0 г,2,91 ммоль) суспендировали в полифосфорной кислоте (30,0 мл). Смесь нагревали при 100 С в течение 4 ч. Горячую суспензию выливали в воду со льдом, интенсивно перемешивали для ее диспергирования и подщелачивали до рН 6 путем добавления твердого КОН. Полученное твердое вещество фильтровали и собирали с получением 0,49 г (69%) 5,6-диметил-2-фенил 7 Н-пирроло[2,3d]пиримидин-4(3H)-она. 1 Н-ЯМР (200 МГц, ДМСО-d6) : 2,17 (с,3H), 2,22 (с, 3H), 7,45 (шир.с., 3H), 8,07 (шир.,2 Н), 11,49 (с, 1 Н), 11,82 (с, 1 Н); МС (ЭН): 344,2 55 Нижеследующие соединения получали способом, описанным в препаративном примере 10. 5-Метил-2-фенил-7 Н-пирроло[2,3d]пиримидин-4(3H)-он. МС (ЭН): 226,0 (M1). 5-Метил-2-(3-пиридил)-7 Н-пирроло[2,3d] пиримидин-4(3H)-он. МС (ЭН): 241,1 (M1). 5,6-Диметил-2-(2-фурил)-7 Н-пирроло[2,3d] пиримидин-4(3H)-он. 1 Н-ЯМР (200 МГц, ДMCO-d6) : 2,13 (с,3H), 2,18 (с, 3H), 6,39 (дд, J= 1,8, 3,6 Гц, 1 Н),6,65 (дд, J=1,8 Гц, 3,6 Гц, 1 Н), 7,85 (дд, J=1,8, 3,6 Гц, 1H), 11,45 (с, 1 Н), 11,60 (с, 1 Н); МС (ЭН): 230,1 (M1). 5,6-Диметил-2-(3-фурил)-7 Н-пирроло[2,3d] пиримидин-4(3H)-он. 1[2,3d]пиримидин-4(3H)-она (1,0 г, 4,2 ммоль) в оксихлориде фосфора (25,0 мл) нагревали с обратным холодильником в течение 6 ч, а затем концентрировали досуха в вакууме. К остатку добавляли воду для инициации кристаллизации и полученное твердое вещество фильтровали и собирали с получением 0,90 г (83%) 4-хлор-5,6 диметил-2-фенил-7 Н-пирроло[2,3d]пиримидина. 1(м, 2 Н), 12,20 (с, 1 Н), МС (ЭН): 258,1 (M1). Нижеследующие соединения получали способом, описанным в препаративном примере 11. 4-Хлор-5-метил-2-фенил-7 Н-пирроло[2,3d] пиримидин. МС (ЭН): 244,0 (M1). 4-Хлор-6-метил-2-фенил-7 Н-пирроло[2,3d] пиримидин. МС (ЭН): 244,0 (M1). 4-Хлор-2-фенил-7 Н-пирроло[2,3d]пиримидин. 1(M1),dl-4-Хлор-5,6-диметил-2-фенил-7 Н-7-(1 фенилэтил)пирроло[2,3d]пиримидин. Препаративный пример 12. К раствору dl-1,2-диаминопропана (1,48 г,20,0 ммоль) и карбоната натрия (2,73 г, 22,0 ммоль) в диоксане (100,0 мл) и воде (100,0 мл) добавляли ди-трет-дикарбонат (4,80 г, 22,0 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 14 ч. Диоксан удаляли в вакууме. Осадок отфильтровывали и фильтрат концентрировали в вакууме досуха. Остаток растирали с EtOAc, а затем фильтровали. Фильтрат концентрировали в вакууме досуха с получением смеси dl-1-амино-2-(1,1 диметилэтокси)карбониламино-пропана и dl-2 амино-1-(1,1-диметилэтокси)карбониламинопропана, которая не могла быть разделена обычным хроматографическим методом. Эту смесь использовали для реакции в примере 8. Препаративный пример 13. К раствору FmocAla-OH (1,0 г, 3,212 ммоль) и оксалилхлорида (0,428 г, 0,29 мл, 3,373 ммоль) в дихлорметане (20,0 мл) добавляли несколько капель N,N-диметилформамида при 0 С. Смесь перемешивали при комнатной температуре в течение 1 ч, а затем добавляли циклопропилметиламин (0,229 г, 0,28 мл, 3,212 ммоль) и триэтиламин (0,65 г, 0,90 мл, 6,424 ммоль). Через 10 мин, смесь обрабатывали 1 М гидрохлоридом (10,0 мл) и водную смесь экст 003604 58 рагировали дихлорметаном (3 х 30,0 мл). Органический раствор концентрировали в вакууме досуха. Остаток обрабатывали раствором 20% пиперидина в N,N-диметилформамиде (20,0 мл) в течение 0,5 ч. После удаления растворителя в вакууме, остаток обрабатывали 1 М гидрохлоридом (20,0 мл) и этилацетатом (20,0 мл). Смесь отделяли и водный слой подщелачивали твердым гидроксидом натрия до рН=8. Осадок удаляли путем фильтрации и водный раствор подвергали ионообменной хроматографии на колонке, проэлюированной 20% пиридином, в результате чего получали 0,262 г (57%) амида Nциклопропилметилаланина. 1H-ЯМР (200 МГц, CD3OD) : 0,22 (м, 2 Н),0,49 (м, 2 Н), 0,96 (м, 2 Н), 2,40 (т, 2 Н), 2,92 (т,2 Н), 3,05 (д, 2 Н); МС (ЭН): 143,1 (M1). Препаративный пример 14. N-трет-бутоксикарбонил-транс-1,4-циклогексилдиамин. Транс-1,4-циклогексилдиамин (6,08 г, 53,2 ммоль) растворяли в дихлорметане (100 мл). Затем, с помощью канюли добавляли раствор ди-трет-бутилдикарбоната (2,32 г, 10,65 ммоль в 40 мл дихлорметана). Через 20 ч, реакционную смесь распределяли между СНСl3 и водой. Слои отделяли и водный слой экстрагировали СНСl3(три раза). Объединенные органические слои сушили MgSO4, фильтровали и концентрировали с получением 1,20 г белого твердого вещества (53%). 1N-трет-Бутоксикарбонил-транс-1,4-циклогексилдиамин (530 мг, 2,47 ммоль) растворяли в дихлорметане (20 мл). Затем по каплям добавляли уксусный ангидрид (250 мг, 2,60 ммоль). Через 16 ч, реакционную смесь разбавляли водой и СНСl3. Слои отделяли и водный слой экстрагировали СНСl3 (три раза). Объединенные органические слои сушили MgSO4, фильтровали и концентрировали. После перекристаллизации 59 вещество, ДМСО (2 мл), NаНСО 3 (200 мг, 2,2 ммоль) и 4-хлор-5,6-диметил-2-фенил-7 Нпирроло[2,3d]пиримидин (35 мг, 0,14 ммоль) объединяли в колбе и нагревали до 130 С. Через 4,5 ч, реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc и водой. Слои отделяли и водный слой экстрагировалиEtOAc (три раза). Объединенные органические слои сушили MgSO4, фильтровали и концентрировали. После хроматографии (препаративные пластины с двуокисью кремния, 20:1, СНСl3: ЕtOН) получали 0,3 мг коричневатого твердого вещества (выход 1%). МС (ЭН): 378,2 (M1). 4-(N-метансульфонил)-N-трет-бутоксикарбонил-транс-1,4-циклогексилдиамин. Транс-1,4-циклогексилдиамин (530 мг,2,47 ммоль) растворяли в дихлорметане (20 мл) и разбавляли пиридином (233 мг, 3,0 ммоль). Затем по каплям добавляли метансульфонилхлорид (300 мг, 2,60 ммоль). Через 16 ч, реакционную смесь разбавляли водой и СНСl3. Слои отделяли и водный слой экстрагировали СНСl3(три раза). Объединенные органические слои сушили MgSO4, фильтровали и концентрировали. После перекристаллизации (EtOH/H2O) получали 206 мг белых кристаллов (29%). 1(ЭН): 293,1 (M1), 278,1 (M+-15), 237,1 (М+-56). 4-(4-транс-метансульфамидоциклогексил) амино-5,6-диметил-2-фенил-7 Н-(1-фенилэтил) пирроло[2,3d]пиримидин. 4-(N-сульфонил)-N-трет-бутоксикарбонилтранс-1,4-циклогексилдиамин (206 мг, 0,71 ммоль) растворяли в дихлорметане (5 мл) и разбавляли TFA (6 мл). Через 16 ч, реакционную смесь концентрировали. Неочищенную реакционную смесь, ДМСО (2 мл), NаНСО 3 (100 мг, 1,1 ммоль) и 1-хлор-5,6-диметил-2-фенил-7 Нпирроло[2,3d]пиримидин объединяли в колбе и нагревали до 130 С. Через 15 ч, реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc (три раза). Объединенные органические слои сушили MgSO4, фильтровали и концентрировали. После хроматографии (препаративные пластины с двуокисью кремния,20:1, CHCl3/EtOH) получали 2,6 мг коричневатого твердого вещества (выход 5%). МС (ЭН): 414,2 (M1) Пример 1. Раствор 4-хлор-5,6-диметил-2-фенил-7 Нпирроло[2,3d]пиримидина (0,50 г, 1,94 ммоль) и 4-транс-гидроксициклогексиламин (2,23 г, 19,4 ммоль) в метилсульфоксиде (10,0 мл) нагревали при 130 С в течение 5 ч. После охлаждения до комнатной температуры добавляли воду (10,0 мл) и полученный водный раствор экстрагировали EtOAc (3 х 10,0 мл). Объединенный раствор EtOAc сушили (МgSO4) и фильтровали,фильтрат концентрировали досуха в вакууме, и остаток хроматографировали на силикагеле с(м, 3H), 8,40-8,44 (дд, J=2,2, 8 Гц, 2 Н), 10,60 (с,1 Н), МС (ЭН): 337,2 (M1). Нижеследующие соединения получали способом, аналогичным описанному в примере 1. 4-(4-транс-Гидроксициклогексил)амино-6 метил-2-фенил-7 Н-пирроло[2,3d]пиримидин. 1
МПК / Метки
МПК: A61K 31/505, A61P 9/00, C07D 487/04
Метки: основе, применение, композиции, пиримидинов, пирроло, 2,3d
Код ссылки
<a href="https://eas.patents.su/30-3604-kompozicii-na-osnove-pirrolo-23d-pirimidinov-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции на основе пирроло [2,3d] пиримидинов и их применение</a>
Предыдущий патент: N-[(замещенное пятичленное ди- или триазадиненасыщенное кольцо) карбонил] гуанидиновые производные для лечения ишемии
Следующий патент: Производные камптотецина, обладающие противоопухолевой активностью
Случайный патент: Способ получения предшественника катализатора фишера-тропша и применение предшественника катализатора в процесах фишера-тропша