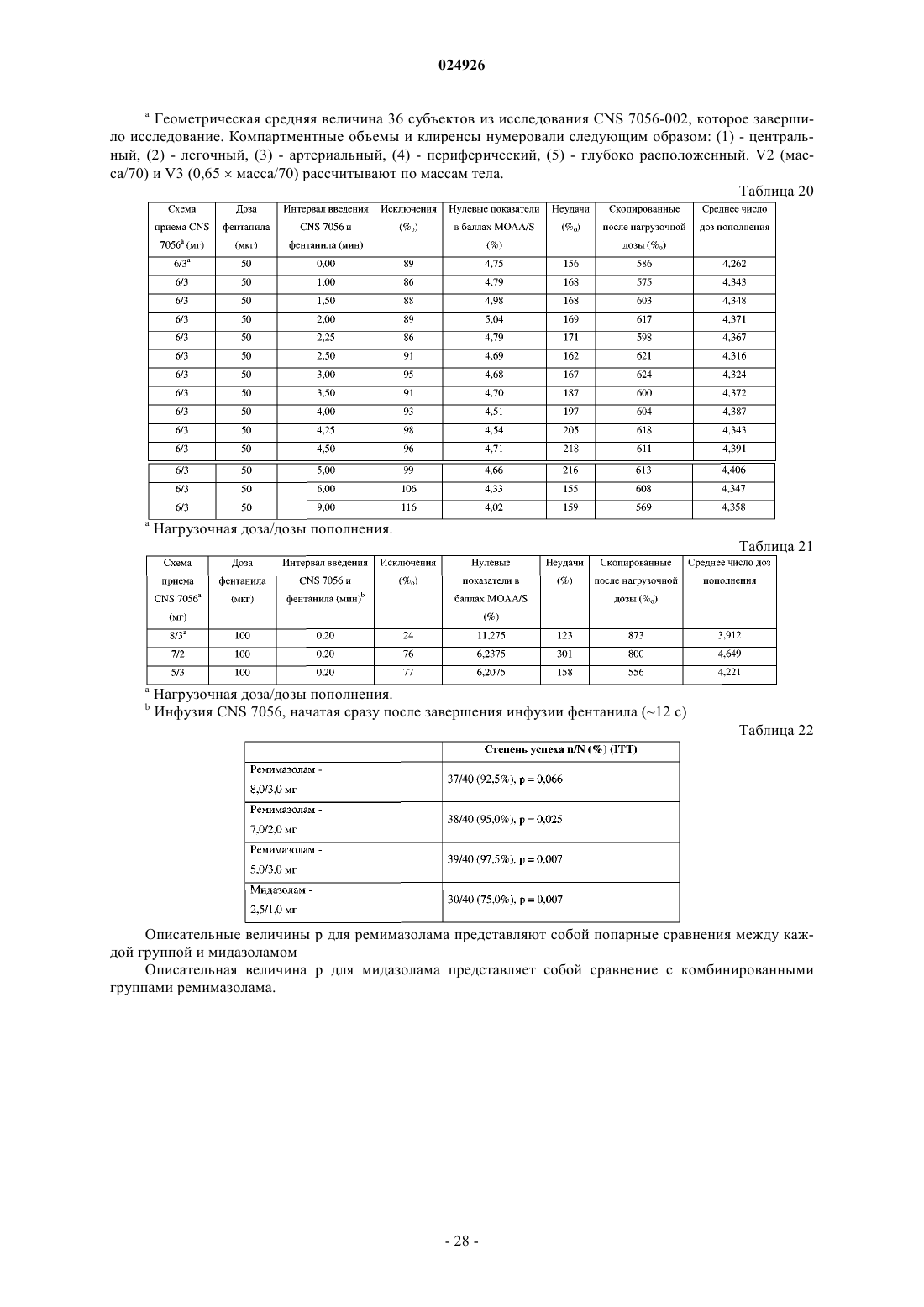
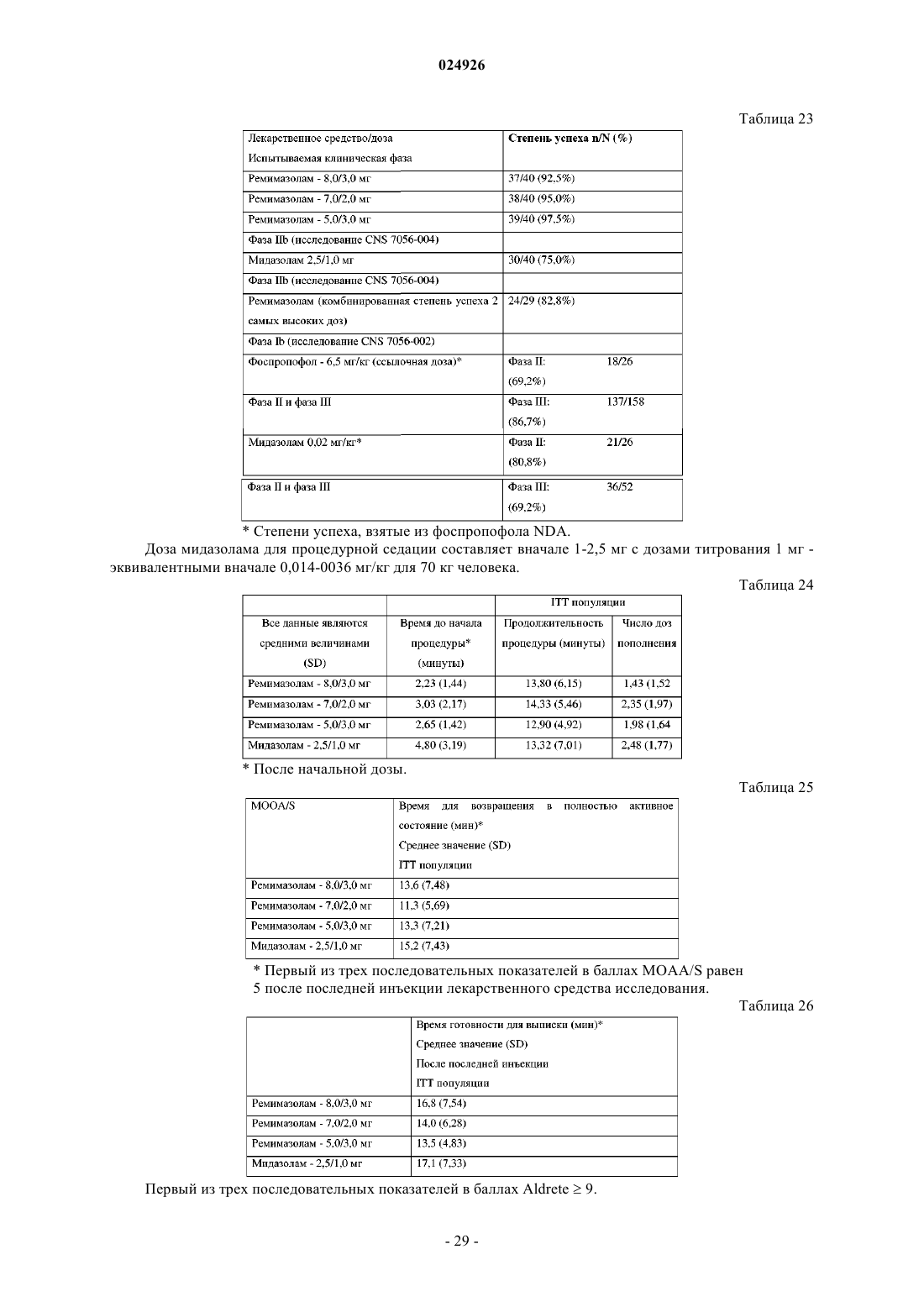
Схема приема cns 7056 (ремимазолама) для индуцирования седации
Номер патента: 24926
Опубликовано: 30.11.2016
Авторы: Уилтшир Хью, Боркетт Кейт, Вильхельм-Огунбийи Карин, Тилбрук Гэри Стюарт
Формула / Реферат
1. Способ индуцирования седации, включающий введение комбинации (i) фиксированной дозы от 2 до 10 мг 3-[(4S)-8-бром-1-метил-6-(2-пиридинил)-4Н-имидазо[1,2-а][1,4]бензодиазепин-4-ил]пропионовой кислоты (CNS 7056) формулы (I)
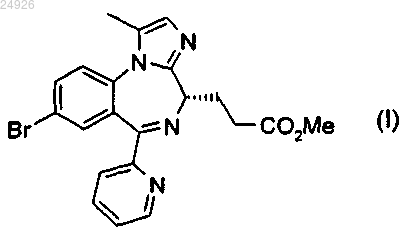
или его фармацевтически приемлемой соли и/или сольвата и (ii) опиоида.
2. Способ по п.1, где вводят по меньшей мере одну дополнительную дозу CNS 7056.
3. Способ по п.2, характеризующийся тем, что дополнительная доза CNS 7056 находится в диапазоне 1-4 мг/пациента.
4. Способ по п.2 или 3, где начальную дозу и дополнительные дозы CNS 7056 сочетают следующим образом:
a) 8 мг начальной дозы плюс 3 мг дополнительной дозы, или
b) 7 мг начальной дозы плюс 2 мг дополнительной дозы, или
c) 5 мг начальной дозы плюс 3 мг дополнительной дозы.
5. Способ по любому из пп.2-4, характеризующийся тем, что дополнительную дозу CNS 7056 вводят не ранее чем через 2 мин и предпочтительно не позднее чем через 5 мин от начальной дозы или предшествующей дополнительной дозы CNS 7056.
6. Способ по любому из пп.2-5, характеризующийся тем, что вводят не более шести дополнительных доз CNS 7056.
7. Способ по любому из указанных выше пунктов, характеризующийся тем, что опиоид выбран из группы, состоящей из морфина, кодеина, тебаина, папаверина, наркотина, героина, гидроморфона, дигидрокодеина, тебакона, гидрокодона, оксиморфона, оксикодона, кетобемидона, петидина, анилеридина, пиминодина, феноперидина, фуретидина, [альфа]продина, тримеперидина, мептазинола, профадола, метадона, декстроморамида, левометадилацетата, фенадоксона, дипипанона, темалона, декстропропоксифена, N-метилморфинана, леворфанола, декстрометорфана, буторфанола, пентазоцина, феназоцина, кетоциклазоцина, бремазоцина, суфентанила, карфентанила, фентанила, лофентанила, алфентанила, охмефентанила, ремифентанила, питрамида, бензтриамида, дифеноксилата, лоперамида, трамадола, тилидина, U-50488, 1-бензил-4-(4-бромфенил)-4-диметиламиноциклогексанола; бупренорфина, дезоцина, диаморфина, этилморфина, эторфина, левометадона, левометадилацетата, налбуфина, налорфина, пиритрамида, тапентадола, мет-энкефалина, лей-энкефалина, ноцицептина, [бета]эндорфина, эндоморфина-1, эндоморфина-2, меторфамида, динорфина-А, динорфина-В и [альфа]неоэндорфина и наиболее предпочтительно фентанила.
8. Способ по любому из пп.1-6, характеризующийся тем, что опиоид представляет собой аналог фентанила, выбранный из группы, состоящей из фентанила, алфентанила, карфентанила, лофентанила, ремифентанила, суфентанила, тиофентанила, α-метилтиофентанила, α-метилацетилфентанила, α-метилфентанила, охмефентанила, β-гидроксифентанила, парафторфентанила, 3-метилфентанила, или его соли или сольвата.
9. Способ по любому из пп.1-6, характеризующийся тем, что опиоид представляет собой фентанил или его соль или сольват.
10. Способ по п.9, характеризующийся тем, что фентанил вводят как фиксированную дозу 50-200 мкг/пациента.
11. Способ по п.9 или 10, характеризующийся тем, что фентанил дают перед введением CNS 7056.
12. Способ по п.11, где фентанил дают в пределах 10 мин перед введением CNS 7056.
13. Способ по любому из пп.9-11, характеризующийся тем, что вводят по меньшей мере одну дополнительную дозу фентанила.
14. Способ по п.13, где дополнительная доза фентанила находится в диапазоне 10-50 мкг/пациента.
15. Способ по п.13 или 14, характеризующийся тем, что дополнительную дозу фентанила вводят не ранее чем через 5 мин после введения предыдущей дозы фентанила.
16. Способ по п.10 или 15, характеризующийся тем, что максимальная доза фентанила на лечение не превышает 200 мкг/пациента.
17. Способ по любому из указанных выше пунктов, характеризующийся тем, что CNS 7056 применяют для дооперационной седации, амнезии для пред- и послеоперационных периодов или поверхностного наркоза с сохранением сознания во время коротких диагностических, операционных или эндоскопических процедур.
18. Способ по любому из пп.1-15, характеризующийся тем, что седацию индуцируют в пределах процедурной седации, предпочтительно эндоскопии, более предпочтительно эндоскопии верхней части GI-тракта или колоноскопии.
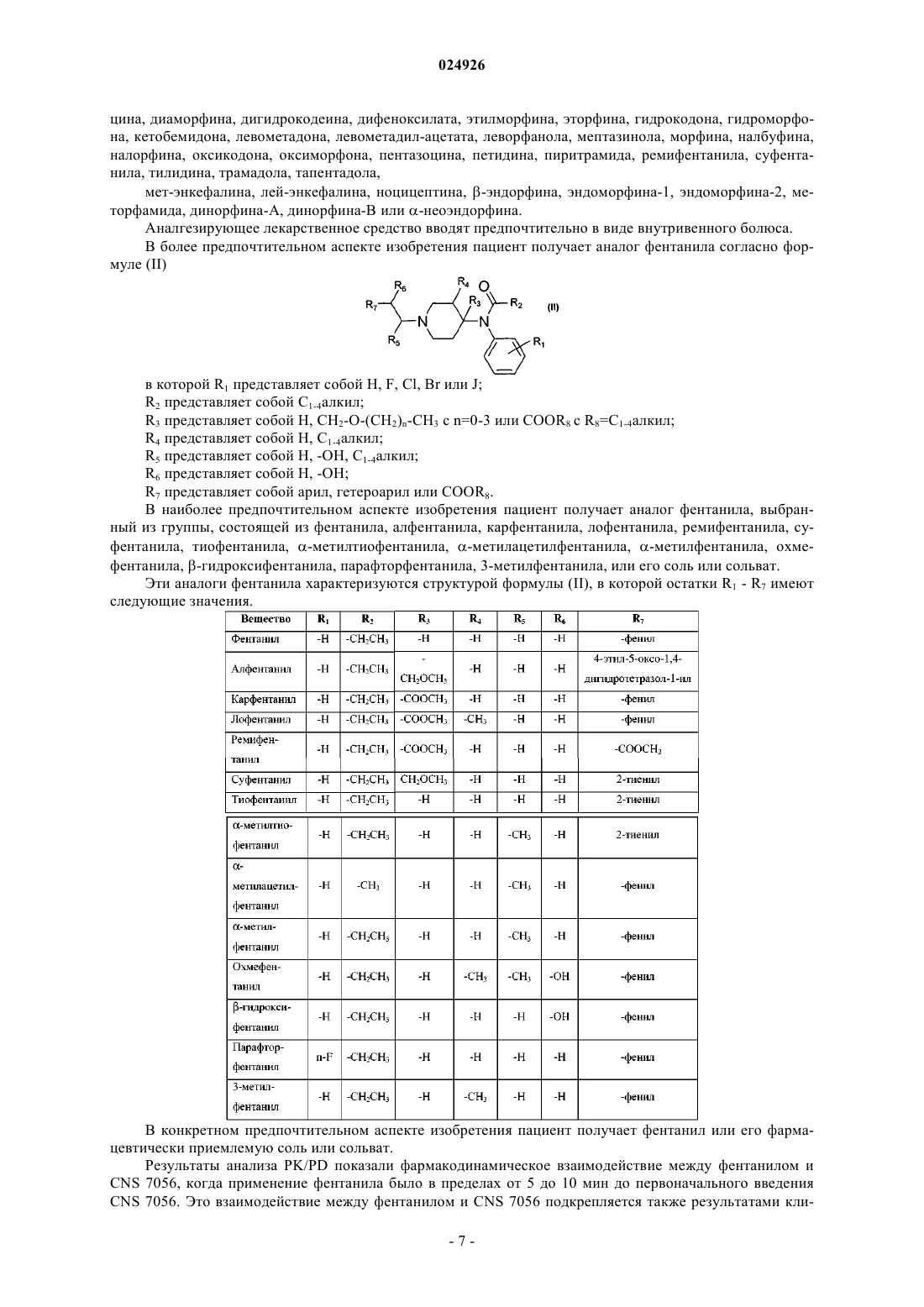
19. Способ по любому из указанных выше пунктов, характеризующийся тем, что индуцируют седацию от слабой до глубокой.
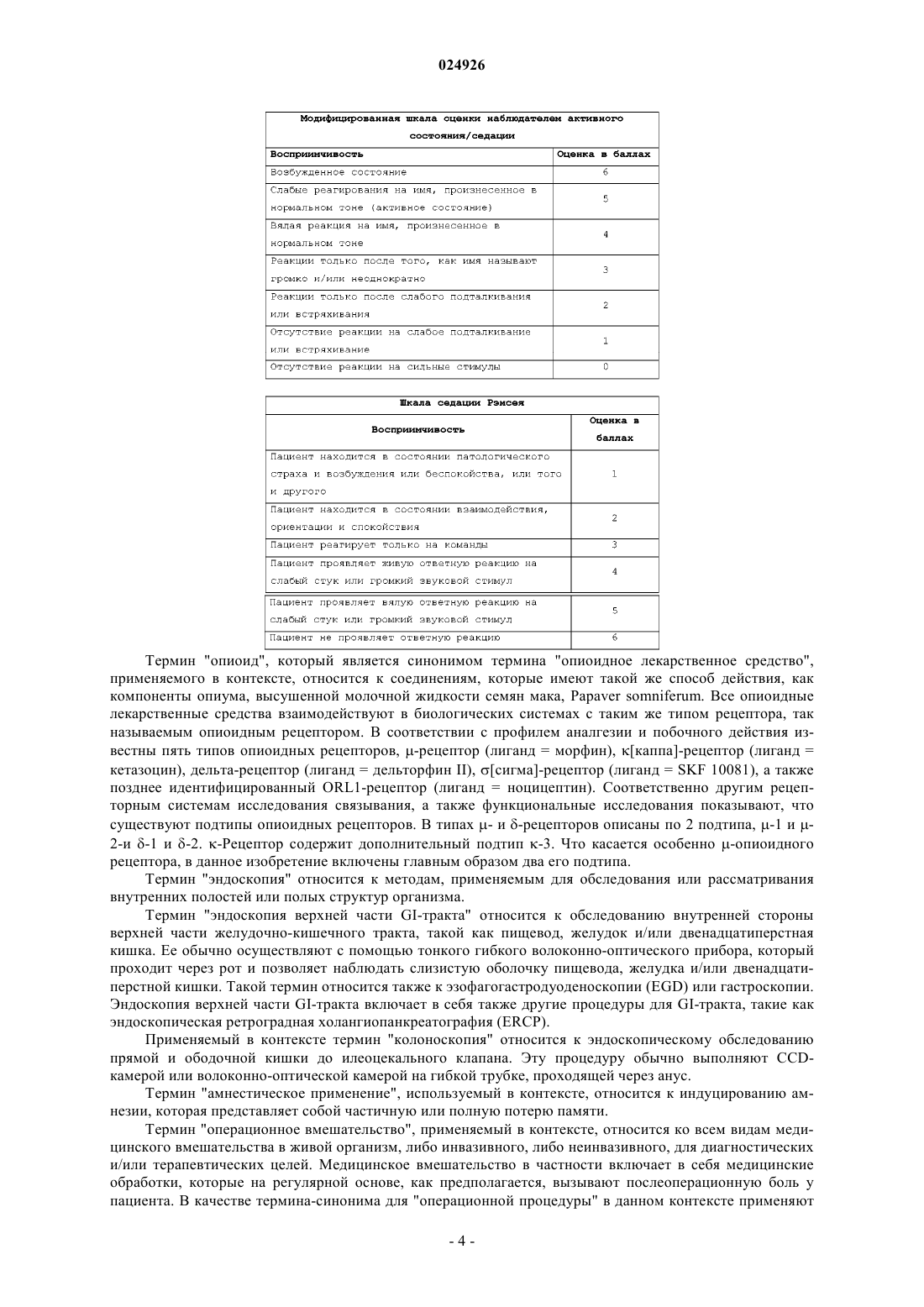
20. Способ по любому из указанных выше пунктов, характеризующийся тем, что индуцируют седацию с показателем в баллах MOAA/S, который равен или ниже 4.
21. Способ по любому из указанных выше пунктов, где CNS 7056 или его соль или сольват находится в контейнере для фармацевтического применения, содержащем 10 мг CNS 7056 или его соли или сольвата.
22. Способ по п.21, где CNS 7056 или его соль или сольват находится в концентрации 1 мг/мл.
23. Способ по п.21 или 22, где контейнер содержит лекарственный продукт.
24. Способ по п.23, где лекарственный продукт представляет собой лекарственный продукт, готовый для применения.
25. Способ по любому из указанных выше пунктов, где седация достигает состояния общей анестезии.
Текст
Изобретение относится к схеме приема для индуцирования седации быстродействующим бензодиазепином, представляющим собой метиловый эфир 3-[(4S)-8-бром-1-метил-6-(2 пиридинил)-4 Н-имидазо[1,2-а][1,4]бензодиазепин-4-ил]пропионовой кислоты (CNS 7056) согласно формуле (I), в комбинации с опиоидом, в частности фентанилом, где CNS 7056 вводят в дозе 2-10 мг, предпочтительно между 4 и 9 мг и наиболее предпочтительно между 5 и 8 мг. Изобретение относится к схеме приема бензодиазепина, метилового эфира 3-[(4S)-8-бром-1-метил 6-(2-пиридинил)-4 Н-имидазо[1,2-а][1,4]бензодиазепин-4-ил]пропионовой кислоты (CNS 7056; ремимазолама), в сочетании с опиоидом, в частности с фентанилом, для индуцирования седации. Седация является медицинской процедурой, включающей в себя введение седативных лекарственных средств для облегчения или предоставления возможности для проведения терапевтической или диагностической процедуры на живом субъекте. Седация представляет собой отличительную черту современной медицины и ее широко применяют, начиная от малого хирургического вмешательства или диагностических процедур до вентиляции легких пациентов в отделениях интенсивной терапии (и реанимации). Известно несколько классов седативных средств, среди них бензодиазепины, которые часто применяют и вводят в сочетании с опиоидами. Такое сочетание представляет собой современный золотой стандарт для седации. Определение оптимальной дозы и схемы приема лекарственного средства представляет собой наиболее критическую точку при применении седативных средств. Это обусловлено высокой вариабельностью концентраций в крови вместе с высокими различиями между индивидуумами в ответных реакциях на седативные лекарственные средства. Поэтому врач может ожидать изменения ответных реакций отдельного пациента в диапазоне от трех- до пятикратного для любого конкретного седативного или обезболивающего средства. Вследствие этой изменяемой ответной реакции обычно рекомендуемой процедурой для попытки клинициста достичь оптимальной седации является введение начального болюса и затем титрование лекарственного средства для пациента посредством приращения дозы до тех пор, пока не достигнет желаемого уровня седации. Получающаяся в результате схема приема лекарственного средства, которая определяет начальную дозу и последующие дозы пополнения и временной интервал между дозами, должна учитывать конкретные фармакокинетические и фармакодинамические свойства лекарственных средств и должна быть конкретно адаптирована для применяемого седативного соединения. Наконец, должен быть определен путь введения (например, внутривенный, пероральный, ректальный, внутримышечный и т.д.). Установление подходящей схемы приема лекарственного средства, в частности, создает проблему,если седативное средство применяют в комбинации с опиоидом для индуцирования и сохранения адекватной седации. Сначала бензодиазепины и опиоиды в отношении индуцирования седации действуют взаимодействующим образом. Поэтому введение опиоида может уменьшить количество бензодиазепинов, необходимое для достижения желаемого уровня седации. Кроме того, бензодиазепины и опиаты обладают аддитивными или даже синергическими действиями в отношении их побочных действий, которые увеличивают риск неблагоприятных случаев, в том числе гипотензии, угнетения дыхания и, как следствие, гипоксемии. Как следствие, обычно считается, что фиксированная комбинация седативных и обезболивающих агентов не позволяет подходящим образом титровать отдельные компоненты седации/аналгезии, чтобы удовлетворить отдельные требования пациента и процедуры при снижении ассоциированных рисков, но для комбинации скорее рекомендуются максимальные дозы. В последнее время был разработан и описан в ЕР 1183243 В 1 новый класс бензодиазепинов. Этот класс бензодиазепинов представляет собой сильнодействующие седативные средства, которые быстро метаболизируются эстеразами тканей в неактивный метаболит и, таким образом, эти соединения классифицировали как бензодиазепины с ультракороткой активностью. Соединение метиловый эфир 3-[(4S)-8-бром-1-метил-6-(2-пиридинил)-4 Н-имидазо[1,2-а][1,4]бензодиазепин-4-ил]пропионовой кислоты (в дальнейшем "CNS 7056") представляет собой один из этих бензодиазепинов ультракороткого действия (описан в качестве примера Ic-8 в ЕР 1183243 B1) . CNS 7056 испытали в ходе исследований клинической фазы I и фазы II в сочетании и без сочетания с фентанилом для индуцирования седации для эндоскопии или колоноскопии, при которой CNS 7056 давали как дозу,скорректированную в соответствии с массой тела. В этих исследованиях CNS 7056 (CNS 7056-001, CNS 7056-002 и CNS 7056-003) проявлял быстрое начало действия, короткую продолжительность действия и профиль быстрого восстановления сознания. В этих исследованиях, однако, стали очевидными также определенные недостатки или риски в отношении пригодности профиля седации и переносимости. При исследовании CNS 7056-002 с применением многих доз отдельные показатели в баллах MOAA/S показали снижение их уровней до потери сознания (LoC) у большинства субъектов в некоторые моменты времени после введения начальной дозы и/или доз пополнения. Кроме того, седативное действие проявляло значительную вариабельность. Некоторых из субъектов классифицировали как "выбывшие из исследования" (субъекты, которые никогда не имели показатель в баллах MOAA/S ниже или равный трем, несмотря на две дозы пополнения) и в то же время одного субъекта классифицировали как "неудачного" пациента (перенес колоноскопию, но достиг полностью активного состояния, т.е. имел показатель в баллах MOAA/S пять). В некоторых случаях слабые гипоксические случаи наблюдали в условиях воздуха комнаты. В некоторых случаях гипотензию наблюдали при введении CNS 7056 вместе с фентанилом. Гипотензия является одной из известных побочных действий фентанила. Однако поскольку известно также, что гипотензия имеет место после введения высоких доз бензодиазепинов, должно быть рассмотрено потенциальное повышение индуцированного фентанилом гипотензивного действия, вызванное CNS 7056. Таким образом, требуется оптимизированная схема приема CNS 7056. Сущность изобретения Таким образом, задачей настоящего изобретения является предоставление удобной и безопасной схемы приема для бензодиазепина CNS 7056 ультракороткого действия, которая приводит также к улучшенному профилю седации. Эта задача решается посредством применения метилового эфира 3-[(4S)-8-бром-1-метил-6-(2 пиридинил)-4 Н-имидазо[1,2-а][1,4]бензодиазепин-4-ил]пропионовой кислоты (CNS 7056) согласно формуле (I) или его фармацевтически приемлемой соли или сольвата для индуцирования и/или поддержания седации, причем CNS 7056 вводят в сочетании с опиоидом по п.1. Схема приема лекарственного средства изобретения является выгодной в отношении минимизации степени "исключения" субъектов с нулевыми показателями в баллах MOAA/S, а также степени "неудач"(субъекты, у которых не поддерживается удовлетворительная седация в течение 60 мин, предпочтительно в течение 45 мин и наиболее предпочтительно в течение 30 мин при введении 6 доз пополнения). Кроме того, схема приема лекарственного средства изобретения имеет значительные фармакоэкономические преимущества, так как вследствие быстрого возвращения пациентов к нормальному состоянию (короткое время от пробуждения до состояния полного бодрствования) пациенты могут быть быстро готовы к выписке. Время от последней инъекции CNS 7056 до тех пор, когда пациенты готовы к выписке, может быть значительно сокращено по сравнению с седацией посредством мидазолама. Определения Термин "седация" относится к расслабленному, спокойному состоянию тела и сознания, которое индуцируется фармакологическим способом, например путем применения седативных средств. Такой термин включает в себя также "аналгоседацию", которая включает в себя сопутствующее применение обезболивающего лекарственного средства. Кроме того, как указано в контексте, термин седация включает в себя также глубокую седацию, дооперационную седацию, анксиолиз и амнезию в случаях пред- и послеоперационных периодов, поверхностный наркоз с сохранением сознания во время коротких диагностических, операционных или эндоскопические процедур и седацию перед введением других анестезирующих или аналгезирующих средств и/или при совместном их введении. Фраза "лечили комбинацией или вводили в комбинации", применяемая в контексте для комбинированного терапевтического применения или введения CNS 7056 и опиоида (например, фентанила), означает, что по меньшей мере одну дозу CNS 7056 и по меньшей мере одну дозу опиоида вводят в пределах интервала времени, когда оба вещества проявляют фармакологическое действие. Этот интервал времени составляет предпочтительно не более 10 мин, более предпочтительно не более 8, 5 или 3 мин. В одном варианте осуществления интервал времени составляет менее 2 мин. Опиоид и CNS 7056 можно вводить одновременно или последовательно. Эта фраза включает в себя лечения, при которых CNS 7056 и опиоид вводят либо одним и тем же путем или разными путями введения. Термин "аналгезия" (обезболивание), применяемый в контексте, относится к фармакологически индуцированному отсутствию или ослаблению чувства боли, например посредством применения аналгетиков, таких как опиоиды. Термин "фиксированная доза", применяемый в настоящем изобретении, относится к количеству лекарственного средства, введенного пациенту независимо от его массы тела. Применяемый в контексте термин "начальная доза" является синонимом термина "нагрузочная доза" и определяется как первая доза лекарственного средства, введенная в контексте лекарственного седативного лечения. Термин "доза пополнения" относится к дозе, вводимой после начальной дозы или предыдущей дозы пополнения в контексте лекарственного лечения. Термин "минимальная седация" или "слабая седация" относится к индуцированному лекарственным средством состоянию, во время которого пациент нормально реагирует на словесные команды. Когнитивная функция и координация могут быть нарушены. Дыхательные и сердечно-сосудистые функции не нарушаются. Минимальная седация известна также как анксиолиз. Термин "умеренная седация" (синоним с поверхностным наркозом с сохранением сознания) относится к индуцированному лекарственным средством подавлению сознания, в течение которого пациент реагирует целенаправленно на голосовую команду, подаваемую либо отдельно, либо в сопровождении со слабой тактильной стимуляцией. Никакие вмешательства не являются обязательными для поддержания проходимости дыхательных путей пациента. Во время умеренной седации спонтанное дыхание является адекватным и обычно поддерживается сердечно-сосудистая функция. Термин "глубокая седация" относится к индуцированному лекарственным средством подавлению сознания, во время которого пациент не может легко переходить в активное состояние, но реагирует целенаправленно после многократной или болезненной стимуляции. Может быть нарушена независимая дыхательная функция. Пациенту может требоваться помощь для поддержания проходимости дыхательных путей пациента. Во время глубокой седации спонтанное дыхание может быть недостаточным, и обычно поддерживают функцию сердечно-сосудистой системы. Термин "процедурная седация" относится к способу введения седативных или диссоциативных агентов с аналгетиками или без аналгетиков для индуцирования состояния, которое позволяет пациенту переносить неприятные процедуры при поддержании сердечно-дыхательной функции. Предполагается,что процедурная седация и обезболивание приводят к пониженному уровню сознания, который позволяет пациенту независимо поддерживать оксигенацию и регуляцию проходимости дыхательных путей. Термин "аналгоседация" относится к фармакологически индуцированной аналгезии с одновременной седацией. В отличие от анестезии пациент может реагировать на внешние раздражители и дышать без посторонней помощи. В зависимости от дозы седативного и/или аналгезирующего лекарственного средства аналгоседация может, намеренно или ненамеренно, достигать состояния общей анестезии. Термин "общая анестезия" относится к индуцированной лекарственным средством потери сознания(LoC), во время которой пациент не способен к активным действиям, даже в ответ на болезненные стимулы. Во время общей анестезии способность поддерживать независимую дыхательную функцию легких часто нарушается, и часто требуется помощь для поддержания проходимости дыхательных путей. Кроме того, искусственная вентиляция легких под положительным давлением может требоваться вследствие ослабленного самопроизвольного дыхания или индуцированного лекарственным средством снижения нервно-мышечной функции и сердечно-сосудистой функции. Термин "обеспечение мониторированной анестезии", применяемый в контексте, относится к конкретному обеспечению анестезии для диагностической или терапевтической процедуры, которая включает в себя следующие аспекты обеспечения анестезии: (I) осмотр перед процедурой, (II) обеспечение анестезии во время процедуры и (III) контроль анестезии после процедуры. Во время обеспечения мониторированной анестезии анестезиолог обеспечивает или руководит рядом терапевтических конкретных действий, включающих в себя, но не ограничивающихся диагнозом и решением клинических проблем,которые имеют место во время процедуры, поддержку жизненно важных функций, введение седативных средств, аналгетиков, снотворных средств, анестезирующих агентов или других лекарственных средств в случае необходимости для безопасности пациентов, психологической поддержки и физического комфорта, а также предоставление других медицинских услуг, которые необходимы для безопасного завершения процедуры. Обеспечение мониторированной анестезии может включать в себя при необходимости варьирование уровня седации, аналгезии и анксиолиза. Лицо, обеспечивающее мониторированную анестезию,должно быть подготовлено и иметь квалификацию для перевода пациента в состояние общей анестезии,когда это необходимо. Это тот случай, когда пациент теряет сознание и способность реагировать целенаправленно, независимо от того, требуется ли применение аппаратуры для дыхательных путей. Для оценки различных состояний седации и аналгоседации часто применяют так называемую модифицированную шкалу оценки наблюдателем активного состояния и седации (MOAA/S) и, альтернативно, шкалу Рэмсея. Эти шкалы являются следующими. Термин "опиоид", который является синонимом термина "опиоидное лекарственное средство",применяемого в контексте, относится к соединениям, которые имеют такой же способ действия, как компоненты опиума, высушенной молочной жидкости семян мака, Papaver somniferum. Все опиоидные лекарственные средства взаимодействуют в биологических системах с таким же типом рецептора, так называемым опиоидным рецептором. В соответствии с профилем аналгезии и побочного действия известны пять типов опиоидных рецепторов, -рецептор (лиганд = морфин), [каппа]-рецептор (лиганд = кетазоцин), дельта-рецептор (лиганд = дельторфин II), [сигма]-рецептор (лиганд = SKF 10081), а также позднее идентифицированный ORL1-рецептор (лиганд = ноцицептин). Соответственно другим рецепторным системам исследования связывания, а также функциональные исследования показывают, что существуют подтипы опиоидных рецепторов. В типах - и -рецепторов описаны по 2 подтипа, -1 и 2-и -1 и -2. -Рецептор содержит дополнительный подтип -3. Что касается особенно -опиоидного рецептора, в данное изобретение включены главным образом два его подтипа. Термин "эндоскопия" относится к методам, применяемым для обследования или рассматривания внутренних полостей или полых структур организма. Термин "эндоскопия верхней части GI-тракта" относится к обследованию внутренней стороны верхней части желудочно-кишечного тракта, такой как пищевод, желудок и/или двенадцатиперстная кишка. Ее обычно осуществляют с помощью тонкого гибкого волоконно-оптического прибора, который проходит через рот и позволяет наблюдать слизистую оболочку пищевода, желудка и/или двенадцатиперстной кишки. Такой термин относится также к эзофагогастродуоденоскопии (EGD) или гастроскопии. Эндоскопия верхней части GI-тракта включает в себя также другие процедуры для GI-тракта, такие как эндоскопическая ретроградная холангиопанкреатография (ERCP). Применяемый в контексте термин "колоноскопия" относится к эндоскопическому обследованию прямой и ободочной кишки до илеоцекального клапана. Эту процедуру обычно выполняют CCDкамерой или волоконно-оптической камерой на гибкой трубке, проходящей через анус. Термин "амнестическое применение", используемый в контексте, относится к индуцированию амнезии, которая представляет собой частичную или полную потерю памяти. Термин "операционное вмешательство", применяемый в контексте, относится ко всем видам медицинского вмешательства в живой организм, либо инвазивного, либо неинвазивного, для диагностических и/или терапевтических целей. Медицинское вмешательство в частности включает в себя медицинские обработки, которые на регулярной основе, как предполагается, вызывают послеоперационную боль у пациента. В качестве термина-синонима для "операционной процедуры" в данном контексте применяют также термин "хирургия". Ручную или механическую вентиляцию легких определяют как внешнюю помощь при дыхании ручными или механическими способами, такими как, например, дыхание в маске или интубация. Выражение "фармацевтически приемлемая соль" относится к соли переменной стехиометрии, которая образована соединением формулы (I) и противоионом и которая является физиологически переносимой и/или обычно не вызывает аллергическую или подобную побочную реакцию, такую как расстройство желудка, головокружение и тому подобное, при введении млекопитающему. Применяемый в контексте термин "сольват" относится к комплексу переменной стехиометрии, образованному растворенным веществом (в данном изобретении соединением формулы (I), опиоидом или его солью) и растворителем. Такие растворители для цели изобретения могут не влиять на биологическую активность растворенного вещества. Примеры подходящих растворителей включают в себя, но не ограничиваются указанными, воду, метанол, этанол и уксусную кислоту. Предпочтительно применяемым растворителем является фармацевтически приемлемый растворитель. Примеры подходящих фармацевтически приемлемых растворителей включают в себя воду, этанол и уксусную кислоту. Наиболее предпочтительно применяемым растворителем является вода. Подробное описание изобретения Изобретение относится к бензодиазепину CNS 7056 ультракороткого действия или его фармацевтически приемлемой соли или сольвату, применяемому для индуцирования седации, притом что CNS 7056 вводят в сочетании с опиоидом. Оба лекарственных средства предпочтительно вводят внутривенно. Кроме того, оба лекарственных средства предпочтительно вводят в виде фиксированной дозы. Дозу CNS 7056 можно изменять от приблизительно 2 до приблизительно 10 мг, предпочтительно от приблизительно 3 (или 4) до приблизительно 9 мг и наиболее предпочтительно от приблизительно 5 до приблизительно 8 мг. В конкретном варианте осуществления настоящего изобретения вводят 10 мг CNS 7056. Таким образом, установлено, что фиксированная доза, определенная на основании предполагаемого воздействия лекарственного средства и клиренса, обеспечивает безопасную и эффективную дозу, особенно в контексте указанной выше схемы приема лекарственного средства. В одном варианте осуществления изобретения CNS 7056 вводят в виде инъекции болюса с концентрацией CNS 7056 1 мг/мл. В предпочтительном варианте осуществления изобретения по меньшей мере одну дозу пополненияCNS 7056 вводят после начальной дозы CNS 7056. Доза пополнения составляет от приблизительно 1,5 до приблизительно 4 мг, предпочтительно приблизительно 2 и приблизительно 3 и наиболее предпочтительно 2 или 3 мг. В предпочтительном аспекте настоящего изобретения CNS 7056 вводят в виде фиксированной дозы, тогда как начальную дозу и дозы пополнения сочетают следующим образом:a) 8 мг начальной дозы плюс 2 или 3 мг дозы пополнения, илиb) 7 мг начальной дозы плюс 2 или 3 мг дозы пополнения, илиc) 5 мг начальной дозы плюс 2 или 3 мг дозы пополнения, илиd) 4 мг начальной дозы плюс 2 или 3 мг дозы пополнения, илиe) 3 мг начальной дозы плюс 2 или 3 мг дозы пополнения. В конкретном варианте осуществления начальную дозу и дозы пополнения выбирают так, чтобы обеспечить максимальную дозу 10 мг на лечение. В следующем предпочтительном аспекте изобретения CNS 7056 вводят в виде фиксированной дозы, тогда как начальную дозу и дозы пополнения сочетают следующим образом:a) 8 мг начальной дозы плюс 3 мг дозы пополнения, илиb) 7 мг начальной дозы плюс 2 мг дозы пополнения, илиc) 5 мг начальной дозы плюс 3 мг дозы пополнения. В одном аспекте изобретения пациенты получают одну начальную внутривенную дозу CNS 7056 на протяжении одной минуты. В другом аспекте изобретения дозу пополнения CNS 7056 вводят не менее чем через 2, предпочтительно 3 мин, более предпочтительно 4 мин и, предпочтительно, не позднее чем через 5 мин после введения начальной дозы или предыдущей дозы пополнения. В одном аспекте изобретения вводят максимально шесть доз пополнения CNS 7056, так что не более семи доз CNS 7056 вводят на одно лечение. Тем не менее авторы изобретения установили, что при начальной дозе до 10 мг необходимы - если вообще необходимы - только от 1 до 3, предпочтительно не более чем 2 дозы пополнения. Таким образом, в одном аспекте настоящего изобретения число доз пополнения меньше 3, предпочтительно даже меньше 2. Медицинская обработка (медицинское вмешательство) и, таким образом, требуемая седация согласно изобретению предпочтительно продолжается менее одного часа, предпочтительно менее 45 мин и более предпочтительно менее 30 мин. Согласно изобретению дозы пополнения могут содержать одинаковые или разные количества CNS 7056, тогда как применение одинаковых количеств CNS 7056 является предпочтительным. В другом аспекте изобретения схему приема лекарственного средства регулируют так, чтобы поддерживать показатель в баллах MOAA/S не более 4 (включая 4), предпочтительно от 1 до 4, более пред-5 024926 почтительно от 2 до 4. Это регулирование предпочтительно выполняют изменением числа доз пополнения в зависимости от дозы пополнения или интервала времени между дозами пополнения или изменением того и другого. В следующем предпочтительном аспекте изобретения изменение интервала времени между дозами пополнения применяют для поддержания уровня показателя в баллах MOAA/S. Таким образом, интервал времени сокращают в случае, если пациент проявляет уменьшенную седацию, и пролонгируют в случае увеличенной седации. В следующем аспекте изобретения схему приема лекарственного средства регулируют для того,чтобы индуцировать и/или поддерживать седацию от легкой до умеренной, которую можно оценить посредством MOAA/S и классифицировать по следующей схеме. В одном варианте осуществления профиль седации изобретения предпочтительно характеризуют следующим образом:MOAA/S4 при трех последовательных измерениях, например, проводимых каждую минуту; отсутствие необходимости для дополнительной седации (например, сохранение седации); отсутствие ручной или механической вентиляции. Поэтому в одном варианте осуществления изобретение относится к применению CNS 7056 в сочетании с опиоидом (например, фентанилом) без механической или ручной вентиляции легких пациента. Тем не менее возможна подача дополнительного кислорода. В следующем аспекте изобретения CNS 7056 вводят в виде фиксированной дозы на пациента. Это стратегия дозирования основана на имеющем широкое применение анализе PK/PD, который показал, что масса тела не была статистически значимым предиктором системного клиренса или воздействия CNS 7056, и такое дозирование в единицах мг/кг не дает преимущества с точки зрения безопасности или эффективности. В другом аспекте изобретения CNS 7056 дают взрослым пациентам, т.е. пациентам, которые имеют возраст 18 лет или больше. Способы получения CNS 7056 вместе с фармацевтически приемлемыми формами описаны в заявке на Европейский патент ЕР 1183243 В 1. В ней описаны также подходящие формы для применения в фармацевтических композициях. Этот документ включен в качестве ссылки для описания изготовления фармацевтически приемлемых форм CNS 7056. Соединение CNS 7056 можно применять в виде формы свободного основания или в виде фармацевтически приемлемой соли. В качестве предпочтительной соли можно применять безилатную или эзилатную соль CNS 7056. Безилатные и эзилатные соли CNS 7056 описываются в заявках на патенты РСТ WO 2008/007071 и WO 2008/007081 соответственно. Такие соли, описываемые в них, включены в качестве ссылки. В следующем предпочтительном аспекте изобретения безилатную соль CNS 7056 применяют в одной из полиморфных форм соли 1, 2, 3 или 4, как описано в заявке на патент РСТ WO 2008/007071. Эти полиморфные формы, описанные в ней, полностью включены в качестве ссылки. В другом аспекте изобретения эзилатную соль CNS 7056 применяют в полиморфной форме соли 1 или 2, как описано в патентной заявке РСТ WO 2008/007081. Эти полиморфные формы, описываемые в ней, полностью включены в качестве ссылки. Согласно изобретению бензодиазепин CNS 7056 ультракороткого действия вводят в виде внутривенного (IV) болюса, предпочтительно в виде внутривенного болюса в течение менее 1 мин, более предпочтительно менее 30 с и наиболее предпочтительно приблизительно 15 с, что эквивалентно ручному применению внутривенного лекарственного средства. В одном аспекте изобретения опиоидное лекарственное средство предпочтительно выбирают из группы, состоящей из морфина, кодеина, тебаина, папаверина, наркотина,героина, гидроморфона, дигидрокодеина, тебакона, гидрокодона, оксиморфона, оксикодона, кетобемидона, петидина, анилеридина, пиминодина, феноперидина, фуретидина, [альфа]продина, тримеперидина, мептазинола, профадола, метадона, декстроморамида, левометадилацетата, фенадоксона, дипипанона, темалона, декстропропоксифена, N-метилморфинана, леворфанола, декстрометорфана, буторфанола, пентазоцина, феназоцина, кетоциклазоцина, бремазоцина, суфентанила, карфентанила, фентанила,лофентанила, алфентанила, охмефентанила, ремифентанила, питрамида, бензтриамида, дифеноксилата,лоперамида, трамадола, тилидина, U-50488, 1-бензил-4-(4-бромфенил)-4-диметиламиноциклогексанола; алфентанила, бупренорфина, буторфанола, кодеина, декстроморамида, декстропропоксифена, дезо-6 024926 цина, диаморфина, дигидрокодеина, дифеноксилата, этилморфина, эторфина, гидрокодона, гидроморфона, кетобемидона, левометадона, левометадил-ацетата, леворфанола, мептазинола, морфина, налбуфина,налорфина, оксикодона, оксиморфона, пентазоцина, петидина, пиритрамида, ремифентанила, суфентанила, тилидина, трамадола, тапентадола,мет-энкефалина, лей-энкефалина, ноцицептина, -эндорфина, эндоморфина-1, эндоморфина-2, меторфамида, динорфина-А, динорфина-В или -неоэндорфина. Аналгезирующее лекарственное средство вводят предпочтительно в виде внутривенного болюса. В более предпочтительном аспекте изобретения пациент получает аналог фентанила согласно формуле (II)R7 представляет собой арил, гетероарил или COOR8. В наиболее предпочтительном аспекте изобретения пациент получает аналог фентанила, выбранный из группы, состоящей из фентанила, алфентанила, карфентанила, лофентанила, ремифентанила, суфентанила, тиофентанила, -метилтиофентанила, -метилацетилфентанила, -метилфентанила, охмефентанила, -гидроксифентанила, парафторфентанила, 3-метилфентанила, или его соль или сольват. Эти аналоги фентанила характеризуются структурой формулы (II), в которой остатки R1 - R7 имеют следующие значения. В конкретном предпочтительном аспекте изобретения пациент получает фентанил или его фармацевтически приемлемую соль или сольват. Результаты анализа PK/PD показали фармакодинамическое взаимодействие между фентанилом иCNS 7056, когда применение фентанила было в пределах от 5 до 10 мин до первоначального введенияCNS 7056. Это взаимодействие между фентанилом и CNS 7056 подкрепляется также результатами кли-7 024926 нического исследования CNS 7056-002, в котором CNS 7056 применяли в сочетании с фентанилом, так как в этом исследовании более низкие дозы CNS 7056 приводили к подходящей седации по сравнению с исследованиями CNS 7056-001 и 7056-003, в которых CNS 7056 применяли в качестве единственного агента (см. фиг. 1 А в сравнении с фиг. 1 В). Дозы, которые приводили к достаточной седации для выполнения процедуры (т.е. MOAA/S меньше или равно 4) при исследовании CNS 7056-002, в котором 64100% испытуемых субъектов получали от 0,04 до 0,1 мг/кг CNS 7056 плюс дозы пополнения 0,04 мг/кг в дополнение к 50 мкг фентанила для того, чтобы сохранять седацию в течение периода 30 мин. При исследовании CNS 7056-003 разовые дозы CNS 7056 от 0,1 до 0,2 мг/кг без сопутствующего фентанила приводили к достаточной седации у 32-64% пациентов. Это подтверждает безопасное применение фентанила в сочетании с CNS 7056. Достаточный аналгетический диапазон, обеспечиваемый фентанилом, снижает также необходимость доз пополнения CNS 7056, что приводит к более стабильной ситуации при седации от легкой до умеренной и позволяет избежать частых падений уровней MOAA/S до 0. В одном аспекте изобретения фентанил, который вводили по схеме приема фиксированной дозы,предпочтительно составлял от 50 до 200 мкг/пациента, более предпочтительно от 75 до 150 мкг/пациента и наиболее предпочтительно 100 мкг/пациента. Как указано выше, результаты анализа PK/PD не обнаружили никакого доказательства фармакодинамического взаимодействия между фентанилом и CNS 7056. Это отсутствие взаимодействия PD позволяет вводить фентанил в широком диапазоне доз, как указано в контексте. Эта довольно высокая доза фентанила, особенно при введении незадолго до начала диагностических или терапевтических вмешательств, приводит к максимальному аналгезирующему диапазону в начале диагностического или терапевтического вмешательства. В наиболее предпочтительном аспекте изобретения 100 мкг фентанила вводят непосредственно перед введением начальной фиксированной дозы CNS 7056 или вместе с начальной фиксированной дозойCNS 7056. В следующем аспекте изобретения фентанил вводят не ранее, чем за 10 мин перед введением CNS 7056, предпочтительно в течение по меньшей мере 5 мин перед введением CNS 7056, более предпочтительно в течение по меньшей мере 3 мин перед введением CNS 7056 и наиболее предпочтительно вместе с CNS 7056. Короткий промежуток времени между введением доз фентанила и CNS 7056 приводит к максимальному аналгезирующему диапазону в начале диагностического или терапевтического вмешательства. Это важно для процедур, которые начинаются с болезненных вмешательств. В качестве примера, при колоноскопии введение колоноскопа и его перемещение через сигмовидный изгиб толстой кишки в начале процедуры является наиболее неудобной и болезненной частью процедуры. В одном аспекте настоящего изобретения вводят по меньшей мере одну дополнительную дозу (дозу пополнения) фентанила, предпочтительно в диапазоне от 10 до 100 мкг/пациента, более предпочтительно в диапазоне от 10 до 75 мкг/пациента и наиболее предпочтительно 25 мкг/пациента. В следующем аспекте изобретения промежуток времени между первой дозой фентанила и дозой пополнения и/или между двумя дозами пополнения находится в диапазоне от 2 до 10 мин, предпочтительно от 2,5 до 7,5 мин и наиболее предпочтительно 5 мин. В одном аспекте изобретения максимальная доза фентанила на лечение не превышает 200 мкг/пациента. В одном аспекте настоящего изобретения CNS 7056 вводят в комбинации с производным фентанила алфентанилом, в котором алфентанил вводят при дозе от 5 до 80 мкг/кг массы тела, предпочтительно от 8 до 75 мкг/кг массы тела и наиболее предпочтительно от 8 до 40 мкг/кг массы тела. В следующем аспекте изобретения CNS 7056 вводят в сочетании с производным фентанила суфентанилом или ремифентанилом, в котором суфентанил или ремифентанил вводят при дозе от 0,5 до 2 мкг/кг массы тела, предпочтительно от 0,75 до 1,5 мкг/кг массы тела и наиболее предпочтительно от 1 до 2 мкг/кг массы тела. Согласно одному варианту осуществления изобретения пациенты получают инфузию солевого раствора до, во время или после введения начальной дозы. В предпочтительном варианте осуществления указанный солевой раствор является физиологическим солевым раствором. В следующем предпочтительном варианте осуществления физиологический солевой раствор вводят в виде инфузии, начиная ее до применения нагрузочной дозы опиоида и/или CNS 7056. В следующем предпочтительном варианте осуществления от 500 до 100 мл обычного солевого раствора вводят в виде капельной инфузии перед введением фентанила. Согласно другому варианту осуществления изобретения пациенты получают дополнительный кислород, который предпочтительно подают во время седации от легкой до умеренной или глубокой седации и/или в случае пожилых пациентов. Кислород можно вводить при помощи кислородной палатки или более предпочтительно кислородной маски или носовой канюли. В предпочтительном варианте осуществления изобретения введение дополнительного кислорода можно начинать незадолго до процедуры(например, за десять минут до начального введения CNS 7056) и можно продолжать со скоростью от 2 до 4 л/мин до тех пор, пока пациент не будет полностью в активном состоянии. В другом варианте осуществления изобретения пациенты не получают дополнительный кислород. Согласно одному аспекту изобретения схему приема лекарственного средства применяют в качестве процедурной седации, предпочтительно для выполнения эндоскопии, более предпочтительно эндоскопии верхней части GI-тракта или колоноскопии. В другом аспекте изобретения CNS 7056 применяют для доперационной седации, амнезии для пред- и послеоперационных периодов или седации в состоянии сознания во время коротких диагностических, операционных или эндоскопических процедур. В другом аспекте изобретения CNS 7056 в качестве изобретения применяют для коротких процедур, таких как вправление поврежденных конечностей или перевязку ран. В предпочтительном аспекте изобретения CNS 7056 применяют для аналгоседации. В другом аспекте изобретения применение CNS 7056 противопоказано для пациентов с известной гиперчувствительностью к бензодиазепинам и пациентов с острой закрытоугольной глаукомой. CNS 7056 можно применять для пациентов с открытоугольной глаукомой, только если они получают подходящую терапию. В другом варианте осуществления изобретения CNS 7056 поставляют в контейнере для фармацевтического применения, содержащем 10 мг CNS 7056, предпочтительно при концентрации 1 мг/мл, например во флаконе, ампуле, шприце или тому подобном контейнере. Контейнер, содержащий 10 мг CNS 7056, предпочтительно включает в себя лекарственный продукт, предпочтительно готовый к применению лекарственный продукт. В следующем аспекте изобретения фармакологическое действие бензодиазепина CNS 7056 с ультракоротким действием и/или опиоидное лекарственное средство можно заменить на другое лекарственное средство, которое называют "заменяющим агентом". В качестве заменяющего лекарственного средства для бензодиазепина CNS 7056 с ультракоротким действием применяют антагонист рецептора GABA, который предпочтительно является флуменазилом. В качестве заменяющего лекарственного средства для опиоидного лекарственного средства применяют антагонист рецептора опиоида, предпочтительно налоксон. Пример 1. Основными задачами анализа были подгонка фармакокинетических и фармакодинамических (особенно модифицированной оценки наблюдателем показателей в баллах активного состояния/седации(MOAA/S моделей к данным, полученным при исследовании CNS 7056-001 и CNS 7056-002, и применение полученных параметров для имитации результатов различных схем приема лекарственных средств с целью прогнозирования оптимальной схемы приема для CNS 7056. Второстепенной задачей было исследование фармакодинамического взаимодействия между CNS 7056 и фентанилом во время исследования CNS 7056-002. Материалы и методы Исследование CNS 7056-001. Фармакокинетические данные получали после того, как CNS 7056 вводили внутривенной инфузией на протяжении одной минуты группам здоровых волонтеров в следующих дозах: 0,01, 0,025, 0,05, 0,075,0,1, 0,15, 0,2, 0,25 и 0,3 мг/кг. Получали образцы как артериальной (1, 2, 3, 4, 6, 8, 10, 12, 15, 20, 30, 45 мин и 1, 2, 3, 4 ч после введения дозы), так и венозной (2, 3, 4, 6, 8, 12 ч) крови, содержащей CNS 7056 и его метаболит, CNS 7054, из применяемых катетеров. Концентрации CNS 7056 и CNS 7054 измеряли с помощью ВЭЖХ с последующим масс-спектрометрическим детектированием. Измерения седации (показатели в баллах MOAA/S и биспектрального индекса (BIS и систолического и диастолического кровяного давления проводили через регулярные интервалы времени. Исследование CNS 7056-002. Во второй части исследования все субъекты получали 50 мкг внутривенной дозы фентанила а затем еще 25 мкг, если ослабление начальной боли было недостаточным. Трем группам 15 пациентов давали нагрузочные дозы CNS 7056 0,04, 0,075 или 0,1 мг/кг, причем более высокие дозы вводили только после того, как была оценена безопасность более низких доз. Вводили максимально две дополнительные дозыCNS 7056 по 0,04 мг/кг, но с промежутком времени между ними не менее чем две минуты, для получения адекватной седации (MOAA/S3) для введения колоноскопа. Затем дозы 0,04 мг/кг CNS 7056 вводили во время процедуры, но не ранее, чем через две минуты после предыдущей дозы, для того, чтобы поддерживать уровень MOAA/S4 в течение 30 мин, причем не более семи доз (начальная доза и шесть доз пополнения) можно вводить любому субъекту. Соотношение полов у субъектов в каждой группе было 7:8. Уровни CNS 7056 в венозной плазме крови измеряли через 1, 5, 10, 20 и 30 мин и 1, 2, 4, 6, 8, 12 и 24 ч после введения дозы. Анализ. Основанные на физиологии и состоящие из трех- и четырех компартментов фармакокинетические модели подгоняли к уровням CNS 7056 в артериальной и венозной плазме крови из объединенных данных, полученных при исследованиях CNS 7056-001 и CNS 7056-002 с применением программы нелиней-9 024926 ного моделирования, NONMEM. Возможное влияние масса тела, пола и частоты сердечных сокращений на объемы и клиренс изучали ковариационным анализом. Фармакокинетические параметры, полученные из предпочтительных моделей, применяли затем для имитации артериальных концентраций лекарственного средства в моменты времени, в которых получали фармакодинамические данные, показатели в баллах MOAA/S и кровяное давление, и сигмоидные ингибирующие фармакодинамические модели подгоняли к наблюдениям с помощью модели "связи", снова с применением NONMEM. Число неожиданных,по-видимому, случайных повышений показателей в баллах MOAA/S с короткой продолжительностью идентифицировали в пределах набора данных и относили к внешним стимулам, таким как острая боль при колоноскопии или обработке сестринским персоналом; их моделировали введением ковариата, который увеличивал ЕС 50. Другой ковариат, "фактор скопим", который также увеличивал ЕС 50, добавляли к модели для имитации пониженной седации во время фактической процедуры колоноскопии, вызванной общим раздражением. Поскольку никакие концентрации фентанила не были получены в ходе исследования CNS 7056-002, величины клиренсов и объемов распределения из истории болезни применяли для имитации уровней опиоида в плазме, так чтобы можно было разработать фармакодинамические модели гипотензии и взаимодействия с CNS 7056. Модель взаимодействия при седации вводила ковариат, оцененный приблизительно моделированием, который превращал имитированные уровни фентанила в плазме в концентрации CNS 7056 в участке действия. Фармакокинетический анализ популяции. Применяли подход последовательного анализа популяции, определяя сначала фармакокинетические параметры для CNS 7056 и затем применяя эти результаты для получения соответствующих фармакодинамических параметров. Применяли нелинейную программу моделирования смешанных эффектов(NONMEM, версия 6) для данных, используя условную оценку первого порядка методом взаимодействияCNS 7056 в артериальной и венозной плазме крови из объединенных наборов данных CNS 7056-001 иCNS 7056-002 (фиг. 2), используя подпрограмму ADVAN6, с допуском (TOL), установленным до пяти,для решения дифференциальных уравнений. Все модели содержали центральный компартмент, соответствующий венозной системе и другим тканям с высокой перфузией, артериальный, легочный, периферический и глубоко расположенные компартменты. Предполагалось, что клиренс CNS 7056-CNS 7054 имеет место из центрального, легочного или периферического компартмента или из печеночного компартмента (фиг. 2). Исследовали также комбинацию двух компартментов клиренса. Показано, что модели с введенным дополнительным, "более глубоко расположенным компартментом", т.е. модели с четырьмя компартментами, превосходят модели с тремя компартментами при исследовании CNS 7056-001. Поскольку проникновение CNS 7056 в эритроциты было неизвестно, оценивали сердечный выброс крови/плазмы во время процесса моделирования. Результаты Фармакокинетический анализ CNS 7056 популяции. Моделирование уровней CNS 7056 в артериальной плазме при исследовании CNS 7056-001 показало, что, хотя модель с тремя отделениями хорошо подгонялась к данным, соответствующая четырехкомпартментная модель с системным клиренсом из центрального компартмента давала значительно меньшую целевую функцию. Кроме того, предполагалось, что, когда клиренс имел место в периферическом компартменте, происходило дальнейшее существенное снижение в целевой функции. Таким образом, простейшие фармакокинетические модели на основе физиологии содержали три компартмента неизвестного объема плюс артериальный и легочный компартменты, объемы которых (артерии = 0,65 кг/70 кг, легкие = 1,0 кг/70 кг), как считалось, пропорциональны массе тела. Системный клиренс и клиренсы между двумя тканями были также неизвестными. Поскольку проникновение CNS 7056 в эритроциты было неизвестно, сердечный выброс крови/плазмы также нужно оценить в процессе моделирования. Эту модель расширяли до модели с четырьмя компартментами неизвестного объема и участку клиренса обеспечивали возможность быть центральным, периферическим, легочным или дополнительным печеночным компартментом, объем которого (1,5 кг/70 кг) и относительный кровоток (26% сердечного выброса), как считалось, являются объемом и относительным кровотоком стандартного субъекта. Вариабельность между индивидуумами (IIV или Eta) включали для системного клиренса, распределения центрального, периферического и глубоко расположенного объемов во всех моделях вместе с пропорциональными и аддитивными остаточными погрешностями. Пятый Eta, по объему четвертого компартмента,также исследовали с каждой моделью. Из простых трехкомпартментных моделей модель с клиренсом из легких (опыт 128S) была явно самой лучшей. Оказалось, что среди четырехкомпартментных моделей с двойным клиренсом, опыт 144S с клиренсом как из легких, так и печени, оказался самым лучшим с точки зрения самой низкой целевой функции. Сравнение параметров лучших фармакокинетических моделей на основе физиологии показано в табл. 1. Ковариационный анализ фармакокинетического анализа CNS 7056 популяции. Масса тела не предсказывает клиренс, объемы или кровоток. Вариабельность между индивидуумами сердечного выброса определяли и проводили ограниченный ковариационный анализ на основе трехкомпартментной модели в опыте 128S с легочным клиренсомCNS 7056. Когда массу тела рассматривали в качестве предсказателя клиренса (опыт 137S), объемов(опыты 130S, 152S, 153S) или кровотока (опыт 127S), целевая функция, по существу, была неизмененной, в этом случае не имела место конечная минимизация (табл. 2). Отсутствие влияния массы тела на клиренс CNS 7056, показанное незначительным изменением в целевой функции, когда вводили ковариат (опыт 137S, табл. 2), показали также построением кривой зависимости массы тела от подогнанных величин легочного клиренса с применением результатов опыта 128S (фиг. 3), причем угол наклона линейной регрессии равен 0,1 с R2 0,0155. Вывод: поскольку не обнаружили взаимосвязь между массой тела и системным клиренсом (фиг. 3),не имеется никакого преимущества в дозировании по массе с точки зрения состоятельности оценки воздействия на CNS 7056. Фармакодинамический анализ популяции. Цельные фармакодинамические модели подгоняли к данным MOAA/S, даже если они относились к нескольким категориям, поскольку в этом случае они являются более стабильными, т.е. когда имеется несколько категорий, и результаты легче интерпретируются. Простые сигмоидные фармакодинамические модели ингибирования плохо подгонялись к данным MOAA/S, и как было признано, необходимо было изменить набор данных для того, чтобы наблюдаемые показатели в баллах можно было точно подогнать. Одно- и двухминутный "пики" повышенных значений в баллах MOAAS/S идентифицировали в этом наборе данных и моделировали как увеличение ЕС 50 приблизительно на 30%. Неожиданный результат, что эффективность CNS 7056, выраженная как типичная ЕС 50, была такой же, как в исследованииCNS 7056-001 (с участием здоровых волонтеров) и CNS 7056-002 (с участием пациентов, подвергающихся колоноскопии) рационализировали предположением, что остаточная седации от дооперационной дозы фентанила приближенно сводится к нулю обычным раздражением на всем протяжении процедуры. Для объяснения этого вводили "фактор скопим", который обычно вызывал 10-12% увеличение ЕС 50. Фармакодинамический анализ CNS 7056 в данных MOAA/S. Все данные MOAA/S из исследований CNS 7056-001 и CNS 7056-002 применяли для фармакодинамического моделирования седации. Уровни их в артериальной плазме, вычисленные из фармакокинетических параметров, оцененных ранее на модели CNS 7056 PBPK128S, связывали с ингибирующим эффектом сигмоидной фармакодинамической модели седации посредством сайта гипотетического "эффекта" и константы степени задержки "ke0". EMIN устанавливали на показателе нуль и EMAX на пять для основных моделей MOAA/S и IIV включали для трех фармакодинамических параметров, ЕС 50, ke0 и коэффициента Хилла, . Поскольку основные модели минимизировали сингулярной R-матрицей, файлы контроля всех последующих моделей MOAA/S исправляли для включения команды МАТРИЦА=S для того,чтобы можно было проводить стадию ковариации. Наборы данных из исследований CNS 7056-001 и CNS 7056-002 анализировали по отдельности и затем после их объединения (табл. 3). Все параметры оценивали с хорошей точностью (среднее значениеRSE%: 5,4-7,9%) и IIV приблизительно 40% для всех трех фармакодинамических параметров (табл. 3). Не имелось никаких очевидных различий между тремя фармакодинамическими параметрами, причем различия ЕС 50 и ke0 отдельных исследований были в пределах приблизительно 10% (табл. 3). Объединенный набор данных "MOAASALL01S" применяли для последующего фармакодинамического моделирования. Ковариационный анализ фентанила в качестве прогностического фактора чувствительности к CNS 7056. Хотя фармакодинамические параметры моделей MOAA/S из исследований CNS 7056-001 и CNS 7056-002 были сходными, исследовали возможное действие фентанила, применяемого только во втором исследовании (табл. 4). Предполагалось, что в первой модели (MOAASALL05S) величина ЕС 50 была другой в присутствии фентанила, но полученная величина (0,338 мкг/мл) была очень сходной с величиной в его отсутствие (0,364 мкг/мл), и снижение в целевой функции по сравнению с моделью MOAASALL01S,которое предполагало, что на типичную величину ЕС 50 не оказывал влияние фентанил, было незначительным (OFV = -0,85, табл. 4). Когда принималась во внимание фактическая доза фентанила (0,50 или 75 мкг) (модель MOAASALL09S), уменьшение целевой функции было снова минимальным (OFV = 1,73, табл. 4). Анализ MOAA/S взаимодействия CNS-7056 и фентанила. Применение ковариационного анализа для исследования возможного фармакодинамического взаимодействия между фентанилом и CNS 7056 предполагает постоянное действие на протяжении периода наблюдения. Однако фентанил ввели за 5-10 мин до CNS 7056 и, поскольку его клиренс происходит очень быстро, концентрации к концу процедуры, вероятно, были относительно низкими. Соответственно этому анамнестические сведения (табл. 5) применяли для имитации подходящих уровней фентанила в плазме, и они, как предполагалось, отражались в качестве эквивалентных концентраций CNS 7056 в участке действия посредством параметра эквивалентности. Корректные диапазоны времени более поздних показателей в баллах МОАА S применяли во всех моделях взаимодействия CNS 7056-фентанил. Когда действие фентанила добавляли к основной модели, фактор эквивалентности был очень малым и слегка отрицательным (-4,46), и не было никакого значимого изменения в целевой функции (опыты FEN01AS и FEN03S, табл. 6). Однако когда сделали поправку на боль, связанную с колоноскопией,имелось значимое снижение в целевой функции (опыт FEN05S, AOFV = -67,6, табл. 6) и больший, положительный фактор концентрации-эквивалентности 21,5. Кроме того, действие, отнесенное к колоноскопу при снижении седации (т.е. увеличение ЕС 50), возросло с 11,6 до 14,5% (опыты FEN04S и FEN05S,табл. 6). Поправка на вариабельность в фармакодинамическом взаимодействии между субъектами дополнительно уменьшила целевую функцию на 35 (опыты FEN06S, FEN05S), хотя вариабельность между субъектами была большой при 162% и плохо оценивалась (табл. 6). Когда системные клиренсы фентанила и CNS 7056 являются сравнимыми приблизительно при 60 л/ч (табл. 5), относительные системные воздействия, по существу, являются пропорциональными отношению их соответствующих доз. Таким образом, для типичных разовых доз CNS 7056 и фентанила 7 и 0,05 мг, соответственно, системное воздействие будет составлять приблизительно 0,12 и 0,00083 мкгчас/мл для двух лекарственных средств. Фактор эквивалентности 20 будет, таким образом, повышать кажущееся воздействие фентанила до 0,017 мкгчас/мл, 14% от воздействия CNS 7056. Действия внезапных дополнительных стимулов вводили в модель взаимодействия фентанила с результатами (табл. 7), подобными результатам более простой модели (табл. 8, 9). Таким образом, стимулы в течение одной и одной/двух минут вызывают понижения целевой функции до 237 (опыт FEN07S) и 351(опыт FEN08S), соответственно, по сравнению с 253 и 371 для более простой модели (опыты MOAASALL21 и MOAASALL23, табл. 8). Сочетание влияний колоноскопа и дополнительных стимулов на ЕС 50 также снижало целевые функции (опыты FEN09S, FEN05S: AOFV = 363, таблицы 6 и 7) таким же образом, как для более простых моделей (опыты MOAASALL31 и MOAASALL18: AOFV = -352, табл. 9). Вариабельность между субъектами имела наименьший эффект при применении для дополнительных стимулов (опыт FEN11S, AOFV = -21, табл. 10), и уменьшении целевой функции для фактора концентрация-эквивалентность (AOFV = -63, опыт FEN14S) и параметра колоноскопии (AOFV = -73,опыт FEN18S) были сходными. Сочетания этих двух параметров давало предпочтительную модель, опытFEN19S, с целевой функцией 2053,7 по сравнению с наилучшей функцией без действия фентанила 2152,8 (MOAASALL32S, табл. 9, AOFV = -99,1). Прямое сравнение MOAASALL27S и опыта FEN11S(OFV = 2169,0), которые имели вариабельность между индивидуумами (IIV) по тем же параметрам, демонстрирует улучшение целевой функции на 24,5 с моделью взаимодействия. Как и в случае более простых способов, набор данных модифицировали, причем нулевые оценки в баллах изменяли до отрицательных величин. Точное соответствие наблюдаемых и подогнанных показателей в баллах после округления величин до целых чисел было 70% для конечной модели взаимодействием фентанила с 23% результатов, отличающихся на одну единицу. Модель дополнительно оптимизировали способом, аналогичным способу для более простой модели, как описано выше, чтобы максимизировать соответствие наблюдаемых и моделированных нулевых показателей в баллах (табл. 11). В этом случае разница между целевыми функциями соответствующих моделей была 19 и 51, но увеличивалась до 221 путем заменыIIV на факторы концентрация-эквивалентность и скопии для EMIN (табл. 12). Эта модель взаимодействия предполагала, что концентрации фентанила в участке действия были эквивалентны концентрациям CNS 7056 после умножения на фактор концентрации-эквивалентности, определяемый моделированием. Среднее значение этого фактора для популяции было 28 (табл. 13) и колебалось от 6 до 330 (табл. 14). Принимая во внимание, что типичные дозы загрузки CNS 7056 были примерно в 100 раз выше доз фентанила(общие дозы вплоть до в 3-4 раза выше) и что клиренсы двух соединений являются сравнимыми, можно считать, что фентанил может способствовать, в порядке возрастания на четверть, седации доз загрузкиCNS 7056 (средняя доза = 5,5 мг) и может повышать на 5-10% общее действие (средняя общая доза = 19,4 мг). Фармакодинамический анализ с применением метода Монте-Карло. Имитации методом Монте-Карло проводили с применением фармакодинамических параметров как предпочтительной простой модели, так и моделей взаимодействия CNS-7056-фентанила с оценками в баллах MOAA/S, изменяя дозы загрузки и дозы пополнения и включая аналогичную долю пиков пониженных оценок в баллах MOAA/S. Всего было проведено 1000 имитаций Монте-Карло при диапазоне схем приема лекарственного средства, которые вероятно были подходящими для CNS 7056 (табл. 15), с применением фармакодинамических параметров из опыта MOAASALLMIN61S (табл. 16). Имитации давали дробные показатели в баллах MOAA/S, которые округляли до ближайшего целого числа, причем отрицательные числа считали равными нулю. Результаты моделирования автоматически предполагали,что всех пациентов лечили таким же методом, как и методы исследований CNS 7056-001 и CNS 7056-002(т.е. без применения фентанила и колоноскопии или с применением фентанила (50 мкг или 75 мкг за 5-10 мин до введения CNS 7056) плюс колоноскопии). Исследование проводили по следующему протоколу: начальные дозы CNS 7056 должны быть достаточны, чтобы получить адекватную седацию (оценка в баллах MOAA/S три или меньше) для большинства субъектов, так чтобы можно было ввести колоноскоп; одну или две дозы пополнения разрешали вводить, если показатели в баллах MOAA/S все еще были выше трех. Если они были недостаточными, считали, что субъект исключается из исследования; дополнительные дозы пополнения вплоть до максимального общего числа шести разрешали для поддержания седации с показателем в баллах ниже пяти для процедуры продолжительностью 24 мин после первой дозы CNS 7056. Считалось, что субъекты, у которых оценка в баллах MOAA/S достигала пяти в течение 24 мин после введения первой дозы, являются неудачными для исследования; нулевые показатели в баллах MOAA/S следует избегать у такого большого числа субъектов, как это возможно; минимальный интервал времени между двумя дозами установили как две минуты; дополнительные стимулы произвольно имитировали при отношении числа стимулов (815/1000 субъектов), сравнимом с отношением числа стимулов, наблюдаемом в исследованиях CNS 7056-001 иCNS 7056-002, хотя ни один субъект не имел более четырех импульсов боли. Фармакодинамические имитации способом Монте-Карло генерировали 1000 непрерывных кривыхMOAA/S для каждой схемы приема лекарственного средства и их преобразовали в показатели баллов от нуля до пяти и, следовательно, для четырех критических параметров, которые следовало либо минимизировать (процентные нулевые показатели в баллах, исключения из исследования, неудачи - т.е. субъекты, которые были "способны перенести скопию", но седация у которых не сохранялась в течение 24 мин при применении максимально шести доз пополнения), либо максимизировать (процент "способных перенести скопию" после нагрузочной дозы CNS 7056). Подсчитывали также среднее число доз пополнения и, следовательно, среднюю общую дозу CNS 7056. Число имитируемых исключений из исследования зависело как от фиксированной нагрузочной дозы, так и фиксированных доз пополнения; таким образом, можно было ожидать долю исключений 5% после следующих схем введения: 9/2,5, 8/3, 7/3,5, 6/4 и 5/4,5 мг (фиг. 4). Аналогично этому, предсказали 4-5% нулевых показателей баллов, которые были связаны со схемами введения 9/2,5, 8/3 и 7/3,5 мг. При более низких нагрузочных дозах 5 и 6 мг нулевые показатели в баллах определялись только величиной доз пополнения, 4% после доз 3,5 мг (фиг. 4). Степень неудач также зависела только от величины доз пополнения, причем предсказанные 5% неудач, обнаружили при дозах 3 мг (фиг. 4). Часть имитированных субъектов, чьи показатели в баллах MOAA/S были ниже трех после нагрузочной дозы CNS 7056 (т.е. считалось, что они перенесли колоноскопию), составляла 90, 83, 72, 57 и 38 после доз 9, 8, 7, 6 и 5 мг соответственно. Исследовали влияние изменения интервалов минимального времени между дозами CNS 7056. Интервалы времени более длинные, чем стандартные две минуты, могут уменьшить вероятность неудач,пациенты, переходящие в активное состояние слишком рано, потому что максимальное допустимое число доз пополнения было принято задолго до конца процедуры. Например, имитации давали степень неудач 5% при схеме приема лекарственного средства 6/3 мг с 2-минутным интервалом времени, но только 0,2% с 4 минутами интервала (табл. 17). Тем не менее еще более длительные интервалы времени увеличивали степень неудач (табл. 17). Более длительные интервалы времени должны также уменьшить возможность передозировки (и, следовательно, увеличить долю нулевых показателей в баллах) после "импульса" пониженной седации после дополнительного стимула. Однако имитации не показали, что это было вероятным, и не было значимого уменьшения в нулевых показателях в баллах (табл. 17). Опасность того, что пациент станет полностью активным во время процедуры, будет поэтому, вероятно, перевешивать снижение степени неудачи. Это определение неудачи предполагает, что процедура будет длиться в течение полных 24 мин; эти субъекты не могут быть отнесены к категории неудачных, если колоноскопию завершали раньше или если применяли одну дополнительную дозу пополнения. Фармакодинамическая имитация, основанная на анализе взаимодействия CNS 7056-фентанил. Имитации, основанные на модели взаимодействия CNS 7056-фентанил, давали сходную долю исключения для более простой модели (например, 42% по сравнению с 44% при схеме введения лекарственного средства 6/4 мг и 50 мкг, введенных за четыре минуты до введения CNS 7056, табл. 18, 15), но число нулевых оценок в баллах было больше (9,95% по сравнению с 6,46% при той же схеме введения). Доля субъектов, находящихся "в состоянии, пригодном для скопии", после нагрузочной дозы была несколько выше (604%o в противоположность 567%o). Однако основное различие было в числе неудач,субъектов, претерпевающих процедуру, но достигающих показатель в баллах MOAA/S пять в течение 24 мин, несмотря на шесть доз пополнения CNS 7056 (например, 86% по сравнению с 13% при схеме введения 6/4 мг). Все эти различия можно объяснить более крутой кривой концентрация-ответ модели взаимодействия (типичные коэффициенты Хилла = 5,16 и 4,03, табл. 19, 16). Увеличение доз фентанила вызывало зависимое от дозы увеличение максимальной седации при сочетании с фиксированной дозой CNS 7056, приблизительно на одну единицу MOAA/S на 50 мкг опиоида(фиг. 5). Удвоение дозы 50 мкг фентанила уменьшало долю исключения пациентов из анализа примерно на 40% (например, от 9,3 до 5,7% при схеме приема лекарственного средства 6/3 мг), но увеличивало число нулевых показателей в баллах MOAA/S примерно на 40% (фиг. 6, табл. 18). Такое же изменение в дозе фентанила увеличивало часть субъектов, "способных перенести скопию", после нагрузочной дозыCNS 7056 на 5-50% в зависимости от дозы CNS 7056 (фиг. 6, табл. 18), но не влияло на степень неудач. На эффект взаимодействия CNS 7056-фентанил сильно не влиял интервал времени между введением этих двух соединений, причем интервалы времени 0-7 мин давали сравнимые результаты по максимальной седации и числа нулевых показателей в баллах, исключений из анализа и неудач (фиг. 7, табл. 20). В целом, схема введения 8/3 мг будет, по-видимому, оптимальной, так как имитации показывают высокую долю субъектов, способных перенести скопию после нагрузочной дозы и доз пополнения, и всего 5% или меньше исключений из анализа, неудач и нулевых показателей в баллах (табл. 18, 21). Выводы Набор данных, состоящий преимущественно из уровней CNS 7056 в плазме артериальной крови, из исследования CNS 7056-001, объединяли с набором данных уровней в плазме венозной крови из исследования CNS 7056-002 для того, чтобы артериальные уровни, необходимые для фармакодинамических моделей популяции, можно было имитировать для последнего исследования. Фармакокинетические модели на основе физиологии с тремя или четырьмя компартментами неизвестного объема плюс легочный и артериальный компартменты, объемы которых, как считали, были пропорциональны массе тела, подгоняли к этим данным. Моделирование показало, что легкие были основным метаболическим органом для CNS 7056, причем печень возможно способствует клиренсу лекарственного средства только на 10%. Оценка показала,что легочный клиренс и пресистемный метаболизм составляли приблизительно 28%. Масса тела не была статистически значимым предиктором системного клиренса CNS 7056, и поэтому дозирование в единицах мг/кг не дает преимущество с точки зрения состоятельности оценки воздействия на CNS 7056. Цельные фармакодинамические модели показателей в баллах MOAA/S подгоняли к наблюдаемым данным. Первую, более простую, модель подгоняли непосредственно к исходным данным и любые эффекты различий в схемах приема фентанила включали в фармакодинамические параметры. Вторая модель имитировала концентрации фентанила при использовании таких же фармакокинетических параметров истории болезни для всех субъектов и была способна оценить фармакодинамическое взаимодействие между CNS 7056 и фентанилом. 50 мкг доза фентанила обычно обеспечивала приблизительно 5-10% седативного действия 20 мг общей дозы CNS 7056, суммированной на протяжении всей процедуры. Острый эффект был более значительным, причем доза 50 мкг была ответственной за дополнительное максимальное снижение показателя в баллах MOAA/S приблизительно на одну единицу при сочетании с CNS 7056. Обе модели улучшали введением "фактора скопим", который увеличивал ЕС 50, и показал снижение седации, являющееся результатом присутствия колоноскопа и "фактора боли", которые также повышали ЕС 50, и соответствовали резким "пикам" повышенного показателя в баллах MOAA/S. Несмотря на значительные улучшения в качестве моделей с такими модификациями, показанные снижениями в целевой функции на несколько сотен, наблюдаемые нулевые показатели в баллахMOAA/S были все же недостаточно подогнанными. Этот недостаток преодолели изменением нулевых оценок в баллах в наборе данных в отрицательные величины (-1,25 или -1,3). Точное соответствие наблюдаемых и подогнанных показателей в баллах было 70% для конечной модели взаимодействия фентанила с 23% результатов, отличающихся на одну единицу. Модель взаимодействия CNS-7056-фентанил подгоняла наблюдаемые данные значительно лучше,чем более простая модель (-OFV-30). Однако ее основное преимущество являлось результатом ее способности включать вариабельность между субъектами как в очень вариабельную скопию, так и в факторы концентрация-эквивалентность (OFV-200). Имитации Монте-Карло схем приема лекарственного средства широкого диапазона предполагали,что нагрузочная доза 8 мг CNS 7056 плюс 100 мкг фентанила с последующими дозами пополнения 3 мг с интервалами введения не менее 2 мин могла быть бы оптимальной с точки зрения минимизации исключения субъектов, нулевых показателей в баллах MOAA/S и неудач (субъекты, седация у которых не сохранялась удовлетворительной в течение 24 мин с 6 дозами пополнения) и максимизации числа доз, подходящих для введения колоноскопа после приема нагрузочной дозы CNS 7056. Если интервал времени между введением доз фентанила и CNS 7056 был небольшим, он обуславливал малое различие в имитациях, это указало на то, что нагрузочную дозу CNS 7056 можно было ввести в любое время между временем введения фентанила и 6-7 мин позже. Пример 2. Исследование фазы IIb ремимазолама по сравнению с мидазоламом при применении комбинации фиксированных доз. Схема исследования. Исследование фазы IIb было двойным слепым, рандомизированным исследованием в параллельных группах с применением трех схем приема ремимазолама (CNS 7056) по сравнению с мидазоламом с участием 160 пациентов, подвергающихся колоноскопии. Пациенты получали любую одну из трех различных начальных доз ремимазолама или мидазолама с последующим введением "доз пополнения" (т.е. множества доз), требуемых для поддержания адекватного уровня седации для проведения стандартной процедуры колоноскопии. Исследование - проводили в США во множестве мест - было предназначено для оценки безопасности ремимазолама и достижения успеха в седации, определения времени пиковой седации, а также времени для полного восстановления сознания и выписки пациента из лечебного учреждения, по сравнению с золотым стандартным агентом, мидазоламом. Кроме того, на основе результатов успешно завершенных исследований фаз Ib и IIa, это исследование разработали для дополнительного уточнения оптимальной схемы приема лекарственного средства перед переходом к фазе III. Следующие данные основаны только на анализе ITT (для цели лечения). Пациенты получали одну из следующих доз мидазолама или ремимазолама: Мидазолам - 2,5 мг с 1,0 мг дозами пополнения (40 пациентов); Ремимазолам - 8,0 мг с 3,0 мг дозами пополнения (40 пациентов); Ремимазолам - 7,0 мг с 2,0 мг дозами пополнения (40 пациентов); Ремимазолам - 5,0 мг с 3,0 мг дозами пополнения (40 пациентов). Дозу мидазолама выбирали в качестве ссылочной дозы. Дозы ремимазолама выбирали на основе результатов трех предыдущих клинических испытаний, предсказываемых всесторонним анализом PK/PD(см. пример 1). Результаты Успехом процедуры был комбинированный конечный результат, состоящий из седации, достаточной для инициирования и завершения процедуры, отсутствия механической или ручной вентиляции и отсутствия избавления от седации. Степень успеха (ITT) с мидазоламом был 75%. Степень успеха с ремимазоламом составила 97,5% при схеме приема самой низкой дозы, 95% при схеме приема средней дозы и 92,5% при схеме приема самой высокой дозы лекарственного средства. Быстрое восстановление сознания до полностью активного состояния (13,3 мин при схеме введения самой низкой дозы, 11,3 мин при схеме введения средней дозы и 13,6 мин при схеме введения максимальной дозы) и короткий промежуток времени для восстановления сознания (13,5 мин при схеме приема самой низкой дозы, 14 мин при схеме приема средней дозы и 16,8 мин при схеме приема самой высокой дозы) наблюдали во всех группах, получавших ремимазолам. Время для возвращения в полностью активное состояние было короче в группах ремимазолама по сравнению с мидазоламом. Современная интерпретация PAION состоит в том, что относительно короткое время пробуждения в случае мидазолама относят к тому факту, что 25% пациентов, получающих мидазолам, не поддавались лечению и поэтому получали пропофол, который известен как очень кратковременно действующее соединение, в качестве неотложной лекарственной терапии довольно рано. Поэтому они не получали "достаточное количество мидазолама", чтобы не было возможности его накопления, и в результате это приводило к более длительному времени возмещения. Это первое клиническое испытание с оптимизированной схемой приема лекарственного средства,показывающее клинически значимые улучшенные результаты применения ремимазолама по сравнению с мидазоламом. В целом, исследование показало, что можно достичь лучших результатов с ремимазоламом по сравнению с золотым стандартом мидазоламом. Профиль безопасности, наблюдаемый в этом испытании,подтвердил хорошую переносимость, показанную также во всех предыдущих исследованиях, и, как ожидалось, для бензодиазепина. Не было никаких наблюдаемых необычных результатов, и ни одному пациенту не требовалась ручная или механическая вентиляция. В общем, была хорошая сердечно-сосудистая и дыхательная стабильность при лечении ремимазоламом. По сравнению с предыдущим исследованием фазы Ib степень AESI (неблагоприятные события,представляющие особый интерес) была значительно ниже, вследствие пересмотренного дозирования и разработки исследования соответственно изобретению (10 близких AESI у 160 субъектов при исследовании фазы IIb по сравнению с 37 у 45 субъектов при исследовании фазы Ib). Список таблиц Табл. 1. Обзор некоторых фармакокинетических анализов на основе физиологии CNS 7056 (исследования CNS 7056-001 и CNS 7056-002) в популяции. Табл. 2. Ковариационный анализ трехкомпартментного фармакокинетического анализа CNS 7056(опыт 128S). Табл. 3. Сравнение фармакодинамических моделей MOAA/S анализов CNS 7056-001, CNS 7056-002 и наборы объединенных данных. Табл. 4. Ковариационный анализ влияния фентанила на ЕС 50 CNS 7056 в фармакодинамическом анализе MOAA/S. Табл. 5. Фармакокинетические параметры истории болезни, используемые для имитации уровней фентанила в плазме. Табл. 6. Фармакодинамические взаимодействия между фентанилом и CNS 7056 в анализах (1)MOAA/S. Табл. 7. Фармакодинамические взаимодействия между фентанилом и CNS 7056 в анализах (2) 7056MOAA/S. Табл. 8. Влияние периода колоноскопии или кратковременных дополнительных стимулов на ЕС 50CNS 7056 фармакодинамическом анализе (1) MOAA/S. Табл. 9. Влияние периода колоноскопии и кратковременных дополнительных стимулов на ЕС 50CNS 7056 в фармакодинамическом анализе (2) MOAA/S. Табл. 10. Фармакодинамические взаимодействия между фентанилом и CNS 7056 в анализе (3) Табл. 11. Сравнение фармакологических анализов взаимодействия CNS 7056-фентанил, в которых наблюдаемые показатели в баллах MOAA/S "Ноль" и "Пять" были модифицированы. Табл. 12. Сравнение трех анализов MOAA/S, основанных на тех же исходных (необработанных) данных (нулевые показатели в баллах изменяли до -1,30). Табл. 13. Сравнение фармакодинамических анализов MOAA/S взаимодействия CNS-7056 фентанил, основанных на трех фармакокинетических моделях. Табл. 14. Описательная статистика не планируемых расчетных параметров фармакодинамического анализа MOAA/S конечного взаимодействия фентанила для CNS 7056 (CNS 7056 FEN26S). Табл. 15. Сводка анализов Монте-Карло различных схем приема CNS 7056 (на основе моделиMOAASALLMIN61S). Табл. 16. Сводка фармакокинетических и фармакодинамических параметров CNS 7056 для анализа Монте-Карло (CNS 7056PBPK128S, MOAASALLMIN61S). Табл. 17. Сводка анализов Монте-Карло двух схем введения CNS 7056 с варьированием минимальных интервалов времени между дозами пополнения (на основе модели MOAASALLMIN61S). Табл. 18. Сводка анализов Монте-Карло различных схем приема CNS 7056 и фентанила (на основе модели CNS 7056FEN26S взаимодействия фентанила). Табл. 19. Сводка фармакокинетических и фармакодинамических параметров для анализов МонтеКарло CNS 7056 (CNS 7056PBPK128S, CNS 7056 FEN26S). Табл. 20. Сводка анализов Монте-Карло различных интервалов времени дозирования CNS-7056 и фентанила (на основе модели CNS 7056FEN26S взаимодействия фентанила). Табл. 21. Сводка анализов Монте-Карло трех схем приема CNS 7056 (на основе моделиCNS7056FEN26S взаимодействия фентанила). Табл. 22. Клиническое исследование (пример 2): улучшенная степень реагирования для ремимазолама (смешанная первичная конечная точка: MOAA/S4 при 3 последовательных измерениях AND и завершении процедуры AND колоноскопии и отсутствие необходимости альтернативного седативного средства или вентиляции). Табл. 23. Клиническое исследование (пример 2): сравнение степеней успеха в колоноскопии (ITT). Табл. 24. Клинические исследования (пример 2): более короткое время до начала процедуры и низкое число доз пополнения. Табл. 25. Клиническое исследование (пример 2): короткое время достижения состояния полной активности. Табл. 26. Клиническое исследование (пример 2): короткое время достижения состояния готовности для выписки. Список фигур Фиг. 1. Дозы и степени успеха в исследованиях CNS 7056-002 и CNS 7056-003. Эффективной была комбинация MOAA/S4 при трех последовательных измерениях и завершении процедуры (в том числе 30 мин седации) и отсутствия необходимости альтернативной седации или вентиляции. Фиг. 2. Схематическое представление компартментных анализов CNS 7056 на основе физиологии. Фиг. 3. График зависимости системного (легочного) клиренса CNS 7056 от массы тела после внутривенного введения различных доз CNS 7056 (модель CNS 7056PBPK128S). Фиг. 4. Сравнение Монте-Карло имитированной доли исключенных субъектов, неудач и нулевых показателей в баллах MOAA/S после внутривенного введения CNS 7056 1000 субъектам (на основе модели MOAASALLMIN61S). Фиг. 5. Имитированные кривые MOAA/S для типичного субъекта после введения различных доз фентанила и последующего введения спустя 4 мин 7 мг CNS 7056 (на основе модели MOAASALLFEN26S). Фиг. 6. Сравнение Монте-Карло имитированных долей исключенных субъектов, нулевых показателей в баллах MOAA/S и пациентов, "способных перенести скопию", после введения комбинаций различных доз фентанила и CNS 7056 (дозы пополнения поддерживали постоянными 3 мг) 1000 субъектам(анализ взаимодействия фентанила на основе модели CNS 7056 FEN26). Фиг. 7. Имитированные кривые MOAA/S для типичного субъекта после введения дозы 100 мкг фентанила и последующего введения 8 мг CNS 7056 через различные интервалы времени (на основе модели MOAASALLFEN26S). Таблица 1 Относительная среднеквадратическая погрешность (RSE%). Примечание: компартментные объемы и клиренсы пронумерованы следующим образом: (1) - центральный, (2) - легочный, (3) - артериальный, (4) - периферический, (5) - глубоко расположенный, (6) более глубоко расположенный, (7) - печеночный.b Непрерывный ковариат - Параметр = 01(Ковариатная величина/Стандарт) 2 (Стандартная масса тела = 70 кг, медианный возраст 37 у, медианные частоты сердечных сокращений = 64, 76, 72 числа ударов в минуту перед введением дозы, 2 и 6 мин после введения соответственно). сHR, HR2 и HR6 представляют собой частоты сердечных сокращений перед приемом дозы и 2 и 6 минут после приема дозы соответственно. Таблица 3 ЕС 50 = 1(масштабированная доза) 2, где "масштабированная доза" = 1 для случая без фентанила, 2 для 50 мкг и 3 для 75 мкг. Таблица 5IIV при факторе скопии; е Целочисленные величины EMAX и EMIN являются фиксированными; все другие величины подгоняют посредством модели. Таблица 12c Трехкомпартментная модель с частотой сердечных сокращений, предсказывающая минутный объем сердца и центральный объем. Таблица 14 Когда EMIN было отрицательной величиной, натуральные логарифмы не могли вычислить и ее устанавливали как среднюю величину популяции (-1,50) для всех субъектов. Компартментные объемы и клиренсы нумеровали следующим образом: (1) - центральный, (2) - легочный, (3) - артериальный, (4) - периферический, (5) - глубоко расположенный. V2 (масса/70) и V3(0,65 масса/70) вычисляли из масс тела. Таблица 17 Геометрическая средняя величина 36 субъектов из исследования CNS 7056-002, которое завершило исследование. Компартментные объемы и клиренсы нумеровали следующим образом: (1) - центральный, (2) - легочный, (3) - артериальный, (4) - периферический, (5) - глубоко расположенный. V2 (масса/70) и V3 (0,65 масса/70) рассчитывают по массам тела. Таблица 20 Нагрузочная доза/дозы пополнения. Инфузия CNS 7056, начатая сразу после завершения инфузии фентанила (12 с) Таблица 22 Описательные величины р для ремимазолама представляют собой попарные сравнения между каждой группой и мидазоламом Описательная величина р для мидазолама представляет собой сравнение с комбинированными группами ремимазолама. Степени успеха, взятые из фоспропофола NDA. Доза мидазолама для процедурной седации составляет вначале 1-2,5 мг с дозами титрования 1 мг эквивалентными вначале 0,014-0036 мг/кг для 70 кг человека. Таблица 24 Первый из трех последовательных показателей в баллах MOAA/S равен 5 после последней инъекции лекарственного средства исследования. Таблица 26 Первый из трех последовательных показателей в баллах Aldrete9.
МПК / Метки
МПК: A61K 31/4468, A61K 31/5517, A61P 25/20, A61P 25/04
Метки: ремимазолама, индуцирования, приема, седации, схема
Код ссылки
<a href="https://eas.patents.su/30-24926-shema-priema-cns-7056-remimazolama-dlya-inducirovaniya-sedacii.html" rel="bookmark" title="База патентов Евразийского Союза">Схема приема cns 7056 (ремимазолама) для индуцирования седации</a>
Предыдущий патент: Антидиабетические твердые фармацевтические композиции
Следующий патент: Смещенное отверстие для клапана плунжерного насоса
Случайный патент: Соединение, представляющее собой антагонист лейкотриена b4